Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Medicina (Buenos Aires)
versión impresa ISSN 0025-7680versión On-line ISSN 1669-9106
Medicina (B. Aires) v.63 n.6 Buenos Aires nov./dic. 2003
Insuficiencia renal crónica y crecimiento
Pasqualini T. , Ferraris J.
Sección de Endocrinología, Crecimiento y Desarrollo y Sección de Trasplante Renal Pediátrico, Departamento de Pediatría, Hospital Italiano de Buenos Aires
Resumen
El retardo de crecimiento es uno de los mayores problemas de los niños con insuficiencia renal crónica (IRC). En 77% de los varones y 71% de las mujeres con IRC diagnosticada durante la niñez, la altura adulta se halla por debajo del percentilo 3. Los factores que influencian el crecimiento antes del trasplante (Tx) son las alteraciones nutricionales, metabólicas y endocrinas; post Tx: la terapia corticoidea inmunosupresora y la alteración de la función del injerto. Sesenta a 64% de los niños llegan al Tx renal con gran deterioro de talla (mediana de talla -2.5 desvíos estándar, DS), no existiendo diferencia entre el DS de talla en el momento del Tx y el DS de talla adulta. Para mejorar el crecimiento post Tx renal, se ha intentado disminuir la dosis de corticoides, administrarlos en días alternos o utilizar corticoides con menos efectos sobre el crecimiento como el deflazacort. Varios estudios demostraron que el tratamiento con hormona de crecimiento (GH) es efectivo y esto condujo a que el FDA (Food and Drug Administration) lo aprobara como tratamiento de los niños, antes de ser sometidos al Tx renal. La magnitud del aumento de la velocidad de crecimiento es mayor durante el tratamiento conservador, post Tx algo menor, observándose la menor respuesta durante la diálisis. Asimismo, la ganancia de talla se correlaciona con mayor duración del tratamiento con GH durante la etapa prepuberal. Como conclusión, si el deterioro de talla es importante, lo ideal es comenzar el tratamiento a edades tempranas, en la etapa del tratamiento conservador, tratar de acortar el tiempo de diálisis, lograr una talla mejor al momento del Tx, teniendo en cuenta que la talla final está fuertemente relacionada con la talla alcanzada al momento del primer Tx.
Palabras clave: Insuficiencia renal crónica; Trasplante renal; Hormona de crecimiento.
Abstract
Many children with chronic renal insufficiency (CRI) show growth retardation. Our objective is to describe the natural history of growth in patients with CRI, its pathogenesis and its optimization. Final height remains below percentile 3 in 77% of male and 71% of female patients. The etiology of growth retardation in these children is multifactorial: age at onset, primary renal disease, fluid and electrolyte abnormalities especially acidosis, renal osteodystrophy, inadequate caloric intake and perturbations of growth factors are all implicated. Post Tx, immunosuppressive corticoid therapy and reduced glomerular filtration rate have a significantly negative effect on final height. Growth retardation in both CRI and renal Tx patients is not the result of abnormal growth hormone secretion or decreased levels of IGF-I, but rather of elevated levels of IGF-I binding proteins inhibiting the bioavailability of the IGFs. Optimization of growth includes reduced corticoid dose, alternate-day instead of daily prednisone therapy, or substituting deflazacort for methylprednisone. Several studies have shown that growth hormone (GH) therapy at a dose of 30 UI/m2/week results in growth improvement and this led the Food and Drug Administration to approve the use of GH prior to Tx. The response to GH is better during conservative therapy, less in allograft recipients and substantially less while undergoing dialysis. In conclusion, in those children with short stature, GH treatment should begin at an early age and during conservative therapy, trying to shorten dialysis in order to attain better height at the time of renal transplantation.
Key words: Chronic renal insufficiency; Renal transplant. Dialysis; Growth retardation and renal insufficiency.
Insuficiencia renal crónica
El retardo de crecimiento y el desarrollo puberal muy tardío siguen siendo uno de los serios problemas de los niños con insuficiencia renal crónica (IRC)1, 9. Gracias a los avances de la diálisis y el trasplante (Tx), la sobrevida de estos pacientes ha aumentado, pero el Tx exitoso raramente se acompaña de una recuperación total de la talla y muchos de estos pacientes presentan tallas finales muy disminuidas, siendo por lo tanto muy importante lograr estrategias para mejorar su crecimiento.
En este artículo, describimos la historia natural del crecimiento en los pacientes con IRC, los mecanismos fisiopatológicos que lo alteran y las estrategias para mejorarlo.
Crecimiento en la insuficiencia renal crónica antes y después del Tx renal
Los factores que influencian el crecimiento antes y durante la diálisis son: la edad de comienzo de la IRC, la enfermedad renal primaria, las alteraciones nutricionales, metabólicas en especial la acidosis, la osteodistrofia renal, y las alteraciones del eje hormona de crecimiento/ factor de crecimiento insulino simil (GH/IGF-I); después del Tx, la terapia corticoide inmunosupresora y la función del injerto son los más importantes.
Se ha descripto que:
1) 77% de los varones y 71% de las mujeres que llegan a diálisis o Tx durante la niñez, presentan una altura final2 por debajo del percentilo 3.
2) Si la IRC comienza al nacer, el mayor deterioro del crecimiento se observa en los 2 primeros años de vida.
3) Entre el 40-64% de los niños que comienzan diálisis tienen una talla debajo del percentilo 3 y el periodo de tiempo en diálisis causa una disminución del desvío estándar de talla en –0.4 DS/año2.
4) Como resultado 60-64% de los niños llegan al Tx renal con talla menor de percentilo 3 (mediana de talla -2.5 desvíos estándar), no existiendo diferencia entre el DS de talla al Tx y el DS de la talla final2, 9.
5) En principio, el Tx renal exitoso restaura las condiciones para un normal crecimiento, comprometido por el estado de uremia. Sin embargo, el crecimiento normal en esta etapa depende de causas múltiples como: a) la edad cronológica al Tx6, 7, 10; b) la función del riñón trasplantado2; c) el esquema de tratamiento inmunosupresor: d) la influencia del desarrollo puberal tardío1, 3, 4, 5.
A) Edad cronológica al Tx. En este sentido, se ha observado crecimiento compensador en los dos primeros años en niños < de 7 años al Tx y tratados con dosis bajas de corticoides10. Sin embargo, el crecimiento post Tx varía ampliamente, observándose en general un continuo deterioro de la talla secundario principalmente a 2 factores: deterioro de la función renal, y el uso de la terapia inmunosupresora que incluye corticoides.
B) Función del riñón trasplantado. El período de tiempo con filtrado glomerular < 50 ml/min/1.73m2 influye negativamente sobre el crecimiento2
C) Esquema del tratamiento inmunosupresor. Dado que cambios en el esquema de tratamiento inmunosupresor puede mejorar el crecimiento post Tx, este tema se aborda más adelante.
D) Influencia del desarrollo puberal tardío. En estos niños, el inicio de la pubertad post Tx se atrasa, siendo la edad media de comienzo puberal de 14.6 ± 1.9 años en los varones y 13.3 ± 1.9 años en las mujeres, la edad media de menarca 15.9 años con una edad ósea de 12.9 años1, 3. El comienzo del empuje puberal se atrasa 2.5 años, su duración se acorta 1.6 años, siendo la ganancia de talla de 65% comparada con niños normales; la ganancia media de talla es 17.3 cm en varones y 13.9 cm en mujeres4, 5.
Alteración del eje hormona de crecimiento/IGF-I (GH/IGF-I)
En la IRC la medición de la secreción espontánea de GH muestra niveles basales y amplitud de los picos aumentada11, 12. Aunque la producción de GH puede estar disminuida, el clearance metabólico está reducido y la vida media prolongada (38.9 ± 11.2 minutos en diálisis vs 19.2 ± 14.4 minutos en controles)13. Existe además una reducción en la expresión del receptor de GH en los órganos periféricos y disminución de la actividad de la proteína transportadora de GH (GHBP) en el suero. GHBP representa el dominio extracelular del receptor de GH. Por lo tanto, al existir disminución del número de receptores de GH, estos niños presentan cierta insensibilidad a la acción de la misma14.
GH ejerce su acción a través de la producción de IGF-I, aumentando la síntesis de la misma a nivel hepático y en los órganos periféricos. En la uremia, los niveles de IGF-I pueden estar normales o bajos15 pero la bioactividad siempre es baja. Usando modelos matemáticos se pudo comprobar que en la IRC la producción de IGF-I está disminuida16, y sus proteínas trasportadoras elevadas.
Debido a que las IGFs, IGF-I y II tienen un peso molecular bajo, circulan en suero unidas a una familia de proteínas trasportadoras (IGFBPs) que las protegen de una rápida metabolización, logrando de esta forma prolongar sus vidas medias; a su vez las IGFBPs regulan el acceso de las IGFs a sus receptores. IGFBP3 es la proteína trasportadora más abundante, circula formando un complejo ternario de 150 kDa, constituido por IGF-I/IGFBP3/proteína subunidad ácido lábil (ALS). La proteólisis de IGFBP3 en el complejo ternario por la acción de una proteasa disminuye la afinidad de IGFBP3 por IGF-I, la cual se halla así disponible para unirse a proteínas como IGFBPs en la fracción sérica de 35 kDa y el receptor tipo I de IGF-I presente en los órganos blanco. Después de liberar IGF, IGFBP3 forma un complejo binario con ALS de 29 kDa. En la IRC, se acumulan las proteínas transportadoras de IGF de menor peso molecular como IGFBP1, IGFBP2, IGFBP6, subunidades de IGFBP3 de 29 kDa, IGFBP4, que en general se eliminan por riñón11, 16-18. El exceso de proteínas trasporta-doras juega un rol importante en la alteración del crecimiento de estos niños al disminuir la cantidad de IGF-I biodisponible capaz de unirse a su receptor, siendo la acumulación de IGFBP1, 2 y 4 las que más se correlacionan con la alteración del crecimiento17, 18.
Por lo tanto existe en estos pacientes disminución de la producción de GH e IGF-I, resistencia a la acción de GH y disminución de IGF-I biodisponible.
Post Tx las alteraciones del eje GH/IGF-I como la disminución de la secreción de GH, disminución de IGF-I libre, aumento de proteínas trasportadoras de IGF-I, están relacionadas con el uso de corticoides y el deterioro de la función del injerto19. Los corticoides en dosis farmacológicas suprimen la secreción de GH por aumento de la liberación de somatostatina. Inhiben la producción de IGF-I, habiéndose observado in vitro disminución del ARNm en hígado y hueso. Intervienen también a nivel óseo inhibiendo la formación de hueso y la síntesis de colágeno20. Además tienen acción catabólica, promoviendo la pérdida de tejido y el balance negativo de nitrógeno. Independiente de la terapia corticoidea, los pacientes con retardo de crecimiento post Tx tienen niveles elevados de proteínas trasportadoras de IGF-I, hallándose una correlación inversa entre los mismos y la función del órgano trasplantado. También, los corticoides promueven el aumento de IGFBP3. Este hallazgo se parece a lo hallado antes del Tx. Por lo tanto la alteración del crecimiento post Tx no es secundaria solamente a la disminución de la secreción de GH por el uso de corticoides, sino también al aumento de proteínas trasportadoras de IGF-I, producido por la alteración de la función del injerto y los corticoides; promoviendo este hecho la disminución de la biodisponibilidad de IGF-I9, 19.
Estrategias para mejorar el crecimiento en la IRC
A) Terapia con corticoides
Post Tx renal, se ha intentado en primer término mejorar el crecimiento tratando de disminuir el efecto de la terapia corticoidea sobre el crecimiento. Entre las estrategias utilizadas se hallan:
1) Los corticoides inmunosupresores más utilizados son la prednisona o metilprednisona. Se ha intentado bajar la dosis de estos compuestos y así de 0.30 se ha ido disminuyendo a 0.15 mg/kg/día21.
2) En algunos centros se ha administrado corticoides en días alternos a partir de los 3-12 meses post Tx21.
3) Hemos demostrado que sustituyendo la metilprednisona por deflazacort, un derivado oxazolínico con menores efectos colaterales, el crecimiento mejora, al igual que el perfil lipoproteico y la disminución de la masa ósea22, 24. Sin embargo, la talla final es 15 cm menor que la talla genética.
4) Se ha sugerido cambiar la terapia inmunosupresora post Tx renal y suspender la corticoterapia. Con la terapia inmunosupresora actual esto no es posible, por aumento entre 50-60% del índice de rechazo. Sin embargo el uso de nuevos inmunosupresores como el mofetil micofenolato (MMF) en sustitución de la azatioprina25, 26 y del Tracolimus (FK 506, lactona macrólida con una potente actividad inmunosupresora in vitro e in vivo) en sustitución de la ciclosporina27, ha demostrado disminución de los rechazos agudos y crónicos. FK 506, MMF y metilprednisona han sido utilizados en por lo menos 82 pacientes pediátricos, habiéndose observado que con este nuevo esquema inmunosupresor inicial, existe la posibilidad de disminuir e interrumpir la utilización de corticoides (70% de los casos) y por ende lograr mayor crecimiento27. Tanto el MMF como el FK506 son drogas aceptadas por la FDA.
B) Terapia con hormona de crecimiento
Los niños con retardo de crecimiento e insuficiencia renal crónica tienen un marcado incremento de su crecimiento linear cuando son tratados con GH.
Es importante que, previo al tratamiento con GH, los factores contribuyentes al deterioro del crecimiento, como los trastornos electrolíticos, la acidosis, la osteodistrofia renal, sean corregidos. Además, un aporte nutricional óptimo debe asegurarse, aun con el uso de alimentación por sonda nasogástrica si es necesario28, 29.
La indicación del tratamiento con GH en los niños con IRC pre Tx fue aceptada por la FDA. Fine y col28 demostraron que durante el tratamiento conservador, 5 años de tratamiento con GH a una dosis de 0.35 mg/kg/semana o 1 UI/kg /semana, aumentaba el DS de talla de -2.6 a -0.728, 29. La edad mínima de comienzo de tratamiento fue de 0.7 años, observándose que en los niños menores de 2.5 años, la ganancia de talla a los 2 años de tratamiento fue +2 DS versus –0.2 DS en el grupo placebo. Durante el seguimiento de los niños, cuando la altura alcanzaba el rango genético (percentilo 50 para la talla de los padres), el tratamiento con GH se suspendió y eventualmente se reinició si la talla caía a percentilo igual o menor de 25 para la talla media genética. Con esta modalidad de tratamiento se observó que aunque 73% de los pacientes debieron reiniciar tratamiento con GH, 27% presentaron suficiente velocidad de crecimiento para sostener su talla genética sin necesidad de volver a recibir tratamiento con GH28, 29.
Hokken-Koelega y col30. trataron 45 niños prepuberales de 7.3 (rango 5.2-10) años al inicio del tratamiento (18 en tratamiento conservador, 18 en diálisis peritoneal y 9 en hemodiálisis), 9 niños completaron 6 años y 6 niños, 8 años de tratamiento. Observaron que a los 3 años de seguimiento la media de talla había alcanzado el percentilo 3 de la población normal, y luego de 6 años habían alcanzado la talla genética. Tres factores se correlacionaron significativamente con el DS de talla a los 4 años de tratamiento, logrando mejoría de la misma: 1) una talla mayor al inicio del tratamiento, 2) una edad menor al inicio del tratamiento, 3) una menor duración de tratamiento en diálisis.
En un estudio sobre talla final en pacientes con IRC antes y después del Tx, se observó que después de 5.3 años de tratamiento con GH, el 65% de los niños alcanzaban tallas adultas normales (dentro de los 2 DS de la talla normal), alcanzando sin embargo una talla adulta 10.1 cm en varones y 12.1 cm en niñas por debajo de su talla genética. La ganancia de talla bajo tratamiento con GH fue de 1.4 DS versus –0.6 DS en el grupo no tratado. Los parámetros que influenciaron sobre una mejor ganancia de talla fueron: mayor duración del período de crecimiento prepuberal y puberal, mayor duración del tratamiento con GH, mayor deterioro de la talla inicial con respecto a la genética, menor duración del tratamiento dialítico y el sexo masculino4.
De lo ya expuesto, surge que el tratamiento con GH está indicado en los pacientes con IRC y deterioro significativo de la talla y/o velocidad de crecimiento, lográndose mayor incremento de la velocidad de crecimiento durante el tratamiento conservador28-30, un poco menor post Tx31 y obteniéndose menor respuesta durante la diálisis3, 4, 29, 30, 32, 33, 34. A su vez, los niños más jóvenes, con mayor tiempo de tratamiento en etapa prepuberal son los que más se benefician. Sin embargo, aun en pacientes puberales se ha observado que el tratamiento con GH, comenzado a una edad media de 15.6 años, durante 2 años, produjo un incremento de 15.7 ± 15.1 cm en los tratados versus 5.8 ± 3.4 cm en el grupo control35.
La vía tradicional de administración de GH es la vía subcutánea (VSC). Sin embargo, en pacientes en diálisis peritoneal, un estudio reciente demostró que la vía intraperitoneal (VIP) puede ser efectiva y bien tolerada. Por esta vía, GH llega a su nivel máximo sérico 4 horas después de su administración y la vida media es de 4.6 horas34.
Aunque post Tx, la respuesta al tratamiento con GH no fue diferente en los pacientes tratados con corticoides en días alternos comparados con los que los recibían diariamente35, ante el temor al incremento de riesgo de rechazo se aconseja que los pacientes en tratamiento con GH reciban tratamiento corticoide diario3.
Son las dimensiones del hueso y de la masa muscular de las piernas y brazos los más alterados. La GH puede restaurar la armonía corporal actuando sobre todo a este nivel36.
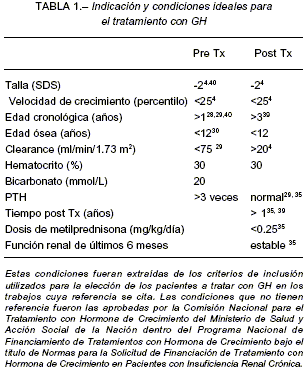
La indicación y condiciones ideales para el tratamiento con GH se observan en la Tabla 1.
Los controles a realizar, una vez iniciado el tratamiento con GH, incluyen un cuidadoso monitoreo de los niveles de creatinina, proteinuria, presión arterial y cualquier signo de rechazo. Asimismo, se debe controlar el metabolismo fosfocálcico incluyendo niveles de PTH, y los niveles de hemoglobina glicosilada28, 29.
Cuando la respuesta al tratamiento con GH no es adecuada, una vez descartada la falta de corrección de los factores contribuyentes, hay que descartar la falta de cumplimiento del mismo y la medición de los niveles de IGF-I, que deben incrementarse con el tratamiento con GH puede ser útil en esta eventualidad29.
Un equipo multidisciplinario, que incluye nefrólogos, endocrinólogos, psicólogos y asistente social, debe intervenir en el seguimiento de estos pacientes con el fin de controlar que el tratamiento tanto inmunosupresor como el de la GH no sea interrumpido.
Efectos adversos del tratamiento con GH
Como efecto adverso se observó aumento de los niveles de insulina basal y post pandrial, sin alteración en el metabolismo de la glucosa28, 29. Sin embargo surge como interrogante si, a largo plazo, asociado a la dislipidemia de la uremia, la hiperinsulinemia producida por el tratamiento con GH puede contribuir a la arteriosclerosis prematura en los pacientes con comienzo temprano de IRC.
No se hallaron cambios en los niveles de calcio, fósforo o paratohormona con el tratamiento con GH, pero el incremento de la velocidad de crecimiento no se produce en presencia de hiperparatiroidismo secundario y las necesidades de calcio y vitamina D deben incrementarse ante una muy buena respuesta de crecimiento28, 29. Además, la persistencia de osteodistrofia renal durante el tratamiento con GH, predispone al desplazamiento y necrosis de la cabeza femoral29. Por otro lado, un estudio reciente observó que ésta se presenta en 7% de niños con IRC, igual proporción de varones y mujeres y sin estar relacionada a la duración de la enfermedad, tipo de enfermedad renal o tratamiento con GH37. Algunos autores como Fine y col. 28, 29 sugieren obtener radiografías de la cabeza del fémur antes de iniciar tratamiento con GH y repetirlas si surgen síntomas sospechosos.
Post Tx, el deterioro de la función del injerto y la inducción de episodios de rechazo son dos parámetros de preocupación con el uso de GH. El riesgo de desarrollo de rechazo renal aumenta en los pacientes con más de un rechazo renal previo y el uso de corticoides en días alternos29.
Los pacientes con IRC tienen mayor tendencia a presentar un cuadro de hipertensión intracraneal benigna (pseudo tumor cerebral) con el tratamiento con GH, por lo cual es aconsejable realizar una evaluación del fondo de ojo previo al inicio del mismo y descartar el desarrollo de edema de papila ante cualquier síntoma sospechoso38.
En conclusión, dado que la talla final está fuertemente relacionada con la talla alcanzada al momento de iniciar la diálisis y al primer Tx, la mejor estrategia para alcanzar una talla adulta cercana al potencial genético es acortar el tiempo en diálisis y comenzar el tratamiento con GH a a edades tempranas. La mayor ganancia de talla está relacionada a la mayor duración de tratamiento con GH en etapa prepuberal.
1. Van Diemen-Steenvoorde R, Donckerwolcke RA, Brackel H, Wolff ED, de Jong JW. Growth and sexual maturation in children after kidney transplantation. J Pediatr 1987,110: 351-2. [ Links ]
2. Hokken-Koelega AC, van Zaal MA, van Bergen W, et al. Final height and its predictive factors after renal transplantation in childhood. Pediatr Res 1994; 36: 323-8. [ Links ]
3. Hokken-Koelega ACS, Saenger P, Cappa M, Greggio N. Unresolved problems concerning optimal therapy of puberty in children with chronic renal diseases. J Pediatr Endocrinol Metab 2001; 14: 945-52. [ Links ]
4. Haffner D, Schaefer F, Nissel R, Wuhl E, Tonshoff B, Mehls O, for The German Study Group for Growth Hormone Treatment in Chronic Renal Failure. Effects of growth hormone treatment on the adult height of chil- dren with chronic renal failure. N Engl J Med 2000; 343: 923-30. [ Links ]
5. Schaefer F, Seidel C, Binding A, Mitchell R, Scharer K, Robertson WR. Pubertal growth in chronic renal failure. Pediatr Res 1990; 28: 5-10. [ Links ]
6. Fine RN, Tejani A. Growth following renal transplantation in children. Transplant Proc 1998; 30: 1959-60. [ Links ]
7. Tejani A, Fine R, Alexander S, Harmon W, Stablein D. Factors predictive of sustained growth in children after renal transplantation. J Pediatr 1993; 122: 397-402. [ Links ]
8. Ferraris JR, Ramírez JA, Lejarraga H. Crecimiento en pacientes con trasplante renal. Bol Med Hosp Infant Mex 1988; 45: 485. [ Links ]
9. Pasqualini T, Ferraris JR, Jasper H, Pennisi P, D´Agostino D. Differences in anthropometric parameters and the IGF-I-IGFBP3 axis between liver and renal transplant children. Transplantation 2000; 70: 472-6. [ Links ]
10. Ingelfinger J, Grupe W, Harmon W, et al. Growth accele-ration following renal transplantation in children less than 7 years of age. Pediatrics 1981; 68: 255-9. [ Links ]
11. Hokken-Koelega ACS, Hackeng WHL, Stijnen T, Wit JM, de Muinck Keizer-Schrama SMPF, Drop SLS. Twenty-four-hour plasma growth hormone (GH) profiles, urinary GH excretion and plasma insulin-like growth factor-I and -II levels in prepubertal children with chronic renal insufficiency and severe growth retardation. J Clin Endocrinol Metab 1990; 71: 688-95. [ Links ]
12. Ferraris J, Pasqualini T, Gutman R, Ramírez J, Fainstein-Day P. Growth hormone-Insulin Like Growth Factor-I (IGF-I) axis in prepubertal children with chronic renal failure. J Pediatr Endocrinol Metab 1997; 10: 19-25. [ Links ]
13. Tonshoff B, Veldhuis JD, Heinrich U, Mehls O. Decon-volution analysis of spontaneous and stimulated growth hormone (GH) secretion in prepubertal children with chronic renal failure (CRF). Horm Res 1991; 35: 28-35. [ Links ]
14. Postel-Vinay MC, Tar A, Crosnier H, et al. Plasma growth hormone-binding activity is low in uraemic children. Pediatr Nephrol 1991; 5: 545-7. [ Links ]
15. Jasper HG, Ferraris JR. Insulin-like growth factor I (IGF-I) and growth in children undergoing hemodialysis or after successful renal transplantation. Medicina (Buenos Aires) 1991; 51: 127. [ Links ]
16. Blum WF. Insulin-like growth factors (IGF) and IGF-binding proteins in chronic renal failure: evidence for reduced secretion of IGF. Acta Pediatr Scand 1991; 379 Suppl: 23-31. [ Links ]
17. Powell DR, Liu F, Baker BK, et al. for The Southwest Pediatric Nephrology Study Group. Modulation of growth factors by growth hormone in children with chronic renal failure. Kidney Internat 1997; 51: 1970-9. [ Links ]
18. Powell DR, Durham SK, Brewer ED, et al. Effects of chronic renal failure and growth hormone on serum levels of insulin-like growth factor-binding protein-4 (IGFBP-4) and IGFBP-5 in children: a report of the Southwest Pediatric Nephrology Study Group. Ann Endocrinol (Paris) 1998; 59: 296-9. [ Links ]
19. Hokken-Koelega ACS, Stijnen T, de Muinck Keizer-Schra-ma SMPF, Blum WF, Drop SLS. Levels of growth hormone, insulin-like growth factor-I(IGF-I) and -II, IGF-binding protein-1 and -3, and cortisol in prednisone-treated children with growth retardation after renal transplantation. J Clin Endocrinol Metab 1993; 77: 932-8. [ Links ]
20. Luo J, Murphy LJ. Dexamethasone inhibits growth hormone induction of insulin-like growth factor-I (IGF-I) messenger ribonucleic acid (mRNA) in hypophysec-tomized rats and reduces IGF-I mRNA abundance in the intact rat. Endocrinology 1989; 125: 165-71. [ Links ]
21. Broyer M, Guest G, Gagnadoux MF. Growth rate in children receiving alternate-day corticosteroid treatment after kidney transplantation. J Pediatr 1992; 120: 721-5. [ Links ]
22. Ferraris JR, Fainstein-Day P, Gutman R, et al. Effect of therapy with a new glucocorticoid, deflazacort, on linear growth and growth hormone secretion after renal transplantation. J Pediatr 1992; 21: 809-13. [ Links ]
23. Ferraris JR, Pennisi P, Pasqualini T, Jasper H. Effects of deflazacort immunosuppression on long-term growth and growth factors after renal transplantation. Pediatr Nephrol 1997; 11: 322-4. [ Links ]
24. Ferraris JR, Pasqualini T, Legal S, et al. and the Deflazacort Study Group. Effect of deflazacort vs methylprednisone on growth, body composition, lipid profile and bone mass after renal transplantation. Pediatric Nephrol 2000; 14: 682-8. [ Links ]
25. European Mycophenolate Mofetil Cooperative Study Group. Placebo-controlled study of mycophenolate mofetil combined with cyclosporin and corticosteroids for prevention of acute rejection. Lancet 1995;345:1321-5. [ Links ]
26. Ferraris JR, Tambutti ML, Redal MA, Bustos D, Ramírez JA, Prigoshin N. Conversion from azathioprine to mycophenolate mofetil in pediatric renal transplant recipients with chronic rejection. Transplantation 2000; 70: 297-301. [ Links ]
27. Shapiro R. Tracolimus in pediatric renal transplantation: a review. Pediatr Transplant 1998; 2: 270-6. [ Links ]
28. Fine RN, Kohaut E, Brown D, Kuntze J, Attie KM. Long-term treatment of growth retarded children with chronic renal insufficiency, with recombinant human growth hormone. Kidney Int 1996; 49: 781-5. [ Links ]
29. Fine RN. Growth hormone treatment of children with chronic renal insufficiency, end-stage renal disease and following renal transplantation-update 1997. J Pediatr Endocrinol Metab 1997; 10: 361-70. [ Links ]
30. Hokken-Koelega A, Mulder P, De Jong R, Lilien M, Donckerwolcke R, Groothof J. Long-term effects of growth hormone treatment on growth and puberty in patients with chronic renal insufficiency. Pediatr Nephrol 2000; 14: 701-6. [ Links ]
31. Tonshoff B, Haffner D, Mehls O, et al. and Members of The German Study Group for Growth Hormone Treatment in Children with Renal Allografts. Efficacy and safety of growth hormone treatment in short children with renal allografts: Three years experience. Kidney Int 1993; 44: 199-207. [ Links ]
32. Pasqualini T, Ferraris J. Tratamiento con hormona de crecimiento pre y post transplante renal. Medicina (Buenos Aires) 1998; 58: 265-70. [ Links ]
33. Sieniawska M, Panczyk-Tomaszewska M, Ziolkowska H, et al. Results of treatment with recombinant human growth hormone in children with growth retardation in end-stage renal disease. Pol Merkuriusz Lek 2001; 10: 263-6. [ Links ]
34. Gipson DS, Kausz AT, Striegel JE, Melvin TR, Astrom LJ, Watkins SL. Intraperitoneal administration of recombinant human growth hormone in children with end-stage renal disease. Pediatr Nephrol 2001; 16: 29-34. [ Links ]
35. Hokken-Koelega ACS, Stijnen T, deRidder MAJ, et al. Growth hormone treatment in growth-retarded adolescents after renal transplantation. Lancet 1994; 343: 1313-7. [ Links ]
36. Zivicnjak M, Franke D, Ehrich JH, Filler G. Does growth hormone therapy harmonize distorted morphology and body composition in chronic renal failure? Pediatr Nephrol 2000; 15: 229-35. [ Links ]
37. Boechat MI, Winters WD, Hogg RJ, Fine RN, Watkins SL. Avascular necrosis of the femoral head in children with chronic renal disease. Radiology 2001; 218: 411-3. [ Links ]
38. Koller EA, Stadel BV, Malozowski SN. Papilledema in 15 renally compromised patients treated with growth hormone. Pediatr Nephrol 1997; 11: 451-4. [ Links ]
39. Ingulli E, Tejani A. An analytical review of growth hormone studies in children after renal transplantation. Pediatr Nephrol 1995; 9: S61-S65. [ Links ]
40. Maxwell H, Rees L. Recombinant human growth hormone treatment in infants with chronic renal failure. Arch Dis Child 1996; 74: 40-3. [ Links ]
Recibido: 27 de septiembre de 2002
Aceptado: 19 de junio de 2003














