Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Medicina (Buenos Aires)
versión impresa ISSN 0025-7680versión On-line ISSN 1669-9106
Medicina (B. Aires) v.63 n.6 Buenos Aires nov./dic. 2003
Hacia un diagnóstico antropométrico de las osteopenias y un diagnóstico biomecánico de las osteoporosis
Cointry G. R. 1, Capozza R. F. 1, Ferretti J.L. 1, Frost H. M. 2
1Centro de Estudios de Metabolismo Fosfocálcico (CEMFoC), Hospital del Centenario y Facultad de Medicina, Universidad Nacional de Rosario;
2Southern Colorado Clinic, Pueblo CO, USA
Resumen
La concepción corriente (metabólica) de las osteopatías fragilizantes supone que la resistencia ósea está determinada por una "masa mineralizada" endocrinamente controlada, que crece hasta alcanzar un pico y luego se pierde con diferente velocidad según el individuo. Esta idea ignora la Biomecánica Osea. Esa «masa» es el sustrato de una estructura, cuya rigidez no depende del volumen, sino de la rigidez intrínseca y de la disposición espacial del material mineralizado que la compone. Los huesos no optimizan su resistencia como resultado de una regulación sistémica de su masa. Los huesos autocontrolan su rigidez (única variable esquelética controlada) orientando espacialmente la formación y la destrucción óseas en función del sensado direccional osteocítico de las deformaciones usuales (gravedad, contracciones musculares). La resistencia y la masa ósea son productos colaterales no-regulados de ese control. Los sistemas endocrino-metabólicos modulan en forma no-direccional el trabajo celular óseo en función del equilibrio mineral, a expensas del control biomecánico óseo, y pueden determinar osteopenias y osteoporosis. Las osteoporosis no son "osteopenias intensas" (concepto de la OMS), sino "osteopenias fragilizantes" (concepto del NIH). El diagnóstico de osteopenia es antropométrico, y puede hacerse densitométricamente; pero el de fragilidad ósea es biomecánico, y requiere evaluar la rigidez y la distribución del material calcificado por otros medios ("resistometría"). Por razones terapéuticas, las osteopenias y osteoporosis deben a su vez evaluarse en función de la proporción entre la masa o la resistencia ósea y la masa o la fuerza muscular del individuo, para distinguir entre etiologías "mecánicas" (desuso), en las que la proporcionalidad hueso / músculo tiende a mantenerse, y "metabólicas" (lesión ósea intrínseca, o desequilibrio sistémico), en las cuales tiende a reducirse.
Palabras clave: Masa ósea; Resistencia ósea; Fragilidad ósea; Biomecánica ósea; Densitometría; Tomografía computada cuantitativa; Osteopenia; Osteoporosis.
Abstract
The current (metabolic) conception of bone-weakening diseases regards bone strength as determined by a systemically-controlled «mineralized mass» which grows until it reaches a peak and then is lost at individually-specific rates. This concept disregards bone biomechanics. Skeletons are structures, it reaches of which depends on the stiffness and the spatial distribution rather than the volume of the calcified material. Rather than allowing a systemic regulation of their "mass" as a way to optimize their strength, bones autocontrol their stiffness by orienting bone formation and destruction as locally determined by the directional sensing, by osteocytes, of the strains caused by mechanical usage (gravity, muscle contractions). Bone mass and strength are just side products of that control. Endocrine-metabolic systems modulate non-directionally the work of bone cells as required for achieving a mineral equilibrium, despite the biomechanical controls, and can determine osteopenias and osteoporoses. Osteoporoses are not "intense osteopenias» (as per the current WHOs conception) but "osteopenic bone fragilities» (as recently stated by the NIH). The diagnosis of osteopenia is an anthropometric problem that can be solved densitometrically; but that of bone fragility is a biomechanical matter that requires evaluation of bone materials stiffness and distribution by other means ("resistometry"). For therapeutic purposes, osteopenias and osteoporoses should be also evaluated according to the relationship between bone mass or strength and muscle mass or strength in order to distinguish between "mechanical" (disuse) and "metabolic" etiologies (intrinsic bone lesion, or systemic disequilibrium), in which the bone / muscle proportionalty tends to remain normal or to deteriorate, respectively.
Key words: Bone mass; Bone strength; Bone fragility; Bone biomechanics; Densitometry; Quantitative computed tomography; Osteopenia; Osteoporosis.
La absorciometría de doble haz de rayos X (densitometría, DXA) determina con aceptable exactitud y precisión la masa de mineral de una región esquelética seleccionada, tanto en forma absoluta (contenido mineral óseo, CMO) como relativa a su superficie de proyección (densidad mineral "areal", DMO), y puede describir su variación terapéutica1, 2. Pero, lamentable-mente, ni el CMO ni la DMO proveen información biomecánicamente relevante como para evaluar la resistencia ósea o predecir el riesgo o la incidencia de fracturas3-9, como tradicionalmente se ha pretendido para esta valiosa metodología. Recientes estudios han mostrado que la correlación frecuentemente reportada entre densidad mineral "areal" y resistencia ósea no se mantiene al asociar los cambios positivos inducidos por tratamientos corrientes en la DMO y en la incidencia de nuevas fracturas en pacientes con osteopenias severas3-6, 10, 11. El problema es importante, por cuanto la DXA está universalmente difundida como recurso estándar de monitoreo terapéutico de la fragilidad ósea1, 2.
Durante las dos últimas décadas han surgido nuevos conceptos en Osteología12, 13, que hemos contribuido a desarrollar7-9. Estas ideas, por un lado, aclaran las razones de esa falencia; y por otro, señalan nuevas opciones de aplicación de la DXA para mejorar sus perspectivas diagnósticas. La concepción de las osteoporosis como "osteopenias intensas", conforme la difundida escala de valores densitométricos de la OMS7, 8, tiende a sustituirse por la de "osteopenias con compromiso mecánico demostrable de la estructura ósea", de acuerdo con la rectificación propuesta por el NIH (USA)14. Ya no se adscribe la "calidad" mecánica de un hueso (resistencia a la deformación y a la fractura) directamente a su masa mineralizada, sino a muchos componentes estructurales diferentes15-18, la mayoría lamentablemente fuera del alcance de la DXA, pero algunos determinables mediante otras técnicas9-11. Además, se tiende a evaluar esa "calidad" ósea en función del uso mecánico de la región estudiada, porque éste constituiría un estímulo extra-esquelético de primer orden para la determinación de la eficiencia del diseño de la estructura de cada hueso, cuya normalidad no podría suponerse a priori 19-21.
Este artículo pretende sintetizar A. el cuerpo de conocimiento teórico desarrollado en este campo, y B. sus consecuencias prácticas clínico-terapéuticas, tratando de reorientar la aplicación diagnóstica de la DXA y de complementarla con otras tecnologías.
A - Conceptos recientes en biología y biomecánica ósea
1. Direccionalidad (anisotropía) micro y macroscópica de la estructura ósea
Para que cualquier cuerpo sólido se rompa, es imprescindible que previamente se deforme lo suficiente como para resquebrajarse en algún punto de su superficie por estiramiento excesivo7, 17. Este principio explica que la regulación de la rigidez ósea (resistencia a la deformación) haya surgido durante la Evolución como un objetivo biológico primario, quedando determinada la resistencia a la fractura como un efecto colateral.
Los esqueletos de todos los vertebrados están constituidos por un material bastante rígido (colágeno calcificado), pero no tanto como para que cualquier mero acúmulo del mismo pueda sostener eficazmente al cuerpo, a menos que su distribución espacial se optimice de alguna manera22. Por esa razón, tanto el arreglo microestructural de los elementos del tejido mineralizado "sólido", como el diseño macroscópico de las cortezas y las tramas trabeculares óseas formadas por ese material, lejos de ser erráticos, están óptimamente orientados para evitar que los huesos se deformen demasiado durante su uso habitual, resistiendo así indirectamente a la fractura.
Podemos distinguir así los dos factores determinantes de la rigidez y la resistencia a la fractura de cada hueso, que cualquier arquitecto consideraría excluyentes para cualquier estructura: a. la "calidad mecánica" de su material calcificado (rigidez intrínseca del tejido, independiente de la forma del hueso), y b. su distribución espacial, que incluye la masa, pero también la forma, el tamaño y la macroestructura del órgano de sostén (diseño del hueso, independiente de su calidad). En términos prácticos, estos factores se refieren como propiedades materiales y diseño óseo7, 17, respectiva-mente (Fig. 1).
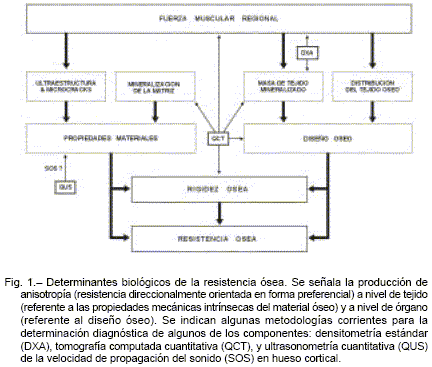
Las propiedades materiales óseas están dadas por el grado de calcificación de la matriz colágena23 y por la disposición espacial de los paquetes cristalinos, fibras, laminillas, osteonas y líneas de cemento, y también de las resquebrajaduras producidas por el uso (microdaño, fatiga del material)15-18. El diseño óseo está determinado a. en las cortezas de los huesos tubulares, por la disposición del material compacto, más eficiente cuanto más periférica resulte respecto de los ejes de flexión o de torsión22, y b. en las tramas esponjosas, por la disposición, el grosor y el grado de conectividad de las trabéculas24. De esas formas, se determinan sendos grados de direccionalidad en el comportamiento mecánico para los niveles de complejidad biológica tisular y orgánico, que configuran las tradicionales "anisotropías" del tejido y del hueso, respectivamente (Fig. 1).
Lamentablemente, ni las propiedades materiales, ni el diseño, ni las referidas anisotropías óseas son evaluables mediante DXA. Aun los intentos de estimar propiedades geométricas o atributos del material óseo en forma indirecta empleando DXA son inapropiados (tanto peor si se extrapolan sus resultados a estimaciones de la resistencia ósea), porque la única variable que la DXA determina directamente es el contenido mineral de la estructura.
2. Autorregulación biomecánica de la estructura ósea
Completado el crecimiento en largo, existen sólo dos mecanismos fundamentales del desarrollo óseo capaces de modificar la calidad y/o la distribución del material óseo mineralizado en relación con este tema: la modelación y la remodelación25-27.
La modelación consiste en una combinación no-acoplada (en distintos sitios) de aposición osteoblástica de hueso nuevo y destrucción osteoclástica de hueso preexistente. Su balance global de masa es general-mente positivo, y es la única forma genuina de ganar masa ósea; o sea, de mejorar una osteopenia o una osteoporosis26 y de hacer más eficiente el diseño óseo, incrementando el crecimiento cortical en ancho o engrosando las trabéculas. Lamentablemente, la intensidad de la modelación disminuye mucho en la segunda mitad de la vida.
La remodelación es un proceso acoplado (sucesivo) de remoción osteoclástica de pequeñas cantidades de hueso pre-existente, que es repuesto total o parcialmente por formación osteoblástica en el mismo sitio, con balance de masa consecuentemente neutro o negativo (modos "conservativo" y "desuso", respectivamente). El mecanismo es útil, porque provee a la homeostasis mineral, reemplaza tejido viejo por nuevo, y repara zonas microdañadas; pero puede resultar también perjudicial, porque su modo "desuso", especialmente importante en la segunda mitad de la vida, es la única forma conocida de perder masa ósea, y por tanto es la única causa de todas las osteopenias y osteoporosis27. La remodelación puede tener lugar sobre las superficies endósticas y trabeculares (lagunas de Howship) o en el seno del cortical "sólido" (sistemas de Havers)28. Por el primer mecanismo puede deteriorar el diseño óseo, eliminando trabéculas o adelgazando cortezas; por el segundo puede también reducir la rigidez del material compacto, no alterando su constitución o microestructura, sino por exceso de porificación o tunelización (haversianización).
Distintas modulaciones direccionalmente orientadas de la modelación y la remodelación permitirían a cada hueso autorregular la rigidez (y con ella la resistencia) de su estructura, como lo haría un edificio inteligente si lo hubiera29. Esto resulta posible gracias a que los osteocitos, únicas células intrínsecas a la matriz calcificada en la cual están inmersos, sensarían direccionalmente las minideformaciones que el uso cotidiano provoca en ese material30, 31. Los osteocitos podrían orientar así la liberación de distintos factores de comunicación célula-célula que, a través de sus prolongaciones, alcanzarían a osteoblastos y osteoclastos extrínsecos a la estructura calcificada, para inhibirlos o estimularlos localmente, en función de la orientación determinada por la gravedad y las contracciones musculares, optimizando permanentemente la rigidez (y la resistencia) del tejido mineralizado y del hueso entero19 (Fig. 2).

3. Independencia de los balances de masa y de resistencia de la estructura ósea
El mecanismo descripto, conocido como mecanostato óseo por Frost29, tiende a controlar la deformabilidad (o su inversa, la rigidez) de la estructura ósea, única característica esquelética que parece estar cibernéticamente regulada32, 33. Según el cuerpo hipotético conocido como "Paradigma de Utah"12, el objetivo del mecanostato óseo parece ser mantener esa defor-mabilidad muy alejada del nivel crítico para que el uso cotidiano pueda llegar a producir una fractura (1-2 vs 20-25 milésimos de variación de la longitud de reposo para esfuerzos fisiológicos máximos, para todos los huesos de todos los vertebrados), en forma específica para cada sitio. Deformaciones reiteradamente mayores de 2 milésimos "dispararían" normalmente la incorporación modelatoria de material nuevo en el sitio preciso para reducir esa deformabilidad. Inversamente, deformaciones reiteradamente bajas determinarían el giro de la remodelación local del modo "conservativo" al modo "desuso", eliminando material en el sitio preciso para aumentar esa deformabilidad. Se tiende a aceptar que, autocontrolando de esta forma la rigidez, el mecanostato determinaría indirectamente la resistencia de la estructura ósea, dentro de límites bastante amplios12, 22, 34.
El balance de masa de ese mecanismo es un efecto aparentemente anecdótico, resultante de los cambios primariamente determinados en las propiedades materiales y en el diseño de la estructura en función del control de la deformabilidad, pero independiente de ellos, y no orientado a cubrir ninguna necesidad regulatoria, mucho menos con sentido cibernético (Fig. 2). No se conoce ningún sistema biológico capaz de medir la masa ósea ni sus modificaciones, y lo que no se puede medir no se puede regular. Tampoco pare- ce existir ningún mecanismo de retroalimentación, con punto de partida en la masa ósea, que pueda informar a sistema alguno capaz de corregir su inadecuación. Esto constituye otra razón del fracaso de la determinación de la masa mineralizada como DMO (DXA) para explicar variaciones en la resistencia ósea.
4. Definición de osteopenia, fragilidad ósea y osteoporosis en función del mecanostato óseo
Un balance reiteradamente negativo del mecanostato en términos de masa mineralizada puede inducir una osteopenia («falta de hueso dentro del hueso»). El fracaso del sistema para mantener una adecuada rigidez de la estructura ósea (único mecanismo posible para aumentar su deformabilidad) puede conducir a una fragilidad ósea (baja resistencia a la fractura). Para que se produzca una osteoporosis tienen que darse ambos desbalances al mismo tiempo (obsérvese la participación de ambos elementos, masa y resistencia mecánica, en el diagrama de determinación de las características óseas de la Fig. 1, y apréciese cuántos elementos resistivos dejan de estimarse cuando sólo se determina la masa de tejido mineralizado). Las osteoporosis no son, en consecuencia, "osteopenias intensas", como sugiere erró-neamente la escala de t-scores densitométricos propuesta por la OMS1, 2. En la acepción más moderna del NIH (USA)14, las osteoporosis son "fragilidades osteopénicas". Los conceptos considerados hasta aquí permiten proponer que todas las osteopenias y osteoporosis resultarían de fallas en el control de la rigidez ósea por el mecanostato.
La capacidad del mecanostato para controlar la deformabilidad y la resistencia de cada hueso requeriría la normalidad a. de sus células; b. del uso mecánico cotidiano del esqueleto que constituye su estímulo natural, y c. de su entorno endocrino-metabólico. Una anormalidad de este último factor podría alterar tanto la percepción de deformaciones fuera del rango natural como señales de error para el sistema, como las respuestas efectoras de osteoblastos y osteoclastos, que en conjunto configuran su punto de referencia biome-cánico29, 32, 33. Las alteraciones de estos tres requisitos naturales determinarían respectivamente tres mecanismos etiopatogénicos fundamentales para todas las osteopenias y osteoporosis conocidas8, 9, 35 (Fig. 3), según sigue.

a. Afecciones celulares intrínsecas (Fig. 3, "1"). Cualquier alteración intrínseca de los osteocitos, blastos y/o clastos puede reducir la eficacia regulatoria del mecanostato, determinando osteopenias y osteoporosis "primarias". Estas son poco frecuentes en forma pura, y presentan características clínicas y terapéuticas propias.
b. Reducción de la estimulación mecánica (Fig. 3, "2"). La hipo o inactividad, la inmovilización, la ingravidez, etc. desestimulan al mecanostato (Fig. 2), induciéndolo a mantener una masa y una rigidez óseas relativamente bajas. Estas condiciones pueden bastarle a la estructura ósea para asimilar la pobre estimulación mecánica cotidiana, pero no para soportar esfuerzos fisiológicos máximos, o incluso habituales en casos severos. Este trastorno se reconoce porque presenta un decaimiento paralelo de músculos y huesos, que no altera la proporción natural entre la masa o la resistencia ósea, por un lado, y la masa o la fuerza muscular, por otro. Al contrario de los casos "secundarios", las osteoporosis por desuso tienden a afectar más al hueso cortical que al trabecular, y más al esqueleto periférico que al central, y también a favorecer más la producción de fracturas por traumas leves que las espontáneas35. Su tratamiento consiste simplemente en la recarga funcional ("reutilización") del esqueleto descargado, y no requiere obligadamente agentes farmacológicos.
c. Desplazamiento del punto de referencia biomecánico (Fig. 3, "3"). Distintas influencias endocrino-metabólicas sobre las células del mecanostato modificarían su trabajo en forma sistémica (no direccional), homogénea para cualquier sitio del esqueleto, orientándolo a la regulación del equilibrio mineral del medio interno, independientemente de los efectos producidos sobre la masa o la rigidez ósea29 (Fig. 2). La mayor jerarquía biológica de los sistemas regulatorios del medio interno (de adquisición evolutiva más temprana, y esenciales para la vida) subordinaría el control de la rigidez ósea a cargo del mecanostato al control homeostático mineral. Esto ocasionaría trastornos "secundarios" de la regulación mecanostática por alteración de su punto de referencia biomecánico, que pueden determinar también osteopenias y osteoporosis. La manifestación regional de estos trastornos, en zonas con predominio de hueso esponjoso (caderas, muñecas, y fundamentalmente vértebras), reflejaría una exageración patológica del problema biomecánico evolutivo derivado de la adquisición de la bipedestación, evidenciado por la permanencia natural de médula ósea roja, proveedora de precursores de blastos y clastos para la remodelación adaptativa, en esos sitios. Estas osteoporosis (la mayoría de los casos de consultorio, incluyendo las postmenopáusicas), tienden a presentar una masa o una rigidez/resistencia óseas inadecuadamente bajas respecto de la masa o la fuerza muscular, y también un riesgo aumentado de fracturas espontáneas, predominantemente vertebrales35. Su tratamiento consiste en la eliminación del desequilibrio sistémico causal, o, en segunda instancia, en la administración de agentes no-hormonales pro-modelatorios (también llamados "anabólicos") o anti-remodelatorios (también llamados "anti-reabsortivos", aunque realmente inhiben tanto la destrucción ósea como su reposición acoplada).
Mecanismos combinados. En determinadas situaciones, de las cuales la senilidad constituye el paradigma, se producen decaimientos funcionales de las células del mecanostato, del sistema endocrino-metabólico que afecta su punto de referencia biomecánico, y/o de la acción gravitatoria o muscular que provee su estímulo mecánico natural8, 9, 35. Esto determina que, especial-mente en la tercera edad, se puedan desarrollar formas mixtas de osteopenias y osteoporosis, tan difíciles de tratar como complicada resulte su combinación etiológica (Fig. 3). Adicionalmente, un decaimiento de la coordinación neuromuscular podría incrementar la tendencia natural a las caídas, importante determinante extraesquelético del riesgo de fractura35.
B – Derivaciones clínico-terapéuticas prácticas
1. Conveniencia de optimizar la evaluación biomecánica del esqueleto
Las determinaciones de CMO y DMO mediante DXA (CMO, DMO) constituyen la mejor estimación actual posible del estado de la masa ósea mineralizada, y por tanto el mejor recurso accesible para diagnosticar una osteopenia1, 2, pero no una osteoporosis. Las limitaciones referidas más arriba conciernen precisamente a ese diagnóstico, porque ni el CMO ni la DMO evalúan las propiedades materiales ni el diseño óseos, y por lo tanto no estiman resistencia3-9, 17 (Fig. 1). Esto determina un alto grado de espuricidad (insuficiente evidencia de relación causal) de las correlaciones ampliamente demostradas entre CMO o DMO y resistencia ósea o riesgo de fractura, que les resta especificidad para evaluar la resistencia de un hueso o para monitorear sus cambios debidos a enfermedades o tratamientos.
Según se ha expuesto, sólo la evaluación no-invasiva de las propiedades materiales y del diseño de un hueso permitiría determinar la capacidad de su estructura para resistir a la fractura7-9, 17, 36, 37 (Fig. 1). Analicemos las dificultades derivadas de estos dos requerimientos técnicos para estimar la resistencia ósea en forma integrada.
a. Estimación de la rigidez del material compacto: Esta propiedad podría estimarse indirectamente en función de la velocidad de propagación del sonido en ese medio (determinación de SOS mediante ultrasonometría de tibia, radio o falange)38, 39; pero esa metodología requiere aun una validación clínica. Lamentablemente, no existen otros recursos para evaluar no-invasivamente esta propiedad en forma integral. La determinación de la densidad volumétrica (vDMO, no la de proyección en superficie, DMO) del tejido óseo compacto23 mediante tomografía computada cuantitativa "clásica", axial (QCT, de columna, cadera, radio, etc. ), o "periférica" (pQCT, de radio, tibia, etc. )8, 9, 37, 40-42 puede proveer una estimación confiable del componente mineral de la matriz ósea "sólida", que normalmente varía en forma paralela a su rigidez. En cambio, la contribución de los componentes microestructurales a la rigidez del material óseo es imposible de determinar en forma no-invasiva por el momento. La DXA está fuera de consideración para la determinación, directa o indirecta, de cualquier clase de indicador de calidad mecánica del material mineralizado.
b. Evaluación del diseño arquitectónico óseo. La eficiencia biomecánica del diseño macroscópico óseo puede evaluarse en ciertos casos, para huesos tubulares o para tramas esponjosas. En huesos tubulares, que trabajan comúnmente en flexión y en torsión, se pueden determinar mediante pQCT los llamados momentos de inercia de sus secciones transversales, que varían proporcionalmente a la distancia a la cual el material cortical disponible está distribuido en la sección ósea respecto de los ejes biomecánicos correspondientes ("perifericidad" de la corteza respecto del diseño óptimo para flexión o para torsión). Huesos anchos de paredes finas resisten mejor que otros de paredes más gruesas pero de menor diámetro porque, aunque tengan la misma masa (igual área de sección transversal), los momentos de inercia para flexión o para torsión de esas secciones son mayores8, 9, 37, 41, 42. La DXA, por constituir una absorciometría de proyección de estructuras volumétricas óseas en sólo dos dimensiones, no puede determinar momentos de inercia, pese a algunas aproximaciones intentadas en ese sentido43. En las vértebras, que trabajan en compresión, la cantidad de material calcificado cortical en la sección transversal puede ser mecánicamente tanto o más importante que los momentos de inercia22. Por tanto, indicadores de masa ósea, como el área o el CMO de la sección cortical medidos por QCT44, 45, o aun el CMO (no la DMO) medido por DXA, podrían resultar proporcionales a la resistencia vertebral en ciertas circunstancias46. Pero, de todos modos, la participación de la calidad de la trama de tejido esponjoso en la determinación de la resistencia vertebral es también importante. Su evaluación requiere estimar la eficiencia de su disposición espacial, y el grosor y el grado de conectividad de las trabéculas. Existen intentos en este sentido mediante tomografía o resonancia magnética nuclear, previo "esqueletonización" (linealización del dibujo de corte) de la trama47, 48, pero aún no están adecuadamente estandarizados.
c. Estimación de la rigidez y la resistencia de un hueso a nivel de órgano ("resistometría" ósea). Estas características pueden en general evaluarse como propiedades estructurales integradas, en función del producto entre un indicador de la calidad del material y otro de la eficiencia arquitectónica del diseño8, 9, 36, 37, 41, 42. Hemos desarrollado recientemente el primer indicador combinado no-invasivo de resistencia ósea, basado en el producto entre la vDMO del hueso cortical y el momento de inercia de la sección transversal, determinados mediante pQCT en fémures de rata36, 49, inaugurando la denominación genérica de "Indices de Resistencia Osea" (Bone Strength Indices, BSIs, que también podrían traducirse como "resistómetros") para esta clase de aproximaciones41, 42. Los principales problemas a resolver para obtener índices no-invasivos de resistencia ósea son: a. la necesidad de contar con indicadores de ambas clases de propiedades (calidad material y diseño), lo cual descarta de hecho a la DXA como metodología de determinación (pese a algunos intentos ingeniosos de otros autores43, que en su momento ensayamos en forma preliminar en el cuello femoral humano)50, y b. la alta especificidad regional y direccional de los BSIs, que requiere cálculos especiales para cada sitio en cada hueso, y para cada forma de desafiarlo mecánicamente51.
2. Ventajas de evaluar el complejo osteo-muscular
Sólo evaluando el estado muscular en forma correlativa con el esquelético se puede distinguir entre las osteopenias y osteoporosis "primarias" o "secundarias" (a las que llamaremos en conjunto "metabólicas", en adelante), por un lado, y las fisiológicas o las ocasionadas por desuso (a las que llamaremos "mecánicas"), por otro (Figs. 1 y 3). El principio general de este recurso propone que en las osteopenias y osteoporosis mecánicas tenderían a afectarse paralelamente músculos y huesos, en tanto en las metabólicas el deterioro óseo debería tender a superar al muscular (Fig. 4). En la práctica, existen hoy dos formas diferentes de encarar este problema. Una aprovecha la capacidad de la DXA para evaluar la relación «masa ósea / masa muscular» (gráfica izquierda en la figura), reivindicando a esta tecnología para proveer un diagnóstico diferencial entre osteopenias (no osteoporosis) metabólicas y mecánicas, difícil de lograr por otros medios, aunque restringido al ámbito antropométrico. La otra recurre a nuevas tecnologías, menos estandarizadas que la DXA pero más adecuadas para evaluar la relación "resistencia ósea / fuerza muscular" (gráfica derecha en la figura), que permiten aproximar un diagnóstico diferencial biomecánico entre osteopenias o también osteoporosis metabólicas y mecánicas, según se discute a continuación.

I. Diagnóstico "antropométrico" de osteopenias metabólicas y mecánicas mediante DXA (Fig. 4, izquierda). Por encima de sus referidas limitaciones, la tecnología de DXA ofrece dos valiosas posibilidades, llamativamente poco aprovechadas por los clínicos8, 9, 19, 52, 53. La DXA puede medir, en el cuerpo entero o en distintas subregiones (cabeza, tronco, miembros), además del CMO, 1. la masa magra, variable que puede considerarse linealmente proporcional a la masa muscular dentro de ciertos límites (Fig. 1)52, 54, y 2. la masa grasa, lo que posibilita eliminar su interferencia con la determinación del CMO y su participación como componente mecánico de la carga del peso corporal mediante el correspondiente ajuste estadístico55.
Analizando la correlación entre el CMO (no la DMO), ajustado o no a grasa, y la masa magra en 1.450 varones y mujeres normales de todas las edades de la ciudad de Rojas (BA)56, hemos mostrado que las gráficas son lineales y paralelas para cualquier edad y estado reproductivo. Estas relaciones, confirmadas recientemente analizando el cuerpo entero y los miembros por separado en una muestra mayor de hombres y mujeres57 (Fig. 5, arriba), expresarían la identidad del control de la salud ósea por el mecanostato en todos los casos, por encima de la natural asociación antropométrica (morfogenética) entre músculos y huesos. Las ordenadas al origen de esas gráficas, crecientes en el sentido: niños y niñas < mujeres post-menopáusicas < hombres < mujeres pre-menopáusicas55, evidenciarían la modulación positiva de ese control por las hormonas sexuales en cada caso.

Esas asociaciones nos permitieron obtener gráficas de referencia percentilizadas o z-scorizadas, específicas de sexo y estado reproductivo, para evaluar la proporción antropométrica entre las masas ósea y muscular en cada región estudiada (Fig. 5, centro). Un CMO considerado a priori bajo, puede resultar proporcionado a la correspondiente masa magra, tanto en sujetos normales como en individuos pequeños (osteopenia "fisiológica"), o que sobrellevan una pobre estimulación muscular del esqueleto (osteopenia por desuso, o mecánica). Pero si el CMO resulta desproporcionadamente bajo respecto de la masa magra, el caso constituiría una osteopenia metabólica, y debería estudiarse ulteriormente para completar o no el diagnóstico de osteoporosis de la misma etiología mediante una estimación de la resistencia ósea, según (II), abajo.
El análisis de estas relaciones nos ha permitido cuantificar desproporciones músculo-esqueléticas en el cuerpo entero o en los miembros inferiores, siempre secundarias a desequilibrios endocrinos, en dialisados renales (Fig. 5, abajo)57, en obesas hiperinsulinémicas euglicémicas58, en hipopituitarios antes y después de recibir somatotrofina59, y en bailarinas profesionales de ballet con hipoestrogenismo por excesiva magritud, así como establecer que las fracturas determinadas por osteopenias metabólicas son casi exclusivas de las mujeres post-menopáusicas (datos aún no publicados).
II. Diagnóstico "biomecánico" de osteoporosis metabólicas y mecánicas empleando otros medios (Fig. 4, derecha). El diagnóstico de osteopenia mecánica o metabólica según (I) puede complementarse con el análisis biomecánico (ya no densitométrico o antro-pométrico) de la proporción entre la resistencia (ya no la masa) del hueso en estudio y la fuerza (ya no la masa) de la musculatura regional. Se están desarrollando diversas metodologías accesorias para establecer esta proporción en distintos casos60. Nosotros hemos des-cripto las proporciones entre indicadores tomográficos de resistencia ósea (BSIs tibiales, vDMO trabecular vertebral en L3) y de fuerza muscular (secciones musculares de la pantorrilla y periespinales, respectivamente), estableciendo una proporcionalidad única entre esas variables para niños, hombres y mujeres pre-menopáusicas, y una menor pendiente de esa relación para mujeres post-menopáusicas normales45 (Fig. 6). Estas curvas pueden también percentilizarse o z-sco-rizarse. Utilizando estas referencias, pudimos describir una interesante diferencia entre las alteraciones músculo-esqueléticas de hombres y mujeres celíacos61 y una evaluación del estado del mecanostato óseo en niños con osteogénesis imperfecta62, imposibles de analizar empleando sólo DEXA.

Conclusiones
La aplicación de estos nuevos recursos diagnósticos se encuentra en plena evolución. Parecen haberse des-cubierto por lo menos dos direcciones novedosas en las cuales convendría investigar en busca de aproximaciones no-invasivas a una estimación de la resistencia ósea (Indices de Resistencia Osea; BSIs) y a un diagnóstico diferencial entre osteopenias y osteoporosis "mecánicas" y "metabólicas". Estos lineamientos aconsejan, respectivamente: 1. describir estructuras mediante estudios seccionales, para obtener indicadores directos de calidad material, diseño y fragilidad además de masa (procedimientos para los cuales la metodología de DXA queda descartada), y 2. analizar siempre en conjunto músculos y huesos, para distinguir entre osteopenias u osteoporosis por desuso o por otras causas (pudiéndose emplear DXA para diferenciar osteopenias con sentido antropométrico, y otras tecnologías para diferenciar osteoporosis con sentido biomecánico). El punto de partida teórico para estos avances (basado en la Teoría del mecanostato óseo de Frost y en el "Paradigma de Utah" ) consistió en reconocer que los huesos no constituyen el resultado pasivo de un balance metabólico de masa por diferencia algebraica entre formación y destrucción, sino un sencillo pero notable producto de la adaptación homeostática activa entre sus propiedades materiales y arquitectónicas, en función del mantenimiento de una adecuada deformabilidad, conforme el uso mecánico habitual del esqueleto.
Agradecimientos: La mayoría de los trabajos referidos de los coautores argentinos fueron apoyados por subsidios del CONICET y del Consejo de Investigaciones de la UNR (CIUNR), y por la Fundación de Investigaciones Metabólicas (FIM) de Buenos Aires. Se agradece la colaboración de los Dres. Ricardo Capiglioni (CEMFoC), Emilio AJ Roldán (Gador SA, Bs.As. ), Armando Negri (USAL, Bs.As. ) y Carlos Cure Cure (Universidad de Barranquilla, Colombia) en la discusión y confección del material expuesto. La procedencia de datos publicados de estos y otros colaboradores externos del CEMFoC se indica en las referencias bibliográficas.
1. Kanis JA, Melton J, Christiansen C, Johnston CC, Khaltaev N. The diagnosis of osteoporosis. J Bone Miner Res 1994; 9: 1137-41. [ Links ]
2. Kanis JA, Devogelaer JP, Gennari C. Practical guide for the use of bone mineral measurements in the assessment of treatment of osteoporosis: A position paper of the European Foundation for Osteoporosis and Bone Disease. Osteoporosis Int 1996; 6: 256-62. [ Links ]
3. Marshall D, Johnell O, Wedel H. Meta-analysis of how well measures of bone mineral density predict occurrence of osteoporotic fractures. Br Med J 1996; 312: 1254-9. [ Links ]
4. Vilani P, Bondino-Riquier R, Bouvenot G. Fragilité des données acquises de la science. Lexemple du fluor dans losteoporose. Presse Med 1998; 27: 361-2. [ Links ]
5. Wilkin T. Changing concepts in osteoporosis. Br Med J 1999; 318: 862-5. [ Links ]
6. Kanis JA, Prediction of fracture from low bone mineral density measurements overestimates risk. Bone 2000; 26: 387-93. [ Links ]
7. Ferretti JL. Biomechanical properties of bone. In: Genant HK, Guglielmi G, Jergas M (eds). Bone Densitometry and Osteoporosis. Berlin: Springer, 1998, p 143-61. [ Links ]
8. Ferretti JL, Cointry GR, Capozza RF. Noninvasive analysis of bone mass, structure, and strength. In: Orthopaedic Issues in Osteoporosis. An YH (ed). Boca Raton (FL): CRC Press, 2002, p 145-67. [ Links ]
9. Ferretti JL, Frost HM. Osteopenias and osteoporoses. Muscle-Bone Interactions, Absorptiometry, Safety Factors, and Fracture Risk. An Overview. In: Orthopaedic Issues in Osteoporosis. An YH (ed). Boca Raton (FL): CRC Press, 2002, p 203-17. [ Links ]
10. Faulkner KG. Bone matters: Are density increases necessary to reduce fracture risk ? J Bone Miner Res 2000; 15: 183-9. [ Links ]
11. Sandor T, Felsenberg D, Brown E. Comments on the hypotheses underlying fracture risk assessment in osteoporosis as proposed by the World Health Organization. Calcif Tissue Int 1999; 64: 267-73. [ Links ]
12. Frost HM. The Utah paradigm of skeletal physiology: An overview of its insights for bone, cartilage and collagenous tissue organs. J Bone Miner Metab 2000; 18: 305-9. [ Links ]
13. Frost HM. From Wolffs Law to the Utah paradigm: Insights about bone physiology and its clinical applications. Anat Rec 2001; 262: 398-404. [ Links ]
14. NIH Consensus Development Panel on Osteoporosis Prevention, Diagnosis, and Therapy. Osteoporosis pre-vention, diagnosis, and therapy. JAMA 2001; 285: 785-91. [ Links ]
15. Currey JD. The design of mineralised tissues for their mechanical functions. J Exp Biol 1999; 202: 3285-91. [ Links ]
16. Landis WJ. The strength of a calcified tissue depends in part on the molecular structure and organisation of its constituent mineral crystals in their organic matrix. Bone 1995; 16: 533-9. [ Links ]
17. Martin RB, Burr DB, Sharkey NA. Skeletal Tissue. Me-chanics. New York, Springer, 1998. [ Links ]
18. Rho JY, Kuhn-Spearing L, Zioupos P. Mechanical pro-perties and the hierarchical structure of bone. Med Eng Phys 1998; 20: 92-102. [ Links ]
19. Frost HM, Ferretti JL, Jee WSS. Some roles of mechanical usage, muscle strength, and the mechanostat in skeletal physiology, disease, and research. Calcif Tissue Int 1998; 62: 1-7. [ Links ]
20. Schönau E, Neu CM, Mokow E, Wassmer G, Manz F. Influence of puberty on muscle area and cortical bone area of the forearm in boys and girls. J Clin Endocrinol Metab 2000; 85: 1095-8. [ Links ]
21. Schönau E, Neu CM, Rauch F, Manz F. The development of bone strength at the proximal radius during childhood and adolescence. J Clin Endocrinol Metab 2001; 86: 613-8. [ Links ]
22. Wainwright SA, Biggs WD, Currey JD, Gossline JM. Mechanical Design in Organisms. London: Edward Arnold, 1976. [ Links ]
23. Currey JD. The effects of porosity and mineral content on the Youngs modulus of elasticity of compact bone. J Biomech 1988; 21: 131-40. [ Links ]
24. Compston JE. Connectivity of cancellous bone: Assessment and mechanical implications. Bone 1994; 15: 463-9. [ Links ]
25. Frost HM. Intermediary Organization of the Skeleton. Vols. I & II. Boca Raton (FL): CRC Press, 1986. [ Links ]
26. Frost HM. Structural adaptations to mechanical usage (SATMU): 1. Redefining Wolffs Law: The bone modeling problem. Anat Rec 1990; 226: 403-13. [ Links ]
27. Frost HM. Structural adaptations to mechanical usage (SATMU): 2. Redefining Wolffs Law: The bone remodeling problem. Anat Rec 1990; 226: 414-22. [ Links ]
28. Jee WSS. Integrated bone tissue physiology: Anatomy and physiology. In: Bone Mechanics Handbook . 2nd ed. Cowin SC (ed). Boca Raton (FL): CRC Press, 2001, p 1-16. [ Links ]
29. Frost HM. The mechanostat: A proposed pathogenetic mechanism of osteoporoses and the bone mass effects of mechanical and nonmechanical agents. Bone Miner 1987; 1: 73-85. [ Links ]
30. Lanyon LE, Rubin CT, Raisz LE, Marotti G, Less H. Osteo-cytes, strain detection, bone modeling and remodeling. Calcif Tissue Int 1993; 53 (Suppl 1): S102-7. [ Links ]
31. Marotti G. The osteocyte as a wiring transmission system, J Musculoskel Neuron Interact 2000; 1: 133-9. [ Links ]
32. Lanyon LE. Functional strain in bone tissue as an objective, and controlling stimulus for adaptive bone remodeling. J Biomech 1987; 20: 1083-9. [ Links ]
33. Rubin CT, McLeod K, Bain S. Functional strains and cortical bone adaptation. Epigenetic assurance of skeletal integrity. J Biomech 1990; 23: 43-9. [ Links ]
34. Fyhrie DP, Vashishth D. Bone stiffness predicts strength similarly for human vertebral cancellous bone in compression and for cortical bone in tension. Bone 2000; 26: 169-75. [ Links ]
35. Frost HM. On defining osteopenias and osteoporoses: Problems! Another view (with insights from a new paradigm). Bone 1997; 20: 385-91. [ Links ]
36. Ferretti JL, Capozza RF, Zanchetta JR. Mechanical validation of a tomographic (pQCT) index for the nonin-vasive measurement of rat femur bending strength. Bone 1996; 18: 97-102. [ Links ]
37. Ferretti JL. Peripheral quantitative computed tomography (pQCT) for evaluating structural and mechanical properties of small bone. In: An YH, Draughn RA (eds). Mechanical Testing of Bone and the Bone-Implant Interface. Boca Raton (FL): CRC Press, 1999, p 385-406. [ Links ]
38. Mehta SS, Öz OK, Antich PP. Bone elasticity and ultrasound velocity are affected by subtle changes in the organic matrix. J Bone Miner Res 1998; 13: 114-20. [ Links ]
39. Rho JY, Ashman RB, Turner CH. Youngs modulus of trabecular and cortical bone material: Ultrasonic and microtensile measurements. J Biomech 1993; 26: 111-7. [ Links ]
40. Augat P, Reeb H, Claes L. Prediction of fracture load at different skeletal sites by geometrical properties of the cortical shell. J Bone Miner Res 1996; 11: 1356-62. [ Links ]
41. Wilhelm G, Felsenberg D, Bogusch G, et al. Biomechanical examinations for validation of the Bone Strength-Strain Index SSI, calculated by peripheral quantitative computed tomography. In: Musculoskeletal Interactions. Vol II. Lyrithis GP (ed). Atenas: Hylonome, 1999, p 105-11. [ Links ]
42. Schiessl H, Ferretti JL, Tysarczyk-Niemeyer G, Willnecker J. Noninvasive Bone Strength Index as analyzed by peripheral quantitative computed tomography (pQCT). In: Schönau E (ed). Pediatric Osteology. Amsterdam: Elsevier, 1996, p 141-5. [ Links ]
43. Beck TJ, Ruff CB, Warden KE, Scott WW, Rao GU. Predicting femoral neck strength from bone mineral data. A structural approach. Invest Radiol 1990; 25: 6-18. [ Links ]
44. Hayes WC, Piazza SJ, Zysset PK. Biomechanics of fracture risk prediction of the hip and spine by quantitative computed tomography. Radiol Clin N Amer 1991; 29: 1-12. [ Links ]
45. Ferretti JL, Capozza RF, Cointry GR, et al. Densitome-tric and tomographic analyses of musculoskeletal interactions in humans. J Musculoskel Neuron Interact 2000; 1: 18-21. [ Links ]
46. Ortoft G, Mosekilde Li, Hasling C, et al. Estimation of vertebral body strength by dual photon absorptiometry in elderly individuals. Bone 1993; 14: 667-73. [ Links ]
47. Chevallier F, Laval-Jeantet AM, Laval-Jeantet M, et al. CT image analysis of the vertebral trabecular network in vivo. Calcif Tissue Int 1992; 51: 8-14. [ Links ]
48. Majumdar S, Genant HK, Grampp S, et al. Correlation of trabecular bone structure with age, bone mineral density, and ostreoporotic status: In vivo studies in the distal radius using high resolution magnetic resonance imaging. J Bone Miner Res 1997; 12: 111-7. [ Links ]
49. Ferretti JL, Cointry GR, Capozza RF, et al. Analysis of biomechanical effects on bone and on the bone-muscle interactions in small animal models. J Musculoskel Neuron Interact 2001; 1: 263-72. [ Links ]
50. Capozza RF, Zanchetta JR, Ferretti JL. Noninvasive assessment of geometric and mechanical properties of the femoral neck from DEXA data. Correlation with age and body weight in 224 normal or osteoporotic women. Bone Miner 1994; 25 (Suppl 2): S2. [ Links ]
51. Schneider P, Reiners C, Cointry GR, Capozza RF, Ferretti JL. Bone quality parameters of the distal radius as assessed by pQCT in normal and fractured women. Osteoporosis Int 2001; 12: 639-46. [ Links ]
52. Visser M, Fuerst T, Lang T, Salamone L, Harris T. Validity of fan-beam dual-energy X-ray absorptiometry for measuring the fat-free mass and leg muscle mass. J Appl Physiol 1999; 87: 1513-22. [ Links ]
53. Ferretti JL, Cointry GR, Capozza RF, Zanchetta JR. Dual-energy X-ray absorptiometry. In: Skeletal Muscle: Patholo-gy, Diagnosis and Management of Disease. Preedy VR, Peters TJ (eds). London: Greenwich Medical Media, 2001, p 451-8. [ Links ]
54. Ferretti JL, Schiessl H , Frost HM. On new opportunities for absorptiometry. J Clin Densitom 1998; 1: 41-53. [ Links ]
55. Ferretti JL, Capozza RF, Cointry GR, et al. Gender-related differences in the relationships between densitometric values of whole-body bone mineral content and lean mass in humans between 2 and 87 years of age. Bone 1998; 22: 683-90. [ Links ]
56. Cure Cure C, García S, Cure Ramírez P, Cointry G, Capozza R, Ferretti JL. A DXA study of muscle-bone relationships in the whole body and limbs of 1,900 normal men and pre- and post-menopausal women. J Bone Miner Res 18 (Suppl 2): S321, 2003. [ Links ]
57. Negri AL, Cointry GR, Salica D, Zanchetta JR, Ferretti JL. Bone / lean mass relationships in peritoneally-dialysed and hemodialysed men and women. J Bone Miner Res 2001; 16 (Suppl 1): S544. [ Links ]
58. Ulla MR, Stivala M, Noriega R, Cointry G, Ferretti JL. Altered relationships between mineral and lean masses in obese, euglycemic, hyperinsulinemic women. J Bone Miner Res 2001; 16 (Suppl 1): S402. [ Links ]
59. Claus-Hermberg H, Fideleff H, Chervin A, et al. Effects of GH on the mineral, lean, and fat masses in pan-hypopituitary men and women. J Bone Miner Res 2001; 16 (Suppl 1): S403. [ Links ]
60. Rittweger J, Beller G, Ehrig J et al. Bone-muscle strength indices for the human lower leg. Bone 2000; 27: 319-26. [ Links ]
61. Ferretti JL, Mazure R, Tanoue P et al. Analysis of the structure and strength of bones in celiac disease patients. Amer J Gastroenterol 2003; 98:382-90. [ Links ]
62. Roldán EJA, Ferretti JL, Cointry GR, Tau C. Bone structure and strength and muscle-bone interactions in 15 children with osteogenesis imperfecta: A pQCT study. Bone 32(5S): S114, 2003. [ Links ]
Recibido: 14 de marzo de 2003
Aceptado: 8 de octubre de 2003














