Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Medicina (Buenos Aires)
versión impresa ISSN 0025-7680versión On-line ISSN 1669-9106
Medicina (B. Aires) v.64 n.1 Buenos Aires ene./feb. 2004
Efectos de la administración temprana de losartán sobre el remodelamiento ventricular en conejos con infarto de miocardio experimental
Germán E. Gonzále#, Florencia Mangas, Jimena Palleiro, Manuel Rodríguez, Ana Depetris Chauvin, Ricardo J. Gelpi*, Celina Morales
# Becario de Doctorado de la Universidad de Buenos Aires
* Miembro de la Carrera del Investigador Científico del CONICET (Consejo Nacional de Investigaciones Científicas y Técnicas)
Laboratorio de Fisiopatología Cardiovascular, Departamento de Patología, Facultad de Medicina, Universidad de Buenos Aires
Dirección Postal: Dra. Celina Morales, Laboratorio de Fisiopatología Cardiovascular, Departamento de Patología, Facultad de Medicina, UBA Uriburu 950, 1114 Buenos Aires, Argentina. Tel./Fax: (54-11) 4962-4945. e-mail: mmorales@fmed.uba.ar
Resumen
En el presente trabajo se evaluaron los efectos de la administración temprana de losartán (Los) sobre el remodelamiento ventricular (RV) en conejos con infarto de miocardio experimental (IM). Conejos Neozelandeses fueron sometidos a ligadura de la arteria coronaria izquierda. Se analizaron 4 grupos: operación simulada o sham (G1, n=13), IM (G2, n=13), sham+Los (G3, n=13), IM+Los (G4, n=13). Los (12.5 mg/kg/día) comenzó a administrarse a las 3 horas post-cirugía. Los animales fueron sacrificados a los 35 días y los corazones fueron perfundidos según la técnica de Langendorff. Se determinaron curvas presión-volumen (P/V) sistólicas y diastólicas. Cuatro animales por grupo se utilizaron para análisis histológico. Los corazones fueron fijados en formol, se calculó la relación entre el peso del corazón y del animal (Pc/Pa), seguidamente fueron cortados y teñidos con tricrómico de Masson y picrosirius red. Se midió el tamaño de infarto (TIM%), el espesor del septum (ES) y de la cicatriz, mediante análisis morfométrico. Los valores se expresaron como X–±SEM. Resultados: El TIM% fue en G2=25.38±5.31% y en G4=21.85±4.13%. El Pc/Pa fue: 3.45±0.16; 3.52±0.25; 2.87±0.16 (p<0.05 vs grupos no tratados) y 3.23±0.18 en G1, G2, G3 y G4 respectivamente. El Los desplazó la relación P/V diastólica a la derecha tanto en G3 y G4 (p<0.05 vs G1 y G2) y no modificó la función sistólica. El ES fue menor en G3 y G4 (P<0.05 vs G2), y G4 presentó menor cantidad de colágeno en la cicatriz (p<0.05 vs G2). En conclusión: la administración temprana de losartán modificó desfavorablemete el RV, incrementando la dilatación y disminuyendo el colágeno y el espesor de la cicatriz.
Palabras clave: Infarto de miocardio; Remodelamiento ventricular; Losartán; Conejos
Abstract
Effects of the early administration of losartan on ventricular remodeling in rabbits with experimental myocardial infarction. This study was carried out to investigate the effects of early administration of losartan on ventricular remodelling (VR) in rabbits with experimental myocardial infarction (MI). New Zealand rabbits underwent left coronary artery ligation. Four groups were analyzed: sham (G1; n=13), MI (G2; n=13), sham+Los (G3; n=13) and MI+Los (G4; n=13). Los (12.5 mg/kg/d) was administered 3 hours post-MI during 35 days when the animals were sacrificed. The hearts were isolated and perfused using Langendorffs technique to determine systolic and diastolic pressure-volume (P/V) curves. Hearts were weighed, fixed in formaline, cut from apex to base, and stained with Masson's trichrome and pricrosirius red. The heart weight (HW)/body weight (BW) ratio was used as an index of hypertrophy. Infarct size (IS; %), septum (SeT, mm) and scar thickness (ST, mm) were measured using morphometric analysis. Results were expressed as X±SEM. IS was G2=25.38±5.31; G4=21.85±4.13 (NS). HW/BW was 3.45±0.16; 3.52±0.25; 2.87±0.16; 3.23±0.18 in G1, G2, G3 and G4, respectively. Los shifted the diastolic P/V relationship to the right in sham and MI (p<0.05 vs sham), and did not modify the systolic relationship. Scar collagen concentration was lower in G4 (p<0.05 vs G2). SeT was lower in G3 and G4 (p<0.05 vs G2). In conclusion, the early administration of Los unfavorably modified post-MI-VR, increasing ventricular dilation and reducing scar collagen concentration and thickness.
Key words: Myocardial infarction; Ventricular remodeling; Losartan; Rabbit
Evidencias experimentales y clínicas sugieren que los inhibidores de la enzima convertidora de angiotensina (IECA) y los bloqueantes de los receptores AT1 de angiotensina II reducen la mortalidad y modifican el remodelamiento ventricular post-infarto de miocardio (IM)1-4. Sin embargo, los resultados experimentales obtenidos en diferentes modelos animales de IM son contradictorios y no existe acuerdo sobre el efecto de dichos fármacos sobre el remodelamiento ventricular1, 2, 5, 6.
Diferentes autores mostraron en ratas que el bloqueo crónico del sistema renina angiotensina reduce la hipertrofia7, 8, atenúa la dilatación ventricular5 y la fibrosis8, 9, tanto en la zona de IM como en zonas remotas al mismo. Sin embargo, otros autores, luego de administrar losartán desde el inicio del IM y en forma crónica, no pudieron prevenir la dilatación ventricular a pesar que describieron una mejoría de la disfunción ventricular10. Por otro lado, es conocido que el corazón de la rata difiere, con respecto a otras especies como el conejo, en el tipo y cantidad de circulación colateral11 y en la expresión de los diferentes componentes del sistema renina angiotensina cardíaco en el IM12. Es interesante observar que el conejo ha sido muy poco utilizado para el estudio del remodelamiento ventricular post-IM y el efecto del bloqueo del receptor AT1 de angiotensina II. Por ello, el objetivo del trabajo fue evaluar si la administración crónica de losartán modifica aspectos funcionales, histológicos y morfométricos del remodelamiento ventricular (RV) en un modelo de IM en conejos.
Materiales y métodos
Modelo experimental de infarto de miocardio
Se utilizaron conejos Neozelandeses de 2.0-2.3 Kg de peso que fueron anestesiados con ketamina (75 mg/kg) y Rompún® (xylazina, 0.75 mg/kg), administrada por vía subcutánea. Seguidamente se realizó una toracotomía lateral izquierda, pericardectomía y posterior ligadura de la arteria coronaria izquierda, como fue previamente descripto13. En un grupo de animales, grupo control (sham), el hilo de sutura fue pasado por debajo de la coronaria pero la misma no fue ligada. Se administró antibioticoterapia (Baytrilâ Enrofloxacina, 5 mg/Kg/día) en forma profiláctica durante 5 días.
Protocolo experimental
Se realizaron 4 grupos experimentales: el grupo 1 (n=13) correspondió a los animales sham, el grupo 2 (n=13) a los animales con IM, el grupo 3 (n=13) a los animales sham que recibieron losartán y el grupo 4 (n=13) a los animales con IM que recibieron losartán. Cada grupo fue subdividido para realizar una evaluación histológica (n=4 por grupo), y para estudios de función ventricular y morfométricos (n=9 por grupo). El losartán (12.5 mg/kg/día) fue administrado diariamente por vía oral comenzando a las 3 horas post-cirugía una vez que el animal se recuperó de la anestesia. El tratamiento se continuó en forma ininterrumpida hasta el día del sacrificio a los 35 días post-IM, cuando el tejido necrótico fue reemplazado por cicatriz13.
Evaluación de la función ventricular
El día del sacrificio los animales fueron pesados y anes-tesiados. Se obtuvieron registros de presión arterial a través de un catéter colocado en la arteria femoral conectado a un transductor de presión Deltram II (Utah Medical System). Los corazones fueron extraídos y perfundidos en forma retrógrada con solución de Krebs termostatizada a 37°C y burbujeada con carbógeno para obtener un valor de pH entre 7.35 y 7.45, según la técnica de Langendorff5. Posteriormente, se colocó y fijó dentro del ventrículo izquierdo, un balón de látex unido a un tubo de polietileno que fue conectado a un transductor de presión Deltram II (Utah Medical System), lo cual permitió medir la presión en el interior del ventrículo izquierdo (PVI). A través de 2 electrodos colocados en la aurícula derecha y en la base de la arteria pulmonar se mantuvo la frecuencia cardíaca constante durante todo el experimento.
Se obtuvieron registros de presión ventricular izquierda (PVI) y su derivada dP/dt14 en tiempo real utilizando una computadora provista con plaqueta conversora analógica-digital.
Se realizaron mediciones de función ventricular a través de la realización de curvas presión-volumen sistólicas y diastó-licas. El balón de látex se llenó con solución acuosa a volúmenes crecientes de 0.1 ml, hasta que la presión diastólica final (PDFVI) alcanzó un valor de 40 mmHg. Para construir las curvas presión-volumen diastólicas, los valores de PDFVI en función de los volúmenes crecientes fueron ajustados a una ecuación exponencial (P=b.eLV) utilizando un programa de computación (Deltagraph 7.0)5. La relación presión-volumen diastólica permitió determinar el grado de dilatación ventricular de los diferentes grupos, a través del desplazamiento de cada curva sobre las abcisas (volumen). También se evaluó la función contráctil utilizando el componente sistólico14 de la curva presión-volumen.
Evaluación morfométrica y determinación cuantitativa del tamaño de infarto
Luego de realizar las determinaciones funcionales el corazón fue parado con cloruro de potasio. El balón fue nuevamente llenado con solución acuosa hasta lograr una PDFVI@10 mmHg. Seguidamente, el corazón fue perfundido con formol buffer al 10% durante 5 minutos para su fijación, permaneciendo en formol durante 72 hs. Previamente al procesamiento los corazones fueron pesados y cortados transversalmente en fetas de 3-4 mm de espesor. Dichos cortes fueron teñidos con solución tricrómica de Masson, y posteriormente fueron digitalizados para realizar mediciones morfométricas utilizando un analizador de imágenes (ImagePro-Plusâ 3.0). Se midió el tamaño de IM2, el espesor del septum, y de la cicatriz.
Evaluación histológica
Cuatro animales por grupo se utilizaron para análisis histológico. Cada corazon fue fijado y cortado como se comentó anteriormente. De cada feta se realizaron cortes de 4 micrones que fueron teñidos con hematoxilina-eosina y picrosirius red. Se realizó un análisis histológico de rutina y, en cortes teñidos con picrosirius red, se midió la concentración de colágeno en la cicatriz. Para ello se utilizó un analizador de imágenes digital (ImagePro-Plusâ 3.0) unido a un microscopio de luz Leitz, con un objetivo de 10 X y contando un total de 10 campos microscópicos por cada sector de cada corte. El porcentaje de colágeno fue calculado sumando las áreas de tejido correspondientes a cada campo microscópico, las cuales fueron divididas por la suma de todas las áreas positivas para colágeno15.
Análisis estadístico
Los valores fueron expresados como media ± SEM. Se realizó un análisis de varianza (ANOVA) para establecer diferencias entre grupos, seguidos por la prueba de Bonferroni para establecer diferencias individuales. Se consideró diferencia estadisticamente significativa al valor de P<0.05.
Resultados
Durante el procedimiento quirúrgico e inmediatamente después de la cirugía, murieron 4 animales (7.7%), de los cuales 3 pertenecían a los grupos con IM. Por otro lado, otros 3 animales con IM murieron antes de finalizar el tiempo de protocolo: 1 animal perteneciente al grupo no tratado y 2 animales al grupo tratado, siendo la mortalidad total al final del protocolo de 13.5%.
No se observaron diferencias en el peso cardíaco, ni en la relación peso del corazón/peso corporal en ambos grupos con IM con respecto al sham (NS vs sham). Estas variables disminuyeron en los animales sham tratados (Tabla 1).
La presión arterial media en los grupos tratados disminuyó en forma significativa con respecto a los no tratados (Tabla 1).
Tabla 1.- Características de los animales
Relación presión-volumen
La Figura 1 muestra las curvas presión-volumen diastó-licas corregidas por el peso del animal. En el grupo de animales con IM sin tratamiento, hubo un desplazamiento de la relación presión-volumen diastólica hacia la derecha con respecto al grupo sham, hecho que pone de manifiesto un aumento del tamaño de la cavidad ventricular. En los grupos de animales tratados también hubo un desplazamiento hacia la derecha de la relación presión-volumen diastólica (p<0.05 vs grupos no tratados). El desplazamiento de la curva en el grupo sham+losartán fue similar a la del grupo con IM sin tratamiento (p<0.05 vs sham), mientras que en el grupo con IM tratado dicho desplazamiento fue mayor (p<0.05 vs otros grupos).
En ambos grupos con IM hubo una disminución de la contractilidad miocárdica, considerada en el mismo rango de volúmenes mostrados en las curvas diastólicas (Fig. 2).
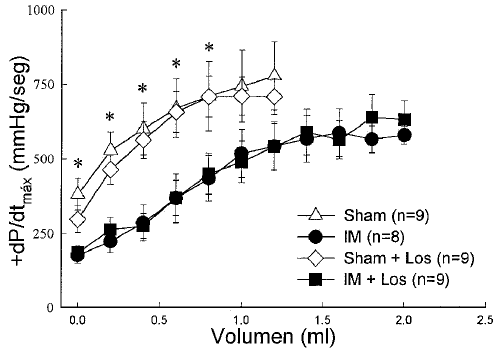
Fig. 1.- Relación presión-volumen diastólica corregidas por el peso del animal en los 4 grupos estudiados. En el grupo con IM sin tratamiento se observa un desplazamiento de la relación presión volumen hacia la derecha con respecto al sham, hecho que pone de manifiesto un incremento del tamaño de la cavidad ventricular. En ambos grupos tratados también hubo un desplazamiento hacia la derecha. El grupo sham+losartán alcanzó volúmenes similares a los del grupo IM no tratado. En el grupo con IM tratado dicho desplazamiento fue aún mayor (*: P<0.05).
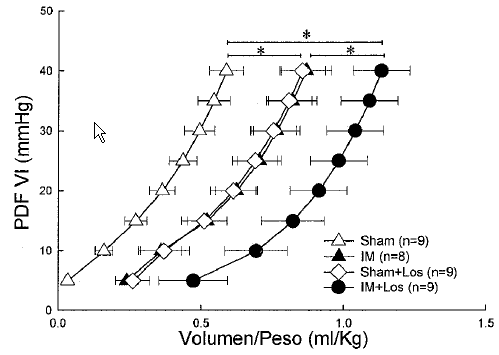
Fig. 2.- Relación presión-volumen sistólica en los 4 grupos estudiados. En ambos grupos con infarto se observa una disminución de la contractilidad miocárdica con respecto a los grupos sham (*: P<0.05 vs sham).
Morfometría y fibrosis
No se observaron diferencias significativas en el tamaño de IM (Tabla 2). Se observó un adelgazamiento del septum en ambos grupos tratados (p<0.05 vs grupos no tratados). El espesor de la cicatriz en los animales no tratados fue de 0.23 ± 0.03 cm mientras que en el grupo tratado fue de 0.16 ± 0.02 (p<0.05 vs IM) (Tabla 2).
La administración de losartán redujo en forma significativa la concentración de colágeno en la cicatriz (Tabla 2).
Tabla 2.- Variables morfométricas y fibrosis
Discusión
En el presente trabajo hemos evaluado el RV en conejos con IM de 35 días de evolución, considerando aspectos funcionales, histológicos, y morfométricos. También mostramos que la administración crónica de losartán produce un efecto desfavorable sobre el remodelamiento ventricular, disminuyendo la concentración de colágeno y el espesor de la cicatriz, y aumentando el tamaño de la cavidad del ventrículo izquierdo.
Evidencias experimentales y clínicas mostraron que el sistema renina angiotensina se activa tempranamente en el IM y participa en el remodelamiento ventricular3,10,16. Esta activación favorecería, al menos durante la primera etapa de evolución del IM, la reparación de la zona infartada16, la hipertrofia compensadora de los miocitos no isquémicos16,17 y el remodelamiento de la matriz extracelular9,15. Sin embargo, estudios experimentales2,5 mostraron que el bloqueo crónico del sistema renina angiotensina, desde el inicio del IM, también tendría un efecto favorable sobre el RV, disminuyendo la evolución a la insuficiencia cardíaca y la mortalidad post-IM. Scheiffer y col.18 mostraron, en ratas tratadas con enalapril y losartán, una reducción de la hipertrofia compensadora, de la fibrosis intersticial y un aumento de la densidad capilar en zonas remotas al infarto. Recientemente, Jain y col.5 determinaron que el losartán redujo la dilatación ventricular, y el adelgazamiento de la cicatriz. Sin embargo, Tanimura y col.6 en un modelo de insuficiencia cardíaca en perros, no encontraron efectos benéficos de este fármaco sobre el RV. En el mismo sentido, Xia y col.10 mostraron en ratas que el efecto favorable del bloqueo AT1 sobre el remodelamiento sería más efectivo cuando el tratamiento se inicia entre 30 minutos y 3 horas posteriores al IM; sin embargo no observaron una atenuación de la dilatación ventricular. Estos resultados coinciden con los obtenidos por Hu y col.2 quienes tampoco pudieron atenuar la dilatación ventricular en ratas tratadas con quinapril y losartán desde el inicio del IM.
En nuestro trabajo, a diferencia de los anteriores, utilizamos conejos como modelo experimental para el estudio del remodelamiento ventricular y el efecto de la administración temprana de losartán. El corazón de conejo presenta similitudes con el corazón humano en el tipo de circulación colateral19 y en la evolución histopa-tológica del IM13, por lo que es considerado un modelo adecuado para el estudio de la cardiopatía isquémica. En este sentido, Gallagher y col.12 mostraron que la expresión de receptores de angiotensina II en fibroblastos y miocitos de conejos con IM es similar a la observada en humanos y se diferencia de lo observado en ratas.
En conejos, a los 35 días del IM, al igual que lo observado en otras especies, detectamos dilatación ventricular que fue evidenciada por el desplazamiento de la relación presión volumen diastólica hacia la derecha, y una reducción de la contractilidad miocárdica.
En nuestro modelo, la administración de losartán desde el inicio del IM, y contrariamente a lo observado en ratas4,5 y otras especies incluyendo el humano1, modificó desfavorablemente el RV post-IM debido a que aumentó la dilatación en los animales con IM y redujo el colágeno en la cicatriz. Además, se observó una disminución en el espesor del septum en ambos grupos tratados y, en los animales sham, una reducción del cociente Pc/Pa.
Diferentes autores8,15,20 sugieren que cambios cualitativos y cuantitativos del colágeno modifican la rigidez de la pared ventricular y producen dilatación en diferentes patologías cardíacas. Thai y col.8, mostraron en ratas con IM tratadas con losartán, que la reducción del colágeno en zonas remotas reduce la rigidez ventricular, y Matsubara y col.15, describieron que la reducción de la fibrosis en ratas tratadas con ramipril aumenta la distensibilidad del músculo papilar.
El hecho que la administración de losartán a conejos con IM aumentó la dilatación ventricular, y redujo la concentración de colágeno y el espesor de la cicatriz, sugiere que dichos cambios pueden ser los determinantes de la dilatación. Al respecto, Zdrojewski y col.21 mostraron en ratas con IM tratadas con quinapril un aumento del tamaño de IM, una reducción de la fibrosis y del espesor de la cicatriz, hechos que asociaron a una falla en la maduración del colágeno. A pesar que nosotros no estudiamos cambios estructurales en el colágeno, los resultados mostrados por estos autores coinciden en parte con lo observado en nuestro estudio. Además, otros estudios sugieren que, independientemente de la concentración y tipo de colágeno, la pérdida de la integridad estructural del mismo, o un desbalance entre colageno-génesis y colagenolisis22, 23 junto con otras causas menos conocidas como la activación de receptores AT224, también podrían ser responsables de la dilatación ventricular durante el RV. Por lo tanto, si alguno o todos estos hechos hubieran ocurrido en nuestros animales, podrían explicar los resultados obtenidos.
En conclusión, hemos mostrado en un modelo experimental de IM en conejos que la administración temprana de losartán, un bloqueante del receptor AT1 de angiotensina II, produce un efecto desfavorable sobre el remodelamiento ventricular; aumentando el tamaño de la cavidad ventricular y reduciendo la concentración de colágeno y el espesor de cicatriz, sin modificar la respuesta contráctil. Nuevos estudios deberían ser realizados para documentar el rol de la matriz extracelular y la participación de los receptores AT2 en el remodelamiento ventricular post-IM.
1. Dickstein K, Kjekshus J. Comparison of baseline data, initial course, and management: losartan versus captopril following acute myocardial infarction (The OPTIMAAL Trial). OPTIMAAL Trial Steering Committee and Investi-gators. Optimal Trial in Myocardial Infarction with the Angiotensin II Antagonist Losartan. Am J Cardiol 2001; 87: 766-71. [ Links ]
2. Hu K, Gaudron P, Anders HJ, et al. Chronic effects of early started angiotensin converting enzyme inhibition and angiotensin AT1-receptor subtype blockade in rats with myocardial infarction: role of bradykinin. Cardiovasc Res 1998; 39: 401-12. [ Links ]
3. Pfeffer MA, Greaves SC, Arnold JM, et al. Early versus delayed angiotensin-converting enzyme inhibition therapy in acute myocardial infarction. The healing and early afterload reducing therapy trial. Circulation 1997; 95: 2643-51. [ Links ]
4. Richer C, Fornes P, Cazaubon C, et al. Effects of long-term angiotensin II AT1 receptor blockade on survival, hemodynamics and cardiac remodeling in chronic heart failure in rats. Cardiovasc Res 1999; 41: 100-8. [ Links ]
5. Jain M, Liao R, Ngoy S, et al. Angiotensin II receptor blockade attenuates the deleterious effects of exercise training on post-MI ventricular remodelling in rats. Cardiovasc Res 2000; 46: 66-72. [ Links ]
6. Tanimura M, Sharov VG, Shimoyama H, et al. Effects of AT1-receptor blockade on progression of left ventricular dysfunction in dogs with heart failure. Am J Physiol 1999; 276: H1385-H92. [ Links ]
7. van Kats JP, Duncker DJ, Haitsma DB, et al. Angiotensin-converting enzyme inhibition and angiotensin II type 1 receptor blockade prevent cardiac remodeling in pigs after myocardial infarction: role of tissue angiotensin II. Circulation 2000; 102: 1556-63. [ Links ]
8. Thai HM, Van HT, Gaballa MA, Goldman S, Raya TE. Effects of AT1 receptor blockade after myocardial infarct on myocardial fibrosis, stiffness, and contractility. Am J Physiol 1999; 276: H873-H80. [ Links ]
9. Ju H, Zhao S, Jassal DS, Dixon IM. Effect of AT1 receptor blockade on cardiac collagen remodeling after myocardial infarction. Cardiovasc Res 1997; 35: 223-32. [ Links ]
10. Xia QG, Chung O, Spitznagel H, et al. Significance of timing of angiotensin AT1 receptor blockade in rats with myocardial infarction-induced heart failure. Cardiovasc Res 2001; 49: 110-7. [ Links ]
11. Verdouw PD, van den Doel MA, de Zeeuw S, Duncker DJ. Animal models in the study of myocardial ischaemia and ischaemic syndromes. Cardiovasc Res 1998; 39: 121-35. [ Links ]
12. Gallagher AM, Bahnson TD, Yu H, Kim NN, Printz MP. Species variability in angiotensin receptor expression by cultured cardiac fibroblasts and the infarcted heart. Am J Physiol 1998; 274: H801-H9. [ Links ]
13. Morales C, Gonzalez GE, Rodriguez M, Bertolasi CA, Gelpi RJ. Histopathologic time course of myocardial infarct in rabbit hearts. Cardiovasc Pathol 2002; 11: 339-45. [ Links ]
14. Little WC. The left ventricular dP/dtmax-end-diastolic volume relation in closed-chest dogs. Circ Res 1985; 56: 808-15. [ Links ]
15. Matsubara LS, Matsubara BB, Okoshi MP, Cicogna AC, Janicki JS. Alterations in myocardial collagen content affect rat papillary muscle function. Am J Physiol 2000; 279: H1534-H9. [ Links ]
16. Sun Y, Weber KT. Angiotensin II receptor binding following myocardial infarction in the rat. Cardiovasc Res 1994; 28: 1623-8. [ Links ]
17. Liu Y, Leri A, Li B, et al. Angiotensin II stimulation in vitro induces hypertrophy of normal and postinfarcted ventricular myocytes. Circ Res 1998; 82: 1145-59. [ Links ]
18. Schieffer B, Wirger A, Meybrunn M, et al. Comparative effects of chronic angiotensin-converting enzyme inhibition and angiotensin II type 1 receptor blockade on cardiac remodeling after myocardial infarction in the rat. Circulation 1994; 89: 2273-82. [ Links ]
19. Miura T, Downey JM, Ooiwa H, et al. Progression of myocardial infarction in a collateral flow deficient species. Jpn Heart J 1989; 30: 695-708. [ Links ]
20. Diez J, Querejeta R, Lopez B, et al. Losartan-dependent regression of myocardial fibrosis is associated with reduction of left ventricular chamber stiffness in hyper-tensive patients. Circulation 2002; 105: 2512-7. [ Links ]
21. Zdrojewski T, Gaudron P, Whittaker P, et al. Ventricular remodeling after myocardial infarction and effects of ACE inhibition on hemodynamics and scar formation in SHR. Cardiovasc Pathol 2002; 11: 88-93. [ Links ]
22. Woodiwiss AJ, Tsotetsi OJ, Sprott S, et al. Reduction in myocardial collagen cross-linking parallels left ventricular dilatation in rat models of systolic chamber dysfunction. Circulation 2001; 103: 155-60. [ Links ]
23. Lindsey ML, Gannon J, Aikawa M, et al. Selective matrix metalloproteinase inhibition reduces left ventricular remodeling but does not inhibit angiogenesis after myocardial infarction. Circulation 2002; 105: 753-8. [ Links ]
24. Busche S, Gallinat S, Bohle RM, et al. Expression of angiotensin AT(1) and AT(2) receptors in adult rat cardiomyocytes after myocardial infarction. A single-cell reverse transcriptase-polymerase chain reaction study. Am J Pathol 2000; 157: 605-11. [ Links ]
Recibido: 23-01-2003
Aceptado: 15-08-2003














