Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Medicina (Buenos Aires)
Print version ISSN 0025-7680On-line version ISSN 1669-9106
Medicina (B. Aires) vol.64 no.2 Ciudad Autónoma de Buenos Aires Mar./Apr. 2004
Progresión de la Poliquistosis renal autosómica dominante. Influencia de polimorfismos de genes de sintasa endotelial del óxido nítrico (ecNOS) y del sistema renina-angiotensina *
Pablo Azurmendi1, Adriana Fraga1, Carolina Muchnik1, Maria dos Ramos Farias1, Felicita Galan1, Danisa Guerra1, Martin O'Flaherty 2, Elvira Arrizurieta1, Rodolfo Martin1, 2
* Este trabajo mereció el Premio Cossio al mejor trabajo clínico otorgado por la Sociedad Argentina de Investigación Clínica durante su reunión anual en Mar del Plata, noviembre 2003
1Instituto de Investigaciones Médicas Alfredo Lanari, Facultad de Medicina, Universidad de Buenos Aires,
2Hospital Universitario Austral, Universidad Austral, Pilar
Direccion postal: Dr. Rodolfo S. Martín, Instituto de Investigaciones Médicas Alfredo Lanari, Facultad de Medicina, Combatientes de Malvinas 3150, 1427 Buenos Aires, Argentina Fax: (54-11) 4523-4963 e-mail: ilanari@pinos.com
Resumen
La velocidad de progresión (VdP) de la poliquistosis renal autosómica dominante (PQRAD) es variable. Estudiamos la asociación de los polimorfismos AGTM235T (angiotensinógeno), AT1A1166C (ATR1) y ecNOSGlu298Asp (NO sintasa endotelial) con la VdP en 88 pacientes. VdP fue estimada por 1/Crpl vs edad. Consideramos edades de Crpl 2 y 6 mg/dl como comienzo de progresión (E2) y arribo a insuficiencia renal crónica terminal (E6), respectivamente. Los polimorfismos se estudiaron por PCR-RFLP. El grupo en su totalidad presentó VdP (ml/min/año) de 6.9±0.5, E2 y E6 de 48.9±1.3 y 55.0±1.4 años y tensión arterial media (TAM) de 111.2±1.2 mmHg. Según E6 observamos dos grupos (£ y > a 55 años). En £ 55 (fenotipo PKD1, n=42), E2 y E6 del genotipo CC de AT1A1166C fueron 36.0±1.2 y 41.4±0.9 años vs. AA-AC (42.8±1.0 y 47.5±0.8, p < 0.001). E2 y E6 del genotipo ecNOS298Asp/Asp fueron 34.8±1.5 y 41.1±0.6 años vs. Glu/Glu-Glu/Asp (42.4±0.9 y 47.1±0.8, p < 0.02). En el genotipo AGT235TT, la VdP fue 12.4±2.2 ml/min/año vs. MM-MT (7.9±0.7, p < 0.03). Esta diferencia también se observó cuando analizamos todos los pacientes PQRAD (TT: 11.02±1.5 vs. MM-MT: 6.44±0.5 ml/min/año, p < 0.003). Los genotipos AT1 1166CC y ecNOS 298Asp/Asp anticipan E2 y E6 mientras que AGT235TT duplica VdP, sugiriendo la participación del sistema renina angiotensina y NO sintasa endotelial en la progresión de la PQRAD.
Palabras clave: Velocidad de progresión; Poliquistosis renal; AT1A1166C; AGTM235T; EcNOSGlu298Asp.
Abstract
Glomerular filtration rate decline in autosomic dominant polycystic kidney disease. Influence of endothelial NO synthase (ecNOS) and renin angiotensin system gene polymorphisms. Glomerular filtration rate decline (GFRd) is variable in autosomic dominant polycystic kidney disease (ADPKD). In 88 ADPKD patients, GFRd was assessed by 1/SCr and compared with the association to AT1A1166C (AT1R), AGTM235T (angiotensinogen) and ecNOSGlu298Asp (NO endothelial synthase) polymorphisms. Age at SCr values of 2 and 6 mg/dl were assumed as beginning of progressive phase (A2) and end-stage-renal disease (A6), respectively. Polymorphisms were studied by PCR-RFLP. The group as a whole showed GFRd (ml/min/year) of 6.9±0.5; A2 and A6 of 48.9±1.3 and 55.0±1.4 years and mean arterial pressure of 111.2±1.2 mmHg. When A6 was considered, two populations were defined (£ and > 55 years). In £ 55 (assumed as PKD1 phenotype) (n=42), A2 and A6 of the AT11166CC genotype were 36.0±1.2 and 41.4±0.9 years vs AA-AC (42.8±1.0 and 47.5±0.8, p<0.001). A2 and A6 of the ecNOS298Asp/Asp genotype were 34.8±1.5 and 41.1±0.6 years vs. Glu/Glu-Glu/Asp (42.4±0.9 and 47.1±0.8, p<0.02). In AGT235TT genotype, GFRd was 12.4±2.2 ml/min/year vs MM-MT (7.9±0.7, p<0.03). This difference was also observed when all ADPKD patients were considered (TT: 11.02±1.5 vs. MM-MT: 6.44±0.5 ml/min/year, p<0.003). AT1 1166CC and ecNOS 298Asp/Asp are associated with earlier A2 and A6 whereas AGT 235TT induce twofold increase in GFRd, suggesting that RAS and ecNOS are involved in ADPKD progression.
Key words: GFR decline; ADPKD; AT1A1166C; AGTM235T; EcNOSGlu298Asp
La poliquistosis renal autosómica dominante (PQRAD) es la enfermedad renal hereditaria más frecuente y la causa genética más común de insuficiencia renal crónica terminal (IRCT) en adultos, alcanzando el 7% de los enfermos en diálisis crónica en Argentina. La enfermedad presenta una primera fase donde la función renal se mantiene estable (fase no progresiva) y otra donde la función renal decae (fase progresiva). Aunque los genes responsables (PKD1 en el cromosoma 16 y PKD2 en el cromosoma 4) han sido identificados, existen factores genéticos aún no definidos que pueden influenciar la gran variabilidad fenotípica inter e intra familiar observada, aun en presencia de una mutación idéntica.
El posible efecto de otros genes modificadores del fenotipo cobra entonces interés pronóstico en el estudio de la evolución de la PQRAD. En este sentido, el fenotipo ha sido comúnmente definido como la edad de entrada en diálisis del paciente, evento sujeto a situaciones clínicas no estrictamente relacionadas con la edad de comienzo de la fase progresiva y la velocidad de caída previa de la función renal. El empleo de estas últimas variables para el estudio de la influencia de otros genes ha sido poco utilizado previamente, debido a la dificultad de contar con series de pacientes con suficiente seguimiento longitudinal y poder estadístico.
Los genes del sistema renina-angiotensina (SRA) y de la sintasa endotelial del óxido nítrico (ecNOS) han sido los más estudiados debido al conocido rol biológico de los polimorfismos del SRA y a que la presencia de hipertensión arterial es un evento común en la enfermedad, asociada a actividad aumentada del SRA1. En poblaciones caucásicas sin PQRAD, se ha observado que el genotipo AGT235TT se asocia a mayor concentración plasmática de angiotensinógeno (AGT)2 y a mayor respuesta vascular a la inhibición del SRA3. Además, el mRNA 235T está aumentado con respecto al mRNA 235M en arterias de decidua humana de heterocigotas4. En ratones recombinantes homólogos existe una correlación entre copias génicas de AGT, su concentración plasmática y las cifras de presión arterial5, 6. En el caso de AT1A1166C se ha encontrado aumento de la sensibilidad a angiotensina II en la vasculatura renal de individuos con genotipo CC, en relación a los genotipos AA y AC7. El ecNOSGlu298Asp mostró distinta actividad Ca++ dependiente entre los distintos genotipos en arterias renales de pacientes PQRAD8.
Hasta el momento los trabajos publicados sobre el efecto de AT1A1166C, AGTM235T y ecNOSGlu298Asp en la progresión de la enfermedad han sido discrepantes8-15. Parte de esta discrepancia puede ser atribuida a variabilidad poblacional, al pequeño tamaño de la muestra o a una medición poco precisa de la rapidez de la progresión de la enfermedad, como es el empleo de la entrada en diálisis crónica como única medida. En muy pocas series fue utilizada la velocidad de caída del filtrado glomerular a lo largo del tiempo12, 14.
Por estos motivos decidimos estudiar el efecto de los po- limorfismos AT1A1166C, AGTM235T y ecNOSGlu298Asp en la velocidad de progresión (VdP) de la PQRAD, determinada con mayor exactitud a través de la caída del filtrado glomerular en el tiempo.
En 88 pacientes con un seguimiento (![]() ±SE) de 5.7±0.5 años y al menos 4 valores de Crpl ³ 2mg/dl (un promedio de 12±1 Crpl/paciente y un total de 1007 determinaciones de Crpl), la VdP fue estimada por 1/Crpl vs. edad. Consideramos edades de Crpl 2 y 6 mg/dl, como comienzo de progresión (E2) y de IRCT (E6), respectivamente. Se registró la presión arterial y se calculó la presión arterial media (TAM) en cada paciente. Los polimorfismos AGTM235T, AT1A1166C y ecNOSGlu298Asp se realizaron por reacción en cadena de la polimerasa con cebadores específicos y posterior digestión con enzimas de restricción que reconocen los alelos de cada uno (PCR-RFLP): Bst UI para el alelo 235T de AGTM235T, BclI para el 1166A de AT1A1166C y BanII para 298Glu o NdeII para 298Asp de ecNOSGlu298Asp. Los productos se separaron por electroforesis en geles de agarosa y se visualizaron bajo luz ultravioleta.
±SE) de 5.7±0.5 años y al menos 4 valores de Crpl ³ 2mg/dl (un promedio de 12±1 Crpl/paciente y un total de 1007 determinaciones de Crpl), la VdP fue estimada por 1/Crpl vs. edad. Consideramos edades de Crpl 2 y 6 mg/dl, como comienzo de progresión (E2) y de IRCT (E6), respectivamente. Se registró la presión arterial y se calculó la presión arterial media (TAM) en cada paciente. Los polimorfismos AGTM235T, AT1A1166C y ecNOSGlu298Asp se realizaron por reacción en cadena de la polimerasa con cebadores específicos y posterior digestión con enzimas de restricción que reconocen los alelos de cada uno (PCR-RFLP): Bst UI para el alelo 235T de AGTM235T, BclI para el 1166A de AT1A1166C y BanII para 298Glu o NdeII para 298Asp de ecNOSGlu298Asp. Los productos se separaron por electroforesis en geles de agarosa y se visualizaron bajo luz ultravioleta.
Los datos fueron analizados usando el software estadístico STATA 5.0 y valores de p<0.05 fueron considerados significativos. Las pendientes de 1/ Crpl vs. edad se calcularon por regresión lineal simple y se aceptaron para el análisis aquéllas con un coeficiente de correlación mayor a 0.85. Las variables continuas se analizaron con test t de Student o Mann-Whitney, según su distribución. Las variables binomiales se analizaron con test exacto de Fisher y corrección de Yates y se usó regresión múltiple para estudiar el efecto confundidor de otras variables.
En la población total estudiada (n=88) la VdP fue 6.9±0.5 ml/min/año, E2 y E6 48.9±1.3 y 55.0±1.4 años, respectivamente, y TAM 111.2±1.2 mmHg. De acuerdo a E6 observamos dos grupos: £ y > de 55 años, con variables clínicas distintas. En los £ de 55 años (n=49), VdP, E2 y E6 fueron 8.4±0.7 ml/min/año, 41.6±0.9 y 46.9±0.7 años, respectivamente, distintas a los > de 55 (4.9±0.6 ml/min/año, 60.0±1.4 y 67.4±1.7 años, respectivamente, p<0.005), sin diferencias en la TAM (110.9±1.5 mmHg vs. 111.7±1.9 mmHg, pNS). Estos resultados permiten corroborar al grupo £ de 55 años como fenotipo PKD1, correspondiéndose a lo descripto por Hateboer et al16.
La distribución alélica y genotípica de los tres polimorfismos no fue diferente en 76 pacientes PQRAD y 40 controles genotipados, encontrándose las poblaciones en equilibrio de Hardy-Weinberg.
En los pacientes con fenotipo PKD1 genotipados para AT1A1166C (n=42), E2 y E6 del genotipo CC fueron 36.0±1.2 y 41.4±0.9 años vs. AA-AC (42.8±1.0 y 47.5±0.8 respectivamente, p < 0.001), (Fig. 1, panel A). VdP y TAM no fueron distintas entre los genotipos CC (7.28±1.38 ml/min/año y 115.3±6.7 mmHg) y AA-AC (8.95±0.79 y 108.4±1.7), respectivamente.
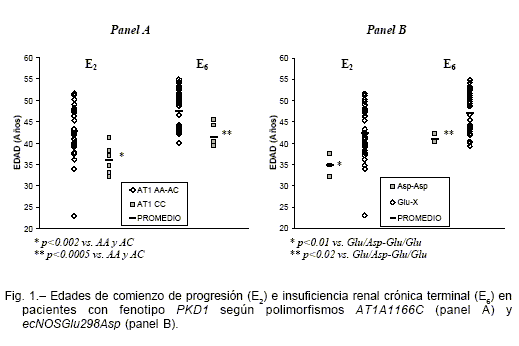
En los pacientes con fenotipo PKD1 genotipados para ecNOSGlu298Asp, E2 y E6 del genotipo Asp/Asp fueron 34.8±1.5 y 41.1±0.6 años vs. Glu/Glu-Glu/Asp (42.4±0.9 y 47.1±0.8 respectivamente, p<0.02), (Fig. 1, panel B). VdP y TAM no fueron distintas entre los genotipos Asp/Asp (5.67±0.88 ml/min/año y 118.4±20.1 mmHg) y Glu/Glu-Glu/Asp (9.0±0.76 y 108.7±1.6), respectivamente.
En contraste, el genotipo TT de AGTM235T mostró una mayor VdP en relación a MM-MT (12.4±2.2 vs. 7.93±0.7 ml/min/año, p<0.03), (Fig. 2). Esta diferencia en VdP de los TT vs. MM-MT se observa también en todos los pacientes (incluyendo el fenotipo no-PKD1) (11.02±1.5 vs. 6.44 ±0.5 ml/min/año, p<0.003). El polimorfismo AGTM235T no mostró diferencias en E2, E6 y TAM en fenotipo PKD1 (TT: 40.9±1.2, 44.2±1.3 años y 112.1±3.1 mmHg; MM-MT: 41.8±1.1, 46.9±0.8 y 108.8±2.0).

En modelos de regresión múltiple, la VdP se correlacionó con AGTM235T, mientras que E2 y E6 lo hicieron con AT1A1166C y ecNOSGlu298Asp, independientemente de la TAM y las variables clínicas restantes en cada caso.
En conclusión, los genotipos CC de AT1A1166C y Asp/Asp de ecNOSGlu298Asp se asocian a E2 y E6 menores en ~5 años, mientras que el TT de AGTM235T a una duplicación de la VdP, indicando un posible efecto de estos genes, tal vez por mecanismos independientes de la hipertensión arterial.
Estos resultados permiten concluir que el análisis de variables clínicas precoces poco estudiadas, tales como la edad de comienzo de la fase progresiva y la velocidad de caída del filtrado glomerular, permiten estudiar con mayor precisión el fenómeno de la progresión del daño renal en etapas tempranas, en la poliquistosis renal autosómica dominante.
El estudio de los polimorfismos del SRA y de la ecNOS, de conocida asociación a fenómenos de hipertensión arterial y daño intersticial, permiten así identificar factores genéticos y biológicos de riesgo importantes en la patogénesis, pronóstico y tratamiento de pacientes con poliquistosis renal autosómica dominante.
Agradecimientos: Agradecemos a los siguientes nefrólogos e investigadores que desde distintos puntos de nuestro país han aportado datos para este estudio: Cristina Aguirre, Mirta Barreneche, Carlos Braccalenti, Eduardo Castiglione, Ana Cusumano, Graciela del Valle, Elisa del Valle, Juan Di Bernardo, Eduardo Dos Ramos Farías, Carlos Ferreyra, Gustavo Ferricher, Jorge Gambino Villada, Héctor Marone, Carlos Najún Zarazaga, José Osso, Irene Pindulli, Adriana Prado, Generoso Santoro, Esteban Siga, Leonardo Sivak, Carlos Triay, Delma Verón y Alfredo Zucchini. Adriana Scerbo y Susana Cesáreo brindaron su experta asistencia técnica. Eliecer Coto (Oviedo, España) brindó entrenamiento en técnicas de biología molecular. Esta investigación fue apoyada por subsidios del Ministerio de Salud (Beca Carrillo-Oñativia), Fundación Alberto Roemmers y Fundación Florencio Fiorini, Argentina.
1. Chapman AB, Johnson A, Gabow PA, et al. The renin-angiotensin-aldosterone system and autosomal dominant polycystic kidney disease. N Engl J Med 1990; 323: 1091-6. [ Links ]
2. Bloem LJ, Manatunga AK, Tewskbury DA, et al. The serum angiotensinogen concentration and variants of the angiotensinogen gene in white and black children. J Clin Invest 1995; 95: 948-53. [ Links ]
3. Hopkins PN, Lifton RP, Hollenberg NK, et al. Blunted renal vascular response to angiotensin II is associated with a common variant of the angiotensinogen gene and obesity. J Hypertens 1996; 14: 199-207. [ Links ]
4. Morgan T, Craven C, Nelson L, et al. Angiotensinogen T235 expression is elevated in decidual spiral arteries. J Clin Invest 1997; 100: 1406-5. [ Links ]
5. Smithies O, Kim HS. Targeted gene duplication and disruption for analyzing quantitative genetic traits in mice. Proc Natl Acad Sci USA 1994; 91: 3612-5. [ Links ]
6. Kim HS, Krege JH, Kluckman KD, et al. Genetic control of blood pressure and the angiotensinogen locus. Proc Natl Acad Sci USA 1995; 92: 2735-9. [ Links ]
7. Spiering W, Kroon AA, Fuss-Lejeune MJJ, et al. Angiotensin II sensitivity is associated with the angio-tensin II type 1 receptor A1166C polymorphism in essential hypertensives on a high sodium diet. Hypertension 2000; 36: 411-6. [ Links ]
8. Persu A, Stoenoiu T, Messiaen T, et al. Modifier effect of ENOS in autosomal dominant polycystic kidney disease. Hum Mol Genetics 2002; 11: 229-41. [ Links ]
9. Peters DJ, Breuning MH. Autosomal dominant polycystic kidney disease: modification of disease progression. Lancet 2001; 358: 1439-44. [ Links ]
10. Baboolal K, Ravine D, Daniels J, et al. Association of the angiotensin I converting enzyme deletion polymorphism with early onset ESRF in PKD1 adult polycystic kidney disease. Kidney Internat 1997; 52: 607-13. [ Links ]
11. Perez-Oller L, Torra R, Badenas C, et al. Influence of the ACE gene polymorphism in the progression of renal failure in autosomal dominant polycystic kidney disease. Am J Kidney Dis 1999; 34: 273-8. [ Links ]
12. van Dijk MA, Breuning MH, Peters DJ, et al. The ACE insertion/deletion polymorphism has no influence on progression of renal function loss in autosomal polycystic kidney disease. Nephrol Dial Transpl 2000; 15: 836-9. [ Links ]
13. Saggar-Malik AK, Afzal AR, Jeffery S, et al. Lack of association of ACE/angiotensinogen genotype with renal function in autosomal dominant polycystic kidney disease. Genet Test 2000; 4: 299-303. [ Links ]
14. KonoshitaT, Miyagi K, Onoe T et al. Effect of ACE gene polymorphism on age at renal death in polycystic kidney disease in Japan. Am J Kidney Dis 2001; 37: 113-8. [ Links ]
15. Walker D, Consugar M, Slezak J, et al. The ENOS polymorphism is not associated with severity of renal disease in polycystic kidney disease 1. Am J Kidney Dis 2003; 41: 90-4. [ Links ]
16. Hateboer N, van Dijk MA, Bogdanova N, et al. Comparison of phenotypes of polycystic kidney disease types 1 and 2. Lancet 1999; 353: 103. [ Links ]














