Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Medicina (Buenos Aires)
versión impresa ISSN 0025-7680versión On-line ISSN 1669-9106
Medicina (B. Aires) v.64 n.4 Buenos Aires jul./ago. 2004
Dosis elevadas de aspirina disminuyen la natriuresis en hipertensos tratados con enalapril
Federico P. Di Gennaro1, Oscar H. Cingolani1, Alejandro F. Abbate1, Jorge E. Tobilli2, Antonio Vilches1
1 Departamento de Medicina Interna, CEMIC (Centro de Educación Médica e Investigaciones Clínicas Norberto Quirno);
2 Sección Hipertensión Arterial, Hospital Alemán, Buenos Aires
Dirección postal: Dr. Federico Di Gennaro, Rodríguez Peña 1657, 1021 Buenos Aires, Argentina. E-mail: fdigennaro@sinectis.com.ar
Resumen
Los inhibidores de la enzima convertidora de la angiotensina (IECA) han demostrado ser eficaces en el tratamiento de la hipertensión arterial. Sin embargo, una importante proporción de hipertensos recibe además antiagregación plaquetaria con ácido acetil salicílico (AAS), y la consecuente inhibición de la síntesis de prostaglandinas con AAS atenuaría el efecto vasodilatador y la mayor excreción urinaria de sodio (Nau) atribuidas al IECA. Nuestro objetivo fue evaluar la interacción de dos dosis de AAS (81 y 325 mg/día) sobre el efecto hipotensor del enalapril y el impacto sobre la excreción de Nau en pacientes hipertensos. Se incluyeron 22 pacientes de ambos sexos, entre 35 y 65 años. Todos recibieron enalapril, dieta hiposódica y, secuencialmente separadas por período de «wash out», las dos dosis de AAS durante los setenta días del estudio. Se evaluó: presión arterial sistólica (PAS), diastólica (PAD), media (PAM) y Nau en un período basal (PB), con 325 y 81 mg de AAS (P1 y P2 respectivamente). Comparando el PB con P1 y P2, se observó una reducción significativa de la PAS, PAD, PAM (p<0.01). Al comparar la PAS, PAD, PAM entre P1 y P2, no hubo diferencias significativas. La Nau en el PB fue mayor (p<0.01) con respecto al P1 y P2, y también P2 con respecto a P1. Estos resultados sugieren que en una población de pacientes hipertensos esenciales tratados con enalapril y diferentes dosis de AAS, el tratamiento con dosis bajas de AAS está asociado a mejor control de la PA y mayor eliminación de sodio urinario.
Palabras clave: Enalapril; Aspirina; Hipertensión; Excreción urinaria de sodio.
Abstract
High doses of aspirin reduce natriuresis in hypertensive patients treated with enalapril. Angiotensin converting enzyme inhibitors have been shown to be useful in the treatment of essential hypertension while anti-platelet agents improve the overall cardiovascular risk profile in this population. Our aim was to assess the interaction of two different aspirin (ASA) doses –81 and 325 mg/day– with the antihypertensive effect of enalapril as well as their impact upon the urinary sodium excretion (Nau). A total of 22 patients between 35 and 65 years of age were included in a prospective double blind trial with a partial cross-over design. We excluded patients with secondary hypertension and recent use of anti-inflammatory drugs. Patients were placed on enalapril and a low sodium diet -<6 g of NaCl/day- and, sequentially, on two different doses of aspirin separated by a 10 day wash out period. Blood pressure (BP) was measured at weekly visits. Systolic, diastolic and mean BP levels decreased significantly in enalapril-treated patients (p<0.01) and no difference was detected between the two AAS dosages although a non-statistically significant difference towards better BP control was observed when 81 mg of ASA was used. Nau was higher at baseline when compared with the two periods under ASA (p<0.01) and Nau was higher with 81 mg than with 325 mg. These results suggest that in essential hypertensive individuals treated with enalapril and two ASA doses, low doses of ASA are associated with better blood pressure control and higher natriuresis.
Key words: Enalapril; Aspirin; Hypertension; Urinary sodium.
La hipertensión arterial (HTA) más allá de su definición en términos cuantitativos es actualmente reconocida como un complejo síndrome clínico que incluye cambios fenotípicos en el endotelio y la reología1, 2, 3. Así, el efecto antiagregante del AAS contribuye a mejorar el perfil de riesgo cardiovascular en la población hipertensa4-7.
Los IECA son eficaces para normalizar la presión arterial (PA) pero brindan además protección ajena a su efecto hemodinámico impidiendo o corrigiendo el remodelado vascular. Ejercen su acción antihipertensiva a través de un doble mecanismo por el cual la reducción de angiotensina II (Ang II) controla la vasoconstricción y el incremento de bradikininas estimula la síntesis de óxido nítrico y favorece la vasodilatación periférica8-10.
Diferentes autores señalan que el efecto vasodilatador de los IECA estaría atenuado al inhibirse la síntesis de prostaglandinas (PGs) por acción del AAS, limitando de esta manera un adecuado control de PA en los pacientes hipertensos11, 12.
Usberti y col. hallaron una disminución de la síntesis de prostaglandina E2 (PGE2) en pacientes tratados con captopril y aspirina13. Este hecho sería de relevancia, ya que el menor efecto vasodilatador y natriurético mediado por la PGE2, podría tener un impacto negativo sobre el control de la PA. En este sentido, los estudios de Riegger y col. demostraron que la inhibición de la síntesis de PGs aumenta la resistencia vascular con disminución de la excreción urinaria de PGE2 y sodio14.
Asimismo en pacientes con insuficiencia cardíaca, otros investigadores pudieron establecer que el tratamiento con enalapril y ticlopidina no indujo los cambios hemodinámicos observados al utilizar enalapril con AAS15.
Estudios experimentales utilizando animales tratados con antiinflamatorios no esteroides (AINES) por vía endovenosa, demostraron una disminución del flujo plasmático renal con la consecuente disminución del filtrado glomerular y la excreción urinaria de sodio16. Además, existe evidencia que en personas normotensas e hipertensas, la inhibición de prostaglandinas afecta la presión arterial a través de la resistencia vascular y la excreción de cloruro de sodio17. Finalmente, estudios multicéntricos en pacientes con hipertensión arterial bajo tratamiento farmacológico en los que se evaluó la relación entre AINES e inadecuado control de la PA, sugieren que la acción sobre PGs es responsable de este fenómeno11, 18, 19.
Con estos antecedentes, el objetivo del presente trabajo fue evaluar el comportamiento de la PA y la natriuresis, en relación a dos distintas dosis de AAS habitualmente usadas en nuestro medio, en una población de pacientes con hipertensión arterial esencial tratados con enalapril.
Materiales y métodos
Diseño del estudio
Todos los participantes brindaron su consentimiento por escrito a un texto aprobado por el Comité de Bioética de CEMIC relativo a las características del estudio y sus potenciales consecuencias.
Se incluyeron 22 pacientes de ambos sexos (13 hombres y 9 mujeres) asistidos en CEMIC con edades entre 35 y 65 años, que reunían criterios de hipertensión arterial esencial estadios I-II según el Sixth Report of the Joint National Committee on Prevention, Detection, Evaluation, and Treatment of High Blood Pressure20. Ninguno de los pacientes había recibido tratamiento antihipertensivo previo. Inicialmente, se evaluó cada paciente mediante un interrogatorio y examen físico completo, con el objetivo de excluir aquéllos con sospecha clínica de hipertensión arterial secundaria o con compromiso de órgano blanco. El índice de masa corporal (IMC) se calculó utilizando las mediciones de altura (m) y peso (kg).
Criterios de exclusión
Se excluyeron todos los pacientes con alguna de las siguientes características: sospecha clínica de hipertensión secundaria, diabetes (glucemia igual o mayor a 126 mg/dl con ocho horas de ayuno) o tratados con hipoglucemiantes, obesos (IMC>30), fumadores, los que consumían más de 30 ml de etanol por día y aquéllos con compromiso clínico de órgano blanco (antecedentes de síndrome coronario agudo, revascularización miocárdica, insuficiencia cardíaca, accidente cerebro vascular, insuficiencia renal, arteriopatía periférica, retinopatía hipertensiva). Tampoco se incluyeron los pacientes con alguna contraindicación para recibir enalapril o aspirina: insuficiencia renal (creatinina>2mg/dl), hiperkalemia (K> 5 mEq/l), embarazo, antecedentes de angioedema, patología renovascular conocida, hemorragia activa o antecedentes de hemorragia digestiva reciente, anemia, trombo-citopenia, diátesis hemorrágica, intolerancia digestiva (antecedentes de úlcera péptica y/o gastritis) e hipersensibilidad al AAS (obstrucción bronquial, exantema cutáneo). Finalmente aquellos pacientes tratados con AINES por otra enfermedad durante los 15 días previos, también fueron excluidos del presente estudio.
Determinación de la PA
Las registros de PA sistólica (PAS) y PA diastólica (PAD) se realizaron una vez por semana durante todo el estudio. En cada una de las visitas se registró tres veces la PAS y la PAD en el brazo derecho con un manómetro aneroide. El nivel de PAS se definió como la aparición del primer latido (fase 1 de Korotkoff), y el nivel de PAD como la desaparición del último latido (fase 5)20. Se utilizó un estetoscopio de dos cabezas (terminal Y), y se capacitó a los médicos que participaron en el seguimiento de los pacientes para desinflar el manómetro a una velocidad de 2 mm Hg/seg. Durante la medición el paciente permanecía sentado luego de cinco minutos de reposo con el brazo descubierto a la altura del corazón. Los pacientes no consumieron alimentos, alcohol o café, y no desarrollaron ejercicio físico en los treinta minutos previos al examen. Todas las mediciones de PA se realizaron durante horas de la mañana (entre 11.30 y 12.30 hs) luego de haber recibido la dosis diaria de medicación antihipertensiva (entre 7.00 y 8.00 hs). Se utilizó el promedio de las tres lecturas, una basal y las otras separadas con un intervalo de tres minutos para el análisis de los datos.
Se consideraron hipertensos los pacientes con PAS>140 mm Hg y/o PAD >90 mm Hg. La PA media (PAM) fue calculada como la PAD + 1/3 (PAS - PAD).
Estudios de laboratorio
Se obtuvieron muestras de sangre con ayuno de catorce horas para determinar: hemograma, sodio (Na), potasio (K), calcio (Ca), creatinina (Cr), glucemia (Glu), colesterol total (Ct), HDL, LDL, triglicéridos (Trig), tiempo de Quick, KPTT y se recolectó orina de 24 hs para medir el clearance de creatinina (Cl Cr) y la natriuresis (Nau).
Esquema de tratamiento
El diseño fue prospectivo, doble ciego, con crossover parcial y formado por dos grupos de pacientes (n=11 pacientes cada grupo). Ninguno de ellos recibió AAS o AINES durante las dos semanas previas y tampoco dosis adicionales de AAS durante el estudio. A todos se les indicó por escrito una dieta hiposódica (6 g de ClNa por día) para realizar dos semanas antes de comenzar con el tratamiento. Como tratamiento antihipertensivo se utilizó enalapril en dosis inicial de 5 mg/día, ajustándose la misma semanalmente, con el objetivo de obtener un valor de PA inferior a 140/90 mm Hg.
Un grupo recibió enalapril más AAS (81 mg/día) y el otro enalapril más AAS (325 mg/día) durante 30 días; luego se realizó"washout" de AAS durante 10 días. En el día 40 se realizó crossover de la dosis de AAS y se continuó el tratamiento por 30 días. Las dos dosis de AAS (81 y 325 mg) fueron administradas en forma de comprimidos iguales y en envases cerrados previamente rotulados (doble ciego), preparados en la farmacia de CEMIC.
Se efectuaron las determinaciones en sangre y orina antes de comenzar el tratamiento con aspirina (medición basal) y al final del primer y segundo mes de tratamiento (días 30 y 70 respectivamente).
El enalapril fue administrado en comprimidos de 5 y 10 mg a todos los pacientes. Al finalizar el estudio se comparó el promedio de registros de PAS, PAD, PAM y Nau basal y en los períodos de tratamiento con AAS 325 mg y con AAS 81 mg.
Análisis estadístico
Todos los cálculos del análisis estadístico fueron procesados con el programa Instat, versión 3.0 (GraphPad Software, Inc., San Diego, California, USA). El método de Kolmogorov & Smirnov 21 se empleó como test para determinar si la distribución de las muestras era "Gaussiana" en los distintos parámetros evaluados. Los valores se expresan como media ± DS. Las diferencias entre los valores basales, del primer y del segundo mes, fueron evaluadas mediante ANOVA para muestras pareadas. Se consideró estadísticamente significativo a p < 0.05.
Resultados
De los 30 pacientes que fueron incluidos, 22 completaron el estudio. Ocho pacientes debieron ser excluidos: tres de ellos decidieron no continuar por razones personales, cuatro por no concurrir a los controles médicos semanales y finalmente un paciente refirió síntomas compatibles con dispepsia. Se corroboró el número de comprimidos de la medicación suministrada al finalizar el primer y segundo período.
Las dosis de enalapril fueron similares durante los dos períodos como se indica en la Tabla 1, y en la mayoría de los pacientes se registraron cifras de PA inferiores a 140/90 mmHg al finalizar el estudio.
TABLA 1.– Variables evaluadas en período basal (PB), a los 30 días (P1) y 70 días (P2)
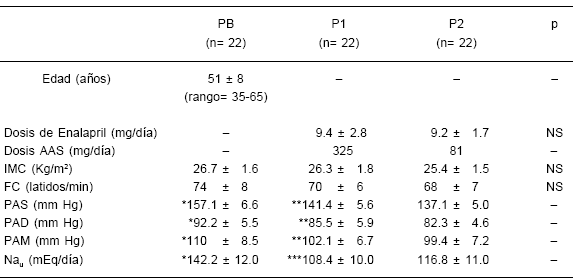
Datos expresados como media ± DS; AAS = Acido acetílsalicílico; IMC = Indice de masa corporal; FC = Frecuencia cardíaca; PAS = Presión arterial sistólica; PAD = Presión arterial diastólica; PAM = Presión arterial media; Nau= Natriuresis en 24 hs. NS = no significativo
* PB versus P1 & P2 = p< 0.01; ** P1 versus P2 = NS ; *** P1 versus P2 = p<0.01
Después de setenta días de seguimiento no se observaron cambios significativos en el IMC y frecuencia cardiaca (FC), como se muestra en la Tabla 1. Todos los pacientes presentaron una reducción significativa de su PAS, PAD y PAM comparando los registros entre el período basal (PB) con los períodos que recibieron las dos dosis de AAS (Tabla 1). No se observaron diferencias estadísticamente significativas entre P1 y P2 con respecto a las determinaciones de PAS, PAD y PAM. Sin embargo, se pudo apreciar un mejor control de la PAS, PAD y PAM en el período que los pacientes recibieron menor dosis de AAS (81 mg/día). Por su parte, la excreción de Nau de 24 hs, presentó una reducción estadísticamente significativa al comparar el PB con respecto a los valores obtenidos al finalizar el P1 y P2 (Tabla 1). Se observó una mayor eliminación de Na en el período en que los pacientes recibieron menor dosis de AAS (81 mg/día), con significación estadística.
Discusión
En este estudio de corto plazo se pudo observar un escaso efecto del AAS sobre el control de la PA en una población de pacientes hipertensos esenciales tratados con enalapril. En ambos períodos del ensayo se pudo apreciar una significativa reducción de la PAS, PAD y PAM con respecto a las mediciones basales, independientemente de las diferentes dosis de AAS administradas (81 y 325 mg/día). Estos resultados son concordantes con la experiencia comunicada por Smith y col., donde se demuestra una interacción no significativa sobre el control de la PAM, al utilizar 75 mg de AAS concomitantemente con 25 mg de captopril en individuos con hipertensión arterial22. Por otro lado, Polónia y col. comunicaron que dosis de 100 mg de AAS por día no modificaron las cifras de PA en pacientes tratados con enalapril. No obstante, los mismos autores destacan en ese estudio que el efecto hipotensor del IECA se vio disminuido en un 45% en presencia de 75 mg/día de indometacina, un potente inhibidor de la síntesis de PGs23. Además, otras experiencias utilizando dosis de 300 mg de AAS han sugerido una disminución en el efecto hipotensor del enalapril24 y otros grupos señalaron el incremento de la PA en pacientes con insuficiencia cardíaca congestiva tratados con IECA y AAS25, 26. La información precedente induce a pensar que bajas dosis de AAS no antagonizan el efecto antihipertensivo de los IECA, lo que coincide con la tendencia observada en nuestro estudio, donde se apreció un mejor control de la PAS, PAD y PAM en aquel período en que los pacientes recibieron dosis bajas de AAS (81 mg/día). Nuestro diseño y el número de pacientes incluidos no permite afirmar o excluir el impacto de la dosis mayor.
Hasta la actualidad no se ha podido precisar el mecanismo por el cual la AAS podría interferir con el efecto hipotensor de los IECA27-29.
La regulación de la PA depende de una serie de complejos sistemas donde intervienen una variedad de factores que en mayor o menor proporción actúan sobre la pared vascular. Entre ellos, uno de los propuestos es el efecto de las PGs sobre la resistencia vascular periférica17, 28, 30. La síntesis de PGs puede ser atenuada por la inhibición de la enzima ciclooxigenasa (COX) a través del uso de AINES como la AAS11, 12, 17, 18. Algunos estudios han mostrado que no hay cambios significativos en la concentración plasmática y urinaria de PGE2 y PGI2, mientras que por el contrario, otros investigadores han demostrado la disminución de PGE2 en pacientes tratados con AAS y enalapril26. Clarke y col. describieron que AAS a bajas dosis (100 mg/día) sólo inhibe la COX plaquetaria sin repercusión en la síntesis de PGs vasodilatadoras sintetizadas en el endotelio31. Por su parte, otros autores señalan que el AAS causa una disminución de la síntesis de PGs renales favoreciendo la retención de sodio y consecuentemente una menor natriuresis13, 18, 30. En nuestro estudio, se observó una diferencia significativa en la natriuresis cuando los pacientes recibieron las diferentes dosis de AAS. Con dosis más baja de AAS (81 mg/día), se pudo apreciar una clara tendencia a eliminar una mayor cantidad de sodio en relación a los valores presentados por estos mismos pacientes cuando recibieron dosis mayores de AAS (325 mg/día).
En conclusión, nuestros datos muestran que en una población de pacientes hipertensos esenciales tratados con enalapril y dos diferentes dosis de AAS, se observa una tendencia al mejor control de la PA y mayor eliminación de sodio en orina cuando estos pacientes recibieron una dosis menor de AAS. El impacto de estos cambios a largo plazo no ha sido establecido.
Agradecimientos: Los autores desean agradecer por la colaboración recibida para realizar el presente trabajo a la Dirección de Investigación de CEMIC por el"Subsidio para investigadores jóvenes" otorgado en junio del 2002 al Dr. Federico Di Gennaro; al Laboratorio Schering-Plough (División Cardiología) por la donación del enalapril; a la Lic. Cristina Flecha, Jefa de Farmacia de CEMIC por coordinar la preparación del AAS. A los Dres. Pablo Rodríguez, Eugenio Cingolani y María Alejandra Lombraña quienes colaboraron en la atención y seguimiento de los pacientes.
Bibliografía
1. MacMahon S, Peto R, Cutler J, et al. Blood pressure, stroke, and coronary heart disease. Prolonged differences in blood pressure: Prospective observational studies corrected for the regression dilution bias. Lancet 1990; 335: 765-74.
2. Kannel WB, Castelli WP, McNamara PM, McKee PA, Feinleib M. Role of blood pressure in the development of congestive heart failure. The Framingham study. N Engl J Med 1972; 287: 781-7.
3. Burt VL, Cutler JA, Higgins M, et al. Trends in the prevalence, awareness, treatment, and control of hypertension in the adult US population: Data from the Health Examination Surveys, 1960 to 1991. Hypertension 1995; 26: 60-9.
4. Leor J, Reicher-Reiss H,Goldbourt U, et al. Aspirin and mortality in patients treated with angiotensin-converting enzyme inhibitors: a cohort study of 11,575 patients with coronary artery disease. J Am Coll Cardiol 1999; 33: 1920-5.
5. Hansson L, Zanchetti A, Carruthers S G, et al. Effects of intensive blood-pressure lowering and low-dose aspirin in patients with hypertension: principal results of the Hypertension Optimal Treatment (HOT) randomised trial. Lancet 1998; 351: 1755-62.
6. Guazzi M, Agostoni P, Guazzi MD. Modulation of alveolar-capillary sodium handling as a mechanism of protection of gas transfer by enalapril, and not by losartan, in chronic heart failure. J Am Coll Cardiol 2001; 37: 398-406.
7. Nguyen KN, Aursnes I, Kjekshus J.Interaction between enalapril and aspirin on mortality after acute myocardial infarction: subgroup analysis of the Cooperative New Scandinavian Enalapril Survival Study II (CONSENSUS II). Am J Cardiol 1997; 79: 115-9.
8. Bauer JH. Angiotensin converting enzyme inhibitors. Am J Hypertens 1990; 3: 331-7.
9. Nakamura M, Funakoshi T, Arakawa N, Yoshida H, Makita S, Hiramori K. Effect of angiotensin-converting enzyme inhibitors on endothelium-dependent peripheral vasodilation in patients with chronic heart failure. J Am Coll Cardiol 1994; 24: 1321-7.
10. Cachofeiro V, Maeso R, Rodrigo E, Navarro J, Ruilope LM, Lahera V. Nitric oxide and prostaglandins in the prolonged effects of losartan and ramipril in hypertension. Hypertension 1995; 26: 236-43.
11. Guazzi M, Brambilla R, Reina G, Tumminello G, Guazzi MD. Aspirin-angiotensin-converting enzyme inhibitor coadministration and mortality in patients with heart failure: a dose-related adverse effect of aspirin. Arch Intern Med 2003; 163: 1574-9.
12. Bao G, Gohlke P, Qadri P Unger T. Chronic kinin receptor blockade attenuates the antihypertensive effect of ramipril. Hypertension 1992; 20: 74-9.
13. Usberti M, Di Minno G, Ungaro B, et al. Angiotensin II inhibition with captopril on plasma ADH, PG synthesis, and renal function in humans. Am J Physiol 1986; 250: F986-90.
14. Riegger AJ. Role of prostaglandins in regulation of kidney function in heart failure. Heart 1991; 16: 116-23.
15. Spaulding C, Charbonnier B, Cohen-Solal A, et al. Acute hemodynamic interaction of aspirin and ticlopidine with enalapril: results of a double-blind, randomized comparative trial. Circulation 1998; 98: 757-65.
16. Chamaa NS, Mosig D, Drukker A Guignard JP. The renal hemodynamic effects of ibuprofen in the newborn rabbit. Pediatr Res 2000; 8: 600-5.
17. Dunn MJ, Grone HJ. The relevance of prostaglandins in human hypertension. Adv Prostaglandin Thromboxane Leukot Res 1985; 13: 179-87.
18. Nawarskas JJ, Townsend RR, Cirigliano MD, Spinler SA. Effect of aspirin on blood pressure in hypertensive patients taking enalapril or losartan. Am J Hypertension 1999; 12: 784-9.
19. De Leeuw PW. Non-steroidal antiinflamatory drugs and hypertension. Drugs 1996; 51: 179-187.
20. The Sixth Report of the Joint National Committee on Prevention, Detection, Evaluation, and Treatment of High Blood Pressure. Arch Intern Med 1997; 157: 2413-46.
21. American Medical Association. Manual of Style. A guide for authors and editors by Maureen Barlw Pugh. 9th Edition. Williams & Wilkins, Baltimore. 1998. Chap. 17. pag. 521-81.
22. Smith SR, Coffman TM, Svetkey LP. Effect of low-dose aspirin on thromboxane production and the antihyper-tensive effect of captopril. J Am Soc Nephrol 1993; 4: 1133-9.
23. Polonia J, Boaventura I, Gama G, et al. Influence of non-steroidal anti-inflammatory drugs on renal function and 24h ambulatory blood pressure-reducing effects of enalapril and nifedipine gastrointestinal therapeutic system in hyper-tensive patients. J Hypertens 1995; 13: 925-31.
24. Guazzi MD, Campodonico J, Celeste F, et al. Antihy-pertensive efficacy of angiotensin converting enzyme inhibition and aspirin counteraction. Clin Pharmacol Ther 1998; 63: 79-86.
25. Kuga T, Egashira K, Mohri M, et al. Bradykinin induced vasodilation is impaired at the atherostatic site, but is preserved at the spastic site of coronary arteries in vivo. Circulation 1995; 92: 183-9.
26. Hall D, Zeitler H, Rudolph W. Counteraction of the vasodilator effect of enalapril by aspirin in severe heart failure. J Am Coll Cardiol 1992; 20: 1549-55.
27. FitzGerald GA, Oates JA, Hawiger J, et al. Endogenous biosynthesis of prostacyclin and thromboxane and platelet function during chronic administration of aspirin in man. J Clin Invest 1983; 71: 676-88.
28. Moore TJ, Crantz FR, Hollenberg NK, et al. Contribution of the prostaglandins to the antihypertensive action of captopril in essential hypertension. Hypertension 1981; 3: 168-73.
29. Sturrock ND, Struthers AD. Non-steroidal antiinflammatory drugs and angiotensin converting enzyme inhibitors: a commonly prescribed combination with variable effects on renal function. Br J Clin Pharmacol 1993; 35: 343-8.
30. Haylor J. Prostaglandins synthesis and renal function in man. J Physiol 1980; 289: 383-96.
31. Clarke RJ, Mayo G, Price P, et al. Suppression of thromboxane A2 but not systemic prostacyclin by controlled-release aspirin. N Engl J Med 1991; 325: 1137-41. [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ]
Recibido: 29-12-2003
Aceptado: 15-04-2004














