Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Medicina (Buenos Aires)
versión impresa ISSN 0025-7680versión On-line ISSN 1669-9106
Medicina (B. Aires) v.64 n.4 Buenos Aires jul./ago. 2004
Osteonecrosis en pacientes infectados por HIV
Edgardo G. Bottaro1, 3, Raúl H. Figueroa2, Pablo G. Scapellato1, Gabriela I. Vidal1, María T. Rodríguez Brieschke1, Silvia da Representaçao4, María B. Seoane1, Marcelo F. Laurido3, Diego Caiafa3, Gustavo Lopardo5, Fabián Herrera6, Isabel Cassetti3, 5
1 Grupo de Infectología y
2 Ortopedia y Traumatología, Hospital General de Agudos Donación F. Santojanni;
3 Helios Salud;
4 Sección Inmunología y Laboratorio Central, Hospital General de Agudos Donación F. Santojanni;
5 Centro de Estudios Infectológicos; 6 CEMIC, Buenos Aires
Dirección postal: Dr. Edgardo Bottaro, Perú 1511, 1141 Buenos Aires, Argentina. Fax: (54-11)4300-5021. E-mail: egbottaro@hotmail.com
Resumen
Según la literatura, la osteonecrosis tiene una mayor incidencia en los pacientes infectados con HIV que en la población general. Ello sería resultado de la confluencia de factores de riesgo clásicos y de otros propios de esta población o más prevalentes en ella, como el tratamiento con inhibidores de proteasa, la dislipemia producto de su consumo, la presencia de anticuerpos anticardiolipina séricos, la hipercoagulabilidad, la restauración inmune y las vasculitis. Presentamos una serie de 13 pacientes infectados con HIV con osteonecrosis. El motivo de consulta fue dolor en grandes articulaciones. Cuatro eran alcoholistas, 8 tabaquistas y 9 tenían dislipemia. Once habían recibido esteroides en algún momento de la vida aunque sólo uno estaba recibiéndolos al momento del inicio del dolor. En 2 se detectaron anticuerpos anticardiolipina séricos. Doce tenían sida y recibían tratamiento antirretroviral de alta eficacia (11 con inhibidores de proteasa). Ellos lograron una adecuada recuperación inmunológica. Consideramos necesario incluir la osteonecrosis como diagnóstico diferencial de artralgia persistente en pacientes infectados con HIV e investigar infección por HIV en todo paciente con osteonecrosis sin claros factores predisponentes.
Palabras clave: HIV; Sida; Osteonecrosis; HAART; Inhibidores de proteasa.
Abstract
Osteonecrosis in HIV-infected patients. Osteonecrosis, also known as avascular necrosis, is chiefly characterized by death of bone caused by vascular compromise. The true incidence of osteonecrosis in HIV-infected patients is not well known and the pathogenesis remains undefined. Hypothetical risk factors peculiar to HIV-infected individuals that might play a role in the pathogenesis of osteonecrosis include the introduction of protease inhibitors and resulting hyperlipidemia, the presence of anticardiolipin antibodies in serum leading to a hypercoagulable state, immune recovery and vasculitis. Hereby we present a series of 13 HIV-infected patients with osteonecrosis. The most common symptom upon presentation was arthralgia. The majority of the patients had received steroids, 9 had developed hyperlipidemia after the introduction of HAART, 8 were smokers and 4 patients were alcoholics. In 2 patients, seric anticardiolipin antibodies were detected. Twelve patients had AIDS and were on HAART (11 were on protease inhibitors). We believe that osteonecrosis should be included as differential diagnosis of every HIV-infected patient who complains of pain of weight bearing joints. Likewise, it seems prudent to rule out HIV infection in subjects with osteonecrosis.
Key words: HIV; AIDS; Osteonecrosis; HAART; Protease inhibitors.
El uso masivo del tratamiento antirretroviral altamente eficaz (HAART) produjo profundos cambios en la epidemiología y manifestaciones clínicas de la enfermedad por HIV, pues a partir de su uso difundido en 1996, se observó una gran reducción de la morbimortalidad de la población infectada que accedía al tratamiento1.
Paralelamente al incremento en el consumo de HAART con inhibidores de la proteasa (IP) se comunicaron situaciones clínicas inesperadas, consideradas efectos adversos de dichas drogas, como dislipemia2, intolerancia a la glucosa3 y lipodistrofia4.
Otros fenómenos como osteopenia5 y osteonecrosis (ON)6, 7 también se informaron con mayor frecuencia a partir del uso de IP, pero su interpretación como efectos adversos de las drogas o complicación de la infección por HIV es hasta hoy controvertida.
Se describe una serie de pacientes infectados con HIV con ON y se revisa la literatura.
Material y métodos
Se llevó a cabo un estudio descriptivo de una serie de 13 pacientes infectados con HIV con diagnóstico de ON asistidos en diferentes centros médicos de la Ciudad de Buenos Aires entre noviembre de 1998 y marzo de 2003.
Todos fueron examinados por el médico de cabecera y luego, para su evaluación, derivados a un médico traumatólogo. Se les realizaron radiografías de las articulaciones comprometidas y se solicitaron estudios para confirmar el diagnóstico presuntivo de ON.
De las historias clínicas se recolectaron los siguientes datos: antecedentes clínicos, recuento de linfocitos CD4, colesterolemia y trigliceridemia antes de comenzar a recibir HAART y al momento de inicio del dolor articular.
Se definió como paciente con dislipemia a quien hubiera presentado algún registro de colesterolemia mayor a 200 mg/dl o de trigliceridemia mayor a 200mg/dl en los doce meses previos al inicio del dolor articular. Estos valores fueron elegidos por estar asociados a morbilidad vascular8, 9.
Se efectuó la detección y cuantificación de los anticuerpos anticardiolipinas IgA, IgG e IgM en suero mediante enzimoin-munoanálisis en microplacas (BindazymeTM. The Binding Site Limited. Birmingham, United Kingdom).
Se llevó a cabo una búsqueda bibliográfica en la base de datos MEDLINE, entre enero de 1989 y diciembre de 2003. Además se revisaron los resúmenes de las Conferencias sobre Retrovirus e Infecciones Oportunistas realizadas desde 1997 hasta 2003 y los resúmenes de las Conferencias Internacionales de Sida desde 1998 en adelante. Para la revisión de algunos tópicos, se extendió la búsqueda a años anteriores.
Resultados
Se diagnosticó ON en 13 pacientes infectados con HIV. La incidencia de ON en la población estudiada fue de 0.56%. Todos consultaron por dolor de grandes articulaciones. Diez fueron varones y 3 mujeres. La edad de los pacientes osciló entre 30 y 50 años (mediana 33 años).
Todos presentaban al menos un factor de riesgo clásico para desarrollo de ON: 9 presentaban dislipemia, 7 tabaquismo, 4 alcoholismo y 1 recibía glucocorticoides en altas dosis al momento de inicio del dolor articular.
De los 12 pacientes que no recibían esteroides al momento de inicio del dolor, 10 habían recibido alguna droga con actividad glucocorticoide (metilprednisolona, dexametasona o megestrol) en algún momento previo durante un lapso que osciló entre 5 días y 70 semanas (mediana 3 semanas). El tiempo libre de esteroides al inicio de la artralgia osciló entre 6 y 32 meses (mediana 17 meses).
Nueve pacientes presentaban dislipemia. Cuatro tenían hipercolesterolemia aislada, 3 hipertrigliceridemia aislada y 2 dislipemia combinada. En 3 casos la hipercolesterolemia era leve (menor a 240 mg/dl) y en 3, severa (mayor a 240 mg/dl).
En 2 pacientes se detectaron niveles mayores a lo normal de anticuerpos anticardiolipina séricos.
Los datos mencionados se resumen en la Tabla 1.
TABLA 1.– Antecedentes clínicos y de laboratorio de los pacientes de la serie presentada

Nota: a Al momento de inicio de la artralgia; b Valor normal IgG hasta 11 UI/ml; IgM hasta 11 UI/ml; IgA hasta 13 UI/ml; M: masculino; F: femenino; a: años; sem: semanas; m: meses; ND: dato no disponible.
Doce pacientes tenían sida y 1 era asintomático. El recuento de linfocitos CD4 antes de iniciar HAART osciló entre 0 y 386 células/mm3 (mediana 25 células/mm3).
Los 12 pacientes con sida recibían HAART, 11 con IP y 1 con nevirapina (este último había recibido IP hasta 18 meses antes de comenzar con artralgia) durante un tiempo que osciló entre 7 y 61 meses (mediana 38 meses). Estos pacientes alcanzaron un incremento significativo del recuento de linfocitos CD4 de entre 80 y 788 células/mm3 (mediana 276 células/mm3).
Los datos anteriores se resumen en la Tabla 2.
TABLA 2.– Aspectos relativos a la enfermedad por HIV de los pacientes de la serie presentada
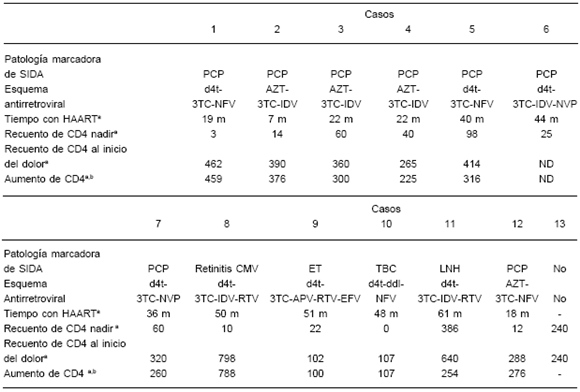
Nota: a en células/mm3; ben respuesta a HAART; M: Masculino; F: Femenino; NFV: Nelfinavir; IDV: Indinavir; APV: Amprenavir; EFV: Efavirenz; NVP: Nevirapina; PCP: neumonía por Pneumocystis carinii; LNH: Linfoma no Hodgkin; CMV: Citomegalovirus; CD: Criptococosis diseminada; ET: Encefalitis por Toxoplasma gondii; LPC: Linfoma Primario de Cerebro; TBC: Tuberculosis; m: meses; ND: dato no disponible.
Los métodos diagnósticos utilizados para confirmar la ON fueron resonancia nuclear magnética (RNM) en 10 pacientes, centellograma óseo con tecnecio (99Tc) en 2, y tomografía axial computada en uno. Un paciente fue sometido a biopsia ósea, lo que ratificó el diagnóstico. Se diagnosticó compromiso de 23 articulaciones en los 13 individuos. La ON fue monoarticular en 4 pacientes. La articulación más frecuentemente comprometida fue la coxofemoral (20 de 23 articulaciones afectadas).
Estos datos se resumen en la Tabla 3.
TABLA 3.– Características clínicas de la osteonecrosis en la serie presentada

Nota: CFD: Coxofemoral derecha; CFI: Coxofemoral izquierda; EHD: Escápulo-humeral derecha; EHI: Escápulo-humeral izquierda; AINE: Antiinflamatorios no esteroides. RNM: Resonancia nuclear magnética. CO: Centellograma óseo. TC: Tomografía axial computada; m: meses.
Todos recibieron antiinflamatorios no esteroides lográndose control adecuado del dolor en 10 casos. En los restantes fue necesaria la cirugía por progresión del dolor. En un paciente se realizó la descompresión del núcleo de la cabeza femoral afectada y en los otros reemplazo total de las articulaciones coxofemorales. Ninguno presentó complicaciones postquirúrgicas.
Discusión y revisión de la literatura
La ON es resultado de la muerte de los elementos celulares óseos como consecuencia del déficit en el flujo sanguíneo arterial10.
La forma idiopática de ON fue denominada previamente necrosis aséptica y necrosis avascular para diferenciarla de las necrosis óseas secundarias a terapia radiante, traumatismos o infecciones11. Finalmente se la llamó ON, siendo ésta la denominación actualmente aceptada.
Aunque los factores clásicamente asociados a ON son varios10-15, aproximadamente 8-20% de los casos no reconocen ningún factor predisponente13. Su incidencia en la población general sería cercana a 0.13%13.
La base fisiopatológica es la isquemia secundaria a oclusión de la microvasculatura subcondral16.
El primer caso de ON en un paciente infectado con HIV fue comunicado por Goorney y col en 199017. Desde entonces varias publicaciones informaron sobre esta asociación18-21. Gutiérrez y col6 y Keruly y col22 informaron un incremento en la incidencia de ON en pacientes infectados con HIV desde 1996. Miller y col23 hallaron una prevalencia de 4.4% en una población de adultos infectados con HIV sin síntomas osteoarticulares. Las manifestaciones clínicas y la localización son las mismas que para la población general: 85% de los casos presentan afección de la cabeza femoral y en casi la mitad es bilateral24.
Nuestra serie suma a la casuística 13 nuevos casos de ON en pacientes infectados por HIV. Doce recibían HAART y todos tenían por lo menos un factor predisponente para ON, siendo el consumo de esteroides previo al inicio del dolor el de mayor prevalencia. Un paciente que no recibía esteroides al inicio del dolor, los recibió 7 meses más tarde, con empeoramiento de la artralgia tras 3 meses de tomarlos, por lo cual se realizaron estudios que confirmaron la ON. Los otros factores de riesgo hallados en nuestra serie en orden decreciente de prevalencia fueron dislipemia, tabaquismo, alcoholismo y presencia de anticuerpos anticardiolipina séricos.
Hay pocos estudios publicados investigando la asociación de ON con HIV.
En una revisión de 38 historias clínicas de pacientes con ON tratados quirúrgicamente25 se halló que 4 de los 7 infectados con HIV incluidos en dicha serie (57%) carecían de factores de riesgo para ON, mientras que lo mismo sucedía sólo en 4 de los 31 seronegativos para HIV (13%). Los autores propusieron a la infección por HIV como un factor de riesgo para ON.
De la literatura surgen varios factores que podrían estar asociados a mayor riesgo de ON en la población infectada por HIV, y podrían ser considerados"nuevos factores de riesgo" para ON en dicha población. Ellos son:
a) Consumo de IP: El incremento en la incidencia de ON en la población infectada por HIV desde la introducción de los IP, hizo suponer que fuera un efecto adverso de esas drogas. Las publicaciones proponiendo esta hipótesis consistieron, en su mayoría, en informes de casos clínicos o pequeñas series de pacientes que desarrollaron artralgia tiempo después de comenzar a recibir IP19, 26, 27. Sin embargo, casi todos los sujetos incluidos en esas publicaciones presentaban algún otro factor de riesgo para ON7, 18-20.
El principal mecanismo por el cual los IP aumentarían el riesgo de ON sería la dislipemia secundaria20. Sin embargo, si bien dos estudios hallaron una mayor proporción de pacientes con dislipemia entre aquellos con ON, las diferencias no alcanzaron significación estadística.
Un segundo mecanismo sería el aumento de la grasa de la médula ósea, como parte del síndrome de lipodistrofia, llevando a incremento de la presión intraósea y a colapso vascular progresivo28.
Otro mecanismo podría considerarse en quienes reciben IP concomitantemente con glucocorticoides. Los IP son potentes inhibidores del citocromo P450 e incrementan los niveles séricos y los efectos adversos de los glucocorticoides29.
A pesar de lo dicho, el estudio prospectivo de Miller y col sobre más de 300 pacientes23, y dos estudios caso-control13, 30 no demostraron que el consumo de IP fuera un factor de riesgo independiente para ON.
b) Restauración inmune: Dos estudios lograron relacionar la ON con una adecuada respuesta inmunológica o virológica por parte de quienes recibían HAART.
Monier y col7 en una revisión bibliográfica, refieren que el empeoramiento de la artralgia o la aparición de ON en 10 de 16 pacientes evaluables, coincidió con un aumento del recuento de linfocitos CD4 o un descenso de la carga viral plasmática de HIV.
Glesby y col30, informaron en su serie de 17 pacientes infectados con HIV con ON y 34 controles sin ON, que 64.7% de los sujetos con ON habían logrado un incremento del recuento de CD4 mayor a 50 células/mm3, mientras que sólo 35.3% de los controles habían alcanzado similar respuesta inmunológica.
En contraposición a los dos estudios previos, Skiest comunicó que de 14 pacientes infectados con HIV con ON, 5 la presentaron tras haber alcanzado un incremento del recuento de linfocitos CD4, pero en 9, la ON fue precedida por un deterioro inmunológico31.
Otros autores proponen que el aumento en la producción de anticuerpos anti-proteína S sería otra manifestación de restauración inmune7. Ello llevaría al establecimiento de un estado de hipercoagulabilidad32, agregando otro factor etiológico de ON.
c) Anticuerpos anticardiolipina y procoagulabilidad: Los anticuerpos anticardiolipina fueron clásicamente implicados en la etiología de ON de cabeza femoral33.
Miller y col23 detectaron un nivel sérico de anticuerpos anticardiolipina superior a lo normal en 50% de los pacientes infectados con HIV con ON, pero sólo en 10% de los infectados con HIV sin ON. La literatura informa que 50-86% de los sujetos infectados con HIV presentan niveles elevados de anticuerpos anticardiolipina séricos24, un porcentaje superior al hallado en nuestra serie.
Varios estudios coinciden en que durante la infección por HIV se establecería un estado de hipercoagulabilidad34, 35. Sin embargo, no hay trabajos publicados estudiando la relación entre hipercoagulabilidad y factores distintos de anticuerpos anticardiolipina con ON en pacientes seropositivos para HIV.
d) Consumo de glucocorticoides: Además de antirretrovirales, los pacientes infectados con HIV reciben drogas para tratar o prevenir complicaciones. Los glucocorticoides, clásicamente ligados al riesgo de ON36, son utilizados como adyuvantes en el tratamiento de algunas patologías oportunistas.
Glesby y col30 hallaron correlación entre el consumo de glucocorticoides y el desarrollo de ON. En su serie, 47% de los pacientes infectados con HIV con ON habían recibido esteroides, mientras que sólo habían recibido esteroides 8.8% de aquellos sin ON.
Miller y col23 hallaron una tendencia similar: 7.7% de los pacientes con ON habían recibido glucocorticoides mientras que sólo 2% de aquellos sin ON los habían recibido.
El megestrol, mediante su actividad glucocorticoide-simil13 también podría ser un agente etiológico de ON en esta población según una pequeña serie de 3 pacientes37. Sin embargo, el estudio de Miller y col23 no halló diferencias en el consumo de megestrol entre los pacientes con y sin ON.
Los mecanismos mediante los cuales los glucocorticoides aumentarían el riesgo de ON serían el incremento en la masa grasa de la médula ósea, llevando a un aumento progresivo de la presión intraósea y a colapso vascular28, la producción de émbolos grasos, la inducción de osteoporosis con microfracturas14 y la inducción de dislipemia28.
En el estudio de Miller y col23, el antecedente de haber recibido testosterona también se asoció a mayor riesgo de ON: 8.3% de los pacientes con ON recibieron testosterona mientras que sólo 2.1% de aquellos sin ON la habían recibido.
A pesar de la relación entre el consumo de glucocorticoides y ON, no está claro durante cuánto tiempo deben, los pacientes, consumir esteroides para ser susceptibles de sufrir ON, cuál es la dosis nociva y durante cuánto tiempo permanecen susceptibles a padecer ON luego de finalizado su consumo.
e) Vasculitis: En 1997, Laroche y col38 en un estudio de las piezas anatómicas tomadas durante la cirugía de 20 pacientes con ON, sin infección por HIV, hallaron vasculitis entre otras lesiones vasculares. Siendo la vasculitis un cuadro frecuentemente descripto en pacientes infectados con HIV39, se la podría incluir como otro potencial factor de riesgo de ON en esta población.
Un caso de ON asociada a arteriopatía oclusiva no aterosclerótica fue comunicado recientemente40. Este tipo de lesiones de grandes y medianas arterias podrían ser secundarias a vasculitis dentro de la vasa vasorum y de los vasos periadventicios41.
El tratamiento de la ON puede ser médico o quirúrgico.
El tratamiento médico consiste en reducir la carga sobre la articulación comprometida, la eliminación de los factores que podrían influir en el desarrollo y empeoramiento de la ON y el uso de analgésicos-antiinflamatorios no esteroides24.
Las opciones quirúrgicas comprenden la cirugía descompresiva del núcleo de la cabeza femoral, el autoinjerto óseo (en ocasiones combinado con la cirugía descompresiva), las osteotomías, y la artroplastia con reemplazo total de la articulación. La elección de la técnica más apropiada para cada caso dependerá de las condiciones generales del paciente, del estadio de la ON y la experiencia de cada centro24, pues se carece aún de datos acerca de la evolución a largo plazo de los pacientes infectados con HIV tratados quirúrgicamente.
Si bien no hay recomendaciones terapéuticas especiales para esta población, es prudente tener en cuenta algunas publicaciones que informan mayor riesgo de infección luego de un reemplazo articular en pacientes infectados con HIV42, 43.
Nuestro estudio coincide con la literatura al hallar una incidencia de ON en pacientes infectados con HIV superior a la de la población general. Los motivos de ello son desconocidos (su estudio no fue objetivo de este trabajo) aunque las hipótesis son varias. Podría tratarse de un fenómeno multicausal en el cual confluirían los factores etiológicos clásicos y los "nuevos factores de riesgo" propuestos.
Son necesarios más estudios con inclusión de un mayor número de pacientes para definir mejor los mecanismos de dicha potencial asociación, así como los factores independientemente asociados a ON en esta población.
Desde un punto de vista práctico, creemos que se debe sospechar ON en todo paciente infectado con HIV con artralgia persistente sin respuesta al tratamiento analgésico, pues el diagnóstico precoz permitiría instaurar medidas no invasivas tendientes a reducir la progresión del daño articular y posponer lo más posible la cirugía.
Asimismo, proponemos sospechar infección por HIV en todo paciente con ON, especialmente si carece de factores de riesgo clásicamente asociados a la misma.
Bibliografía
1. Palella FJ Jr, Delaney KM, Moorman AC, et al. Declining morbidity and mortality among patients with advanced human immunodeficiency virus infection. HIV Outpatient Study Investigation. N Engl J Med 1998; 338: 853-60.
2. Periard D, Telenti A, Sudre P, et al. Atherogenic dyslipemia in HIV-infected individuals treated with protease inhibitors. Circulation 1999; 100: 700-5.
3. Dubé MP. Disorders of glucose metabolism in patients infected with human immunodeficiency virus. Clin Infect Dis 2000; 31: 1467-75.
4. Carr A. HIV protease inhibitor-related lipodystrophy syndrome. Clin Infect Dis 2000; 30 (suppl 2): S135-42.
5. Tebas P, Powderly WG, Claxton S, et al. Accelerated bone mineral loss in HIV-infected patients receiving potent antiretroviral therapy. AIDS 2000; 14: F63-7.
6. Gutiérrez F, Padilla S, Ortega E, et al. Avascular necrosis of the bone in HIV-infected patients: incidence and associated factors. AIDS 2002; 16: 481-3.
7. Monier P, McKown K, Bronze MS. Osteonecrosis complicating highly active antiretroviral therapy in patients infected with human immunodeficiency virus. Clin Infect Dis 2000; 31: 1488-92.
8. Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults. Executive Summary of the Third Report of the National Cholesterol Education Program (NCEP) Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults (Adult Treatment Panel III). JAMA 2001; 285: 2486-97.
9. Hokanson JE, Austin MA. Plasma triglyceride level is a risk factor for cardiovascular disease independent of HDL cholesterol level: a metaanalysis of population-based prospective studies. J Cardiovasc Risk 1996; 3: 213-9.
10. Steinberg ME. Avascular necrosis: diagnosis, staging, and management. J Musculoeskel Med 1997; 14: 13-25.
11. Sugano N, Atsumi T, Ohzono K, Kubo T, Hotokebuchi T, Takaoka K. The 2001 revised criteria for diagnosis, classification, and staging of idiopathic osteonecrosis of the femoral head. J Orthop Sci 2002; 7: 601-5.
12. Mankin HJ. Nontraumatic necrosis of bone (osteonecrosis). N Engl J Med 1992; 326: 1473-9.
13. Scribner AN, Troia-Cancio PV, Cox BA, et al. Osteonecrosis in HIV: A case-control study. J Acq Imm Defic Synd 2000; 25:19-25.
14. Plate AM, Boyle BA. Review of avascular necrosis and HIV. AIDS Reader 2000; 10: 570-3.
15. Van Veldhuizen PJ, Neff J, Murphey MD, Bodensteiner D, Skikne BS. Decreased fibrinolytic potential in patients with idiopatic avascular necrosis and transient osteoporosis of the hip. Am J Hematol 1993; 44: 1473-9.
16. Cushner MA, Friedman RJ. Osteonecrosis of the humeral head. J Am Acad Orhop Surg 1997; 5: 339-46.
17. Goorney BP, Lacey H, Thurairajasingam S, Brown JD. Avascular necrosis of the hip in a man with HIV infection. Genitourin Med 1990; 66: 451-2.
18. Rademaker J, Dobro JS, Solomon G. Osteonecrosis and human immunodeficiency virus infection. J Rheumatol 1997; 24: 601-4.
19. Chevalier X, Larget-Piet B, Hernigou P, Gherardi R. Avascular necrosis of the femoral head in HIV-infected patients (letter). J Bone Joint Surg Br 1993; 75:160.
20. Meyer D, Behrens G, Schmidt RE, Stoll M. Osteonecrosis of the femoral head in patients receiving HIV protease inhibitors (letter). AIDS 1999; 13: 1147-8.
21. Calza L, Manfredi R, Mastroianni A, Chiodo F. Osteonecrosis and highly active antiretroviral therapy during HIV infection: report of a series and literature review. AIDS Patient Care and STDs 2001; 15: 385-9.
22. Keruly JC, Chaisson RE, Moore RD. Increasing incidence of avascular necrosis of the hip in HIV-infected patientes. J Acq Immune Defic Syndr 2001; 28: 101-2.
23. Miller KD, Masur H, Jones EC, et al. High prevalence of osteonecrosis of the femoral head in HIV-infected adults. Ann Intern Med 2002; 137: 17-24.
24. Allison GT, Bostrom MP, Glesby MJ. Osteonecrosis in HIV disease: epidemiology, etiologies, and clinical management. AIDS 2003; 17: 1-9.
25. Ries MD, Barcohana B, Davidson A, Jergesen HE, Paiement GD. Association between human immunodeficiency virus and osteonecrosis of the femoral head. J Arthrop 2002; 17: 135-9.
26. Bonfanti P, Grabbuti A, Carradori S, et al. Osteonecrosis in protease inhibitor-treated patients. Orthopedics 2001; 24: 271-2.
27. Franzen C, Salzberger B, Fatkenheuer G. Avascular necrosis of both femoral heads in an HIV-infected patient receiving protease inhibitors. Eur J Med Res 2001; 6: 83-4.
28. Cruess RL. Steroid-induced avascular necrosis of the head of the humerus: natural history and treatment. J Bone Joint Surg 1976; 58B: 313-7.
29. Clevenbergh P, Corcostegui M, Gerard D, et al. Iatrogenic Cushings syndrome in an HIV-infected patient treated with inhaled corticosteroids (fluticasone propionate) and low dose ritonavir enhanced PI containing regimen. J Infect 2002; 44: 194-5.
30. Glesby MJ, Hoover DH, Vaamonde CM. Osteonecrosis in patients infected with human immunodeficiency virus: a case-control study. J Infect Dis 2001; 519-23.
31. Skiest DJ. Osteonecrosis in human immunodeficiency virus infected-patients may not be related to immune reconstitution. Clin Infect Dis 2001; 33: 268-70.
32. Sorice M, Griggi T, Arcieri P, et al. Protein S and HIV infection. The role of anticardiolipin and anti-protein S antibodies. Thromb Res 1994; 73: 165-75.
33. Korompilias AV, Gilkeson GS, Ortel TL, Seaber AV, Urbaniak JR. Anticardiolipin antibodies and osteonecrosis of the femoral head. Clin Orthop 1997; 345: 174-80.
34. de Larrañaga GF, Petroni A, Deluchi G, Alonso BA, Benetucci JA. Viral load and disease progression as responsible for endothelial activation and/or injury in human immunodeficiency virus-1-infected patients. Blood Coagul Fibrinolysis 2003; 14: 15-8.
35. Saif MW, Bona R, Greenberg B. AIDS and thrombosis: retrospective study of 131 HIV-infected patients. AIDS Patient Care STDs 2001; 15: 311-20.
36. Epstein NN, Tuffanelli DL, Epstein JH. Avascular bone necrosis. A complication of long-term corticosteroid therapy. Arch Dermatol 1965; 92: 178-80.
37. Koller E, Mann M, Malozowski S, Bacsanyi J, Gibert C. Aseptic necrosis in HIV seropositive patients: a possible etiologic role for megestrol acetate. AIDS Patient Care STDs 2000; 14: 405-10.
38. Laroche M, Ludot I, Thiechart M, Viguier G, Dromer C, Mazieres B. Histological appearance of the intra-osseous vessels of the femoral head in aseptic osteonecrosis of the hip, with or without antiphospholipid antibodies. Clin Rheumatol 1997; 16: 367-71.
39. Kaye BR. Rheumatologic manifestations of infection with human immunodeficiency virus (HIV). Ann Intern Med 1989; 111: 158-67.
40. Calza L, Manfredi R, Chiodo F. Arterial Occlusive disease and osteonecrosis in HIV infection: a common etiologic and pathogenetic mechanism? Infect Dis in Clin Practice 2002; 11: 23-4.
41. Chetty R, Batitang S, Nair R. Large artery vasculopathy in HIV-positive patients: another vasculitic enigma. Hum Pathol 2000; 31: 374-9.
42. Hicks JL, Ribbans WJ, Buzzard B, et al. Infected joint replacements in HIV-positive patients with haemophilia. J Bone Joint Surg Br 2001; 83: 1050-4.
43. Lehman CR, Ries MD, Paiement GD, Davidson AB. Infection after total joint arthroplasty in patients with human immunodeficiency virus or intravenous drug use. J Arthroplasty 2001; 16: 330-5.
Recibido: 22-12-2003
Aceptado: 24-03-2004














