Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Medicina (Buenos Aires)
versión impresa ISSN 0025-7680versión On-line ISSN 1669-9106
Medicina (B. Aires) v.64 n.5 Buenos Aires sep./oct. 2004
Los leucocitos polimorfonucleares disminuyen la capacidad inmunoestimuladora de las células dendríticas*
Paulo Maffia, Sandra Zittermann, María Lucila Scimone, Fernanda Buzzoa, Nancy Tateosián, Viviana Lutzky, Carolina Jancic, Marcos Barbosa, Eduardo Chuluyán
Laboratorio de Inmunogenética, Hospital de Clínicas José de San Martín y Departamento de Microbiología, Parasitología e Inmunología, Facultad de Medicina, Universidad de Buenos Aires
Dirección postal: Dr. H. Eduardo Chuluyan, Laboratorio de Inmunogenética, Hospital de Clínicas José de San Martín, Facultad de Medicina, Universidad de Buenos Aires, Avenida Córdoba 2351, 1120 Buenos Aires, Argentina. Fax: (54-11) 5950-8758. E-mail: chulu@interar.com.ar
*Este trabajo mereció el Premio Leonardo Satz durante la Reunión Anual, Sociedad Argentina de Inmunología, Mar del Plata, noviembre 2003.
Resumen
El objetivo de este trabajo fue evaluar la capacidad de los leucocitos polimorfonucleares (PMNL) de modular la fisiología de las células dendríticas (CDs). Utilizando CDs humanas analizamos el efecto de los PMNL sobre las CDs. Las CDs incubadas con los PMNL mostraron una menor capacidad aloestimuladora de linfocitos T (LT) (42±14%, n=8, p<0.05), la cual se correlacionó con una menor concentración de IFNg (CDs: 781±3 pg/ml; CDs-PMNL: 343±178 pg/ml, p<0.05). También se pudo observar el efecto inhibitorio de los PMNL sobre las CDs en un cultivo antígeno específico. Sin embargo, el efecto inhibitorio no se pudo observar sobre CDs maduras. Además, la inhibición de la capacidad aloestimuladora de las CDs tratadas con los PMNL fue revertida utilizando inhibidores de serino proteasas. Estos resultados indican que los PMNL modulan la actividad de las CDs inmaduras a través de la liberación de serino proteasas.
Palabras clave: Células dendríticas; Leucocitos polimorfonucleares; Respuesta inmune adaptativa.
Abstract
Polymorphonuclear leukocytes decrease the immunostimulatory capacity of human dendritic cells. The aim of this work was to evaluate the ability of polymorphonuclear leukocytes (PMNL) to modulate the function of dendritic cells (DCs). Human DCs were used to analyze the effect of PMNL on DCs. The allostimulatory proliferation of T cells induced by DCs incubated with PMNL was lower (42 ± 14%, n:8, p< 0.05) compared with untreated DCs. The decreased proliferation correlated with lower IFNg production (DCs: 781±3 pg/ml; DCs-CS: 343±178 pg/ml, p<0.05). The same effect was observed in an antigen specific assay. However, the effect was not observed when PMNL where incubated with mature DCs. Indeed, the effect of PMNL was partially reverted with serine proteases inhibitors. Overall, these results suggest that PMNL modulates DCs activity by serine proteases.
Key words: Dendritic cells; Polimorphonuclear leukocytes; Adaptative immune response.
Las células dendríticas (CDs) son células presentadoras de antígenos derivadas de la médula ósea con la particular capacidad de inducir respuestas inmunes primarias. Se localizan tanto en tejidos linfáticos como en tejidos no hematopoyéticos. Ante la presencia de un daño tisular, las CDs migran desde el foco inflamatorio hacia el ganglio linfático periférico, donde estimulan a los linfocitos T (LT) antígeno-específicos1. Simultáneamente a la emigración de las CDs se produce el reclutamiento de leucocitos polimorfonucleares (PMNL) desde la sangre hacia el foco inflamatorio, proceso en el que participan factores quimiotácticos y moléculas de adhesión2, 3. Los procesos de migración de las CDs y los PMNL han sido exhaustivamente estudiados en forma independiente. Sin embargo, estudios de cinética de migración4, de las CDs y los PMNL, permiten postular una interacción entre ambos tipos celulares en el foco inflamatorio, la cual aún no ha sido examinada. En el presente trabajo estudiamos la interacción entre los PMNL y las CDs. Para ello, se utilizaron CDs humanas diferenciadas a partir de monocitos de sangre periférica con GM-CSF (800 U/ml) e IL-4 (500 U/ml), tal como fuera descripto previamente5.
En primer lugar examinamos el efecto de la incubación de PMNL con CDs sobre la capacidad de estas últimas de estimular la proliferación de LT alogénicos. Como se observa en la Figura 1(a), las CDs inducen una fuerte respuesta linfoproliferativa, la cual se ve disminuida cuando las CDs han sido coincubadas con los PMNL. Este resultado se correlacionó con los niveles de IFNg hallados en los sobrenadantes de los cultivos alogénicos (781±3 pg/ml vs. 343+178 pg/ml, CDs vs. CDs tratadas, n= 2, p<0.05). En cambio, los niveles de IL-4 estuvieron por debajo del límite de detección de la metodología utilizada (ELISA, sensibilidad > 32 pg/ml).
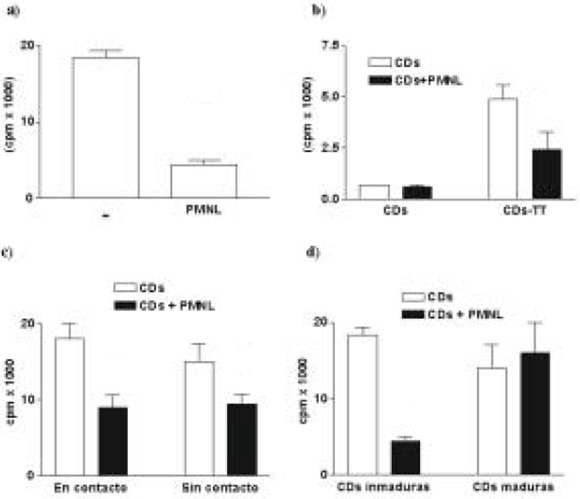
Fig. 1.- Proliferación de linfocitos T (LT) inducida por células dendríticas (CDs). (a) Proliferación de LT alogénicos inducidos por CDs co-incubadas o no con leucocitos polimorfonucleares (PMNL). (b) Proliferación de LT antígeno específicos inducidos por CDs expuestas a toxoide tetánico (TT), co-incubadas o no con PMNL. (c) Proliferación de LT alogénicos inducidos por CDs co-incubadas o no con PMNL y por CDs separadas de los PMNL a través de filtros de policarbonato y que no están presentes en el ensayo de proliferación de LT. (d) Proliferación de LT alogénicos inducidos por CDs maduras co-incubadas o no con PMNL. Se determinó la respuesta proliferativa al 6to día por incorporación de 3H-timidina.
* p<0.05; **p<0.01 por ANOVA (post hoc Dunnet test)
Posteriormente, se evaluó la capacidad de los PMNLs de inhibir la proliferación de linfocitos T específicos para el toxoide tetánico inducida por CDs previamente expuestas al antígeno. Es importante aclarar que la exposición previa al antígeno, permite el procesamiento del mismo por parte de las CDs. Como se observa en la Figura 1(b), los PMNLs inhibieron la capacidad inmuno-proliferadora de linfocitos T específicos inducidos por CDs.
El efecto inhibitorio de los PMNL sobre la capacidad inmunoestimuladora de las DCs podría ser mediado por factores solubles liberados por los granulocitos o por interacciones célula-célula. Para responder a esta pregunta, las CDs y los PMNLs fueron incubados en compartimientos separados por un filtro de policarbonato de 0.4 µm durante 3 hs, de manera de impedir la interacción celular, pero permitir el pasaje de factores solubles. Posteriormente, las CDs fueron recuperadas y examinadas en su capacidad de inducir la proliferación de LT. Como se observa en la Figura 1(c), las CDs separadas de los PMNL por el filtro presentaron menor capacidad inmunoestimuladora, comparadas con sus controles, sugiriendo la participación de factores solubles moduladores en el mecanismo de acción del PMNL.
El efecto inhibitorio de los PMNLs sobre las CDs también fue examinado sobre CDs inducidas a madurar con TNFa (200 U/ml). La coincubación de PMNLs con CDs maduras no modificó la capacidad inmunoestimuladora de las CDs. (Fig. 1d)
Los resultados preliminares indican que el efecto de los PMNLs podría ser mediado por serino proteasas presentes en sus gránulos ya que inhibidores de serino proteasas revierten parcialmente el efecto observado sobre las CDs inmaduras.
Los procesos inflamatorios son desencadenados por estímulos o noxas y se caracterizan por el reclutamiento de poblaciones leucocitarias que forman parte de la repuesta inmune innata. Sin embargo, los mismos estímulos son los encargados de iniciar la respuesta inmune adaptativa a través de la migración de las CDs desde el foco inflamatorio hacia los ganglios linfáticos. El mecanismo descripto en este trabajo sugiere la posibilidad de una interacción entre las primeras células reclutadas (PMNL) en el foco inflamatorio y las células encargadas de poner en marcha la respuesta adaptativa (CDs). Sin embargo, su significado en el proceso inflamatorio merece ser discutido en base a la inhibición observada. Este mecanismo inhibitorio formaría parte de una serie de fenómenos que tienden a limitar el proceso inflamatorio y que son desencadenados por la misma respuesta inflamatoria. Desde el punto de vista del gasto energético, sería poco efectivo iniciar una respuesta inmune adaptativa cuando el proceso inflamatorio es efectivo en erradicar a la noxa. Sin embargo, es importante remarcar que este efecto sólo se observa en CDs inmaduras. Es decir que las células que han sufrido la acción de la noxa y comienzan a madurar, no serían los blancos de acción de los PMNL. Haciendo una analogía con los mecanismos de control en el sistema nervioso podríamos postular que la inhibición observada sobre las CDs inmaduras y no sobre las CDs maduras, actuaría como los circuitos de inhibición lateral6. En el sistema nervioso, estos circuitos aumentan la resolución, incrementando el contraste. En el proceso inflamatorio, es probable que CDs maduras y CDs inmaduras, presentando antígenos propios como extraños, migren al ganglio linfático regional. ¿Cómo es posible discernir entre la información relevante de la irrelevante frente a un flujo continuo de CDs? Probablemente, el mecanismo aquí descripto contribuya a incrementar el contraste, permitiendo focalizar la respuesta inmune hacia la noxa inicial. De esta manera se evitaría el"ruido" ocasionado por el flujo continuo de CDs inmaduras hacia el ganglio linfático regional.
Agradecimientos: A la Dra. Alejandra Cherñiavsky y Dra. Verónica García por su colaboración en las técnicas moleculares.
Bibliografía
1. Banchereau J, Steiman R. Dendritic cells and the control of immunity. Nature 1998; 392: 245-52. [ Links ]
2. Sozzani S, Avellana P, Vecchi A, Mantovani A. The role of chemokines in the regulation of dendritic cell trafficking. J Leuk Biol 1999; 66: 1. [ Links ]
3. Issekutz A, Rowter D, Springer T. Role of ICAM-1 and ICAM-2 and alternate CD11/CD18 ligands in neutrophil transendothelial migration. J Leuk Biol 1999; 65: 117. [ Links ]
4. Gautam N, Hedqvist P, Lindbom L. Kinetics of leukocyte-induced changes in endothelial barrier function. Br J Pharmacol 1998; 125: 1109. [ Links ]
5. Jancic C, Chuluyan H, Morelli A, et al. Interactions of dendritic cells with fibronectin and endothelial cells. Immunology 1998; 95: 283-90. [ Links ]
6. Pinker H, Willis W Jr. (eds). Information processing in the nervous system. New York: Raven Press, 1980. [ Links ]














