Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Medicina (Buenos Aires)
versión impresa ISSN 0025-7680versión On-line ISSN 1669-9106
Medicina (B. Aires) v.64 n.6 Buenos Aires nov./dic. 2004
Células mesenquimales de médula ósea. Diferenciación y potencial reemplazo neuronal
Catalina C. Bianchi de Di Risio, Florencia Callero, Alejandra Hidalgo, Pablo Argibay
Instituto de Ciencias Básicas y Medicina Experimental (ICBME)
Hospital Italiano de Buenos Aires
Dirección postal: Lic. Catalina C Bianchi de Di Risio, ICBME Hospital Italiano, Potosí 4240; 1199 Buenos Aires, Argentina. E-mail: icbme@hitalba.edu.ar
Resumen
Las células troncales embrionarias son totipotentes y se encuentran en pequeño número en el blastocisto donde pueden expandirse en forma indiferenciada durante un corto tiempo y de acuerdo al sitio donde se alojan, ellas adquirirán determinados fenotipos de diferenciación. Las células hemopoyéticas troncales se caracterizan por poseer un gran potencial proliferativo, cuyo modelo de regulación es jerárquico. Ellas retienen, a lo largo de su existencia, un cierto grado de plasticidad, lo cual hace que se puedan diferenciar en distintos tipos de células o de tejidos no hemopoyéticos, de acuerdo al microambiente donde se encuentran o bien a la presencia de ciertos factores estimulantes. En trabajos recientes se han podido aislar, por adherencia al plástico, en cultivo in vitro de médula ósea, células no hemopoyéticas que fueron llamadas mesenquimales por su semejanza con el tejido mesenquimal del embrión. Estas células, in vitro, pueden ser inducidas hacia nuevas líneas celulares, que se diferenciarán en nuevos tejidos. Las expectativas del beneficio terapéutico del transplante de médula ósea como el de células mesenquimales en enfermedades no hemopoyéticas son grandes, porque al utilizar tejidos o células autólogas, se evitan los graves problemas del rechazo inmunológico. En el caso del tejido nervioso la problemática de una fuente adecuada de donantes hace el tema especialmente interesante.
Palabras clave: Células mesenquimales; Médula ósea; Diferenciación neuronal.
Abstract
Mesenchymal stem cells. Differentiation and alternative source of neural tissue. Embryonic stem cells are a population of cells located in the blastocyst, commited to specific differentiation according to spatial and temporal factors such as age and place of final location. Despite the final fate of hematic cells, hemopoietic cells retain a relative degree of plasticity dependent on environmental factors. Mesenchymal cells are a well differentiated population of bone marrow derived non hemopoietic cells with totipotential properties. The medical interest of such totipotentiality rests in the potential of such cells to repair damaged tissues. Particularly neuronal differentiation from progenitors obtained from mesenchymae non hemopoietic cells offers a new possibility in the field of neural transplantation and tissue engineering to repair functional entities in the nervous system.
Key words: Mesenchymal stem cells; Bone marrow; Neuronal differentiation.
Las células troncales o stem cells (SC) se definen como aquellas células que pueden diferenciarse en células progenitoras con más de un fenotipo de diferenciación y que pueden expandirse en forma indiferenciada.
El origen de las células que conforman el sistema hemopoyético no se conoce totalmente; ellas derivan de una población de células no hemopoyéticas, llamadas células troncales embrionarias o embrionary stem cells, que en pequeño número se encuentran en el blastocisto del primer estadio embrionario. Allí, en pocas horas duplican su número y en pocos días se encuentran dispersas en el embrión donde, de acuerdo al sitio donde se alojan, originarán células que se van a diferenciar hacia una determinada línea celular1.
A lo largo de la vida fetal, se forma el tejido hemopoyético, que se inicia en primer lugar en el saco vitelino, pasa luego a las regiones paraaórtica esplecno-pleura y aórtica-gonada-mesonéfrica, al hígado y bazo, para establecerse definitivamente luego del nacimiento en la médula ósea (MO)2, 3.
Células troncales hemopoyéticas o hemopoietic stem cells (HSC)
La MO es un tejido complejo, sinusoidal y bien organizado que se encuentra en la cavidad medular de los huesos largos, del esternón, de los huesos de la cadera y de las vértebras esponjosas y constituye uno de los mayores tejidos del cuerpo, cuya función principal es la de promover la hemopoyesis. Está constituido por varios tipos de células y mantiene en su estado indiferenciado y funcional a las HSC, que son las primeras células del sistema hemopoyético, con una identidad bien definida4.
El modelo de regulación de las HSC es jerárquico. Las más primitivas poseen un gran potencial proliferativo que se pierde a medida que ellas adquieren características específicas de diferenciación. Sin embargo, dentro del tejido hemopoyético se encuentran algunas HSC en estado latente lo cual las proteje en su supervivencia, frente a irradiaciones u otros daños, evitando su agotamiento.
Las HSC son las únicas células capaces de autorrenovarse y diferenciarse hacia todas las líneas hemopoyéticas. Ellas requieren, para su supervivencia y desarrollo, de la interacción con el microambiente medular que está constituido por una población homogénea de células fibroblastoides, cuya función principal es inducir la diferenciación y proliferación de las HSC, a través de la secreción autocrina y paracrina de factores de crecimiento. Ambos, las HSC y el microambiente son de derivación mesodérmica, y si bien poseen un progenitor común, son considerados dos entidades diferentes5.
En base a numerosos estudios se ha propuesto un modelo por el cual la producción de células sanguíneas es mantenida secuencialmente por una o más SC linfohemopoyéticas que proliferan activamente y se diferencian, mientras que hay otras SC llamadas residuales que quedan latentes y con relativa quietud. Este modelo es consistente con los hallazgos obtenidos en transplantes y forma la base de la jerarquización de las SC.
Este sistema ha sido considerado tradicionalmente como un sistema de organización jerárquica. En el ápice se encuentran a las SC multipotentes, capaces algunas de autorrenovarse pero otras de originar células con menor capacidad de diferenciación, para finalizar luego en células maduras.
Desde hace poco se ha comenzado a entender que la sangre no solamente es una distribuidora de HSC, sino que constituye un sistema que provee células con capacidad de desarrollarse dentro de varios tejidos no hemopoyéticos y hasta, en caso de injuria, de reparar tejidos sólidos6.
Plasticidad
El paradigma clásico de que la diferenciación de las SC está restringida a su órgano específico, ha sido sustituido por la evidencia que las SC adultas, inclusive las HSC, a lo largo de su existencia, retienen un cierto grado de plasticidad de desarrollo que les permite dirigirse hacia varias direcciones (tejidos u órganos)7.
Se ha verificado en los últimos tiempos, por hallazgos experimentales, que células de un tejido adulto pueden cambiar hacia un fenotipo diferente del tejido en el cual se encuentran, sugiriendo su capacidad de ser reprogramadas hacia un nuevo destino8.
Vimos anteriormente que las células troncales que se encuentran en MO adultas y que llegan a ese tejido temprano en su desarrollo son multipotentes y retienen su multipotencialidad a lo largo de toda la vida. Junto con las células comprometidas, cuyo potencial de diferenciación es limitado, normalmente están programadas para sustituir células específicas de la MO donde residen, pero en determinadas situaciones se ha observado que pueden transdiferenciarse en células de otro tejido u órgano. Esto implica una reprogramación genética dentro del núcleo, si bien no se entiende completamente el mecanismo molecular responsable de esto9.
Generalmente se acepta que una célula comprometida hacia una determinada línea adquiere un fenotipo definido. Sin embargo, hay numerosos ejemplos donde las células troncales hemopoyéticas presentes en la MO pueden ser, in vitro, inducidas a convertirse, bajo ciertos estímulos, de una línea a otra, es decir, originar linajes celulares que no son normalmente encontrados en esa MO (Fig. 1)10.
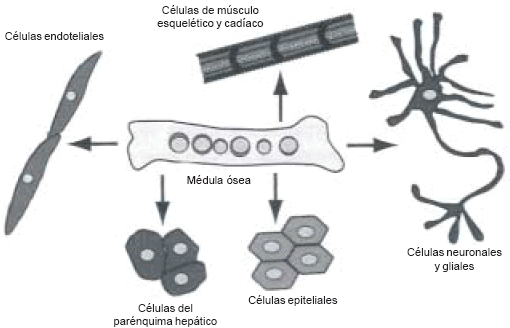
Fig. 1.– Esquema de la conversión a partir de células hematopoyéticas a diferentes líneas celulares.
Vimos ejemplos donde las SC circulantes son desviadas hacia órganos sólidos, para generar tejidos específicos, pero los mecanismos implicados en estos fenómenos no son conocidos totalmente. La injuria de un tejido que causa cambios en el microambiente, puede ser una de las causas que hace que las células troncales intrínsecas a ese tejido, sean inducidas a reemplazar a las células necróticas endógenas. Este mecanismo podría agotarse, por lo tanto las SC exógenas circulantes podrían ser las encargadas de reparar el tejido dañado.
En la Fig. 2 podemos observar un ejemplo de plasticidad presentado por las HSC dentro del sistema hemopoyético. Se ve cómo los progenitores linfoides pueden originar células granulocíticas y cómo los progenitores granulocíticos pueden originar, además, a granulocitos y macrófagos, eritrocitos y megacariocitos y los progenitores eritroides se diferencian además en granulocitos, indicando como estas células, en presencia de estimulantes adecuados in vitro, pueden transdiferenciarse de una línea a otra11.
Las conclusiones formuladas en base a los resultados de los estudios recientes sobre la plasticidad de las SC adultas, contradicen lo supuesto, aceptado anteriormente por el cual su proceso de diferenciación está restringido a una determinada línea de maduración12.

Fig. 2.– Esquema de plasticidad a partir de células troncales hematopoyéticas. Las líneas gruesas indican la diferenciación normal y las finas la diferenciación inducida. CLP: progenitor linfoide común. CMP: progenitor multipotencial común. T y B: linfocitos. GMP: progenitor granulocítico–macrofágico. MEP: progenitor megacariocítico-eritroide. Mac: macrofago. G: granulocito. Eos: eosinófilo. Eb: eritroblasto. E: eritrocito. Meg: megacariocito.
Células troncales mesenquimales o Mesenchyme Stem Cells (MSC)
Se han observado, dentro de la MO, unas células que no son del linaje hemopoyético y que son capaces de diferenciarse en células troncales definidas mesenquimales (MSC). Se aíslan in vitro por su adherencia al plástico y se pueden expandir indefinidamente en cultivo reteniendo su multipotencialidad13.
Se pueden cultivar durante más de 120 duplicaciones. El fenotipo de ellas es negativo para CD34, 44, 45, c-kit y para el complejo mayor de histocompatibilidad clase 1 y 2. Las murinas tienen similar fenotipo que las humanas, pero requieren la presencia del factor inhibidor leucémico (LIF) para mantener su estado indiferenciado in vitro14.
A la capa de células mesenquimales se la llama también estroma medular que in vitro consta de una población homogénea de células adherentes al plástico con una uniformidad morfológica del 98%. En cultivo tienen la capacidad de expandirse duplicando varias veces su número preservando su pluripotencialidad e indiferenciación y transformarse espontáneamente en células no adherentes CD34+. A través del contacto célula a célula y de varios factores de crecimiento, ellas pueden mantener su viabilidad y su capacidad de proliferar indefinidamente15.
Una pregunta interesante es: ¿Son equivalentes a células embrionarias? A lo largo de su desarrollo podría haber sucedido que las células embrionarias persistan durante la vida adulta y solamente se observen in vitro, o bien que el período prolongado en el cual las células permanecen en cultivo induzca a ciertas células a regresar a su estado más primitivo, con la particularidad de ser reprogramadas a adquirir propiedades de SC embrionarias16.
Actualmente se considera a las MSC un potencial terapéutico, dado que al ser utilizadas in vivo han demostrado la capacidad de reparar tejidos dañados.
En la Fig. 3 «Mesengénesis» se aprecia que estas células mesenquimales, desarrolladas a partir de MO, son capaces de diferenciarse en cultivo en múltiples líneas mesenquimales, induciendo asi su diferenciación17.

Fig. 3.– Las células mesenquimáticas (MSC) son capaces de diferenciarse en múltiples líneas celulares mesenquimales.
Diferenciación neuronal
Dos conceptos pilares sobre la biología del desarrollo fueron primordiales en todos los tiempos. El antiguo dogma de que el cerebro adulto no se regenera ha sido sustituido por la evidencia de que nacen y se diferencian nuevas neuronas, en la zona subgranular del hipocampo y subventricular lateral, a lo largo de toda la vida. El otro concepto básico era que células que habían sido comprometidas hacia un cierto tipo de diferenciación, en virtud de residir en un órgano determinado, no podían cambiar su destino.
Recientes investigaciones hacen dudar de estos conceptos, observándose, como dijimos anteriormente, que ciertas células de mamíferos poseen un alto grado de plasticidad para diferenciarse en otros diferentes tipos celulares.
En los últimos tiempos, muchos autores han publicado trabajos donde, utilizando células extraídas de MO humana y murina, pudieron inducir una diferenciación neuronal18.
Entre otros autores, Sánchez-Ramos (2002) describe que células de MO o de sangre de cordón umbilical, inducidas in vitro a originar células mesenquimales, podrían ser diferenciadas en glias y neuronas. Además, anticipando el potencial terapéutico de estas observaciones, el autor demuestra en un modelo murino la corrección de defectos neurológicos inducidos previamente19.
Mezey (2000) observa, al trasplantar MO en ratones, que al cerebro migran células que se diferencian y expresan marcadores neuronales. Con estos estudios demuestra además que la MO es una fuente accesible de células neuronales con la ventaja además que al utilizarse MO autóloga, se evitan los problemas inmunológicos derivados de la incompatibilidad correspondiente20.
Azizi investigó el efecto de la inyección directa de células mesenquimales humanas, dentro del cuerpo calloso del cerebro de rata. Entre los 5 y 72 días, hace estudios histológicos del cerebro por fluorescencia y encuentra un 20% de células humanas. Esto podría indicar o que una fracción elevada de MSC ha sobrevivido, o bien que un pequeño grupo de MSC ha adquirido a contacto con el microambiente del cerebro un elevado poder proliferativo21.
Black y Woodbury obtienen por proliferación in vitro, células estromales murinas y humanas (MSC) induciéndolas luego hacia el fenotipo neuronal, utilizando un simple protocolo de diferenciación22, 23.
Brazelton muestra que células de MO murinas inyectadas intravascularmente en un ratón irradiado, entran al cerebro y asumen características de células del sistema nervioso central, que expresan proteínas neuronales24.
Dado que en trabajos previos se había demostrado que células de MO transplantadas podían entrar en el cerebro y diferenciarse en neuronas, Mezey y col. (2002) deciden examinar post mortem, cerebros de pacientes de sexo femenino que habían recibido transplantes de dadores masculinos. Observan que si bien algunas células de genotipo masculino no son neuronas, otras lo son ciertamente, especialmente aquellas que se alojan en el hipocampo y corteza cerebral. Concluyen entonces que, como en ratones, también en humanos es posible convertir células medulares en neuronales25.
Weissmann describe que en pacientes en los que habían sido transplantadas células de MO humana, se originaron neuronas de Purkinje en el cerebro, cruzando la barrera sangre-cerebro. Pudo comprobar esto debido a que fue posible analizar por estudios citogenéticos cromosomas sexuales de células de cerebro obtenidas de pacientes femeninas, dado que por su enfermedad hematológica las pacientes habían recibido transplantes de MO de dadores masculinos. Los resultados confirmaron una vez más que células de MO pueden convertirse, en el cerebro de adultos, en células nerviosas26.
En nuestro laboratorio, a partir de MO humana y con un protocolo propio de diferenciación, hemos obtenido células con marcación citoplasmática positiva para GFAP (Fig. 4), así como también marcación positiva para neurofilamentos, FITC. (Datos preliminares) (Fig. 5).

Fig. 4.– Inmunohistoquímica de fluorescencia de cultivo de células mesenquimáticas sometidas a diferenciación neuronal: a) Se observan células con marcación citoplasmática positiva para GFAP (FITC). b) Se observan células bipolares con marcación positiva para GFAP en citoplasma y en sus prolongaciones (FITC). c) Control negativo. Se utilizó HOECHST para coloración nuclear. (Aumento: 40X) (COOLPIX4500 (NIKON)).
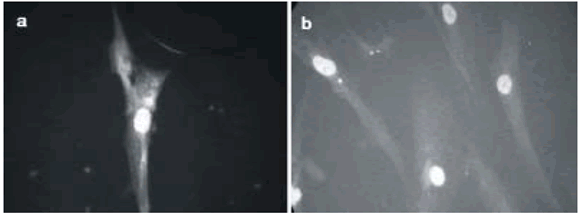
Fig. 5.– Inmunohistoquímica de fluorescencia de cultivo de células mesenquimáticas sometidas a diferenciación neuronal: a) Se observa una célula con marcación citoplasmática positiva para neurofilamentos (FITC). b) Control negativo. Se utilizó HOECHST para contracoloración nuclear (aumento 40X) (COOLPIX4500 – NIKON)).
Algunas consideraciones finales
La antigua creencia de que la diferenciación de SC hacia una determinada línea está limitada al órgano donde ellas residen, ha sido sustituida por las evidencias de que las SC están dotadas de gran plasticidad lo cual les permiten diferenciarse en tejidos u órganos diferentes.
Sin embargo podemos preguntarnos: ¿Todos estos hechos son debidos a la plasticidad de las células troncales o bien ellas se encuentran dentro de estos tejidos a través de la circulación y actúan como contaminantes? Hemos visto sin embargo que el tejido muscular del esqueleto, además de contener progenitores hemopoyéticos tiene también células neuronales, las mismas que se encuentran dentro de la sangre.
Poder trasplantar células mesenquimales autólogas, induciendo su proliferación in vitro, confiere grandes ventajas terapéuticas, porque se evitan los problemas del rechazo inmunológico y además la MO de la cual se extraen estas células, es un tejido accesible y sin riesgos y puede convertirse en un proveedor ilimitado de células para el tratamiento de defectos o injurias de tejidos autólogos o heterólogos. El estroma mesenquimal además provee una población de células renovables, que crecen rápidamente en cultivo y que es posible diferenciar en neuronas u otras células, utilizando un protocolo simple.
Enormes son las expectativas del beneficio terapéutico de todo lo que hemos descripto a partir de la MO, tanto en la utilización de células mesenquimales extraidas de ella y expandidas in vitro, como para las células troncales obtenidas directamente de ella.
El caso del reemplazo neuronal es particularmente interesante, ya que las fuentes alternativas de donantes presentan obstáculos diversos, desde los problemas éticos del uso de embriones, la inutilidad del donante cadavérico convencional (por muerte cerebral) o los problemas inmunológicos del xenotrasplante.
Bibliografía
1. Quesenberry PJ, Colvin GA, Lambert JF. The chiaroscuro stem cell: a unified stem cell theory. Blood 2002; 100: 4266-71.
2. Bianchi de Di Risio CC, Argibay P. Características de las células primordiales germinales murinas y su relación con la hemopoyesis. Medicina 2001; 61: 491-4.
3. Dzierzak E, Medviensky A, de Bruijn M. Qualitative and quantitative aspects of haematopoietic cell development in the mammalian embryo. Immunology Today 1998; 19: 228-35.
4. Huang S, Terstappen L. Formation of haematopoietic microenvironment and haematopoietic stem cells from single human bone marrow stem cells. Nature 1994; 368: 664.
5. Singer JW, Keating A, Cuttner J. Evidence for a stem cell common in hematopoietic and its in vitro environment: studies of patients with clonal hematopoietic neoplasia. Leuk Res 1984; 8: 535-45.
6. Chen J, Li Y, Chopp M. Intracerebral transplantation of bone marrow with BDNF after MCAo in rat. Neuropharmacology 2000; 39: 711-6.
7. Kusminsky GD, Sánchez Avalos JC. Células stem. Plasticidad y el pacto de la maldita clonación. Medicina (Buenos Aires) 2002; 62: 371-4
8. Thomas G. Differentiation plasticity of hematopoietic cells. Blood 2002; 99: 3089-4101.
9. Chen J, Li Y, Wang Y, et al. Therapeutic benefit of intra-venous administration of bone marrow stromal cells after cerebral ischemia in rat. Stroke 2001a; 32: 1005-11.
10. Korbling M, Estrov Z. Adult stem cells for tissue repair- A new therapeutic concept? N Engl J Med 2003; 349: 570-82.
11. Krause DS, Theise ND, Collector MI. Multiorgan, multilineage engraftment by a single bone marrow derived stem cell. Cell 2001; 105: 369-77.
12. Huss R, Lange C, Weissinger EM, Kolb HJ, Thalmeier K. Evidence of peripheral blood-derived, plastic-adherent CD34 -/low hematopoietic stem cell clones with mesenchymal stem cell characteristics. Stem Cells 2000; 18: 252-60.
13. Pittenger MF, Mackay AM. Mesenchymal stem cells of human adult bone marrow. Stem Cell Biology 2001; Cold Spring Harbor Laboratory Press; 349-73.
14. Jiang T, Jahagirdar BN, Reinhardt RL, et al. Pluripotency of mesenchymal stem cells derived from adult marrow. Nature 2002; 418: 41-9.
15. Prockop DJ. Marrow stromal cells as stem cells for nonhematopoietic tissues. Science 1997; 276: 71-4.
16. Reyes M, Lund T, Lenvik T, Aguiar D, Koodie L, Verfaillie CM. Purification and ex vivo expansion of postnatal human marrow mesodermal progenitor cells. Blood 2001; 98: 2615-25.
17. Orkin SH, Morrison SJ. Stem-cell competition. Nature 2002; 418: 25-7.
18. Terada N, Hamazaki T, Oka M, Hoki M, Mastalerz DM, Nakano Y. Bone marrow cells adopt the phenotype of other cells by spontaneous cell fusion. Nature 2002; 416: 542-5.
19. Sanchez Ramos JR. Neural cells derived from adult bone marrow and umbilical cord blood. J Neuros Res 2002; 69: 880-93.
20. Mezey E, Chandross KJ, Harta G, Maki RA, McKercher SR. Turning blood into brain: cells bearing neuronal antigens generated in vivo from bone marrow. Science 2000; 290: 1779-81.
21. Azizi SA, Stokes D, Augelli BJ, DiGirolamo C, Prockop DJ. Engraftment and migration of human bone marrow stromal cells implanted in the brains of albino rats-Similarities to astrocyte grafts. Proc Natl Acad Sci 1998; 95: 3908-13.
22. Black I, Woodbury D. Adult rat and human bone marrow stromal stem cells differentiate into neurons. Blood Cells 2001; 27: 632-6.
23. Woodbury D, Schwarz EJ, Prockop DJ, Black IB. Adult rat and human marrow stromal cells differentiate into neurons. Jour Neur Res 2000; 61: 364-70.
24. Brazelton TR, Rossi FMV, Keshet GJ, Blau HM. From marrow to brain: expression of neuronal phenotypes in adult mice. Science 2000; 290: 1775-9.
25. Mezey E, Key S, Vogelsang G, Szalayova I, Lange GD, Crain B. Transplanted bone marrow generates new neurons in human brains. Ed. Thomas Hokfelt Stockolm Sweden 2003:100: 1364-9.
26. Weimann JM, Charlton CA, Brazelton TR, Hackman RC, Blau HM. Contribution of transplanted bone marrow cells to Purkinje neurons in human adult brains. PNAS 2003; 100: 2088-93. [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ]
Recibido: 21-01-2004
Aceptado: 4-06-2004














