Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Medicina (Buenos Aires)
versión impresa ISSN 0025-7680versión On-line ISSN 1669-9106
Medicina (B. Aires) v.65 n.2 Buenos Aires mar./abr. 2005
Cambio del isotipo en la respuesta a antígenos T independientes por co-inoculación con antígenos T dependientes
Alejandro Ferrari, Federico S. Weill, Mariela L. Paz, Juliana Leoni
Instituto de Estudios de la Inmunidad Humoral, Facultad de Farmacia y Bioquímica, Universidad de Buenos Aires
Dirección postal: Bioq. Alejandro Ferrari, Instituto de Estudios de la Inmunidad Humoral, Cátedra de Inmunología, Facultad de Farmacia y Bioquímica, Universidad de Buenos Aires. Junín 956, 1113 Buenos Aires, Argentina. E-mail: aferrari@ffyb.uba.ar
Resumen
Un paradigma clásico de la inmunología plantea que para que ocurra cambio de isotipo en los anticuerpos es condición sine qua non la presentación del antígeno a un linfocito T colaborador por parte de una célula presentadora de antígenos. En el presente trabajo se diseñó un modelo animal, ratones BALB/c, de respuesta inmune frente a dos antígenos típicos. Se utilizó dextrán como antígeno T independiente (AgTI) y seroalbúmina bovina (SAB) como antígeno T dependiente (AgTD), y se estudió la respuesta, analizando los isotipos de los anticuerpos específicos producidos. Los resultados obtenidos muestran que la respuesta a dextrán en presencia de SAB ocurre con cambio de isotipo (switch), esencialmente de IgM a IgG1. Estos experimentos sugieren que la SAB genera un entorno bioquímico inductor de cambio de isotipo tanto en su propia vía de procesamiento como en la del dextrán. Los resultados señalan que la asociación exclusiva de los AgTDs con las respuestas en las que ocurre cambio de isotipo es incorrecta. Considerando el modelo propuesto resulta poco probable encontrar in vivo y en forma espontánea casos en los que los AgTIs ingresen al organismo aislados; en cambio, es mucho más probable que el ingreso ocurra conjuntamente con AgTDs, y en consecuencia ocurra cambio de isotipo.
Palabras clave: cambio de isotipo, respuesta inmune, antígenos T independientes, dextrán, seroalbúmina bovina
Abstract
Isotype switch in the response against T independent antigens by co-inoculation with T dependent antigens. A classical paradigm in immunology establishes that for the isotype switch to take place in antibodies, it is a sine qua non condition that the antigen is presented by an antigen presenting cell to a helper T cell. In the present study an animal model of the immune response against two typical antigens was designed in BALB/c mice. Dextran was chosen as a T independent antigen (TIAg), and bovine seroalbumin (BSA) as a T dependant antigen (TDAg), and the response was studied, analyzing the isotypes of the specific antibodies produced. The results show that the response against dextran, in the presence of BSA, takes place with isotype switch, essentially from IgM to IgG1. These experiments suggest that BSA generates a switch inductor biochemical environment in its own processing pathway as well as in the dextran's. These results indicate that the exclusive association of TDAgs with isotype switch responses is inaccurate. Considering the proposed model, it seems unlikely the finding of a spontaneous in vivo case in which TIAgs enter the organism isolated; instead, it is much more probable that they would enter together with TDAgs, and in consequence the isotype switch would take place.
Key words: isotype switch, immune response, isotype, T independent antigens, dextran, bovine seroalbumin
Cuando un antígeno (Ag) extraño ingresa al organismo dispara una gran variedad de mecanismos con el fin de eliminarlo. Se activan en forma simultánea y coordinada mecanismos inmunes innatos y adaptativos; dentro de los innatos se cuentan la activación de macrófagos, células NK, neutrófilos, basófilos, eosinófilos, mastocitos y las enzimas del complemento; dentro de los mecanismos adaptativos, la producción de anticuerpos (ACs) por parte de linfocitos B (LB) diferenciados (plasmocitos) y la activación, proliferación y diferenciación de linfocitos T (LT), tanto citotóxicos (LT CD8+) como colaboradores (LT CD4+). La participación de estos mecanismos en la eliminación del antígeno dependerá, entre otros factores, de las características del Ag1,2.
En la inmunidad adaptativa se clasifican los Ags en aquellos que inducen una respuesta preferentemente celular y aquellos que desencadenan una respuesta humoral. Los Ags inductores de una respuesta celular son los localizados dentro de las células del huésped y reconocidos como extraños; esto ocurre en infecciones causadas por virus, bacterias intracelulares y en tumores.
Los Ags que inducen una respuesta humoral se clasifican a su vez en dependientes o independientes de LT (AgTDs y AgTIs). Para responder a los primeros, los LB productores de ACs específicos necesitan, indefectiblemente, de la participación de LT CD4+ para activarse y secretar, en primera instancia ACs de isotipo M (IgM) y luego efectuar un cambio en el isotipo producido (switch). El mismo consiste en un cambio en la región constante de la cadena pesada de las inmunoglobulinas sintetizadas, sin alterar la especificidad del AC. En el caso de los AgTIs, los LB son capaces de proliferar, diferenciarse y producir IgM sin la participación de los LT CD4+. Generalmente se asocian los AgTDs con proteínas de peso mayor a 6000 Dalton, y los AgTIs con polímeros repetitivos, como por ejemplo los polisacáridos1.
Para que los LB produzcan ACs frente a AgTDs y tenga lugar el cambio de isotipo, son necesarios dos estímulos: una señal que proviene de la interacción entre el Ag y los receptores de superficie del LB, y una señal citocínica, producida fundamentalmente por LT CD4+ una vez que éstos han sido activados por células presentadoras de antígenos (CPA).
Con los AgTIs, solamente es necesaria la primera señal, que proviene de la interacción del Ag con los receptores de superficie de LB. Al parecer dicha señal difiere de la que ocurre con los AgTDs en el número de receptores que interactúan con el Ag. Para los AgTIs el número sería mucho mayor, y el estímulo producido por dicha interacción suficiente para disparar una respuesta humoral.
La clasificación de los Ags en AgTIs y AgTDs parece vincular exclusivamente a los AgTIs con respuestas que carecen de cambio de isotipo, y a los AgTDs con respuestas que sí lo poseen. Al momento de la realización de este trabajo, no se encontraron referencias de estudios sobre sistemas de AgTDs y AgTIs no unidos en forma covalente, analizando la posible prescindibilidad de las interacciones directas entre células y antígenos para que ocurra el cambio de isotipo, y estudiando cómo se comporta el sistema inmune frente a mezclas de Ags solubles3-8. Por el contrario, sí existen referencias sobre sistemas de AgTIs y AgTDs covalentemente unidos en los que se evidencia respuesta con cambio de isotipo frente a ambos Ags9, 10.
En el presente trabajo se estudió en un modelo animal la respuesta inmune frente a dos Ags típicos. Se utilizó dextrán como AgTI y seroalbúmina bovina (SAB) como AgTD. Si bien el dextrán pertenece a un grupo de AgTIs a los cuales tradicionalmente se les ha adjudicado cierta capacidad de inducir cambio de isotipo y dependencia de una subpoblación minoritaria de LTs que madura fuera del timo11, evidencias recientes han demostrado que al menos el cambio de isotipo no ocurre para este Ag9.
Se estudió la respuesta a ambas sustancias, analizando los isotipos de ACs producidos.
Materiales y métodos
Animales. Se utilizaron 12 ratones BALB/c machos y 12 ratones BALB/c hembras de entre 5 y 8 semanas de edad.
Planes de Inmunización. La seroalbúmina bovina (Sigma) y el dextrán T500 (Amersham Biosciences) fueron disueltos en buffer PBS en una concentración de 1 mg/ml, tanto preparados individualmente, como en mezcla. Los Ags fueron conservados a -20 °C hasta el momento de su uso, tanto para inoculaciones como para inmunoensayos.
Los animales fueron inoculados intraperitonealmente los días 1 (preinmune), 7, 14 y 28, inoculando 100 µg de cada Ag, diluidos al medio con adyuvante de Freund completo o incompleto (AFC o AFI, respectivamente) según el lote de animales, en un volumen final de 200 µl. Los animales fueron divididos en seis grupos distintos, cada uno compuesto por dos machos y dos hembras de edad similar, según la Tabla 1.
Tabla 1.- Tratamiento de los ratones BALB/c y planes de inmunización

Obtención de sueros. En los días 1, 7, 14 y 28 se tomaron muestras de sangre por punción del seno venoso retro-orbital. Las muestras se dejaron coagular 1 hora a 37 °C, los sueros fueron separados por centrifugación y conservados a – 20 °C hasta el momento de su uso.
Inmunoensayos. Los ensayos de ELISA12 se realizaron en placas Nunc-MaxiSorp de 96 pocillos, sensibilizando con 10 µg de Ag durante 1 hora a 37 °C y bloqueando con leche en polvo descremada al 3% en PBS, durante 18 horas a 4 °C. Los sueros obtenidos según el punto anterior fueron diluidos 1/250 en PBS e incubados durante 1 hora a 37 °C. Para la detección de los distintos isotipos se utilizaron antisueros comerciales, producidos en conejo: anti-IgM (BIORAD), anti-IgG1 (DAKO), anti-IgG2a (DAKO), anti-IgG2b (DAKO) y anti-IgG3 (DAKO). Todos ellos fueron utilizados en una dilución única de 1/1.000, e incubados durante 1 hora a 37 °C. En todos los casos se incubó luego con inmunoglobulinas de cabra anti-inmunoglobulinas de conejo, marcadas con peroxidasa, en una dilución 1/5.000. El revelado fue realizado con una solución de Ortofenilendiamina y H2O2 como cromógeno y sustrato respectivamente, y la lectura de densidad óptica (DO) se realizó a 490 nm en un lector de ELISA Metertech 960. Todos los lavados fueron llevados a cabo con PBS - Tween 0.05%.
Análisis de datos. Los análisis de datos y procedimientos estadísticos fueron llevados a cabo con el programa Graph Pad Prism 2.01.
Resultados
Los ensayos de detección de ACs fueron de carácter semicuantitativo y realizados en una dilución única de 1/250, elegida en base a ensayos de puesta a punto llevados a cabo previamente (resultados no mostrados). Los resultados están expresados en unidades arbitrarias (UA), definidas como una DO de 0.034 a 490 nm, correspondiente a un promedio de todos los sueros preinmunes del experimento.
1. Anticuerpos anti-dextrán T500.
IgM - (Fig.1 A). Los anticuerpos de isotipo M se comportaron de igual manera en todos los tratamientos, aumentando el valor de UAs notablemente del día 7 al 14 y luego manteniéndose dicho valor aproximadamente constante hasta al menos el día 28.
IgG1 - (Fig. 1 B). No se obtuvo respuesta de anticuerpos de isotipo IgG1 en los casos en que se inoculó con dextrán como único antígeno. Por el contrario, cuando el dextrán se inoculó conjuntamente con la SAB se obtuvo un aumento en UAs que se evidenció a partir del día 14, y que se hizo aún más significativo el día 28.
IgG2a, IgG2b e IgG3.No se observó un incremento estadísticamente significativo, y no hubo diferencia entre los distintos tratamientos.



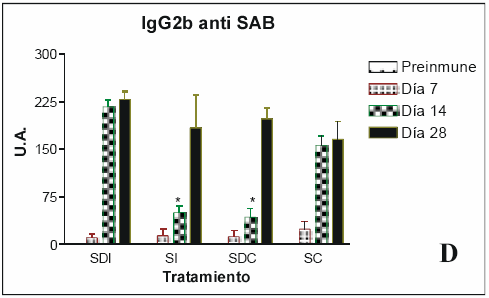

Fig. 1.- Determinación de anticuerpos anti SAB (A) Determinación de IgM anti SAB; (B) IgG1 anti SAB; (C) IgG2a anti SAB; (D) IgG2b anti SAB; (E) IgG3 anti SAB. En todos los casos las unidades son unidades arbitrarias (U.A.). Las barras de error representan el error estándar de la media; *: resultados estadísticamente significativos.
2. Anticuerpos anti-SAB.
IgM – (Fig. 2 A). Se observó un valor de UAs máximo para la IgM al día 7, que luego disminuye a lo largo del tiempo. El perfil de disminución parece estar alterado para el tratamiento con SAB, dextrán y AC, pero dicha alteración no lo diferencia en forma significativa de los otros tratamientos.
IgG1 – (Fig 2. B). Al día 7 se observó un aumento en las UAs respecto a los sueros preinmunes, que recién al día 14 resultó significativo. Dicho valor se mantiene al menos hasta el día 28. No se encontraron diferencias significativas entre tratamientos, salvo en el caso del día 14 del tratamiento con SAB, dextrán y AC, que presentó un valor de UAs considerablemente menor.
IgG2a e IgG2b - (Fig. 2 C y D). En el caso de la IgG2a, se aprecia un aumento progresivo del valor de UAs a partir del día 7, siendo significativo y máximo recién a partir del día 14, y manteniéndose hasta el final del experimento; en el caso del tratamiento con SAB y AC, el valor máximo se alcanza ya en el día 7, y se mantiene así hasta el final del experimento. Para la IgG2b, dicho incremento es más marcado al día 14, y en los tratamientos con SAB y AI, y con SAB, dextrán y AC, el valor de UAs del día 14 se halla significativamente reducido.
IgG3 – (Fig. 2 E). Se observó un aumento de las UAs el día 7 respecto al suero preinmune, que se hizo máximo el día 14. Los valores del día 28 se mantienen estadísticamente iguales a los del día 14, aunque se evidencia cierta tendencia hacia valores menores. No se observaron diferencias significativas entre tratamientos, salvo en los animales inmunizados con SAB, dextrán y AC, en los que se ve una diferencia significativa entre el valor de UAs del día 28 respecto del día 14 (hay un aumento). En consecuencia, mientras que en los otros tres tratamientos se alcanza un valor máximo y estable al día 14, en este tratamiento el valor aumenta progresivamente desde el día 7 al 28, alcanzando valores máximos que no difieren estadís-ticamente de los valores máximos alcanzados en los demás tratamientos.


Fig. 2.- Determinación de anticuerpos anti dextrán (A) Determinación de IgM anti dextrán; (B) IgG1 anti dextrán. En todos los casos las unidades son unidades arbitrarias (U.A.). Las barras de error representan el error estándar de la media; *: señalan los resultados estadísticamente significativos.
Discusión
Un paradigma clásico de la inmunología plantea que para que ocurra cambio de isotipo en los anticuerpos es condición sine qua non la presentación del antígeno a un LT CD4+ por parte de una CPA. Esto induce a asociar las respuestas en las que ocurre el cambio, con aquellos antígenos pasibles de ser presentados en moléculas del Complejo Mayor de Histocompatibilidad de Clase II, como son los péptidos y las proteínas. Sin embargo, esta clasificación deja sin explicación a las respuestas con cambio de isotipo que ocurren frente a algunos AgTIs, como ciertos polisacáridos.
La aparición de IgG1 con especificidad hacia dextrán que se observa en los sueros de los ratones coinmunizados con dextrán y SAB, teniendo en cuenta que no se ha descripto que el dextrán pueda ser presentado por CPA a LT CD4+, permite suponer que el procesamiento de la SAB, que es un AgTD típico, modula la respuesta contra el dextrán de manera que ocurre cambio de isotipo de los anticuerpos en la respuesta hacia él.
Los resultados obtenidos muestran que la respuesta a dextrán en presencia de SAB, ocurre con cambio de isotipo, esencialmente de IgM a IgG1. Por el contrario, la presencia de dextrán no influye sobre la respuesta frente a SAB. Estos experimentos parecen mostrar que la SAB genera un entorno bioquímico inductor de cambio de isotipo, tanto en su propia vía de procesamiento como en la del dextrán; es decir, el entorno citocínico generado por el procesamiento de SAB estimula indistintamente a plasmocitos con especificidad hacia SAB como a los que la tienen hacia dextrán.
Los LT CD4+ se dividen en varias subpoblaciones, denominadas Th1, Th2 y Th31-2-13. Se sabe además que el perfil de citocinas que induce la activación de los LT CD4+, condiciona la subpoblación generada. A su vez, cada subpoblación está asociada a la producción de un perfil de ACs característico por parte de los LB.
Teniendo en cuenta este modelo, es razonable suponer que si la naturaleza de un AgTD puede influir en los isotipos de ACs producidos como respuesta frente a él, también puede influir en los isotipos de ACs producidos contra el AgTI coinoculado.
Los ACs producidos como respuesta a dextrán inoculado solo, son únicamente de isotipo M. En cambio, cuando el dextrán es coinoculado con SAB, la respuesta exhibe un perfil de ACs típicamente Th2. Dicho perfil consiste en la generación inicial de una respuesta por ACs de isotipo IgM, seguida de cambio a IgG1, donde los isotipos IgG2a, IgG2b e IgG3 permanecen en valores de UAs considerablemente bajos, o nulos. La respuesta contra SAB inoculada sola también ocurre con predominio de IgG1. En este caso es interesante hacer notar que la respuesta con ACs de tipo IgG contra dextrán se produce más lentamente que la respuesta equivalente contra SAB. Estos resultados no permiten descartar que a tiempos posteriores al día 28, la respuesta frente a dextrán tienda a igualar los resultados observados contra la SAB.
Por otro lado, se observa que el perfil de IgM a lo largo del experimento difiere en la respuesta contra dextrán, respecto de la respuesta contra SAB. En particular, mientras que la respuesta frente a SAB es máxima al día 7 y decrece con el tiempo, la respuesta contra dextrán muestra un incremento progresivo a lo largo del experimento.
Accesoriamente al estudio de la influencia del procesamiento de AgTDs en la respuesta a AgTIs, se buscó estudiar, también, la influencia del uso de AFI y AFC en la respuesta inmune humoral. La bibliografía se refiere al AI como inductor de una respuesta de carácter Th214,15. Sin embargo muchos investigadores proponen al AFC como la mejor opción14. En el presente trabajo no se vieron diferencias claras en el uso de uno u otro adyuvante.
Otro fenómeno que se evidencia en los gráficos del presente trabajo, es la gran variación interindividual en las respuestas frente a los diferentes antígenos o combinaciones antigénicas utilizadas; variabilidad sorprendente, teniendo en cuenta que se utilizaron ratones endocriados, de una cepa singeneica. A nuestro parecer, este fenómeno, si bien en algunos casos dificultaría el análisis o la visualización de los resultados, es muestra de la complejidad del sistema inmune, sujeto a un gran número de variables, y de que la predicción de su comportamiento se halla siempre sujeta a diversos factores.
Los resultados obtenidos refuerzan el concepto de que el sistema inmune funciona como un todo y de manera coordinada. A su vez, muestran que la asociación exclusiva de los AgTDs con las respuestas en las que ocurre cambio de isotipo es incorrecta. Considerando el modelo propuesto resulta poco probable encontrar in vivo y en forma espontánea, casos en los que los AgTIs ingresen al organismo en forma aislada. En cambio, es mucho más probable que el ingreso ocurra siempre conjuntamente con AgTDs, y en consecuencia ocurra cambio de isotipo.
Agradecimientos: Se agradece la participación de la Bioquímica Natalia Saccodossi, el Bioquímico Daniel González Maglio y el Veterinario Emilio De Simone, por su revisión crítica durante la elaboración del presente trabajo. Asimismo, se agradece la colaboración de las técnicas del bioterio del Instituto de Estudios de la Inmunidad Humoral.
Bibliografía
1. Margni RA. Inmunología e Inmunoquímica; Fundamentos. Buenos Aires: Panamericana, 1996; p. 22. [ Links ]
2. Abbas AK, Lichtman AH, Pober JS. Inmunología Celular y Molecular. Madrid: Mc Graw Hill - Interamericana, 1999; p 379. [ Links ]
3. Snapper CM, McIntyre TM, Mandler R, et al. Induction of IgG3 secretion by interferon g: A model for T cell-indepen-dent class switching in response to T cell-independent Type 2 antigens. J Exp Med 1992; 175: 1367-71. [ Links ]
4. Vos Q, Snapper CM, Mond J. Heterogeneity in the ability of cytotoxic murine NK cell clones to enhance Ig secretion in vitro. Int Immunol 1999; 11: 159-68. [ Links ]
5. Mongini PKA, Stein KE, Paul WE. T cell regulation of IgG subclass antibody production in response to T-independent antigens. J Exp Med 1981; 153: 1-12. [ Links ]
6. Snapper CM, Yamaguchi H, Moorman MA, et al. An in vitro model for T cell-independent induction of humoral immunity. J Immunol 1994; 152: 4884-92. [ Links ]
7. Ediriwickrema CP, Tonkonogy SL, Hammerberg B. Natural killer cell-dependent immunoglobulin G2a anti-bovine serum albumin (BSA) response elicited by high molecular weight dextran-BSA conjugates associated with dextran-mediated macrophage-natural killer cell interaction. Immunol 2000; 101: 474-83. [ Links ]
8. Snapper CM, Mond JJ. A model for induction of T cell-independent humoral immunity in response to poly-saccharide antigens. J Immunol 1996; 157: 2229-33. [ Links ]
9. Lindroth K, Fernández Mastache E, Roos I, et al. Un-derstanding thymus-independent antigen-induced reduc-tion of thymus-dependent immune responses. Immunol 2004; 112: 413-9. [ Links ]
10. Cruse JM, Lewis RE Jr, eds. Conjugate vaccines. Con-tributions to microbiology and immunology. New York: Karger 1989; Vol 10. [ Links ]
11. Janeway CA Jr, Travers P. Immunobiology: The immune system in health and disease. 4th Edition. Singapore: Stamford Press, 2000, p 321-3. [ Links ]
12. Tanaka M, Takeda Y, Miyazaki H, et al. Biliary secretion of antibody to dextran following oral immunization with dextran B512. Immunopharmacology 1995; 29: 251-9. [ Links ]
13. Weiner HL. Oral tolerance: immune mechanisms and the generation of Th3-type TGF-beta-secreting regulatory cells. Microbes Infect 2001; 3: 947-54. [ Links ]
14. Paul WE. Fundamental Immunology. Baltimore: Lippin-cott Williams & Wilkins, 1997; Chapter 42. [ Links ]
15. Weir DM. Handbook of Experimental Immunology - Immunochemistry. Oxford: Blackwell Scientific Publications, 1986; Chapter 8. [ Links ]
Recibido: 10-08-2004
Aceptado: 21-12-2004














