Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Medicina (Buenos Aires)
versión impresa ISSN 0025-7680versión On-line ISSN 1669-9106
Medicina (B. Aires) v.65 n.4 Buenos Aires jul./ago. 2005
Desarrollo de improntas para el diagnóstico del virus Epstein-Barr por inmunofluorescencia indirecta
Germán R. Pérez1, 3, Miguel A. Taborda1, Alicia Toffi2, Marcelo Palonsky1, Melina Pagotto1, Daniela N. Gardiol1, 3, Adriana A. Giri1, 3
1Area Virología, Departamento de Microbiología; 2Sección Inmunidad Celular, Departamento de Bioquímica Clínica; 3Instituto de Biología Molecular y Celular de Rosario, Facultad de Ciencias Bioquímicas y Farmacéuticas, Universidad Nacional de Rosario
Dirección postal: Bioq. Germán R. Pérez. Area Virología, Departamento de Microbiología, Instituto de Biología Molecular y Celular de Rosario (IBR), Facultad de Ciencias Bioquímicas y Farmacéuticas, Universidad Nacional de Rosario, Suipacha 531, 2000 Rosario, ArgentinaFax: (54-341) 439-0465. E-mail: gperez@fbioyf.unr.edu.ar
Resumen
El virus de Epstein-Barr (VEB) es el principal agente oncogénico linfotrópico dentro de la familia Herpesviridae y se encuentra mundialmente distribuido. La primoinfección se produce en adultos jóvenes y se manifiesta como mononucleosis infecciosa. La detección de anticuerpos anti-viral capside antigen (VCA) indica infección previa o presente con VEB. Además, se observan títulos elevados de anticuerpos anti-VCA en las enfermedades neoplásicas asociadas al VEB como los linfomas, en individuos HIV-positivos. El objetivo de este estudio fue el desarrollo y puesta a punto de improntas de células P3HR1 para la detección serológica del VEB por técnicas de inmunofluorescencia indirecta (IFI). Se estimularon cultivos de células P3HR1 en crecimiento exponencial con phorbol-12-mirystoil-13-acetato, y se recolectaron alícuotas a distintos tiempos para realizar improntas. Se realizó una IFI con cada impronta usando como anticuerpo primario un suero VEB-positivo. Se observó un aumento del 11% en la expresión del VCA a las 40 horas post-estimulación, decayendo al 3.5% a las 48 horas. Estos datos fueron corroborados por ensayo de western blot con inmunodetección. La precisión intra- e inter-lote de las improntas fue evaluada para anticuerpos IgM e IgG, con sueros probados previamente por equipos para esta determinación disponibles en el mercado para el VEB y con sueros reactivos para otros miembros de la familia Herpesviridae. No se obtuvieron resultados falsos-negativos ni falsos-positivos para el VEB ni se observó reactividad cruzada con otros herpesvirus. Las improntas desarrolladas constituyen un instrumento para el diagnóstico de la primoinfección del VEB y la detección serológica de anticuerpos IgG anti-VCA de neoplasias asociadas al VEB.
Palabras clave: virus Epstein-Barr, diagnóstico, improntas, anti-viral capside antigen, inmunofluorescencia indirecta
Abstract
Development of slides for Epstein-Barr virus diagnosis by indirect immunofluorescence. Epstein-Barr virus (EBV) is the main oncogenic lymphotropic agent of the Herpesviridae family and is globally distributed. EBV acute infection occurs in young adults producing infectious mononucleosis. Detection of anti-viral capside antigen (VCA) antibodies indicates previous or present EBV infection. Moreover, high titles of anti-VCA antibodies are observed in EBV-associated neoplasic disorders, such as lymphomas in AIDS patients. The objective of this study was the development and optimization of P3HR1 cell slides for the EBV serologic detection by indirect immunofluorescence (IIF) assay. P3HR1 exponential growth culture cells were stimulated with phorbol-12-mirystoil-13-acetate, collected at different time points and used for slide preparation. IIF assay was performed in each slide using an anti-EBV positive serum as primary antibody. An 11% increase in VCA expression was observed at 40 hours post-stimulation. Data was confirmed by western blot and immunodetection. Intra- and inter-lot precisions of the developed slides were evaluated for IgG and IgM antibodies using EBV-positive sera and positive samples for other members of the Herpesviridae family. Neither false-positive or false negative results were obtained for EBV detection nor cross-reaction was observed with other members of the Herpesviridae family with the developed slides. In conclusion, the slides here presented can be a useful instrument for acute EBV infection diagnosis and for the serologic detection of IgG anti-VCA antibodies in EBV-associated neoplastic disorders.
Key words: Epstein-Barr virus, diagnosis, slides, anti-viral capside antigen, indirect immunofluorescence
El virus de Epstein-Barr (VEB) pertenece a la familia Herpeviridae y está mundialmente distribuido. El VEB se transmite por saliva e ingresa a las células epiteliales de la orofaringe en donde se replica activamente para luego infectar células B en donde establece una infección latente. Entre 10 y 20% de los adultos sanos seropositivos asintomáticos son portadores del VEB en sus secreciones orales1. En las células B, el genoma lineal del VEB se circulariza por recombinación homóloga de sus repeticiones terminales. En estas condiciones, las células B adquieren la propiedad de inmortalidad encontrándose el ADN viral fundamentalmente en forma circular no integrado (episoma), y pueden ser cultivadas in vitro2. Durante la fase lítica, el VEB expresa alrededor de 90 proteínas virales, incluidos el early antigen (EA) y el viral capside antigen (VCA). Durante la infección latente, el VEB expresa un número controlado de proteínas entre las que se encuentran los Epstein-Barr nuclear antigens (EBNA)3.
Las infecciones por el VEB ocurren dentro de los primeros años de vida en la mayor parte del mundo3. En áreas geográficas donde las condiciones de saneamiento e higiene son deficientes, la primoinfección se documenta en los primeros 6-12 meses de vida y los individuos afectados no manifiestan sintomatología3. En áreas donde las condiciones de sanidad son mejores, la primoinfección con el VEB se produce en adolescentes o adultos jóvenes y se manifiesta como un síndrome linfoproliferativo autolimitado denominado mononucleosis infecciosa (MI)4. En la MI se observa una respuesta a anticuerpos heterófilos (AH), los cuales se definen como aquellos anticuerpos capaces de aglutinar glóbulos rojos de carnero o de caballo5, 6. Los AH no son exclusivos de la MI y su presencia ha sido documentada en el suero de individuos sanos luego de estimulaciones antigénicas por infecciones con otros agentes o transfusiones sanguíneas5. Por otro lado, muchos niños y cerca del 30% de los adultos infectados por el VEB no desarrollan AH7. Además, el citomegalovirus (CMV) y el Toxoplasma gondii producen enfermedades clínicamente indistinguibles de la MI, debiéndose realizar la determinación de anticuerpos específicos contra el VEB para un diagnóstico certero8. La detección de anticuerpos anti-VCA indica infección previa o presente con el VEB9. Una determinación positiva para anticuerpos IgM anti-VCA o un aumento significativo en el título de anticuerpos IgG anti-VCA en muestras pareadas indican primoinfección o reactivación del virus latente4. No obstante, los resultados de la detección de los anticuerpos anti-VCA son significativos desde el punto de vista diagnóstico cuando se relacionan con los datos hematológicos y las manifestaciones clínicas del paciente10.
El VEB es el principal agente oncogénico linfotrópico dentro de la familia Herpesviridae. Se observó el desarrollo de títulos elevados de anticuerpos IgG e IgM anti-VCA en enfermedades asociadas al VEB tales como el linfoma de Burkitt, la leucemia linfocítica, el lupus eritematoso sistémico, la artritis reumatoidea, la sarcoidosis y los linfomas no-Hodgkin (LNH)11. En particular, en individuos infectados con el virus de la inmunodeficiencia humana (HIV) el riesgo de desarrollo de linfomas está muy incrementado. La infección con el VEB probablemente precede y contribuye a la linfomagénesis en la infección por HIV y, aun en la era de la terapia anti-retroviral de alta eficacia, aproximadamente el 10% de los enfermos de sida desarrollan LNH12. Esto no es casual, ya que se observa una hiperactivación crónica de células B en estos pacientes que induce un incremento en el título de anticuerpos específicos contra el VEB, entre los que se encuentran los anti-VCA.
La detección de anticuerpos anti-VCA puede efectuarse utilizando diferentes metodologías, tales como radioinmunoensayo (RIA)13, enzimoinmunoensayo (ELISA) e inmunofluorescencia indirecta (IFI)14, 15. Los métodos de RIA y ELISA no son altamente específicos debido a la existencia de reacciones cruzadas entre distintos miembros de la familia Herpesviridae8, 16. La IFI permite el reconocimiento de un patrón de fluorescencia característico en las células infectadas usadas como sustrato antigénico. La especificidad de la IFI, junto a la sensibilidad y la rapidez de su realización, hacen de esta técnica el método de elección por los laboratorios clínicos para la detección de anticuerpos anti-VCA17. Sin embargo, el elevado costo de las improntas disponibles en el mercado impide el uso de la IFI en el ámbito de la salud pública, condicionando a los laboratorios a utilizar una técnica poco sensible y específica para el diagnóstico de la primoinfección por el VEB, como es la determinación de AH.
En este trabajo informamos el desarrollo y puesta a punto de improntas de células de la línea linfoblastoide P3HR1 para la detección serológica del VEB por técnica de IFI, con un desempeño comparable al de las improntas actualmente disponibles en el mercado de importación.
Materiales y métodos
Cultivo celular. La línea celular linfoblastoide P3HR1 está constituida por células B transformadas e infectadas con el VEB, derivadas de un linfoma de Burkitt18; 2-3% de la población celular expresa el antígeno VCA en la membrana plasmática. La glicoproteína VCA (150 kD) codificada por el gen BcLF1 del VEB se expresa durante la fase lítica de la infección y es inmunogénica. La replicación lítica del VEB en esta línea celular puede ser inducida por una variedad de sustancias entre las que se encuentra el phorbol-12-mirystoil-13-acetato (TPA). El TPA mimetiza la acción del mensajero intracelular diacilglicerol y activa al factor de transcripción AP-1, resultando en una mayor expresión de las proteínas virales en las células19. Para la preparación de las improntas, se cultivaron células P3HR1 en medio RPMI1640 (PAA Laboratories GmbH, Austria) suplementado con L-glutamina 2 mM, penicilina 100 U/ml (Sigma, Alemania), estreptomicina 100 µg/ml (Sigma, Alemania) y suero fetal bovino al 10% (Gibco, EE.UU.).
Muestras. Se usaron 12 sueros probados previamente por equipos comerciales para detección serológica del VEB (IFI, Bion Enterprises LTD, EE.UU.; ELISA EBV-VCA IgM, Diag-nostic Automation Inc, EE.UU.; ELISA EBV-VCA IgG, Diagnostic Automation Inc, EE.UU.); 4 sueros positivos para CMV (ELISA IgM-CMV, Diagnostic Systems Laboratories Inc, EE.UU.; ELISA IgG-CMV, Diagnostic Systems Laboratories Inc, EE.UU.); 2 sueros positivos para el virus de la varicela-zoster (VZV) (IFI, Bion Enterprises LTD, EEUU) y 2 sueros positivos para el virus Herpes Simplex tipos 1-2 (HSV 1-2) (IFI, Bion Enterprises LTD, EE.UU.). Los sueros se obtuvieron a partir de sangre entera periférica recolectada por venipuntura. Los especímenes se alicuotaron y se almacenaron a -20°C hasta su uso. Para cada técnica, se utilizaron los criterios de positividad recomendados por el fabricante.
Improntas. Se estimularon cultivos de células P3HR1 en crecimiento exponencial con TPA (40 ng/ml) y se recolectaron alícuotas de 1 ml cada 24 hs durante una semana. Las células se centrifugan 10 minutos a 800 rpm (centrífuga Eppendorf 5415D, rotor F54-24-11, Alemania). El sedimento celular se lavó 2 veces con buffer fosfato salino pH 7 (PBS), y el pellet se resuspendió en PBS a una concentración de 4 x 106 células/ml. Se dispensaron 20 µl de la suspensión celular en cada área de impronta y se secó en estufa a 37°C. De esta forma, se obtuvo un número de células totales por campo de 400x similar al observado en las improntas comerciales (aproximadamente 200 células por campo 400x). Las improntas fueron sumergidas en distintas soluciones fijadoras (etanol, acetona, y etanol:acetona 1:1) e incubadas a -20°C por 10 minutos. Las improntas fueron almacenadas con desecador a -20°C, envueltas en papel absorbente y papel de aluminio, hasta su uso. Bajo estas condiciones, fueron estables hasta 4 meses después de su elaboración. Se obtuvieron improntas de células P3HR1 a las 24, 48, 72, 96 y 120 horas post-estimulación. Se realizó una IFI con cada impronta usando como anticuerpo primario un suero VEB-positivo (título 1:640, dilución 1:50) y como anticuerpo secundario, anti-inmunoglobulinas totales humanas (anti-Ig) (Pas-teur Diagnostic, Francia) conjugado con isotiocianato de fluoresceína (FITC).
Inmunofluorescencia Indirecta. Un suero humano con título elevado de anticuerpos anti-VCA del VEB fue diluído 1/20 en PBS e incubado con el sustrato celular de las improntas durante 30 minutos a temperatura ambiente en cámara húmeda. Luego se realizaron 3 lavados de 5 minutos con PBS. En un segundo paso, se añadieron anticuerpos anti-Ig, anti-IgG humana (IFI, Bion Enterprises LTD, EE.UU.) o anti-IgM humana (IFI, Bion Enterprises LTD, EE.UU.) conjugados con FITC y azul de Evans al 0.001%. Las improntas se incubaron por 30 minutos a temperatura ambiente, en la oscuridad y en cámara húmeda. Luego se realizaron 3 lavados con PBS durante 5 minutos. Las muestras se observaron en un microscopio de fluorescencia (Zeiss, Alemania). El criterio para considerar a una muestra positiva fue la observación de al menos una célula fluorescente por campo de 400x.
Western Blot. Las células P3HR1 se lavaron con PBS, se suspendieron en buffer de lisis [NET-2F (EDTA 5 mM pH 8, NaCl 150 mM, Tris-HCl 50 mM pH 7.4, dodecilsulfato sódico 0.1%, Triton X-100 0.5%), Triton X-100 0.5%, PMSF 1 mM (Sigma, Alemania), DTT 0.5 mM] y se incubaron 20 minutos a 0ºC. El lisado se centrifugó durante 10 minutos a 13 200 rpm (centrífuga Eppendorf 5415D, rotor F54-24-11) y se separó el sobrenadante. La concentración de proteínas del extracto celular (EC) se dosó por el método del Rojo de Pirogalol (Proti U/LCR, Wiener lab, Argentina) y fue almacenado a -70°C hasta su procesamiento. Los EC fueron sometidos a electroforesis en gel de poliacrilamida con dodecilsul-fato sódico (SDS), sembrando por pocillo 50 mg de proteína, y transferidos a membranas de nitrocelulosa. La membrana fue incubada 20 minutos con buffer de bloqueo (leche descremada 10% en PBS) y durante toda la noche con el anticuerpo primario (suero de un paciente VEB-positivo con elevado título de anticuerpos anti-VCA probado por ELISA), diluído 1:100 en buffer de bloqueo. La membrana fue lavada 3 veces con TTBS (Tween 1% en PBS) e incubada por 2 horas en la oscuridad con un anticuerpo anti-Ig conjugado con fosfatasa alcalina, en una dilución 1:1000 en buffer de bloqueo. Finalmente, la membrana fue lavada 3 veces con TTBS e incubada en la solución de sustrato [5-bromo-4-cloro-3-indolyl-fosfato (Sigma, Alemania) y nitroblue tetrazolium (Sigma, Alemania)] hasta aparición de color.
Resultados
Desarrollo y puesta a punto de las improntas a partir de células P3HR1. Como se muestra en la Figura 1A, el mayor porcentaje de células fluorescentes por campo se observó en las improntas derivadas del segundo día post-estimulación. Este experimento fue realizado por triplicado, obteniéndose resultados promediables. Por otro lado, la mejor visualización microscópica y menos depósito de detritus, se obtuvo cuando las improntas se fijaron con la mezcla etanol:acetona 1:1 (datos no mostrados).
Con el objetivo de aumentar la precisión en el tiempo en el cual se observó la máxima inducción viral en el cultivo celular, se acotaron los tiempos dentro de los 3 primeros días post-estimulación. Se tomaron alícuotas del cultivo de células P3HR1 a las 0, 24, 32, 40, 48, 64 y 72 horas y se elaboraron improntas. Se realizó una IFI con cada impronta en condiciones idénticas a las descriptas y por triplicado. Se observó un aumento cercano al 11% de la expresión del VCA a las 40 horas post-estimulación, decayendo al 3.5% a las 48 horas (Figura 1B). Para corroborar los datos obtenidos por IFI, se realizó un ensayo de Western blot con inmunodetección, donde se visualizó una banda de mayor intensidad de 150 kD, correspondiente a la glicoproteína VCA, a las 40 horas post-estimulación (Figura 2).

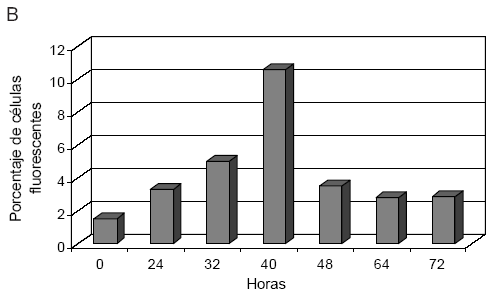
Fig 1.– Desarrollo y puesta a punto de las improntas a partir de células P3HR1.
A.Valor promedio del porcentaje de células P3HR1 fluo-rescentes por campo de 400x a distintos días post-estimulación con 40 ng/ml de TPA (phorbol-12-mirys-toil-13-acetato).
B. Valor promedio del porcentaje de células P3HR1 fluo-rescentes por campo de 400x a distintos tiempos dentro de los 3 primeros días post-estimulación con 40 ng/ml de TPA (phorbol-12-mirystoil-13-acetato).
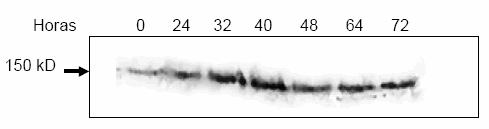
Fig 2.– Expresión de la proteína VCA (viral capside antigen) en células P3HR1 inducidas con TPA. Western blot de los extractos celulares obtenidos a distintos tiempos post-estimulación con 40 ng/ml de TPA. El revelado se efectuó con anticuerpo anti-Ig humana conjugado con fosfata-sa alcalina.
Estudios de sensibilidad y especificidad de la IFI con las improntas producidas a partir de células P3HR1. La precisión inter- e intra-lote de las improntas fue evaluada para anticuerpos IgM e IgG anti-VCA del VEB.
En ambas pruebas se ensayó un total de 12 sueros: 3 sueros negativos para anticuerpos anti-VCA clases IgG e IgM y 9 sueros VEB-positivos para IgG o IgM. Los títulos de las muestras IgG-positivas o IgM-positivas para VEB fueron determinados con ensayos comerciales y fluctuaban entre 1:80-1:1280 y 1:10-1:320, respectivamente. Para determinar la precisión inter- e intra-lote se realizó IFI sobre 5 lotes diferentes de improntas (precisión inter-lote) y por triplicado sobre cada lote (precisión intra-lote).
Los resultados obtenidos para IgG e IgM se muestran en las Tablas 1 y 2, respectivamente. Puede observarse que en algunas determinaciones se obtuvieron títulos fluctuantes para un dado suero VEB-positivo. Sin embargo, esta variación se limitó a una dilución inmediatamente superior o inferior, lo cual está dentro de los límites de confiabilidad de esta metodología20. Además, ninguno de los sueros fluctuó entre un resultado positivo o negativo y no se detectaron falsos positivos.
Como el VEB es miembro de la familia Herpesviridae, se estudió la posibilidad de reacción cruzada entre anticuerpos IgG e IgM contra otros miembros de esta familia. Las improntas desarrolladas se ensayaron por IFI utilizando sueros con anticuerpos IgG e IgM para CMV, VZV y HSV 1-2. Todos los sueros analizados fueron negativos para el sustrato antigénico de las improntas desarrolladas, no observándose ninguna célula fluorescente por campo de 400x (datos no mostrados). Este resultado indica la ausencia de reactividad cruzada entre las células P3HR1 inducidas con TPA y los anticuerpos IgG e IgM de otros miembros de esta familia.
TABLA 1.– Análisis de la precisión inter- e intra-lote de las improntas para la detección de anticuerpos IgG anti-VCA del Virus Epstein-Barr (VEB).
TABLA 2.– Análisis de la precisión inter- e intralote de las improntas para la detección de anticuerpos IgM anti-VCA del VEB
Discusión
En este trabajo se presenta el desarrollo y puesta a punto de la elaboración de improntas con células P3HR1 para la detección serológica de anticuerpos anti-VCA de clases IgG e IgM contra el VEB. Observamos que la expresión máxima del antígeno lítico VCA en las células P3HR1, luego de su estimulación con TPA, se produce a las 40 horas post-estimulación. A este tiempo, se recolectaron las células y se aplicaron en una concentración adecuada en las áreas de improntas. La fijación con etanol:acetona 1:1 permitió una mejor visualización microscópica debido a una menor deposición de detritus celular y fluorescencia inespecífica.
Los anticuerpos IgG anti-VCA del VEB aparecen tempranamente con un título máximo (> 1:640) entre las 2-4 semanas post-infección para declinar a valores más bajos (< 1:80) los cuales persisten indefinidamente. Un incremento de 4 veces el título de IgG anti-VCA en muestras pareadas es diagnóstico de infección aguda o reactivación del VEB. La presencia de anticuerpos IgM anti-VCA del VEB es altamente sugestiva de infección aguda con el VEB, puesto que se encuentran tempranamente en la MI en el 90% de los casos. Estos anticuerpos no se encuentran usualmente en la población general, ya que el título máximo se alcanza a la 3-4 semanas y declina hasta niveles indetectables en 8-10 semanas después de la infección4. La serología para la determinación de anticuerpos anti-VCA de clase IgM por IFI es atractiva puesto que combina especificidad con sensibilidad; en la mayoría de los casos requiere una única muestra de suero, constituyendo una alternativa al tradicional ensayo de Paul-Bunnell-Davidsohn para AH20.
Las improntas desarrolladas mostraron una precisión inter- e intra-lote satisfactoria para la detección de ambos tipos de anticuerpos por IFI y comparable a lo observado con improntas comerciales. Esto valida su utilización en determinaciones serológicas cualitativas y semicuantitativas de anticuerpos IgG e IgM anti-VCA del VEB. Si bien no se observaron reacciones cruzadas entre el sustrato celular de las improntas desarrolladas y anticuerpos de clases IgG e IgM de otros herpesvirus, sí se observaron en estudios llevados a cabo por la empresa Bion Enterprises LTD. Cabe destacar que en estos estudios, y según consta en el prospecto del equipo, se utilizó un mayor número de sueros para el análisis de la especificidad de las improntas comercializadas por la empresa que los incluidos en nuestro análisis.
Los resultados aquí presentados indican que las improntas de células P3HR1 pueden ser usadas en el diagnóstico de la infección primaria del VEB, así como en la semicuantificación serológica de anticuerpos IgG anti-VCA de neoplasias asociadas al VEB. La disponibilidad de este instrumento en el ámbito de la salud pública posibilitará la certeza y continuidad del diagnóstico. Esto es de suma importancia si además consideramos los costos de las improntas de importación, actualmente disponibles en el mercado, 2 dólares estadounidenses por determinación vs. 0.20 dólares con las improntas desarrolladas en este trabajo, y la disponibilidad condicionada de los materiales de origen importado.
El éxito en esta puesta a punto permitirá abordar el desarrollo de nuevas improntas para la detección de anticuerpos contra otros antígenos del VEB, tales como EA y EBNA utilizando como sustrato antigénico otras líneas linfoblastoides inmortalizadas por el VEB. De esta manera, se podrá disponer de los marcadores necesarios para caracterizar serológicamente las distintas enfermedades crónicas asociadas al VEB.
Agradecimientos: Este trabajo ha sido parcialmente financiado por un subsidio del Fogarty International Center, AIDS International Training Research Program-NIH (Subsidio Nº: 5 D43 TW001037).
Bibliografía
1. Cohen J. Epstein-Barr virus infection. N Engl J Med 2000; 34: 481-92. [ Links ]
2. Rickinson AB, Kieff E. Epstein Barr virus and its replication. In: Knipes DM, Howley PM, Griffin DE, Martin MA, Lamb RA, Roizman B, Straus SE (eds). Fields Virology. 3ª ed. Philadelphia: Lippincott Williams and Wilkins, 1996, p 2575-627. [ Links ]
3. Miller D. Epstein-Barr Herpes virus and infectious mono-nucleosis. Prog Med Virol 1975; 20: 84-112. [ Links ]
4. Crawford DH. Epstein-Barr virus. In: Zuckerman AJ, Barratvala JE, Patterson J (eds). Principles and Practice of Clinical Virology. England: John Wiley and Son Ltd., 2000, p 117-39. [ Links ]
5. Fleisher G, Lennette ET, Henle G, Henle W. Incidence of heterophile antibody responses in children with infectious mononucleosis. J Pediatr 1979; 94: 723-8. [ Links ]
6. Mishra B, Mohan B, Ratho RK. Heterophile antibody positive infectious mononucleosis. Indian J Pediatr 2004; 71: 15-8. [ Links ]
7. Young LS, Rowe M. Epstein-Barr virus, lymphoma and Hodgkin's disease. Semin Cancer Biol 1992; 3: 273-84. [ Links ]
8. Henle G, Henle W. Epstein-Barr virus. In: Nahamias AJ, Dowdlw AJ, Schinazi RF (eds). The Human Herpesvirus. New York: Elsevier, 1981, p 374-8. [ Links ]
9. Middeldorp JM and Herbrink P. Epstein-Barr virus specific marker molecules for early diagnosis of infectious mono-nucleosis. J Viro Meth 1988; 21: 133-46. [ Links ]
10. Grotto I, Mimouni D, Huerta M, et al. Clinical and laboratory presentation of EBV positive infectious mono-nucleosis in young adults. Epidemiol Infect 2003; 131: 683-9. [ Links ]
11. Liebwitz D. Epstein-Barr Virus pathogenesis. In: McCance DJ (ed). Human Tumor Virus. Washington DC: ASM Press, 1998, p 133-72. [ Links ]
12. International Collaboration on HIV and Cancer: Highly active antiretroviral therapy and incidence of cancer in human immunodeficiency virus-infected adults. J Natl Cancer I 2000; 92: 1823-30. [ Links ]
13. Hutchinson HD, Ziegler DW, Feorino PM. Radioimmu-noassay for detection of antibodies to Epstein-Barr virus in human infectious mononucleosis serum speci-mens. J Clin Microbiol 1975; 1: 429-33. [ Links ]
14. Sheppard C, Cohen B, Andrews N, Surridge H. Development and evaluation of an antibody capture ELISA for detection of IgG to Epstein-Barr virus in oral fluid samples. J Virol Meth 2000; 93: 157-66. [ Links ]
15. Vyse AJ, Knowles WA, Cohen BJ, Brown DWG. Detection of IgG antibody to Epstein-Barr virus viral capsid antigen in saliva by antibody capture radioimmunoassay. J Virol Meth 1997; 63: 93-101. [ Links ]
16. Feorino PM, Dye LA, Humphrey DD. Comparison of diagnostic tests for infectious mononucleosis. J Am Coll Health Assoc 1971; 19: 190-3. [ Links ]
17. Hinuma Y, Konn M, Yamaguchi J, Wudarski DJ, Blakes-lee JR, Grace JT. Immunofluorescence and Herpes-Type virus particles in the P3HR-1 Burkitt lymphoma cell line. J Virol 1967; 1: 1045–51. [ Links ]
18. Longnecker R. Molecular biology of Epstein-Barr virus. In: McCance DJ (ed). Human tumor viruses. US: American Society for Microbiology 1998, 9: 133-72. [ Links ]
19. zur Hausen H, O'Neil F, Freese U. Persisting oncogenic herpesviruses induced by tumor promoter TPA. Nature 1978; 272: 373-5. [ Links ]
20. Harnett GB, Palmer CA, Bucens MR. A modified immu-nofluorescence test for Epstein-Barr virus-specific IgM antibody. J Virol Meth 1985; 12: 25-30. [ Links ]
Recibido: 5-01-2005
Aceptado: 28-07-2005














