Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Medicina (Buenos Aires)
versión impresa ISSN 0025-7680versión On-line ISSN 1669-9106
Medicina (B. Aires) v.66 n.1 Buenos Aires ene./feb. 2006
Caracterización del canal epitelial de sodio en sinciciotrofoblasto de placenta humana preeclamptica*
Silvana del Mónaco1, Yanina Assef1, Alicia Damiano2, Elsa Zotta2, Cristina Ibarra2, Basilio A. Kotsias1
1Laboratorio de Neurofisiología, Instituto de Investigaciones Médicas Alfredo Lanari; 2Laboratorio de Fisiopatogenia, Departamento de Fisiología, Facultad de Medicina, Universidad de Buenos Aires
Dirección postal: Dr. Basilio A. Kotsias, Instituto de Investigaciones Médicas Alfredo Lanari, Combatientes de Malvinas 3150, 1427 Buenos Aires, Argentina. E-mail: kotsias@mail.retina.ar
* Este trabajo mereció el Premio Cherny otorgado por la Sociedad Argentina de Investigación Clínica en Mar del Plata, noviembre 2005
Resumen
El sinciciotrofoblasto (SCT) de placenta humana regula la transferencia de solutos y agua entre la sangre fetal y materna. En el presente trabajo observamos que el canal de sodio ENaC (asociado a cuadros como el síndrome de Liddle y pseudohipoaldosteronismo) está presente en la membrana apical del SCT y que la subunidad a del canal tiene una expresión reducida en placentas con hipertensión gestacional (preeclampsia). Realizamos estudios a nivel de expresión de ARN (RT-PCR) y a nivel proteico (western blot e inmunohistoquímica). En la línea celular BeWo (modelo de SCT humano) el canal se encuentra presente y la expresión del mismo es regulada por las hormonas aldosterona, vasopresina, estradiol y progesterona. Analizamos la actividad del ENaC por electrofisiología y observamos corrientes sensibles a amiloride (10 µM) cuando las células BeWo se cultivaron 12 horas con aldosterona (100 nM). Esta corriente presentó una magnitud 20 veces mayor que las corrientes basales, un potencial de reversión cercano a 3 mV y una conductancia de 127 ± 26 pS/pF entre los pulsos de –60 y –140 mV aplicados. Las características de esta corriente son similares a las producidas por ENaC en otros tejidos y evidencian la presencia de un canal funcional. El papel del ENaC en el SCT es poco comprendido, aunque la diferencia de expresión en la preeclampsia podría tener consecuencias para el transporte placentario de agua y iones. Nuestros datos son un aporte para futuros estudios de los mecanismos involucrados en la patofisiología de la preeclampsia.
Palabras clave: ENaC, placenta humana, preeclampsia, western blot, inmunohistoquímica
Abstract
Characterization of the epithelial sodium channel in human pre-eclampsia syncytiotrophoblast. The syncytiotrophoblast (SCT), a multinucleated epithelium forming the outer layer of chorionic villi, acts in human placenta as a transporting barrier regulating the transference of nutrients, solutes and water between maternal and fetal blood. Electrolyte homeostasis and extracellular fluid volume are maintained primarily by regulated Na+ transport. The present study was conducted to analyze the presence of the epithelial Na channel (ENaC) in placental tissue from normal and pre-eclamptic women and in BeWo cell, a model of a human SCT. Changes in the expression of these proteins during sodium transport across the placenta may be related to the pathogeny of pre-eclampsia. The role that ENaC and Na+ transport deregulation play on human placental tissues still remains unknown although in aldosterone-responsive epithelial cells (kidney, colon), abnormalities upregulating its activity lead to increased Na+ uptake and hypertension (i.e. Liddle´s syndrome) whereas a diminished channel activity can result in the pseudohypoaldosteronisn syndrome with salt loss and hypotension. Our results show that ENaC is expressed in the apical membrane of normal syncytiotrophoblast. The amplified fragment of a-ENaC was cloned and sequenced having a 100% identity with the sequence of a-ENaC obtained from GenBankTM (SCNN1A, accession number Z92981). We found that the transcription of the a-ENaC mRNA was not detectable in preeclamptic placentas and the protein was not observed with immunohistochemistry staining, probably indicating a low protein expression level. In BeWo cells ENac was found and its expression is regulated by aldosterone, vasopressin, progesterone and estradiol. With patch clamp techniques we studied the currents trough ENaC channels in Bewo cells. We observed currents that were blocked by 10 µM amiloride in cells incubated in 100 nM aldosterone for 12 hs. The amplitude of this current was 20-fold the basal current, a reversal potential of 3 mV and a conductance of 127 ± 26 pS/pF with pulses between -60 and -140 mV. These characteristics are similar to those reported in ENaC channels in several tissues. Although their roles in placenta are still poorly understood, the differences in the expression of ENaC in pre-eclamptic placentas may have consequences for ion transport and these data could lead to future studies concerning the mechanism involved in the pathophysiology of pre-eclampsia.
Key words: ENaC, human placenta, pre-eclampsia, western blot, immunohistochemistry
El sinciciotrofoblasto (SCT), es la capa celular periférica que recubre las vellosidades coriónicas y regula el pasaje transcelular de nutrientes, solutos y agua manteniendo el crecimiento fetal normal1-3. Este transporte transepitelial involucra movimiento de Na+ y la presión osmótica generada por el ión es un determinante importante del volumen del líquido extracelular. En SCT se han identificado diversas proteínas relacionadas al transporte de Na+: el intercambiador Na+/H+, la bomba Na+- K+ ATPasa y otros cotransportadores e intercambiadores de Na+4. En cuanto a la presencia de canales iónicos, para nosotros resultó de gran interés el canal epitelial de sodio (ENaC). ENaC es un canal que media la entrada de Na+ desde el fluido luminal a las células en epitelios absortivos. Se compone de tres subunidades homólogas: a, b, y g que forman un tetrámero (2a, b, y g). La cantidad de ENaC en la membrana aumenta por efecto de las hormonas aldosterona y vasopresina5 y es modulado por estrógenos y progesterona6 . ENaC es sensible al bloqueo por amiloride y sus análogos y se caracteriza por su alta afinidad al Na+ por sobre otros cationes monovalentes5, 7. En el riñón contribuye al 5-8% del transporte de Na+ pero su ubicación en la porción distal del nefrón es un paso limitante para la reabsorción de Na+. La importancia del ENaC se evidencia en epitelios absortivos (riñón, colon) dado que una regulación positiva de su actividad puede llevar a una elevada captación de sodio e hipertensión (síndrome de Liddle), mientras que una actividad disminuida puede resultar en el pseudohipoaldosteronismo tipo I, que provoca pérdida salina e hipotensión8. La subunidad a del ENaC ha sido descripta en placenta de cerdo9, mientras que el ARNm de las subunidades a y g del canal se encontraron en células de cultivo primario de citotrofoblasto de placenta humana10.
La hipertensión arterial inducida por el embarazo o preeclampsia es una de las complicaciones más comunes y causa más frecuente de morbimortalidad materna, fetal y perinatal, responsable del 15-20% de las muertes de mujeres en el embarazo. En el feto se produce retardo del crecimiento y/o asfixia perinatal. En la madre puede llevar a un grave deterioro de la salud. En ocasiones el cuadro se complica presentando proteinuria elevada, edema masivo, ascitis, coagulación intravascular diseminada, convulsiones, hemorragia y/o manifestaciones de compromiso neurológico. No se conoce la etiología del trastorno pero es importante notar que la pre-eclampsia ocurre sólo en presencia de la placenta y que la remoción de la misma normaliza la sintomatología, indicando que la función de este órgano es primordial en su fisiopatología11.
El objetivo del presente trabajo es analizar la localización de ENaC en tejido placentario humano normal y de mujeres pre-eclámpticas y además verificar su fun-cionalidad. Para esto se realizaron estudios a nivel proteico y de ARN con técnicas de biología molecular y de electrofisiología con patch clamp. Se utilizaron placentas humanas y la línea celular BeWo, derivada de coriocarcinoma humano, que presentan propiedades morfológicas y bioquímicas similares a las del trofoblasto humano. Las mismas expresan gonadotrofina coriónica (GCH) y lactógeno placentario y son un modelo adecuado para el estudio de los mecanismos de transporte placentario y la caracterización de las proteínas invo-lucradas. A pesar de la importancia clínica de la pre-eclampsia, no hay estudios sobre la localización y funcionalidad del ENaC en placentas humanas y pensamos que alteraciones en la expresión de las proteínas involucradas en el transporte placentario de Na+ podrían estar relacionadas con la enfermedad. Nuestros estudios permitirán entender si esta posible participación es causa o consecuencia de los síntomas observados. La regulación hormonal del transporte de Na+ en placentas preeclámpticas debe ser considerada importante, pudiendo aportar datos a la poca información existente sobre la patogénesis de este desorden y la influencia hormonal en el desarrollo fetal durante el mismo.
Se realizaron estudios en placentas normales y preeclámpticas obtenidas dentro de los 20 minutos de producido el parto espontáneo vaginal e inmediatamente procesadas en condiciones libres de ARNasas para impedir su degradación. Dicho material fue acondicionado en nuestro laboratorio y conservado en forma de tacos de parafina, extractos de ARN y proteínas, para ser utilizados en el desarrollo del trabajo. En forma paralela se analizó la presencia del canal en nuestro modelo de trabajo, la línea celular BeWo (ATCC-EE.UU.). Criterio para preeclapsia: proteinuria asociada a hipertension (presión sistólica > 140 mm Hg o diastólica >90 mm Hg) registrada al menos en dos ocasiones luego de la semana 20 del embarazo en mujeres sin antecedentes de hipertensión. La proteinuria se definió con 300 mg o más /24 horas o por una [proteína] de 300 mg/l11.
Para evaluar la presencia del ARNm que codifica el canal epitelial de sodio en placentas normales y preeclámpticas, se utilizó la técnica de RT-PCR y oligonucleótidos específicos para cada subunidad del mismo: a, b y g-ENaC. Validamos la identidad de nuestros productos de amplificación mediante secuenciación de ADN y comparación con secuencias informadas en el GenBankTM. Estudiamos las variaciones de expresión de las subunidades entre placentas normales y preeclámpticas. La expresión del canal en células BeWo también se estudió mediante RT-PCR, evaluando la respuesta de dichas células a la exposición a hormonas como aldosterona, vasopresina, estradiol y progesterona, en concentraciones fisiológicas.
La proteína ENaC se evaluó por western blot e inmunocitoquímica utilizando un anticuerpo policlonal dirigido contra el extremo amino terminal (aminoácidos 20 al 42) de la subunidad a del canal (Abcam, Cambridge, UK).
Debido a que el ENaC es un canal iónico, evaluamos la funcionalidad del mismo en las células BeWo con técnicas de electrofisiología. La actividad se midió en la configuración célula entera (whole cell) de la técnica de patch clamp, manteniendo el potencial en 0 mV y aplicando pulsos despolarizantes e hiperpolarizantes desde –60 a –140 mV en pasos de 20 mV. Las soluciones utilizadas se prepararon para eliminar posibles contaminaciones de canales no específicos y así estudiar las corrientes de Na+ a través del ENaC. Dado que la presencia del ENaC en membrana es estimulada por fosfo-rilación mediada por proteinquinasas, se estudió el efecto del 8Br-AMPc (100 µM, 30 min) sobre las corrientes basales. También se estudiaron los efectos de la aldosterona (100 nM, incubación de 12 horas) sobre la amplitud de las corrientes y la magnitud del bloqueo del diurético amiloride (10 µM). Todos los valores de corriente fueron normalizados por la capacitancia de membrana (Cm) y de esta forma se independizaron del tamaño celular. Los datos fueron analizados con el test estadístico t de Student de dos colas mediante el programa GraphPad InstatTM. La hipótesis nula plantea que no existe diferencia significativa entre el control y el tratamiento, siendo rechazada cuando se obtiene un p<0.05.
Los resultados obtenidos hasta el momento nos indican que el ARNm que codifica para las tres subunidades del canal epitelial de sodio a, b y gENaC se encuentra presente en el ARN total de SCT de placentas normales. El fragmento de amplificación de a-ENaC fue clonado y secuenciado, evidenciando un 100% de identidad con la secuencia de a-ENaC obtenida del GenBankTM (SCNN1A, número de acceso Z92981). Sin embargo, en las muestras de placenta preeclámptica el ARNm de dicha subunidad, necesaria y excluyente para la formación de un canal funcional, se encontró por debajo del nivel de detección de la técnica (n = 6), indicando una transcripción disminuida o nula del gen en los tejidos enfermos.
Con la técnica de western blot observamos en placentas normales bandas inmunorreactivas que se corresponden con el peso molecular predecido para las formas glicosiladas, no glicosiladas y completamente procesadas de a-ENaC. Confirmamos dicha presencia por inmunohistoquímica, observándose una señal positiva en la membrana apical (materna) del SCT, no detectable cuando el anticuerpo es adsorbido previamente con el péptido de bloqueo correspondiente. En el caso de las muestras provenientes de placentas preeclámpticas no se observó señal en SCT por inmunohistoquímica, indicando una probable expresión proteica disminuida. Todos los experimentos de western blot e inmunohistoquímica se llevaron a cabo al menos tres veces.
Una vez completados los análisis de detección del canal en placentas normales y preeclámpticas, continuamos con la búsqueda de un modelo que nos permitiera el estudio de las características funcionales del canal en este tejido. En condiciones control la línea celular BeWo expresa únicamente el ARNm de la subunidad a-ENaC y esto se confirmó con el hallazgo de la proteína correspondiente. Sin embargo, cuando las células fueron expuestas a concentraciones fisiológicas de diversas hormonas (aldosterona 100 nM, vasopresina 250 nM, estradiol 30 ng/ml, progesterona 300 ng/ml) durante 12 horas, los patrones de transcripción de las subunidades se vieron modificados. Todas las hormonas evaluadas generaron la expresión del ARNm de g-ENaC, y solamente con el estímulo de aldosterona o estradiol se produjo la transcripción de b-ENaC. Posteriores estudios más detallados nos permitirán cuantificar los niveles de aumento en la síntesis de los respectivos mensajeros. Para un análisis relativo de la viabilidad de las células ante los estímulos hormonales se llevó a cabo la medición de los valores de GCH sintetizada por las mismas en cada tratamiento. No se observaron diferencias en los valores de GCH entre los distintos tratamientos.
En cuanto al análisis de funcionalidad del ENaC en las células BeWo no se observaron corrientes sensibles a amiloride (10 µM) en condiciones control ni luego de la estimulación con 8Br-AMPc (100 µM). Sin embargo, cuando las células se cultivaron por 12 horas con aldosterona (100 nM) se produjo una corriente sensible al amiloride significativa (p=0.05), de una magnitud 20 veces mayor a las corrientes basales (sin estimulación hormonal), cuyo potencial de reversión fue cercano a 3 mV. La conductancia de dicha corriente fue de 127 ± 26 pS/pF entre los pulsos de –60 y –140 mV (corrientes entrantes), que representa la cantidad de iones que circulan a través del canal por unidad de tiempo. Las características de esta corriente observada se corresponden con corrientes de sodio transportadas por ENaC en otros sistemas que presentan también variabilidad de expresión de las distintas subunidades12.
Nuestros resultados midiendo tanto el ARNm como la proteína muestran la presencia de ENaC en la membrana apical del SCT de placentas normales y evidencian una expresión disminuida del mismo en placentas preeclámpticas. También utilizamos las células BeWo, en las cuales observamos la presencia de la subunidad a del canal y la estrecha regulación hormonal que induce la expresión de b y g-ENaC. Y es particularmente bajo el estímulo hormonal de la aldosterona que detectamos una corriente inducida por AMPc e inhibida por amiloride de características similares a la producida por el canal en otros sistemas celulares humanos. Estos resultados nos indican que el canal en este tejido es funcional y podría cumplir una importante función reguladora para el mantenimiento de la homeostasis de sodio entre la madre y el feto.
Las placentas preeclámpticas evidencian expresión alterada de diversos genes cuyos productos pueden tener implicancia en el desorden13. A pesar de que el papel que juega el ENaC en el tejido todavía es poco comprendido, su menor expresión en placentas preeclámpticas puede generar consecuencias para el transporte placentario de iones y agua para el desarrollo del feto en gestación. En relación a ello, la concentración plasmática de aldosterona está disminuía en pacientes preeclámp-ticas con respecto a embarazos normales14, 15, y creemos que la regulación del canal en preeclampsia puede estar relacionado a estos desbalances hormonales. Nuestros resultados podrían aportar al conocimiento de los mecanismos involucrados en la patofisiología de la preeclampsia dada la muy escasa información existente al respecto.
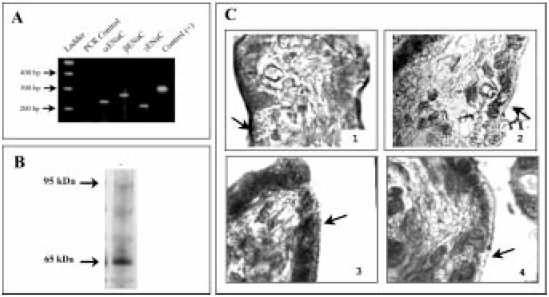
Fig. 1.- A. Estudios de RT-PCR obtenidos a partir de ARN total de SCT de placenta normal. Detección de a-ENaC (257 pb), b-ENaC (237 pb) y g-ENaC (237 pb). Control positivo b-actina (289 bp). B. Estudios de western blot a partir de proteínas de membrana apical de SCT normal evidenciando la presencia de a-ENaC. C. Localización de a-ENaC en membrana apical de SCT. 1: Marcación positiva en placentas normales incubadas con anticuerpo primario anti-a-ENaC. 2. Control negativo de 1, previa incubación del anticuerpo con péptido de bloqueo. 3. Ausencia de marcación en placentas preeclámpticas. 4. Control negativo de 3 (idem 2).

Fig. 2.- A. Estudios de RT-PCR obtenidos a partir de ARN total de células BeWo. Detección de a-ENaC, b-ENaC y g-ENaC luego de los tratamientos hormonales (aldosterona 100 nM, vasopresina 250 nM, estradiol 30 ng/ml, progesterona 300 ng/ml; durante 12 horas). Se observa una modulación diferencial en la expresión de las subunidades según el tratamiento hormonal. B. Estudios de western blot a partir de proteínas de células BeWo evidenciando la presencia de a-ENaC en condiciones control. C. Células BeWo cultivadas con aldosterona 100 nM por 12 horas. Relación de densidad de corriente (pA/pF) generada en función de los pulsos de voltaje aplicados (mV). Se observa un aumento significativo de corriente en los pulsos hiperpolarizantes (corrientes entrantes) luego del estímulo con AMPc 100 µM, 30 minutos (p= 0.05). Dicha corriente es luego inhibida significativamente con el agregado de amiloride 10 µM, 8 minutos (p= 0.05).
Agradecimiento: Este trabajo fue financiado por un subsidio de la UBA (MO44) y por el PRODIM (CONICET).
Bibliografía
1. Sibley CP, Glazier JD, Greenwood SL, et al. Regulation of placental transfer: the Na(+)/H(+) exchanger-a review. Placenta 2002; 23 Suppl A: S39-46. [ Links ]
2. Persson A, Johansson M, Jansson T, Powell TL. Na+ /K+-ATPase activity and expression in syncytiotrophoblast plasma membranes in pregnancies complicated by diabetes. Placenta 2002: 23, 386-91. [ Links ]
3. Johansson M, Jansson T, Powell TL. Na(+)-K(+)-ATPase is distributed to microvillous and basal membrane of the syncytiotrophoblast in human placenta. Am J Physiol (Regul Integr Comp Physiol) 2000; 279: R287-94. [ Links ]
4. Stulc J. Placental transfer of inorganic ions and water. Physiol Rev 1997; 77: 805-36. [ Links ]
5. Garty H, Palmer LG. Epithelial sodium channels: Function, structure and regulation. Physiol Rev 1997; 77: 359-96. [ Links ]
6. Gambling L, Dunford S, Wilson CA, McArdle HJ, Baines DL. Estrogen and progesterone regulate a, b, and gENaC subunit mRNA levels in female rat kidney. Kidney Int 2004; 65: 1774-81. [ Links ]
7. Alvarez de la Rosa D, Canessa CM, Fyfe GK, Zhang P. Structure and regulation of amiloride sensitive sodium channels. Annu Rev Physiol 2000; 62: 573-94. [ Links ]
8. Rossier BC, Pradervand S, Schild L, Hummler E. Epithelial sodium channel and the control of sodium balance: Interaction between genetic and environmental factors. Annu Rev Physiol 2002; 64: 877-97. [ Links ]
9. Page KR, Ashworth CJ, McArdle HJ, Finch AM, Nwagwu MO. Sodium transport across the chorioallantoic membrane of porcine placenta involves the epithelial sodium channel (ENaC). J Physiol 2003; 547: 849-57. [ Links ]
10. Driver PM, Rauz S, Walker EA, Hewison M, Kilby MD, Stewart PM. Characterization of human trophoblast as a mineralocorticoid target tissue. Mol Hum Rep 2003; 9: 793-8. [ Links ]
11. Sibai B, Dekker G, Kupferminc M.Pre-eclampsia. Lancet 2005; 365: 785-99. [ Links ]
12. Ma H-P, Al-Khalili O, Ramosevac S, et al. Steroids and exogenous gamma-ENaC subunit modulate cation channels formed by alpha-ENaC in human B lymphocytes. J Biol Chem 2004; 279: 33206-12 [ Links ]
13. Sharkey LC, McCune SA, Yuan O, Lange C, Fray J. Spontaneous pregnancy-induced hypertension and intrauterine growth restriction in rats. Am J Hypert 2001; 14: 1058-66. [ Links ]
14. Brown MA, Nicholson E, Gallery ED. Sodium-renin-aldosterone relations in normal and hypertensive pregnancy. Br J Obstet Gynaecol 1988; 95: 1237-46 [ Links ]
15. Walker BR, Williamson PM, Brown MA, Honour JW, Edwards CRW, Whitworth JA. 11b-hydroxysteroid dehy-drogenase and its inhibitors in hypertensive pregnancy. Hypertension 1995; 25: 626-30. [ Links ]














