Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Medicina (Buenos Aires)
Print version ISSN 0025-7680On-line version ISSN 1669-9106
Medicina (B. Aires) vol.66 no.3 Buenos Aires May/June 2006
Avances en el desarrollo de terapias neutralizantes en la sepsis
Maria Florencia Henning1, Horacio Garda1, Laura Bakás1, 2
1Instituto de Investigaciones Bioquímicas, Facultad de Ciencias Médicas;
2Departamento de Ciencias Biológicas, Facultad de Ciencias Exactas, Universidad Nacional de La Plata
Dirección postal: Dra. Laura Bakás, INIBIOLP-Facultad de Ciencias Médicas, Calle 60 y 120, 1900 La Plata, Argentina Fax (54-221) 4258988
E-mail:lbakas@biol.unlp.edu.ar
Resumen
El lipopolisacárido bacteriano (LPS), también denominado endotoxina, es el constituyente mayoritario de la membrana externa de bacterias Gram negativas. Esta molécula es liberada de la bacteria a la circulación exhibiendo una amplia variedad de efectos tóxicos y pro-inflamatorios, los cuales están asociados al lípido A y a su vez están relacionados a la patogénesis de la sepsis. Muchos de los fenómenos fisiológicos producidos por el LPS resultan de la capacidad de esta molécula de activar las células del sistema inmune del huésped, entre ellas monocitos, macrófagos y leucocitos polimorfonucleares. Este proceso produce una inflamación local, proceso beneficioso para el huésped. Sin embargo, si la cantidad de LPS liberado excede cierta concentración crítica umbral, la exacerbada liberación de citoquinas inflamatorias como Factor de Necrosis Tumoral (TNF-a) e interleuquinas (IL) resulta en sepsis grave, lo que hace necesario encontrar nuevas opciones terapéuticas capaces de neutralizar la endotoxina circulante. En este artículo se presenta una revisión actualizada de los resultados experimentales obtenidos in vivo e in vitro empleando proteínas y péptidos sintéticos con la finalidad de neutralizar el LPS, y las perspectivas que en este área ofrece el uso de lipoproteínas, en particular la apolipoproteína A-I y formas mutantes o péptidos derivados de esta proteína.
Palabras clave: Sepsis, Lipopolisacárido, Endotoxina, Péptidos neutralizantes, HDL, Apolipoproteína A-I
Abstract
Advances in the development of neutralizing therapies for sepsis. Lipopolisaccharide (LPS), also called endotoxin, is the major component of the external membrane in Gram negative bacteria. This molecule is released to circulation by the bacteria, producing a large variety of toxic and pro-inflammatory effects which are associated with lipid A as well as with sepsis pathogenesis. Many physiological phenomena produced by LPS arise from this molecule's capacity to activate cells in the host immune system such as monocytes, macrophages and polymorphonuclear leukocytes. This process leads to a local inflammation, and it is beneficial for the host. However, if the amount of LPS released exceeds the critical concentration threshold an augmented release of inflammatory cytokines as TNF-a, and interleukines (IL) produce a severe sepsis. This fact led us to find therapeutical alternatives able to neutralize circulating endotoxin. This work is focused on the experimental results obtained in vivo and in vitro using synthetic proteins and peptides in order to neutralize LPS, and on future perpectives in this research area that offer the use of lipoprotein and in particular apolipoprotein A-I and mutants or peptides derived from this protein.
Key words: Sepsis, Lipopolysaccharide, Endotoxin, Neutralizing peptides, HDL, Apolipoprotein A-I
La sepsis grave es la respuesta inflamatoria sistémica a una infección asociada a múltiples fallas orgánicas, pudiendo incluso causar la muerte del paciente. A pesar de los avances realizados en las unidades de terapia intensiva y en el desarrollo de nuevos antibióticos, la tasa de mortalidad asociada a este cuadro continúa siendo preocupante, dado que las terapias antiinflamatorias ensayadas hasta el momento no han sido exitosas1. Algunos resultados alentadores han sido obtenidos con el empleo de la proteína C recombinante humana (activada). Esta proteína tiene efectos antitrombóticos, antiinflamatorios y propiedades fibrinolíticas, reduciendo el nivel de marcadores inflamatorios en pacientes con sepsis grave de manera dependiente de la dosis, con una reducción en la mortalidad que fue de 24.7% en los tratados con proteína C y de 30.8% en pacientes tratados con placebo 28 días luego de comenzado el tratamiento. Sin embargo, la incidencia en el riesgo de sangrado se encuentra muy aumentada en pacientes tratados con proteína C activada2. De allí la importancia de continuar la búsqueda de nuevas opciones terapéuticas que influyan en la cascada de mediadores inflamatorios responsables del síndrome clínico.
En la sepsis por bacterias Gram negativas, el lipopolisacárido (LPS), endotoxina constituyente de la membrana externa de estas bacterias, juega un rol central en la iniciación y perpetuación de la respuesta inflamatoria sistémica3.
Como puede verse en la Fig. 1, luego de la liberación del LPS de la membrana bacteriana, como consecuencia de la división celular o muerte bacteriana, así como por tratamiento con antibióticos empleados para combatir las infecciones, la endotoxina inicia la activación de las células del huésped mediada por interacciones específicas con proteínas del suero tales como LBP (lipopolisaccharide binding protein) y receptores de superficie como CD14m (membrane boundcell differentation 14). Receptores como TLR4 (Toll-like Receptors)4 junto a MD25 y canales de potasio ligados al estrés6forman parte del sistema multicomponente del receptor del LPS, ligados a la iniciación de los eventos de señalización intracelular. La estimulación por LPS resulta en la activación del factor nuclear kb (NFkb) y de proteínas quinasa-activadas por mitógenos (MAPs)7, que llevan a la producción de citoquinas incluyendo TNF-a, IL-1, IL-6, IL-8 e IL-12 y mediadores como prostaglandinas y óxido nítrico, responsables de las respuestas patológicas como fiebre, diarrea, shock hipotensivo, coagulación intravascular generalizada y múltiples fallas orgánicas8. De aquí que algunas estrategias usadas contra los procesos sépticos consistan en neutralizar el LPS a través de su unión a proteínas, interrumpiendo la interacción con CD14m y LBP.

Fig. 1.- Secuencia de eventos inducidos por el lipopolisacárido durante la respuesta inflamatoria.
LPS: lipopolisacárido, LBP: LPS binding protein, CD: cell differentation, TLR: Toll like receptor, TNF: Factor de necrosis tumoral, IL: interleuquina, IFN: interferón.
En estudios realizados in vitro se ha encontrado que las lipoproteínas unen y neutralizan los efectos tóxicos del LPS. Sin embargo, en la respuesta de fase aguda, definida como el conjunto de cambios fisiológicos y metabólicos que ocurren en respuesta a la infección o injuria de tejidos9, un componente clave es la síntesis hepática alterada de proteínas involucradas en la coagulación, sistema de complemento y metabolismo de lípidos10, 11. Esto origina que en pacientes sépticos las concentraciones de lipoproteínas y en particular de las lipoproteínas de alta densidad (HDL) estén disminuidas, estando los cambios observados en relación directa con la gravedad de la infección, perpetuando de esta manera la respuesta inflamatoria.
Es este el motivo por el cual se han diseñado algunas estrategias enfocadas a la neutralización del LPS. El lípido A en particular, representa un blanco potencial en el desarrollo de las terapias debido a que ha sido identificado como la región evolutivamente conservada del LPS y por ser además reconocida como la parte bioactiva de la molécula.
En este trabajo se presenta una revisión de lo publicado hasta el momento respecto a los resultados obtenidos con proteínas y péptidos miméticos con capacidad neutralizante de la endotoxina, así como las perspectivas en este campo a la luz de los conocimientos de la estructura y función de la apolipoproteína A-I, componente proteico mayoritario de las HDL (high density lipoprotein).
Es importante sin embargo destacar que existen otros blancos hacia los cuales pueden dirigirse las terapias para combatir la sepsis, tales como la proteína HMG-B1 se (high mobility group 1)12. Esta proteína nuclear y citosólica de 30 kDa es liberada por macrófagos y ha sido identificada como mediador de la liberación de citoquinas en la inflamación sistémica letal (endotoxemia y sepsis), artritis e inflamación local. En estudios clínicos se ha observado que los niveles séricos de HMG-B1 se incrementan significativamente en pacientes con sepsis, disfunción orgánica inducida por la sepsis como hipotensión, acidosis láctica y coagulación intravascular diseminada, en comparación con el nivel encontrado en voluntarios sanos. Se han evaluado estrategias para su inhibición en modelos preclínicos de inflamación aguda y crónica, encontrando que la inhibición con etil piruvato inhibe el shock séptico experimental13.
Considerando que la sepsis es la respuesta inflamatoria sistémica a la infección, la sepsis grave es la sepsis con evidencias de disfunción orgánica como oliguria, hipoxemia, acidosis láctica o función cerebral alterada, el shock séptico es la sepsis grave complicada con hipotensión, y que el síndrome de respuesta inflamatoria sistémica (SIRS) puede ser precipitado por una variedad de condiciones aun en ausencia de infección, esta revisión que aquí se presenta apunta exclusivamente a encontrar terapias para neutralizar el LPS circulante. De esta manera, se intenta atacar la respuesta inflamatoria disparada en las primeras fases de la infección bacteriana, sobre todo en aquellos pacientes con metabolismo lipídico alterado, dado el importante papel de las lipoproteínas en el proceso de neutralización del LPS.
LPS: composición química y estructura
El LPS es el componente estructural mayoritario de las membranas externas de las bacterias Gram negativas. Se trata de una molécula anfifílica cuya composición presenta variaciones intra e inter especie. En la Fig. 2 se representan esquemáticamente las regiones más importantes de esta molécula.
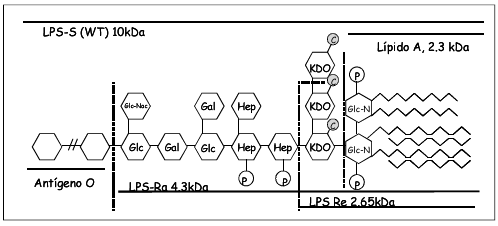
Fig. 2.- Representación esquemática de la molécula de lipopolisacárido.
LPS: lipopolisacárido, LPS-S (WT): LPS liso (wild type) completo, LPS-Ra y Re: LPS rugoso (mutantes), Glc: Glucosa, Glc-Nac: N-acetil D- glucosamina, Gal: D-galactosa, Hep: 1-glicero-D-heptosa, Glc-N: D-glucosamina, P: fosfato, C: carboxilato.
El LPS está compuesto por el lípido A que constituye la parte hidrofóbica de la molécula y a través del cual se inserta en la membrana externa de la bacteria, un extremo distal constituido por un polisacárido lineal denominado antígeno O, y uniendo ambas partes un hetero-oligosacárido no repetitivo conocido como core o núcleo.
El lípido A es la estructura biológicamente activa dentro de la molécula de LPS. Posee una estructura altamente conservada y es el responsable de la mayoría de las enfermedades graves asociadas a infecciones producidas por bacterias Gram negativas. En Escherichia coli el lípido A está formado por un disacárido de D-glucosamina con seis residuos de ácidos grasos y dos grupos fosfato. El número de sustituciones de ácidos grasos parece estar en relación directa con la capacidad de inducir respuesta inflamatoria, ya que moléculas de LPS con cinco cadenas acilo no inducen inflamación, pudiendo incluso actuar como antagonistas4.
El LPS y el lípido A, como moléculas anfifílicas forman agregados en medios acuosos por encima de su concentración micelar crítica (CMC). Por debajo de este valor las moléculas de LPS se presentan como monómeros, mientras que por encima de la CMC los monómeros están en equilibrio con las micelas. A mayores concentraciones de LPS los agregados anfifílicos forman agregados supramoleculares aproximadamente esféricos, los cuales pueden tener estructura multilamelar o no lamelar, dependiendo de las condiciones fisicoquímicas del medio14 y de la forma de los monómeros15. A su vez, la estructura de los agregados del lípido A es determinante de su bioactividad16.
Monoméros Û Micelas Û Agregados supramoleculares
Un aparente prerrequisito para que proteínas o péptidos neutralicen el LPS es que sean capaces de cambiar la estructura de los agregados del lípido A. Esto se debe a que la activación celular por acción de la endotoxina se inicia por su interacción con proteínas como LBP y CD14, seguido de la interacción con el complejo de señalización transmembrana TLR4/MD2, cuyo reconocimiento por el LPS dependerá de la accesibilidad de los epitopes de esta molécula, lo que depende a su vez de la estructura de los agregados.
Por último, la forma molecular de los monómeros en sí es importante como determinante de la actividad, ya que aquellos con forma cónica producirán una importante distorsión en la membrana blanco luego de su incorporación, y por lo tanto inducirán un estrés mecánico que se propagará a las proteínas de señalización17.
Proteínas que unen LPS
En circulación, el LPS se une a la LBP, glicoproteína miembro de la superfamilia de proteínas que unen y transfieren fosfolípidos. La LBP circula en plasma asociada a las HDL y su concentración incrementa 100 veces en plasma durante la respuesta de fase aguda. Esta proteína presenta un sitio de unión para el lípido A y participa en la respuesta celular del LPS, mediando la desagregación de agregados supramoleculares de LPS para formar el complejo LPS-LBP. De esta manera participa en la presentación del LPS a los receptores CD14m asociados a membrana, presentes en células mieloides incluyendo monocitos y neutrófilos, iniciándose así la activación celular con la subsiguiente liberación de citoquinas (IL-1, IL-6 y TNF-a).
El complejo LPS-LBP también puede interactuar con CD14s, forma soluble de CD14m, para formar un complejo que actúa sobre células endoteliales, epiteliales y células de Kuppfer, activando mecanismos de señalización dependientes del factor nuclear NFkb.
Estudios realizados in vitro demostraron que la LBP cataliza la transferencia de monómeros de LPS desde los agregados hacia micelas de fosfolípidos, sugiriendo que in vivo esta proteína podría actuar transfiriendo catalíticamente monómeros de LPS hacia CD14s o CD14m, aumentando así la respuesta.
Por otro lado, el complejo LPS-LBP se une a las lipoproteínas plasmáticas resultando en la detoxificación del LPS18, 19. Se ha demostrado que la LBP incrementa la incorporación a las HDL de monómeros de LPS, ya sea desde su forma micelar o de complejos LPS-CD14s por un proceso en el cual las moléculas de LPS son intercambiadas por fosfolípidos. Por lo tanto LBP, CD14 y HDL juegan un rol crucial en el balance entre neutralización y activación inmune (Fig. 3).

Fig. 3.- Ruta de activación y neutralización del lipopoli-sacárido. Rol de las lipoproteínas de alta densidad (HDL).
LPS: lipopolisacárido, CD 14: cell differentation 14, LBP: LPS binding protein, HDL: high density lipoprotein, apo A-I: apolipoproteína A-I.
Receptores celulares de LPS
El receptor CD14m es una proteína de membrana con un ancla de glicosilfosfatidilinositol (GPI) que carece de dominios citoplasmáticos20. Dado que CD14m no se comunica con el interior celular, se ha sugerido que el receptor de LPS es un complejo proteico multimérico que actúa como transductor de señales a través de la membrana. Datos recientes proponen que este receptor es un miembro de la familia TLR (toll like receptor)21, proteínas de membrana con una única región transmembrana, una región extracelular rica en residuos de leucina y un tallo citoplasmático similar al del receptor de IL-122. Asimismo se ha demostrado recientemente que el TLR4 puede interaccionar directamente con el LPS23.
La señalización intracelular a través de TLR2 y TLR4 emplea proteínas involucradas en la señalización de IL-1, como MyD88, quinasa asociada al receptor de IL-1 (IRAK), factor 6 asociado al factor de necrosis tumoral (TRAF6) y factor beta de crecimiento activado por quinasa 1 (TAK-1). La TAK-1 activa al NFkb a través de la quinasa inducida por NFkb (NIK) e involucra la activación de MAP quinasa y quinasa c-Jun (JNK)24-27 (Fig. 4). La MD2 es otra proteína de membrana que se encuentra en estrecha asociación con receptores TLR4, pudiendo unir directamente LPS sin la asistencia de LBP o CD14. Sin embargo, MD2 no se encuentra asociada a la superficie celular en ausencia de TLR428.
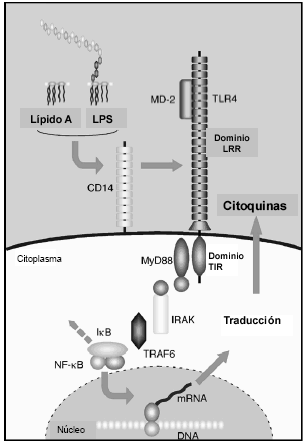
Fig. 4.- Receptores involucrados en el proceso de activación celular inducida por el lipopolisacárido.
LPS: lipopolisacárido, CD14: cell differentation 14, TLR4: toll like receptor 4, IRAK: quinasa asociada al receptor de IL-1, TRAF6: factor 6 asociado al factor de necrosis tumoral, TAK-1: factor beta de crecimiento activado por quinasa 1 NFkb: factor nuclear kb, IK: quinasa inducida por NFkb, mRNA: RNA mensajero.
Rol de las lipoproteínas en la neutralización del LPS y en la modulación de la respuesta en fase aguda.
Las lipoproteínas son partículas de alto peso molecular que transportan lípidos no polares, principalmente triglicéridos y ésteres de colesterol en plasma. Cada partícula tiene un centro no polar el cual contiene los lípidos hidrofóbicos, y rodeando a esta parte central una monocapa de lípidos anfipáticos como fosfolípidos y colesterol no esterificado. Estas partículas también contienen proteínas específicas localizadas en la monocapa superficial interactuando con los fosfolípidos. Una de las clasificaciones más comúnmente empleadas de las lipoproteínas se basa en su densidad. De acuerdo a esto se dividen en 4 clases mayoritarias: quilomicrones, VLDL (very low density lipoprotein), LDL (low density lipoprotein) y HDL (high density lipoprotein).
Ya desde 1957 era conocido que la incubación del LPS con suero reducía la respuesta febril a la endotoxina en ratones29. Estos resultados llevaron a realizar estudios a nivel molecular, encontrando que el LPS interactúa con componentes séricos y como consecuencia se produce un desplazamiento en la densidad de las fracciones lipoproteicas, observando paralelamente una inhibición de la actividad tóxica del LPS30.
Se ha demostrado, in vitro e in vivo, que en plasma humano existen varias proteínas con capacidad de unir y neutralizar el LPS. In vitro, el suero humano es capaz de prevenir la activación de monocitos inducida por el LPS mientras que el suero libre de lipoproteínas pierde esta capacidad, la cual se recupera por reconstitución con las mismas31.
Estudios más recientes han demostrado que las HDL son los únicos componentes del plasma que unen y neutralizan el LPS 32-34, mientras que las VLDL y LDL no tienen esta capacidad neutralizante35. Sin embargo, en casos de sepsis grave las VLDL se convierten en el aceptor dominante de la endotoxina36. En cuanto a los estudios realizados en modelo de endotoxemia humana, el pretratamiento con HDL reduce los niveles de TNF-a, IL-6 e IL-8, encontrándose simultáneamente asociada a estas lipoproteínas una regulación negativa de CD14 en monocitos37.
HDL y sepsis
Si bien la función principal de las HDL es participar en el transporte reverso de colesterol, también estarían involucradas en el transporte reverso de LPS. In vitro, las lipoproteínas unen y neutralizan el efecto tóxico del LPS. En pacientes sépticos, sin embargo, las concentraciones de lipoproteínas, especialmente de las HDL, están reducidas, y los cambios observados están en relación directa con la gravedad de la infección38. Así la modulación del metabolismo de lipoproteínas puede influir en la cascada de mediadores inflamatorios en la sepsis.
Por otro lado, durante la fase aguda, la proteína amiloide A pasa a ser la proteína mayoritaria de las HDL, pudiendo redirigir el complejo LPS/HDL desde la ruta CD14 hacia la ruta de scavenger de macrófagos en el hígado para una rápida detoxificación. Las consecuencias de estas propiedades biofísicas alteradas podrían estar relacionadas con un recambio más rápido de las HDL y en consecuencia con una eliminación incrementada del LPS en circulación.
Interacción de HDL con otras proteínas
Existe una gran variedad de proteínas que interaccionan con las HDL, entre ellas CETP (cholesteryl ester transfer protein), PLTP (phospholipid transfer protein), SAA (serum amyloid)39. Las CETP y PLTP son miembros de una familia de proteínas que transfieren ésteres de colesterol y fosfolípidos y también participan en la unión de lipopolisacáridos. Esta familia incluye también a la LBP y a la BPI (bactericidal/permeability increasing protein). Estas proteínas comparten gran homología de secuencias y todas tienen la capacidad de unir sustratos lipofílicos.
In vitro e in vivo, SSA se asocia con las HDL desplazando a la apo A-I y se transforma en la apolipoproteína predominante de esta fracción lipoproteica. Este proceso causa la remodelación de las HDL originando partículas de mayor densidad (HDL3)40. La presencia de SSA en las partículas de HDL reduce unas 10 veces la vida media de estas lipoproteínas en circulación. Además, el número de sitios de unión sobre los macrófagos para SSA/HDL se incrementa durante la inflamación, mientras que disminuye sobre los hepatocitos, lo que sugiere que durante la fase aguda las HDL son redirigidas del hepatocito al scavenger SR-BI situado en los macrófagos41. Interesantemente, el scavenger SR-BI es importante en la eliminación de circulación de la endotoxina42. Así, SSA puede redirigir el LPS neutralizado por las HDL de la ruta de activación CD14 hacia la ruta del scavenger de macrófagos hepáticos para una rápida detoxificación. Por ese motivo, la disminución de las HDL durante la fase aguda puede reducir la capacidad neutralizante del LPS.
Apolipoproteína A-I
La apo A-I, proteína mayoritaria de las HDL, tiene un rol clave en varias de las etapas del transporte reverso de colesterol (RCT) como: a) la microsolubilización de lípidos de las membranas de células periféricas, b) la interacción y reconocimiento de proteínas celulares (como ABC-AI y SR-B1), c) la activación de diferentes vías de señalización, algunas de ellas resultando en la movilización de depósitos intracelulares de colesterol (Col) hacia la membrana plasmática, y d) la activación de lecitin-colesterol-aciltransferasa (LCAT).
Además de su función antiaterogénica esta proteína ha sido considerada recientemente como una proteína de fase aguda43. Se ha sugerido que la apo A-I es el principal componente de las HDL con actividad antiendotoxina, uniendo el LPS y disminuyendo así la liberación de citoquinas44. Se ha demostrado también que la apo A-I inhibe la adhesión de los neutrófilos activados a la fibronectina, el estallido oxidativo y reduce la degranulación11.
Estructura y flexibilidad conformacional de apo A-I. Diferentes tipos de complejos con lípidos
La apo A-I pertenece al grupo de apolipoproteínas intercambiables, denominadas así por presentar un equilibrio entre sus formas libre y unida a lípidos. Otros representantes de este grupo son las apolipoproteínas A-II, A-IV, C y E. La forma madura de la apo A-I humana contiene 243 aminoácidos con repeticiones capaces de formar a-hélices anfipáticas45. Es de esperar que la apo A-I y las otras apolipoproteínas intercambiables requieran de una gran flexibilidad conformacional para ser solubles en el estado libre de lípidos, y estar en equilibrio con diferentes estados de unión a lípidos como unida a membranas y a complejos lipoproteicos de diferente morfología y tamaño, las que se interconvierten entre sí durante su ciclo funcional.
En cuanto a la estructura en las a-HDL esféricas, se propone que las hélices de la apo A-I formarían una monocapa externa rodeando a un núcleo de lípidos hidrofóbicos (ésteres de colesterol y/o triglicéridos)45. Todos los modelos propuestos de las HDL discoidales concuerdan en que una bicapa lipídica discoidal es rodeada en su borde por la apolipoproteína, con las caras hidrofóbicas de las hélices interactuando con los fosfolípidos. Los modelos con mayor base teórica y experimental son aquellos en los que las hélices de la apo A-I se disponen en su mayoría perpendiculares a las cadenas hidrocarbonadas de los fosfolípidos. Las evidencias recientes indican la coexistencia de dos configuraciones, pero con las 2 moléculas de apo A-I antiparalelas entre sí y totalmente extendidas en el borde del disco46.
El tamaño y contenido lipídico de las HDL discoidales depende primariamente del número de moléculas de apo A-I que conforman el disco, ya que pueden encontrarse discos de 2, 3 o más moléculas de apo A-I. Entre las HDL discoidales con 2 apo A-I por partícula, han sido bien caracterizadas dos tipos: las de diámetro de Stokes de 78 Å y las de 96 Å, con alrededor de 30 y 70 moles de lípido por mol de apo A-I, respectivamente47. La conformación de la apo A-I es diferente en estas partículas, lo que resulta en diferentes propiedades fisiológicas: las HDL de 78 Å tienen una afinidad 60 veces menor por el receptor SR-BI y capacidad de activar LCAT de 16 veces menor a las HDL de 96 Å48, 49.
Varios mutantes han sido diseñados para estudiar y comprender cómo alteraciones estructurales en la apo A-I afectan las funciones de las HDL. Las deleciones de los residuos 89-99 producen la mutante apo A-I D(89-99) con capacidad de promover el flujo de colesterol mediado por ABC-AI y SR-BI reducida a 68% y 78% respecto de la forma nativa. Sin embargo, estos mutantes mostraron una interacción reducida con la PLTP (phospholipid transfer protein) y por lo tanto una transferencia disminuida de fosfolípidos desde las VLDL/LDL hacia las HDL50. Otras estrategias incluyen la truncación de la apo A-I en el extremo C-terminal, produciendo la mutante apo A-I D(1-192) con una unión a lípidos disminuida, o la truncación del N-terminal, apo A-I D(44-243), que rinde una proteína con una estructura en solución alterada, con una conformación similar a la adoptada por la unión a lípidos. Sin embargo, la eliminación simultánea de los residuos 1-43 y 187-243 produce un fragmento que constituye el elemento central estable de la apo A-I. Si la deleción del N-terminal o del C-terminal estabiliza elementos que resultan en la formación en un ramillete de hélices, podría esperarse que se desarrolle una mayor afinidad por lípidos51.
Estudios realizados con péptidos miméticos de las 10 hélices anfipáticas localizadas en tandem mostraron que existe una mínima cooperatividad entre hélices adyacentes en la asociación con lípidos. Todos los estudios indican que las hélices 9 y 10 son las más eficientes en la asociación con lípidos, mientras que los dominios helicoidales de la región central poseen una afinidad por lípidos más débil52.
Estrategias para neutralizar LPS
Las estrategias de neutralización del LPS actualmente utilizadas, emplean anticuerpos anti-LPS o anti-TNF que unen y neutralizan el LPS circulante o capturan el TNF liberado, respectivamente. Sin embargo, estas estrategias han tenido un éxito limitado, por lo que una terapia alternativa ha sido el empleo de péptidos cargados positivamente que interactúen con el LPS, como polimixina B (PMB), NK-lisina, SAP(synthetic antitoxin peptides), BPI (Bactericidal/Permeability Increasing Protein) o péptidos derivados de estas moléculas, los que serían capaces así de inhibir la producción de citoquinas inflamatorias.
Polimixina B (PMB) y derivados
La PMB es considerada uno de los compuestos más potentes en cuanto a su actividad endotóxica. Es un oligopéptido catiónico cíclico de naturaleza anfipática ligado a un ácido graso. Se ha demostrado que muestra gran afinidad por el lípido A, presentando una estequiometría de unión 1:1. Dado que el lípido A es una región conservada del LPS, la PMB neutraliza el LPS proveniente de la mayoría de las bacterias Gram negativas, desarrollando raramente resistencia. Sin embargo, su nefrotoxicidad, neurotoxicidad y sus características farmacodinámicas y farmacocinéticas limitan su aplicación sistémica53.
La PMB conjugada con dextrán-70 genera PMX62254, que limita el extravasamiento a los tejidos de la PMB debido al alto peso molecular del dextrán. La efectividad de PMX622 ha sido demostrada en modelo equino55, de ratón56, carnero57 y conejo58. La PMX622 mostró ser una droga eficiente y segura, conservando las propiedades de la PMB en cuanto a su alta eficiencia de neutralización de la endotoxina y reteniendo las propiedades farmacocinéticas y metabólicas favorables del dextrán. Si bien PMBX622 ha superado las pruebas de fase I, no se ha demostrado aún su eficiencia en la fase II, correspondiente a pacientes sépticos que presentan fallas orgánicas. Por otro lado, se ha demostrado que su eficiencia depende del momento de administración en relación al aumento en la concentración de endotoxina en circulación, ya que es activa sólo si se la administra previamente pero no si es administrada 15 minutos con posterioridad a este aumento. Así, el uso de PMX622 funcionaría eficientemente en la profilaxis pero no en las aplicaciones terapéuticas59.
Otros derivados que se han desarrollado pero no están suficientemente caracterizados para su uso clínico son los conjugados con inmunoglobulina G60.
Otra serie de estudios están basados en pequeños péptidos diseñados con una estructura primaria y secundaria relacionada con la PMB. Los factores estudiados con la finalidad de encontrar estructuras óptimas en cuanto a la unión del lípido A y que resulten en la detoxificación del LPS incluyen la naturaleza catiónica, anfipática, tamaño, estructura y conformación del péptido. Se ha podido así determinar una secuencia de 8 a 13 aminoácidos la cual está presente también en proteínas que naturalmente unen el LPS, entre ellas LBP humana y de ratón, CD14 humana, BPI y el factor anti-LPS de Limulus61-66.
Dos péptidos sintéticos denominados péptidos antiendotoxina sintéticos, (SAEP-2 y SAEP-4), neutralizan la endotoxina con una eficiencia similar a la PMB67. La mayor actividad del SAEP-4 respecto al SAEP-2 se debe a la menor solubilidad del primero, lo cual produce la precipitación y remoción de los complejos SAEP-LPS68. Sin embargo, el comportamiento de estos péptidos in vitro es contrario al encontrado in vivo, habiéndose especulado sobre la existencia de mecanismos alternativos de protección por los péptidos no relacionados a los mecanismos de internalización de LPS vía CD14m. Una posible explicación radica en el efecto inhibitorio de la PMB y de SAPs sobre la proteinquinasa C (PKC), molécula clave de los mecanismos de señalización intracelular inducidos por el LPS69.
BPI/BNEP (Bactericidal/Permeability Increasing Protein)
La BPI es una proteína catiónica de 456 residuos producida y almacenada en neutrófilos con una potente actividad antiendotoxina70. En la región N-terminal, de aproximadamente 20kDa se han identificado 3 dominios separados (17-45, 65-99 y 142-169) a los que se les adjudica esta propiedad71, encontrando a su vez que los péptidos correspondientes a estas secuencias tienen actividad neutralizante del LPS72. El BNEP, un péptido sintético derivado de la proteína BPI correspondiente al dominio 148-161 presenta actividad antiendotóxica mostrando mayor afinidad por el lípido A que por el LPS debido al menor impedimento estérico de esta unión.
El desarrollo de péptidos anti-LPS con relevancia terapéutica requiere no solo de una actividad neutralizante específica o capacidad de unión in vitro, sino que debe probarse su eficiencia en modelo animal. El BNEP posee importantes efectos sobre las citoquinas tempranas y tardías involucradas en el proceso séptico. Comparado con la PMB que protege de la endotoxemia en modelo de ratón a una dosis de 1 mg/kg, el BNPE posee una mayor dosis efectiva (5 mg/kg). Es interesante que cuando se usaron dosis del orden de 10 mg/kg de BNPE no se observaron efectos colaterales73.
Componente P Amiloide Sérico (SAP)
El SAP es otra proteína presente en plasma humano con capacidad neutralizante del LPS74; es una glicoproteína decamérica compuesta de subunidades idénticas de 25.5 kDa asociadas en forma no covalente en dos anillos pentaméricos. Al igual que la proteína C-reactiva (CRP), pertenece a la familia de pentraxinas. Ambas proteínas comparten un 51% de homología de secuencia, sin embargo el SAP, a diferencia de la CRP, no es una proteína de fase aguda en humanos, sino que se encuentra de manera constitutiva en suero en concentraciones de 30-50 µg/ml. Su concentración se duplica durante la sepsis75 desempeñando funciones en el clearence de residuos derivados del huésped y del patógeno en los sitios de inflamación76. El SAP se une al LPS con alta afinidad en presencia de bajas concentraciones de la LBP, inhibiendo la respuesta celular inducida por el LPS77. Sin embargo, no es capaz de neutralizar el efecto endotóxico en presencia de suero o de altas concentraciones de LBP78, dado que ambas proteínas compiten por su unión al LPS74. Contrariamente a lo que se ha demostrado en el caso de las HDL que interaccionan con las formas monoméricas, e incluso promueven la desagregación del LPS, el SAP se une a las formas agregadas del mismo.
Se ha demostrado que SAP posee más de un sitio de unión al LPS y al igual que otras proteínas que unen LPS, como BPI, lactoferrina, apo B y apo E, posee un sitio de unión a heparina79. Los péptidos correspondientes a la secuencia comprendida entre los residuos 27-39, 61-75 y 186-200 de SAP unen LPS e inhiben la respuesta de fagocitos humanos al LPS en presencia de suero o sangre humana.
Tanto la carga como el carácter hidrofóbico de los aminoácidos presentes en los péptidos es importante para determinar su unión al LPS, aunque es esencial para que éstos posean actividad neutralizante, una secuencia de unión específica de estos residuos80.
NK-2
Esta molécula es un potente antibiótico de 27 residuos aminoacídicos derivados de la región central de la NK-lisina, polipéptido citolítico y antimicrobiano producido por linfocitos de mamíferos. El péptido NK-2 es muy potente contra bacterias, hongos y también contra Tripanozoma cruzi y presenta bajos niveles de toxicidad para células humanas81. El tamaño molecular, carga y la naturaleza anfipática de NK-2 es similar al que presentan gran número de péptidos naturales antimicrobianos que son parte del sistema inmune de una gran variedad de especies82. Estos péptidos matan microorganismos destruyendo la función de barrera de sus membranas.
La sensibilidad de diferentes cepas de Salmonella a NK-2 fue R595>R60> tipo salvaje. El LPS de la cepa tipo salvaje contiene la cadena antigénica O completa (LPS-S), la cepa mutante R60 contiene LPS-Ra, el cual conserva la parte central de azúcares y la cepa mutante R595 contiene LPS-Re, compuesto además del lípido A por el monosacárido KDO (Fig. 2). Estos resultados indican una correlación entre la actividad del péptido y la longitud de la cadena del polisacárido del LPS, resultando en una reducción en la producción de TNF con el acortamiento de la cadena de carbohidratos presente. A mayor longitud de la cadena de azúcares, son necesarias mayores concentraciones de péptido para producir una reducción significativa en los niveles de TNF. La relativamente alta afinidad de NK-2 por el LPS permitiría el desplazamiento de LBP, y por lo tanto la posibilidad de neutralización de LPS in vivo. Por el contrario, la proteína relacionada NK-lisina, falla en neutralizar LPS in vivo debido a la menor afinidad por el LPS.
Apo A-I
Los efectos antiinflamatorios y antiaterogénicos de las HDL han sido adjudicados a la apo A-I83. Aunque muchos estudios muestran los efectos beneficiosos de la administración de lipoproteínas en animales con endotoxemia, poco es lo que se conoce sobre el impacto de la apo-liproteína A-I. Estudios recientes demuestran que la administración de la apo A-I inhibe la liberación de TNF y mejora la tasa de sobrevida en ratas con endotoxemia84. Experimentos empleando la apo A-I purificada por ultra-centrifugación ponen en evidencia la existencia de dos diferentes sitios de unión de LPS sobre esta proteína. Uno de ellos correspondería al dominio de unión a lípidos y por lo tanto podría estar involucrado en la unión directa del LPS, mientras que el otro dominio postulado participa en la unión de la LBP y por lo tanto en la unión indirecta del LPS44.
Los estudios realizados en modelo celular indican que el efecto de la apo A-I es desplazar al LPS unido a receptores de superficie de monocitos36.
Sin embargo, a pesar de que estos resultados sugieren que la administración de HDL o apo A-I tendría efectos beneficiosos, las cantidades terapéuticas necesarias lo hace impracticable. Por este motivo los péptidos miméticos de apo A-I con afinidad incrementada por el LPS representan un área emergente en este campo terapéutico85-87.
Péptidos miméticos de apo A-I
El péptido denominado L-4F inhibe la respuesta inflamatoria inducida por el LPS y el lípido A en células endoteliales humanas a través de una reducción en la expresión de VCAM-1(vascular cell adhesión molecule-1). Se ha propuesto que el L-4F se une al lípido A previniendo la unión del LPS a la LBP y por lo tanto, la activación de los receptores celulares situados en células endoteliales88.
La interacción física entre el péptido y el LPS es responsable de la inhibición observada en la expresión de las moléculas de adhesión. En el caso del péptido L-4F, se ha encontrado una inhibición de la expresión de VCAM-1 inducida por LPS y lípido A, pero no aquella estimulada por TNFa o IL-1b, siendo esta última dependiente de la unión del LPS con LBP y CD1489.
El L-4F se une al LPS y altera su estado de agregación. En este sentido, se ha sugerido que el LPS es biológicamente activo en estado agregado y es la forma de estos agregados, lo que influye en la unión a LBP/CD1490. Esto llevó a hipotetizar que el L-4F induce un cambio conformacional en el LPS alterando su estado de agregación, provocando así que el lípido A no sea accesible a la LBP, previniendo de esta manera la formación del complejo y su unión a los receptores celulares.
Respecto a ensayos realizados in vivo sobre la neutralización de los efectos de la endotoxina, existe un único informe que muestra que la administración de L-4F prolonga la sobrevida de ratones inyectados con LPS91.
Perspectivas
Tal como lo muestra la revisión presentada en este artículo, durante los últimos 10 años se ha ensayado un gran número de opciones terapéuticas contra la sepsis basadas en el empleo de proteínas y péptidos que naturalmente unen el LPS. Si bien los resultados obtenidos in vitro han sido exitosos en muchos casos, hasta el momento el balance entre la cantidad terapéutica necesaria para neutralizar el efecto endotóxico y la toxicidad in vivo no rinde una ecuación satisfactoria. Esta es la razón por la cual las perspectivas futuras están enfocadas en el desarrollo de formas mutantes de la apolipoproteína A-I, proteína que naturalmente une y neutraliza el LPS, basadas en los avances que a nivel molecular existen en el conocimiento de la estructura y función de esta proteína. En particular el rol de las hélices anfipáticas en la unión a lípidos y en el reconocimiento de receptores del tipo SR-BI alientan los estudios de diseño de mutantes con eficiencia incrementada en la unión de LPS y con el consecuente aumento en la eficiencia de eliminación de esta endotoxina o de los complejos LBP/LPS de circulación vía receptores SR-BI.
Referencias
1. Efron P, Moldawer L. Sepsis and the dendritic cell. Shock 2003; 20: 386-401.
2. Bernard GR, Vincent JV, Laterre PF, et al. Efficacy and safety of recombinant human activated protein C for severe sepsis. N Engl J Med. 2001; 344: 699-709.
3. Bone RC. The pathogenesis of sepsis. Ann Inter Med 1991; 115: 457-69.
4. Backhed F, Normark S, Schweda E, Oscarson S, Richter-Dahlfors A. Structural requirements for TLR4-mediated LPS signalling: a biological role for LPS modifications. Microbes Infect 2003; 5: 1057-63.
5. Viriyakosol S, Kirkland T, Soldau K, Tobias P. MD-2 binds to bacterial lipopolysaccharide. J Endotoxin Res 2000; 6: 489-91.
6. Blunck R, Scheel O, Muller M, et al. New insights into endotoxin-induced activation of macrophages: involvements of a K+ channel in transmembrane signaling. J Immunol 2001; 166: 1009-15.
7. Han J, Lee J, Bibbs L, Ulevitch R. A MAP kinase targeted by endotoxin and hyperosmolarity in mammalian cells. Science 1994; 265: 808-11.
8. Sweet M, Hume D. Endotoxin signal transduction in macrophages. J Leukoc Biol 1996; 60: 8-26.
9. Bayne C, Gerwick L. The acute phase response and innate immunity of fish. Development and Comparative Immunology 2001; 25: 725-43.
10. Burger D, Dayer J. High density lipoprotein associated apolipoprotein A-I: the missing link between infection and chronic inflammation? Autoimmunity Reviews 2002; 1: 111-7.
11. Liao X, Ma J, Lou B, Wu M. Alteration of the components in serum high density lipoprotein during the acute phase reaction induced by lipopolysaccharide. Fudan University Journal of Medical Sciences 2004; 31: 471-4.
12. Wang H, Bloom O, Zhang M, et al. HMG-1 as a late mediator of endotoxin lethality in mice. Science 1999; 285: 248-51.
13. Ulloa L, Ochani M, Yang H, et al. Ethyl pyruvate prevents lethality in mice with established lethal sepsis and systemic inflammation. Proc Natl Acad Sci U S A 2002; 99: 12351-6.
14. Brandenburg K, Andra J, Muller M, Koch M, Garidel P. Physicochemical properties of bacterial glycopolimers in relation to bioactivity. Carbohydr Res 2003; 338: 2477-89.
15. Brandenburg K, Mayer H, Koch M, et al. Influence of the supramolecular structure of free lipid A on its biological activity. Eur J Biochem 1993; 218: 555-63.
16. Schromm A, Brandenburg K, Loppnow H, et al. Biological activities of lipopolysaccharides are determined by the shape of their lipid A portion. Eur J Biochem 2000; 267: 2008-13.
17. Seydel U, Oikawa M, Fukase K, Kusumoto S, Brandenburg K. Intrinsic conformation of lipid A is responsible for agonistic and antagonistic activity. Eur J Biochem 2000; 267: 3032-9.
18. Levels J, Abraham P, van den Enda, A Deventer, S. Distribution and kinetics of lipoprotein-bound endotoxin. Infect Immun 2001; 69: 2821-8.
19. de Haas C, Poppelier M, van Kessel K, van Strijp J. Serum amyloid P component prevents high-density lipoprotein-mediated neutralization of lipopolysaccharide. Infectious Immunology 2000; 68: 4954-60.
20. Haziot A, Chen S, Ferrero E, et al. The monocyte differentiation antigen, CD14, is anchored to the cell membrane by a phosphatidylinositol linkage. J Immunol 1988; 141: 547-52.
21. Muta T, Takeshige K. Essential roles of CD14 and lipopolysaccharide-binding protein for activation of tolllike receptor 2 (TLR-2) as well as TLR4. Reconstitution of TLR2- and TLR4-activation by distinguishable ligands in LPS preparations. European Journal of Biochemistry 2001; 268: 4580-9.
22. Kirkland T, Fierer J. Coccioidomycosis: a reemerging infectious disease. Emerg Infect Dis 1996; 2: 192-9.
23. Drutz D, Huppert M. Coccidioidomycosis: factors affecting the host-parasite interaction. J Infect Dis 1983; 147: 372-90.
24. Reddy R, Chen G, Newstead M, et al. Alveolar macrophage deactivation in murine septic peritonitis: role of interleukin 10. Infect Immun 2001; 69: 1394-401.
25. Shoham S, Huang C, Chen J, Golenbock D, Levitz S. Toll-like receptor 4 mediates intracellular signaling without TNF-alpha release in response to Cryptococcus neoformans polysaccharide capsule. J Immunol 2001; 166: 4620-6.
26. Steele C, Marrero L, Swain S, et al. Alveolar macrophage-mediated killing of Pneumocystis carinii f. sp. muris involves molecular recognition by the Dectin-1 beta-glucan receptor. J Exp Med 2003; 198: 1677-88.
27. Takeda K, Akira S. TLR signaling pathways. Semin. Immunol. 2004; 16: 3-9.
28. Brown G, Herre J, Williams D, et al. Dectin-1 mediates the biological effects of beta-glucans. J Exp Med 2003; 197: 1119-24.
29. Rall D, Gaskin J, Kelley M. Reduction of febrile response to bacterial polysaccharide following incubation with serum. Am J Physiol 1957; 188: 559-62.
30. Ulevitch R, Johnston A. The modification of biophysical and endotoxic properties of bacterial lipopolisaccharides by serum. J Clin Invest 1978; 62: 1313-24.
31. Flegel W, Wolp A, Mannel D, Northoff H. Inhibition of endotoxin-induced activation of human monocytes by human lipoproteins. Infect Immun 1989; 57: 2237-45.
32. Brandenburg K, Jurgens G, Andra J, et al. Biophysical characterization of the interaction of high-density lipoprotein (HDL) with endotoxins. Eur J Biochem 2002; 269: 5972-81.
33. van Leeuwen HJ, van Beek AP, Dalliga-Thie GM, et al. The role of high density lipoprotein in sepsis. The Netherlands Journal of Medicine. 2001; 59: 102-10.
34. Wu A, Hinds C, Thiemermann C. High-density lipoproteins in sepsis and septic shock: metabolism, actions, and therapeutic applications. Shock 2004; 21: 210-21.
35. Zhang H, Wu M, Lou B, Chen P. Role of high density lipoprotein in protecting against endotoxin toxicity. Fudan University Journal of Medical Sciences 2003; 30: 474-6.
36. Kitchens RL, Thompson PA. Impact of sepsis-induced changes in plasma on LPS interactions with monocytes and plasma lipoproteins: roles of soluble CD14, LBP, and acute phase lipoproteins. Journal of Endotoxin Research 2003; 9: 113-8.
37. Pajkrt D, Doran JE, Koster F, et al. Antiinflammatory effects of reconstituted high-density lipoprotein during human endotoxemia. J Exp Med 1996; 184: 1601-8.
38. Sammalkorpi K, Valtonen V, Kertula Y, Nikkila E, Taskinen M. Changes in serum lipoprotein pattern induced by acute infections. Metabolism 1988; 37: 859-65.
39. Khovidhunkit W, Memon R, Feingold K, Grunfeld C. Infection and inflammation-induced proatherogenic changes of lipoproteins. Infect Dis 2000; 181: 462-72.
40. Cabana V, Lukens J, Rice K, Hawkins T, Getz G. HDL content and composition in acute phase response in three species: triglyceride enrichment, of HDL a factor in its decrease. J Lipid Res 1996; 37: 2662-74.
41. Acton S, Rigotti A, Landschulz K, et al. Identification of scavenger receptor SR-BI as a high density lipoprotein receptor. Science 1996; 271: 518-20.
42. de Winther M, van Dijk K, Havekes L, Hofker M. Macrophage scavenger receptor class A-A multifunctional receptor in atherosclerosis. Atheroscler Thrombos Vascul Biol 2000; 20: 290-7.
43. Jahoor F, Gazzard B, Phillips G, et al The acute-phase protein response to human immunodeficiency virus infection in human subjects. Am J Physiol 1999; 276: E1092-E1098.
44. Ma J, Liao XL, Lou B, Wu MP. Role of apolipoprotein A-I in protecting against endotoxin toxicity. Biochim Biophys Acta Sin (Shanghai) 2004; 36: 419-24.
45. Segrest J, Jones M, De Loof H, et al. The amphipathic helix in the exchangeable apolipoproteins: a review of secondary structure and function. J Lipid Res 1992; 33: 141-66.
46. Silva R, Hilliard G, Li L, Segrest J, Davidson W. A mass spectrometric determination of the conformation of dimeric apolipoprotein A-I in discoidal high density lipoproteins. Biochemistry 2005; 44: 8600-7.
47. Jonas A, Wald JH, Toohill KL, Krul ES, Kezdy KE. Apolipoprotein A-I structure and lipid properties in homogeneous, reconstituted spherical and discoidal high density lipoproteins. J Biol Chem 1990; 265: 22123-9.
48. Bergeron J, Frank P, Scales D, et al. Apolipoprotein A-I conformation in reconstituted discoidal lipoproteins varying in phospholipid and cholesterol content. J Biol Chem 1995; 270: 27429-38.
49. McGuire K, Davidson W, Jonas A. High yield overexpression and characterization of human recombinant proapolipoprotein A-I. J Lipid Res 1996; 37: 1519-28.
50. Chroni A, Kan H, Shkodrami A, Liu T, Zannis V. Deletions of helices 2 and 3 of human ApoAI are associated with severe dyslipemia following Adenovirus-mediated gene transfer in Apo AI deficient mice. Biochemistry 2005; 44: 4108-17.
51. Beckstead J, Block B, Bielicki J, et al. Combined N- and C-terminal truncation of human apolipoprotein A-I yields a folded, functional central domain. Biochemistry 2005; 44: 4591-9.
52. Mishra VK, Palgunachari MN, Datta G, et al. Studies of synthetic peptides of human apolipoprotein A-I containing tandem amphipathic alpha-helixes. Biochemistry 1998; 37: 10313-24.
53. Ghiselli R, Giacometti A, Cirioni O, Circo R, Mocchegiani F. Neutralization of endotoxin in vitro and in vivo by Bac7(1-35), a proline-rich antibacterial peptide. Shock 2003; 19: 577-81.
54. Handley D, Lake P. Polymixin B conjugates. US patent 5177059. 1993;
55. MacKay R, Clark C, Logdberg L, Lake P. Effect of a conjugate of polymyxin B-dextran 70 in horses with experimentally induced endotoxemia. Am J Vet Res 1999; 60: 68-75.
56. Camerota A, Logdberg L, Lake P, Larkin V, Fink M. Delayed therapy with polymyxin B-dextran conjugate (PMX-622) improves survival in rabbits with gramnegative peritonitis. J Endotoxin Res 1997; 4: 286-92.
57. Doig G, Martin C, Sibbald W. Polymyxin-dextran antiendotoxin pretreatment in an ovine model of normo-tensive sepsis. Crit Care Med 1997; 25: 1956-61.
58. Bucklin S, Lake P, Logdberg L, Morrison D. Therapeutic efficacy of a polymyxin B-dextran 70 conjugate in experimental model of endotoxemia. Antimicrob Agents Chemother 1995; 39: 1426-66.
59. Lake P, De Leo J, Cerasoli F, et al. Pharmacodynamic Evaluation of the Neutralization of Endotoxin by PMX622 in Mice. Antimicrobial Agents and Chemotherapy 2004; 48: 2987-92.
60. Dubrick J, Bhattacharjee A, Hoover D, et al. Covalent Polymyxin conjugates with human immunoglobulin G as an anti-endotoxin reagent. Antimicrobian Agents Chemother 1998; 42: 583-8.
61. Porro M. Structural basis of endotoxin recognition by natural polypeptides. Trends Microbiol 1994; 2: 65-6.
62. Roth R, Tobias P. Lipopolysaccharide-binding proteins of Limulus amebocyte lysate. Infect Immun 1993; 61: 1033-9.
63. Rustici A, Velucchi M, Faggioni R, et al. Molecular mapping and detoxification of the lipid A binding site by synthetic peptides. Science 1993; 259: 361-5.
64. Wright SD, Ramos RA, Tobias P, Ulevitch R, Mathison JG. CD14, a receptor for complexes of lipopolysaccharide (LPS) and LPS binding protein. Science 1990; 249: 1431-3.
65. Marra M, Au-Young J, Lin L, et al. Identification of bactericidal/permeability increasing protein (BPI) and lipopolysaccharide binding protein (LBP) domains which are important for LPS neutralizing or transducing activity and circulating half-life. J Endotoxin Res 1994; 1: 18.
66. Evans T, Carpenter A, Moyes D, Martin R, Cohen J. Protective effects of a recombinant amino-terminal fragment of human bactericidal/permeability-increasing protein in an animal model of gram-negative sepsis. J Infect Dis 1995; 171: 153-60.
67. Iwagaki A, Porro M, Pollack M. Influence of synthetic antiendotoxin peptides on lipopolysaccharide (LPS) recognition and LPS-induced proinflammatory cytokine responses by cells expressing membrane-bound CD14. Infect Immun 2000; 68: 1655-63.
68. Vaara M, Porro M. Group of peptides that act synergistically with hydrophobic antibodies against gramnegative enteric bacteria. Antimicrob Agents Chemother 1996; 40: 1801-5.
69. Jun C, Choi B, Kim H, Chung H. Involvement of protein kinase C during taxol-induced activation of murine peritoneal macrophages. J Immunol 1995; 154: 6541-7.
70. Alexander S, Bramson J, Foley R, Xing Z. Protection from endotoxemia by adenoviral-mediated gene transfer of human bactericidal/permeability-increasing protein. Blood 2004; 103: 93-9.
71. Kleiger G, Beamer L, Grothe R, Mallick PE, Isenberg D. The 1.7 A crystal structure of BPI: a study of how two dissimilar amino acid sequences can adopt the same fold. J Mol Biol. 2004; 299: 1019-34.
72. Mayo K, Haseman J, Ilyina E, Gray B. Designed betasheet-forming peptide 33 mers with potent human bactericidal/permeability increasing proteinlike bactericidal and endotoxin neutralizing activities. Biochim Biophys Acta 1998; 1425: 81-92.
73. Zheng J, Hong Z, Guo W, et al. A synthetic peptide derived from bactericidal/permeability-increasing protein neutralizes endotoxin in vitro and in vivo. Int Immunopharmacol 2004; 4: 527-37.
74. de Haas C, Van der Tol M, Van Kessel K, Verhoef J, Van Strijp J. A synthetic lipopolysaccharide (LPS)-binding peptide based on amino acids 27-39 of serum amyloid P component inhibits LPS-induced responses in human blood. J Immunol 1998; 161: 3607-15.
75. Emsley J, White H, O'Hara B, et al. Structure of pentameric human serum amyloid P component. Nature 1994; 367: 338-45.
76. Gewurz H, Zhang X, Lint T. Structure and function of the pentraxins. Curr Opin Immunol 1995; 7: 54-64.
77. de Haas C, Haas P, Van Kessel K, Van Strijp J. Affinities of different proteins and peptides for lipopolysaccharide (LPS) as determined by biosensor technology. Biochem Biophys Res Commun 1998; 252: 492-6.
78. de Haas C, van Leeuwen H, Verhoef J, Van Kessel K, Van Strijp J. Analysis of lipopolysaccharide (LPS)-binding characteristics of serum components using gel filtration of FITC-labeled LPS. J Immunol Methods 2000; 242: 79-89.
79. Van Berkel P, Geerts M, van Veen H, et al. N-terminal stretch Arg2, Arg3, Arg4 and Arg5 of human lactoferrin is essential for binding to heparin, bacterial lipo-polysaccharide, human lysozyme and DNA. Biochem J 1997; 328: 145-51.
80. de Haas C, van der Zee R, Benaissa-Trouw B, et al. Lipopolysaccharide (LPS)-binding synthetic peptides derived from serum amyloid P component neutralize LPS. Infect Immun 1999; 2790-6.
81. Jacobs T, Bruhn H, Gaworski I, Fleischer B, Leippe M. NK-lysin and its shortened analog NK-2 exhibit potent activities against Trypanosoma cruzi. Antimicrob Agents Chemother 2003; 47: 607-13.
82. Zasloff M. Antimicrobial peptides of multicellular organisms. Nature 2002; 415: 389-95.
83. Shah P, Kaul S, Nilsson J, Cercek B. Exploiting the vascular protective effects of high density lipoprotein and its apolipoproteins: an idea whose time for testing is coming, part I. Circulation 2001; 104: 2376-83.
84. Imai T, Fujita T, Yamazaki Y. Beneficial effects of Apo-lipoprotein A-I on endotoxemia. Surgery Today 2003; 33: 684-7.
85. Garber D, Datta G, Chaddha M, et al. A new synthetic class A amphipathic peptide analogue protects mice from diet induced atherosclerosis. J Lipid Res 2001; 42: 545-52.
86. Datta G, Chaddha M, Hama S, et al. Effects of increasing hydrophobicity on the physical-chemical and biological properties of a class A amphipathic helical peptide. J Lipid Res 2001; 42: 1096 -104.
87. Navab M, Anantharamaiah G, Reddy S, et al. Human apolipoprotein A-I and A-I mimetic peptide: potential for atherosclerosis reversal. Curr Opin Lipidol 2004; 15: 645- 9.
88. Gupta H, Dai L, Datta G, et al. Inhibition of lipopolysaccharide-induced inflammatory responses by an Apolipoprotein AI mimetic peptide. Circ Res 2005; 97: 236-43.
89. Bocknov V, Kadl A, Huber J, et al. Protective role of phospholipids oxidation products in endotoxin-induced tissue damage. Nature 2002; 419: 77- 81.
90. Mueller M, Lindner B, Kusumoto S, et al. Aggregates are the biologically active units of endotoxin. J Biol Chem 2004; 279: 26307-13.
91. Levine D, Parker T, Donnelly T, Walsh A, Rubin A. In vivo protection against endotoxin by plasma high density lipoprotein. Proc Natl Acad Sci U S A. 1993; 90: 12040 -4.
Recibido: 29-09-2005
Aceptado: 21-02-2006














