Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Medicina (Buenos Aires)
versión impresa ISSN 0025-7680versión On-line ISSN 1669-9106
Medicina (B. Aires) v.67 n.1 Buenos Aires ene./feb. 2007
Evaluación crítica del test de tolerancia oral a la glucosa para el diagnóstico de resistencia insulínica en pacientes con síndrome de ovario poliquístico
Cecilia E. Calvar, Sonia V. Bengolea, Ricardo Hermes, Marcelo Loyato
Servicio de Endocrinología, Hospital J. A. Fernández, Buenos Aires
Dirección postal: Dra. Cecilia Elizabeth Calvar, Av. Santa Fe 2843, 1425 Buenos Aires, Argentina. Fax: (54-11) 4822-8074
e-mail: ccalvar@ intramed.net
Resumen
El test de tolerancia oral a la glucosa (TTOG) es el más frecuentemente utilizado en la práctica clínica para el diagnóstico de resistencia insulínica (RI). El objetivo del presente trabajo fue la evaluación de la utilidad de los índices basales e índices TTOG, en mujeres con síndrome de ovario poliquístico (SOP) y del valor predictivo de los índices basales sobre la glucemia a los 120 minutos postprandial (G 120). Se estudiaron 114 pacientes con diagnóstico de SOP y 29 mujeres normales. A todas se les realizó un TTOG. Se dosó insulina y glucosa séricas cada 30 min durante las 2 horas del test y se determinaron los siguientes índices: Indices basales: GLU/lNS (glucemia en ayunas / insulinemia en ayunas), HOMA (modelo homeostático) y QUICKI (índice cuantitativo de sensibilidad insulínica) e índices TTOG: AI (área bajo la curva de insulina) e ISI composite (índice de sensibilidad insulínica). Se observaron correlaciones significativas entre los índices basales y los índices TTOG. Hubo 9 pruebas con índices basales normales que presentaban índice TTOG patológicos. Ninguna paciente con niveles de insulina menores a 9.9 Ul/ml presentó RI, mientras que todas las pacientes con niveles de insulina mayores a 18.4 Ul/ml tuvieron RI. Catorce pacientes (10.5%) presentaron G 120 ³ a 140 mg%. En 4 de los 14 casos (12.2%), los valores basales no hicieron sospechar la posibilidad del diagnóstico de hiperglucemia post prandial. En conclusión, en pacientes con SOP, los índices basales son útiles para diagnosticar RI. Proponemos realizar TTOG para diagnóstico de RI en aquellas pacientes que presenten insulinemias en ayunas entre 9.9 y 18.4 Ul/ml. En pacientes con SOP, se recomienda la evaluación periódica de la G 120.
Palabras clave: Síndrome de ovario poliquístico; Resistencia insulínica; Test de tolerancia a la glucosa
Abstract
Critical evaluation of the oral glucose tolerance test for the diagnosis of insulin resistance in patients with polycystic ovary syndrome. Oral glucose tolerance test (OGTT) is the most commonly used method to evaluate insulin resistance (IR) in the clinical practice. Our objective was to evaluate the diagnostic utility of fasting tests compared with OGTT tests in women with PCO, and the ability of fasting tests to detect postprandial hyperglycemia. One hundred fourteen women with PCO and 29 normal women were evaluated by a 2 hours OGTT. Fasting plasma insulin (INS) and glucose were measured during the test. GLU:INS ratio (r) (fasting glucose/fasting insulin), HOMA (homeostatic model assessment), QUICKI (quantitative insulin sensitivity check index) (fasting tests), as well as the AUCI (area under the curve of INS) and ISI composite (ISI) (insulin sensitivity index) (OGTT tests), were determined. A significant correlation between fasting tests and OGTT tests was found. Normal fasting tests with abnormal OGTT tests were found in 9 patients. No patient with fasting insulin levels less than 9.9 UI/ml were IR, and all women with fasting insulin levels over 18.4 UI/ml were classified as having IR. We found glucose levels 120 min post glucose load (G 120) ³ 140 mg/dl in 14 patients (12.2%). Fasting glucose and insulin levels and the fasting tests, were poor predictors of impaired glucose tolerance (IGT) and type 2 diabetes (DBT 2). Thus, fasting tests are useful in the diagnostic of IR in PCO patients. OGTT is necessary when the fasting insulin levels range between 9.9 and 18.4 UI/ml. Women with PCO should undergo periodic screening for abnormal glucose tolerance.
Key words: Polycystic ovary syndrome; Insulin resistance; Oral glucose tolerance test
El síndrome de ovario poliquístico (SOP), es un desorden endocrino heterogéneo y muy frecuente, que afecta entre el 6 y 8% de las mujeres en edad reproductiva1. Este síndrome se caracteriza por anovulación crónica asociada a signos de hiperandrogenismo clínico y/o bioquímico2-5.
El SOP está asociado con la presencia de resistencia insulínica (RI) y disfunción de las células beta pancreáticas, independientemente de la obesidad. Estos defectos confieren un aumento sustancial del riesgo de intolerancia a la glucosa y diabetes tipo 2 (DM2) en este grupo de pacientes6-8. Asimismo, las mujeres con SOP tienen un aumento del riesgo cardiovascular debido a la mayor prevalencia de obesidad, dislipemia9, 10 y alteración de la función vascular11. Es claro que estas enfermedades crónicas, tales como la DM2, se pueden retrasar o prevenir, identificando a sujetos con RI. El retraso del daño se logra disminuyendo los factores de riesgo mediante cambios en el estilo de vida12 y/o el uso de agentes farmacológicos13.
Varios métodos han sido utilizados para la detección precoz de RI14-18; entre éstos, el clamp hiperinsulinémico es considerado el método de referencia para la evaluación de la sensibilidad insulínica19. Sin embargo, este método es complejo, costoso, molesto para el paciente y no aplicable a gran escala en la práctica clínica asistencial. Lo mismo es cierto para el test de tolerancia endovenosa a la glucosa en el cual se utiliza el modelo mínimo (una simplificada representación matemática), ya que se requiere del dosaje de un gran número de muestras20, 21.
El test de tolerancia oral a la glucosa (TTOG), es el más frecuentemente utilizado en la práctica clínica para el diagnóstico de RI en estudios epidemiológicos22, 23.
Se han desarrollado varios índices con los cuales se evalúa la sensibilidad insulínica mediante el dosaje de glucemia e insulinemia en ayunas (índices basales)24. Sin embargo, no está clara la correlación existente entre los índices en ayunas y los que surgen de los valores de glucemia e insulinemia en los diferentes tiempos del TTOG (índices TTOG) en pacientes con SOP. Los objetivos del presente trabajo fueron: a) evaluar la utilidad de los índices basales para el diagnóstico de RI en relación con los índices TTOG en mujeres con SOP y b) evaluar el valor predictivo de los índices basales sobre la glucemia a los 120 min postprandial (G 120).
Materiales y métodos
Pacientes
Se estudiaron 143 mujeres premenopáusicas. Ciento catorce pacientes portadoras de SOP, (rango de edad: entre 12 y 40 años) [Indice de masa corporal (IMC): 29.5 ± 0.7; rango 17.2-50] y 29 mujeres normales (rango de edad: entre 12 y 40 años) (IMC: 24.5 ± 0.7; rango: 16.4-33.3); las pacientes de este último grupo reunieron los siguientes criterios: ciclos menstruales regulares, sin evidencias de hirsutismo, hiperandrogenemia o historia familiar de diabetes, y constituyeron el grupo control. Todas las pacientes se encontraban eutiroideas, normoprolactinémicas y ninguna había recibido terapia farmacológica alguna durante los tres meses previos a la iniciación del estudio. El diagnóstico de SOP se realizó por la presencia de a) amenorrea u oligomenorrea persistente de inicio puberal asociado a hirsutismo y/o acné, b) aumento de los niveles séricos de testosterona y/o delta-4-androstenediona y/o c) evidencia ecográfica de ovarios aumentados de tamaño y poliquísticos. Se excluyeron las pacientes portadoras de hiperplasia suprarrenal congénita, tumor productor de andrógenos o síndrome de Cushing, mediante el uso de los estudios apropiados (dosaje de 17 OH progesterona plasmática, niveles plasmáticos de andrógenos y niveles de cortisol libre en orina de 24 h).
Protocolo de estudio
A todas las pacientes se les realizó el TTOG. Luego de tres días de una dieta conteniendo 300 g de hidratos de carbono, se extrajeron muestras de sangre en condiciones basales (12 h de ayuno) y 30, 60, 90 y 120 minutos luego de la ingesta de 75 g de glucosa. Las muestras de plasma fueron inmediatamente separadas en alícuotas para la determinación de glucosa plasmática (Glu). Método utilizado: Glucosa-oxidasa y procesadas en autoanalizador Alcyon 300i (Abbott), el coeficiente de variación porcentual (CV%) intra-ensayo no fue mayor al 1.3%, e interensayo de 1.9%. El resto de las alícuotas se mantuvieron congeladas (- 20° C) hasta la determinación de los niveles plasmáticos de insulina (Ins). Método utilizado: MEIA (Abbott) y procesadas en un autoanalizador Axzym (Abbott), el coeficiente de variación porcentual (CV%) intraensayo no fue mayor al 2.6% e interensayo de 2.9%. Todas las determinaciones se realizaron por duplicado.
Análisis de los datos
Se determinaron los siguientes índices:
Indices basales:
Indice glucosa/insulina: Glu ay (mg/dl)/Ins ay (µUI/ml)25
HOMA (homeostasic model assessment; modelo homeostático); Glu ay (mm/l) X Ins ay (µUI/ml)/22.526.
QUICKI (quantitative insulin sensitivity check index: Indice cuantitativo de sensibilidad insulínica): 1/(log Ins ay + log Glu ay)27.
Indices TTOG:
AI (Area bajo la curva de insulina): 30 X (Ins ay + Ins 30´+ Ins 60´+ Ins 90´+ Ins 120´) (µUI/ml)28.
ISI composite (ISI) (Indice de sensibilidad insulínica)22
![]()
Gay: Glucosa plasmática medida en ayunas
Iay: Insulina plasmática medida en ayunas
PGTTOG: Valor promedio de todas las glucemias medidas durante el TTOG
PITTOG: Valor promedio de todas las insulinemias medidas durante el TTOG
Se determinaron los valores de corte de los diferentes índices para el diagnóstico de RI, por el valor de los percentilos 3 o 97 del grupo control (Tablas 1 y 2).
TABLA 1.- Valores de corte de los índices de sensibilidad insulínica (los valores corresponden al percentilo 3 o 97 del grupo control)
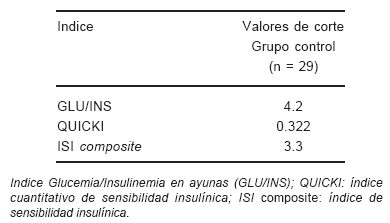
TABLA 2.- Valores de corte de los índices de resistencia insulínica (los valores corresponden al percentilo 3 o 97 del grupo control)
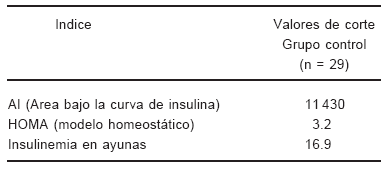
Se utilizó un valor de corte de 140 y 200 mg/dl para el diagnóstico de intolerancia a la glucosa (IG) y DM 2 respectivamente29.
Los resultados fueron evaluados por el test de correlación de Pearson.
Resultados
Se observó una correlación significativa entre los niveles de insulina en ayunas y los índices basales [HOMA (modelo homeostático), QUICKI (índice cuantitativo de sensibilidad insulínica) y G/I (glucemia de ayuno / insulina de ayuno)] (Tabla 3) (Fig. 1).
TABLA 3.- Correlaciones entre todos los índices


Fig. 1.- Correlación entre los niveles de insulina en ayunas y el índice HOMA en el grupo completo de pacientes. Las líneas expresan los valores de corte de cada índice. r = 0.976. P< 0.01
Los índices basales (HOMA, QUICKI y G/I) correlacionaron en forma significativa con los índices TTOG [(AI (área bajo la curva de insulina), ISI (índice de sensibilidad insulínica)] (Tabla 3) (Figs. 2 y 3).

Fig. 2.- Correlación entre los índices HOMA e ISI composite en el grupo completo de pacientes. Las líneas expresan los valores de corte de cada índice. r = -0.647. P< 0.01

Fig. 3.- Correlación entre los niveles de insulina en ayunas y el índice ISI composite en el grupo completo de pacientes. La línea horizontal expresa el valor de corte de ISI composite. Las líneas verticales expresan los niveles de insulinemia entre los cuales es necesario realizar el TTOG para el diagnóstico de RI. r = -0.679. P< 0.01
A pesar de las correlaciones significativas, hubo 9 pruebas con índices basales normales que presentaron índices TTOG patológicos.
Los resultados de algunas de estas nueve pruebas pueden verse en la Tabla 4.
TABLA 4.- Ejemplos de los valores del TTOG e índices en ayunas y TTOG, de cinco pacientes con índices en ayunas normales e índices TTOG compatibles con RI

Los niveles basales de insulina de estas pacientes se encontraban entre 9.9 y 18.4 µUI/ml y tres de las mismas presentaban G 120, indicativa de intolerancia a la glucosa (IG) (Tabla 4).
Utilizando los valores de corte de todos los índices (basales y TTOG), ninguna paciente con niveles de insulina en ayunas menores a 9.9 µUI/ml presentó RI, mientras que todas las pacientes con niveles de insulina mayores a 18.4 µUI/ml fueron diagnosticadas como resistentes a la insulina (Fig. 3).
Catorce de las 114 pacientes con SOP (12.2%), presentaron G 120 ³ 140 mg/dl. Doce de las pacientes (10.5%), presentaron niveles plasmáticos de G 120 ³ 140 mg/dl, (indicativos de IG) y dos pacientes (1.8%), presentaron niveles de G 120 ³ 200 mg/dl (indicativos de DM2). Si bien observamos correlaciones significativas entre las glucemias en ayunas y los índices basales y las glucemias a los 120 min postprandial, teniendo en cuenta los valores de corte para diagnóstico de RI de nuestro grupo control, en 4 de 14 casos (35%), los valores basales no hicieron sospechar la posibilidad del diagnóstico de IG y diabetes mellitus tipo 2 (DM2) (Fig. 4).

Fig. 4.- Niveles de insulina plasmática en ayunas (INS ayunas) y glucemia a los 120 min del TTOG (G 120) de las catorce pacientes con G 120 ³ 140 mg/dl.
Discusión
En el presente trabajo hemos determinado un rango de niveles plasmáticos de insulina en ayunas, entre los cuales se hace necesario realizar un TTOG con medición de glucemia e insulinemia en todos los tiempos, para calcular los índices TTOG que permitirían realizar el diagnóstico de RI, en un subgrupo específico de pacientes con SOP.
El clamp hiperinsulinémico es considerado el método de referencia para la evaluación de la sensibilidad insulínica19. Consiste en realizar una infusión con insulina mientras se evita la hipoglucemia mediante la administración endovenosa de glucosa. La dosificación de la administración de glucosa necesaria para mantener el nivel de normoglucemia medida en mg/kg.min permite cuantificar el efecto biológico de la insulina. El alto costo de este test, así como la necesidad de un operador ampliamente experimentado, lo hacen poco práctico para el uso sistemático en la evaluación clínica. Habitualmente se utiliza la correlación existente entre el clamp y los índices basales y TTOG, para evaluar la utilidad clínica de éstos últimos. Sin embargo, el clamp está diseñado para medir la utilización periférica de glucosa30 debido a que durante el mismo, la producción hepática de glucosa está totalmente suprimida. Los índices basales evalúan la sensibilidad hepática a la insulina, ya que en condiciones de ayuno los niveles plasmáticos de glucosa están determinados por la producción hepática basal de glucosa, la cual está inversamente relacionada con la sensibilidad hepática a la insulina31, mientras que la evaluación de las concentraciones de glucosa e insulina luego de una carga de glucosa (TTOG), proveen una estimación más certera de la sensibilidad insulínica corporal total (hepática y periférica)32.
Varios investigadores han encontrado una buena correlación entre la sensibilidad insulínica medida por el clamp hiperinsulinémico y los índices basales resultantes de la glucemia e insulinemia en ayunas (QUICKI, HOMA)31, 33-35, lo cual podría explicarse por la buena correlación que habitualmente existe entre la sensibilidad hepática y muscular a la insulina22.
A pesar de esto último, ha sido demostrado que existe un número significativo de individuos que presentan sensibilidad hepática a la insulina normal o casi normal, quienes sin embargo tienen resistencia periférica a la insulina y viceversa22.
En nuestro grupo de pacientes con SOP, encontramos que los índices de ayunas (índices basales) son útiles para el diagnóstico de RI, y que tienen buena correlación con los índices derivados del TTOG. Sin embargo, al evaluar individualmente a las pacientes, utilizando los valores de corte para el diagnóstico de resistencia insulínica, de los valores derivados de los percentilos 3 y 97 de nuestra población control, que concuerdan con los publicados por otros autores25, 36-38, pudimos observar que entre las mujeres que presentaron niveles plasmáticos de insulina en ayunas entre 9.9 y 18.4 Ul/ml, hubo un subgrupo con índices en ayunas normales que presentaban índices TTOG con evidencia de resistencia insulínica. Teniendo en cuenta entonces que los índices basales miden situaciones metabólicas diferentes que los índices TTOG, probablemente las pacientes que no pudieron ser diagnosticadas con los niveles de glucemia e insulinemia en ayunas, se encuentren en el grupo que presenta sensibilidad hepática a la insulina conservada con alteración de la sensibilidad periférica.
El SOP está caracterizado por una forma aparentemente única de resistencia insulínica, asociado a otros factores que podrían afectar la sensibilidad insulínica, como los ácidos grasos libres y los niveles de andrógenos. La evaluación de la correlación entre los índices basales y el clamp hiperinsulinémico-euglucémico en este grupo de pacientes muestra resultados contradictorios24, 39; sin embargo, todos los autores coinciden en que los índices TTOG tienen mejor correlación con el clamp40, probablemente porque ambos miden la utilización periférica de glucosa.
Ha sido publicado que las pacientes portadoras de SOP no obesas, pueden presentar niveles de insulina normales en ayunas, con hiperinsulinemia posterior a la sobrecarga oral de glucosa40-42. Nuestro subgrupo de pacientes con índices en ayunas normales e índices TTOG patológicos presentaban todas un IMC > 26, por lo que no podemos atribuir al peso corporal las diferencias observadas entre los índices basales y los índices TTOG.
En el grupo de pacientes estudiadas, obtuvimos un 10.5% de IG y un 1.8% de DM2 diagnosticadas por los niveles de G 120. Estos porcentajes son similares a un estudio recientemente publicado, realizado en mujeres de la cuenca del Mediterráneo43. Sin embargo, se encuentran muy por debajo de los porcentajes publicados por Legro y colaboradores, quienes encontraron un 31.1% de prevalencia de IG y 7.5% de DM2 en mujeres con SOP6. Las diferencias probablemente se deban a diferente alimentación, razas, estilos de vida y al hecho de que nuestras pacientes, presentaron una media de IMC menor.
Si bien tanto los niveles de glucemia en ayunas, como todos los índices basales, tuvieron una correlación significativa con los niveles de G 120, en cuatro de las catorce pacientes que presentaron una G 120 patológica, los valores basales no hicieron sospechar esta posibilidad.
La IG es un factor de riesgo mayor para DM2 así como un factor de riesgo independiente de enfermedad cardiovascular y muerte súbita, particularmente en mujeres44. Muchos trabajos han demostrado que los cambios en el estilo de vida, así como algunos tratamientos farmacológicos, pueden retrasar el desarrollo de DM2 en individuos con IG45, 46. Por esto último, actualmente existe un renovado interés en identificar individuos con riesgo de IG. Múltiples grupos profesionales incluyendo la Asociación Americana de Diabetes29, el Colegio Americano de Obstetras y Ginecólogos47, la Unión de la Sociedad Americana de Medicina Reproductiva y el Grupo de Trabajo de Consenso de la Sociedad Europea de Reproducción Humana y Endocrinología3, han publicado las guías recomendando la evaluación de mujeres con SOP, para descartar IG y DM2 con el uso del TTOG.
Según nuestros resultados, creemos que es de fundamental importancia realizar G120 a todas las pacientes con SOP, ya que por el momento no existe un valor en ayunas que prediga la presencia de G 120 patológica.
En conclusión, en pacientes con SOP, los índices que evalúan la glucemia e insulinemia en ayunas, son útiles para el diagnóstico de RI, pero debido a que miden diferentes situaciones metabólicas que los índices derivados del TTOG, la evaluación de estos últimos sería necesaria en un subgrupo determinado de pacientes. En base a nuestros resultados, proponemos el dosaje de glucemia e insulinemia en todos los tiempos del TTOG para diagnóstico de RI en aquellas pacientes que presenten niveles plasmáticos de insulina en ayunas entre 9.9 y 18.4 Ul/ml, así como el dosaje de GLU 120 para descarte de IG y DM2 a todas las pacientes con SOP.
Bibliografía
1. Tsilchorozidou T, Overton C, Conway GS. The pathology of polycystic ovary syndrome. Clin Endocrinol 2004; 60: 1-17.
2. Dunaif A, Givens JR, Haseltine FP, Merriam GR. The Polycystic Ovary Syndrome. Cambridge: Blackwell Scientific 1992.
3. Rotterdam ESHRE/ASRM-Sponsored PCOS Consensus Workshop Group. Revised 2003 consensus on diagnostic criteria and long-term health risks related to polycystic ovary syndrome. Fertil Steril 2004; 81: 19-25.
4. Knochenhauer ES, Key TJ, Kahsar-Miller M, Waggoner W, Boots LR, Azziz R. Prevalence of the polycystic ovary syndrome in unselected black and white women of the Southeastern United States: a prospective study. J Clin Endocrinol Metab 1998; 83: 3078-82.
5. Asunction M, Clavo RM, San Millan JI, Sancho J, Avila S, Escobar-Morreale HF. A prospective study of the prevalence of the polycystic ovary syndrome in unselected Caucasian women from Spain. J Clin Endocrinol Metab 2000; 85: 2434-8.
6. Legro RS, Kunselman AR, Dodson WC, Dunauf A. Prevalence and predictors of risk for type 2 diabetes mellitus and impaired glucose tolerance in polycystic ovary syndrome: a prospective, controlled study in 254 affected women. J Clin Endocrinol Metab 1999; 84: 165-9.
7. Norman RJ, Masters L, Milner CR, Wang JX, Davies MJ. Relative risk of conversion from normoglycaemia to impaired glucose tolerance or non-insulin dependent diabetes mellitus in polycystic ovarian syndrome. Hum Reprod 2001; 9: 1995-8.
8. Palmert MR, Gordon CM, Kartashov AI, Legro RS, Emans SJ, Dunaif A. Screening for abnormal glucose tolerance in adolescents with polycystic ovary syndrome. J Clin Endocrinol Metab 2002; 87: 1017-23.
9. Rajkhowa M, Neary RH, Kumpatla P, et al. Altered composition of high density lipoproteins in women with polycystic ovary syndrome. J Clin Endocrinol Metab 1997; 82: 3389-94.
10. Mather KJ, Kwan F, Corenblum B. Hyperinsulinemia in polycystic ovary syndrome correlated with increased cardiovascular risk independent of obesity. Fertil Steril 2000; 73: 150-6.
11. Kelly CJG, Speirs A, Gould GW, Petrie JR, Lyall H, Connell JMC. Altered vascular function in young women with polycystic ovary syndrome. J Clin Endocrinol Metab 2002; 87: 742-6.
12. Tuomilehto J; Lindstrom J; Ericksson JG, et al. Prevention of type 2 diabetes mellitus by changes in lifestyle among subjects with impaired glucose tolerance. N Engl J Med 2001; 344: 1343-50.
13. Buchanan TA; Xiang AH; Peters RK, et al. Preservation of pancreatic beta-cell function and prevention of type 2 diabetes by pharmacological treatment of insulin resis-tance in high-risk hispanic women. Diabetes 2002; 51: 2796-803.
14. DeFronzo RA, Tobin JD, Andres R. Glucose clamp technique: a method for quantifying insulin secretion and resistance. Am J Physiol 1979; 273: E214-E23.
15. Shen SW, Reaven GM, Farquhar JW. Comparison of impedance to insulin-mediated glucose uptake in normal subjects and in subjects with latent diabetes. J Clin Invest 1970; 49: 2151-60.
16. Harano Y, Ohgaka S, Hidaka H, et al. Glucose, insulin and somatostatin infusion for the determination of insulin sensitivity. J Clin Endocrinol Metab 1977; 45: 1124-7.
17. Bergman RN, Phillips LS, Cobelli C. Physiologic evaluation of factors controlling glucose tolerance in man. J Clin Invest 1981; 68:1456-67.
18. Kahn SE, Prigeon RL, Mcculloch DK, et al. Quantification of the relationship between insulin sensitivity and [beta]-cell function in human subjects. Diabetes 1993; 42: 1663-72.
19. American Diabetes Association. Consensus Development Conference on Insulin Resistance. Diabetes Care 1998; 21: 310-4.
20. Saad MF, Anderson RL, Laws A, et al. A comparison between the minimal model and the glucose clamp in the assessment of insulin sensitivity across the spectrum of glucose tolerance. Diabetes 1994; 43: 1114-21.
21. Cobelli C, Bettini F, Caumo A, Quon MJ. Overestimation of minimal model glucose effectiveness in presence of insulin response is due to undermodelling. Am J Physiol 1998; 275: E1031-E36.
22. Matsuda M, DeFronzo RA. Insulin sensitivity indices obtained from oral glucose tolerance testing: comparison with the euglycemic insulin clamp. Diabetes Care 1999; 22:1462-70.
23. Stumvoll M, Mitrakou A, Pimenta W, et al. Use of the oral glucose tolerance test to assess insulin release and insulin sensitivity. Diabetes Care 2000; 23: 295-301.
24. Škrha J, Haas T, Šindelka G, et al. Comparison of the insulin action parameters from hyperinsulinemic clamps with homeostasis model assessment and QUICKI Indexes in subjects with different endocrine disorders. J Clin Endocrinol Metab 2004; 89: 145-51.
25. Legro RS, Finegood D, Dunaif A. A gasting glucose to insulin ratio is a useful measure of insulin sensitivity in women with polycystic ovary syndrome. J Clin Endocrinol Metab 1998; 83: 2694-8.
26. Matthews DR, Hosker JP, Rudenski AS, Naylor BA, Treacher DF, Turner RC. Homeostasis model assessment: insulin resistance and beta-cell function from fasting plasma glucose and insulin concentrations in man. Diabetologia 1985; 28: 412-9.
27. Katz A, Nambi SS, Mather K, et al. Quantitative insulin sensitivity check index: a simple, accurate method for assessing insulin sensitivity in humans. J Clin Endocrinol Metab 2000; 85: 2402-10
28. Tai MM. A mathematical model for the determination of total area under glucose tolerance and other metabolic curves. Diabetes Care 1994; 17: 152-4.
29. American Diabetes Association. Screening for type 2 diabetes. Diabetes Care 2004; 27, (Suppl1): S11-S14.
30. Bergman RN, Finegood DT, Ader M. Assessment of insulin sensitivity in vivo. Endocr Rev 1985; 6: 45-86.
31. Ferrannini E, Simonson DC, Katz LD, et al. The disposal of an oral glucose load in patients with non-insulin-dependent diabetes. Metabolism 1988; 37: 79-85.
32. Mitrakou A, Kelley D, Veneman T, et al. Contribution of abnormal muscle and liver glucose metabolism to postprandial hyperglycemia in NIDDM. Diabetes 1990; 39: 1381-90.
33. Bonora E, Kiechel S, Willeit J, et al. Prevalence of insulin resistance in metabolic disorders: the Bruneck Study. Diabetes 1998;47: 1643-9.
34. Rabasa-Lhoret R, Bastard JP, Jan V, et al. Modified quantitative insulin sensitivity check index is better correlated to hyperinsulinemic glucose clamp than other fasting-based index of insulin sensitivity in different insulin-resistant states. J Clin Endocrinol Metab 2003; 88:4917-23
35. Uwaifo GI, Fallon EM, Chin J, Elberg J, Parikh SJ, Yanovski JA. Indices of insulin action, disposal, and secretion derived from fasting samples and clamps in normal glucose-tolerant black and white children. Diabetes Care 2002; 25: 2081-7.
36. Parra A, Ramírez A, Espinosa de los Monteros A. Fasting glucose/insulin ratio. An index to differentiate normofrom hyperinsulinemic women with polycystic ovary syndrome. Rev Invest Clin 1994; 46: 363-8.
37. Ortega-González S, Luna S, Hernández L, et al. Responses of serum androgen and insulin resistance to metformin and pioglitazone in obese, insulin-resistant women with polycystic ovary syndrome. J Clin Endocrinol Metab 2005; 90:1360-5.
38. Baillargeon JP, Jakubowicz DJ, Iuorno MJ, Jakubowicz S, Nestler JE. Effects of metformin and rosiglitazone, alone and in combination, in nonobese women with polycystic ovary syndrome and normal indices of insulin sensitivity. Fertil Steril 2004; 82: 893-902.
39. Diamanti-Kandarakis E, Kouli C, Alexandraki K, Spina G. Failure of mathematical indices to accurately assess insulin resistance in lean, overweight, or obese women with polycystic ovary syndrome. J Clin Endocrinol Metab 2004; 89: 1273-6.
40. Altuntas Y, Bilir M, Ozturk B, Gundogdu S. Polycystic ovary disease. Comparison of various simple insulin sensitivity and b-cell function indices in lean hyperan-drogenemic and normoandrogenemic young hirsute women. Fertil Steril 2003; 80: 133-42.
41. Vrbikova J, Bendlova B, Hill M, Vankova M, Vondra K, Starka L. Insulin sensitivity and beta-cell function in women with polycystic ovary syndrome. Diabetes Care 2002; 25: 1217-22.
42. Osei K. Increased basal glucose production and utilization in nondiabetic first-degree relatives of patients with NIDDM. Diabetes 1990; 39: 597-601.
43. Gambineri A, Pelusa C, Manicardi E, et al. Glucose Intolerance in a Large Cohort of Mediterranean Women With Polycystic Ovary Syndrome. Phenotype and Associated Factors. Diabetes 2004; 53: 2353-8.
44. The DECODE Study Group. Glucose tolerance and mortality: comparison of WHO and American Diabetes Association diagnostic criteria. Lancet 1999; 354: 617-21.
45. Knowler WC, Barrett-Connor E, Fowler SE, et al. Diabetes Prevention Program Research Group. Reduction in the incidence of type 2 diabetes with lifestyle intervention or metformin. N Engl J Med 2002; 346: 393-403.
46. Lindstrom J, Louheranta A, Mannelin M, et al. Finnish Diabetes Prevention Study Group. The Finnish Diabetes Prevention Study (DPS): Lifestyle intervention and 3-year results on diet and physical activity. Diabetes Care 2003; 26: 3230-6.
47. ACOG 2002. ACOG Practice Bulletin: clinical management guidelines for obstetrician-gynecologists: number 41, polycystic ovary syndrome. Obstet Gynecol 2002; 100: 1389-402.
Recibido: 26-12-2005
Aceptado: 23-08-2006














