Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Medicina (Buenos Aires)
versión impresa ISSN 0025-7680versión On-line ISSN 1669-9106
Medicina (B. Aires) v.67 n.2 Buenos Aires mar./abr. 2007
Epidemiología de los enterovirus asociados a enfermedades neurológicas
Daniel M. Cisterna1, Gustavo Palacios2, Karina Rivero1, Daniela Girard1, Cristina Lema1, María Cecilia Freire1
1 Servicio de Neurovirosis, Instituto Nacional de Enfermedades Infecciosas ANLIS Dr. Carlos G. Malbrán, Buenos Aires;
2 Jerome L. and Dawn Greene Infectious Disease Laboratory, Mailman School of Public Health, Columbia University, New York, USA
Dirección postal: Dr. Daniel M. Cisterna, Servicio de Neurovirosis, Instituto Nacional de Enfermedades Infecciosas, ANLIS Dr. Carlos G. Malbrán, Av. Vélez Sarsfield 563, 1281 Buenos Aires. Fax: (54-11) 4302-5064
e-mail: dcisterna@anlis.gov.ar
Resumen
El presente estudio describe los resultados de la investigación de los enterovirus humanos (HEV) mediante cultivo celular y reacción en cadena de la polimerasa y su tipificación molecular en 2167 casos de parálisis fláccida aguda, meningitis aséptica y encefalitis aguda, obtenidos entre 1991 y 1998 en la Argentina. La frecuencia de detección de HEV en parálisis fláccida aguda fue 19.5% (130/666) y de poliovirus Sabin 5.4% (36/666). La tasa de detección de HEV en los casos de meningitis fue 28.8% (231/801) y en encefalitis 3.0% (21/700). El grupo etario más afectado por las meningitis fue entre 1 y 9 años (75.3%) y en los casos de parálisis fláccida aguda, de 1 a 4 años (58%). En muestras de brotes de meningitis se identificó echovirus (E) 4, E9, E30 y E17, y en casos esporádicos virus coxsackie A (CAV) 2, B (CBV) 2 y CBV5, E7, E11, E19, E24 y E29, y enterovirus (EV) 71. Finalmente, en casos de encefalitis se detectó E4, E7 y E24. En casos de parálisis fláccida aguda se identificaron 28 serotipos distintos de enterovirus no polio. En la Argentina y en otros países latinoamericanos existe escasa información acerca de la circulación de los HEV y su relación con diversas enfermedades neurológicas. Este estudio proporciona información que puede servir como base para posteriores investigaciones.
Palabras clave: Meningitis; Encefalitis; Parálisis fláccida; Enterovirus
Abstract
Epidemiology of enterovirus associated with neurologic diseases. This report describes the results of human enterovirus (HEV) detection and characterization using cell culture, polymerase chain reaction and molecular typing in 2167 samples obtained from acute flaccid paralysis, aseptic meningitis and acute encephalitis patients, from 1991 to 1998 in Argentina. HEV were isolated in 130 out of 666 cases (19.5%) and 36 out of 666 (5.4%). HEV RNA was detected in 28.8% (231/801) and 3.0% (21/700) of the patients with meningitis and encephalitis, respectively. Children with ages ranging from 1 to 9 years accounted for 75.3% of the meningitis cases and from 1 to 4 years for 58% of acute flaccid paralysis patients. Echovirus 4 (E4), E9, E30 and E17 were identified from meningitis outbreaks. Coxsackievirus A2 (CAV2), CBV2, CBV5, E7, E11, E19, E24, E29 and enterovirus 71 were recovered only from sporadic cases. Three different serotypes were identified in encephalitis patients: E4, E7 and E24. A total of 28 different serotypes of non-polio enteroviruses were detected from acute flaccid paralysis cases. The information here presented contributes to improving our knowledge about enteroviruses epidemiology in Argentina and their relationship with different neurological diseases. This study provides valuable data that could be useful to further research.
Key words: Meningitis; Encephalitis; Flaccid paralysis; Enterovirus
Los enterovirus humanos (HEV) son un género de la familia Picornaviridae que comprende más de 90 serotipos incluyendo los poliovirus (PV), virus coxsackie A (CAV) y B (CBV), echovirus (E) y los nuevos enterovirus (EV). Son virus ubicuos siendo el hombre el único reservorio conocido. Su diseminación ocurre principalmente a través de la vía fecal-oral. En los países de clima templado, las infecciones por HEV ocurren fundamentalmente en los meses de verano y otoño. Causan una amplia variedad de enfermedades que incluye entre otras: meningitis aséptica, enfermedad paralítica, miocarditis, pleurodinia, varios cuadros exantemáticos y febriles. La mayoría de sus infecciones son asintomáticas1.
Son la causa más común de meningitis aséptica, tanto en casos esporádicos como en brotes epidémicos, y se estima que representan el 80% de los casos de causa conocida. Si bien los brotes de meningitis por HEV no se asocian con secuelas (excepto en pacientes inmuno-deprimidos) y causan enfermedades de corta duración, afectan a un elevado número de personas y producen grandes pérdidas económicas2, 3. En Argentina, el Sistema Nacional de Vigilancia Epidemiológica (SINAVE) del Ministerio de Salud, que recibe notificaciones de meningo-encefalitis desde 1970, recibió más de 500 informes de casos de meningitis virales en el año 20044. En el período 1995-1998, siete brotes de meningitis aséptica fueron notificados en distintas regiones de la Argentina5. Por otro lado, existe escasa información sobre la importancia de los HEV como agentes productores de encefalitis en nuestro país.
Como consecuencia del éxito de los planes de vacunación en Argentina, el último caso de poliomielitis asociado a poliovirus salvaje se detectó en 19846. Anualmente se detectan aproximadamente 100 casos de parálisis fláccida aguda (PFA). Más del 80% de los HEV aislados en el continente americano, mediante la vigilancia de PFA, son enterovirus no polio (EnP)7. Aunque los EnP pueden ser los agentes etiológicos de enfermedad paralítica, estos casos parecen ser circunstanciales y esporádicos. No obstante, se han notificado brotes de PFA causados por E71, CAV7 y más recientemente los E22 y E338-10.
Los métodos estándar para la identificación de PV en los casos de PFA son los ensayos de neutralización con mezclas de antisueros específicos11. Estos métodos, aunque generalmente adecuados, son muy laboriosos y demandan mucho tiempo. En los últimos años, han sido suplementados con una variedad de métodos moleculares, tales como métodos de reacción en cadena de la polimerasa con retrotranscripción (RT-PCR) genéricos para enterovirus (panEV) y poliovirus (panPV)12, 13.
El método clásico para la identificación del serotipo de los HEV se realiza mediante el uso de mezclas de sueros hiperinmunes1. Sin embargo, la complejidad, laboriosidad, escasez de reactivos y dificultades en la estandarización limitan su utilidad14. Recientemente se han desarrollado varios métodos de identificación molecular utilizando las secuencias nucleotídicas provenientes de diferentes regiones del genoma enteroviral15-17.
El objetivo de este trabajo fue describir la epidemiología de los HEV asociados a enfermedades neurológicas en Argentina. El presente estudio detalla los resultados de la investigación de HEV y su tipificación molecular en 2167 casos de meningitis aséptica, encefalitis aguda y parálisis fláccida aguda, ocurridos entre 1991 y 1998 en nuestro país.
Materiales y métodos
Muestras clínicas: Se estudiaron 666 muestras de materia fecal provenientes de casos de parálisis fláccida aguda (PFA) procedentes del Programa Nacional de Parálisis Fláccida Aguda correspondiente al Plan de Erradicación de poliovirus salvaje en las Américas (OPS/OMS)6. El resto de las muestras analizadas correspondieron a líquidos cefalorraquídeos (LCR) obtenidos de 801 casos de meningitis aséptica y 700 casos de encefalitis aguda, recibidos para su estudio en el Servicio de Neurovirosis del INEI-ANLIS Dr. Carlos G. Malbrán. Todas las muestras se obtuvieron dentro de una semana de iniciado el cuadro clínico.
Detección de enterovirus y poliovirus en casos de PFA: El estudio de los casos de PFA se realizó según el protocolo utilizado dentro de la Red de Laboratorios de Poliovirus de OPS/OMS11. Brevemente, una muestra de materia fecal de niños menores de 15 años es inoculada en líneas celulares Rd. En los aislamientos virales con efecto citopático compatible con HEV, se realiza un ensayo de neutralización para PV en cultivo celular con antisueros equinos hiperinmunes específicos. Los aislamientos neutralizados con estos antisueros se consideran PV y los no neutralizados se consideran EnP. Con el objeto de comparar los resultados obtenidos en cultivo celular, se realizó en forma retrospectiva, en los aislamientos con efecto citopático compatible con HEV, una RT-PCR genérica para HEV (panEV) y una RT-PCR genérica para poliovirus (panPV)13. Finalmente, la diferenciación intratípica de las cepas de poliovirus detectadas se realizó mediante una RT-PCR multiplex específica para poliovirus Sabin12, 13.
Detección de enterovirus en casos de meningitis y encefalitis: La detección de HEV en los casos de meningitis y encefalitis se realizó en forma prospectiva, en una muestra de LCR mediante una PCR en formato anidado (RT-nPCR) específica para HEV. Este método, que amplifica una porción de la región 5' no codificante del genoma viral, permite determinar la presencia de cualquiera de los serotipos conocidos de HEV18.
En los años 50, las cepas salvajes de PV eran importantes agentes causantes de meningitis y, menos frecuentemente, de encefalitis. Sin embargo, en nuestro país, gracias a las campañas nacionales de vacunación, las cepas salvajes fueron erradicadas desde 1984 y actualmente sólo circulan cepas de origen vacunal (Sabin). Estas cepas infrecuentemente se asocian a este tipos de trastornos neurológicos19. En consecuencia, en este estudio, los HEV detectados en los casos de meningitis y encefalitis se consideraron como EnP.
Tipificación molecular de los EnP: La tipificación molecular de los serotipos de HEV se realizó en forma retrospectiva mediante la secuenciación parcial de la región 3´terminal del gen que codifica la proteína VP1. Esta región se amplificó utilizando dos estrategias: (i) en los aislamientos de HEV obtenidos de los casos de PFA se usó una RT-PCR que utilizó dos juegos de iniciadores 011/012-040 y 222/187-188-18915; (ii) la tipificación de los HEV detectados en los casos de meningitis y encefalitis se realizó directamente desde el LCR mediante una RT-nPCR16. El producto de la amplificación se secuenció en ambos sentidos con el sistema comercial Big Dye Terminator Cycle Sequencing Ready Reaction Kit (Applied Biosystems Inc., Foster City, California, EE.UU.). Las secuencias nucleotídicas obtenidas se editaron utilizando el alineamiento en aminoácidos como una guía para obtener un grupo de datos definitivos (2902-3279 nt, de acuerdo a la cepa de referencia de echovirus 7 Wallace). El serotipo enteroviral se determinó comparando la secuencia de 378 nt obtenida, con las secuencias de la misma región disponibles en la base de datos obtenida de internet (GenBank). La identidad de la secuencia de VP1 en al menos un 75% con cualquier cepa prototípica de enterovirus y el segundo índice más alto de identidad inferior al 70%, indica que el aislamiento es de un serotipo homólogo20.
Análisis estadístico: Los intervalos de confianza de los promedios de las edades de los casos de meningitis, encefalitis y parálisis fláccida asociados a enterovirus se calcularon mediante el paquete estadístico STATA 8.0. La comparación de los diferentes grupos etarios en los casos de meningitis, encefalitis o PFA asociados a enterovirus se realizó mediante eltest no paramétrico de Kruskel-Wallis. Las comparaciones entre sexo y edad en los mismos casos y los análisis de estacionalidad se realizaron mediante el método de Chi cuadrado (STATA 8.0). Se consideró un resultado significativo cuando p<0.05.
Resultados
En los casos de PFA se detectaron 181 (27.2%) aislamientos con efecto citopático compatible con HEV. Mediante el ensayo de neutralización con antisueros poliovirus-específicos, 31 (17.1%) cepas se identificaron como PV; mientras que 150 fueron consideradas EnP. Sin embargo, quince (10.0%) de estos 150 aislamientos negativos en el ensayo de neutralización para PV, fueron negativos por panEV. En los 135 aislamientos panEV-positivos restantes, se identificaron 5 (3.7%) PV mediante panPV. Estos resultados fueron confirmados por secuenciación nucleotídica parcial de VP1. La frecuencia de detección de EnP en PFA fue de 19.5% (130/666), con un rango de 9.3-46.4% entre 1991-98. La frecuencia de detección de PV fue de 5.4% (36/666), rango 0-18.7%.Todas las cepas de PV detectadas en este estudio fueron de origen vacunal (Sabin).
Los HEV son los agentes etiológicos en la Argentina del 28.8 % (231/801) de los casos de meningitis aséptica, con un rango de 2.2-36.4% entre 1991-98. La tasa de detección de HEV en los casos de encefalitis fue de 0.9-7.1%, con un promedio de 3.0% (21/700). En conclusión, en 2167 casos estudiados, se detectaron 382 EnP (17.6%) (Tabla 1).
TABLA 1.- Detección de enterovirus por síndrome neurológico, 1991-1998, Argentina

Las infecciones con HEV afectan fundamentalmente a la población infantil. La edad promedio de los casos de meningitis por HEV fue de 7.7 años (IC 95%: 6.6-8.9), en los de encefalitis por HEV, fue de 11.4 años (IC 95%: 3.6-18.9) y en los casos de PFA con aislamiento de HEV, la edad promedio fue 4.9 años (IC 95% 4.1- 5.7). El 92.3% de los casos de meningitis y el 80.0% de las encefalitis enterovirales se detectó en menores de 15 años. La incidencia más alta en los casos de meningitis por HEV se determinó entre 1 y 9 años (75.3%). Esta incidencia fue significativamente superior a la del grupo de 10-14 años (12.1%; p= 0.000). En los casos de PFA donde se aisló HEV, el grupo de 1-4 años tuvo la mayor incidencia (58.0%). Esta incidencia fue significativamente superior a la del grupo de 5-9 años (24.7%; p= 0.000).
Los casos de encefalitis y PFA causados por HEV se distribuyeron en forma similar entre hombres y mujeres, 47.1%-52.9% y 50.8%-49.2%, respectivamente. En los casos de meningitis, se observó un predominio de casos en hombres: (58.8%) frente a las mujeres: (41.2%), aunque esta diferencia no fue estadísticamente significativa (p =0.336).
Las meningitis asépticas por HEV mostraron una marcada estacionalidad. Se observó un aumento de casos de meningitis por enterovirus no polio en verano y otoño (78.4%, p= 0.000), posiblemente a expensas de 7 brotes epidémicos de meningitis aséptica ocurridos en ese período. No se observó estacionalidad en los HEV en los casos de PFA y encefalitis, donde el 53.8% (p=0.910) y el 28.7% (p=0.109) se detectaron entre diciembre y mayo, respectivamente.
La mayoría de los serotipos asociados a enfermedad neurológica pertenece al genotipo B. Se identificó el serotipo en 162 (43.5%) de un total de 382 EnP detectados. La especie B representó el 93.4% de los HEV tipificados, la especie C el 5.4% y la A el 1.2%.
En los casos de meningitis se identificaron 13 serotipos distintos. En muestras de brotes se identificó E4, E9, E30 y E17; en casos esporádicos CAV2, CBV2, CBV5, E7, E11, E19, E24, E29, y EV71. En los casos de encefalitis se identificaron tres serotipos diferentes (E4, E7 y E24). En los casos de PFA se observó una gran diversidad identificándose 28 distintos. Ocho serotipos representaron el 59.8% del total identificado (CBV1, CBV3, CBV5, E13, E11, E2, E20, E7).
Sólo dos serotipos se detectaron en las tres enfermedades estudiadas (E7 y E24) mientras que 6 se detectaron en casos de meningitis y parálisis fláccida aguda (EV71, E30, E19 y E11, CBV2 y CBV5). E4 se identificó en casos de meningitis y encefalitis (Fig. 1).

Fig. 1.- Serotipos de enterovirus no polio identificados en enfermedades neurológicas, Argentina, 1991-1998 (N = 149).
Discusión
En Argentina y en otros países latinoamericanos existe escasa información acerca de la circulación de los enterovirus no polio y su relación con diversas enfermedades neurológicas. Este estudio, que involucra más de 2.000 casos de enfermedad neurológica durante un período de 8 años, proporciona información valiosa que puede servir como base para posteriores investigaciones.
El avance en la erradicación mundial de la poliomielitis ha puesto énfasis en la detección e identificación de las cepas de poliovirus circulantes. En tal sentido, la tasa de aislamiento de enterovirus no polio en casos de parálisis fláccida aguda es utilizada como un indicador para evaluar la eficiencia del programa de erradicación en el laboratorio. La tasa promedio obtenida en el período en estudio (19.5%), fue ampliamente superior a la recomendada por la OPS/OMS (al menos 10%)7, demostrando la adecuada sensibilidad del sistema de vigilancia y la alta circulación de EnP acorde a las características climáticas de nuestro país.
Se ha hecho énfasis en el desarrollo de métodos más sensibles y específicos para la detección de poliovirus en este tipo de cuadros clínicos. Los ensayos de PCR que utilizan iniciadores genéricos para HEV (panEV), en conjunto con iniciadores genéricos para poliovirus (panPV) han demostrado ser muy útiles para detectar poliovirus en aislamientos clínicos procedentes de casos de PFA, especialmente en aislamientos virales que habían sido identificados como EnP por el método estándar de neutralización13. En nuestro estudio, la investigación de rutina de poliovirus fue comparada con los resultados de los métodos de panEV y panPV. El 10% de los EnP aislados en cultivo celular e identificado por efecto citopático no fue detectado por el ensayo de panEV. La diferencia en la sensibilidad podría ser explicada por diferentes factores, tales como una errónea identificación del efecto citopático en cultivo celular, aunque tampoco puede descartarse la pérdida de viabilidad de los aislamientos durante su manipulación. Cuando se investigó la presencia de poliovirus por medio de panPV, el 3.7% de los aislamientos confirmados como HEV por panEV, se identificó como poliovirus. El total de las nuevas cepas de poliovirus detectadas representó un 16% más del total de poliovirus aislados por los procedimientos estándares. Estos resultados muestran que los métodos de PCR mejoran la vigilancia de poliovirus en los países libres de poliovirus y podrían suplantar la metodología de rutina, cara, laboriosa y de menor sensibilidad.
Las cepas de poliovirus derivadas del virus vacunal (VDPV) son capaces de producir brotes en comunidades con baja cobertura vacunal21 o de persistir en individuos inmunocomprometidos22. En consecuencia, su detección y caracterización es de crucial importancia en las etapas finales de erradicación mundial. En el período en estudio, todas las cepas de poliovirus detectadas fueron de origen vacunal y de acuerdo a sus características genéticas ninguna fue un poliovirus Sabin derivado (dato no mostrado).
Si bien existen numerosos informes sobre la relación entre EnP y enfermedad paralítica, la mayoría se concentra en algunos serotipos causantes de brotes de parálisis fláccida, principalmente CAV7 y EV7123. En casos esporádicos, los serotipos más a menudo implicados han sido los CAV7, CBV1-5 y E6 y E9, y menos frecuentemente CAV4, 5 y 10 y los E1-4, E7, E11, E14, E16-18 y E3024. En nuestro estudio, los aislamientos se realizaron a partir de materia fecal y no fue posible señalar serotipos prevalentes. Por el contrario, se identificaron 28 serotipos diferentes de enterovirus. Estos EnP pueden representar la circulación natural de HEV en la población en estudio, tal como ha sido sugerido en un estudio similar realizado en Túnez25.
La meningitis aséptica es el síndrome neurológico más común de infección del SNC. En EE.UU. se informan 7000 casos por año y su incidencia se supone que es 10 veces mayor26, 27. En Argentina se informan entre 1 y 2.3 casos por 100.000 habitantes y se notifican más de 500 casos de meningitis viral por año4. Nuestros resultados muestran que los HEV son los agentes etiológicos del 28.8 % de los casos de meningitis aséptica en la Argentina. La prevalencia observada fue similar a la notificada en otros países (24-41%)28, 29.
La edad es uno de los factores más importantes en la infección enteroviral. En los casos de meningitis aséptica, los HEV afectaron fundamentalmente a la población infantil, principalmente el grupo etario de 1-9 años, con una edad promedio de 7.7 años, igualmente a lo ya informado por otros autores30-32.
Los serotipos causantes de brotes de meningitis, E4, E9 y E30 han sido también causa de brotes epidémicos en EE.UU., China y otros países en el mismo período2, 3. En Argentina, E9 y E30 también han sido identificados como agentes causales de brotes más recientemente, en 2002 y 2003. Su circulación parece ser cíclica, con períodos de entre 5 y 7 años4. Durante estos períodos de interrupción posiblemente se produce una acumulación de individuos susceptibles, resultando en la aparición de nuevos brotes de enfermedad. Dos serotipos diferentes (E30 y E17) fueron detectados simultáneamente como agentes causales de un brote de meningitis en Chascomús, provincia de Buenos Aires. Si bien no es habitual, la circulación simultánea de uno o más serotipos de HEV en situaciones de brote ya ha sido descripta33. Una probable causa para esta situación es el deterioro abrupto y general de la situación sanitaria en una determinada población (por ejemplo, en la calidad del agua), con la consiguiente aparición simultánea de brotes epidémicos por los serotipos circulantes en ese momento.
La circulación de los HEV tiende a ser estacional en climas templados, fundamentalmente en los meses de verano y otoño30. El conocimiento del patrón estacional de la actividad enteroviral es extremadamente importante para intentar su diagnóstico. Las meningitis asépticas por HEV mostraron una marcada estacionalidad, posiblemente a expensas de los brotes estudiados, a diferencia de los casos esporádicos asociados a PFA y encefalitis.
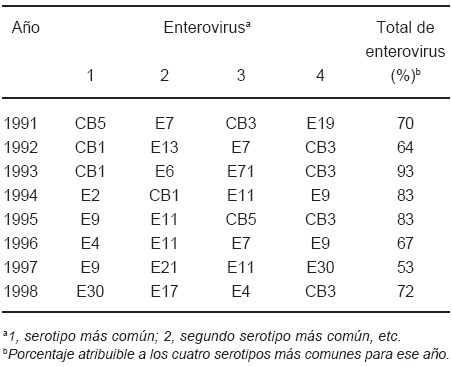
La actividad epidémica de los HEV, en el período en estudio, se manifestó a través de la prevalencia de al menos un serotipo por año (Tabla 2). Esto es claramente observable en el período 1995-1998 donde se detectaron 7 brotes de meningitis aséptica. Tres asociados a E9 (1995 y 1997), uno a E4 (1996), y dos a E30 (1998). En 1998 se observó un brote con co-circulación simultánea de E30 y E17. Finalmente, la actividad endémica de los HEV se detectó en aquellos serotipos presentes durante casi todo el período en estudio, como por ejemplo E11 o CBV3 (Tabla 2).
TABLA 2.- Serotipos de enterovirus no polio más comunes (1991-1998)
Los HEV han sido considerados como los agentes etiológicos de una pequeña fracción (2%) de las encefalitis agudas34. Numerosos serotipos son causantes de encefalitis: CAV9, CBV2, CBV5, E6 y E9 son los más frecuentemente asociados. En nuestro estudio, la tasa de detección de HEV fue del 3%, similar a la ya descripta. Sin embargo, los serotipos asociados a este cuadro en la Argentina (E4, E7 y E24) no han sido descriptos previamente como agentes causales de casos esporádicos de encefalitis. Aunque un virus específico no siempre es identificado en los casos de encefalitis, y a pesar de que el número de HEV identificados es bajo, éstos son junto con los arbovirus la segunda causa reconocida de encefalitis en otros países26.
En este estudio se identificaron 28 serotipos en los casos de PFA y 13 en los casos de de meningitis. Seis serotipos fueron detectados en ambas enfermedades, uno solo de ellos (E30), asociado a brote. Si los serotipos detectados en las muestras de heces de los casos de PFA representan la circulación asintomática de los EnP, sería esperable la detección más frecuente de los serotipos asociados a casos de meningitis. Las razones de esta marcada diferencia son desconocidas, aunque podrían estar relacionadas a múltiples factores, tales como edad y estado inmune del huésped o tropismo viral, entre otros30.
Nuestro estudio muestra al menos dos limitaciones. Primero, dada la naturaleza voluntaria y pasiva del sistema de vigilancia de meningitis y encefalitis, los resultados podrían no ser completamente representativos de todo el país. Segundo, debido a que muchos serotipos no fueron identificados el número total de los mismos podría haber sido subestimado.
En conclusión, la información presentada confirma la importancia de los HEV como agentes etiológicos de las meningitis asépticas y encefalitis agudas en la Argentina. La aplicación de técnicas de PCR podría suplantar la metodología de rutina y mejorar la vigilancia de poliovirus. Finalmente, la utilización de técnicas moleculares incrementó la capacidad para diagnosticar y tipificar las infecciones enterovirales, y contribuir al conocimiento de la epidemiología de sus serotipos.
Agradecimientos: Este estudio fue financiado por el Instituto Nacional de Enfermedades Infecciosas, ANLIS Dr. Carlos G. Malbran, Ministerio de Salud, Argentina y por el Programa de Erradicación del Poliovirus Salvaje de la Organización Panamericana de la Salud. Los autores agradecen a los Dres. Mark Pallansch y Steven Oberste del Centro de Control y Prevención de Enfermedades (CDC), EE.UU., por su colaboración en la transferencia de la tecnología para la identificación de los enterovirus asociados a casos de parálisis fláccida.
Bibliografía
1. Pallansch MA, Roos, R. P. Enteroviruses: polioviruses, coxsackieviruses, echoviruses, and newer enteroviruses. In: D. M. Knipe PMH, D. E. Griffin, R. A. Lamb, M. A. Martin, B. Roizman & S. E. Straus., ed. Fields Virology. 4th ed. Philadelphia: Lippincott Williams & Wilkins, 2001: 723-76.
2. Zhao YN, Jiang QW, Jiang RJ, Chen L, Perlin DS. Echovirus 30, Jiangsu Province, China. Emerg Infect Dis 2005; 11: 562-7.
3. Outbreaks of aseptic meningitis associated with echoviruses 9 and 30 and preliminary surveillance reports on enterovirus activity-United States, 2003. MMWR Morb Mortal Wkly Rep 2003; 52: 761-4.
4. Meningitis Virales. Boletín Epidemiológico Periódico. Ministerio de Salud y Ambiente de la Nación. Vol. 10. Buenos Aires, 2004: 5-7.
5. Cisterna DP, Palacios G, Rivero K, Girard D, Freire MC. Brotes de meningitis aséptica en la Argentina. En: VIII Congreso Argentino de Microbiología. Buenos Aires, 1998; 177.
6. de Quadros CA, Hersh BS, Olive JM, Andrus JK, da Silveira CM, Carrasco PA. Eradication of wild poliovirus from the Americas: acute flaccid paralysis surveillance, 1988-1995. J Infect Dis 1997; 175 (Suppl 1): S37-42.
7. Dietz V, Andrus J, Olive JM, Cochi S, de Quadros C. Epidemiology and clinical characteristics of acute flaccid paralysis associated with non-polio enterovirus isolation: the experience in the Americas. Bull World Health Organ 1995; 73: 597-603.
8. Figueroa JP, Ashley D, King D, Hull B. An outbreak of acute flaccid paralysis in Jamaica associated with echovirus type 22. J Med Virol 1989; 29: 315-9.
9. Grimwood K, Huang QS, Sadleir LG, et al. Acute flaccid paralysis from echovirus type 33 infection. J Clin Microbiol 2003; 41: 2230-2.
10. Hayward JC, Gillespie SM, Kaplan KM, et al. Outbreak of poliomyelitis-like paralysis associated with enterovirus 71. Pediatr Infect Dis J 1989; 8: 611-6.
11. Pinheiro FP, Kew OM, Hatch MH, da Silveira CM, de Quadros CA. Eradication of wild poliovirus from the Americas: wild poliovirus surveillance-laboratory issues. J Infect Dis 1997; 175 Suppl 1: S43-9.
12. Kilpatrick DR, Nottay B, Yang CF, et al. Serotype-specific identification of polioviruses by PCR using primers containing mixed-base or deoxyinosine residues at positions of codon degeneracy. J Clin Microbiol 1998; 36: 352-7.
13. Kilpatrick DR, Nottay B, Yang CF, et al. Group-specific identification of polioviruses by PCR using primers containing mixed-base or deoxyinosine residue at positions of codon degeneracy. J Clin Microbiol 1996; 34: 2990-6.
14. van Loon AM, Cleator GC, Ras A. External quality assessment of enterovirus detection and typing. European Union Concerted Action on Virus Meningitis and Encephalitis. Bull World Health Organ 1999; 77: 217-23.
15. Oberste MS, Maher K, Kilpatrick DR, Flemister MR, Brown BA, Pallansch MA. Typing of human enteroviruses by partial sequencing of VP1. J Clin Microbiol 1999; 37: 1288-93.
16. Casas I, Palacios GF, Trallero G, Cisterna D, Freire MC, Tenorio A. Molecular characterization of human enteroviruses in clinical samples: comparison between VP2, VP1, and RNA polymerase regions using RT nested PCR assays and direct sequencing of products. J Med Virol 2001; 65: 138-48.
17. Caro V, Guillot S, Delpeyroux F, Crainic R. Molecular strategy for 'serotyping' of human enteroviruses. J Gen Virol 2001; 82: 79-91.
18. Casas I, Klapper PE, Cleator GM, Echevarria JE, Tenorio A., Echevarria JM. Two different PCR assays to detect enteroviral RNA in CSF samples from patients with acute aseptic meningitis. J Med Virol 1995; 47: 378-85.
19. Johnson RT. Meningitis, Encephalitis and Poliomyelitis. Viral Infections of the Nervous System. Philadelphia: Lippincott-Raven, 1998: 87-132.
20. Oberste MS, Maher K, Kilpatrick DR, Pallansch MA. Molecular evolution of the human enteroviruses: correlation of serotype with VP1 sequence and application to picornavirus classification. J Virol 1999; 73: 1941-8.
21. Kew O, Morris-Glasgow V, Landaverde M, et al. Outbreak of poliomyelitis in Hispaniola associated with circulating type 1 vaccine-derived poliovirus. Science 2002; 296: 356-9.
22. Hidalgo S, Garcia Erro M, Cisterna D, Freire MC. Paralytic poliomyelitis caused by a vaccine-derived polio virus in an antibody-deficient Argentinean child. Pediatr Infect Dis J 2003; 22: 570-2.
23. Chumakov M, Voroshilova M, Shindarov L, et al. Enterovirus 71 isolated from cases of epidemic poliomyelitis-like disease in Bulgaria. Arch Virol 1979; 60: 329-40.
24. Kapoor A, Ayyagari A, Dhole TN. Non-polio enteroviruses in acute flaccid paralysis. Indian J Pediatr 2001; 68: 927-9.
25. Bahri O, Rezig D, Nejma-Oueslati BB, et al. Enteroviruses in Tunisia: virological surveillance over 12 years (1992-2003). J Med Microbiol 2005; 54: 63-9.
26. Rotbart H. Meningitis and Encephalitis. In: Rotbart H, ed. Human Enterovirus Infections. Washington, DC: American Society for Microbiology, 1995: 271-89.
27. Enterovirus surveillance-United States, 2000-2001. MMWR Morb Mortal Wkly Rep 2002; 51: 1047-9.
28. Potter PC, Donald PR, Moodie J, Slater C, Kibel MA. Meningitis in Cape Town children. S Afr Med J 1984; 66: 759-62.
29. Tee WS, Choong CT, Lin RV., Ling AE. Aseptic meningitis in children the Singapore experience. Ann Acad Med Singapore 2002; 31: 756-60.
30. Morens DM, Pallansch MA. Epidemiology. In: Rotbart H, ed. Human Enterovirus Infections. Washington: American Society of Microbiology, 1995: 3-23.
31. Freire MC, Cisterna DM, Rivero K, et al. Analysis of an outbreak of viral meningitis in the province of Tucuman, Argentina. Rev Panam Salud Publica 2003; 13: 246-51.
32. McIntyre JP, Keen GA. Laboratory surveillance of viral meningitis by examination of cerebrospinal fluid in Cape Town, 1981-9. Epidemiol Infect 1993; 111: 357-71.
33. Oprisan G, Combiescu M, Guillot S, et al. Natural genetic recombination between co-circulating heterotypic enteroviruses. J Gen Virol 2002; 83: 2193-200.
34. Steiner I, Budka H, Chaudhuri A, et al. Viral encephalitis: a review of diagnostic methods and guidelines for management. Eur J Neurol 2005; 12: 331-43.
Recibido: 2-03-2006
Aceptado: 15-09-2006














