Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Medicina (Buenos Aires)
versión impresa ISSN 0025-7680versión On-line ISSN 1669-9106
Medicina (B. Aires) v.67 n.3 Buenos Aires mayo/jun. 2007
Tratamiento de la tuberculosis. Guía práctica elaborada por la Sección Tuberculosis, Asociación Argentina de Medicina Respiratoria
Eduardo H. Abbate1, Domingo J. Palmero2, Jorge Castagnino1, Mónica Cufre1, Alejandra Doval3, Rosa Estevan1, Adriana Kuriger4, Leticia Limongi5, Eduardo Moraña2, Rosa Musella1, Carlos Pibida2, Ana María Putruele5, Susana Tanco6, Marisa Vescovo1
1 Instituto de Tisioneumonología R. Vaccarezza y Hospital F. J. Muñiz;
2 Hospital F. J. Muñiz;
3 Programa de Tuberculosis de la Provincia de Entre Ríos;
4 Programa de Tuberculosis Provincia de Buenos Aires, Zona V, Hospital F. J. Muñiz;
5 Hospital de Clínicas José de San Martín;
6 Instituto María Ferrer, Buenos Aires Asociación Argentina de Medicina Respiratoria, Sección Tuberculosis (Coordinadores María C. Brian, César B. Sáenz)
Dirección postal: Dr. Eduardo H. Abbate, Av. Vélez Sarfield 405, 1281 Buenos Aires Fax: (54-11) 4304-1129 e-mail: edu1001@fibertel.com.ar
Resumen
La tuberculosis es una enfermedad prevalente en todo el mundo. La emergencia de cepas multirresistentes del Mycobacterium tuberculosis ha incentivado la búsqueda de nuevos fármacos. Existen diversas guías de tratamiento de la enfermedad, internacionales y a nivel programático local. Un grupo de especialistas argentinos elaboró una guía práctica basada en criterios clínicos y en la bibliografía nacional e internacional sobre el tema a través de reuniones de consenso, abarcando tópicos como: fármacos antituberculosos disponibles en la Argentina, modalidades de tratamiento inicial y retratamiento, tratamiento en situaciones especiales, reacciones adversas a fármacos antituberculosos, indicaciones actuales de tratamiento quirúrgico y nuevos fármacos en estudio para el tratamiento de la enfermedad.
Palabras clave: Tuberculosis; Guía terapéutica; Tratamiento
Abstract
Tuberculosis treatment. A practical guide elaborated by the Tuberculosis Section, Argentine Association of Respiratory Medicine. Tuberculosis is a worldwide prevalent disease. The emergence of multidrug-resistant strains spurred the search for new drugs. There are several tuberculosis treatment guidelines, international and local in a programmatic approach. An Argentinean specialists panel draw practical guidelines based in clinical criteria and the local and international bibliography through consensus meetings, including issues as: antituberculosis drugs available in Argentina, initial and re-treatement modalities, special situations treatment, adverse reactions to antituberculosis drugs, current indications of surgical treatment and new drugs under study for the treatment of the disease.
Key words: Tuberculosis; Practical guidelines; Treatment
La tuberculosis (TBC) persiste como una enfermedad prevalente en la mayor parte del mundo. La OMS informó para 2004 un total de 8 918 000 casos, concentrados el 79.6% de ellos en 22 países denominados de alta carga de TBC1. Argentina es un país de mediana incidencia de la enfermedad, con 12 079 casos notificados en 20042. La emergencia y diseminación de formas resistentes del Mycobacterium tuberculosis (TBC multirresistente) ha despertado el interés por la investigación de nuevos fármacos. Existen diversas guías para el tratamiento de la TBC, tanto sensible como fármaco resistente, a nivel internacional3-5 del Programa de Control Nacional6. La Sección Tuberculosis de la Asociación Argentina de Medicina Respiratoria reunió un conjunto de especialistas argentinos en el tema a fin de conformar a través de reuniones de consenso una guía práctica basada en la experiencia clínica de los participantes.
Materiales y métodos
Un grupo de especialistas en tratamiento de la TBC, convocado por la Sección TBC de la Asociación Argentina de Medicina Respiratoria se reunió a los fines de establecer por consenso una guía práctica ajustada a los usos terapéuticos en nuestro país. Fueron nombrados dos coordinadores y se efectuaron dos reuniones preliminares en las que se distribuyó la elaboración de los distintas partes de la guía entre los participantes, se discutieron sus contenidos y en una reunión plenaria, realizada en julio de 2006, con la asistencia de todos los participantes se revisó y aprobó el documento final.
Los capítulos de esta guía comprenden: 1) Fármacos antituberculosos, 2) Tratamiento original de la TBC; 3) Esquemas de retratamiento; 4) Tratamiento de la TBC en situaciones especiales; 5) Reacciones adversas a los fármacos antituberculosos; 6) Tratamiento supervisado; 7) Nuevos fármacos antituberculosos; 8) Cirugía de la TBC y 9) Criterios de internación.
Se tomaron como base bibliográfica de la discusión las normas de tratamiento del Programa Nacional de Tuberculosis6 (no disponibles en la web), guías de tratamiento internacionales (OMS y CDC)3-5 y fue buscada sistemáticamente bibliografía relevante sobre el tema a través de MEDLINE.
Fármacos antituberculosos1, 3-10
Los fármacos para el tratamiento de la tuberculosis se dividen en dos grupos:
1) Fármacos de primera línea: isoniacida (H), ri-fampicina (R), pirazinamida (Z) etambutol (E) y estreptomicina (S) (Tabla 1), y 2) Fármacos de segunda línea o subsidiarios, utilizables en reacciones adversas y resistencias: kanamicina (Ka), amikacina (Ak), capreomicina (Cp), rifabutina (Rb), rifapentina (Rp), ácido para aminosalicílico (PAS), etionamida (Et)- protionamida (Pt), cicloserina (Cs)- terizidona (Tz), ciprofloxacina (Cipro), ofloxacina (Of), levofloxacina (Levo), moxifloxacina (Moxi) (Tabla 2).
TABLA 1.- Fármacos de primera linea para el tratamiento de la tuberculosis
TABLA 2.- Fármacos subsidiarios para el tratamiento de la tuberculosis
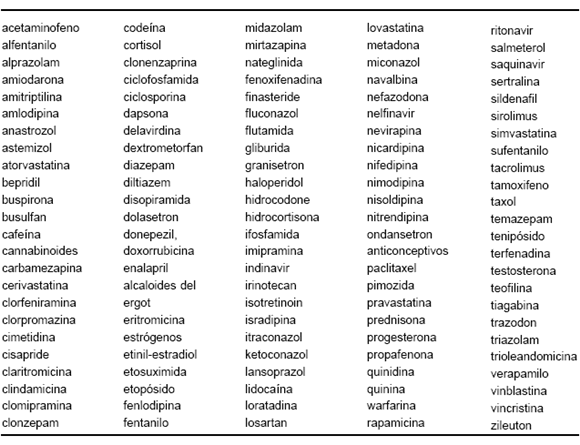
La R es un fármaco de primera línea que presenta numerosas interacciones farmacológicas, que son reseñadas en la Tabla 3.
TABLA 3.- Fármacos cuya eficacia disminuye por la acción inductora sobre el citocromo p450 (isoenzima CYP3A4) de la rifampicina3, 5, 7, 8, 12
Tratamiento original de la tuberculosis
Es el tratamiento que se aplicará a los casos de TBC que no han recibido previamente fármacos antituberculosos o que los hayan recibido por un período inferior a un mes6.
El tratamiento de la TBC se fundamenta en:
1. Obtener la rápida conversión bacteriológica del esputo para cortar la cadena de transmisión, por destrucción de los bacilos de multiplicación activa en las cavernas.
2. Evitar la selección de mutantes resistentes asociando fármacos bactericidas.
3. Esterilizar todas las lesiones para obtener la curación del enfermo y evitar recaídas. La persistencia de bacilos de multiplicación lenta debe evitarse con la prolongación del tratamiento en el tiempo.
Para lograr estos objetivos el tratamiento debe ser precoz, intensivo, combinado, prolongado y supervisado.
Esquema original de tratamiento3, 5, 6, 13: el esquema original de tratamiento está constituido por la asociación de los tres fármacos más eficaces: H, R y Z. La evidencia bacteriológica puede consultarse en cita 15. Se aconseja asociar un cuarto fármaco como el E, ya que la resistencia inicial a H y S es elevada en muchos países y se podría estar realizando una monoterapia encubierta. En Argentina la monorresistencia a H es de 1.8% y a S de 5.1% (en conjunto a H, R, E, S es de 8.0%)14. Si bien la S es bactericida, se prefiere asociar como cuarta droga el E, bacteriostático de baja resistencia inicial (1.0% en Argentina) y administración oral (excepto en meningitis TBC donde se utiliza S justamente por su acción bactericida3).
Los regímenes farmacológicos son bien tolerados, de baja toxicidad y se administran en 2 fases:
a) Fase intensiva o bactericida: dos meses de H R Z E en forma diaria que incluye 60 tomas y b) Fase de consolidación (esterilizante): cuatro meses de H R en forma diaria que corresponde a 120 tomas, o en forma intermitente (3 veces por semana) solamente si es supervisado, que corresponde a 48 tomas.
Se recomienda una fase de consolidación más prolongada, de 6 a 10 meses con H R diaria para los pacientes con formas graves de TBC pulmonar, extrapulmonar y diseminada.
El crecimiento lento del bacilo (14-24 h) permite que la administración de los fármacos sea de una toma diaria; la inhibición del crecimiento dura varios días, hecho que permite realizar un esquema intermitente trisemanal en la fase de consolidación, que facilita la supervisión del tratamiento y es más económico3, 5.
Estos esquemas terapéuticos tienen una eficacia cercana al 100% en el caso de pacientes con gérmenes sensibles y que cumplan adecuadamente con el tratamiento3, 13.
Esquemas alternativos13: en caso de no poder utilizar algún fármaco de primera línea, se aconsejan los siguientes esquemas alternativos:
Sin H: 2 REZS / 7 RE (9-12 meses según extensión lesional).
Sin R: 2 HEZS / 10 HE (12 meses).
Sin Z: 2 HRES / 7 HR (9 meses).
Sin E: 2 HRZS / 4 HR (6 meses).
Fármacos asociados en dosis fijas: existen diferentes presentaciones farmacológicas que asocian 2 (H 150 mg + R 300 mg) y 3 (H 75mg + R 150mg + Z 400mg) fármacos en dosis fijas. Son utilizadas con excelentes resultados16. Recientemente se ha elaborado una asociación de los 4 fármacos utilizados en la primera fase de tratamiento (H 75mg + R 150mg + Z 400 mg + E 275 mg ), no disponible aún en la Argentina.
Estas asociaciones son muy útiles ya que facilitan la toma de la medicación, evitan el abandono parcial de los fármacos evitando la selección de cepas resistentes (son la opción obligada en el caso de no supervisarse el tratamiento).
Uso de corticoides como adyuvantes en el tratamiento de la TBC: se utilizan empíricamente en la TBC que compromete serosas (especialmente pericarditis). Se recomienda una dosis de prednisona 0.5 mg/kg/d por 30 días. En la meningitis TBC se ha demostrado que el uso inicial de corticoides disminuye la mortalidad, no así las secuelas de la enfermedad17.
Esquemas de retratamiento
Se define retratamiento como la administración de un esquema de fármacos antituberculosos al paciente que ha recibido previamente medicación específica por más de un mes6. Las principales causas de retratamiento son3, 5, 13.
1. Abandono del tratamiento: incurre en esta situación el paciente que luego de haber tomado más de un mes de medicación, deja su tratamiento por dos meses o más.
2. Recaída: es la aparición de un cultivo de esputo positivo en un paciente que ha concluido un régimen satisfactorio (completo, adecuado, supervisado) de tratamiento.
3. Fracaso terapéutico: es la aparición de un cultivo positivo a partir del cuarto mes de tratamiento bajo DOTS (acrónimo en inglés de: tratamiento directamente observado, acortado). El cultivo del tercer mes positivo o la baciloscopia del cuarto mes positiva son circunstancias que hacen sospechar el fracaso. El fracaso terapéutico conlleva la mayor posibilidad de resistencias bacterianas. El Programa Nacional de TBC denomina fracaso operativo cuando esta misma circunstancia ocurre en un paciente sin supervisión terapéutica completa6.
Abandono, recaída y fracaso son indicaciones absolutas de efectuar pruebas de sensibilidad a los fármacos principales, a fin de detectar la aparición de resistencias, que son más probables en los casos de fracaso terapéutico13. La forma de resistencia de mayor gravedad se denomina TBC multirresistente (TBCMR), que es la provocada por cepas de Mycobacterium tuberculosis resistentes a H + R como mínimo, y que compromete los resultados del tratamiento.
Conducta terapéutica en el retratamiento: antes de decidir una conducta terapéutica deben efectuarse:
1. Una detallada historia de los fármacos tomados previamente por el paciente.
2. Las pruebas de sensibilidad (antibiograma).
Se consideran indicaciones de antibiograma las siguientes3: a) fracaso terapéutico (definido como la persistencia del cultivo positivo al cuarto mes de tratamiento); b) abandono (suspensión del tratamiento mayor a dos meses); c) recaídas (aparición de cultivo positivo luego del alta médica); pacientes con HIV/sida por la mayor frecuencia de TBCMR en esta población y e) contactos de pacientes con TBCMR.
La realización de antibiograma implica un tiempo de espera que depende de la abundancia bacilar de la muestra y oscila entre 30 a 90 días para los métodos tradicionales y 15-30 días para los métodos rápidos. La determinación de la sensibilidad a S, H, R, E es suficiente para el enfoque inicial del paciente con resistencias. Un antibiograma a mayor número de fármacos suele realizarse en laboratorios de referencia.
Ante un posible caso de multirresistencia se pueden adoptar dos conductas:
1) Prescripción del mismo esquema terapéutico hasta conocer el antibiograma.
2) Administrar tres fármacos adicionales que el paciente no haya recibido previamente. Esta opción es la recomendable cuando las formas clínicas son avanzadas y/o la gravedad del paciente lo justifique.
Una vez confirmada por el antibiograma la o las resistencias, éstas pueden ser:
1. Monorresistencia: cepas de M. tuberculosis resistentes a un fármaco. Los esquemas alternativos citados en tratamiento original son válidos en estas situaciones.
2. Polirresistencia: cepas de M. tuberculosis resistentes a dos o más fármacos, no incluyendo resistencia asociada a R + H.
3. Multirresistencia: ya definida.
A su vez, estas resistencias pueden presentarse en pacientes sin tratamiento previo (antes denominadas primarias o iniciales) o con tratamiento previo (antes denominadas adquiridas)13.
Tanto en poli como en multirresistencia se aconseja utilizar un esquema "a medida" que incluya tres a cuatro fármacos por vía oral asociados a un inyectable (amino-glucósido o capreomicina) a los que el antibiograma muestre sensibilidad. El tratamiento debe ser siempre supervisado (DOT).
El esquema se constituye con una fase "inicial" de una duración estimada de 2 a 6 meses que incluya el inyectable (cuando la fase inicial supere los 2 meses, debe aplicarse en forma intermitente bi o trisemanal para disminuir su toxicidad) y una "fase de continuación" con los fármacos orales. La duración del tratamiento es como mínimo de 18 meses a partir de obtener el primer cultivo negativo (con no menos de seis cultivos negativos en ese período). La tasa de recaídas esperable con regímenes que incluyan fármacos subsidiarios es superior al 10%4, 9.
Debe considerarse que un precepto básico en retra-tamientos es evitar el denominado por Crofton "síndrome de adición", consistente en el agregado de un fármaco por vez a un esquema con fracaso terapéutico18.
Existe la posibilidad, en países con escasos recursos de bacteriología, de utilizar esquemas fijos de retratamiento teniendo en cuenta encuestas nacionales de resistencia, pero la evidencia posteriormente ha demostrado que es preferible el empleo de regímenes a medida según las pruebas de sensibilidad y los antecedentes de tratamientos previos19, 20. La Argentina cuenta con una excelente red de bacteriología de la TBC, por lo que no surge la necesidad de emplear permanentemente esquemas fijos de retratamiento en TBCMR.
Previo a iniciar el tratamiento de una TBCMR y en caso de no contar con experiencia suficiente, se aconseja requerir asesoramiento a un centro especializado.
Tratamiento de la TBC en situaciones especiales
HIV/sida21: El tratamiento de la TBC es prioritario en estos pacientes respecto de la terapia antirretroviral de gran actividad (TARGA), la que podrá prescribirse (si corresponde según nivel de CD4 y carga viral) a partir del primero o segundo mes de tratamiento específico. Siempre debe incluir R, dado que existe un aumento de la mortalidad en regímenes sin esta droga. No deben emplearse regímenes intermitentes en pacientes con niveles de CD4 inferiores a 200/µl (o si se desconocen). Por la inmunodepresión y la alta carga bacilar asociada en estos pacientes, la duración del tratamiento se extiende a 9 meses a expensas de la segunda fase.
El uso de TARGA en pacientes con TBC/sida se ve limitado por la superposición de efectos tóxicos, las interacciones farmacológicas y las reacciones paradojales al tratamiento en lo que se ha denominado síndrome inflamatorio de reconstitución inmune (SIRI).
La R es un potente inductor del sistema citocromo P-450 hepático CYP3A por lo que interactúa con los inhibidores de la proteasa (IP: saquinavir, ritonavir, indinavir, nelfinavir, amprenavir y atazanavir) y los inhibidores de la transcriptasa reversa no nucleósidos (ITRNN: nevirapina y delarvidine) provocando niveles subterapéuticos. Esto se asocia con incompleta supresión de la replicación viral y aparición de mutantes resistentes del HIV.
Algunos efectos adversos, como la polineuropatía periférica asociada con la H, pueden verse potenciados por el uso de TARGA incluyendo inhibidores de la transcriptasa reversa nucleosídicos (ITRN) como estavudina (d4T), didanosina (ddI) o zalcitabina (ddC); también la hepatotoxicidad relacionada con la H, R y Z puede favorecerse con el uso de IP o ITRNN.
Por esta razón, la administración concomitante de R con estos fármacos antirretrovirales obliga a modificar sus dosis. Por ejemplo, R reduce los niveles plasmáticos de efavirenz en un 13 a 37%, por lo que se sugiere incrementar la dosis de éste a 800 mg/día. Se prefiere efavirenz a nevirapina, siempre asociado a dos ITRN en el TARGA concomitante a la administración de R, para evitar la suma de hepatotoxicidad entre esta última y los fármacos antituberculosos. Existe la posibilidad de emplear regímenes de 3 ITRN cuando se usa concomitantemente R, pero su eficacia antirretroviral es menor. Los IP no deben utilizarse si el paciente recibe R.
El inicio de la TARGA en pacientes con infección por HIV suele acompañarse de un incremento en los valores de linfocitos T CD4 + y de una reconstitución inmunológica parcial. El SIRI (también denominado efecto paradojal, descrito desde los albores de la terapia antituberculosa) asociado con la TARGA en pacientes con TBC suele presentarse entre 1 y 3 meses después del inicio de la administración de antirretrovirales bajo la forma de una adenitis mediastinal, periaórtica, mesentérica o periférica, en especial de localización supraclavicular acompañada de fiebre y leucocitosis. También se ha descrito esta respuesta bajo la forma de una pleuresía con derrame y granulomas tuberculoides en la biopsia pleural. Tiene una frecuencia de aparición aproximada del 30%.
El tratamiento del SIRI se basa en el mantenimiento de la terapia específica y de TARGA, más el agregado de antiinflamatorios no esteroideos. Si las manifestaciones persisten puede agregarse prednisona a la dosis de 20 a 40 mg/día durante 4 a 8 semanas. Eventualmente puede requerirse el drenaje quirúrgico de las lesiones focales.
Insuficiencia renal: R e H son metabolizadas a nivel hepático, por lo que sus dosis no se modifican en insuficiencia renal ni en pacientes en diálisis. La Z se metaboliza al mismo nivel, pero sus metabolitos (ácidos pirazinoico e hidroxi pirazinoico) se eliminan por orina, por lo que requiere ajustes de dosis. El E es metabolizado en un 80% a nivel renal. Solamente Z es removida significativamente por la hemodiálisis, aunque es preferible la administración de H, R, E, y S post-hemodiálisis (ver Tabla 4).
TABLA 4.- Dosis recomendadas para adultos con función renal reducida o pacientes en hemodiálisis22

Farmacos antituberculosos y hepatopatía5: en caso de hepatopatía grave o evolutiva es aconsejable un régimen que no incluya fármacos hepatotóxicos. Indicar E, S, quinolona y Cs. Dicho esquema deberá extenderse como mínimo 18 meses, con la S en una fase inicial de 2-3 meses (aplicada de lunes a viernes).
Embarazo y lactancia3, 6: en el embarazo se recomienda el esquema estándar de tratamiento. Todos los fármacos de primera línea pueden ser indicados, excepto la S que puede provocar sordera congénita. Se recomienda indicar piridoxina 25 mg/día en las embarazadas que reciben H. Los fármacos antituberculosos pueden estar presentes en pequeñas concentraciones en la leche materna, sin embargo estos niveles son bien tolerados por los lactantes.
Silicosis5: dada la insuficiencia inmunológica de los macrófagos provocada por la sílice, en estos enfermos se recomienda extender la duración del tratamiento a 9 meses a expensas de la segunda fase.
Diabetes mellitus: Los pacientes diabéticos tienen mayor riesgo de contraer TBC, la cual compromete más frecuentemente los lóbulos inferiores. Dada la inmunodepresión que conlleva la diabetes se recomienda la prolongación del esquema terapéutico estándar a 9 meses (2 HRZE/7HR). Debe recordarse que la R reduce los niveles séricos de hipoglucemiantes orales como las sulfonilureas y biguanidas, por lo que debe realizarse el estricto seguimiento para mantener niveles aceptables de glucemia y de ser necesario indicar insulina. También es mayor el riesgo de polineuritis por H, por lo que se debe coadministrar piridoxina profilácticamente (25 mg/d).
Reacciones adversas a fármacos antituberculosos (RAFA)
Las toxicidades individuales de los fármacos antituberculosos se reseñan en las Tablas 1 y 2. Siendo el tratamiento de la TBC una poliquimioterapia, la identificación del fármaco incriminado en una RAFA suele ser dificultosa. Se describen a continuación las conductas frente a las toxicidades más comunes en el tratamiento combinado.
Hepatotoxicidad5, 6, 13: todos los pacientes deben tener un hepatograma antes de iniciar el tratamiento y se les debe informar sobre posibles RAFA, si es posible por escrito, con la advertencia de suspender el tratamiento y consultar de inmediato al médico si aparecen náuseas y vómitos persistentes, dolor abdominal y/o ictericia.
En pacientes con antecedentes de enfermedades hepáticas, hepatograma anormal antes del tratamiento, alcoholismo, embarazo o HIV/sida, es necesario el monitoreo regular de la función hepática; semanalmente el primer mes y quincenalmente el segundo.
Hasta un 20% de los pacientes tratados con los cuatro fármacos principales tienen elevaciones leves, asintomáticas y transitorias de las transaminasas. En estos casos, el tratamiento no debe ser interrumpido porque se resuelve espontáneamente. Sin embargo, los controles clínicos y de laboratorio deben ser más frecuentes.
Cuando las transaminasas aumentan más de cinco veces el límite superior normal con o sin síntomas, o más de tres veces con síntomas, o hay aumento de la bilirrubina, los fármacos deben suspenderse y el paciente debe ser evaluado con: exhaustivo interrogatorio sobre enfermedades hepáticas y/o biliares preexistentes, alcoholismo, ingesta de medicamentos; debe solicitarse serología para hepatitis virales y ecografía hepática y de vías biliares.
Hasta que el paciente mejore es conveniente administrar por lo menos tres fármacos no hepatotóxicos (E, quinolona y aminoglucósido). Cuando el hepatograma se normaliza, se administran nuevamente los fármacos en forma secuencial comenzando con R. Si no hay aumento de transaminasas, luego de una semana se continúa con H y luego de una semana se agrega Z (la de mayor frecuencia de hepatotoxicidad). Si aparecen síntomas o aumentan las transaminasas, se debe suspender la última droga administrada. Si la tolerancia es buena, se continúa con el esquema estándar y se suspenden los fármacos alternativos.
Reacciones cutáneas y de hipersensibilidad5, 6, 13: la conducta ante un rash o erupción cutánea depende de la gravedad de la misma. Si es leve se puede administrar un antihistamínico y continuar con el tratamiento. Si hay petequias, solicitar recuento de plaquetas y si éstas están bajas, probablemente se deba a trombocitopenia por R. En este caso se debe suspender definitivamente el fármaco y controlar las plaquetas hasta su normalización.
Si el rash es generalizado y está acompañado de fiebre y/o compromiso de mucosas, todos los fármacos deben ser suspendidos inmediatamente y en algunos casos es necesario administrar corticoides sistémicos. Es importante destacar que cuando un paciente presenta hipersensibilidad a una droga, frecuentemente se vuelve hipersensible a todos los fármacos dados. Cuando desaparece la reacción cutánea, los fármacos se administran cada uno por separado y en dosis de prueba progresivas, comenzando por R, luego H, E y Z con intervalos de dos o tres días. Si el rash reaparece, se suspende la última droga agregada. Las dosis de prueba de cada medicamento se administran según el esquema aconsejado en la Tabla 5.
TABLA 5.- Dosis de prueba para detectar hipersensibilidad cutánea a los fármacos antituberculosos

Si no aparece ninguna reacción a las dosis de prueba, se puede continuar hasta las dosis plenas. Si la reacción inicial fue grave, la dosis de prueba debe ser más baja que la del día 1 (aproximadamente 1/10 de la dosis indicada para el día 1).
Intolerancia digestiva: cuando aparece intolerancia digestiva: náuseas, vómitos, dolor abdominal, hiporexia, hay que solicitar un hepatograma. Si las transaminasas están por debajo de tres veces el límite superior normal, los síntomas no se deben a toxicidad hepática y puede continuarse el tratamiento administrando los fármacos con las comidas o asociando tratamiento sintomático.
Polineuropatía: es producida fundamentalmente por H en pacientes predispuestos (diabetes, alcoholismo, desnutrición, embarazo, HIV). Se aconseja adicionar al tratamiento piridoxina 25 mg/d como dosis preventiva y 100 mg/d como dosis terapéutica.
Reacciones adversas en pacientes HIV+: la frecuencia de RAFA graves que obligan a suspender el tratamiento en pacientes TBC/HIV es variable. En un estudio retrospectivo, 21% tuvieron RAFA y la R fue la responsable más frecuente24.
Hay que recordar que puede haber superposición de RAFA y antirretrovirales, lo cual dificulta la identificación de las mismas. Por lo tanto, se recomienda, si corresponde iniciar el tratamiento antirretroviral, hacerlo después del antituberculoso. Las interacciones medicamentosas de R y antirretrovirales ya han sido descriptas.
Tratamiento supervisado: DOTS/TAES 5, 6
La estrategia DOTS o TAES (tratamiento acortado estrictamente supervisado), promovida oficialmente por la OMS desde 1995 consta de cinco componentes principales: 1) el compromiso gubernamental con las actividades continuadas de lucha antituberculosa; 2) la detección de los casos por baciloscopia de esputo entre los pacientes sintomáticos que acuden espontáneamente a los servicios sanitarios (estos pacientes pulmonares con baciloscopia positiva son el primer objetivo de la estrategia); 3) una pauta terapéutica normalizada de seis a ocho meses de duración para todos los casos de baciloscopia positiva como mínimo, con tratamiento bajo observación directa al menos durante los dos primeros meses, control bacteriológico periódico y al alta; 4) el suministro gratuito, regular e ininterrumpido de todos los fármacos antituberculosos y 5) un sistema normatizado de registro y notificación que permita evaluar los resultados del tratamiento a través del estudio de cohortes que realiza el Programa Nacional.
Las ventajas de la aplicación de la estrategia DOTS/TAES son obvias: 60% de los pacientes bajo regímenes autoadministrados finalizan su tratamiento mientras que no menos del 80% lo hace con la supervisión terapéutica. Existen incentivos para el DOTS/TAES, como merienda, bonos de alimentos, ropas, viáticos para el pasaje, etc., que logran incrementar su rendimiento al 90% de los casos5
Nuevos fármacos antituberculosos
La reemergencia de la tuberculosis y la proliferación de cepas multirresistentes han renovado el interés en el desarrollo de nuevos agentes antimicobacterianos26. Se describen a continuación: 1) derivados rifamicínicos, 2) fluoroquinolonas, 3) derivados del nitroimidazol, 4) diarilquinolinas, 5) análogos del E, 6) tiolactomicinas, 7) oxazolidinonas, 8) fármacos no antibióticos (fenotiazinas e inmunomoduladores).
Derivados rifamicínicos
La R constituye la piedra angular del tratamiento antituberculoso debido a sus propiedades "esterilizantes". Sus derivados incluyen la rifabutina (Rb), rifapentina (Rp) y rifalazil27. En estudios clínicos la Rb no ha demostrado ventajas en relación a la R. Su uso está recomendado para los pacientes portadores de HIV/TBC que no pueden recibir R a causa de la interacción con el tratamiento antirretroviral.
La Rp, aprobada para el tratamiento de la TBC en 1998 parecería tener ventajas terapéuticas en relación a la R, sin embargo, el alto porcentaje de unión a proteínas (95% versus 80% de la R) afectaría su actividad27. Su larga vida media permite la administración unisemanal. Se hallan en fase III estudios sobre su empleo asociado a moxifloxacina en la segunda fase del tratamiento de la TBC y asociada a H en tratamiento de la infección latente.
La resistencia cruzada entre la Rb y la R es del 70% y con la Rp es total. Esto impide el uso en casos de TBCMR.
Fluoroquinolonas: un avance significativo en el tratamiento de la tuberculosis ha sido el desarrollo de las fluoroquinolonas de amplio espectro. Actúan inhibiendo la topoisomerasa II (ADN girasa) del M. tuberculosis y son efectivas en TBCMR.
La nueva generación de fluoroquinolonas (gatifloxacina y moxifloxacina) presenta CIM significativamente más bajas. La moxifloxacina a dosis diaria de 400 mg parece ser la más activa fluoroquinolona contra el M. tuberculosis27. Recientemente se han comunicado efectos adversos de la gatifloxacina (hiper o hipoglucemia)28 que obligaron a su retiro del mercado.
Derivados nitroimidazólicos: los nitroimidazopiranos son agentes originalmente investigados como antineoplásicos, que demostraron actividad bactericida in vitro e in vivo en un modelo murino de infección tuberculosa. El compuesto más activo de la serie es el PA-824, pequeña molécula relacionada con el metronidazol29; es activo sobre cepas multirresistentes.
Diarilquinolinas: un compuesto derivado de la mefloquina, denominado R-207910 o TMC-207, generaría mutaciones en el gen que codifica parte de la subunidad F0 de la ATP sintetasa. De esta forma altera la bomba de protones del complejo proteico requerido para la síntesis de ATP, fuente de energía del bacilo. Esto constituye un nuevo mecanismo de acción antibiótica. Andries y col demostraron la actividad bactericida del compuesto en ratones30, es activa sobre cepas multirresistentes.
Análogos del etambutol: un fármaco derivado denominado SQ-109 reveló acción bactericida contra cepas sensibles y multirresistentes del M. tuberculosis27.
Tiolactomicina: es una pequeña molécula natural con actividad antituberculosa débil. La síntesis de varios derivados ha llevado a la identificación de moléculas muy activas contra cepas sensibles y multirresistentes del M. tuberculosis27.
Oxazolidinonas: las oxazolidinonas son un grupo nuevo de agentes antimicrobianos. Uno de los miembros de la familia, linezolid, fue aprobado por la FDA en el año 2000 para el tratamiento de infecciones producidas por cocos Gram+ meticilino y vancomicina resistentes27. El linezolid inhibe la síntesis proteica al ligarse a la ARN peptidil transferasa de la subunidad ribosomal 50 S.
Existe experiencia a nivel nacional con un pequeño número de pacientes con TBCMR31.
Agentes no antibióticos: las fenotiazinas son inhibidores in vitro del crecimiento del M. tuberculosis. La clorpro-macina y tioridazina son las de mayor potencia32.
Los inmunomoduladores33 podrían ocupar un futuro rol en el tratamiento de la tuberculosis. Existen experiencias en pequeño número de pacientes con interferón gamma y alfa34.
Cirugía de la tuberculosis
Actualmente la tisiocirugía es complementaria del tratamiento médico, son sus indicaciones el tratamiento de secuelas y algunas formas de TBCMR.
Las secuelas pueden ser: a) pleurales, las cuales libradas a su evolución producen paquipleura y pulmón emparedado y b) parenquimatosas, de las cuales las cavitarias tienen especialmente indicación quirúrgica. En general se traducen clínicamente por hemoptisis, o bien por sobreinfecciones por gérmenes y hongos oportunistas.
Los procedimientos operatorios a considerar son: 1) colapsantes: neumotórax terapéutico, toracoplastias, plombajes, 2) de exéresis (lobectomías, pleuroneumonectomía), 3) combinados (toracocavernostomía + mioplastia con músculo dorsal ancho y exéresis + toracoplastia), 4) tratamiento del empiema pleural y drenajes (toracocavernostomía y espeleotomía de Bernau, que son de excepcional indicación).
Neumotórax terapéutico: se ha abandonado como tratamiento colapsante al igual que el neumoperitoneo.
Toracoplastia: está indicada en cavernas de los vértices pulmonares, cuando el examen funcional respiratorio no permite la resección parenquimatosa. Se realiza como complementaria de las exéresis en el mismo tiempo operatorio (contemporánea). También se indica en los postoperatorios más o menos alejados para tratar la falta de reexpansión pulmonar, fístula broncopleural, empiema, etc., como segundo tiempo operatorio.
Plombaje: tratamiento colapsante que se indica en pacientes con parámetros fisiológicos similares a los de las indicaciones de la toracoplastia.
Exéresis: indicadas en primer término para tratar las secuelas pleuropulmonares de la TBC pulmonar (lobectomías, pleuroneumonectomías).
Las toracocavernostomías con mioplastias del músculo dorsal ancho se han utilizado en pacientes con mal estado general y secuelas pleuropulmonares que no permitían la resección y los tratamientos colapsantes. La cirugía es en casos seleccionados un tratamiento efectivo en TBCMR logrando conversión bacteriológica del esputo entre 50-96%35, 36.
En líneas generales, las indicaciones quirúrgicas están reservadas a pacientes que no se hallen gravemente inmunosuprimidos.
Criterios de internación en TBC
Son criterios de internación, las formas avanzadas de TBC, las complicaciones y asociaciones morbosas que de por sí indiquen una internación, las RAFA que puedan comprometer la vida del paciente y motivos socioeconómicos que impidan el tratamiento ambulatorio inicial.
Bibliografía
1. World Health Organization (WHO) report 2006.Global tuberculosis control - surveillance, planning, financing. WHO/HTM/TB/2006.362
2. Instituto Nacional de Enfermedades Respiratorias (INER) Emilio Coni, Santa Fe. Situación de la tuberculosis. República Argentina 2004. PRO.TB.DOC.TEC 04/05. inerconi@infovia.com.ar
3. WHO. Treatment of tuberculosis. Guidelines for national programmes. WHO/CDS/TB/2003.313.
4. WHO. Guidelines for the programmatic management of drug-resistant tuberculosis. WHO/HTM/TB 2006.361
5. American Thoracic Society/Centers for Disease Control and Prevention/ Infectious Diseases Society of America: Treatment of tuberculosis. Am J Resp Crit Care Med 2003; 167: 603-62.
6. Programa Nacional de Control de la Tuberculosis. Normas técnicas 2002. INER Coni: inerconi@infovia. com.ar
7. Goodman and Gilman's. The pharmacological basis of therapeutics.10th Ed. New York: Mc Graw Hill, 2001, p 1242-371.
8. Peloquin CA. Pharmacology of the antimycobacterial drugs. Med Clin North Am 1993; 77: 1253-62.
9. Palmero D J, Waisman JL. Tratamiento de la tuberculosis multirresistente. En: González Montaner LJ, Palmero DJ y col. Tuberculosis Multirresistente. Buenos Aires, Ed. Hoechst Marion Roussel, 1998, p 131-47.
10. Nau R, Sorgel F, Prange HW. Pharmacokinetic optimisation of the treatment of bacterial central nervous system infections. Clinical Pharmacokinetics 1998; 35: 223-46.
11. Kruuner A, Jureen P, Levina K, Ghebremichael S, Hoffner S. Discordant resistance to kanamycin and amikacin in drug-resistant Mycobacterium tuberculosis. Antimicrob Agents Chemother 2003; 47: 2971-3.
12. Bolt HM. Rifampicin, a keystone inducer of drug metabolism: from Herbert Remmer's pioneering ideas to modern concepts. Drug Metab Rev 2004; 36: 497-509.
13. Caminero Luna JA. Guía de la tuberculosis para médicos especialistas. París, Unión Internacional Contra la Tuberculosis y Enfermedades Respiratorias (UICTER), 2003, p 156-92.
14. WHO.Anti-tuberculosis drug resistance in the world. Report n° 3. WHO/HTM/TB/2004.343
15. Grosset J. Bacteriological basis for short-course chemotherapy for tuberculosis. Clin Chest Med 1980; 1: 231-242.
16. Moulding T. Dutt AK, Reichman LB. Fixed-dose combinations of antituberculous medications to prevent drug resistance. Ann Intern Med 1995; 122: 951-54.
17. Thwaites GE, Duc Bang N, Dung NH, et al. Dexamethasone for the treatment of tuberculosis meningitis in adolescents and adults. N Eng J Med 2004; 351: 1741-51.
18. Crofton J. Tuberculosis: Propter Koch, Post Koch: a global review. The Robert Koch memorial lecture of the International Union Against Tuberculosis and Lung Disease, Mainz, June 1994. IUATLD Newsletter 1994; 2.
19. Mitnick C, Bayona J, Palacios E, et al. Community-based therapy for multidrug-resistant tuberculosis in Lima, Peru. N Eng J Med 2003; 348: 119-28.
20. Caminero Luna JA. Management of multidrug-resistant tuberculosis and patients in retreatment. Eur Resp J 2005; 25: 928-36
21. Corti M, Palmero D. Tratamiento antirretroviral en pacien-tes con sida y micobacteriosis. Medicina(Buenos Aires) 2005; 65: 353-60.
22. Bartlett JG. Terapéutica de las Enfermedades Infeccio-sas. Buenos Aires: Waverly Hispánica SA, 2000, p 36-52.
23. Abbate EH, Chertcoff J, Musella RM.: Anemia hemolítica provocada por rifampicina. Anales de la Cátedra de Tisioneumonología UBA 1980; 39: 5-7.
24. González Montaner LJ, Castagnino JP, Musella RM: The nature and frequency of serious adverse drugs reactions to antituberculous therapy among HIV infected patients. Am Rev Respir Dis 1991; 143 (S): A116.
25. The global alliance for TB drug development 2001. Scientific blueprint, p:1-52. http://www.tballiance.org/pdf/TB%20Scientific%20Blueprint%20Full.pdf (Consultado el 24/9/05).
26. Iseman MD. Tuberculosis therapy: past, present and future. Eur Respir J 2002; 20: 87-95.
27. Kremer L, Besra GS. Current status and future development of antitubercular chemotherapy. Expert Opin Investig Drugs 2002; 11: 1033-49.
28. Park-Wyllie LY, Juurlink DN, Kopp A. Outpatient gatifloxacin therapy and disglycemia in older adults. N Engl J Med 2006; 354: 1352-61.
29. Stover CK, Warrener P, VanDevanter DR, et al . A small-molecule nitroimidazopiran drug candidate for the treatment of tuberculosis. Nature 2000; 405: 962-6.
30. Andries K, Verhasselt P, Guillemon T, et al. A diarylquinolina drug active on the ATP synthasa of Mycobacterium tuberculosis. Science 2005; 307: 223-7.
31. Abbate E, Brea A, Cufré M, et al. Linezolid in multidrug-resistant tuberculosis treatment. Eur Respir J 2004; 24 (S48):485.
32. Amaral L, Kristiansen JE, Viveiros M, Atouguia J. Activity of phenothiazines in antibiotic-resistant Mycobacterium tuberculosis. J Antimicrob Chemother 2001; 47: 505-11.
33. Barry III CE. Laboratory of immunogenetics. Tuberculosis research section. http://www.niaid.nih.gov/dir/labs/lhd/barry.htm. (consultado el 12/9/05).
34. Palmero D, Eiguchi K, Rendo P, Castro Zorrilla L, Abbate E, González Montaner LJ. Phase II trial of recombinant interferon-alpha2b in patients with advanced intractable multidrug-resistant pulmonary tuberculosis: long-term follow-up. Int J Tuberc Lung Dis 1999; 3: 214-8.
35. Abbate EH, Dambrosi A, Di Lonardo M, González Montaner LJ. Multiple drug- resistant pulmonary tuberculosis - Fourteen years experience in Buenos Aires, Argentina. Tuberc Lung Dis 1994; 75 (Suppl.): 34.
36. Chan ED, Laurel V, Strand M, Chan J, Huynh, Goble M, Iseman M. Treatment and outcome analysis of 205 patients with multidrug-resistant tuberculosis. Am J Respir Crit Care Med 2004; 169: 1103-9.
Recibido: 18-09-2006
Aceptado: 7-12-2006














