Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Medicina (Buenos Aires)
versión impresa ISSN 0025-7680versión On-line ISSN 1669-9106
Medicina (B. Aires) v.67 n.4 Buenos Aires jul./ago. 2007
Modificaciones dinámicas en los islotes de Langerhans de dos Líneas de ratas espontaneamente diabeticas
Juan Carlos Picena1, Silvana M. Montenegro2, 3, María Cristina Tarrés2, 3, Stella Maris Martínez2, 3
1 Cátedra de Anatomía Patológica,
2 Cátedra de Biología, Facultad de Ciencias Médicas,
3 Consejo de Investigaciones, Universidad Nacional de Rosario
Dirección postal: Dra. Stella Maris Martínez, Cátedra de Biología, Facultad de Ciencias Médicas, Universidad Nacional de Rosario, Santa Fe 3100, 2000 Rosario, Argentina Fax: (54-341) 4804577 e-mail: stellamartinez@telnet.com.ar
Resumen
La rata eSMT derivó del cruzamiento de eSS y b, líneas de la cepa IIM. eSS es un modelo de diabetes tipo 2 sin sobrepeso; b desarrolla obesidad moderada e intolerancia tardía a la glucosa. Fueron comparados características metabólicas y hallazgos histopatológicos del páncreas endocrino entre eSS y eSMT. Cotejados con eSS, los animales eSMT jóvenes son más corpulentos y desarrollan hiperglucemia de ayuno e intolerancia a la glucosa más precoces e intensas. En los machos eSMT de 6 y 9 meses existen islotes de formas alteradas y con fibrosis, detectándose esporádicas imágenes de apoptosis. En los de un año se tornan más pequeños y escasos, remedando la histoarquitectura de los machos eSS en el segundo año de vida; posteriormente los islotes van disgregándose, a la vez que muestran ocasionales mitosis y se observa nesidioblastosis. Se sugiere que estas modificaciones dinámicas constituyen una respuesta a la hiperglucemia. Las hembras eSS conservan por más tiempo la estructura insular y tienen menores alteraciones de la glucemia. El dimorfismo sexual del síndrome diabético de eSMT es atenuado respecto de eSS. La construcción de una tipología de individuos mediante el análisis multivariado separó tres clusters, evidenciando diferencias genéticas, etáreas y de sexo.
Palabras clave: Páncreas; Islote; Rata eSS; Rata eSMT; Diabetes
Abstract
Dynamic modifications in islets of Langerhans in two lines of spontaneously diabetic rats. The eSMT rat is derived from the crossing of eSS and b, both lines belonging to the IIM strain, while eSS is a model of type 2 diabetes without overweight and b develops moderate obesity and late glucose intolerance. Metabolic characteristics and histopathological findings in endocrine pancreas of eSS and eSMT were compared. Young eSMT animals are more robust than eSS and develop more intense fasting hyperglycemia and glucose intolerance at an earlier age. eSMT males of 6 and 9 months show islets with altered shapes and fibrosis, as well as sporadic images of apoptosis. At 12 months of age, islets are reduced in number and size, resembling the histoarchitecture of eSS males during their second year of life; eventually islets undergo disruption and, at the same time, occasional mitoses and nesidioblastosis are seen. These dynamic modifications may be expressing a response to hyperglycemia. eSS females preserve their insular structure for a longer time and have less glycemic alterations. Sexual dimorphism of the diabetic syndrome of eSMT is attenuated when compared with eSS. The construction of a typology of individuals through multivariate analysis separated three clusters, evidencing genetic, age and sex differences.
Key words: Pancreas; Islet; ESS rat; ESMT rat; Diabetes
En los países desarrollados, la diabetes tipo 2 ocupa el tercer lugar como causa de muerte, después de las afecciones cardiovasculares y el cáncer1. En Argentina, la prevalencia de la diabetes tipo 2 está en continuo crecimiento y alcanza el 7% de la población adulta2. Para la comprensión de su patogénesis, el empleo de modelos animales ha sido crucial3.
En Rosario, una cepa desarrollada en el Instituto de Investigaciones Médicas (IIM), dio origen a las líneas que se crían en la Facultad de Ciencias Médicas y que son objeto de este trabajo4. La rata eSMT es una línea sintética obtenida por endocría de la F1 del cruzamiento de eSS y b5. b presenta en forma espontánea un síndrome de obesidad puberal sin hiperfagia, con hipertrigliceridemia y normocolesterolemia, que evoluciona más tardíamente a la intolerancia glúcida6, 7. La rata eSS es un modelo de diabetes tipo 2 de moderada gravedad, con intolerancia glúcida temprana y progresiva8, 9 que, después de un período de hiperinsulinemia moderada, desarrolla hipoinsulinemia creciente; en el segundo año de vida va disminuyendo la masa insular con reducción de células beta10, a la vez que aumentan la hiperglucemia y la glucosuria; este síndrome tiene un notable dimorfismo sexual, ya que es más precoz y mucho más intenso en los machos que en las hembras11. eSMT tiene sobrepeso y, respecto de eSS, muestra un comienzo anticipado del síndrome y una evolución exacerbada de la hiperglucemia de ayuno y la intolerancia a la glucosa5.
En distintos lugares del mundo han sido caracterizados modelos murinos de diabetes12. Entre ellos, la rata Torii13, la rata BHE14, la rata Cohen15 y la rata GotoKakizaki16, 17, 18,19 son modelos de diabetes sin obesidad y con disminución de la masa insular pancreática, en tanto que la rata SNR/N es diabética, obesa e hipertensa, mostrando algunas veces hiperplasia de los islotes de Langerhans20. Es por lo tanto oportuno estudiar la histopatología pancreática de eSMT y compararla con la de eSS, analizando sus modificaciones con la edad.
Materiales y métodos
Se estudiaron 139 ratas eSS (71 ![]() y 68
y 68 ![]() ), 122 ratas eSMT (50
), 122 ratas eSMT (50 ![]() y 72
y 72 ![]() ) de 3, 6, 9, 12, 15, 21, 24 y 26 meses y 8 Wistar machos de 12 meses. Los machos Wistar eumetabólicos fueron empleados para analizar si las alteraciones histológicas y metabólicas de las ratas eSS y eSMT, que son evidentes al año de edad5 y 10, eran o no exclusivamente fenómenos de envejecimiento. Por otra parte, se utilizaron solamente Wistar machos porque tanto en eSS y eSMT como en otros modelos murinos, este sexo es el que expresa con mayor intensidad las alteraciones diabéticas11, 13, 15, 19. Cabe aclarar que no pudieron estudiarse machos eSS ni eSMT de más de 24 meses porque es excepcional que estos animales alcancen o superen esa edad3, 8.
) de 3, 6, 9, 12, 15, 21, 24 y 26 meses y 8 Wistar machos de 12 meses. Los machos Wistar eumetabólicos fueron empleados para analizar si las alteraciones histológicas y metabólicas de las ratas eSS y eSMT, que son evidentes al año de edad5 y 10, eran o no exclusivamente fenómenos de envejecimiento. Por otra parte, se utilizaron solamente Wistar machos porque tanto en eSS y eSMT como en otros modelos murinos, este sexo es el que expresa con mayor intensidad las alteraciones diabéticas11, 13, 15, 19. Cabe aclarar que no pudieron estudiarse machos eSS ni eSMT de más de 24 meses porque es excepcional que estos animales alcancen o superen esa edad3, 8.
Los ejemplares eSS y eSMT pertenecían al Bioterio de la Cátedra de Biología de la Facultad de Ciencias Médicas (UNR) y los Wistar, al de la Facultad de Ciencias Bioquímicas (UNR). Las colonias tienen un estatus microbiológico no especificado, y condiciones de cría comparables. Recibieron agua y alimento balanceado (CargillR) ad libitum.
Se registró el peso de los animales y se los sacrificó respetando las normas éticas que rigen el empleo de animales de investigación21. De inmediato se extrajo el páncreas y se lo pesó en una balanza electrónica (IshidaR CB-600). El órgano fue cortado longitudinalmente abarcando todos los sectores, desde la ampolla de Vater hasta su extremo esplénico; se lo fijó en formol neutro al 10% e incluyó en parafina, obteniéndose cortes de 5 mm de espesor, que se colorearon con hematoxilina-eosina (H-E) y hematoxilina-PAS (H-PAS).
Se registró el número de islotes de Langerhans por campo microscópico con una magnificación de 100x. Se consideró islotes chicos (ICh) a los de diámetro inferior a tres acinos (120 µm), y grandes (IGr) cuando alcanzaban o superaban este valor. Los campos observados abarcaban solamente parénquima pancreático, sin tejido adiposo ni espacios vacíos. En el 92% de los casos se contaron entre 4 y 10 campos. Asimismo, se calculó el área insular (AI) mediante la fórmula22:
AI= [n° de islotes chicos + (n° de islotes grandes x 3)]/n° de campos a 100 aumentos
Se juzgó conservada la arquitectura del islote si su forma era redonda u ovalada, de límites netos. Se consideró que un islote era de forma alterada si presentaba al menos uno de estos rasgos: contornos policíclicos, contornos estrellados o disgregación insular.
Se consignó la presencia de focos de nesidioblastosis, considerada como la proliferación de células beta a partir de células primordiales del epitelio ductal23, así como la existencia en el islote de fibrosis, infiltración linfocitaria y hemosiderosis intersticial. Asimismo, se investigó la existencia de apoptosis, mitosis e insulinomas.
En los machos eSS y eSMT de 3, 6 y 12 meses de edad y en los testigos Wistar, inmediatamente antes del sacrificio, se extrajo sangre por punción de las venas de la cola para efectuar curvas de tolerancia oral a la glucosa. La glucemia fue dosada, empleando un kit comercial (Wiener LabR) después de 18 horas de ayuno (G0) y tras 30, 60 y 120 minutos (G30, G60 y G120) de una sobrecarga oral con solución de glucosa al 10% administrada por sonda nasogástrica (200 mg/ 100 g de peso corporal).
Esos valores fueron analizados según los criterios diagnósticos propuestos por la American Diabetes Association24: glucemia de ayuno normal (G0<110 mg/dl); tolerancia a la glucosa normal (G120<140 mg/dl); glucemia de ayuno alterada (110 mg/dl£G0<126 mg/dl); tolerancia a la glucosa alterada (140 mg/dl£G120<200 mg/dl); diagnóstico provisional de diabetes (G0³126 mg/dl o G120³200 mg/dl).
Los análisis estadísticos fueron realizados en parte con el software SPSS25, utilizándose los métodos paramétricos y no paramétricos que se indican en la presentación de los resultados.
Se efectuó por último un análisis multivariado procurando identificar diferencias en la expresión conjunta de variables de la estructura insular. Fueron analizados caracteres pancreáticos en todos los animales eSS y eSMT consignando: línea, sexo, peso, edad, cantidad por campo microscópico de ICh y de IGr, AI, presencia de islotes de arquitectura conservada (R), de contornos policíclicos (P), estrellados (E) y disgregados (D), fibrosis insular (F), infiltrados linfocitarios (IL), nesidioblastosis (N) y hemosiderosis (H). Se realizó un análisis de componentes principales, técnica factorial que se utiliza para reducir las dimensiones de una matriz de datos en la búsqueda de factores explicativos que den cuenta de los montos más importantes de la variación total26, 27 y a continuación se efectuaron agrupamientos de individuos con rasgos semejantes, que se describieron a partir de las variables activas e ilustrativas. El procesamiento estadístico se efectuó con el software SPAD28.
El proyecto de investigación fue examinado y aprobado en forma previa por la Comisión de Bioética de la Facultad de Ciencias Médicas-UNR.
Resultados
Respecto de la relación entre el peso y la edad (Tabla 1), hasta los 9 meses se verificó efecto línea (valores superiores en eSMT) y efecto sexo (pesos mayores en machos). La diferencia entre sexos continuó siendo significativa a los 15, 21 y 24 meses. Si bien en todos los grupos se comprobó un marcado descenso de peso a los 24 meses, la disminución mayor ocurrió en los machos eSMT. Entre las hembras, las eSMT fueron las de mayor biomasa.
TABLA 1.- Peso (g) de machos y hembras eSS y eSMT de diferentes grupos etáreos

En la Tabla 2 se consignan los valores de peso y de glucemia de los machos eSS y eSMT. Se verificó efecto línea para peso, G0 y G30, siendo los valores más altos en eSMT en todas las edades. A su vez, G0 y G30 aumentó con la edad en ambas líneas mientras que G60 y G120 fueron semejantes en ambas líneas.
TABLA 2.- Peso, glucemia basal (G0) y tras 30 (G30), 60 (G60) y 120 minutos (G120) de sobrecarga glúcida en machos eSS y eSMT de diferentes grupos etáreos
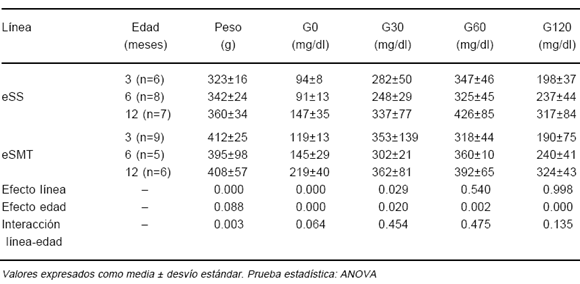
En la Tabla 3 se observan los resultados obtenidos en las hembras. Tanto el peso como los valores de glucemia evidenciaron efecto línea, comprobándose su significativo incremento con la edad. Al igual que entre los machos, los valores fueron siempre mayores en eSMT.
TABLA 3.- Peso, glucemia basal (G0) y tras 30 (G30), 60 (G60) y 120 minutos (G120) de sobrecarga glúcida en hembras eSS y eSMT de diferentes grupos etáreos
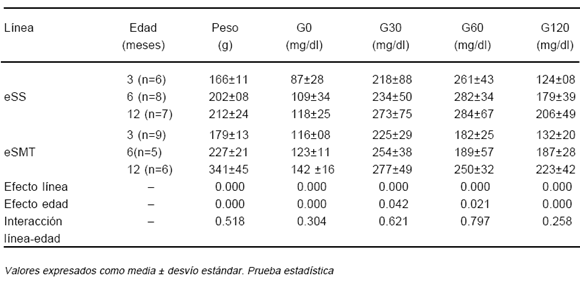
Los testigos Wistar presentaron glucemias normales, tanto de ayuno (G0= 93 ± 10 mg/dl) como tras sobrecarga con glucosa (G30=143 ± 8; G60=136 ± 6; G120=111 ± 2 mg/dl).
Al analizar los valores de glucemia de eSS y eSMT se concluyó que:
- Los machos eSMT mostraron a los 3 meses valores alterados de G0 y glucemias compatibles con diabetes desde los 6.
- Los machos eSS de 6 meses presentaron alteración de la capacidad de procesar la glucosa y los 12 valores diagnósticos de diabetes.
- En ambas líneas, la diabetes se expresó en las hembras más tardíamente que en los machos. Las eSS conservaron hasta los 12 meses valores de G0 normales, mientras las eSMT alcanzaron a los 6 meses cifras propias de diabetes.
Las Figuras 1, 2 y 3 ilustran la marcada disminución de la cantidad de ICh y IGr así como del AI en los machos eSMT de 6 a 15 meses, así como su estabilización en cifras más bajas respecto de todos los demás grupos en edades posteriores. En las hembras eSS, los ICh fueron más numerosos que en los otros grupos; los machos eSS y las hembras eSMT exhibieron valores que oscilaron en el tiempo y mostraron cierta semejanza entre sí (Fig. 1). En ambas líneas diabéticas, los machos tuvieron en general menor número de IGr que las hembras (Fig. 2). El AI está muy influida por la cantidad de IGr por lo que ambas variables mostraron comportamientos similares (Fig. 3).

Fig. 1.- Número de islotes chicos por campo microscópico en ratas eSS y eSMT de ambos sexos de 3 a 24 meses de edad.
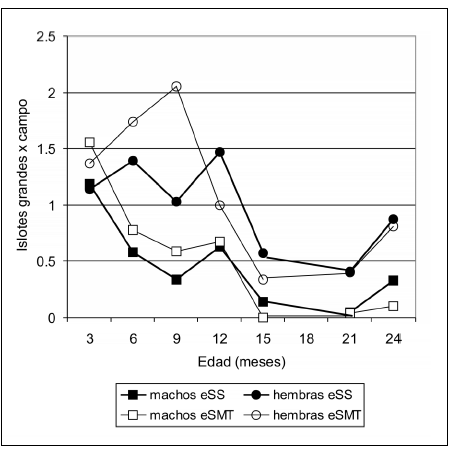
Fig. 2.- Número de islotes grandes por campo microscópico en ratas eSS y eSMT de ambos sexos de 3 a 24 meses de edad.

Fig. 3.- Area insular en ratas eSS y eSMT de ambos sexos de 3 a 24 meses de edad.
Los animales Wistar presentaron un número de ICh (media ± desvío estándar: 0.69 ± 0.35) similar al registrado en eSMT pero menor que el de eSS (p=0.005), siendo todos los animales machos de 12 meses. Cabe destacar que en Wistar, tanto la cantidad de IGr (1.62 ± 0.58) como los valores del AI (5.25 ± 0.74) fueron significativamente superiores a los constatados en los machos eSMT (p=0.009) y eSS (p=0.042) de 12 meses, asemejándose a los verificados en los machos eSMT de 3 meses.
A partir del año, la alteración de la estructura insular fue muy notable entre los machos diabéticos, principalmente en eSMT. En los machos de 15 meses y más, los islotes se hallaban totalmente disgregados y habían sido reemplazados, en muchos casos, por pequeños cúmulos de células insulares dispersas entre bandas fibrosas. En cambio, las hembras eSS conservaron islotes de buen tamaño, sin mayores modificaciones, hasta los 26 meses. Las hembras eSMT presentaron un cuadro intermedio entre hembras y machos eSS.
Algunos machos eSS de 3, 6, 9 y 12 meses mostraron islotes de contornos policíclicos y estrellados. Se detectó fibrosis y disgregación insular a partir de los 12 meses. Las hembras eSS presentaron islotes de contornos policíclicos desde los 6 meses y hasta los 26. En ellas fueron raros los islotes disgregados y la presencia de fibrosis.
Los machos eSMT mostraron ya desde los tres meses islotes de contornos policíclicos, estrellados y con tabiques fibrosos (Fig. 4 y Fig. 5). A partir de los 9 aparecieron imágenes de disgregación de la arquitectura insular (Fig. 6) y la fibrosis fue haciéndose más prominente. Casi todas las hembras eSMT de 6 meses presentaron islotes de contornos policíclicos y este rasgo continuó observándose hasta los 21. Fue detectada dislocación insular desde los 9 hasta los 24 meses; al año, la fibrosis insular fue notable.

Fig. 4.- Islote de contorno policíclico con tabiques fibrosos. Macho eSMT de 6 meses. H-PAS 200x.
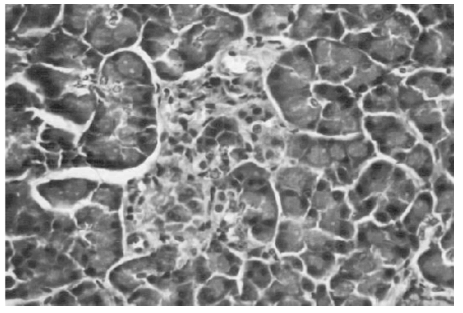
Fig. 5.- Islote de contornos estrellados. Macho eSMT de 21 meses de edad. H-E 200x.
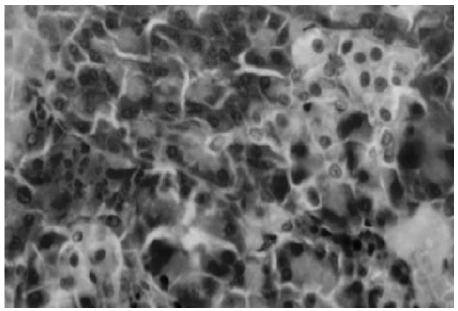
Fig. 6.- Disgregación insular. Dos islotes chicos de formas alteradas. Macho eSMT de 24 meses. H-E 400x.
Cabe destacar que el desmoronamiento insular apareció entre 3 y 9 meses después de haberse observado islotes de contornos policíclicos, estrellados y con fibrosis. Este intervalo de tiempo fue más corto en eSMT que en eSS, tanto en machos como en hembras.
En algunos islotes de contornos policíclicos de machos eSS y eSMT, sobre todo en los de 6 y 9 meses de edad, fueron detectadas imágenes de apoptosis (Fig. 7), que constituían entre el 0.85% y el 4% de la población celular del islote. También se vio cuerpos apoptóticos en hembras, aunque más esporádicamente.
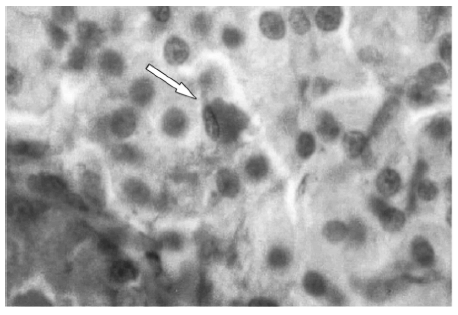
Fig. 7.- Imagen de apoptosis en una célula insular (flecha). Macho eSMT de 9 meses. H-E 630x.
Se observó mitosis en células insulares de animales eSS de 6 a 12 meses y eSMT de entre 9 y 15 meses. El animal más añoso en que se las detectó fue una hembra de 15 meses (Fig. 8). La presencia de nesidioblastosis (Fig. 9) fue frecuente y no varió entre sexos ni entre líneas (machos: c2=1.714, p=0.190; hembras: c2=0.042, p=0.838).
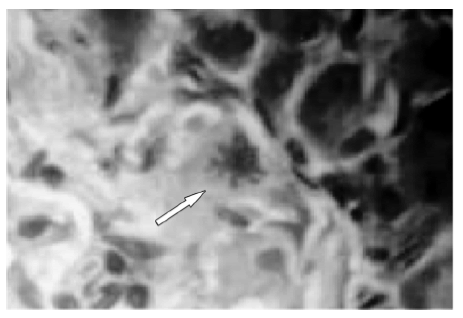
Fig. 8.- Mitosis en una célula del borde de un islote (flecha). Hembra eSMT de 15 meses. H-E 630x.
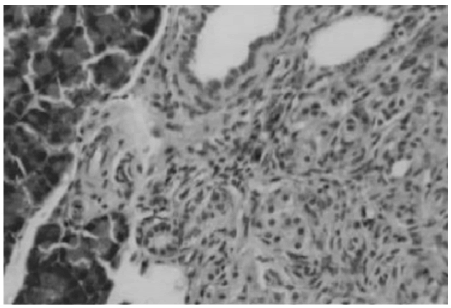
Fig. 9.- Imagen de nesidioblastosis. Hembra eSMT de 12 meses. H-E 200x.
Fueron hallados insulinomas, bien encapsulados, de entre 780 y 1260 mm de di ámetro máximo, en dos machos eSMT de 21 meses y el tercero en una hembra eSMT de 24. Esos animales no fueron incluidos en el cálculo del área insular.
La hemosiderosis fue una lesi ón relativamente frecuente. No se verificaron variaciones entre líneas ni en los machos (c2= 0.042, p=0.837) ni en las hembras (c2= 3.055, p=0.081). No hubo diferencia por sexo en la línea eSMT mientras que en eSS el número de machos con hemosiderosis fue mayor.
La infiltraci ón linfocitaria insular fue un hallazgo esporádico y muy poco frecuente.
En los animales Wistar los islotes fueron redondeados y de contornos netos, sin lesiones agregadas.
Complementariamente al an álisis factorial, se definió una partición en tres clusters que se interpretaron en función de las variables originales. Su descripción es la siguiente: la clase 1 incorporó el 35% de los animales, mayoritariamente eSMT (p=0.006), de menor edad (6.3±3.6 meses, p=0), con islotes R (p=0.005) o P (p=0), sin H (p=0.004), con más altos valores de IGr (1.4±0.6, p=0) y de AI (5.4±1.9, p=0) y menor biomasa (283±82g, p=0); la clase 2, con el 22% de los animales, estuvo constituida fundamentalmente por eSS (p=0), de mayor edad (17.4 ±6.3 meses, p=0), con N (p=0) o H (p=0.005) y valores más altos de ICh (2.6±0.8, p=0) y un AI de 4.3±1.6 (p=0); la clase 3 fue la más numerosa, con el 43% de los animales de ambas líneas, integrada predominantemente por machos (p=0.001), de 16.6±5 meses de edad (p=0), con menor cantidad de ICh (0.6±0.4, p=0), de IGr (0.3±0.2, p=0) y un AI baja de 1.2±0.8 (p=0), con islotes no P (p=0) ni E (p=0.003) y mayor biomasa (352±66g, p=0). Se proyectaron los individuos en el gráfico factorial y en la Fig. 10 se muestran identificados por su número de clase.

Fig. 10.- Proyección de los individuos de las líneas eSS y eSMT según su clase. Clase 1: predominio de animales eSMT más jóvenes y con islotes de mayor tamaño; Clase 2: preponderan los eSS de mayor edad, con islotes de menor tamaño y evidencias de neogénesis insular; Clase 3: agrupa el 43% de los individuos de ambas líneas, predominando los machos de más edad, con islotes escasos y de formas alteradas.
Discusión
La interacción de rasgos de diabetes, característicos de eSS, y el sobrepeso aportado por b, hace comprensible la mayor gravedad del cuadro metabólico en eSMT. En los animales jóvenes, la biomasa de eSMT es superior a la de eSS, pero debido al mayor empeoramiento progresivo del síndrome en eSMT, esta diferencia se va desdibujando con la edad.
Los machos eSMT de 3 meses presentan G0 alterada y los de 6 y 12 meses pueden considerarse severamente hiperglucémicos24, 29. Por el contrario, los machos eSS y las hembras eSMT alcanzan esta característica más tardíamente. Se destaca, además, que existe un dimorfismo sexual menos ostensible en eSMT respecto de la expresión de su síndrome diabético, ya que los valores registrados en las hembras eSS se mantienen siempre muy por debajo de los correspondientes a los machos de esta línea.
Durante el segundo año, tanto eSS como eSMT exhiben notorios incrementos de la glucemia, descenso de la insulinemia y reducción del número y tamaño de los islotes5, 8, 9. A los 9 meses de edad el área insular es mayor en los machos eSMT respecto de los eSS, para luego disminuir pronunciadamente. Al año, los islotes de los eSMT se hacen más pequeños y escasos, con fibrosis más intensa, remedando las imágenes del páncreas de los eSS durante el segundo año de vida. Las hembras eSS, cuya metabolopatía es de menor intensidad, tienen islotes más numerosos y de mayor tamaño.
Un estudio previo había revelado que en los machos eSS de 6 meses ya se detectaba distorsión de la arquitectura insular y fibrosis. A los 18 meses la cicatrización era intensa, quedando la población celular reducida a cordones irregulares de elementos insulino-inmunorreactivos entre bandas de fibrosis mutilante10.
Este estudio muestra que los machos eSS de 3 meses presentan algunos islotes de contornos policíclicos, rasgo bien visible en la mayoría de los de 6. La fibrosis se va haciendo evidente recién a los 12 meses, en tanto que la dislocación de la arquitectura insular se halla presente en la mayor parte de los machos de 12 y 15 meses. Tales fenómenos se desarrollan en forma más acelerada en los machos eSMT, puesto que a los 3 meses de edad ya revelan fibrosis y desarticulación insular.
Si bien en eSS el área insular va decreciendo durante el segundo año de vida, curiosamente fue más alta en los animales de 24 meses. Dado que la mayoría de los machos eSS muere entre los 17 y 20 meses en estado de caquexia30, los pocos individuos de dos años acá estudiados son inesperados sobrevivientes que podrían representar una evolución poco habitual del síndrome diabético de esta línea.
En la rata diabética Goto-Kakizaki (GK), también se ha observado presencia de islotes de contornos estrellados ("star-fish islets") desde los 3 meses, con una frecuencia que aumenta con la edad16, 17, 18, 19. En la diabetes bovina espontánea se ha comprobado reducción del número y tamaño insular junto con el aumento compensatorio del tamaño de los pocos islotes remanentes31.
La paulatina reducción del área insular en eSS y eSMT se explicaría por la puesta en marcha del mecanismo de apoptosis, ya que es posible detectar cuerpos apoptóticos en islotes de machos, sobre todo en los de 6 y 9 meses de edad. Se ha señalado que en los pacientes con diabetes tipo 2 la apoptosis disminuye la población de células beta32, 33 y que la hiperglucemia es una señal inductora de apoptosis, causando disminución de la producción de insulina34. En ratas GK alimentadas con sacarosa al 30%, se detectan asimismo imágenes apoptóticas en células beta35, en tanto que en pacientes diabéticos tipo 2, además de la gluco y la lipotoxicidad, la agregación del polipéptido amiloide del islote (amilina) ha sido sindicada como factor desencadenante de apoptosis36, 37.
Este término fue acuñado en 1972 por Kerr y col. quienes definieron al proceso como "un mecanismo muy poco conocido de eliminación controlada de células, el cual cumple un papel complementario, pero opuesto a la mitosis, en la regulación de las poblaciones celulares animales"38. En contraste con la necrosis, que es un evento pasivo, accidental, la apoptosis es un proceso de muerte celular programada que culmina con la autodestrucción39, 40.
Aunque las imágenes de apoptosis fueron detectadas en eSS y eSMT muy ocasionalmente, su importancia en la reducción del tamaño insular no debe ser soslayada, ya que este fenómeno es de corta duración41, 42. En este sentido, apenas se ha logrado identificar una frecuencia media de 0.067% de células beta apoptóticas en las ratas GK sometidas a una dieta rica en sacarosa35.
En eSS y eSMT se observó nesidioblastosis e imágenes de mitosis en algunos islotes, así como 3 casos de insulinoma en animales añosos. Mitosis y nesidioblastosis podrían representar tentativas de reposición celular. La coexistencia de nesidioblastosis e insulinomas ha sido estudiada en una serie de 1085 pacientes japoneses43, y también se la ha descripto en pacientes insulinorresistentes que no desarrollan diabetes tipo 2 mientras dura el intento compensador del páncreas44.
Las modificaciones de la histoarquitectura insular en las ratas eSS y eSMT podrían explicarse por la puesta en marcha del mecanismo de apoptosis, que redundaría en la paulatina disminución del tamaño de los islotes con alteración de sus contornos. Esta idea es apoyada por el hallazgo, si bien esporádico, de imágenes apoptóticas en islotes de contornos policíclicos, estrellados y con fibrosis. En una etapa posterior, los islotes sufren disgregación, detectándose simultáneamente indicios de regeneración: mitosis y nesidioblastosis; este último hallazgo es relativamente frecuente. Parece razonable plantear que las lesiones alterativas celulares y los intentos compensatorios que se oponen a ellas van estableciendo, a lo largo del tiempo, una notable modificación del área insular en las ratas eSS y eSMT.
El hallazgo en los machos Wistar eumetabólicos de 12 meses de islotes redondeados y de bordes netos, sin lesiones agregadas, permite descartar que las alteraciones histológicas constatadas en eSS y eSMT sean atribuibles sólo al envejecimiento. Cabe señalar, asimismo, que en ratas Sprague-Dawley eumetabólicas se han descrito las alteraciones pancreáticas vinculadas con la edad. Los machos de 24 meses presentaron aumento del área insular promedio respecto de los de 4, hecho interpretado como un intento de restauración de la homeostasis metabólica. En los de 30 meses dicha área disminuyó, con polimorfismo y fragmentación insular por fibrosis, dando por resultado un aumento del número de islotes pero de menor tamaño45. En las ratas eSS y eSMT, si bien existen modificaciones similares, éstas aparecen mucho más precozmente y la caída progresiva del área insular es llamativa ya desde los 12 meses.
Cabe señalar que en el Hamster chino los islotes de los animales adultos disminuyen progresivamente en número y tamaño, mostrando ocasionalmente infiltrados de linfocitos; de ahí que para este modelo fuera postulada una patogenia autoinmune46, 47. El ratón diabético no obeso NOD también exhibe insulitis48. Por contraste, en las ratas eSS y eSMT la infiltración linfocitaria insular fue excepcional.
La hemosiderosis del intersticio, un hallazgo bastante frecuente en machos y hembras de las líneas diabéticas, podría estar asociada a hemorragias focales previas. Este rasgo ha sido reportado en ratas machos diabéticas WBN a partir de los tres meses de edad49.
Finalmente, la aplicación del análisis multidimensional permitió construir una tipología de los individuos eSS y eSMT a partir de modificaciones del islote de Langerhans, el sexo, la edad y la línea, que definió una partición en tres clases. Un agrupamiento correspondió principalmente a animales eSMT jóvenes de ambos sexos, con islotes de mayor tamaño indicativos de las etapas iniciales del síndrome en esta línea. Otro grupo incluyó hembras y machos eSS más añosos quienes, aun en una fase tardía de la metabolopatía, mostraron signos de neogénesis insular. El agrupamiento de la clase 3 desdibujó el efecto línea y vinculó una marcada pérdida de área insular con el sexo masculino y la edad avanzada. De este modo, mediante técnicas multidimensionales pudieron detectarse diferencias fenotípicas en las ratas eSS y eSMT que incluyen a la histoarquitectura insular.
En conclusión, la configuración espacial de los individuos evidenció diferencias multidimensionales que incluyen a la histoarquitectura insular, y que están determinadas por diferencias genéticas, de edad y de sexo.
Bibliografía
1. Gagliardino JJ, Olivera EM, Barragán HL, Hernández RE. Diabetes mellitus e hipertensión arterial: aspectos clínicos y epidemiológicos en la población de La Plata. Medicina (Buenos Aires) 1995; 55: 421-30.
2. Gagliardino JJ. Epidemiología de la diabetes mellitus (Simposio de Diabetes). Medicina (Buenos Aires) 2003; 63: 504.
3. Montenegro S, Tarrés MC, Picena JC, Martínez SM. Modelos animales en la investigación biomédica. Las ratas eSS y eSMT: líneas espontáneamente diabéticas de la Facultad de Ciencias Médicas de Rosario. Rev Méd Rosario 2003; 69: 12-7.
4. Calderari S, Font MT, Garrocq O, et al. The inbred IIM/ Fm stock. Rat News Let 1991; 25: 28-9.
5. Tarrés MC, Montenegro S, Martínez SM, et al. The eSMT rat: a murine model of type 2 human diabetes. Chapter: Animal models in the study of human diseases. In: Tur- Marí J, Orellana-Muriana JM (eds). Proceedings of the International Joint Meeting Twelfth ICLAS General Assembly & Conference. 7th Felasa Symposium. London: Laboratory Animals Ltd, 2000, 93-4.
6. Calderari SA, González AC, Gayol MD. Spontaneous hypertriglyceridemic obesity and hyperglycemia in an inbred line of rats. Int J Obes 1987; 11: 571-9.
7. Posadas M, Olguín MC, Zingale MI, et al. Oleoyl-estrone metabolic effect in relation with caloric restriction in inbred Beta rats with spontaneous obesity and type 2 diabetes. Medicina (Buenos Aires) 2004 ; 64: 332-6.
8. Martínez SM, Tarrés MC, Montenegro SM, et al. Spontaneous diabetes in eSS rats. Acta diabetol lat 1988; 25: 303-13.
9. Tarrés MC, Martínez SM, Montenegro SM, Picena JC, Llorens A, Naves A. The eSS rat: A model of non-insulindependent human diabetes. Am J Pathol 1992; 141: 761-3.
10. Martínez SM, Tarrés MC, Picena JC, et al. eSS rat, an animal model for the study of spontaneous non-insulindependent diabetes. In: Shafrir E (ed). Lessons from Animal Diabetes IV. London: Smith-Gordon, 1993, p 75-90.
11. Tarrés MC, Martínez SM, Montenegro SM, Figueroa NS, D'Ottavio AE, Picena JC. Influence of gonadectomy in eSS diabetic rats. J Physiol Biochem 1997; 53: 211-6.
12. Van Zutphen LFM. Laboratory animal science. A view on the edge of the millenium (Plenary Lecture). In: Tur- Marí J, Orellana-Muriana JM (eds). Proceedings of the International Joint Meeting. Twelfth ICLAS General Assembly & Conference. 7 th Felasa Symposium. London: Laboratory Animals Ltd, 2000, p 1-8.
13. Shinohara M, Masuyama T, Shoda T, et al. A new spontaneously diabetic non-obese Torii rat strain with severe ocular complications. Int J Exp Diabetes Res 2000; 1: 89-100.
14. Bernadier C. The BHE rat: an animal model for the study of non-insulin-dependent diabetes mellitus. FASEB J 1991; 5: 2139-44.
15. Weksler-Zangen S, Yagil C, Zangen DH, Ornoy A, Jacob HJ, Yagil Y. The newly inbred Cohen diabetic rat: a nonobese normolipidemic genetic model of diet-induced type 2 diabetes expressing sex differences. Diabetes 2001; 50: 2521-9.
16. Goto Y, Kakizaki M, Masaki N. Spontaneous diabetes produced by selective breeding of normal Wistar rats. Proc Jpn Acad 1975; 51: 80-5.
17. Goto Y, Suzuki K-I, Sasaki M, Ono T, Abe S. GK rat as a model of nonobese, non insulin dependent diabetes: selective breeding over 35 generations. In: Shafrir E, Renold AE (eds). Lessons from Animal Diabetes II. London: John Libbey, 1988, p 301-3.
18. Suzuki K-I, Goto Y, Toyota T. Spontaneously diabetic GK (Goto-Kakizaki) rats. In: Shafrir E (ed). Lessons from Animal Diabetes IV. London: Smith-Gordon, 1993, p 107-16.
19. Östenson C-G, Abdel-Halim SM, Andersson A, Efendic S. Studies on the pathogenic of NIIDDM in the GK (Goto Kakizaki) rat. In: Shafrir E (ed). Lessons from Animal Diabetes VI. Boston-Basel-Berlin: Birkhäuser, 1996, p 299-315.
20. Velasquez MT, Kimmel PL, Michaelis IV OE. Animal models of spontaneous kidney disease. FASEB J 1990; 4: 2850-9.
21. Committee on Care and Use of Laboratory Animals Resources. Guide for the Care and Use of Laboratory Animals. NIH Publication n° 86-23. Bethesda, Maryland, USA, 1985.
22. Martínez SM, Tarrés MC, Robledo HA, Liborio MM, Picena JC, Rabasa SL. Modelo murino de la diabetes clinicamente benigna de los jóvenes (MODY). Medicina (Buenos Aires) 1984; 44: 145-52.
23. Jones LC, Clark A. Beta cell neogenesis in type 2 diabetes mellitus. Diabetes 2001; 50 (Suppl 1): S186-S7.
24. Report of the Expert Committee on the diagnosis and classification of Diabetes Mellitus. Diabetes Care 2002; 25: S5-S20.
25. SPSS for Windows. Release 8.0 (computer program). Chicago, IL: SPSS Inc, 1998.
26. Aluja Banet T, Morineau A. Aprender de los datos: el análisis de componentes principales. Barcelona: EUB, 1999, p 176.
27. Carrasco JL, Hernán MA. Estadística multivariante en las ciencias de la vida. Fundamentos, Métodos y Aplicación. Madrid: Ciencia 3 Editorial, 1993, p 363.
28. Lébart L, Morineau A, Piron M. Système SPAD, Version 4.51 ®CISIA - CERESTA, 2000.
29. DeFronzo RA, Bonadonna R, Ferrannini E. Pathogenesis of NIDDM. Diabetes Care 1992; 15: 318-68.
30. Tarrés MC, Martínez SM, Montenegro SM, et al. Relación entre dieta, biomasa y expresión de la diabetes en la rata eSS. Medicina (Buenos Aires) 1990; 50: 235-43.
31. Tanimaya H, Shirawaka T, Furuoka H, Osame S, Kitamura N, Miyazawa K. Spontaneous diabetes mellitus in young cattle: histologic, inmunohistochemical, and electron microscopic studies of the islet of Langerhans. Vet Pathol 1993; 30: 46-54.
32. Butler A, Janson J, Bonner-Weir S, Ritzel R, Rizza R, Butler PC. B-cell deficit and increased B-cell apoptosis in humans with type 2 diabetes. Diabetes 2003; 52: 102-10.
33. Ritzel R, Butler P. Replication increases b-cell vulnerability to human islet amyloid polypeptide-induced apoptosis. Diabetes 2003; 52: 1701 -8.
34. Mandrup-Poulsen T. Apoptotic signal transduction pathways in diabetes. Biochem Pharmacol 2003; 15: 1433-40.
35. Koyama M, Wada R, Sakuraba H, Miukami H, Yagihashi S. Accelerated loss of islet beta cells in sucrose-fed Goto- Kakizaki rats, a genetic model of non-insulin-dependent diabetes mellitus. Am J Pathol 1998; 153: 537-45.
36. Hull RL, Westermark GT, Westermark P, Kahn SE. Islet amyloid: a critical entity in the pathogenesis of type 2 diabetes. J Clin Endocr Metab 2004; 89: 3629-43.
37. Ahren B. Type 2 diabetes, insulin secretion and beta-cell mass. Curr Mol Med 2005; 5: 275-86.
38. Kerr JFR, Wyllie AH, Currie AR. Apoptosis: a basic biological phenomena with wide-ranging implications in tissue kinetics. Br J Cancer 1972; 26: 239-57.
39. Steller H. Mechanism and genes of cellular suicide. Science 1995; 267: 1445-9.
40. Salomon RN, Díaz-Cano S. Introduction to apoptosis. Proc Natl Acad Sci USA 1996; 95: 2239-44.
41. Thompson CB. Apoptosis in the pathogenesis and treatment of disease. Science 1995; 267: 1456-62.
42. Balbarrey HL, Picena JC, Poy C, Guibert EE. Apoptosis e insuficiencia cardíaca. Rev Fed Arg Cardiol 2001; 30: 65-71.
43. Soga J, Yakuwa Y, Osaka M. Insulinoma/hypoglicemic syndrome: a statistical evaluation of 1085 reported cases of a Japanese series. J Exp Clin Cancer Res 1998; 17: 379-88.
44. Hayden M. Islet amyloid, metabolic syndrome, and the natural progressive history of type 2 diabetes. J Pancreas (Online) 2002; 3: 126-38.
45. Riccillo FL, Bracamonte MI, Cónsole GM, Gómez Dumm CLAG. Histomorphological and quantitative immunohistochemical changes in the rat pancreas during aging. Biocell 2004; 28: 127-34.
46. Dulin WE, Gerritsen GC, Chang AY. Characteristics of the pre diabetic state in the Chinese hamster and evaluation of environmental factors that affect expression of the diabetic genes. In: Shafrir E, Renold AE (eds). Lessons from Animal Diabetes. London: John Libbey, 1984, p 199-209.
47. Frankel BJ. Diabetes in the Chinese hamster. In: Shafrir E (ed). Lessons from Animal Diabetes VI. Boston-Basel- Berlin: Birkhäuser, 1996, p 267-98.
48. Wicker LS, Miller BJ, Cocker LZ. Genetic control of diabetes and insulitis in the nonobese diabetic (NOD) mouse. J Exp Med 1987; 165: 1639-54.
49. Mori Y, Yokoyama J, Nemoto M, Nishimura M, Ikeda Y. Expression of diabetes, its genetics and complications in WBN rats with endocrine-exocrine pancreatic lesions. In: Shafrir E (ed). Lessons from Animal Diabetes IV. London: Smith-Gordon, 1993, p 91-106. [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ]
Recibido: 15-08-2006
Aceptado: 26-12-2006














