Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Medicina (Buenos Aires)
versión impresa ISSN 0025-7680versión On-line ISSN 1669-9106
Medicina (B. Aires) v.67 n.6-2 Ciudad Autónoma de Buenos Aires nov./dic. 2007
Macrófagos e inducción de arginasa como mecanismo de evasión de parásitos
Cinthia C. Stempin, Fabio M. Cerbán
Area Inmunología, CIBICI-CONICET, Departamento de Bioquímica Clínica, Facultad de Ciencias Químicas, Universidad Nacional de Córdoba
Dirección postal: Dr. Fabio M. Cerbán, CIBICI-CONICET, Inmunología, Departamento Bioquímica Clínica, Facultad de Ciencias Químicas, Universidad Nacional de Córdoba, Haya de la Torre y Medina Allende s/n, Ciudad Universitaria, 5000 Córdoba, Argentina Fax: (54-351) 4333048 e-mail: fcerban@mail.fcq.unc.edu.ar
Resumen
Aunque existen varios mecanismos inmunológicos para eliminar a los patógenos intracelulares, éstos han elaborado una variedad de estrategias para escapar de la respuesta del sistema inmune y asegurarse su supervivencia y replicación en el huésped. Algunos parásitos modulan la producción de numerosas moléculas tóxicas sintetizadas por el sistema inmune. Varios parásitos son altamente sensibles al óxido nítrico (ON) y sus derivados. El ON es producido en macrófagos (MΦ) luego de la estimulación con productos microbianos o con citoquinas. En el pasado, los MΦ se identificaban como células puramente inflamatorias (MΦ activados en forma clásica), capaces de secretar mediadores inflamatorios, actuar como células presentadoras de antígenos y matar patógenos intracelulares. Sin embargo, los MΦ activados representan un grupo más heterogéneo de células con distintos marcadores biológicos que pueden llevar a cabo diferentes funciones inmunológicas. Los MΦ activados alternativamente, fallan en producir ON en virtud de la inducción de la enzima arginasa y consecuentemente tienen disminuida su capacidad para matar patógenos intracelulares. Se ha comunicado la inducción de arginasa por parte de varios parásitos, por lo tanto este mecanismo podría favorecer su supervivencia en el huésped. En un modelo de infección con Trypanosoma cruzi, en nuestro grupo estudiamos la participación de arginasa y de las señales intracelulares involucradas en su inducción, durante la replicación de este parásito en los MΦ. La información obtenida a partir de nuestros trabajos permitiría comprender algunos mecanismos por los cuales distintas células del sistema inmune pueden ser programadas para favorecer el establecimiento de infecciones parasitarias crónicas.
Palabras clave: Macrófagos; Arginasa; Parásitos; MAPK; Trypanosoma cruzi
Abstract
Macrophages and arginase induction as a mechanism for parasite escape. Although there are several immunological mechanisms to eliminate the intracellular pathogens, they have elaborated a variety of strategies to escape of the immune response and to make possible their survival and replication in the host. Some parasites modulate the production of several toxic molecules synthesized by the immune system. Several parasites are highly sensitive to nitric oxide (ON) and their derivatives. ON is produced in macrophages (MΦ) after stimulation with microbial products or cytokines. In the past, M Φ were defined as inflammatory cells (classically activated MΦ), able to produce inflammatory mediators, to act like antigens presenting cells and to kill intracellular pathogens. Nevertheless, activated MΦ involve a more heterogeneous group of cells with different biological markers that can carry out different immunological functions. Alternatively activated MΦ fail to produce ON due to the arginase induction and consequently they have diminished their capacity to kill intracellular pathogens. It has been reported the induction of arginase by different parasites; therefore this mechanism could favor their survival in the host. In our group, we studied the participation of arginase in a model of Trypanosoma cruzi infection and the intracellular signals involved in the replication of this parasite in MΦ. The data obtained from our works would allow the understanding of some mechanisms by which cells can be programmed to favor the establishment of chronic parasitic infections.
Key words: Macrophages; Arginase; Parasite; MAPK; Ttrypanosoma cruzi
Los MΦ representan actualmente un grupo de células heterogéneas con múltiples funciones1, 2. El primer indicio de la heterogeneidad de los MΦ apareció con la caracterización de los "MΦ activados alternativamente" (MΦaA). La exposición de MΦ a IL-4 o glucocorticoides induce una población de células que incrementan la expresión de ciertos receptores fagocíticos, pero que fallan para producir radicales del oxígeno3, 4, lo cual conduce a una limitada muerte de los patógenos intracelulares. Si bien a estos MΦ se los denominó MΦaA, este término no es del todo adecuado, ya que esta denominación estaría señalando que es la única manera, adicional a la clásica, de activar al MΦ. Estudios recientes sugieren que éste no es el caso ya que la exposición de MΦ a señales de activación clásicas, como el lipopolisacárido (LPS) o el INF-γ, en presencia de complejos inmunes induce la generación de un tipo celular fundamentalmente diferente al "MΦ activado clásicamente" (MΦaC). Estas células liberan grandes cantidades de IL-10 y de esta manera son inhibidores potentes de la respuesta inflamatoria inducida por endotoxinas bacterianas2. Estos MΦ han sido denominados "MΦ activados Tipo 2" (MΦaT2)5 debido a su habilidad para inducir respuestas de células Th2.
Macrófago activado clásicamente (MΦaC)
Los MΦ se activan clásicamente en respuesta a la citocina IFN-γ en combinación con el factor de necrosis tumoral (TNF-α) o un estímulo que induce TNF-α6. Una de las características principales de estas células es la inducción de la enzima óxido nítrico sintetasa inducible (iNOS) que actúa sobre L-arginina produciendo óxido nítrico (ON) y citrulina7 (Fig. 1). La iNOS es inducida en MΦ a través de las citocinas inflamatorias como TNF-α, IFN-γ e IL-12.
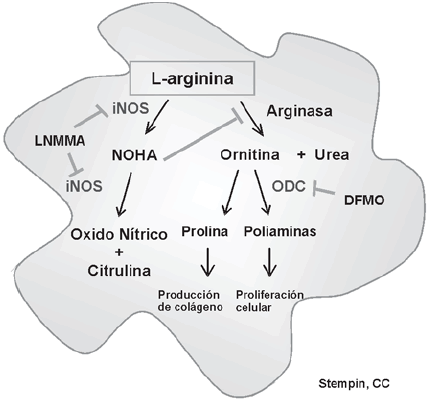
Fig. 1.- Metabolismo de L-arginina. En MΦ, L-arginina puede ser metabolizada por dos vías diferentes. Por un lado, es oxidada por la enzima óxido nítrico sintetasa (iNOS), inducida por citocinas Th1, para generar óxido nítrico (ON) y citrulina. Durante este proceso se genera un compuesto intermediario NOHA, que es un potente inhibidor de arginasa. Por otra parte, L-arginina es hidrolizada a urea y ornitina a través de la acción de la enzima arginasa. Existen dos isoformas de esta enzima en células de mamíferos: arginasa I, citosólica inducida por citocinas Th2 en MΦ, mientras que arginasa II es mitocondrial y se expresa de manera constitutiva. Luego, por la acción de la ornitina decarboxilasa (ODC), la ornitina es transformada a poliaminas (putrescina, espermidina y espermina). Estas últimas son aminas de bajo peso molecular, cuya función está relacionada a la proliferación y división celular. Por otra parte la prolina producida a partir de la ornitina es un componente clave para la síntesis de colágeno. LNMMA: N-G-metil-L-arginina, DFMO: di-fluor-metil ornitina, ODC: ornitina decarboxilasa, NOHA: NG-hidroxi- L-arginina
Por otra parte, los MΦaC pueden ser identificados por una variedad de criterios funcionales y bioquímicos. Estas células muestran un incremento en la expresión de moléculas del complejo mayor de histocompatibilidad clase II (MHC) y de moléculas co-estimulatorias. Además, los MΦaC tienen mayor capacidad para presentar antígenos y para eliminar patógenos intracelulares. Sin embargo, los MΦaC expresan niveles reducidos del receptor de manosa (RM) y se observa que estas células liberan citocinas pro-inflamatorias como IL-6, TNF-α, IL-12 e IL-16, 8.
Estas c élulas migran a los sitios de inflamación donde encuentran a los patógenos y los degradan. Estos MΦ poseen un marcado incremento en su capacidad para eliminar microorganismos intracelulares y durante varios años este fue el criterio funcional utilizado para definir que un MΦ estaba activado. Esta muerte está acompañada por un incremento en la producción de especies tóxicas del oxígeno.
En este contexto, ON act úa como una molécula efectora citotóxica del sistema inmune. Varios estudios demuestran la toxicidad de esta molécula y sus derivados frente a distintos patógenos. Las acciones antimicrobianas han sido atribuidas al ON y también a varios productos de reacción del ON, que comúnmente se denominan intermediarios reactivos del nitrógeno, como por ejemplo el peroxinitrito9.
Se ha estudiado el rol de iNOS en varias infecciones utilizando ratones knock out y se ha demostrado que en algunas de ellas la actividad de esta enzima es esencial para el control del patógeno, como es el caso de Leishmania major10, Salmonella typhimurium11, entre otros. En la infección con Trypanosoma cruzi se ha informado que los ratones deficientes en iNOS son altamente susceptibles a la infección12, mientras que Cummings y col. demostraron que iNOS es importante pero no esencial para el control de la infección con este parásito13.
Macrófago activado alternativamente (MΦaA)
En 1990, mientras se examinaba la regulación de la expresión del RM, Gordon y col. observaron que una manera eficiente de inducir la expresión de este receptor era tratar los MΦ con IL-4. Los autores arribaron a la conclusión de que los MΦ tratados con IL-4 asumían un "fenotipo de activación alternativa"4. Esto representó la primera descripción de los MΦ que exhibían señales de activación, claramente diferentes a las de los activados clásicamente. Estudios subsecuentes de Goerdt y Orfanos8 han clasificado a esta célula como un MΦ regulador, con diversos roles biológicos diferentes a los del MΦaC. Además se demostró que también la IL-13 puede activar alternativamente a los MΦ, debido a que esta citocina comparte una cadena del receptor con el de IL- 41. También se ha visto que la generación de MΦaA ocurre como resultado de la captura de células apoptóticas14.
Los MΦaA, en contraste con los MΦaC, fallan en producir ON a partir de L-arginina, en virtud a la inducción de la enzima arginasa3 y estos MΦ tienen comprometida su capacidad para eliminar patógenos intracelulares. A través de arginasa se produce urea y ornitina, y luego poliaminas y prolina8 (Fig. 1).
Estos MΦ exhiben una incrementada capacidad de endocitosis y fagocitosis. Sin embargo, no son eficientes células presentadoras de antígenos y, en muchas instancias, inhiben la proliferación de las células T. La actividad supresora de estos MΦ alcanza a células T activadas por mitógenos, las cuales muestran una respuesta proliferativa y secretoria significativamente disminuida en presencia de MΦaA8, 15, 16. Las citocinas características producidas por estos MΦaA son la IL-10, el receptor antagonista de IL-1 (IL-1RA) y TGF-β1, 8.
Por otro lado, recientemente, se ha demostrado que la arginasa I se expresa en forma constitutiva en los granulocitos humanos y participaría como un nuevo mecanismo efector contra hongos, disminuyendo en forma marcada la disponibilidad de arginina en el fagolisosoma17. A diferencia de la arginasa I murina, su expresión no es influenciada por citoquinas pro-inflamatorias o anti-inflamatorias in vitro. Por otro lado, su localización no es citosólica sino que está presente en los gránulos azurófilos y se ha determinado que la arginasa presente en gránulos de neutrófilos humanos tiene capacidad de suprimir las funciones de la célula T18.
Por otra parte, varios estudios han dilucidado la expresión diferencial de genes en MΦaA. Se han identificado genes que codifican para una lectina secretoria (Ym1) y para arginasa, como los más frecuentemente incrementados en MΦ tratados con IL-419. Además, se ha demostrado que en MΦaA, durante la infección con Brugia malayi, los genes inducidos más abundantemente son Ym1 y FIZZI, el cual codifica para una proteína que es secretada20.
Estudios recientes en esta población celular han comenzado a focalizar su función potencial en la curación de heridas y angiogénesis. Los MΦaA producen altos niveles de fibronectina y proteínas asociadas a la matriz extracelular21. La inducción de arginasa en estas células puede llevar a la biosíntesis de poliaminas y prolina, promoviendo el crecimiento celular, la formación de colágeno y la reparación de tejidos (Fig. 1). Además, la producción de citocinas anti-inflamatorias podría frenar el proceso inflamatorio inducido por los MΦaC22. Asimismo, la capacidad de los MΦaA de suprimir la proliferación de las células T explica su presencia en la placenta y el pulmón de individuos sanos8. También se han encontrado en sitios inmunoprivilegiados, sugiriendo que los MΦaA protegen a los órganos y tejidos circundantes de la respuesta inmune dañina1.
Macrófago activado tipo 2 (MΦaT2)
Posteriormente, el grupo de Mosser demostró que la unión de inmunocomplejos a los receptores Fc para la IgG (FcγRs) en MΦ suprimía la síntesis de IL-1223 e inducía la secreción de grandes cantidades de IL-1024. Se ha utilizado una gran variedad de complejos inmunes y diferentes estímulos de activación, y en todos los casos la unión del FcγR resultó en una producción alterada de estas dos citocinas25. Al igual que para los MΦaC descriptos anteriormente, la activación tipo 2 requiere de dos señales. La primera señal es la unión al receptor Fcγ; sin embargo, ésta debe estar acoplada a una segunda que estimule al MΦ a producir citocinas a través de los receptores de tipo Toll.
Los MΦaT2 exhiben similitudes funcionales con los MΦaA y MΦaC. Al igual que los MΦaC, ellos producen TNF-α, IL-1 e IL-6. Sin embargo, a diferencia de los MΦaC, los MΦaT2 no producen IL-12, pero secretan IL-10 y dirigen la respuesta inmune hacia un perfil Th2. Este fenotipo es parecido al de activación alternativa, pero en contraste a los MΦaA, los MΦaT2 no tienen actividad de arginasa2, 6.
Por lo tanto, hasta el momento existirían al menos tres poblaciones diferentes: la primera y mejor definida es la de MΦaC, cuyo rol es participar como célula efectora en una respuesta celular de tipo Th18. El segundo tipo celular, el MΦaA, parece estar involucrado en la inmunosupresión y la reparación de tejidos8, y además estos MΦ presentan la capacidad de fagocitar cuerpos apoptóticos derivados de células muertas26. La adición más reciente a la lista es el MΦaT2, el que ejerce funciones antiinflamatorias e induce una respuesta inmune humoral de tipo Th227. Juntas, estas tres poblaciones celulares podrían formar su propia red reguladora para prevenir que una respuesta inmune progrese a una enfermedad inmune.
El MΦ, una célula con capacidad para eliminar patógenos intracelulares
Los MΦ tienen un rol central en la respuesta a las infecciones. La generación de metabolitos como los intermediarios reactivos del oxígeno y nitrógeno, permite atribuirle a estas células una potente actividad microbicida. Concomitantemente, es necesario que se disparen mecanismos de control que les permitan evitar la excesiva activación del sistema inmune cada vez que el organismo enfrente a un antígeno extraño. Por otro lado, los MΦaA en condiciones normales, han sido identificados en tejidos en los cuales es necesario evitar la inflamación, como pulmón y placenta28. Recientemente se demostró la presencia de actividad de arginasa en sangre periférica de mujeres embarazadas, y se encontró incrementada la actividad de esta enzima en la placenta29; también estos MΦ han sido identificados durante la fase de remisión de reacciones inflamatorias agudas y crónicas como en la artritis reumatoidea y psoriasis30, 31. Por lo tanto, la generación de MΦaA luego de la inflamación permitiría el correcto funcionamiento inmunológico y el mantenimiento de la homeostasis del organismo. Sin embargo, recientemente se ha visto que el fenotipo de activación alternativa de MΦ, puede ser aprovechado por varios microorganismos32, 33 y por células tumorales34 para persistir y proliferar en el huésped.
Debido a lo expuesto, una de las posibilidades de tener éxito en la eliminación de un agente invasor (infeccioso o tumoral) depende de la existencia de señales temporal y espacialmente organizadas que regulen con precisión el tipo de activación que sufrirá el MΦ.
Arginasa versus iNOS como mecanismo de evasión para favorecer la supervivencia de parásitos en MΦ
En modelos de infección con helmintos se ha observado que la infección de ratones con el nematodo Brugia malayi, que causa la infección en humanos, produce un reclutamiento de MΦ que expresan fenotipo de MΦaA y que este fenómeno es dependiente de IL-416. Además, en un modelo de cisticercosis, ratones infectados con Taenia crassiceps muestran una respuesta Th1 en etapas tempranas de la infección, la cual es reemplazada por una Th2 en la etapa crónica y se acompaña con la aparición de una población de MΦaA35 que exhiben actividad de arginasa36. Se ha visto que carbohidratos presentes en T. crapssiceps pueden producir el cambio perjudicial de respuesta Th1 hacia una Th2 durante la infección, induciendo MΦaA productores de IL-1037. En otro trabajo se demostró que la infección previa con Taenia crassiceps favorece la parasitemia e induce lesiones cutáneas más importantes durante la co-infección con Leishmania major o con Leishmania mexicana. Estos autores demostraron que la infección con este cestode favorece la instalación de Leishmania a través de la inducción de MΦaA más que por una inhibición de la respuesta Th138.
Por otra parte, ha sido ampliamente demostrado que carbohidratos presentes en los huevos de Schistosoma mansoni (SEA) podrían ser los responsables del cambio de respuesta tipo Th1 presente en etapas tempranas, a Th2 durante etapas tardías de la infección39. Además, durante la infección experimental con S. mansoni, se ha observado actividad de arginasa y un incremento en los niveles de poliaminas en circulación en los ratones infectados, lo cual podría favorecer el crecimiento de los helmintos40. Asimismo, los MΦaA promueven la síntesis de prolina a través de arginasa, incrementando el depósito de colágeno y la fibrosis hepática22. Estos datos sugieren que la actividad de la enzima arginasa, presente en los MΦaA, contribuye a la patología granulomatosa durante la infección con Schistosoma.
Asimismo, se ha informado que durante la infección con Trypanosoma brucei, la activación sostenida de MΦ por la vía clásica podría inducir daño de tejidos; por lo tanto, los ratones que progresan a una etapa crónica generan una respuesta tipo Th2, capaz de favorecer el desarrollo de MΦaA41.
Por otra parte, se ha observado que Leishmania major tiene la capacidad de inhibir la producción de IL-12 a través de la inducción de IL-10 y TGF-β. Esta desviación de Th1 a Th2/Th3 refleja la susceptibilidad a la enfermedad42. Este ambiente produce la activación del MΦ por la vía alternativa, facilitando la diseminación del parásito en el huésped. Además, el tratamiento de MΦ con IL-4 previo a la infección con Leishmania major o Leishmania infantum dirige el metabolismo de L-arginina a través de arginasa hacia la síntesis de poliaminas, las cuales promueven el crecimiento intracelular del parásito. También, la inhibición de la actividad de arginasa disminuye el número de parásitos intracelulares al incrementar la producción de ON. De esta manera, MΦaA evocados en un ambiente de citocinas Th2/Th3 durante la infección con Leishmania podría ser perjudicial para el huésped43.
En nuestro grupo demostramos la influencia de un antígeno del Trypanosoma cruzi, cruzipaina (Cz), sobre las vías de activación de MΦ, ya que los MΦ activados por esta glicoproteina, muestran un perfil de activación alternativa. En nuestros experimentos, observamos que los MΦ activados por Cz producen urea (a través de la activación de arginasa), IL-10 y TGF-β pero no ON e IL-1244. Además, demostramos que los MΦ de ratones BALB/c infectados muestran un incremento de arginasa a medida que la infección aguda progresa, y la inhibición de esta enzima lleva a una reducción en el número de amastigotes en células provenientes de animales infectados. De esta manera se demuestra la importancia que presenta la inducción de la vía para que la infección prospere. En relación a esto se ha demostrado que monocitos de sangre periférica de ratas infectadas con Trypanosoma cruzi no son capaces de producir ON a expensas de un incremento en la actividad de arginasa45.
En los MΦ activados alternativamente por Cz y luego infectados con T. cruzi, se observó un incremento en el número de parásitos. Este fenómeno podría atribuirse a TGF-β, que es inducido por Cz, ya que se ha demostrado que este factor es capaz de desplazar el metabolismo de L-arginina en MΦ, disminuyendo ON e induciendo la producción de ornitina, con la subsiguiente biosíntesis de poliaminas14. Además, TGF-β también ejerce un potente efecto regulatorio sobre la función de MΦ, incluyendo la supresión de la producción de IL-1246; en este sentido, observamos que las células activadas por Cz no son capaces de producir IL-12. Por otra parte, se ha demostrado que la IL-10 liberada por MΦaA es capaz de inhibir la generación de MΦaC a partir de MΦ estimulados con CpG-DNA47. Nuestros resultados demuestran que las células peritoneales activadas con Cz son capaces de liberar grandes cantidades de IL-10, de esta manera se incrementaría la activación alternativa de MΦ favoreciendo la replicación parasitaria44. Además se ha demostrado que IL-10 y algunos antígenos microbianos, como por ejemplo el fosfoglicano presente en promastigotes de Leishmania48 presentan la capacidad de inhibir la producción de IL-1227,49.
Por lo tanto, el balance entre citocinas anti-inflamatorias (IL-10 y TGF-β) y pro-inflamatorias (IL-12) al comienzo de la infección con T. cruzi podría ser crucial para permitir la instalación del parásito. En este sentido, Cz se comportaría de modo equivalente a los antígenos presentes en T. crapssiceps37 o a los existentes en los huevos de S. mansoni39, a los que podría atribuirse la capacidad de producir el cambio de respuesta Th1 a Th2 durante etapas tempranas de la infección. Además, se ha demostrado que la inmunización de ratones BALB/c con Cz dirige la respuesta hacia un perfil Th2 y se generan MΦ de bazo activados alternativamente50, mientras que la inmunización de ratones C57BL/6 con Cz induce un perfil Th1 en las células de bazo de estos ratones51.
Nuestros estudios mostraron que en células J774 activadas con Cz no se expresa iNOS; de esta manera Cz induciría regulación negativa de iNOS, lo cual podría deberse al consumo de L-arginina a través de arginasa inducida en estos MΦ44. Estos hallazgos sugerirían que la interacción de este antígeno con MΦ daría como resultado consecuencias negativas en los mecanismos de eliminación de parásitos. Es así como nuestros resultados demuestran que células J774 incubadas en presencia de Cz poseen menor capacidad para eliminar parásitos intracelulares que aquellas incubadas con LPS44. En este sentido, durante nuestros estudios demostramos que los MΦ tratados con Cz se comportan de manera similar a aquellos incubados con IL-4, que es un potente inductor de arginasa44. Además, la inhibición de arginasa también condujo a una drástica reducción de la replicación del T. cruzi dentro de MΦ52. Por lo tanto, los hallazgos de nuestro grupo en relación a la activación alternativa de MΦ, extenderían los hallazgos informados para otros parásitos a la infección con T. cruzi. Nuestro trabajo fue el primero en demostrar la capacidad de un antígeno parasitario de inducir la activación alternativa de MΦ in vitro44 y demostramos que el perfil de activación alternativa se asoció con una capacidad funcional de estas células para promover el crecimiento intracelular del parásito44. Este podría ser un mecanismo de evasión a la respuesta inmune innata usado por T. cruzi para favorecer su instalación en el huésped (Fig. 2).

Fig. 2.- Modelo de activación alternativa de macrófagos inducida por cruzipaina. Diagrama resumiendo el modelo de activación alternativa de macrófagos (aAMΦ) inducido por cruzipaina (Cz). Cz contacta con su receptor/ no es identificado/s en macrófagos e induce la aAMΦ, a través de la expresión de arginasa, liberación de IL-10 y TGF-β. Los MΦaA ofrecen un ambiente propicio para que los amastigotes de T. cruzi se repliquen descontroladamente. Además los MöaA pueden favorecer el perfil Th2.
Mediadores intracelulares involucrados en la activación de arginasa dada por cruzipaina
Uno de los primeros trabajos que indagaron acerca de las señales intracelulares que participaban en la activación de arginasa mediado por LPS fue realizado por Corraliza y col.53. En ese trabajo se demostró que la activación de proteína kinasa A (PKA) era requerida para que se active la arginasa en MΦ tratados con LPS; mientras que la activación de la enzima no dependía de PKC, ni del incremento en los niveles intracelulares de Ca++53. Más tarde, se estudiaron las señales intracelulares involucradas en la inducción de arginasa en MΦ estimulados con IL-13.
Chan y col. demostraron que el efecto regulador negativo de IL-13 sobre la producción de ON era ejercido a través de la inducción de arginasa. La activación de esta enzima involucraba la activación de varias señales intracelulares como PKA, tirosina kinasas (TK) y p38 MAPK, además de la participación del mensajero AMPc54. También se ha demostrado la participación del factor de transcripción STAT-6 en la inducción de la expresión del gen de arginasa I en MΦ tratados con IL-4 e IL-1355. Recientemente, se demostró que la manipulación indirecta del ON a través de la modulación de la actividad de arginasa representa un importante mecanismo bioquímico que regula la actividad de NF-kB. Esto sería relevante en ciertas infecciones o inflamaciones crónicas donde se demostró activación de NF-kB como así también de arginasa56.
En nuestros trabajos se estudiaron las señales intracelulares disparadas por Cz para inducir arginasa a través de la utilización de inhibidores farmacológicos de distintas proteína kinasas. Estos estudios revelaron que la activación de arginasa mediada por Cz involucra la activación de múltiples señales intracelulares como TK, PKA y p38 MAPK, ya que el tratamiento con estos inhibidores disminuyó la actividad de arginasa inducida por Cz (Fig. 3). Estos datos muestran que Cz dispara un patrón de señales intracelulares similares al que utiliza IL-13 para activar arginasa54; además, al igual que lo que ocurre con LPS53 también Cz induce arginasa a través de PKA.
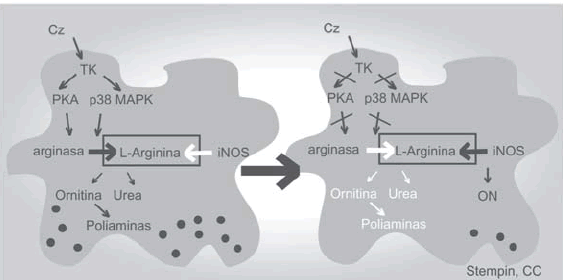
Fig. 3.- Efecto de la inhibición de señales que inducen arginasa sobre el crecimiento de T. cruzi. Diagrama resumiendo las vías de señalización involucradas en la inducción de arginasa mediada por Cz, y el efecto de la inhibición de las mismas sobre la replicación del parásito. Cz al contactar con su receptor/es no identificado/s en macrófagos, activa distintas señales intracelulares como tirosina kinasas (TK), p38 MAPK y proteína kinasa A (PKA), que llevan a la inducción de la enzima arginasa, la cual favorece la replicación de amastigotes de T. cruzi. La inhibición de TK, p38 MAPK, PKA o arginasa en los macrófagos activados por Cz, produce un cambio en el metabolismo de L-arginina, favoreciendo la actividad de la enzima iNOS, lo cual lleva al control de la replicación parasitaria.
Mediadores intracelulares que favorecen la proliferación de prásitos
La capacidad de varios microorganismos de persistir en el huésped reside en su habilidad para evadir mecanismos de defensa presentes en diferentes células del sistema inmune, como el MΦ. La interferencia con estas respuestas puede ser debida a la manipulación directa por parte del parásito de múltiples cascadas de señales intracelulares necesarias para que tales mecanismos de defensa sean eficientes.
Estudios previos han demostrado que Leishmania major y Toxoplasma gondii pueden suprimir la liberación de citocinas pro-inflamatorias, desestabilizando señales intracelulares requeridas para la síntesis de las mismas57, 58. En otro trabajo han sugerido que la activación de MAPK en MΦ es diferente, dependiendo si éstos se infectaron con cepas patogénicas o no patogénicas de micobacterias59. La activación de MAPK en MΦ juega un importante rol en promover actividad anti-microbiana y en la producción de varias moléculas efectoras, luego de una infección con micobacterias60.
En nuestro trabajo estudiamos si la inhibición de señales que inducen arginasa tiene influencia en el crecimiento del parásito. Observamos que el tratamiento con los inhibidores de TK, PKA y p38 MAPK en células J774 estimuladas con Cz y luego infectadas causaba una disminución en el crecimiento del parásito, que se correlacionaba con un desplazamiento en el balance nitritos/ urea a favor de la producción de nitritos52. Estos resultados mostraron por primera vez la existencia de señales intracelulares que regulan el balance iNOS/arginasa en MΦ y que están implicadas en el control/persistencia de Trypanosoma cruzi en estas células52 (Fig. 3). Además, también observamos que el tratamiento con estos inhibidores reducía la carga parasitaria de células adherentes de bazo (CAB) provenientes de ratones infectados; de esta manera estas señales son también importantes in vivo para favorecer la replicación de T. cruzi dentro de MΦ. Estudios de otros grupos han relacionado el rol de p38 MAPK en el crecimiento parasitario en MΦ. Junghae y Raynes observaron que la activación de p38 MAPK atenúa la infección de MΦ con Leishmania donovani61, mientras que Wei y col. demostraron que el inhibidor de p38 MAPK bloquea el crecimiento intracelular de T. gondii62. Estos autores demostraron más tarde la presencia de una proteína MAPK en T. gondii con una similitud significativa con una isoforma de p38 presente en humanos, y se designó como TgMAPK-163. El inhibidor de p38 MAPK es capaz de bloquear la autofosforilación de la TgMAPK-1, por lo tanto estos autores no descartan la posibilidad de que la disminución en la replicación de T. gondii observada anteriormente se deba a un efecto directo sobre la kinasa presente en el parásito63. También se ha observado que la eliminación de un gen de MAPK de Leishmania resulta en un defecto en la replicación del parásito dentro de MΦ64.
Aunque se conoce muy poco acerca del rol que juegan las MAPKs en el ciclo de vida de los parásitos, esta información sería interesante para entender la biología de los mismos y además podría ser útil en el desarrollo de drogas que actúen sobre las MAPK presentes en los parásitos, sin alterar la fosforilación de las kinasas involucradas en procesos fisiológicos de la célula huésped65.
Por otra parte, el hallazgo reciente de la secuencia del genoma de T. cruzi ha permitido identificar la presencia de diversas PK y fosfatasas con pocas similitudes a las presentes en eucariotas66. Por lo tanto, se generan expectativas en relación a estas proteínas presentes en el parásito que pueden ser moléculas blanco para el desarrollo de nuevas drogas.
En consecuencia, sería importante para el parásito modular las señales intracelulares que conducen a la inducción de arginasa en combinación con la regulación negativa de iNOS. En este sentido se comprobó que Cz no es capaz de inducir la activación de PKC, p44/p42 MAPK ni JNK, demostrando que no son señales involucradas en la inducción de arginasa. Cuando las CAB provenientes de ratones infectados se trataron con los inhibidores de JNK, PKC y p44/p42 MAPK, se observó un incremento del número de amastigotes intracelulares.
En relación a estos ensayos varios investigadores han estudiado el rol de ciertas moléculas del parásito con capacidad de favorecer su persistencia en el huésped. Se ha demostrado que el lipofosfoglicano presente en Leishmania es capaz de suprimir la producción de IL-12, presumiblemente debido a la incapacidad de esta molécula de causar la fosforilación de p44/p42 MAPK67. Asimismo se ha informado que la infección con Leishmania inhibe la actividad de PKC de MΦ, lo cual ha sido relacionado a una menor reacción en el estallido respiratorio en respuesta a ésteres de forbol. Además, la inhibición de PKC en MΦ con un inhibidor específico, previo a la infección con Leishmania, resulta en un incremento de la proliferación del parásito. Se ha sugerido que la capacidad de inhibir PKC estaría dada por la molécula lipofosfoglicano del parásito68. En este caso, estos resultados concuerdan con los demostrados en nuestro grupo ya que el tratamiento de CAB de animales infectados con el inhibidor de PKC aumenta la carga parasitaria en estas células.
Por otra parte, se ha demostrado que cepas no virulentas de Mycobacterium avium inducen la activación de p44/p42 MAPK, y la inhibición de esta vía resulta en una disminución de la producción de TNFα e incrementa la proliferación de la micobacteria. En contraste, el crecimiento de una cepa virulenta se reduce cuando se inhibe p38 MAPK69. Estos resultados concuerdan con los nuestros, ya que la inhibición de p38 MAPK en CAB de ratones infectados reduce la carga parasitaria, en cambio la inhibición de p44/p42 MAPK y JNK causó un incremento en el número de amastigotes en estas células.
Por lo expuesto, nuestro trabajo aporta evidencias en relación a las señales intracelulares involucradas en la inducción de arginasa mediada por un antígeno parasitario y demuestra la importancia de estas señales para favorecer la proliferación del T. cruzi. Por lo tanto, el estudio de los mecanismos moleculares a través de los cuales se establecen interacciones huésped-parásito permitiría avanzar en el conocimiento de la biología de los parásitos como así también de las células en las cuales ellos residen.
Implicancias y consecuencias terapéuticas de la inhibición de arginasa
El rol exacto de arginasa I en células y tejidos extra-hepáticos no está claro; aunque la inducción de arginasa en MΦ humanos in vitro ha sido dificultosa, la expresión de arginasa se ha detectado en células mononucleares humanas luego de una injuria70, en células inflamatorias de lavados bronqueoalveolares de pacientes asmáticos71, en cáncer72 y lesiones de psoriasis73. Recientemente se ha demostrado la expresión constitutiva de arginasa I en granulocitos humanos17, 74. Por otra parte, la arginasa puede modular la función de las células T, reduciendo la proliferación y regulando negativamente la expresión de CD3 zeta, que corresponde a la cadena transductora de señales del TCR75. Por lo tanto, se podría hipotetizar que la inhibición de arginasa sería beneficiosa para el control de varias enfermedades, entre ellas la infección con T. cruzi. En este sentido, se ha demostrado que la inhibición de esta enzima durante la infección experimental con Leishmania disminuye los efectos adversos de la infección y controla la replicación parasitaria76, 77 y se ha sugerido que la modulación del metabolismo de L-arginina podría ser una nueva estrategia para el tratamiento del asma78. Sin embargo, la arginasa participa en procesos normales de la célula y su inhibición en hígado podría ser perjudicial para el huésped. Por lo tanto la posibilidad de un tratamiento a través de la inhibición de arginasa debe ser cuidadosamente evaluada. No obstante, el estudio de los mecanismos que regulan específicamente la expresión de esta enzima en MΦ y neutrófilos, sería de interés para poder modularla sin afectar su actividad y expresión fisiológica en otros tejidos.
Nota: Fabio M. Cerbán es Miembro de la Carrera del Investigador del CONICET y Cinthia C. Stempin es becaria post doctoral del CONICET.
1. Gordon S. Alternative activation of macrophages. Nat Rev Immunol 2003; 3: 23-35.
2. Edwards JP, Zhang X, Frauwirth KA, Mosser DM. Biochemical and functional characterization of three activated macrophage populations. J Leukoc Biol 2006; 80: 1298-307.
3. Modolell M, Corraliza IM, Link F, Soler G, Eichmann K. Reciprocal regulation of the nitric oxide synthase/ arginase balance in mouse bone marrow-derived macrophages by TH1 and TH2 cytokines. Eur J Immunol 1995; 25: 1101-4.
4. Stein M, Keshav S, Harris N, Gordon S. Interleukin 4 potently enhances murine macrophage mannose receptor activity: a marker of alternative immunologic macrophage activation. J Exp Med 1992; 176: 287-92.
5. Anderson CF, Mosser DM. A novel phenotype for an activated macrophage: the type 2 activated macrophage. J Leukoc Biol 2002; 72: 101-6.
6. Mosser DM. The many faces of macrophage activation. J Leukoc Biol 2003; 73: 209-12.
7. Hibbs JB Jr. Infection and nitric oxide. J Infect Dis 2002; 185: Suppl 1, S9-17.
8. Goerdt S, Orfanos CE. Other functions, other genes: alternative activation of antigen-presenting cells. Immunity 1999; 10: 137-42.
9. Bogdan C. Nitric oxide and the immune response. Nat Immunol 2001; 2: 907-16.
10. Assreuy J, Cunha FQ, Epperlein M, et al. Production of nitric oxide and superoxide by activated macrophages and killing of Leishmania major. Eur J Immunol 1994; 24: 672-6.
11. Mastroeni P, Vazquez-Torres A, Fang FC, et al. Antimicrobial actions of the NADPH phagocyte oxidase and inducible nitric oxide synthase in experimental salmonellosis. II. Effects on microbial proliferation and host survival in vivo. J Exp Med 2000; 192: 237-48.
12. Saeftel M, Fleischer B, Hoerauf A. Stage-dependent role of nitric oxide in control of Trypanosoma cruzi infection. Infect Immun 2001; 69: 2252-9.
13. Cummings KL, Tarleton RL. Inducible nitric oxide synthase is not essential for control of Trypanosoma cruzi infection in mice. Infect Immun 2004; 72: 4081-9.
14. Freire-de-Lima CG, Nascimento DO, Soares MB, et al. Uptake of apoptotic cells drives the growth of a pathogenic trypanosome in macrophages. Nature 2000; 403: 199-203.
15. Schebesch C, Kodelja V, Muller C, et al. Alternatively activated macrophages actively inhibit proliferation of peripheral blood lymphocytes and CD4+ T cells in vitro. Immunology 1997; 92: 478-86.
16. Loke P, MacDonald AS, Robb A, Maizels RM, Allen JE. Alternatively activated macrophages induced by nematode infection inhibit proliferation via cell-to-cell contact. Eur J Immunol 2000; 30: 2669-78.
17. Munder M, Mollinedo F, Calafat J, et al. Arginase I is constitutively expressed in human granulocytes and participates in fungicidal activity. Blood 2005; 105: 2549-56.
18. Munder M, Schneider H, Luckner C, et al. Suppression of T-cell functions by human granulocyte arginase. Blood 2006; 108: 1627-34.
19. Welch JS, Escoubet-Lozach L, Sykes DB, Liddiard K, Greaves DR, Glass CK. TH2 cytokines and allergic challenge induce Ym1 expression in macrophages by a STAT6-dependent mechanism. J Biol Chem 2002; 277: 42821-9.
20. Loke P, Nair MG, Parkinson J, Guiliano D, Blaxter M, Allen JE. IL-4 dependent alternatively-activated macrophages have a distinctive in vivo gene expression phenotype. BMC Immunol 2002; 3: 7.
21. Gratchev A, Guillot P, Hakiy N, et al. Alternatively activated macrophages differentially express fibronectin and its splice variants and the extracellular matrix protein betaIG-H3. Scand J Immunol 2001; 53: 386-92.
22. Hesse M, Modolell M, La Flamme AC, et al. Differential regulation of nitric oxide synthase-2 and arginase-1 by type 1/type 2 cytokines in vivo: granulomatous pathology is shaped by the pattern of L-arginine metabolism. J Immunol 2001; 167: 6533-44.
23. Sutterwala FS, Noel GJ, Clynes R, Mosser DM. Selective suppression of interleukin-12 induction after macrophage receptor ligation. J Exp Med 1997; 185: 1977-85.
24. Sutterwala FS, Noel GJ, Salgame P, Mosser DM. Reversal of proinflammatory responses by ligating the macrophage Fcgamma receptor type I. J Exp Med 1998; 188: 217-22.
25. Gerber JS, Mosser DM. Reversing lipopolysaccharide toxicity by ligating the macrophage Fc gamma receptors. J Immunol 2001; 166: 6861-8.
26. Fadok VA, Bratton DL, Konowal A, Freed PW, Westcott JY, Henson PM. Macrophages that have ingested apoptotic cells in vitro inhibit proinflammatory cytokine production through autocrine/paracrine mechanisms involving TGF-beta, PGE2, and PAF. J Clin Invest 1998; 101: 890-8.
27. Mosser DM, Karp CL. Receptor mediated subversion of macrophage cytokine production by intracellular pathogens. Curr Opin Immunol 1999; 11: 406-11.
28. Mues B, Langer D, Zwadlo G, Sorg C. Phenotypic characterization of macrophages in human term placenta. Immunology 1989; 67: 303-7.
29. Kropf P, Baud D, Marshall SE, et al. Arginase activity mediates reversible T cell hyporesponsiveness in human pregnancy. Eur J Immunol 2007, 37: 935-45.
30. Goerdt S, Bhardwaj R, Sorg C. Inducible expression of MS-1 high-molecular-weight protein by endothelial cells of continuous origin and by dendritic cells/macrophages in vivo and in vitro. Am J Pathol 1993; 142: 1409-22.
31. Djemadji-Oudjiel N, Goerdt S, Kodelja V, Schmuth M, Orfanos CE. Immunohistochemical identification of type II alternatively activated dendritic macrophages (RM 3/ 1+3, MS-1+/-, 25F9-) in psoriatic dermis. Arch Dermatol Res 1996; 288: 757-64.
32. Noel W, Raes G, Hassanzadeh Ghassabeh G, De Baetselier P, Beschin A. Alternatively activated macrophages during parasite infections. Trends Parasitol 2004; 20: 126-33.
33. Vincendeau P, Gobert AP, Daulouede S, Moynet D, Mossalayi MD. Arginases in parasitic diseases. Trends Parasitol 2003; 19: 9-12.
34. Chang CI, Liao JC, Kuo L. Macrophage arginase promotes tumor cell growth and suppresses nitric oxide-mediated tumor cytotoxicity. Cancer Res 2001; 61: 1100-6.
35. Rodriguez-Sosa M, Satoskar AR, Calderon R, et al. Chronic helminth infection induces alternatively activated macrophages expressing high levels of CCR5 with low interleukin-12 production and Th2-biasing ability. Infect Immun 2002; 70: 3656-64.
36. Brys L, Beschin A, Raes G, et al. Reactive oxygen species and 12/15-lipoxygenase contribute to the antiproliferative capacity of alternatively activated myeloid cells elicited during helminth infection. J Immunol 2005; 174: 6095-104.
37. Dissanayake S, Khan N, Shahin A, Wijesinghe S, Lukic M. Induction of immunoglobulin G1, interleukin-6 and interleukin-10 by Taenia crassiceps metacestode carbohydrates. Immunology 2002; 107: 411-9.
38. Rodriguez-Sosa M, Rivera-Montoya I, Espinoza A, et al. Acute cysticercosis favours rapid and more severe lesions caused by Leishmania major and Leishmania mexicana infection, a role for alternatively activated macrophages. Cell Immunol 2006; 242: 61-71.
39. Okano M, Satoskar AR, Nishizaki K, Harn DA Jr. Lacto- N-fucopentaose III found on Schistosoma mansoni egg antigens functions as adjuvant for proteins by inducing Th2-type response. J Immunol 2001; 167: 442-50.
40. Abdallahi OM, Bensalem H, Augier R, Diagana M, De Reggi M, Gharib B. Arginase expression in peritoneal macrophages and increase in circulating polyamine levels in mice infected with Schistosoma mansoni. Cell Mol Life Sci 2001; 58: 1350-7.
41. Baetselier PD, Namangala B, Noel W, Brys L, Pays E, Beschin A. Alternative versus classical macrophage activation during experimental African trypanosomosis. Int J Parasitol 2001; 31: 575-87.
42. Scharton-Kersten T, Afonso LC, Wysocka M, Trinchieri G, Scott P. IL-12 is required for natural killer cell activation and subsequent T helper 1 cell development in experimental leishmaniasis. J Immunol 1995; 154: 5320-30.
43. Iniesta V, Gomez-Nieto LC, Corraliza I. The inhibition of arginase by N(omega)-hydroxy-l-arginine controls the growth of Leishmania inside macrophages. J Exp Med 2001; 193: 777-84.
44. Stempin C, Giordanengo L, Gea S, Cerban F. Alternative activation and increase of Trypanosoma cruzi survival in murine macrophages stimulated by cruzipain, a parasite antigen. J Leukoc Biol 2002; 72: 727-34.
45. Fabrino DL, Leon LL, Parreira GG, Genestra M, Almeida PE, Melo RC. Peripheral blood monocytes show morphological pattern of activation and decreased nitric oxide production during acute Chagas' disease in rats. Nitric Oxide 2004; 11: 166-74.
46. Boutard V, Havouis R, Fouqueray B, Philippe C, Moulinoux JP, Baud L. Transforming growth factor-beta stimulates arginase activity in macrophages. Implications for the regulation of macrophage cytotoxicity. J Immunol 1995; 155: 2077-84.
47. Katakura T, Miyazaki M, Kobayashi M, Herndon DN, Suzuki F. CCL17 and IL-10 as effectors that enable alternatively activated macrophages to inhibit the generation of classically activated macrophages. J Immunol 2004; 172: 1407-13.
48. Piedrafita D, Proudfoot L, Nikolaev AV, et al. Regulation of macrophage IL-12 synthesis by Leishmania phosphoglycans. Eur J Immunol 1999; 29: 235-44.
49. Skeen MJ, Miller MA, Shinnick TM, Ziegler HK. Regulation of murine macrophage IL-12 production. Activation of macrophages in vivo, restimulation in vitro, and modulation by other cytokines. J Immunol 1996; 156: 1196-206.
50. Giordanengo L, Guiñazú N, Stempin C, Fretes R, Cerbán F, Gea S. Cruzipain, a major Trypanosoma cruzi antigen, conditions the host immune response in favor of parasite. Eur J Immunol. 2002; 32:1003-11.
51. Guiñazú N, Pellegrini A, Giordanengo L, et al. Immune response to a major Trypanosoma cruzi antigen, cruzipain, is differentially modulated in C57BL/6 and BALB/c mice. Microbes Infect. 2004; 6:1250-8.
52. Stempin CC, Tanos TB, Coso OA, Cerban FM. Arginase induction promotes Trypanosoma cruzi intracellular replication in Cruzipain-treated J774 cells through the activation of multiple signaling pathways. Eur J Immunol 2004; 34: 200-9.
53. Corraliza IM, Modolell M, Ferber E, Soler G. Involvement of protein kinase A in the induction of arginase in murine bone marrow-derived macrophages. Biochim Biophys Acta 1997; 1334: 123-8.
54. Chang CI, Zoghi B, Liao JC, Kuo L. The involvement of tyrosine kinases, cyclic AMP/protein kinase A, and p38 mitogen-activated protein kinase in IL-13-mediated arginase I induction in macrophages: its implications in IL-13-inhibited nitric oxide production. J Immunol 2000; 165: 2134-41.
55. Pauleau AL, Rutschman R, Lang R, Pernis A, Watowich SS, Murray PJ. Enhancer-mediated control of macrophage- specific arginase I expression. J Immunol 2004; 172: 7565-73.
56. Ckless K, van der Vliet A, Janssen-Heininger Y. Arginase modulates NF-{kappa}B activity via nitric oxide dependent mechanism. Am J Respir Cell Mol Biol 2007.
57. Butcher BA, Kim L, Johnson PF, Denkers EY. Toxoplasma gondii tachyzoites inhibit proinflammatory cytokine induction in infected macrophages by preventing nuclear translocation of the transcription factor NF-kappa B. J Immunol 2001; 167: 2193-201.
58. Denkers, E.Y. From cells to signaling cascades: manipulation of innate immunity by Toxoplasma gondii. FEMS Immunol Med Microbiol 2003; 39: 193-203.
59. Roach SK, Schorey JS. Differential regulation of the mitogen-activated protein kinases by pathogenic and nonpathogenic mycobacteria. Infect Immun 2002; 70: 3040-52.
60. Schorey JS, Cooper AM. Macrophage signalling upon mycobacterial infection: the MAP kinases lead the way. Cell Microbiol 2003; 5: 133-42.
61. Junghae M, Raynes JG. Activation of p38 mitogenactivated protein kinase attenuates Leishmania donovani infection in macrophages. Infect Immun 2002; 70: 5026-35.
62. Wei S, Marches F, Daniel B, Sonda S, Heidenreich K, Curiel T. Pyridinylimidazole p38 mitogen-activated protein kinase inhibitors block intracellular Toxoplasma gondii replication. Int J Parasitol 2002; 32: 969-77.
63. Brumlik MJ, Wei S, Finstad K, et al. Identification of a novel mitogen-activated protein kinase in Toxoplasma gondii. Int J Parasitol 2004; 34: 1245-54.
64. Wiese, M. A mitogen-activated protein (MAP) kinase homologue of Leishmania mexicana is essential for parasite survival in the infected host. Embo J 1998; 17: 2619-28.
65. Doerig C. Protein kinases as targets for anti-parasitic chemotherapy. Biochim Biophys Acta 2004; 1697: 155-68.
66. El-Sayed NM, Myler PJ, Bartholomeu DC, et al. The genome sequence of Trypanosoma cruzi, etiologic agent of Chagas disease. Science 2005; 309: 409-15.
67. Feng GJ, Goodridge HS, Harnett MM, et al. Extracellular signal-related kinase (ERK) and p38 mitogen-activated protein (MAP) kinases differentially regulate the lipopolysaccharide- mediated induction of inducible nitric oxide synthase and IL-12 in macrophages: Leishmania phosphoglycans subvert macrophage IL-12 production by targeting ERK MAP kinase. J Immunol 1999; 163: 6403-12.
68. Descoteaux A, Matlashewski G, Turco SJ. Inhibition of macrophage protein kinase C-mediated protein phosphorylation by Leishmania donovani lipophosphoglycan. J Immunol 1992; 149: 3008-15.
69. Tse HM, Josephy SI, Chan ED, Fouts D, Cooper AM. Activation of the mitogen-activated protein kinase signaling pathway is instrumental in determining the ability of Mycobacterium avium to grow in murine macrophages. J Immunol 2002; 168: 825-33.
70. Ochoa JB, Bernard AC, O'Brien WE, et al. Arginase I expression and activity in human mononuclear cells after injury. Ann Surg 2001; 233: 393-9.
71. Zimmermann N, King NE, Laporte J, et al. Dissection of experimental asthma with DNA microarray analysis identifies arginase in asthma pathogenesis. J Clin Invest 2003; 111: 1863-74.
72. Bronte V, Serafini P, De Santo C, et al. IL-4-induced arginase 1 suppresses alloreactive T cells in tumorbearing mice. J Immunol 2003; 170: 270-8.
73. Bruch-Gerharz D, Schnorr O, Suschek C, et al. Arginase 1 overexpression in psoriasis: limitation of inducible nitric oxide synthase activity as a molecular mechanism for keratinocyte hyperproliferation. Am J Pathol 2003; 162: 203-11.
74. Jacobsen LC, Theilgaard-Monch K, Christensen EI, Borregaard N. Arginase 1 is expressed in myelocytes/ metamyelocytes and localized in gelatinase granules of human neutrophils. Blood 2007; 109: 3084-7.
75. Rodriguez PC, Zea AH, Culotta KS, Zabaleta J, Ochoa JB, Ochoa AC. Regulation of T cell receptor CD3zeta chain expression by L-arginine. J Biol Chem 2002; 277: 21123-9.
76. Iniesta V, Carcelen J, Molano I, et al. Arginase I induction during Leishmania major infection mediates the development of disease. Infect Immun 2005; 73: 6085- 90.
77. Kropf P, Fuentes JM, Fahnrich E, et al. Arginase and polyamine synthesis are key factors in the regulation of experimental leishmaniasis in vivo. Faseb J 2005; 19: 1000-2.
78. Morris CR, Poljakovic M, Lavrisha L, Machado L, Kuypers FA, Morris SM, Jr. Decreased arginine bioavailability and increased serum arginase activity in asthma. Am J Respir Crit Care Med 2004; 170: 148-53.
Recibido: 24-04-2007
Aceptado: 21-06-2007














