Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Medicina (Buenos Aires)
versión impresa ISSN 0025-7680versión On-line ISSN 1669-9106
Medicina (B. Aires) v.68 n.2 Ciudad Autónoma de Buenos Aires mar./abr. 2008
Trasplante de células progenitoras hematopoyéticas en enfermedades autoinmunes
Flavio Albarracín, María José López Meier, Gustavo Naswetter, Héctor Longoni
Unidad de Trasplante de Médula Osea, División de Reumatología, Hospital de Clínicas José de San Martín, Facultad de Medicina, Universidad de Buenos Aires
Dirección Postal: Dr. Flavio Albarracín Garramuño, Lamadrid 753 Casa 2, 5500 Mendoza, Argentina Fax: (54-0261) 4286859 e-mail: fhalbarracin@gmail.com
Resumen
El trasplante de células progenitoras hematopoyéticas, células con capacidad de autorrenovación y reconstitución de todos los tipos de células sanguíneas, se utiliza en el tratamiento de numerosas enfermedades potencialmente letales incluyendo leucemias y linfomas. Hoy en día es posible además aplicarlo en el tratamiento de enfermedades autoinmunes graves, como esclerosis múltiple, lupus eritematoso sistémico o esclerosis sistémica, resistentes a la terapia convencional. Estudios en modelos animales nos demuestran que la transferencia de células progenitoras hematopoyéticas podría revertir el proceso de autoinmunidad, un fenómeno que puede explicarse mediante diferentes mecanismos. El resultado de los estudios clínicos que se están llevando a cabo, así como también estudios en pacientes y modelos animales, ayudarán a determinar el rol que el transplante de células progenitoras hematopoyéticas puede jugar en el tratamiento de enfermedades autoinmunes.
Palabras clave: Trasplante de células progenitoras hematopoyéticas; Enfermedades autoinmunes; Terapia
Abstract
Hematopoietic stem cell transplantation in autoimmune diseases. Transplantation of hematopoietic stem cells, which are capable of self renewal and reconstitution of all types of blood cells, can be a treatment for numerous potential lethal diseases, including leukemias and lymphomas. It may now be applicable for the treatment of severe autoimmune diseases, such as therapy-resistant multiple sclerosis, lupus and systemic sclerosis. Studies in animal models show that the transfer of hematopoietic stem cells can reverse autoimmunity. The outcome of ongoing clinical trials, as well as of studies in patients and animal models, will help to determine the role that stem-cell transplantation can play in the treatment of autoimmune diseases.
Key words: Hematopoietic stem cell transplantation; Autoimmune diseases; Therapy
Inicios y evolución del trasplante en enfermedades autoinmunes
Las enfermedades autoinmunes (EA) son un grupo heterogéneo de desórdenes con factores etiológicos de diverso origen: genéticos, ambientales e individuales1. Las estrategias terapéuticas básicas para todas ellas consisten en el empleo de la inmunosupresión e inmunomodulación, las cuales son generalmente exitosas en mayor o menor medida. Sin embargo, aquellos pacientes que no responden y que requieren mayor inmunosupresión para mantener o alcanzar una remisión, representan un desafío terapéutico.
Tanto la respuesta clínica de algunos pacientes con EA que recibieron un trasplante autólogo de células progenitoras hematopoyéticas (auto-TCPH) por indicaciones convencionales2, 3, como los modelos animales con auto-TCPH para la prevención y tratamiento de EA graves4, 5, y las distintas consideraciones teóricas, sugieren que las altas dosis de quimioterapia seguidas de rescate con auto-TCPH podrían reformular la inmunidad alterada6.
Esto llevó a distintos grupos internacionales, como el EBMT (European Group for Blood and Marrow Transplantation) y el EULAR (European League against Rheumtism), a coordinar a partir del año 19957 estudios de fase I/II para unificar la experiencia colectiva. Los resultados fueron rápidamente documentados8. Las técnicas de trasplante estándar, como la movilización y la recolección de las células, la manipulación del injerto y los regímenes de acondicionamiento, demostraron su aplicación en estas nuevas indicaciones. La toxicidad del procedimiento demostró ser comparable con los resultados obtenidos en auto-TCPH para enfermedades malignas avanzadas9. Diferentes estudios han logrado establecer y definir los criterios de respuesta en enfermedades autoinmunes10-15.
Los datos obtenidos del estudio retrospectivo realizado por el EBMT sobre 110 centros participantes, evaluando los resultados del auto-TCPH en EA desde 1995 al 2005, demostraron claras evidencias de que el auto-TCPH puede detener la progresión de la enfermedad e inducir una remisión estable en pacientes seleccionados con EA graves16. La respuesta y la toxicidad difirió según la enfermedad, concluyendo que cada una de ellas debía ser considerada en forma separada. A pesar de la heterogeneidad de los diferentes centros, el impacto en los resultados se observó en todas las categorías de enfermedades y en todos los grupos de pacientes. Todos confirmaron el concepto de intensificación de dosis (uso de altas dosis de quimioterapia) como estrategia terapéutica. Además fue posible interrumpir la progresión inevitable de la enfermedad (Tablas 1, 2 y 3).
TABLA 1.- Base de datos del registro ADWP-EBMT que ilustra algunas características de los trasplantes en enfermedades autoinmunes efectuados hasta el año 2006
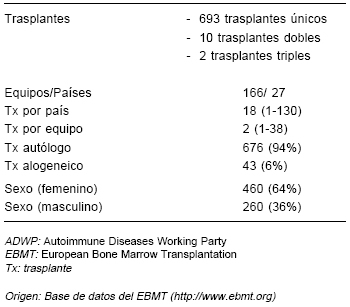
TABLA 2.- Trasplantes realizados según el diagnóstico de enfermedad autoinmune en la base de datos del registro ADWP-EBMT hasta el año 2006
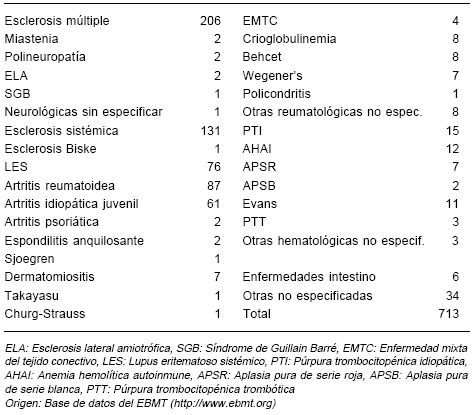
TABLA 3.- Datos del registro del EBMT (2004-05). Se evidencia un aumento significativo en la frecuencia de trasplantes efectuados para el tratamiento de la esclerosis múltiple, con disminución en otras indicaciones como en artritis reumatoidea cuya frecuencia era mayor en el registro del año 1999

Los datos iniciales evidenciaron toxicidad relacionada con el procedimiento, lo que determinó algunas limitaciones. La recolección de células y el auto-TCPH, como en otras indicaciones, también se asociaron a cierto grado de morbimortalidad. Se han informado reagudizaciones de la enfermedad e incluso complicaciones letales durante el proceso de movilización9. Los datos más recientes indican que la mortalidad relacionada al trasplante alcanza un 7 ± 3% con una clara mejoría a través del año calendario, presumiblemente debido a una mejor selección de los pacientes y a la experiencia alcanzada por los distintos equipos17. La mortalidad relacionada al trasplante en EA es todavía elevada, sin embargo es comparable a la que se observa en auto-TCPH para enfermedades malignas18-20.
Como en las indicaciones convencionales para auto-TCPH (enfermedades linfoproliferativas, gammapatías monoclonales, etc.), el riesgo de mortalidad relacionada al trasplante debe compararse con el riesgo de morbimortalidad relacionado a la enfermedad. En el estudio del EBMT la probabilidad de muerte relacionada a la enfermedad a los 3 años (9 ± 4%) es mayor que las complicaciones relacionadas al transplante; y esto posiblemente refleja la gravedad de la enfermedad en el momento de la selección del paciente16.
Los principales factores que influyen en la mortalidad relacionada al trasplante en indicaciones convencionales son: la enfermedad y su estadio, edad del paciente, tiempo desde el diagnóstico al auto-TCPH y la fecha de trasplante (esto tiene en cuenta el mejoramiento de las técnicas trasplantológicas). En parte, se identifican los mismos factores de riesgo en auto-TCPH para EA. Existe una asociación entre la edad y el estadio dentro de algunas categorías específicas de enfermedad. Un alto score EDSS (Expanded Disability Status Scale) < 6, lo que refleja enfermedad avanzada en esclerosis múltiple (EM) o una hipertensión pulmonar grave, que refleja enfermedad avanzada en esclerosis sistémica (ES), se asociaron con malos resultados12, 21, 22.
Elección de regímenes acondicionantes
Se utilizan principalmente dos regímenes acondicionantes (mieloablativo y no mieloablativo) para los pacientes con desórdenes autoinmunes. Luego de un tratamiento mieloablativo se infunden CPH para reconstituir la hematopoyesis así como para prevenir una pancitopenia irreversible y letal. Por otro lado, luego de un régimen no mieloablativo, también llamado linfoablativo, la infusión de CPH se realiza con el objetivo de acortar la duración de la neutropenia.
En las enfermedades malignas, como la leucemia o linfomas, las mutaciones oncogénicas se alojan en las células progenitoras hematopoyéticas primitivas. Los regímenes acondicionantes fueron diseñados para eliminar esas células malignas. Las recaídas de los cánceres ocurren generalmente cuando dichas células malignas sobreviven a dicho régimen.
El trasplante de CPH para enfermedades autoinmunes fue propuesto por médicos oncólogos con amplia experiencia en tratamientos mieloablativos, lo que llevó frecuentemente a la elección de dicho tratamiento como régimen acondicionante.
Estos regímenes extremadamente inmunosupresores son también linfoablativos. La regeneración del sistema inmune luego de una linfopenia grave resultaría teóricamente en un "reseteado" del sistema inmune.
Las enfermedades autoinmunes son inducidas por un estímulo ambiental en pacientes genéticamente predispuestos. Por lo tanto, el objetivo del régimen acondicionante es la linfoablación, a diferencia de lo que ocurre en las enfermedades malignas. El acondicionamiento linfoablativo sería suficiente y posiblemente más seguro para eliminar la autoinmunidad y reinducir la auto-tolerancia a través del desarrollo de nuevos linfocitos T en el timo. La ciclofosfamida a dosis linfoablativas (200 mg/kg) sin el soporte del transplante de CPH ha sido utilizada para el tratamiento de enfermedades autoinmunes. Las potenciales ventajas a favor de la linfoablación y rescate con CPH son:
- La capacidad de la ciclofosfamida de permitir la movilización de células madres a sangre periférica para su posterior recolección, y además producir linfoablación al utilizarla como régimen acondicionante.
-La posibilidad de asociar otro agente inmunosupresor dentro del régimen acondicionante, como la globulina antitimocito.
-La posibilidad de disminuir el tiempo de neutropenia post régimen acondicionante y el riesgo de infecciones con la infusión de las CPH.
La selección de los regímenes acondicionantes ha sido una materia de debate desde el inicio23. Los últimos informes indican que los regímenes acondicionantes de alta intensidad se asociaron con un alto riesgo de mortalidad relacionada al trasplante, pero con una baja probabilidad de progresión de enfermedad. Estos últimos hallazgos evidencian que no representa un hallazgo casual el impacto del procedimiento sobre el resultado de la enfermedad. La respuesta en forma sostenida se asocia directamente con la sobrevida. Los pacientes con una respuesta sostenida tienen un 100% de sobrevida a 3 años, mientras que los pacientes sin respuesta o con una respuesta transitoria tienen un 20% de probabilidad de morir por progresión de la enfermedad dentro del mismo lapso16.
Trasplante alogeneico en enfermedades autoinmunes
La modalidad del auto-TCPH se ha preferido por sobre el alo-TCPH debido sobre todo al incremento en la toxicidad y al riesgo potencial de rechazo en este último. El riesgo de enfermedad injerto contra huésped (EICH) en el alo-TCPH, el cual deriva del ataque de células T alogeneicas del donante sobre aloantígenos en el receptor, se asocia con una significativa morbimortalidad. De todas formas, se han evidenciado remisiones completas en un escaso número de pacientes sometidos a alo-TCH por enfermedades malignas con enfermedades autoinmunes en forma coincidente24. Más recientemente, diversos grupos han utilizado protocolos no mieloablativos o de reducida intensidad en alo-TCPH como una forma de inducir tolerancia al trasplante y restablecer autotolerancia en modelos animales de EA. Aunque estos recientes avances hacen al alo-TCPH menos tóxico, es un procedimiento intensivo que probablemente no reemplace aún a los tratamientos farmacológicos actuales en EA de menor gravedad, tratables en forma más conservadora.
Desarrollo
Haremos una evaluación de los mecanismos mediante los cuales el TCPH puede inducir tolerancia hacia auto y aloantígenos. Realizaremos también una actualización sobre las EA en las que se están llevando a cabo TCPH basándonos en la literatura internacional dado que no existen datos publicados en nuestro país.
En cuanto a los mecanismos de acción del trasplante de células progenitoras hematopoyéticas en la terapia de trastornos autoinmunes, los mecanismos postulados son los siguientes:
a) Inmunomodulación mediante el acondicionamiento inmunosupresivo
b) Destrucción inmunomediada de linfocitos B y T autorreactivos
c) Deleción de linfocitos T auto y alorreactivos en el timo
d) Anergia y deleción de linfocitos T auto y alorreactivos periféricos
e) Tolerancia de los linfocitos T regulatorios
f) Tolerancia de los linfocitos B auto y alorreactivos
Desarrollaremos brevemente cada uno de ellos:
a) Inmunomodulación mediante el acondicionamiento inmunosupresivo:
Los tratamientos inmunosupresivos intensivos pueden eliminar linfocitos autorreactivos T y B de memoria (Fig. 1a), "reseteando" de esta manera el sistema inmune. El desarrollo de nuevos linfocitos B y T, a los cuales se presentarán distintos autoantígenos, podría generar un mecanismo de autotolerancia. Así también las circunstancias ambientales que llevan al desarrollo de la autoinmunidad podrían no presentarse nunca más en la vida del paciente.
Fig. 1.- Diversos mecanismos mediante los cuales el trasplante puede corregir el proceso de autoinmunidad. Estos no necesariamente funcionan en forma exclusiva. Las células derivadas del donante se muestran en negro y las células derivadas del huésped se muestran en blanco. TGA: Timoglobulina, RCT: Radioterapia corporal total, Cy: Ciclofosfamida, TGFβ: Factor de crecimiento transformante β, TNF: Factor de necrosis tumoral, IFNγ: Interferón γ, Alo CPA: Células presentadoras de antígenos alogeneicas. Megan Sykes y Boris Nikolic25.
De todas formas, no está todavía claro si los linfocitos B y T de memoria autorreactivos y las células plasmáticas de larga sobrevida pueden ser completamente removidos de los órganos linfohematopoyéticos por medio de cualquier tratamiento acondicionante. Las respuestas subóptimas y las altas tasas de recaídas tempranas notificadas en algunos trabajos con auto-TCPH podrían deberse a una inmunoablación incompleta. Pero incluso con una incompleta inmunoablación, la dependencia de múltiples poblaciones celulares para el mantenimiento de algunas reacciones podría ser la causa de la mejoría de la enfermedad. Por ejemplo, los tratamientos acondicionantes intensos inducen graves y prolongadas depresiones de linfocitos T CD4+, caracterizadas por una inversión en la relación de linfocitos T CD4:CD8+, con predominancia de linfocitos T memoria y con un patrón de recuperación de linfocitos T principalmente extratímico. Estos linfocitos T exhiben un aumento de susceptibilidad a la apoptosis y una alterada funcionalidad26. De esta forma entonces, la reconstitución inmune alterada y la inmunosupresión no específica post-acondicionamiento resultarían en una prolongada remisión de enfermedad.
b) Destrucción inmunomediada de linfocitos B y T autorreactivos:
Los regímenes de acondicionamiento utilizados en auto-TCPH para el tratamiento de leucemias y linfomas han sido diseñados para poder destruir el máximo número de células malignas, aunque la completa eliminación no sería ciertamente posible sólo con quimioterapia. La eliminación total de estas células y la completa curación son sólo posibles utilizando el alo-TCPH. Con esta modalidad, la total eliminación resulta de una respuesta inmune del injerto contra el huésped (ICH), debido a que los linfocitos T del donante reconocen los aloantígenos en el receptor. Esto habitualmente se asocia con la conocida EICH. A pesar de su asociada morbimortalidad, la EICH también está vinculada a un aumento del efecto injerto contra leucemia (ICL), el cual refleja una destrucción inmune de células leucémicas residuales. Un efecto beneficioso similar se ha observado con el alo-TCPH en el tratamiento de EA. Aunque el auto-TCPH permite una intensa inmunosupresión en el huésped, la eliminación de cada linfocito de memoria restante con altas dosis de quimioterapia y/o irradiación no es del todo factible. Para lograr una completa inmunoablación, con reversión de la autoinmunidad, se requeriría del efecto injerto contra autoinmunidad (ICA), propio del alo-TCPH (Fig. 1b), como lo sugieren los resultados superiores del alo-TCPH en numerosos modelos animales. Es de tener en cuenta que este beneficio viene acompañado siempre del riesgo de EICH.
La asociación del efecto ICA con EICH se confirmó en un metaanálisis donde se analizaron datos de pacientes individuales27 y también con el abandono de la inmunosupresión en un paciente que había recibido un alo-TCPH para el tratamiento de una leucemia28. Existen dos casos documentados de alo-TCPH no mieloablativo en síndrome de Evans. En uno de ellos la infusión de linfocitos del donante produjo una respuesta clínica con remisión inmunológica completa seguida de EICH29, 30.
Este mecanismo se aplica solamente en el caso del alo-TCPH.
c) Deleción de linfocitos T auto y alorreactivos en el timo:
El alo-TCPH y la reconstitución completa a partir de células del donante producen una deleción intratímica (o tolerancia) de nuevos timocitos emergentes que reconocen antígenos del donante, permitiendo de esta forma la aceptación de órganos del donante sin terapia inmunosupresiva. El quimerismo hematopoyético mixto es un estado en el cual coexisten células hematopoyéticas, y por ende poblaciones hematopoyéticas multilineales, del donante y receptor. El estado de quimerismo hematopoyético mixto tiene algunas ventajas sobre el estado de quimerismo completo, y esto es algo que se está explorando en modelos animales como una aproximación para alcanzar la organotolerancia. Este estado de quimerismo mixto puede alcanzarse utilizando tratamientos acondicionantes moderados que no produzcan una ablación completa de células hematopoyéticas en el receptor. De esta manera se anula la alta toxicidad relacionada al tratamiento, situación que hasta este entonces complicaba la utilización del alo-TCPH en enfermedades sin riesgo de vida en lo inmediato. El estado de quimerismo mixto se asocia con una mejor inmunocompetencia comparado con el quimerismo completo, particularmente si donante y receptor no comparten alelos del complejo mayor de histocompatibilidad (CMH). Las quimeras mixtas contienen una fuente de células presentadoras de antígenos (CPA) de larga sobrevida, las que comparadas con quimeras completas, pueden presentar en forma más efectiva antígenos a linfocitos T, que son seleccionados en forma positiva en el timo del receptor (Fig. 1c)31.
Si ambas células, tanto del donante como del receptor, contribuyen a la hematopoyesis, el nuevo repertorio de linfocitos T generado en el timo del receptor se convertiría en tolerante a los antígenos expresados por las células hematopoyéticas de ambos orígenes. Las células hematopoyéticas delecionan en forma más efectiva timocitos con alta afinidad por moléculas del CMH, asegurando de esta forma tolerancia tanto para el huésped como para el receptor31. La inducción de quimerismo mixto previene el desarrollo de EA con más eficacia que lo que sucede con el auto-TCPH en diversos modelos animales. Es posible que CPA del donante que expresan moléculas del CMH alogeneicas medien una deleción intratímica de timocitos del huésped autorreactivos con reactividad cruzada por el receptor de células T (TCR).
d) Anergia y deleción de los linfocitos T auto y alorreactivos periféricos:
En adultos normales, existen en la periferia linfocitos T maduros con capacidad de reaccionar ante células del donante. Estas células deben ser eliminadas o inactivadas por el acondicionamiento inicial sobre el huésped para prevenir el rechazo de las células hematopoyéticas del donante. El bloqueo de señales de vías coestimulatorias CD40-CD154 y CD28-CD80/CD86, junto con el alo-TCPH, pueden superar la barrera celular T a la adaptación del injerto del alo-TCPH, lo cual produciría una rápida tolerancia específica hacia las células del donante. El mantenimiento a largo plazo de esta tolerancia sistémica se alcanza a través de una deleción central de los linfocitos T alorreactivos, al igual que en otros modelos de quimerismo mixto32, 33. De todas formas, debido a que no se produce una depleción completa de los linfocitos T del receptor antes del TCPH, otros mecanismos deben permitir la aceptación de la médula del donante y la tolerancia de los linfocitos T pre-existentes del receptor (Fig. 1d). Este mecanismo ejerce su rol únicamente en el alo-TCPH.
e) Tolerancia de los linfocitos T regulatorios:
Los linfocitos T regulatorios CD4+CD25+ están implicados en el mantenimiento de la tolerancia periférica hacia antígenos propios organoespecíficos, así como también hacia aloantígenos. Se sugiere que este proceso está mediado por la secreción de TGF-β y de IL-10 a través de linfocitos T regulatorios25. Tanto el alo como el auto-TCPH pueden incorporar este mecanismo (Fig. 1e).
f) Tolerancia de los linfocitos B auto y alorreactivos:
Los autoanticuerpos proveen criterios diagnósticos y pronósticos que juegan un rol fundamental en la patogénesis de numerosas EA. Esto ha llevado a considerar de interés el desarrollo de terapias de depleción dirigidas hacia linfocitos B en EA. Además de la tolerancia hacia los linfocitos T, el quimerismo hematopoyético podría potenciar la tolerancia de los linfocitos B pre-existentes del receptor hacia autoantígenos expresados por células hematopoyeticas del donante (Fig. 1f). Este mecanismo sólo se aplica para el alo-TCPH.
Esclerosis múltiple
La EM es una enfermedad que se caracteriza por producir una seria incapacidad. Se considera como una enfermedad autoinmune mediada por células T que destruye la mielina que rodea los axones. Otro efecto importante es la degeneración neuronal secundaria. Esta degeneración tiene implicancias muy importantes para la terapéutica, por lo que puede iniciarse muy temprano en el curso de la enfermedad progresando en forma no concomitante con la existencia de inflamación.
La meta en el tratamiento de la EM es detener la progresión de la enfermedad. Las opciones terapéuticas incluyen a los esteroides para los ataques agudos, interferón y acetato de glatiramer (copaxone) para las formas de EM que cursan con recaída/remisión, y la mitoxantrona que se utiliza también para las formas con recaída/remisión y para las que cursan de forma progresiva secunda-ria. La ciclofosfamida se usa sobre todo en los ataques agudos donde existe una importante inflamación cerebral. El problema deriva en que los resultados con el uso de estas drogas no son muy alentadores. En general no son muy efectivas, especialmente en pacientes con la forma crónica progresiva, primaria y secundaria progresiva; así como también en aquellos pacientes con la forma extremadamente progresiva de EM, más conocida como Marburg o maligna.
El TCPH como terapia en EM se introdujo a inicios de la década de los 90 en forma experimental para tratar la encefalo-mielitis autoinmune experimental (EAE), que representa el modelo animal de EM. En estos modelos la tasa de remisión fue alta (aproximadamente del 100%), pero la tasa de recaída fue también elevada (aproximadamente del 30%) y dependiente de la intensidad del acondicionamiento. Otro hallazgo importante fue la capacidad de lograr una tolerancia a largo plazo, aunque si el auto-TCPH se realizaba más tardíamente no se evidenciaban resultados terapéuticos. Este hallazgo con respecto a la sensibilidad del auto-TCPH en el tiempo se puede explicar desde el punto de vista que los cambios tardíos en EM se deben a la forma degenerativa y no así a la forma inflamatoria, donde el auto-TCPH parecería ejercer su principal efecto34.
El análisis de los primeros 83 casos de EM tratados con auto-TCPH fue publicado en el año 200235. El efecto más importante que se observó fue la supresión casi completa de la inflamación cerebral, un criterio de respuesta objetivo observado mediante las imágenes por resonancia magnética. Clínicamente la EM es una enfermedad donde es muy difícil poder objetivar la eficacia de terapias de investigación. De todas formas, parece ser que el auto-TCPH retrasa la progresión, especialmente en la forma progresiva secundaria y en pacientes jóvenes con bajo score de incapacidad. La mortalidad relacionada al auto-TCPH que se informa para EM va del 1.5 al 5%, especialmente si los pacientes no son correctamente seleccionados o son pacientes mayores con alto score de incapacidad.
En un análisis posterior del EBMT-ADWP (Autoimmune Diseases Working Party) sobre 183 pacientes registrados (con respuesta objetivable en 143), se evidenció una mejoría o estabilidad del score EDSS en el 60% de los pacientes (Tabla 4).
¿Cuáles serían los pacientes con EM candidatos al auto-TCPH?
TABLA 4.– Análisis de los resultados del trasplante en esclerosis múltiple. Se evidenció una mejoría o estabilidad del score EDSS en el 60% de los pacientes

Según los resultados de algunos estudios36 los mejores candidatos parecen ser pacientes jóvenes con enfermedad rápidamente progresiva que aún presentan un bajo score de incapacidad (EDSS), con cambios inflamatorios en el sistema nervioso central y con un intervalo de enfermedad menor a 5 años (Fig. 2). Todavía no se conoce cuál sería el mejor régimen acondicionante a emplear, ni tampoco si el injerto debe ser o no deplecionado de linfocitos T ex vivo. La intensidad del acondicionamiento parece jugar un rol importante, no sólo por la mortalidad relacionada al auto-TCPH demostrada en el reciente análisis del EBMT sobre 473 pacientes12, sino también debido a que la intensidad del acondicionamiento se asocia con respuestas sostenidas en cuanto a la progresión de la enfermedad, por lo tanto se necesita un régimen acondicionante intensivo en el contexto clínico así como se vio en el contexto experimental. No existe una respuesta definitiva en cuanto a la manipulación ex vivo del injerto. En el análisis los resultados fueron similares, independientemente de si el injerto fuera o no deplecionado de linfocitos T. Parece haber una mayor toxicidad con la depleción de linfocitos T.

Fig. 2.- Sobrevida libre de progresión de acuerdo a la edad y al intervalo de enfermedad hasta el momento del trasplante en esclerosis múltiple. Los resultados en esclerosis múltiple demuestran que los mejores candidatos son los pacientes menores de 40 años y con un intervalo me-nor o igual a 5 años desde el diagnóstico hasta el momento del trasplante. SLP: Sobrevida libre de progresión. Análisis efectuado por Saccardi y col. para el EBMT (/ /www.ebmt.org)
El estudio internacional ASTIMS37 (llevado a cabo por el EBMT) de auto-TCPH en EM es un estudio fase III, prospectivo, comparativo, ciego simple, aleatorizado. Este estudio, el cual aún se encuentra abierto, está comparando el TCPH con la mitoxantrona en el tratamiento de casos con EM grave, con forma progresiva secundaria y con recaída-remisión, en los cuales ha fallado la terapia convencional (interferón, acetato de glatiramer), o en los que no se obtuvo una buena respuesta con mitoxantrona, teniendo en cuenta que las dosis de mitoxantrona no hayan sido superiores a 700 mg/m2. El objetivo primario del estudio es la reducción en la progresión de la incapacidad a 3 años, los objetivos secundarios incluyen la actividad a nivel de resonancia magnética, parámetros de laboratorio, seguridad y disminución en la mortalidad.
Los pacientes que integran este estudio son menores de 50 años sin contraindicaciones médicas para el auto-TCPH. Desde el punto de vista neurológico se incluyen aquellos con enfermedad progresiva, indicada por un aumento en el score de EDSS de al menos 1 punto en el año precedente al enrolamiento. Deben tener además signos de enfermedad visible activa en la resonancia magnética con al menos una lesión con realce del gadolinio. Sin evidencias positivas en la resonancia, deben tener progresión de enfermedad más grave, indicado por un incremento de más de 1 punto en el score EDSS en el año previo al enrolamiento.
El tratamiento utilizado para la rama control consiste en utilizar la mitoxantrona 20 mg en forma endovenosa por mes durante 6 meses, junto con metilprednisolona 1 g. Para la rama del auto-TCPH, el régimen acondicionante que se utiliza es el BEAM (BCNU 300 mg/m2 día -6, etoposido 200 mg/m2 desde el día -5 al -2, Ara-C 200 mg/m2 día -1, melfalán 140 mg/m2 día -1), gammaglobulina antitimocítica a dosis de 7 mg/kg en los días +1 y +2, y metilprednisolona 5 mg/kg en los días -1, +1 y +2. La movilización se realiza con ciclofosfamida 4 g/m2 más factores estimulantes de colonias granulocíticas desde el día +5 en adelante. No se realiza purga de linfocitos.
Lupus eritematoso sistémico
El lupus eritematoso sistémico (LES) es una enfermedad autoinmune que afecta principalmente a mujeres jóvenes; antes de la llegada del tratamiento inmunosupresor su cur-so era generalmente fatal en las formas graves de la enfermedad. Con el uso de terapias agresivas inmunosupresoras, como la ciclofosfamida para el compromiso de órganos vitales (riñón, sistema nervioso central), su mortalidad ha disminuido. Sin embargo, algunos pacientes persisten con actividad de la enfermedad a pesar del tratamiento. Esto ha llevado a buscar terapias alternativas.
El primer auto-TCPH en pacientes con diagnóstico de LES fue llevado a cabo por Marmont y su equipo38 en Italia en el año 1996 y ese mismo año el equipo de Traynor39 lo hizo en EE.UU.
El LES es una enfermedad inmunomediada, por lo que el auto-TCPH podría ser efectivo; el desafío mayor consiste en identificar correctamente el paciente candidato para dicho tratamiento.
Los pacientes con mayor riesgo de complicaciones letales presentan compromiso renal, pulmonar o del sistema nervioso central; hipertensión arterial, anemia, trombocitopenia, presencia de anticuerpos antifosfolípidos o actividad de la enfermedad demostrada con un alto índice de actividad a pesar del tratamiento. Existen diferentes índices para caracterizar o medir la actividad de la enfermedad: The British Isles Lupus Assessment Group (BILAG) scale40, Systemic Lupus Erythematosus Disease Activity Index (SLEDAI)41, Systemic Lupus Activity Measure (SLAM)42, y el Lupus Activity Index (LAI)43; el uso de uno u otro depende de la familiaridad del investigador o la institución con dicho instrumento. El tratamiento estándar para el LES con compromiso grave de órganos vitales son los corticoesteroides a altas dosis asociados a ciclofosfamida endovenosa mensual (500-1000 mg/m2) por un período de 6 meses, seguida de un régimen de mantenimiento de 2 años.
¿Cuáles serían los pacientes con LES candidatos al auto-TCPH?
Los criterios de inclusión más frecuentemente utilizados en los trabajos publicados son pacientes con diagnóstico de LES (con al menos 4 de 11 criterios del American College of Rheumatology), que requieren 20 mg/día o más de prednisona o sus equivalentes, a pesar del uso de ciclofosfamida. En un reciente trabajo publicado por Burt y col.44 se consideraron los siguientes criterios de inclusión: glomerulonefritis grado III o IV, de la clasificación de la Organización Mundial de la Salud (OMS), compromiso pulmonar (vasculitis, neumonitis, hemorragia alveolar), compromiso del sistema nervioso central (cerebritis o mielitis transversa), vasculitis (confirmada por biopsia o angiografía), miositis (confirmada por biopsia), citopenias autoinmunes con requerimientos transfusionales, serositis grave, enfermedad mucocutánea ulcerativa y síndrome antifosfolípido.
Los regímenes de movilización más utilizados consisten en emplear ciclofosfamida a una dosis de entre 2 y 4 g/m2 asociado al uso de factores estimulantes de colonias granulocíticas (10 µg/kg); el régimen acondicionante generalmente utiliza una dosis total de ciclofosfamida de 200 mg/kg repartido en 4 días, asociado al uso de gammaglobulina antitimocítica.
En este grupo de pacientes seleccionados, gravemente enfermos, los resultados parecen ser alentadores. En diferentes ramas de investigación se ha demostrado una mejoría significativa de la actividad de la enfermedad con una remisión completa mayor al 50%. Traynor y col.14, en un informe que incluyó 15 pacientes con un tiempo medio de seguimiento de 36 meses, evidenció luego del auto-TCPH una tendencia franca hacia la mejoría del SLEDAI (<5 en 12/15 pacientes), así como también una disminución marcada de los requerimientos de medicación inmunosupresora. En el 2004, Jayne y col.45 informaron 53 pacientes del registro europeo con una tasa de remisión (SLEDAI < 3) del 66% a los 6 meses del auto-TCPH; sin embargo, el 32% de este grupo recayó. Recientemente Burt y col.44 informaron 50 pacientes seguidos por un tiempo medio de 29 meses y observaron que la sobrevida a 5 años fue del 84%.
Esclerosis sistémica
La ES es una enfermedad autoinmune heterogénea que se caracteriza por el depósito excesivo de colágeno tanto en la piel como en órganos internos. Existen dos for-mas de presentación, sistémica y localizada, que se diferencian por la extensión del compromiso cutáneo, el compromiso de órganos internos y el perfil de anticuerpos.
La patogénesis exacta permanece aún desconocida. Furst y col. propusieron diferentes mecanismos patogénicos46 en los que la activación celular, predominantemente T, con producción de autoanticuerpos y citoquinas parece jugar un rol importante. El inicio de la enfermedad se correlaciona con injuria difusa de la microvasculatura y lesión endotelial, que contribuyen con la activación de marcrófagos y fibroblastos o un aumento de la producción de colágeno.
Cuando se presenta clínicamente con compromiso pulmonar, renal o cardiológico en los primeros 3 a 5 años de enfermedad, la tasa de sobrevida disminuye siendo del 35% al 45% a los 3-5 años posteriores47. No existe aún un tratamiento efectivo para controlar la enfermedad o revertir la fibrosis. En los últimos años se ha utilizado la ciclofosfamida endovenosa para el compromiso pulmonar con resultados controvertidos48.
Los primeros auto-TCPH en esclerodermia se realizaron en 1996 y los resultados iniciales indicaban a este procedimiento como efectivo, con mejoría de los pará-metros del compromiso cutáneo, pero con una mortalidad demasiado elevada. A partir de entonces se modificaron los criterios de selección de pacientes y se optimizaron los regímenes acondicionantes para disminuir la morbimortalidad inicial asociada al procedimiento.
¿Cuáles serían los pacientes con ES candidatos al auto-TCPH?
De acuerdo a los criterios de inclusión utilizados en distintos trabajos, se consideran mejores candidatos a los pacientes con diagnóstico reciente de la enfermedad. En primer lugar con menos de 4 años de evolución, con un score de Rodnan modificado < 15 y con compromiso de un órgano interno (pulmonar: definido por una CVF o DLCO <80, o intersticiopatía demostrada por tomografía computada, radiografía, lavado broncoalveolar o biopsia, compromiso renal secundario a la enfermedad de base y compromiso cardíaco definido por la presencia de trastornos de la conducción o derrame pericárdico). Y en segundo lugar, pacientes con esclerosis difusa de 2 años de evolución con un score de Rodnan modificado > 20 asociado a eritrosedimentación > 25 mm en la 1ra. hora y/o hemoglobina <11g/dl no explicable por otras causas.
El estudio ASTIS49 (Autologous Stem Cell Transplantation International Scleroderma Trial) es un trabajo multicéntrico, prospectivo y randomizado en fase III que compara la eficacia y seguridad del auto-TCPH contra el tratamiento convencional de pulsos de ciclofosfamida para el tratamiento de la esclerosis sistémica grave. Está siendo llevado a cabo por el EBMT y el EULAR. Hasta el mes de mayo del corriente año han sido enrolados 68 pacientes desde 20 centros distintos; 31 de ellos en la rama del auto-TCPH y 37 en la rama los pulsos con ciclofosfamida endovenosa. Todos los pacientes presentaron al momento del ingreso compromiso sistémico grave asociado a compromiso cardíaco, pulmonar o renal. Los resultados publicados en el año 2004 del registro de 57 pacientes son prometedores: franca mejoría de la puntuación (score) de piel a los 36 meses luego del TCPH, 92% de respuesta parcial o completa a los 22.9 meses de seguimiento y mortalidad relacionada al trasplante de 8.7% versus un 14% relacionada con la progresión de la enfermedad. Un grupo de EE.UU. está llevando a cabo el estudio SCOT50 (Scleroderma: cyclophosphamide or Transplantation) el cual está en fase de inclusión de pacientes por lo que sus resultados aún se desconocen. El objetivo primario es comparar seguridad y eficacia, con la esperanza de encontrar un tratamiento efectivo que induzca a la remisión de la enfermedad de manera duradera y efectiva para la mayoría de los pacientes.
Vasculitis sistémicas
Las vasculitis sistémicas son un grupo heterogéneo de enfermedades, tanto en su patogénesis como en su forma de presentación. Sin tratamiento inmunosupresor tienen un curso generalmente fatal. El uso de ciclofosfamida y del rituximab (casos notificados de vasculitis asociada a anticuerpos antineutrófilos51) ha disminuido la tasa de mortalidad; sin embargo, existe un grupo de pacientes refractario al tratamiento.
De esta manera surge el TCPH como alternativa terapéutica. El grupo EBMT/EULAR evaluó el rol del auto-TCPH como opción terapéutica en un análisis retrospectivo en pacientes con vasculitis52. Se analizaron 15 pacientes con diagnósticos de crioglobulinemia, enfermedad de Behcet, granulomatosis de Wegener, vasculitis indiferenciada, Churg-Strauss, arteritis de Takayasu, policondritis y poliarteritis nodosa. En 14 pacientes se realizó auto-TCPH y en el paciente restante alo-TCPH. Se observó a los 45 meses del trasplante una respuesta completa (inactividad de la enfermedad sin utilizar medicación inmunosupresora) del 46% y una respuesta parcial (al terminar TCPH se disminuyó sustancialmente la dosis de drogas inmunosupresoras) del 46%. Este estudio sugiere al TCPH como posible tratamiento para las vasculitis debiendo ser confirmado por estudios prospectivos controlados.
En conclusión, la eficacia y seguridad de esta nueva modalidad terapéutica está siendo ahora investigada a partir de estudios fase III comparando la inmunosupresión intensiva con el tratamiento convencional, empleando criterios uniformes en cuanto a elegibilidad, regímenes de tratamiento y parámetros de estudio. Para una adecuada valoración del efecto riesgo-beneficio, estos estudios tienen diseños prospectivos, aleatorizados y controlados con seguimiento prolongado53. El planteo sería si la inmunosupresión intensa, con el propósito de producir la inmunoablación, es superior a la inmunosupresión moderada continua con respecto a toxicidad y eficacia a largo plazo.
Una vez que la eficacia y seguridad de esta modalidad de tratamiento pueda ser demostrada, los estudios posteriores deberán focalizarse en la evaluación del cos-to-efectividad y en la mejor identificación de ciertos componentes del esquema de tratamiento. Por ejemplo, si la inmunosupresión intensiva demostrara ser demasiado tóxica o no suficientemente eficaz, se podrían considerar otras estrategias de trasplante alternativas. Los regímenes acondicionantes más intensivos (ej: mieloablativos), pueden llegar a ser más eficaces, aunque esto debe ser aún demostrado. Sin ser sorprendente, en análisis de registros retrospectivos los protocolos de acondicionamiento más intensos demostraron también ser más tóxicos.
El trasplante alogeneico podría llegar a ser más efectivo que el autólogo si existieran en estas enfermedades anormalidades intrínsecas en células madres y si además la hematopoyesis del huésped y las poblaciones de células inmunes anormales pudieran ser erradicadas a través del efecto injerto versus autoinmunidad. Los avances recientes en alotrasplante han mejorado su seguridad, permitiendo de esta manera su aplicación en enfermedades no malignas. De todas formas, resta aún determinar si el potencial beneficio del trasplante alogeneico justifica el riesgo de la EICH y la mortalidad relacionada al tratamiento.
Aún resta mucho por aprender en cuanto a la patogénesis y el rol del sistema inmune. De acuerdo a los actuales paradigmas, la meta de la inmunoablación debería ser la reinstitución de la autotolerancia con el propósito de lograr la cura en las enfermedades autoinmunes sistémicas. Es también muy pobre nuestro conocimiento actual sobre los procesos que determinan las recaídas y remisiones en estas enfermedades. Estos aspectos deben ser investigados en estudios clínicos meticulosos, con un cuidadoso entendimiento de las necesidades y expectativas de los pacientes involucrados.
1. Davidson A, Diamond B. Autoimmune diseases. N Engl J Med 2001; 345: 340-50. [ Links ]
2. Gratwohl A, Passweg J, Gerber I, Tyndall A. Stem cell transplantation for autoimmune diseases. Best Pract Res Clin Haematol 2001; 14: 755-76. [ Links ]
3. Marmont AM. Stem cell transplantation for autoimmune disorders. Coincidental autoimmune disease in patients transplanted for conventional indications. Best Pract Res Clin Haematol 2004; 17: 223-32. [ Links ]
4. van Bekkum DW. Stem cell transplantation for autoimmune disorders. Preclinical experiments. Best Pract Res Clin Haematol 2004; 17: 201-22. [ Links ]
5. Ikehara S. Treatment of autoimmune diseases by hematopoietic stem cell transplantation. Exp Hematol 2001; 29: 661-9. [ Links ]
6. Burt RK, Slavin S, Burns WH, Marmont AM. Induction of tolerance in autoimmune diseases by hematopoietic stem cell transplantation: getting closer to a cure? Int J Hematol 2002; 76 (Suppl. 1): 226-47. [ Links ]
7. Marmont A, Tyndall A, Gratwohl A, Vischer T. Haematopoietic precursor-cell transplants for autoimmune diseases. Lancet 1995; 345: 978. [ Links ]
8. Tyndall A, Gratwohl A. Haematopoietic stem and progenitor cells in the treatment of severe autoimmune diseases. Ann Rheum Dis 1996; 55: 149-51. [ Links ]
9. Van Laar JM, Tyndall A. Intense immunosuppression and stem-cell transplantation for patients with severe rheumatic autoimmune disease: a review. Cancer Control 2003; 10: 57-65. [ Links ]
10. Binks M, Passweg JR, Furst D, et al. Phase I/II trial of autologous stem cell transplantation in systemic sclerosis: procedure related mortality and impact on skin disease. Ann Rheum Dis 2001; 2001; 60: 577-84. [ Links ]
11. Farge D, Marolleau JP, Zohar Z, et al. Autologous bone marrow transplantation in the treatment of refractory systemic sclerosis: early results from a French multicentre phase I-II study. Br J Haematol 2002; 119: 726-39. [ Links ]
12. Fassas A, Passweg JR, Anagnostopoulos A, et al. Hematopoietic stem cell transplantation for multiple sclerosis. A retrospective multicenter study. J Neurol 2002; 249: 1088-97. [ Links ]
13. Wulffraat NM, Sanders LA, Kuis W. Autologous hemopoietic stem-cell transplantation for children with refractory autoimmune disease. Curr Rheumatol Rep 2000; 2: 316-23. [ Links ]
14. Traynor AE, Barr WG, Rosa RM, et al. Hematopoietic stem cell transplantation for severe and refractory lupus. Analysis after five years and fifteen patients. Arthritis Rheum 2002; 46: 2917-23. [ Links ]
15. Rosen O, Thiel A, Massenkeil G, et al. Autologous stem-cell transplantation in refractory autoimmune diseases after in vivo immunoablation end ex vivo depletion of molecular cells. Arthritis Res 2000; 2: 327-36. [ Links ]
16. Gratwohl A, Passweg J, Marmont A, et al. Autologous hematopoietic stem cell transplantation for autoimmune diseases. Bone Marr Transplant 2005; 35: 869-79. [ Links ]
17. Van Laar JM, McSweeney PA. High-dose immunosuppressive therapy and autologous progenitor cell transplantation for systemic sclerosis. Best Pract Res Clin Haematol 2004; 17: 233-45. [ Links ]
18. Attal M, Harousseau JL, Facon T, et al. Single versus double autologous stem-cell transplantation for multiple myeloma. N Engl J Med 2003 ; 349: 2495-02. [ Links ]
19. Milpied N, Deconinck E, Gaillard F, et al. Initial treatment of aggressive lymphoma with high-dose chemotherapy and autologous stem-cell support. N Engl J Med 2004; 350: 1287-95. [ Links ]
20. Philip T, Guglielmi C, Hagenbeek A, et al. Autologous bone marrow transplantation as compared with salvage chemotherapy in relapses of chemotherapy-sensitive nonHodkin's lymphoma. N Engl J Med 1995; 333: 1540-5. [ Links ]
21. Fassas A, Anagnostopoulos A, Kazis A, et al. Autologous stem cell transplantation in progressive multiple sclerosis - an interim analysis of efficacy. J Clin Immunol 2000; 20: 24-30. [ Links ]
22. Mancardi GL, Saccardi R, Filippi M, et al. Autologous hematopoietic stem cell transplantation suppresses Gdenhanced MRI activity in MS. Neurology 2001; 57: 62-8. [ Links ]
23. Schimtz N, Linch DC, Dreger P, et al. Randomised trial of filgrastim-mobilised peripheral blood progenitor cell transplantation versus autologous bone-marrow transplantation in lymphoma patients. Lancet 1996; 347: 353-7. [ Links ]
24. Burt RK, Traynor AE, Craig R, Marmont AM. The promise of hematopoietic stem cell transplantation for autoimmune diseases. Bone Marrow Transplant 2003; 31: 521-4. [ Links ]
25. Sykes M, Nikolic B. Treatment of severe autoimmune disease by stem-cell transplantation. Nature 2005; 435: 620-7. [ Links ]
26. Guillaume T, Rubinstein DB, Symann M. Immune reconstitution and immunotherapy after autologous hematopoietic stem cell transplantation. Blood 1998; 92: 1471-90. [ Links ]
27. Hinterberger W, Hinterberger-Fischer M, Marmont AM. Clinically demonstrable antiautoimmunity mediated by allogeneic immune cells favorably affects outcome after stem cell transplantation in human autoimmune diseases. Bone Marrow Transplant 2002; 30: 753-9. [ Links ]
28. Slavin S, Nagler A, Varadi G, Or R. Graft vs. autoimmunity following allogeneic nonmyeloablative blood stem cell transplantation in a patient with chronic myelogenous leukemia and severe systemic psoriasis and psoriatic polyarthritis. Exp Hematol 2000; 28: 853-7. [ Links ]
29. Oyama Y, Papadopoulos EB, Miranda M, et al. Allogeneic stem cell transplantation for Evans syndrome. Bone MarrowTransplant 2001; 28: 903-5. [ Links ]
30. Marmont AM, Gualandi F, Van Lint MT, Bacigalupo A. Refractory Evans' syndrome treated with allogeneic SCT followed by DLI. Demonstration of a graft-versus auto-immunity effect. Bone Marrow Transplant. 2003; 31: 399-02. [ Links ]
31. Sykes M. Mixed chimerism and transplant tolerance. Immunity 2001; 14: 417-24. [ Links ]
32. Kurtz J, Wekerle T, Sykes M. Tolerance in mixed chimerism - a role for regulatory cells? Trends Inmunol 2004; 25: 518-23. [ Links ]
33. Wekerle T, Hill J, Zhao Y, et al. Extrathymic T cell deletion and allogeneic stem cell engraftment induced with costimulatory blockade is followed by central T cell tolerance. J Exp Med 1998; 187: 2037-44. [ Links ]
34. Burt RK, Padilla J, Begolka WS, Canto MC, Millar SD. Effect of disease stage on clinical outcome after syngeneic bone marrow transplantation for relapsing experimental autoimmune encephalomyelitis. Blood 1998; 91: 2609-16. [ Links ]
35. Fassas A, Passweg JR, Anagnostopoulos A, et al. Hematopoietic stem cell transplantation for multiple sclerosis. A retrospective multicenter study. J Neurol. 2002; 249: 1088-97. [ Links ]
36. Saccardi R, Mancardi GL, Solari A, et al. Autologous HSCT for severe progressive multiple sclerosis in a multicenter trial: impact on disease activity and quality of life. Blood 2005; 105: 2601-7. [ Links ]
37. ASTIMS. Autologous Stem Cell Transplantation International Multiple Sclerosis Trial. http://www.astims.org; consultado el 10/12/2006. [ Links ]
38. Marmont AM, van Lint MT, Gualandi F, Bacigalupo A. Autologous marrow stem cell transplantation for severe systemic lupus erythematosus of long duration. Lupus 1997; 6: 545-8. [ Links ]
39. Burt RK, Traynor A, Ramsey-Goldman R. Hematopoietic stem cell transplantation for systemic lupus erythematosus. N Engl J Med 1997; 337: 1777-8. [ Links ]
40. Symmons DPM, Coopock JS, Bacon PA, et al. Development and assessment of a computerized index of clinical disease activity in systemic lupus erythematosus. Q J Med 1988; 68: 927-37. [ Links ]
41. Bombardier C, Gladman DD, Urowitz MB, et al. Derivation of the SLEDAI. A disease activity index for lupus patients. The committee on prognosis studies in SLE. Arthritis Rheum 1992; 35: 630-40. [ Links ]
42. Liang MH, Socher SA, Roberts WN, Esdaile JM. Measurement of systemic lupus erythematosus activity in clinical research. Arthritis Rheum 1988; 31: 817-25. [ Links ]
43. Gladman DD, Goldsmith CH, Urowitz MB, et al. Cross-cultural validation and reliability of three disease activity indices in systemic lupus erythematosus. J Rheum 1992; 19: 608-11. [ Links ]
44. Burt RK, Traynor A, Statkute L, et al. Nonmyeloablative hematopoietic stem cell transplantation for systemic lupus erytematosus. JAMA 2006; 295: 527-35. [ Links ]
45. Jayne D, Passweg J, Marmont A, et al. Autologous stem cell transplantation for systemic lupus erythematosus. Lupus. 2004; 13:168-76. [ Links ]
46. Furst DE. Rational therapy in the treatment of systemic sclerosis. Curr Opin Rheumatol. 2000; 12: 540-4. [ Links ]
47. Steen VD, Medsger TA Jr. Severe organ involvement in systemic sclerosis with diffuse scleroderma. Arthritis Rheum 2000; 43: 2437-44. [ Links ]
48. Tashkin DP, Elashoff R, Metersky M. The Scleroderma Lung Study Research Group. N Engl J Med 2006; 354: 2655-66. [ Links ]
49. ASTIS. Autologous Stem Cells Transplantation International Scleroderma Trial. http://www.astistrial.com; consultado el 10/12/06. [ Links ]
50. SCOT. Scleroderma: cyclophosphamide or transplantation. http://www.sclerodermatrial.org; consultado el 10/12/06. [ Links ]
51. Keogh KA, Wylam ME, Stone JH, et al. Induction of remission by B lymphocyte depletion in eleven patients with refractory antineutrophil cytoplasmic antibody associated vasculitis. Arthritis Rheum 2005; 52: 262-8. [ Links ]
52. Daikeler T, Kotter I, Bocelli Tyndall C, et al. Haematopoietic stem cell transplantation for vasculitis including Behect's disease and polychondritis- A retrospective analysis of patients recorded to the European Bone Marrow Transplantation (EBMT) and European League Against Rheumatism (EULAR) databases and a review of the literature. Ann Rheum Dis 2007; 66: 202-7. [ Links ]
53 .de Buys P, Khanna D, Furtst DE. Hematopoietic stem cell transplantation in rheumatic diseases- an update. Autoinmunity Reviews, 2005; 4: 442-9. [ Links ]
Recibido: 2-01-2007
Aceptado: 12-12-2007














