Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Medicina (Buenos Aires)
versión impresa ISSN 0025-7680versión On-line ISSN 1669-9106
Medicina (B. Aires) v.68 n.3 Ciudad Autónoma de Buenos Aires mayo/jun. 2008
Retinoides (RARβ y CRBP1) en carcinoma de pulmón a células no pequeñas
Laura V. Mauro1, Mercedes Dalurzo2, David Smith2, José Lastiri2 , Bartolomé Vasallo2 , Elisa Bal de Kier Joffe1*, María Guadalupe Pallotta2, Lydia Puricelli1*
1Area Investigación, Instituto de Oncología Angel H. Roffo;
2Hospital Italiano, Buenos Aires
#Becario y *Miembro de la Carrera del Investigador del CONICET
Dirección postal: Dra. Lydia Puricelli, Instituto de Oncología A. H. Roffo, Av. San Martín 5481, 1417 Buenos Aires, Argentina Fax: (54-11) 4580-2811 e-mail: lydiapur@fmed.uba.ar
Resumen
Aunque los pacientes con cáncer de pulmón a células no pequeñas en estadios tempranos (NSCLC) tienen buen pronóstico, el 20-30% recae, siendo relevante la identificación de biomarcadores pronósticos. Los retinoides regulan crecimiento y diferenciación, y pueden antagonizar la progresión tumoral. Su efecto depende del transporte citosólico mediado por moléculas como CRBP1, y de la unión a receptores específicos (RARβ). Alteraciones en esta vía se asociaron con cáncer. Nuestro objetivo fue estudiar la expresión, mediante inmunohistoquímica, de RARβ y CRBP1 en el tejido tumoral de 49 pacientes NSCLC Estadio I/II, obtenido durante la cirugía. La supervivencia se analizó mediante los test Log Rank y multivariado de Cox. El 44.9% de los tumores fueron positivos para RARβ con expresión a nivel citoplasmático, mientras que el 34.7% lo expresó a nivel nuclear. La tinción para CRBP1 se observó en el 61.2% de los tumores. No se encontró asociación entre la expresión de ambas moléculas y las características clinicopatológicas (sexo, tamaño tumoral, nódulos línfáticos comprometidos, histopatología y p53). Tampoco se encontró asociación con el hábito de fu-mar. La presencia de células tumorales en el lavado pleural se asoció significativamente con la expresión de CRBP1. Por otro lado, se demostró asociación entre la expresión elevada de RARβ citoplasmático y menor supervivencia global (LR 4.17, p=0.0412). El análisis multivariado no mostró asociación con otras variables de pronóstico en NSCLC. En conclusión, en este grupo de pacientes NSCLC Estadio I/II, RARβ pareciera predecir la supervivencia global en forma independiente.
Palabras clave: NSCLC; Retinoides; RARβ; CRBP1; Immunohistoquímica; Marcador pronóstico
Abstract
Retinoid expression (RARβ and CRBP1) in non-small-cell lung carcinoma. Although early-stage non-small-cell lung carcinoma (NSCLC) patients have a relative by favorable prognosis, the risk of a bad outcome remains substantial. Identification of reliable prognostic markers for disease recurrence and death has meaningful clinical application. Retinoids are involved in cell growth and differentiation and may antagonize cancer progression. Their effects are mediated through nuclear receptors called Retinoic Acid Receptor (RAR) and regulated by molecules such as Cellular Retinol-Binding Protein 1 (CRBP1) that function in retinol storage. The aim of this work was to analyze by immunohistochemistry the expression patterns of RARβ and CRBP1, involved in retinoid-mediated signaling, in the tumoral tissue of a cohort of stage I/II NSCLC patients (n=49) who underwent a successful surgical resection. Prognostic evaluation was performed with the multivariate Cox proportional hazard model: 44.9% of tumors were positive for RARβ staining at cytoplasmic level, while 34.7% showed nuclear staining. CRBP1 staining was observed in 61.2% of the lung tumors. No relationship was found between the number of cells expressing the studied molecules and clinical pathological features, including sex, T and N (stage), histopathology and p53 expression. Univariate analysis showed a significant association between positive cytoplasmatic expression of RARβ with shorter overall survival (Log-rank test 4.17, p=0.0412). Multivariate studies indicated that RARβ expression was not influenced by other clinical pathological parameters. In conclusion, in this cohort of stage I and II NSCLC, only the expression of RARβ at cytoplasmatic level is a significant independent unfavorable prognostic factor.
Key words: NSCLC; Retinoids; RARβ; CRBP1; Immunohistochemistry; Prognostic marker
El cáncer de pulmón es la causa más frecuente de muerte por tumor maligno tanto en hombres como en mujeres, siendo responsable de hasta el 25% de las muertes por cáncer. Sólo el 14% de los pacientes con tumores malignos de pulmón vive a los 5 años del diagnóstico inicial. Este tipo de cáncer se asocia a síndromes paraneoplásicos más frecuentemente que otros tumores. La dificultad diagnóstica en estadios tempranos, la tendencia a dar metástasis sistémicas, aun en el caso de tumores primarios pequeños y la adquisición de resistencia a los tratamientos habituales son las causas atribuibles a la alta mortalidad en pacientes con esta enfermedad1.
El cáncer de pulmón, desde el punto de vista anátomopatológico, se divide en dos grupos principales: carcinoma pulmonar de células no pequeñas (NSCLC) y carcinoma de células pequeñas (SCLC), siendo diferentes en cuanto a la patogénesis, diferenciación, biología y tratamiento. Dentro de los NSCLC, los tres tipos anátomopatológicos más frecuentes son el adenocarcinoma, el carcinoma epidermoide y el carcinoma de células grandes. El adenocarcinoma, que comprende el 40% de to-dos los cánceres de pulmón es más frecuente en mujeres y no fumadores. Para los tumores NSCLC el tratamiento de elección es la cirugía. Sin embargo, la resección quirúrgica es sólo posible en aproximadamente el 30-40% de los pacientes al momento del diagnóstico, siendo esta indicación dependiente del estadio2.
Existen pocos marcadores individuales pronósticos y/o predictivos, independientes de los parámetros clínicopatológicos establecidos, que sean de utilidad en cáncer de pulmón. Por lo tanto, surge la necesidad de la búsqueda de nuevas moléculas relevantes en el proceso invasivo que permitan la detección de subpoblaciones tumorales asociadas con una mayor agresividad, lo cual permitiría individualizar la terapia, aumentando la calidad y tiempo de supervivencia del paciente3.
Los retinoides son un grupo de compuestos que incluyen la Vitamina A (retinol), sus metabolitos naturales y varios compuestos sintéticos. El retinol, que se incorpora con la dieta, una vez en la célula es esterificado para su almacenaje o bien metabolizado a ácido retinoico (RA), siendo All Trans Retinoic Acid (ATRA) el principal metabolito a través del cual la Vitamina A ejerce su efecto biológico4. El RA es capaz de regular muchas funciones biológicas, como crecimiento, diferenciación y muerte celular. Además, es esencial para el desarrollo embrionario, sobre todo en el cerebro y el sistema reproductivo, regulando organogénesis y homeostasis4, 5.
RA activa la transcripción por unión a receptores nucleares retinoideos (RARα, β y γ) y rexinoideos (RXRα, β y γ). Luego de unirse al RA, los RARs y RXRs se homo o heterodimerizan y como factores transcripcionales modulan la transcripción de genes específicos, pudiendo afectar la eficiencia de otras vías de señalización por mecanismos poco conocidos. Estos complejos se unen a elementos respondedores de ácido retinoico (RARE) que se encuentran en la región regulatoria de los genes "blanco"5. El efecto de los retinoides es regulado a varios niveles, por ejemplo las proteínas Cellular Retinol Binding Protein (CRBP) (1, 2 y 3) intervienen en el metabolismo del retinol, facilitando la formación de ésteres de retinil para su almacenamiento o la conversión de retinol a ácido retinoico6.
Muchas evidencias experimentales apoyan el conocimiento de que los RA pueden interferir, en varios niveles, con los eventos multifactoriales que intervienen en la oncogénesis, evitando la progresión de lesiones premalignas a malignas o bien, una vez establecido el tumor, pueden impedir o demorar su crecimiento. Por otro lado, como se han detectado alteraciones en la vía de señalización de los RA en varias enfermedades oncológicas, se está intentando modular el sistema RA como terapia antitumoral. Esta terapia tiene como objetivo revertir las alteraciones en el camino de señalización de los RA que bloquean la diferenciación inducida por los retinoides y conducir a las células malignas a la apoptosis. En este sentido, el tratamiento eficaz de la leucemia promielocítica aguda por el uso de RA solo o en combinación con una enzima que descondensa el ADN a nivel del promotor de genes involucrados en este sistema, constituye un interesante ejemplo7, 8. Un número menor de estudios y con resultados variados involucran tumores sólidos9, 10.
Varias teorías han intentado explicar por qué los resultados exitosos encontrados en varios modelos experimentales de tumores sólidos no han podido llevarse a la clínica con el éxito esperado. Así, la actividad clínica limitada de los retinoides clásicos podría estar relacionada con alteraciones en la expresión de los componentes de la vía de señalización del retinoico, como los RAR, detectadas en distintos modelos experimentales y tumores humanos11-13. Además, se ha encontrado que especialmente el RARβ se encuentra frecuentemente silenciado en la carcinogénesis epitelial, lo cual ha llevado a la hipótesis de que RARβ actuaría como un supresor tumoral14. En estos casos una estrategia terapéutica válida podría ser la activación de estos receptores silenciados.
El objetivo de este estudio fue analizar el patrón de expresión del receptor de retinoides RARβ y de la molécula transportadora CRBP1 en tumores de pulmón NSCLC en estadios I y II, provenientes de pacientes operados, y correlacionar los resultados con parámetros clínico-patológicos relacionados con el cáncer de pulmón, incluyendo la supervivencia global.
Materiales y métodos
Se realizó un estudio retrospectivo, donde se analizaron cortes histológicos de piezas quirúrgicas correspondientes a tu-mores NSCLC de 49 pacientes con Estadio I y II. Se incluyeron pacientes vírgenes de tratamiento y sometidos a cirugía como tratamiento primario. Se estableció, además, como criterio de inclusión, que la cirugía fuese considerada curativa. No se incluyeron pacientes que hubieran padecido otro cáncer ni previo ni durante el tratamiento o seguimiento de su cáncer de pulmón. En todos los pacientes que fallecieron la muerte fue debida a la progresión de su cáncer de pulmón.
Todos los pacientes fueron diagnosticados y tratados en el Hospital Italiano de Buenos Aires entre los años 1998 y 2003. Sólo 4/49 recibieron tratamiento adyuvante (2 radioterapia y 2 radio más quimioterapia). El estudio incluyó 35 hombres con una mediana de edad de 64 años (45-78)] y 14 mujeres con 64.5 años (51-83)]. El estudio fue aprobado por los Comités de Docencia e Investigación del Instituto de Oncología A. H. Roffo y el Hospital Italiano de Buenos Aires.
Cortes histológicos de 4 µm de espesor, provenientes de tumores fijados con formol y embebidos en parafina, fueron tratados con microonda para recuperar la antigenicidad. Luego de la eliminación de la peroxidasa endógena, los cortes fueron incubados a 4 °C durante 12 h con los anticuerpos primarios RARβ (Clone 336, Sigma) y CRBP1 (sc-17145, Santa Cruz Laboratories, EE.UU.), seguidos por un segundo anticuerpo biotinilado (Gibco BRL, Gaithersburg, EE.UU.). Luego, los cortes fueron tratados con Vectastain ABC Kit Universal (PK-6200, Vector Laboratories, Burlingame, EE.UU.) y revelados con el cromógeno 3,3' diaminobencidina. Finalmente, el tejido fue teñido con hematoxilina y montado. En todos los casos, se incluyó un corte adicional no expuesto al primer anticuerpo como control negativo para discriminar la tinción de fondo.
La expresión de los marcadores moleculares fue analizada por dos observadores independientes. El porcentaje de células con tinción marrón específica se evaluó semicuantitativamente de acuerdo al siguiente score: 0-10%: (-), 1025 (+), 25-50: (++), 50-75 (+++), 75-100 (++++). En función de esto se definió tinción pobre o negativa versus tinción positiva. Tinción positiva significa que 10% o más de las células epiteliales se tiñen positivamente para ambos antígenos a nivel de citoplasma. Para el caso de RARβ nuclear se consignó positividad si más del 5% de las células presentaban inmunomarcación positiva.
La asociación entre la expresión de RARβ y CRBP1 y los parámetros clínicos fue estudiada con el test de chi-cuadrado. Para los análisis de correlación se calculó el coeficiente de Pearson. Se consideró como significativo un p<0.05. Los datos clínicos e histopatológicos, incluyendo la expresión de p53 y la presencia de células tumorales en el líquido de lavado pleural fueron extraídos de las historias clínicas. De ellas también se extrajo la información sobre el hábito de fumar del paciente.
La supervivencia global, definida como el tiempo transcurrido entre el diagnóstico inicial y la muerte o última consulta, fue analizada mediante las curvas de Kaplan-Meier y el Log-rank test. El análisis de Cox se empleó para analizar simultáneamente la expresión de los marcadores estudiados y las otras variables de pronóstico.
Resultados
En los tumores de pulmón NSCLC la tinción para RARβ fue predominantemente citoplasmática y más intensa en el área perinuclear. Se determinó que el 44.9% de los tumores fueron positivos para RARβ. Por otro lado, se observó que el 34.7% de tumores expresa RARβ a nivel nuclear. El 16.3% (8/49) de los tumores expresó tinción específica tanto a nivel citoplasmático como nuclear.
En el caso de CRBP1, la tinción se asoció a inclusiones citoplasmáticas tipo vesicular, debido a que esta proteína se localiza en gotas de lípidos. La tinción para CRBP1 se evidenció en el 61.2% de los tumores. El coeficiente de correlación entre la expresión de RARβ y CRBP1 fue 0.4941 (Pearson, p<0.0431).
En cuanto al tejido normal, en los casos en los cuales pudo analizarse se observó tinción positiva, tanto para RARβ como para CRBP1, en las células epiteliales bronquiales del epitelio adyacente al tejido tumoral.
Se realizó un análisis univariado comparando la expresión tanto de RARβ como de CRBP1, con los diferentes parámetros clínico-patológicos de utilidad en el cáncer de pulmón consignados en el momento del diagnóstico primario. Para el caso de RARβ se analizó en forma separada la tinción a nivel de citoplasma y a nivel nuclear. Los resultados, resumidos en la Tabla 1, muestran que ni la expresión de RARβ ni la de CRBP1 se vieron afectadas por el sexo o edad del paciente, el tipo histopatológico, el tamaño tumoral o la presencia de ganglios intrapulmonares (siendo estos dos últimos parámetros incluidos en la variable estadio).
TABLA 1.- Asociación entre la expresión de RARβ y los principales parámetros clínico-patológicos relevantes en cáncer de pulmón
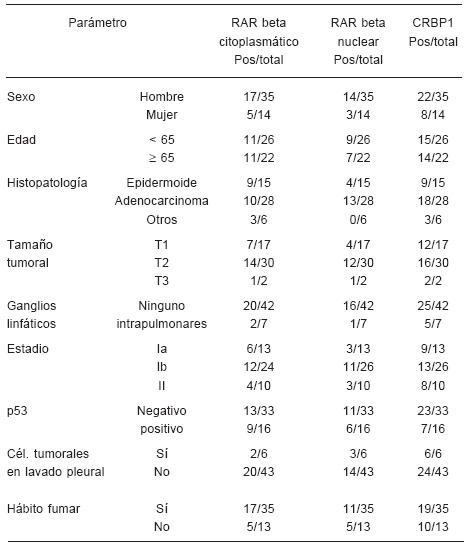
Una observación interesante fue que los tumores del tipo adenocarcinoma expresan más RARβ nuclear que aquéllos con diagnóstico histopatológico de epidermoide. Además, observamos que ningún tumor indiferenciado expresa RARβ nuclear. Otra observación indica que el 14.3% de los pacientes que tienen ganglios positivos presentan expresión para RARβ nuclear en el tejido tumoral versus el 38.1% de los pacientes cuyos ganglios son negativos.
También estudiamos si la presencia de células tumorales en el líquido de lavado pleural se asocia a la expresión de los antígenos estudiados. Se observó que CRBP1 se expresó en todos los tumores que presentaban células tumorales en el lavado pleural, mientras que sólo se expresó en el 55.8% de los tumores donde la citología no detectó células neoplásicas en el líquido pleural (p<0.0375). En cambio, la presencia de células tumorales en el lavado pleural no se asoció con los niveles de inmunomarcación para RARβ.
Por otro lado, los pacientes cuyos tumores expresan RARβ no difieren estadísticamente de aquellos negativos para RARβ con referencia a los niveles de expresión del supresor tumoral p53, que se encuentra frecuentemente alterado (mutado) en el tejido tumoral. El hábito de fumar tampoco mostró relación sobre el número de células positivas para RARβ o CRBP1, encontradas en los cortes de los tumores NSCLC estudiados.
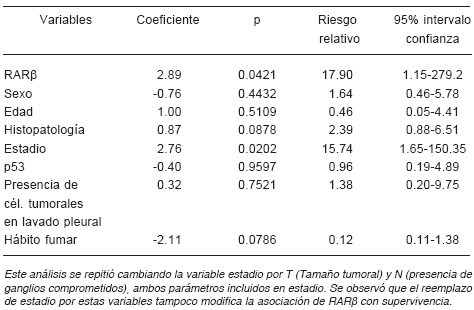
Además, analizamos si la expresión de las dos moléculas estudiadas se asociaba con la supervivencia global en este grupo de pacientes. Como se observa en la Fig. 1A, una expresión aumentada de RARβ a nivel de citoplasma se asoció significativamente con una menor supervivencia global. El análisis de supervivencia estratificado por estadio indicó que la asociación de alta expresión para RARβ citoplasmático y supervivencia es significativa tanto para los pacientes de estadio I como para los de estadio II (LR test 6.93, p<0.0082). Cinco de 18 pacientes EI con RARβ positivo fallecieron, en tanto que no falleció ninguno de los RAR negativos. El análisis de Cox mostró que la expresión elevada de RARβ citoplasmática es un marcador pronóstico independiente, no asociado a ninguna de las variables clínico-patológicas estudiadas (Tabla 2). Por otro lado, ni la inmunomarcación nuclear para RARβ ni la de CRBP1 se asociaron con supervivencia global (Figs. 1B y 2).
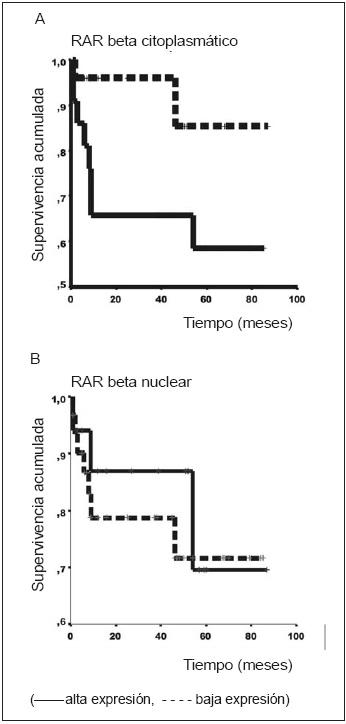
Fig. 1.- Curva de Kaplan-Meier de acuerdo a la expresión de RARβ citoplasmático (A) y nuclear (B). En (A) Log Rank test 4.17; p<0.0412.Fig. 1.- Curva de Kaplan-Meier de acuerdo a la expresión de RARβ citoplasmático (A) y nuclear (B). En (A) Log Rank test 4.17; p<0.0412.
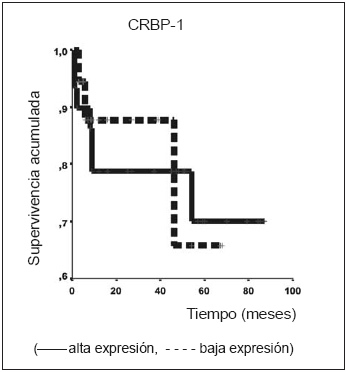
Fig. 2.- Curva de Kaplan-Meier de acuerdo a la expresión de CRBP1 (Log Rank test NS).
TABLA 2.- Modelo de Cox sobre la expresión de RARβ citoplasmático en la supervivencia global de pacientes con cáncer de pulmón
Discusión
A pesar de los numerosos esfuerzos para reducir la alta mortalidad asociada al cáncer de pulmón, mediante los tratamientos quirúrgico y radio/quimioterápicos, el 20% de los pacientes con NSCLC de estadio I y 30% de los pacientes de estadio II recidivan y evolucionan desfavorablemente provocando la muerte del paciente.
Los retinoides son moléculas que participan en el desarrollo y la homeostasis pulmonar en el período embrionario y fetal15. Hay varios estudios que indican que también los retinoides cumplen un papel importante en el crecimiento del pulmón postnatal y en la reparación del órgano luego de una injuria, manteniendo de este modo la integridad organotípica. Además, se sabe que la deficiencia de Vitamina A puede causar cambios preneoplásicos en el epitelio bronquial, lo cual está asociado con un mayor riesgo de cáncer16, 17. Esto, sumado al hecho de que se ha demostrado que el epitelio bronquial expresa receptores para retinoides, ha llevado a proponer su uso en el tratamiento de algunas enfermedades pulmonares. En este sentido, se ha demostrado en niños que el suplemento de Vitamina A disminuye la incidencia y gravedad de la displasia broncopulmonar18. Por otra parte, muchas evidencias experimentales apoyan la hipótesis de que los retinoides podrían interferir, en varios niveles, con los eventos multifactoriales que están involucrados en la oncogénesis, evitando la progresión de lesiones pre-malignas a malignas o bien, una vez establecido el tumor, podrían impedir o demorar su crecimiento. Así, su posible efecto quimioprofiláctico y/o quimioterapéutico se ha ensayado en varias enfermedades malignas y premalignas, aunque con resultados variables9.
En este contexto, nuestro grupo estudió en cortes histológicos de carcinoma de pulmón la expresión de algunos componentes de la vía de señalización de los retinoides, como CRBP1 y RARβ. Nuestro objetivo fue determinar si estas moléculas pueden ser marcadores de utilidad clínica. Se seleccionó un grupo de pacientes en estadio bajo, ya que frente al establecimiento de factores de mala evolución las posibilidades curativas en estos pacientes son más altas.
En el grupo de pacientes estudiado encontramos que el receptor RARβ se expresa a nivel citoplasmático en alrededor del 45% de los carcinomas de pulmón NSCLC. El estudio univariado demostró que no hay correlación entre la expresión del marcador molecular y las principales variables de pronóstico en carcinoma de pulmón, como estadificación (T y N), tipo histológico, sexo, presencia de células tumorales en el lavado pleural y alteración del gen supresor p53. La asociación de alta expresión citoplasmática de RARβ con mal pronóstico resultó ser una variable independiente de otras variables pronósticas relevantes en el cáncer de pulmón (estudio multivariado). Es importante señalar que cuando se estratificó por estadio, tanto en el grupo de pacientes EI como EII, la alta expresión de RARβ mantuvo la propiedad de asociarse con mala evolución.
Varios autores han determinado que durante la carcinogénesis de los NSCLC se observa una pérdida progresiva de RARβ14,19. Sin embargo, nuestro trabajo demuestra que una alta expresión de RARβ en el tejido tumoral está asociada a mal pronóstico, en términos de supervivencia global. Un resultado similar fue observado por un equipo de investigadores del Anderson Cancer Center de Houston, EE.UU.20. Una posible explicación que justifique este resultado podría estar asociada a la complejidad de la expresión de RARβ ya que el mismo gen, por escisión alternativa y por la acción de distintos factores transcripcionales, puede generar al menos cuatro isoformas de RARβ (1, 2, 3, 4)5, 21. Estas isoformas pueden tener funciones opuestas. Así por ejemplo, estudios in vitro indican que RARβ2 media la detención del crecimiento y la inducción de la apoptosis inducida por RA en células de cáncer de pulmón, mientras que RARβ4 parecería predisponer al tejido pulmonar a la hiperplasia y neoplasia22, 23. Por lo tanto, RARβ2 podría funcionar como supresor tumoral, por silenciamiento epigenético vía metilación o por deacetilación de histonas24,25 y RARβ4 parece ser oncogénico22. Si esto es así, niveles aumentados de RARβ4 podrían asociarse a peor pronóstico. Sería interesante estudiar en las muestras de tejidos de NSCLC la expresión de las distintas isoformas de RARβ. Sin embargo, como hasta el momento no hay anticuerpos específicos que permitan distinguir las distintas isoformas de RARβ, estos estudios se deberían hacer con otras técnicas como PCR. Otra posibilidad a considerar es que la sobreexpresión de alguna forma de RARβ con función supresora al localizarse en un lugar ectópico, como el citoplasma, convierta a este receptor en una molécula no funcional, contribuyendo así a la progresión tumoral. Los mecanismos de localización citoplasmática de receptores nucleares es un punto de discusión, pero es posible que la incapacidad de transporte de los RAR al núcleo module su funcionalidad. Así, como ejemplo, Fukunaba y col, empleando un modelo no tumoral, encontraron cambios en la localización celular de los RAR en el epitelio endometrial humano durante las distintas fases del ciclo menstrual26.
También estudiamos la expresión de RARβ a nivel nuclear, especialmente porque la presencia de estos receptores en el núcleo podría indicar que los mismos son funcionalmente activos. No se encontró correlación entre la expresión de RARβ a nivel nuclear y a nivel citoplasmático. Una observación muy interesante fue que ningún tumor NSCLC indiferenciado expresó RARβ a nivel nuclear. También encontramos que los tumores de pacientes que tienen ganglios linfáticos comprometidos presentan, aunque sin valor estadístico, menor expresión de RARβ nuclear. Sin embargo, la inmunomarcación de RARβ nuclear no se asoció con el pronóstico de los pacientes NSCLC EI y II estudiados.
La nicotina es capaz de modular la expresión de RARβ y el efecto de los retinoides sobre la inhibición del crecimiento en células de cáncer de pulmón27. Nosotros analizamos si la expresión de RARβ a nivel citoplasmático o nuclear estaba asociada con el hábito de fumar. Sin embargo, no se encontró ninguna asociación significativa. Si bien de las historias clínicas pudimos relevar que 35 pacientes de la población estudiada relataron ser fumadores, allí no estaba consignado ni el dato del número de cigarrillos/día que consumieron ni durante cuanto tiempo lo hicieron. Por lo tanto, consideramos que sería necesario realizar un estudio más exhaustivo en este sentido.
En algunos modelos se ha encontrado pérdida de respuesta a los retinoides en células de epitelio bronquial a pesar de la expresión constitutiva de RARβ28. De aquí surge la importancia de estudiar el sistema de señalización de retinoides completo, o sea estudiar el conjunto de los RAR y los RXR.
Como el efecto de los retinoides, mediado por receptores nucleares, parece depender de la funcionalidad de CRBP1, nosotros añadimos al estudio de RARβ el análisis de la expresión de esta proteína que participa en la regulación de la homeostasis y metabolismo del retinol. El papel de CRBP1 en la carcinogénesis humana es poco conocido. En algunos cánceres, como ovario y mama, se encontró una expresión disminuida de CRBP1, producida por una metilación aberrante de la región del promotor del gen6, 29, mientras que en carcinoma de próstata su expresión está aumentada30. Nosotros encontramos inmunomarcación positiva para esta molécula en el 60% de los carcinomas de pulmón NSCLC de pacientes EI y II. Esta expresión no se asoció con los parámetros de pronóstico clásicos usados en cáncer de pulmón, con la única excepción de haber encontrado tinción significativa-mente aumentada de CRBP1 en los tumores de pacientes que tenían células neoplásicas en el lavado pleural. Sería interesante estudiar la expresión de esta molécula en las células con capacidad para acceder al espacio pleural, para determinar si la alta expresión de CRBP1 contribuye a que las células adquieran esta propiedad.
Por otro lado, la alteración de CRBP1 en tumores de pacientes de estadios bajos podría indicar que esta alteración es un evento relativamente temprano en la progresión de NSCLC. Farías y col.31 demostraron, utilizando un modelo de células mamarias inmortalizadas con el virus SV40, que la baja expresión de CRBP1 en forma crónica compromete la actividad de los RAR, restringiendo el efecto de la vitamina A endógena sobre las células epiteliales y llevando a una pérdida de diferenciación y a la progresión tumoral.
Se ha probado in vitro que células tumorales de diferente origen son capaces de responder al tratamiento con retinoides, inhibiendo su crecimiento y/o induciendo diferenciación y apoptosis32, 33. En el caso particular del cáncer de pulmón, los estudios in vitro indican que las células son relativamente resistentes a la inhibición del crecimiento por RA, aunque las células de tumores NSCLC son más sensibles que aquéllas provenientes de SCLC34. Estos estudios llevaron a intentar modular el sistema RA como terapéutica antitumoral en varios tipos de cánceres, con resultados variables en tumores sólidos. Varias teorías han intentado explicar por qué los resultados exitosos encontrados en varios modelos experimentales de tumores sólidos no han podido llevarse a la clínica con el mismo resultado. Uno de ellos es la presencia de alteraciones en la vía RA, por inactivación de receptores u otras moléculas participantes de la vía. En estos casos una estrategia terapéutica válida podría ser reactivar estas moléculas silenciadas.
En conclusión, en este grupo de pacientes NSCLC de estadio I y II encontramos que la expresión de CRBP1 se asocia a la presencia de células tumorales en lavado pleural y que una expresión alta de RARβ a nivel citoplasmático es un factor independiente de mal pronóstico. Estos hallazgos pueden ser de importancia clínica, ya que permitirían identificar aquellos pacientes de bajo estadio que a pesar de haber sido operados exitosamente recidivan. A estos pacientes se les podría aplicar otros esquemas terapéuticos, puesto que podrían tener más oportunidades de sobrevivir si se tratan tempranamente en forma más agresiva. Por otro lado, la elucidación del patrón de expresión y de las interacciones de todos los receptores de retinoides podría mejorar nuestra capacidad para desarrollar terapias quimioprofilácticas, para predecir la utilidad de los tratamientos adyuvantes y para mejorar globalmente el manejo de la enfermedad NSCLC.
Agradecimientos: Este trabajo se realizó gracias al Subsidio de la Agencia Nacional de Promoción de Ciencia y Técnica BID 1728/OC-AR- PICT 11217.
Los autores desean expresar su agradecimiento a la Lic. Fernanda Roca y a la Lic. María José Veloso por la colaboración en la realización de las tinciones por inmunohistoquímica y al Dr. Gabriel Agüero por la colaboración en la extracción de datos de las historias clínicas.
1. Travis WD, Travis LB, Devesa SS. Lung cancer. Cancer 1995; 75: 191-202. [ Links ]
2. Stang A, Pohlabeln H, Muller KM, Jahn I, Giersiepen K, Jockel KH. Diagnostic agreement in the histopathological evaluation of lung cancer tissue in a population-based case-control study. Lung Cancer 2006; 52: 29-36. [ Links ]
3. Thunnissen FB, Schuurbiers OC, den Bakker MA. A critical appraisal of prognostic and predictive factors for common lung cancers. Histopathology 2006; 48: 779-86. [ Links ]
4. Altucci L, Gronemeyer H. The promise of retinoids to fight against cancer. Nat Rev Cancer 2001; 1: 181-93. [ Links ]
5. Chambon P. A decade of molecular biology of retinoic acid receptors. Faseb J 1996; 10: 940-54. [ Links ]
6. Kuppumbatti YS, Rexer B, Nakajo S, Nakaya K, Mira-y-Lopez R. CRBP suppresses breast cancer cell survival and anchorage-independent growth. Oncogene 2001; 20: 7413-9. [ Links ]
7. Powell BL. Acute progranulocytic leukemia. Curr Opin Oncol 2001; 13: 8-13. [ Links ]
8. Nucifora E, Fantl D, Goldstein S, Kusminsky G. Acute promyelocytic leukemia: experience with trans-retinoic acid in Argentina. Medicina (Buenos Aires) 1996; 56: 333-8. [ Links ]
9. Kurie JM, Lotan R, Lee JJ, et al. Treatment of former smokers with 9-cis-retinoic acid reverses loss of retinoic acid receptor-beta expression in the bronchial epithelium: results from a randomized placebo-controlled trial. J Natl Cancer Inst 2003; 95: 206-14. [ Links ]
10. Freemantle SJ, Spinella MJ, Dmitrovsky E. Retinoids in cancer therapy and chemoprevention: promise meets resistance. Oncogene 2003; 22: 7305-15. [ Links ]
11. Farias EF, Arapshian A, Bleiweiss IJ, Waxman S, Zelent A, Mira y Lopez R. Retinoic acid receptor alpha2 is a growth suppressor epigenetically silenced in MCF-7 human breast cancer cells. Cell Growth Differ 2002; 13: 335-41. [ Links ]
12. Mira y Lopez R, Zheng WL, Kuppumbatti YS, Rexer B, Jing Y, Ong DE. Retinol conversion to retinoic acid is impaired in breast cancer cell lines relative to normal cells. J Cell Physiol 2000; 185: 302-9. [ Links ]
13. Zhong C, Yang S, Huang J, Cohen MB, Roy-Burman P. Aberration in the expression of the retinoid receptor, RXRalpha, in prostate cancer. Cancer Biol Ther 2003; 2: 179-84. [ Links ]
14. Brabender J, Metzger R, Salonga D, et al. Comprehensive expression analysis of retinoic acid receptors and retinoid X receptors in non-small cell lung cancer: implications for tumor development and prognosis. Carcinogenesis 2005; 26: 525-30. [ Links ]
15. Mollard R, Ghyselinck NB, Wendling O, Chambon P, Mark M. Stage-dependent responses of the developing lung to retinoic acid signaling. Int J Dev Biol 2000; 44: 457-62. [ Links ]
16. Sporn MB, Dunlop NM, Newton DL, Smith JM. Prevention of chemical carcinogenesis by vitamin A and its synthetic analogs (retinoids). Fed Proc 1976; 35: 1332-8. [ Links ]
17. Dogra SC, Khanduja KL, Gupta MP. The effect of vitamin A deficiency on the initiation and postinitiation phases of benzo(a)pyrene-induced lung tumourigenesis in rats. Br J Cancer 1985; 52: 931-5. [ Links ]
18. Robbins ST, Fletcher AB. Early vs. delayed vitamin A supplementation in very-low-birth-weight infants. JPEN J Parenter Enteral Nutr 1993; 17: 220-5. [ Links ]
19. Xu XC, Sozzi G, Lee JS, et al. Suppression of retinoic acid receptor beta in non-small-cell lung cancer in vivo: implications for lung cancer development. J Natl Cancer Inst 1997; 89: 624-9. [ Links ]
20. Khuri FR, Lotan R, Kemp BL, et al. Retinoic acid receptor-beta as a prognostic indicator in stage I non-small-cell lung cancer. J Clin Oncol 2000;18: 2798-804. [ Links ]
21. Zelent A, Mendelsohn C, Kastner P, et al. Differentially expressed isoforms of the mouse retinoic acid receptor beta generated by usage of two promoters and alternative splicing. Embo J 1991; 10: 71-81. [ Links ]
22. Berard J, Gaboury L, Landers M, et al. Hyperplasia and tumours in lung, breast and other tissues in mice carrying a RAR beta 4-like transgene. Embo J 1994; 13: 5570-80. [ Links ]
23. Berard J, Laboune F, Mukuna M, Masse S, Kothary R, Bradley WE. Lung tumors in mice expressing an antisense RARbeta2 transgene. Faseb J 1996; 10: 1091-7. [ Links ]
24. Petty WJ, Li N, Biddle A, et al. A novel retinoic acid receptor beta isoform and retinoid resistance in lung carcinogenesis. J Natl Cancer Inst 2005; 97: 1645-51. [ Links ]
25. Soprano DR, Qin P, Soprano KJ. Retinoic acid receptors and cancers. Annu Rev Nutr 2004; 24: 201-21. [ Links ]
26. Fukunaka K, Saito T, Wataba K, Ashihara K, Ito E, Kudo R. Changes in expression and subcellular localization of nuclear retinoic acid receptors in human endometrial epithelium during the menstrual cycle. Mol Hum Reprod 2001; 7: 437-46. [ Links ]
27. Chen GQ, Lin B, Dawson MI, Zhang XK. Nicotine modulates the effects of retinoids on growth inhibition and RAR beta expression in lung cancer cells. Int J Cancer 2002; 99: 171-8. [ Links ]
28. Kim YH, Dohi DF, Han GR, et al. Retinoid refractoriness occurs during lung carcinogenesis despite functional zretinoid receptors. Cancer Res 1995; 55: 5603-10. [ Links ]
29. Kuppumbatti YS, Bleiweiss IJ, Mandeli JP, Waxman S, Mira YLR. Cellular retinol-binding protein expression and breast cancer. J Natl Cancer Inst 2000; 92: 475-80. [ Links ]
30. Jeronimo C, Henrique R, Oliveira J, et al. Aberrant cellular retinol binding protein 1 (CRBP1) gene expression and promoter methylation in prostate cancer. J Clin Pathol 2004; 57: 872-6. [ Links ]
31. Farias EF, Ong DE, Ghyselinck NB, Nakajo S, Kuppumbatti YS, Mira y Lopez R. Cellular retinol-binding protein I, a regulator of breast epithelial retinoic acid receptor activity, cell differentiation, and tumorigenicity. J Natl Cancer Inst 2005; 97: 21-9. [ Links ]
32. Seewaldt VL, Johnson BS, Parker MB, Collins SJ, Swisshelm K. Expression of retinoic acid receptor beta mediates retinoic acid-induced growth arrest and apoptosis in breast cancer cells. Cell Growth Differ 1995; 6: 1077-88. [ Links ]
33. Hatoum A, El-Sabban ME, Khoury J, Yuspa SH, Darwiche N. Overexpression of retinoic acid receptors alpha and gamma into neoplastic epidermal cells causes retinoic acid-induced growth arrest and apoptosis. Carcinogenesis 2001; 22: 1955-63. [ Links ]
34. Geradts J, Chen JY, Russell EK, Yankaskas JR, Nieves L, Minna JD. Human lung cancer cell lines exhibit resistance to retinoic acid treatment. Cell Growth Differ 1993; 4: 799-809. [ Links ]
Recibido: 17-08-2007
Aceptado: 11-01-2008














