Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Medicina (Buenos Aires)
Print version ISSN 0025-7680On-line version ISSN 1669-9106
Medicina (B. Aires) vol.68 no.4 Ciudad Autónoma de Buenos Aires July/Aug. 2008
Hallazgo de antígenos en un tumor murino espontáneo no inmunogénico mediante el uso de una vacuna basada en células dendríticas
Verónica L. Reffo, Paula Chiarella, Juan Bruzzo, Oscar D. Bustuoabad, Raúl A. Ruggiero
División Medicina Experimental, ILEX-CONICET, Instituto de Investigaciones Hematológicas, Academia Nacional de Medicina, Buenos Aires
Dirección postal: Dr. Raúl A. Ruggiero, División Medicina Experimental, Instituto de Investigaciones Hematológicas, Academia Nacional de Medicina, Pacheco de Melo 3081, 1425 Buenos Aires, Argentina Fax: (54-11) 4803-9475 e-mail: ruloruggiero@yahoo.com.ar
Resumen
La inmunoterapia sería un tratamiento ideal contra el cáncer porque combina eficacia y especificidad, pero hasta hoy no ha dado resultados exitosos contra tumores establecidos. En este trabajo abordamos el problema de la falta de inmunogenicidad de los tumores espontáneos como una posible causa del fracaso de la inmunoterapia. Nos preguntamos si esta falta de inmunogenicidad se debe a la ausencia de antígenos o a la existencia de mecanismos tolerogénicos que impiden a esos antígenos iniciar una respuesta inmune. Para deslindar entre ambas alternativas, utilizamos dos tumores murinos -uno espontáneo y no inmunogénico (linfoma LB) y otro inducido por metilcolantreno y fuertemente inmunogénico (fibrosarcoma MC-C)- y la técnica de inmunización con células dendríticas (DC) estimuladas con extracto acelular de tumor. Al estimular DC in vitro con extracto de LB, las DC no exhibieron maduración ni inmunizaron in vivo contra implantes de LB. Por otro lado, extractos de MC-C, hicieron madurar las DC y las convirtieron en poderosas vacunas contra implantes de MC-C pero no de LB, indicando que MC-C y LB no tienen antígenos compartidos. Por último, cuando DC fueron estimuladas con una mezcla de los extractos de LB y MC-C, expresaron marcadores de maduración y exhibieron capacidad vacunante contra LB. Estos resultados sugieren que el tumor LB tiene antígenos específicos de tumor pero carece de otras señales necesarias para la maduración de las DC. Estas señales serían aportadas por el extracto de MC-C, permitiendo de este modo iniciar una respuesta inmune contra LB.
Palabras clave: Tumores espontáneos; Células dendríticas; Antígenos tumorales
Abstract
Unveiling antigens in a non-immunogenic spontaneous murine tumor using a dendritic cell-based vaccine. Up to date, most attempts to use immunotherapy to cause the regression of animal and human established tumors have not been successful. Former experiments have postulated that this failure could be attributed, at least in part, to a lack of immunogenicity of spontaneous tumors. In this paper, we have investigated whether this lack of immunogenicity can be attributed to the absence of tumor antigens or to the existence of tolerogenic mechanisms preventing such antigens from initiating an antitumor immune response. We have used two murine tumors -a non-immunogenic spontaneous lymphoma (LB) and a strongly immunogenic methylcholanthrene-induced fibrosarcoma (MC-C)- together with a vaccination strategy based on the inoculation of dendritic cells (DC) loaded with a tumor lysate. When DC were pulsed with LB lysate (DC+LB), no maturation of DC was achieved in vitro and no protection against LB implants after DC+LB inoculation was observed in vivo. On the other hand, when DC were pulsed with MC-C lysate (DC+MC-C), maturation of DC was observed along with a strong protection against MC-C implants after DC+MC-C inoculaton. Finally, when DC were pulsed with both LB and MC-C lysates (DC+LB+MC-C), maturation of DC and protection against LB implants were achieved. Since no immune cross reaction between MC-C and LB was ever observed, the most likely interpretation is that LB bears specific tumor antigens but lacks other signals to achieve DC maturation. These signals would be provided by MC-C which would enable DC to mature and to initiate an effective anti-LB immune response.
Key words: Spontaneous tumors; Dendritic cells; Tumor antigens
Durante décadas, numerosos investigadores han tratado de comprender la complejidad celular y molecular del cáncer. Si bien se ha avanzado mucho en estas investigaciones, pocos de los conocimientos adquiridos han podido materializarse en una terapia realmente efectiva1. En la actualidad existen tres tratamientos convencionales contra el cáncer: la cirugía, la radioterapia y la quimioterapia. Los dos primeros cumplen su objetivo terapéutico cuando las células tumorales se encuentran puntualmente localizadas. Por el contrario, cuando éstas se han diseminado desde su lugar de origen, estos métodos van perdiendo eficacia por lo que se requiere de un procedimiento que destruya las células cancerosas donde sea que se encuentren. Es aquí donde se recurre a la quimioterapia. No obstante, los procedimientos de esta práctica son, en mayor o menor medida, tóxicos para las células normales dado que no son específicos contra el tumor, limitando así sus aplicaciones terapéuticas1.
Una terapia ideal debería combinar tanto especificidad como eficacia, actuando selectivamente y siendo atóxica, lo cual implicaría sólo la eliminación de las células tumorales sin causar perjuicio a las células normales. La inmunoterapia parecería ser, en principio, un tratamiento ideal ya que mediante la estimulación del propio sistema inmune del paciente, éste podría reconocer y eliminar las células tumorales sin afectar al resto del organismo.
Desde hace muchos años se sabe que es posible desarrollar vacunas para prevenir la aparición de tumores experimentales en animales de laboratorio. Asimismo, en el hombre se han desarrollado exitosos protocolos de vacunación contra el virus de la hepatitis B que redujeron significativamente la incidencia de hepatocarcinomas en áreas donde la infección precoz con el virus y la existencia de tumores hepáticos estaban fuertemente correlacionadas2, 3.
Sin embargo, la mayoría de los intentos por aplicar vacunas, no ya en forma preventiva sino con un propósito terapéutico para tratar tumores establecidos, no han resultado, hasta hoy, exitosos, ni en animales ni en seres humanos4, 5.
Este fracaso ha sido observado tanto con tumores experimentales fuertemente antigénicos -como, por ejemplo, tumores murinos inducidos por dosis masivas de carcinógenos químicos y virales- como con tumores de origen espontáneo. Se han invocado diferentes mecanismos inmunosupresores para explicar la refractariedad de los individuos portadores de tumores fuertemente antigénicos a las terapias inmunológicas. Por ejemplo, la expresión aumentada de células supresoras del tipo de T reg CD4+CD25+ o NKT, la aparición de una condición inflamatoria sistémica, la producción por células tumorales de factores potencialmente inmunosupresores como IL-10, TGF-b, galectina-1, etc.6-10. En los últimos años, se llevaron a cabo intentos para eliminar o atenuar estos mecanismos y, sobre esa base, se elaboraron algunos promisorios protocolos de inmunoterapia en animales de experimentación5, 10.
Por otro lado, respecto de los tumores de origen espontáneo, la dificultad podría ser mucho más profunda. En efecto, a diferencia de muchos tumores experimentales, la gran mayoría de los tumores surgidos espontáneamente en ratas y ratones, carecen de detectable inmunogenicidad2, 11-14. Esta particularidad podría hacerse extensiva a los cánceres humanos más comunes, sobre la base de que muchos de ellos no aumentan su incidencia en seres humanos que padecen de inmunodeficiencias genéticas o adquiridas15.
Ahora bien, esta falta de inmunogenicidad de los tumores espontáneos, ¿se debe a la ausencia de antígenos -en cuyo caso todo intento de inmunoterapia sería vano- o a la existencia de mecanismos tolerogénicos que impedirían a esos antígenos iniciar una respuesta inmune de rechazo?
Para deslindar entre ambas alternativas, utilizamos dos tumores murinos de la cepa BALB/c -uno de origen espontáneo (linfoma LB) y otro inducido por metilcolantreno (fibrosarcoma MC-C)- y la técnica de inmunización con células dendríticas (DC) estimuladas con extracto acelular de tumor. Una descripción detallada de los tumores LB y MC-C y de la preparación del extracto tumoral aparecen en trabajos anteriores10, 13, 14.
Por su parte, la técnica de inmunización con DC involucra, en primera instancia, la obtención de DC a partir de los precursores de médula ósea. Con tal motivo, se extrajeron del fémur y la tibia de ratones, los precursores correspondientes, y se resuspendieron en medio RPMI conteniendo 10% de suero bovino fetal (SBF), 1% de antibióticos, 5 × 10-5 M de b-mercaptoetanol y 30% del sobrenadante de cultivo de la línea J588 productora de GM-CSF (factor estimulador de colonias de granulocitos y macrófagos). Al cabo de 8 días de cultivo, se obtuvo una población con 90% de DC (CD11c+), las que se incubaron durante 48 horas con extracto acelular del tumor LB, con extracto acelular del tumor MC-C o con una mezcla 50:50 de ambos extractos (1 × 106 DC en 1 ml de medio con 0.25 ml de extracto tumoral). Más detalles de la preparación y maduración de DC fueron dados previamente10. Las DC estimuladas con los diferentes extractos fueron analizadas por citometría de flujo para evaluar su estado de maduración, el cual se determinó, usando anticuerpos fluorosceinados específicos, por un aumento en el % de DC que expresaban las moléculas coesti-muladores CD80 y CD86 y del complejo mayor de histo-compatibilidad clase II (MHCII) y/o por un incremento de la expresión media (por DC) de estas moléculas.
Una dosis de 2 × 105 DC de cada uno de los grupos se inoculó en la almohadilla plantar de ratones normales en dos oportunidades con un intervalo de 7 días. Siete días después de la segunda inoculación, los ratones recibieron, por la vía subcutánea, diferentes dosis de células tumorales vivas con el propósito de medir el poder inmunizante de las DC. Ratones no pretratados o pretratados con DC inmaduras sirvieron como control. La capacidad inmunizante de los diferentes protocolos de vacunación se evaluó mediante la determinación de la dosis tumoral 50 (DT50) en los animales vacunados y controles, definiendo DT50 como el número de células tumorales que es capaz de crecer en el 50% de los animales. Se considera que cuanto mayor es el incremento de la DT50 por arriba de los valores controles, mayor es la resistencia de los animales al tumor y en consecuencia, mayor es la capacidad inmunizante de la vacuna que provocó ese incremento. La significación estadística fue determinada por el test de ANOVA de una sola vía, post t test de Bonferroni, considerándose significativas las diferencias p = 0.05 o menores.
Los resultados de estos experimentos revelaron que al estimular DC in vitro con extracto del tumor espontáneo LB, las DC no exhibieron un aumento significativo de la expresión de los marcadores de maduración CD80, CD86 y MHCII respecto de las DC sin estimular o estimuladas con extracto acelular de esplenocitos normales (Fig. 1), ni inmunizaron in vivo contra implantes de células LB (Fig. 2).

Fig. 1.- Expresión de los marcadores de maduración CD80, CD86 y MHCII en células dendríticas (DC) sin estimular o estimuladas con extracto de esplenocitos normales (Control, a) o en DC estimuladas durante dos días en cultivo con extracto del tumor MC-C (DC+MC-C, b), con extracto del tumor LB (DC+LB, c) o con la mezcla de los extractos de ambos tumores (DC-MC-C+LB, d). Los marcadores de maduración fueron revelados con anticuerpos fluorosceinados específicos y medidos mediante citometría de flujo. % Células: indica el porcentaje de células con fenotipo CD11c+ (DC) que expresan el marcador correspondiente. MFI: intensidad media de fluorescencia. Los resultados representan el promedio (media ± error estándar) de 3 experimentos independientes.
CD11c/CD80: % de células: *b vs. a: p < 0.01; b vs. c: p<0.02; b vs. d: p<0.05. ** d vs. a: p<0.05; d vs. c: p < 0.05.
CD11 c/CD80: MFI: * b vs. a: p<0.05; b vs. c: p<0.05.
CD11 c/CD86: % de células: * b vs. a: p < 0.01; b vs. c: p< 0.05. ** d vs. a: p < 0.05.
CD11 c/CD86: MFI: * b vs. a: p < 0.01: b vs. c: p < 0.01; ** d vs. a: p < 0.05; d vs. c: p < 0.05.
CD11 c/MHCII: % de células: * d vs. a: p < 0.05.
CD11 c/MHCII: MFI: * b vs. a: p < 0.05; b vs. c: p < 0.05.
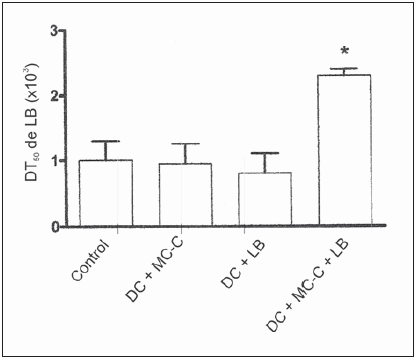
Fig. 2.- Medición de la Dosis Tumoral 50 (DT50) en ratones que no recibieron tratamiento (Control, a) o que recibieron 2 dosis de 2 × 105 de DC estimuladas con extracto del tumor MC-C (DC + MC-C, b), o con extracto del tumor LB (DC + LB, c) o con la mezcla de extractos de ambos tumores (DC+MC-C+LB, d). Las dos dosis de DC fueron inoculadas en la almohadilla plantar de los ratones 14 y 7 días antes del desafío subcutáneo con diferentes dosis de células tumorales LB vivas (desde 1 × 105 a 1 × 102).
DT50 de LB: Número de células tumorales LB capaces de crecer en el 50% de los ratones.
DT50 de LB: d vs. a, b y c: p < 0.05. Los datos son el resultado de 3 experimentos independientes (media ± error estándar) que involucraron 41 ratones en el grupo vacunado con DC +LB+MC-C; 49 ratones en el grupo control, 42 ratones en el grupo pretratado con DC+LB y 14 ratones en el grupo pretratado con DC+MC-C.
Por otro lado, los extractos del fibrosarcoma MC-C inducido por metilcolantreno, hicieron madurar las DC (Fig. 1) y las convirtieron en poderosas vacunas contra implantes de MC-C. La DT50 de MC-C en ratones controles (media ± error estándar) fue: 4 × 104 ± 0.4 × 104 células MC-C, mientras que en ratones vacunados fue > 1 × 106, en 3 experimentos que incluyeron 18 ratones vacunados y 21 controles, p < 0.001.
Por último, cuando DC fueron estimuladas con una mezcla de los extractos de los tumores LB y MC-C, expresaron marcadores de maduración en un nivel superior al observado en DC inmaduras y en DC tratadas con el extracto de LB sólo (Fig. 1). Asimismo, exhibieron una capacidad vacunante contra LB -reflejada en un aumento significativo de la DT50 respecto de los controles- que no mostraron las DC estimuladas sólo con extracto de LB (Fig. 2). Este efecto no puede atribuirse a una supuesta reacción cruzada entre los antígenos de MC-C y LB, dado que DC estimuladas sólo con extracto de MC-C no mostraron capacidad vacunante contra LB (Fig. 2).
Discusión
La gran mayoría de los tumores murinos de origen espontáneo, y probablemente muchos de los cánceres humanos comunes, carecen de detectable inmunogenicidad. Este hecho ha sido invocado como una de las causas más importantes que impedirían la aplicación de terapias inmunológicas en la clínica. En este trabajo nos hemos preguntado si esta falta de inmunogenicidad se debe a la falta de antígenos o a la existencia de mecanismos que impedirían a esos eventuales antígenos iniciar una respuesta inmune. Los resultados de los experimentos informados aquí, sugieren que el tumor espontáneo LB tendría antígenos específicos de tumor. Sin embargo, carecería de otras señales madurativas (heat shock proteins u otras) que junto con los antígenos, serían necesarias para estimular y hacer madurar a las DC, bloqueándose de este modo el primer paso para el desarrollo de una respuesta inmune antitumoral. Esto explicaría por qué, en condiciones normales, ninguna de las técnicas de inmunización usadas en el pasado14 ni la utilizada en este trabajo, con DC estimuladas con extracto de LB, pudieron vacunar contra implantes de LB. Por otro lado, cuando se mezclaron los extractos de los tumores LB y MC-C, aquellas señales habrían sido provistas por el tumor inmunogénico MC-C. Como consecuencia de la acción combinada de los antígenos de LB y de las señales madurativas de MC-C, las DC estimuladas con la mezcla de extractos habrían podido madurar y luego actuar como vacunas eficientes contra LB.
Si lo que hemos observado con LB se aplicara también a otros tumores murinos y humanos de origen espontáneo, entonces, las terapias inmunes contra el cáncer serían todavía posibles, porque si los tumores espontáneos tuvieran antígenos específicos, podrían ser reconocidos como extraños por el sistema inmune. Sin embargo, para que una terapia inmunológica contra este tipo de tumores tuviera la posibilidad de ser eficiente, no bastaría la aplicación de vacunas antitumorales -como se ha intentado sin éxito hasta ahora- sino que se requeriría de un protocolo que añadiera a esas vacunas, las señales madurativas para DC que faltarían en las células de esos tumores y cuya naturaleza queda por determinarse.
Conflicto de interés: Este trabajo fue financiado con subsidios del CONICET (Consejo Nacional de Investigaciones Científicas y Técnicas) y de la Agencia Nacional de Promoción Científica y Tecnológica (PICT 05-38197/2005), Argentina.
1. Bailar JC, Gornik HL. Cancer undefeated. N Engl J Med 1997; 336: 1569-74. [ Links ]
2. Prehn RT, Main JM. Immunity to methylcholanthrene-induced sarcomas. J Natl Cancer Inst 1957; 18: 769-78. [ Links ]
3. Chang MH, Chen TH, Hsu HM, et al. Prevention of hepatocellular carcinoma by universal vaccination against hepatitis B virus: the effect and problems. Clin Cancer Res 2005; 11: 7953-7. [ Links ]
4. Cranmer LD, Trevol KT, Hersh EM. Clinical applications of dendritic cell vaccination in the treatment of cancer. Cancer Immunol Immunother 2004; 53: 275-306. [ Links ]
5. Vieweg J, Su Z, Dahm P, Kusmartsev S. Reversion of tumor-mediated immunosuppression. Clin Cancer Res 2007, 13: 727-32. [ Links ]
6. Von Boehmer H. Mechanisms of suppression by suppressor T cells. Nat Immunol 2005; 4: 338-44. [ Links ]
7. Waldman TA. Immunotherapy: past, present and future. Nat Med 2003; 3: 269-77. [ Links ]
8. Chiarella P, Vulcano M, Laborde E, et al. Reversión del eclipse inmunológico y vacunación terapéutica contra el cáncer en un modelo experimental. Medicina (Buenos Aires) 2007; 67: 44-8. [ Links ]
9. Rubinstein N, Alvarez M, Zwirner NW, et al. Targeted inhibition of galectin-1 expression in tumor cells results in heightened T cell-mediated rejection: a potential mechanism of tumor-immune privilege. Cancer Cell 2004; 5: 241-51. [ Links ]
10. Chiarella P, Vulcano M, Bruzzo J, et al. Anti-inflammatory pretreatment enables an efficient dendritic cell-based immunotherapy against established tumors. Cancer Immunol Immunother 2008; 57: 701-18. [ Links ]
11. Hewitt HB, Blake ER, Walder AS. A critique of the evidence for active host defence against cancer based on personal studies of 27 murine tumours of spontaneous origin. Br J Cancer 1976; 33: 241-59. [ Links ]
12. Middle JG, Embleton MJ. Naturally arising tumors of the inbred WAB/Not rat strain. Immunogenicity of transplanted tumors. J Natl Cancer Inst 1981; 67: 637-43. [ Links ]
13. Ruggiero RA, Bustuoabad OD, Cramer P, Bonfil RD, Pasqualini CD. Correlation between seric antitumor activity and concomitant resistance in mice bearing nonimmunogenic tumors. Cancer Res 1990; 50: 7159-65. [ Links ]
14. Franco M, Bustuoabad OD, di Gianni PD, Goldman A, Pasqualini CD. A serum-mediated mechanism for concomitant resistance shared by immunogenic and non-immunogenic murine tumours. Br J Cancer 1996; 74: 178-86. [ Links ]
15. Grulich AE, van Leeuwen MT, Falster MO, Vajdic CM. Incidence of cancers in people with HIV/AIDS compared with immunosuppressed transplant recipients: a meta-analysis. Lancet 2007; 370: 6-7. [ Links ]














