Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Medicina (Buenos Aires)
versión impresa ISSN 0025-7680versión On-line ISSN 1669-9106
Medicina (B. Aires) v.69 n.3 Ciudad Autónoma de Buenos Aires mayo/jun. 2009
ARTÍCULO ORIGINAL
Fisiopatología y respuesta inmune de ovinos experimentalmente infectados con Echinococcus granulosus
Edmundo Larrieu1, Ángela Rosa Álvarez1, Antonio Gatti2, Sergio Mancini2, Ricardo Bigatti2, Daniel Araya2, Verónica Véspoli2, Juan García Vinet3, Mariela García Cacheau2, Emiliano Álvarez2, Laura Cavagion2
1Facultad de Veterinaria de la Universidad Nacional de La Pampa;
2Ministerio de Salud, Provincia de Río Negro;
3Instituto Nacional de Tecnología Agropecuaria, Viedma, Río Negro
Dirección postal: Edmundo Juan Larrieu, Laprida 240, 8500 Viedma, Río Negro, Argentina Fax (54-2920) 430007 e-mail: elarrieu@salud.rionegro.gov.ar
Resumen
La respuesta inmune a la infección por Echinococcus granulosus en el ovino ha sido poco estudiada. El objetivo del presente trabajo fue aportar información sobre la fisiopatología y la respuesta inmune a la infección experimental con E. granulosus en ovinos. Se inocularon experimentalmente ovinos con tres dosis distintas de huevos de E. granulosus, evaluándose la repuesta inmune por seguimiento mediante enzimo inmuno ensayo con tres preparaciones antigénicas (líquido hidatídico total, fracción purificada de líquido hidatídico total y fracción lipoproteica purificada) durante 500 días. Se sacrificaron animales en forma escalonada para observar macroscópica y microscópicamente el desarrollo del parásito. La respuesta inmune se detectó a partir de los 10 días y se mantuvo durante el período de observación, resultando inicialmente proporcional a la carga de huevos inoculados, y disminuyendo las diferencias con el tiempo. Se identificaron quistes fértiles a los 10 meses post inoculación y oncósferas vivas 500 días post inoculación. La respuesta de anticuerpos en el ovino a la infección por E. granulosus fue anterior a la formación de líquido hidatídico y resultó generada por la movilidad de la oncósfera. La temprana fertilidad identificada histológicamente indica que la alimentación de canes con vísceras de ovinos jóvenes puede producir ciclos de infección. La presencia de oncósferas vivas en el hígado, por su parte, aporta información sobre la patogenia de la enfermedad y permite expresar hipótesis sobre las causas de nuevas operaciones en el hombre luego de la extirpación de un quiste hidatídico lo que podría liberar el freno inmunitario sobre dichas oncósferas.
Palabras clave: Equinococcosis; Ovinos; Respuesta inmune; Fisiopatología
Abstract
Pathophysiology and immune response in sheep experimentally infected with Echinococcus granulosus. The immune response to Echinococcus granulosus in sheep has not been extensively investigated. The objective of this study was to increase the information on the physiopathology of E. granulosus and the immune response elicited in sheep. Animals were experimentally inoculated with three different doses of E. granulosus eggs and the immune response was evaluated over 500 days using enzyme immunoassay with three antigenic preparations: total hydatid fluid, purified fraction of hydatid fluid and purified lipoprotein fraction. Sheep were slaughtered at different intervals to observe the macroscopic and microscopic development of the parasite. Immune response was detected at 10 days and was maintained throughout the observation period, being initially proportional to the load of inoculated eggs and then decreasing over time. Fertile cysts were identified 10 months after inoculation and live onchosphere 500 days after inoculation. Antibody response to E. granulosus in sheep preceded hydatid fluid formation and was generated by the mobility of the onchosphere. Early histological identification of fertile cysts indicates that feeding dogs with viscera of young sheep can produce cycles of infection. Furthermore, the presence of live onchosphere in the liver here found contributes to a better knowledge of the pathogenesis of this disease it could be hypothetically considered as a cause for the repeated surgeries necessary in man after the extirpation of a hydatid cyst.
Key words: Echinococcosis; Sheep; Immune response; Pathophysiology
La equinococcosis quística es una zoonosis parasitaria producida por un cestode, Echinococcus granulosus, cuyo ciclo de vida incluye un hospedero definitivo carnívoro (principalmente el perro) y un hospedero intermediario ungulado (principalmente ovino). Los animales herbívoros y las personas se infectan a partir de la ingestión de huevos de E. granulosus. En el intestino delgado los huevos eclosionan, las oncósferas resultantes penetran en los capilares y migran en su mayor parte al hígado o pulmón en donde se desarrollará la forma larval o quiste hidatídico el cual puede causar seria morbilidad.
La forma larval o metacestode que se desarrolla en el ovino es típicamente unilocular, pleomórfica, llena de fluido y con una compleja estructura consistente en una membrana germinal interna, compuesta por células de núcleo circular u ovalado y una membrana cuticular, acelular y elástica (externa), rodeada por una membrana adventicia y fibrosa producida por el hospedero. El quiste hidatídico es fértil cuando presenta protoescólices y es viable cuando los protoescólices están vivos1,2.
Existen varias fuentes de estimulación antigénica para el hospedero con capacidad de producir anticuerpos: la exposición a la oncósfera infectante, el desarrollo subsiguiente de quistes inmaduros y el desarrollo de quistes fértiles1. Establecido el metacestode con su capa laminar, los antígenos localizados en la membrana germinal, en el líquido hidatídico y en los protoescólices quedan secuestrados dentro del quiste hidatídico cesando la estimulación para el hospedero. La salida de macromoléculas a través de microfisuras de la capa laminar del metacestode maduro constituye la segunda fuente de estimulación para el hospedero2,3.
En el ovino, la respuesta inmune a la infección por E. granulosus ha sido poco estudiada1. Así, el objetivo del presente trabajo es aportar nueva información sobre la respuesta de anticuerpos antiantígeno total y antiantígeno B en ovinos experimentalmente infectados y analizar la respuesta inmune en relación al estado evolutivo de la oncósfera y al desarrollo del metacestode.
Materiales y métodos
Se dosificaron 245 perros de áreas endémicas de la Provincia de Río Negro y 20 de la Provincia de Buenos Aires con el tenífugo bromhidrato de arecolina. La materia fecal eliminada fue depositada en bandeja de fondo oscuro y los especímenes de E. granulosus presentes fueron aspirados y alojados en tubos de ensayo con 5 ml de solución fisiológica adicionada de penicilina. Se conservaron a una temperatura de 8-10 °C a razón de dos especímenes adultos y grávidos por tubo de ensayo (estimado en 1000 huevos de E. granulosus), obtenidos de un solo perro. Se remitieron muestras de los cestodes al Instituto Nacional de Microbiología Carlos Malbrán para determinación de cepas.
Se utilizaron tres dosis diferentes de inóculos: dosis baja (2000 huevos, 4 proglótidos maduros), dosis media (4000 huevos, 8 proglótidos maduros) y dosis alta (20 000 huevos, 40 proglótidos maduros). Los ovinos fueron inoculados por medio de una sonda nasogástrica con lavado posterior con agua en abundancia.
Se seleccionaron dos grupos de animales: a) grupo de inoculación experimental: 23 ovejas de 2 a 4 años de edad y b) grupo control: 15 animales sin inocular.
Los dos grupos de animales fueron clasificados como libres de equinococcosis quística mediante una evaluación serológica 15 días antes de la inoculación. Todos los animales presentaron valores de densidad óptica por debajo del nivel de corte para enzimo inmuno ensayo (EIE) con tres preparaciones antigénicas: líquido hidatídico total (EIE.LHT), fracción purificada de líquido hidatídico total (EIE.S2B) y fracción lipoproteica purificada (EIE.B), acorde a técnicas descriptas4.
Se seleccionaron aleatoriamente los animales a ser inoculados. Ocho (34.8%) de éstos recibieron una carga baja de huevos de E. granulosus, 9 animales (39.1%) una carga media y otros 6 animales (26.1%) una carga alta.
Se efectuaron extracciones de sangre pre-inoculación y luego sucesivamente a los 10, 20, 30, 60, 90, 120, 180, 210, 270, 360 y 500 días posteriores a la inoculación.
El suero se extrajo mediante centrifugación y se conservó refrigerado a 5-8 °C hasta su remisión al laboratorio antes de las 48 h en donde se mantuvieron a -20 °C hasta su procesado mediante EIE con las tres preparaciones antigénicas.
Se seleccionaron aleatoriamente 10 animales a los que se les practicó necropsia a los 60, 120, 240, 300, 360 y 500 días posteriores a la inoculación para observar macroscópicamente el crecimiento del metacestode y, mediante histología, la instalación y crecimiento de la oncósfera y del metacestode hasta su evolución a la fertilidad. Los ovinos se sacrificaron de acuerdo a recomendaciones de manejo ético5.
La estimación de las diferencias estadísticas se efectuó con chi cuadrado de asociación o chi cuadrado de Pearson, (según correspondiera) utilizándose el software EPIDAT 3.0, fijándose en p = 0.05 el límite de significación.
Resultados
En los ovinos inoculados se observó que EIE.LHT alcanzó el valor de corte a los 20 días posteriores a la inoculación, y a partir de los 30 días se mantuvo por encima del valor de corte hasta 500 días después de la inoculación. A los 270 días el valor promedio de la respuesta de anticuerpos se expresó por debajo del nivel de corte (Fig. 1-A).
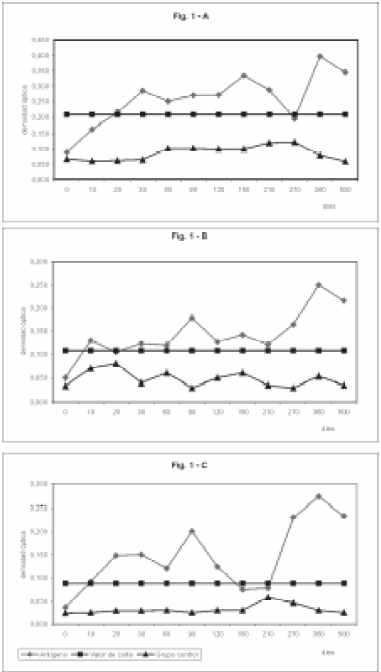
Fig. 1.- Valor medio de la respuesta de anticuerpos en EIE con diferentes preparaciones antigénicas (1-A): líquido hidatídico total (LHT), (1-B): fracción purificada de LHT (S2B) y (1-C): fracción lipoproteica purificada (EIAB) durante 500 días en ovinos experimentalmente infectados con E. granulosus.
La respuesta inmunológica con el EIE.S2B superó el valor de corte a los 10 días posteriores a la inoculación, manteniéndose por encima de dicho valor durante todo el período de observación.(Fig. 1-B).
El EIE.B alcanzó el valor de corte a los 10 días posteriores a la inoculación, presentando mayor variabilidad en la respuesta a lo largo del período de observación, incluyendo un resultado por debajo del valor de corte a los 150 días posteriores a la inoculación (Fig. 1-C).
Dos (8.6%) animales se mantuvieron negativos a todas las pruebas serológicas hasta su sacrificio a los 300 días de su inoculación, mientras que 1 (4.3%) animal inoculado permaneció negativo durante el período de observación sólo a antígeno B. El resto (91.4%) de los animales inoculados presentaron con los EIE.LTH y EIE.S2B al menos una determinación serológica por encima del valor de corte durante el período de observación. La respuesta individual más tardía en los animales seropositivos con EIE.LHT se identificó a los 310 días posteriores a la inoculación y con EIE.S2B a los 360 días.
El grupo control mantuvo siempre con las tres preparaciones antigénicas valores promedio por debajo del valor de corte, resultando las diferencias estadísticamente significativas en relación al grupo inoculado (p: 0.0000) (Fig. 1).
En relación a las dosis aplicadas, las diferencias a lo largo del período de observación resultaron estadísticamente significativas (Chi cuadrado de Pearson p: 0.0000 para EIA.LHT, EIA.S2B y EIA.B). La respuesta resultó proporcional a la carga de huevos inoculada (mayor respuesta a mayor dosis) comparando 20 000 huevos en relación a 2000 y 4000 huevos, no así en la comparación entre 2000 y 4000 huevos en que la respuesta fue proporcionalmente mayor con 2000 huevos y estadísticamente significativa (Chi cuadrado de Pearson p: 0.0000 ) (Fig. 2).

Fig. 2.- Valor medio de la respuesta de anticuerpos en EIE con diferentes preparaciones antigénicas (2-A): líquido hidatídico total (LHT), (2-B): fracción purificada de LHT (S2B) y (2-C): fracción lipoproteica purificada (EIAB) durante 500 días en ovinos experimentalmente infectados con E. granulosus de acuerdo al número de huevos inoculados (2000, 4000 y 20 000 huevos).
En el primer animal necropsiado, a los 60 días posteriores a la inoculación, no se observaron formaciones macroscópicas compatibles con equinococcosis. A los 120 días posteriores a la inoculación se observaron en un animal inoculado con 2000 huevos, en total 15 formaciones visibles macroscópicamente compatibles con equinococcosis (11 en pulmón y 4 en hígado) de 2 a 3 mm de diámetro.
A los 240 días posteriores a la inoculación se observó en un animal inoculado con 2000 huevos la presencia en pulmón e hígado de quistes superficiales e intraparenquimatosos de 2.5 a 3 mm de diámetro, (2 con contenido líquido) mientras en otro inoculado con 20 000 huevos no se observaron formaciones visibles compatibles con hidatidosis.
A los 300 días posteriores a la inoculación de 2000 huevos, se observaron en 2 animales un total de 10 y 66 quistes respectivamente, de 3 mm a 4 cm de diámetro en pulmón e hígado, mientras que en un animal inoculado con 4000 huevos no se observaron formaciones macroscópicas compatibles con equinococcosis.
En los animales necropsiados a los 360 días posteriores a la inoculación se observaron, con 4.000 huevos, quistes de hasta 1.5 cm, con líquido hidatídico, mientras que en otro inoculado con 20 000 huevos se observaron 630 formaciones visibles macrocópicamente compatibles con hidatidosis.
A los 500 días posteriores a la inoculación de 4000 huevos se observaron 184 quistes de hasta 1.3 cm.
En los estudios histológicos, a los 60 días posteriores a la inoculación se observaron en pulmón oncósferas vivas en distinto estado de desarrollo, y algunas muertas, de localización peribronquial, peribronquiolar y perivascular en grandes vasos, mientras que en el hígado se observaron oncósferas vivas en localización centrolobulillar y portal.
A los 120 días se observaron quistes en formación viables, quistes alterados por inflamación, otros viables y uno con vesículas hijas.
A los 240 días se observó en el pulmón una gran zona de necrosis coagulativa y oncósferas peribronquiales vivas. En el hígado se observaron grandes áreas de necrosis coagulativa y oncósferas muertas.
A los 300 días se observó en hígado y pulmón presencia de oncósferas vivas, incluso en animales negativos a la necropsia. Se observaron quistes fértiles en pulmón con formación de protoescólices.
A los 360 días se observaron quistes en hígado y pulmón con membrana prolígera y otros en vías de contaminación (leve infiltración de células inflamatorias que invaden la periferia del quiste, sin ocuparlo totalmente) y oncósferas rodeadas de células de la inflamación. En bazo se observó un quiste fértil con protoescólices vivos en su interior y 2 oncósferas periarteriales.
A los 500 días se observaron quistes con membrana prolígera y oncósferas vivas.
La proporción entre huevos inoculados y quistes formados tuvo un rango de 0-200 huevos por quiste (Tabla 1).
TABLA 1.- Resultados de necropsias y estudios histológicos en ovinos experimentalmente infectados con E. granulosus

quistes fértiles (con protoscolices)
**: presenta membrana prolígera
Todos los E. granulosus enviados al Instituto Nacional de Microbiología Carlos Malbrán resultaron cepa Ovina G1.
Discusión
En el presente trabajo se ha seguido el desarrollo de la oncósfera, su transformación en metacestode y su crecimiento hasta alcanzar capacidad reproductiva, determinada por la identificación de protoescólices mediante necropsias y estudios histológicos efectuados en animales adultos experimentalmente infectados.
La respuesta inmune detectada es consecuente con estudios previos que indican que la oncósfera produce secreciones para facilitar su penetración en el organismo y que estas secreciones, además, protegen al parásito contra las defensas del organismo mientras se desarrolla la membrana laminar6. La respuesta inmune se mantuvo durante los 500 días posteriores a la inoculación.
La respuesta de anticuerpos fue detectada en forma precoz, lo cual confirma experiencias previas, que con EIE detectaron la respuesta de anticuerpos más temprana a las dos semanas posteriores a la infección7, mientras que con doble difusión en gel de agar recién identificaron respuesta de anticuerpos a los 112 y 120 días posteriores a la infección respectivamente8, 9.
En relación a la dosis infectante, estudios previos identificaron una correlación positiva entre sensibilidad del EIE y dosis infectante, especialmente entre animales inoculados con 100 y 1000 huevos de E. granulosus en relación a aquellos inoculados con 10 huevos7. En la presente experiencia esa asociación sólo se identificó con una alta carga de huevos inoculados.
Se observó que la respuesta de anticuerpos a la infección por E. granulosus en el ovino es anterior a la producción de líquido hidatídico y evidencia que la activación, movilidad e instalación en los tejidos de la oncósfera genera respuestas del sistema inmunitario del hospedero.
Así, muchas reacciones serológicas tanto en el ovino como eventualmente en el hombre, podrían ser clasificadas como falsos positivos ante la imposibilidad de localizar un quiste hidatídico en el hospedador, pero pueden resultar verdaderas infecciones por E. granulosus en estado de oncósfera o de fase temprana de desarrollo del metacestode.
La proporción de quistes desarrollada fue directamente proporcional a la dosis de huevos inoculados (hasta 16 quistes con dosis de 2000 huevos, hasta 196 quistes con dosis de 4000 huevos y hasta 630 quistes con dosis de 20000 huevos), resultado que confirma experiencias previas10 que establecieron en animales experimentalmente infectados que la edad no tenía significación para el establecimiento de la infección, aunque sí la dosis y la susceptibilidad individual.
Los quistes se transformaron en fértiles por presencia de protoescólices a los 300/360 días posteriores a la inoculación. En ovinos de Libia se encontraron quistes fértiles recién a los 428/611 días posteriores a la infección11, mientras que en Nueva Zelanda no identificaron fertilidad en quistes hidatídicos ovinos hasta los 2 años posteriores a la infección10.
Estos hallazgos indican que la alimentación de perros con vísceras crudas de animales jóvenes puede generar ciclos de infección con desarrollo de parásitos adultos en el perro, contrariamente a lo supuesto hasta el momento.
La identificación de oncósferas vivas en vísceras a los 300 y 500 días posteriores a la inoculación, y en presencia de quistes hidatídicos formados, es un hallazgo no descrito hasta el presente. Su significado fisiopatológico debería ser cuidadosamente evaluado.
La presencia de oncósferas latentes podría resultar de un freno inmunitario generado por un metacestode desarrollado. Se ha supuesto que esta situación era generada en condiciones naturales por la inmunidad adquirida con posterioridad a la primer ingestión de huevos, inhibiendo el desarrollo de oncósferas resultantes de subsiguientes infecciones en un medio natural con oferta permanente y elevada de huevos. Los hallazgos de la presente experiencia indican que esta inmunidad o modulación inmune limitante del crecimiento de oncósferas puede ser generada a partir de una sola infección10, 12, 13.
Estos aspectos resultan relevantes para una mejor comprensión de las respuestas al tratamiento en el hombre. En casos humanos tratados quirúrgicamente se han señalado tasas de reoperación del 2% al 25% en programas de seguimiento longitudinal, atribuibles a una no completa extirpación del quiste o a la presencia de quistes no detectables previamente o a reinfecciones. En general, estas teorías no explican acabadamente el fenómeno de las reoperaciones, en tanto que en la actualidad las técnicas quirúrgicas están sumamente desarrolladas al igual que los métodos sensibles de diagnóstico por imágenes.
De acuerdo a lo observado en el presente trabajo, esta situación podría ser explicada por el crecimiento de oncósferas latentes al desaparecer por la extirpación del quiste los procesos de modulación de la respuesta inmune generados por el metacestode.
Se ha observado en programas de seguimiento longitudinal que portadores de quistes hidatídicos tratados con albendazol no desarrollaron nuevos quistes hidatídicos. Esta situación podría ser generada por el sostenimiento de la modulación inmune dado por la permanencia de un quiste hidatídico muerto por efecto de la droga14 o directamente por la acción parasiticida del albendazol sobre las oncósferas.
Así, la identificación de oncósferas vivas en tejido hepático a los 500 días posteriores a la inoculación permite explicar razonablemente las respuestas observadas en estudios longitudinales en el hombre como consecuencia de los distintos tratamientos aplicados.
1. Lightowlers MH, Gottstein B. Echinococcosis/Hydatidosis: antigens, immunological and molecular diagnosis. The biology of Echinococcus granulosus and hydatid disease (Thompson R, Lymbery J.) London: George Allen and Unwin, 1995, p 355-96. [ Links ]
2. Craig PS. Immunodiagnosis of Echinococcus granulosus and a comparison of techniques for diagnoses of canine echinococcosis. In: Compendium on echinococcosis in Africa and in a Middle Eastern Countries (Andersen F, Ouhelli H, Kachani M.) Utah: Brigham Young University Print Services, 1997, p 86-118. [ Links ]
3. Siracusano A, Ortona E, Rigano R. Molecular and cellular tools in human echinococcosis. C Drug Targ 2002; 2: 235-45. [ Links ]
4. Gatti A, Alvarez R, Santillan G, et al. Ovine echinococcosis I. Immunological diagnosis by enzyme immunoassay. Vet Parasitol 2007; 143: 112-21. [ Links ]
5. Blocks G. Concerned about study on euthanasia. J A Vet Med As 1993; 203: 664-6. [ Links ]
6. Holcman B, Heath DD. The early stages of Echinococcus granulosus development. Acta Tropica 1997; 64: 5-17. [ Links ]
7. Yong WK, Heath DD, Van Knapen F. Comparison of cestode antigens in an enzyme-linked immunosorbent assay for the diagnosis of Echinococcus granulosus, Taenia hydatigena and Taenia ovis infections in sheep. Res Vet Sci 1984; 36: 24-31. [ Links ]
8. Yong WK, Heath DD. Arc 5 antibodies in sera of sheep infected with Echinococcus granulosus, Taenia hyda-tigena and Taenia ovis. Parasite Immunol 1979; 1: 27-38. [ Links ]
9. Conder GA, Andersen FL, Schantz PM. Immunodiagnostic tests for hydatidosis in sheep: an evaluation of double diffusion, immunoeletrophoresis, indirect hemagglutination, and intradermal tests. Parasitology 1980; 66: 577-84. [ Links ]
10. Gemmel M, Lawson R, Robertson M. Population dynamics in echinococcosis and cysticercosis: biological parameters of Echinococcus granulosus in dogs and sheep. Parasitology 1986; 92: 599-620. [ Links ]
11. Gusbi A, Awan A. Experimental infection of Libyan sheep with Echinococcus granulosus. Ann Trop Med Parasitol 1991; 4: 433-7. [ Links ]
12. Heath DD. Immnunology of Echinococcus infections. In The biology of Echinococcus granulosus and hydatid disease (Thompson R, Lymbery J.). London: George Allen and Unwin, 1995, p 183-94. [ Links ]
13. Torgerson PR, Heath DD. Transmission dynamics and control options for Echinococcus granulosus. Parasitology 2003; 127: 143-58. [ Links ]
14. Larrieu E, Del Carpio M, Salvitti J, et al. Ultrasonographic diagnosis and medical treatment of human cystic echinococcosis in asymptomatic school age carriers: 5 years of follow-up. Acta Tropica 2004; 91: 5-13. [ Links ]
Recibido: 31-1-2008
Aceptado: 24-2-2009














