Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Medicina (Buenos Aires)
Print version ISSN 0025-7680On-line version ISSN 1669-9106
Medicina (B. Aires) vol.69 no.4 Ciudad Autónoma de Buenos Aires Sept./Oct. 2009
ARTÍCULO ORIGINAL
Transmisión vectorial y congénita del Trypanosoma cruzi en Las Lomitas, Formosa
Sergio Sosa-Estani1-3, Lucía Dri4, Cecilia Touris1, Sergio Abalde4, Ana Dell'Arciprete1, José Braunstein3
1Centro Nacional de Diagnóstico e Investigación de Endemo-epidemias (CeNDIE) / Administración Nacional de Laboratorios e Institutos de Salud (ANLIS) Dr. Carlos G. Malbrán,
2Instituto de Efectividad Clínica y Sanitaria,
3Consejo Nacional de Investigaciones Científicas y Técnicas (CONICET), Buenos Aires,
4Atención Primaria de la Salud, Hospital Las Lomitas, Formosa
Dirección postal: Dr. Sergio Sosa-Estani, CeNDIE/ANLIS, Av. Paseo Colón 568, 1063 Buenos Aires, Argentina Fax: (54-11) 4331 2536 e-mail: ssosa@msal.gov.ar
Resumen
La enfermedad de Chagas causada por el Trypanosoma cruzi es una causa importante de morbimortalidad en Latino América. El objetivo de este estudio fue describir las tasas de infestación en las viviendas de cuatro comunidades aborígenes de Las Lomitas (Región del Gran Chaco), Formosa, Argentina; la tasa de infección en la población infantil residente en las mismas, en donantes de sangre y en mujeres embarazadas que asistieron al Hospital de Las Lomitas y la tasa de infección congénita de niños nacidos de mujeres infectadas durante el período de estudio. La tasa de infestación en 172 viviendas evaluadas en 2006 alcanzó el 32%. La prevalencia de infección en 445 personas fue de 17.5% y en menores de 5 años de edad fue 8.6%. La tasa de infección en donantes de sangre alcanzó a 18.6% y en mujeres embarazadas fue 29.1%. La tasa de infección considerada congénita en 47 niños nacidos de mujeres infectadas residentes en viviendas bajo vigilancia fue de 17.0%. El estudio mostró, al momento de su inicio, índices compatibles con transmisión vectorial activa. Después del control vectorial con insecticidas, la tasa de infestación se redujo a 3.3%. El sistema de salud local incorporó procedimientos de prevención primaria y secundaria para evitar nuevos casos e instaurar el tratamiento de la población infectada.
Palabras clave: Trypanosoma cruzi; Enfermedad de Chagas; Transmisión congénita; Triatomino; Argentina
Abstract
Vectorial and congenital transmission of Trypanosoma cruzi in Las Lomitas, Formosa. Chagas disease, caused by Trypanosoma cruzi, is a major cause of morbidity and mortality in Latin America. The objective of this study was to describe the rate of infestation in four aboriginal communities in Las Lomitas (Great Chaco Region), Formosa, Argentina; the rate of infection in children residing in these communities, in blood donors and in pregnant women who received care at the Hospital Las Lomitas, as well as the rate of congenital infection in children born to women infected during the study period. The rate of infestation of 172 households evaluated in 2006 reached 32%. Prevalence of infection among 445 people was 17.5% and in children under 5 years old it was 8.6%. The rate of infection reached 18.6% in blood donors and 29.1% in pregnant women. The rate of infection among 47 children born to infected women, and living in residences under vectorial surveillance was 17.0%. These infections were considered as congenital. This study showed indexes compatible with active vectorial transmission at the beginning. After vectorial control with insecticides the infestation rate has been reduced to 3.3%. The local health system has introduced high impact procedures of primary and secondary prevention in order to prevent new cases and to treat infected people.
Key words: Trypanosoma cruzi; Chagas disease; Congenital transmission; Triatomine; Argentina
La enfermedad de Chagas, o tripanosomiasis americana, es causada por el parásito protozoario Trypanosoma cruzi. Esta es una causa importante de morbimortalidad en Latino América. La infección es transmitida principalmente por vectores pero también por transfusión de sangre infectada, o por transmisión congénita de una madre infectada a su feto. Otras formas menos frecuentes son por transplantes de órganos o por ingesta de alimentos contaminados1. El Programa Nacional de Chagas (PNCh) en la Argentina, a través de sus acciones normalizadas, ha logrado un alto impacto en el control de la transmisión vectorial y transfusional2 y, aunque aún con bajas tasas de detección, está consolidando el control de la transmisión congénita3-5. Asimismo, existen aún áreas con transmisión vectorial activa debido a la discontinuidad de las acciones de vigilancia que mantienen las poblaciones de triatominos ausentes de las viviendas2,6.
En la Argentina existen en la actualidad 10 etnias aborígenes mayoritarias, de las cuales el 90% se encuentran en áreas de transmisión vectorial7.
Entre los años 2006 y 2007 nuestro grupo de trabajo realizó un estudio antropológico-etnográfico para identificar las diferentes concepciones culturales relativas a la enfermedad de Chagas en la comunidad y de la atención de la población en el servicio de salud. Como parte del estudio se realizó un diagnóstico de situación de la transmisión del T. cruzi en la zona de estudio. El objetivo de este trabajo fue describir las tasas de infestación en las viviendas de las 4 localidades del estudio, la infección en la población infantil residente en las mismas, la tasa de infección en donantes de sangre y en mujeres embarazadas que asistieron al Hospital de las Lomitas y la tasa de infección congénita de niños nacidos de mujeres infectadas durante el período de estudio.
Materiales y métodos
Se realizó un estudio descriptivo para el diagnóstico poblacional que sirvió de base para el estudio antropológico-etnográfico en el Municipio de Las Lomitas (24º 42' LS 60º 35' LO), Departamento Patiño, Provincia de Formosa. En esta área se aplica la estrategia de Atención Primaria de la Salud (APS) desde 1983 y cuenta con un Hospital de complejidad IV. El área programática de Las Lomitas es extensa, cubriendo una población de 27 247 habitantes en 17 696 km2. Cuenta con 32 Centros de Salud (18 periurbanos y 14 rurales). Este trabajo se realizó en la comunidad donde se llevó a cabo el estudio etnográfico, y en el Hospital de Las Lomitas.
Para el estudio en la comunidad donde se efectuó el estudio etnográfico se seleccionaron 4 localidades del Municipio. Estas corresponden a 2 etnias, la etnia Pilagá en La Bomba, periubana, y Km 14, rural; y la etnia Wichi en Lote 47, periurbana, y Lote 42, rural. En las mismas se estudió al universo de las viviendas para describir la tasa de infestación con triatominos en las viviendas, y detectar la infección con T. cruzi en la población residente en las mismas. La población de estudio para identificar infección fue la menor de 15 años de edad y la de adultos que requirieran el estudio, según establece el PNCh. El muestreo serológico se hizo, por conveniencia, en la población que acudía a los talleres de vigilancia y en visitas programadas a las escuelas.
En el Hospital se analizaron los datos del universo de la población de donantes de sangre, de mujeres embarazadas que consultaron en él, y de los hijos de estas últimas, para la detección de infección congénita. Para describir la tasa de infección en mujeres embarazadas y de transmisión congénita se analizaron los antecedentes de infección de embarazadas y partos ocurridos entre el 1/7/2005 y el 30/6/2006. Este período de estudio permitió completar el seguimiento de los recién nacidos para el diagnóstico definitivo de la infección congénita.
Para la evaluación entomológica en las 4 comunidades se aplicaron los procedimientos de vigilancia establecidos a través del Sistema de APS. La vigilancia es realizada por los agentes sanitarios asignados por el Sistema en cada localidad y en sus visitas trimestrales, o por denuncias de los pobladores que registran la infestación de la vivienda por triatominos, la que se corrobora por la muestra del insecto capturado8, 9. Se analizaron las tasas de infestación detectadas por la presencia de triatominos al momento del rociado de ataque (rociado con insecticidas piretroides al total de las viviendas existentes en la localidad), realizado durante el proyecto antropológico-etnográfico, y posteriormente la infestación detectada luego del rociado selectivo de las viviendas con reinfestación o infestación residual detectadas durante el proceso de vigilancia entomológica.
Para el diagnóstico de infección en la población residente en las 4 localidades seleccionadas se tomaron muestras de sangre utilizando el procedimiento normalizado por el PNCh10. Se tomaron muestras de sangre capilar utilizando equipos para su conservación en glicerina tamponada (SEROKIT®, Polychaco S.A.I.C.). Se realizaron las reacciones serológicas de hemaglutinación indirecta (HAI, Instituto Fatala Chaben) e enzimoinmunoensayo (ELISA Chagatest®, Laboratorio Wiener). La prueba de HAI se consideró reactiva cuando se observó reactividad a diluciones =1/16. El ELISA se clasificó con resultado cualitativo Reactivo o No reactivo. Se consideraron infectadas las personas con 2 pruebas reactivas. Los niños con infección confirmada recibieron el tratamiento etiológico según establecen las normas vigentes10. En el Hospital se tomaron muestras de sangre venosa a todos los donantes de sangre voluntarios con edades entre 18 y 54 años, y a toda mujer embarazada, en los controles prenatales. En ambas poblaciones se realizaron pruebas serológicas con las técnicas de HAI titulada y ELISA por método cualitativo. Se consideraron infectados a los donantes o mujeres embarazadas que presentaban las 2 pruebas reactivas. La detección de infección congénita de los hijos de mujeres infectadas con T. cruzi se realizó a través de dos controles durante el primer año de vida, con una prueba parasitológica directa (micro hematocrito) a todo recién nacido o durante el primer trimestre, y 2 pruebas serológicas simultáneas luego del 8º mes de vida10,11. Todas las pruebas serológicas se realizaron con control da calidad12. En el análisis de los datos las prevalencias de infestación de las viviendas e infección en la población de estudio se informaron con un intervalo de confianza del 95%. Para la comparación de proporciones se utilizó la prueba Chi cuadrado con un nivel de significancia a =0.05 o la prueba de Fisher. Para la comparación de variables continuas se utilizó ANOVA o Kruskal-Wallis. Se utilizó para el análisis de los datos el Programa Epi Info para Windows (CDC, versión 3.2.2). Este estudio se llevó a cabo de acuerdo con las normas establecidas en la Declaración de Helsinski. Se solicitó autorización de los tutores y su consentimiento oral informado para la toma de muestra de sangre de los niños. Unicamente se realizaron intervenciones normalizadas por el Sistema de Salud. El presente protocolo fue aprobado por el Comité de Etica independiente del Hospital Dr. F.J. Muñiz, Buenos Aires, Argentina.
Resultados
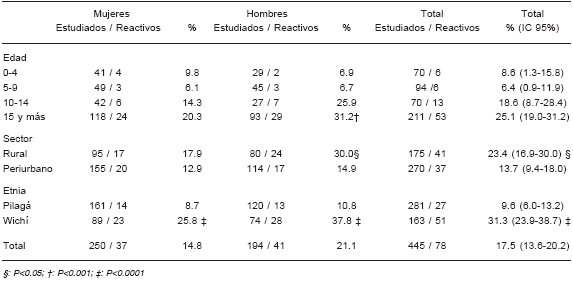
El estudio en la comunidad, sobre la totalidad de la población de las 4 localidades seleccionadas, alcanzó a 805 personas integrando 163 familias (Tabla 1). La distribución por edad y sexo en el área de estudio presentó una pirámide de población clásica de poblaciones con altas tasas de natalidad y baja expectativa de vida, con base ancha y vértices estrechos (datos no mostrados). Las tasas de infestación de las viviendas, que corresponden al resultado de detección de triatominos luego del rociado con piretroides en el total de las mismas, alcanzó el 32%, con variación según las localidades de estudio entre 19.4% y 53.8% (Tabla 2). Accedieron voluntariamente 445 personas para realizar toma de muestras para estudios serológicos. La cobertura de tamizaje serológico en niños menores de 15 años de edad fue de 63.3% (238/376) y la cobertura de confirmación con 2 pruebas realizadas y leídas fue 98.3% (234/238). La prevalencia de infección en el total de la población estudiada en la comunidad fue del 17.5%. La prevalencia de infección en la población menor de 5 años de edad fue 8.6 % (6/70) (Tabla 3). Las poblaciones pertenecientes a las 2 comunidades Wichí presentaron mayores tasa de infección que la población de las comunidades Pilagá (p < 0.0001), tanto en hombres como en mujeres (Tabla 3). La prevalencia de infección según lugar de residencia fue mayor en áreas rurales (Tabla 3). Estas prevalencias fueron superiores en la comunidad Wichí según residieran en área rural (31.8%) o periurbana (30.7%), cuando se comparó con la comunidad Pilagá residentes en el área rural (14.9%) o periurbana (7.2%).
TABLA 1.- Localización y distribución de la población de las localidades La Bomba, Km 14, Lote 47 y Lote 42, Las Lomitas, Departamento Patiño, Formosa, Argentina, 2005

TABLA 2.- Tasa de infestación con triatominos de las viviendas de las localidades La Bomba, Km 14, Lote 47 y Lote 42, Las Lomitas, Departamento Patiño, Formosa, Argentina, 2006

IC 95%: Intervalo de confianza 95%
1Familia registrada en el Sistema de Atención Primaria de la Salud (actualizado anualmente)
2Viviendas (viv.) rociadas, cuando se aplica insecticidas piretroides según metodología establecida por el Programa Nacional de Chagas. Rociado en Fase de Ataque, cuando se rocian el total de las viviendas de una comunidad. Rociado en Fase de Vigilancia, cuando el rociado es selectivo en las viviendas reinfestadas o con infestación residual durante la vigilancia entomológica2.
3Viviendas (viv.) con registro de evaluación entomológica continua luego del rociado en fase de ataque
4En diciembre de 2007 se rociaron 32 viviendas en ataque y 6 resultaron positivas (18.8%, IC 95%: 7.2-36.4)
5 La diferencia entre familias censadas y viviendas rociadas responde a una conformación social de la familia que puede habitar más de una unidad domiciliaria aglomerada.
TABLA 3.- Prevalencia de infección con Trypanosoma cruzi en 445 personas residentes en comunidades aborígenes pilagás y wichi, Las Lomitas, Departamento Patiño, Formosa, Argentina, 2006
El tamizaje de donantes de sangre en el Hospital mostró una tasa de prevalencia de infección del 18.6% (70 / 377). La prevalencia de infección en mujeres embarazadas fue 29.1% (79 / 271). Para estimar la tasa de transmisión congénita se analizaron 108 partos ocurridos durante el período de observación descrito en Materiales y Métodos. De estos se excluyeron del análisis 6 eventos (2 abortos, 1 mortinato y 3 fallecidos con otro diagnóstico diferente a enfermedad de Chagas, en el primer semestre). Entre los restantes, 102 derivaron en el seguimiento de sus hijos. La edad de las madres fue 24.1 ± 7.0 años (rango 13-43, mediana 22, moda 21).
El 40.2% (41/102) residía en comunidades aborígenes. La edad en las mujeres fue diferente estadísticamente, según residieran en comunidades criollas (25.5±7.4), aborígenes pilagá (23.3±5.8) y aborígenes wichi (21.7±5.5) (p=0.03). La tasa de ocurrencia de abortos y mortinatos previos fue de 9.8% para ambos parámetros por separado. La tasa de cobertura de control de Chagas congénito alcanzó al 72.6%. La oportunidad de intención de diagnóstico al momento del nacimiento expresada en el tiempo transcurrido entre el nacimiento y el estudio parasitológico tuvo una mediana de 2 días; para los estudios serológicos en el segundo semestre fue de 13.2 ± 2.1 meses. La tasa de infección congénita estimada en 47 nacimientos de mujeres infectadas cuyos hijos habían completado el seguimiento según protocolo, 8 meses o más de vida hasta el final de la observación, fue estimada en 17.0% (8/47) (Tabla 4). Cinco entre los 8 (62.5%) niños infectados congénitamente fueron diagnosticados por estudios parasitológicos, antes del alta o pocos días después de la misma y los restantes por estudios serológicos después del 8º mes de vida. No se observó diferencia en las tasas de infección en los recién nacidos según sexo, edad de la madre (Tabla 4), o antecedentes de la madre en relación a abortos o mortinatos previos. La tasa de infección de los niños nacidos de madres aborígenes fue del 21.1% (4/19), y de los niños nacidos de madres de origen criollo fue de 14.3% (4/28) (prueba de Fisher, p>0.05).
TABLA 4.- Distribución de la tasa de transmisión congénita de Trypanosoma cruzi en hijos de mujeres infectadas nacidos en Las Lomitas, Departamento Patiño, Formosa, Argentina, 2005-20061

1 Cinco (62.5%) de los 8 hijos nacidos de madres infectadas con T. cruzi fueron diagnosticados con infección por método directo (microhematocrito) al momento del nacimiento.
Los registros de las evaluaciones entomológicas en las viviendas de residencia y/o de visitas frecuentes de los 8 niños con diagnóstico de infección congénita, indican que 4 de ellas presentaron antecedentes de infestación con triatominos y rociado inmediato previos al nacimiento. En dos casos este antecedente ocurrió después del nacimiento con rociado de las viviendas antes de los 30 días; y dos viviendas no tuvieron antecedentes de infestación (Tabla 5). Aunque asumimos estos casos como infección congénita definimos como tasa confirmada al 13.3% (6/45) donde el numerador comprende a los niños con diagnóstico parasitológico al nacer o serológico después del 8° mes de edad, no expuestos a triatominos en su domicilio o residencias de visitas, y adicionalmente una tasa probable de 4.9% (2/41) donde el numerador comprende a los niños expuestos a triatominos en su domicilio luego del nacimiento. Fueron excluidos en esta estimación aquellos niños infectados no expuestos a triatominos (n=4). Las tasas definidas como confirmadas o probables asumen que la exposición vectorial entre los niños no infectados tuvo una distribución aleatoria. La tasa total de niños con infección, considerando los casos confirmados y probables de transmisión congénita, alcanzó 17.7% (8/45).
TABLA 5.- Forma de diagnóstico, esquema de tratamiento, seguimiento y antecedentes de exposición vectorial en 8 niños con infección congénita con Trypanosoma cruzi, Las Lomitas, Departamento Patiño, Formosa, Argentina, 2005-2006

†Hermanos mellizos, que fallecen (6 y 9 meses post-parto) por causas externas a la enfermedad de Chagas.
‡Rociados en fase de ataque. Rociado en fase de ataque: cuando se rocían el total de las viviendas de una comunidad.
Dos de los 8 casos presentaron sintomatología, correspondiendo a un parto gemelar nacidos por cesárea. El primer recién nacido con 2.720 kg., de 37 semanas y Apgar 9/9, presentó gastroenteritis a las 48 horas, con deshidratación y sepsis. El segundo recién nacido con bolsa embrionaria separada, con 2.110 kg, de 37 semanas y Apgar 9/9, presentó escaso líquido meconial claro en estómago que fue aspirado, y distrés respiratorio leve. Luego de haber recibido tratamiento y el alta en relación a la infección con T.cruzi, ambos fueron internados 4 meses después por un cuadro de gastroenteritis con deshidratación grave, falleciendo uno de ellos en esta internación. El otro hermano volvió a ser internado 5 meses después por un cuadro de neumonía y falleció. El área de servicio social confirmó un diagnóstico de condiciones de vida de indigencia. No se observaron signos ni síntomas clínicos compatibles con enfermedad de Chagas en los restantes niños con infección confirmada. El 100% de los casos recibieron el tratamiento etiológico con buena respuesta, presentando todos ellos microhematocrito negativo con posterioridad al tratamiento. El seguimiento serológico está en curso actualmente.
Discusión
Los resultados obtenidos indican que el área es altamente endémica para la transmisión del T. cruzi y con alto riesgo para las diferentes formas de transmisión de importancia en salud pública. La alta tasa de infestación con triatominos en las viviendas y las tasas de infección en la población menor de 5 años de edad, indican que en el área ocurría transmisión activa del T. cruzi al momento del inicio del estudio. Como limitaciones de este estudio podemos mencionar al procedimiento para estimar la tasa de infestación, debido a que la evaluación entomológica a través de la comunidad y agentes sanitarios puede ser menos reproducible que el método de referencia (evaluación hora/hombre), aunque más sensible8. La población analizada por serología participó a través de un muestreo por conveniencia, asimismo ésta alcanzó una cobertura superior al 60% en la población de interés. Para la estimación de la tasa de infección congénita se tuvo que diferenciar tasas definidas como confirmadas y probables en función de los antecedentes de exposición a vectores en las residencias.
El índice de infestación en las 4 localidades del estudio en Las Lomitas (32%) fue notablemente superior al promedio nacional que alcanzó el 2% para el mismo período. Además, las condiciones eco-ambientales fueron propicias para una alta tasa de reinfestación13. La ocurrencia de la transmisión vectorial activa expresada por las altas prevalencias de infección en la población menor de 5 años de edad fue también descrita por otros autores en otras áreas de la región del Chaco argentino 14-17. Asimismo, también ha sido descrito el impacto en la interrupción de la transmisión vectorial cuando las acciones de control son aplicadas apropiadamente18. En las 4 localidades la disminución de la tasa de infestación muestra el impacto de las acciones de control realizadas por el sistema de APS. La mayor tasa de infestación e infección en la población wichi que en la pilagá, y la ausencia de estas diferencias según lugar de residencia rural o urbana, sugiere que las características culturales más que las geográficas son determinantes que favorecen la infestación, y consecuentemente, la transmisión de la infección en el área de estudio. Las elevadas tasas de prevalencia de infección en donantes de sangre y en mujeres embarazadas demuestran también una intensa transmisión en el pasado. La prevalencia de infección en donantes de sangre a transfundir fue 5 veces superior al promedio del país (3.1%), y casi 2 veces mayor que el promedio de la provincia de Formosa (9.0%)5. Este alto índice dificulta la posibilidad de contar con sangre para transfusiones19,20. La alta tasa de infección en mujeres embarazadas, superior al promedio nacional (4.3%) y al promedio provincial (8.8%) obliga a tener un sistema intensivo para la detección de casos de recién nacidos con infección congénita. La transmisión congénita también ha mostrado una tasa de ocurrencia por encima de los promedios del país (3.6%) con rangos en los últimos 5 años de 0.7% a 11.0%. La tasa de detección de parasitemia por método directo fue más alta comparada con las observadas en otros estudios de la Argentina en áreas bajo control vectorial21-24. Posibles hipótesis para explicar esta elevada tasa de infección congénita cuando se comparan con otras observaciones son: I) el uso del método más sensible, que consiste el seguimiento por más de 8 meses de vida de los niños nacidos de madres infectadas10,11; II) transmisión vectorial activa reciente con la consecuente elevada parasitemia en las madres, que puede significar mayor riesgo de transmisión25; III) respuesta inmunológica específica con expresión de inmunidad poblacional26,27 que en las etnias estudiadas signifiquen un mayor riesgo para la transmisión transplacentaria del T. cruzi; IV) características genéticas de expresión prevalente en las mujeres de las etnias estudiadas favorecidas por el agrupamiento poblacional28. Se demostró la buena oportunidad para aplicar los métodos recomendados (parasitológicos o serológicos)10,11, lo que posibilita el diagnóstico y tratamiento oportunos. Asimismo, sería recomendable insistir en el diagnóstico parasitológico al nacimiento y disminuir el lapso para la realización del diagnóstico serológico a 10 meses de vida, tal como se recomienda en la actualidad, con el fin de mejorar el cumplimiento en el seguimiento y control para el diagnóstico final. Se observó una buena respuesta terapéutica al tratamiento etiológico de los recién nacidos infectados, con negativización parasitológica y serológica acorde a los tiempos de seguimiento. Estas estrategias de control y vigilancia, como de atención médica, deben contemplar particularidades en comunidades donde las pautas culturales no permiten una aplicación de meto-dologías estándar, las cuales deben ser particularmente adaptadas.
Agradecimientos: Directores del Hospital de Las Lomitas: Dr. Luis Robles y Dra. Laura Filipini, Profesionales y técnicos del Hospital: Dra. Liliana Viola, Dra. Ana Maria Pechiutta, Dra. Elena Pérez, Supervisores de Atención Primaria de la Salud Sras. Claudia Aranda y Margarita Salas, Téc. Marisa Cerqueti, Téc. Reina Ruiz. Personal del INP Dr. Mario Fatala Chaben y CeNDIE: Téc.Nilda Alonso, Sr. José Ojea. Servicio Nacional de Chagas: Dra. Cynthia Spillmann. Autoridades y Personal del Ministerio de Salud de la Provincia de Formosa.
Financiamiento: Este estudio recibió apoyo financiero parcialmente del Programa Especial PNUD/ Banco Mundial/OMS de Investigaciones y Enseñanzas sobre Enfermedades Tropicales (TDR); Becas Ramón Carrillo-Arturo Oñativia 2006, Comisión Nacional Salud Investiga, Ministerio de Salud de Argentina, ANLIS Dr. Carlos G. Malbrán.
Conflictos de interés: Los autores declaran no tener ningún conflicto de interés.
1. World Health Organization. Report of the Expert Committee on the control of Chagas disease. Geneva: World Health Organization; 2002. 115 p. (vol. Technical Report Series 905). [ Links ]
2. Zidemberg M, Spillmann C, Carrizo Páez R. Control de Chagas en la Argentina. Su evolución. Rev Arg de Cardiol 2004; 72: 375-80. [ Links ]
3. Gurtler RE, Segura EL, Cohen JE. Congenital transmission of Trypanosoma cruzi infection in Argentina. Emerg Infect Dis 2003; 9: 29-32. [ Links ]
4. Sosa-Estani S. Congenital transmission of Trypanosoma cruzi infection in Argentina. Rev Soc Bras Med Trop 2005; 38 (Suppl 2): 29-32. [ Links ]
5. Ministerio de Salud de Argentina, Programa Federal de Chagas. Situación de la enfermedad de Chagas y su Control en Argentina. En: http://www.msal.gov.ar/chagas/home.htm; consultado el 15/07/2008. [ Links ]
6. Gurtler RE, Diotaiuti L, Kitron U. Commentary: Chagas disease: 100 years since discovery and lessons for the future. Int J Epidemiol 2008; 37: 698-701. [ Links ]
7. Anónimo - Enciclopedia Wikipedia. Indígenas de Argentina. En: http://es.wikipedia.org/wiki/Ind%C3%ADgenas_de_Argentina; consultado el 01/07/2008. [ Links ]
8. Chuit R, Paulone I, Wisnivesky-Colli C, et al. Result of a first step toward community-based surveillance of transmission of Chagas' disease with appropriate technology in rural areas. Am J Trop Med Hyg 1992; 46: 444-50. [ Links ]
9. Segura EL, Sosa Estani S, Esquivel ML, Gomez A, Salomon OD. Control of the transmission of Trypanosoma cruzi in Argentina 1999. Medicina (Buenos Aires) 1999;59 (Suppl 2): 91-6. [ Links ]
10. Ministerio de Salud R. Argentina. Guías para la Atención al Paciente Infectado con Trypanosoma cruzi (Enfermedad de Chagas). En: http://www.msal.gov.ar/chagas/home.htm; consultado el.15/07/2008. [ Links ]
11. Carlier Y, Torrico F. Congenital infection with Trypanosoma cruzi: from mechanisms of transmission to strategies for diagnosis and control. Conclusions of round tables and synopsis of an International Colloquium. Cochabamba, Bolivia, 6-8 November 2002. En: http://www.scielo.br/pdf/rsbmt/v36n6/a24v36n6.pdf; consultado el 12/07/2008. [ Links ]
12. Cura EN, Segura EL. Quality assurance of the serologic diagnosis of Chagas' disease. Rev Panam Salud Pública 1998; 3: 242-8. [ Links ]
13. Dohna HZ, Cecere MC, Gurtler RE, Kitron U, Cohen JE. Re-establishment of local populations of vectors of Chagas disease after insecticide spraying. J Appl Ecol 2007; 44: 220-7. [ Links ]
14. Chuit R, Subias E, Perez AC, Paulone I, Wisnivesky-Colli C, Segura EL. Usefulness of serology for the evaluation of Trypanosoma cruzi transmission in endemic areas of Chagas' disease. Rev Soc Bras Med Trop 1989; 22: 119-24. [ Links ]
15. Basombrio MA, Segovia A, Peralta Ramos M, et al. Endemic Trypanosoma cruzi infection in indian populations of the Gran Chaco territory of South America: Performance of diagnostic assays and epidemiological features. Ann Trop Med Parasitol 1999; 93: 41-8. [ Links ]
16. Biancardi MA, Conca Moreno M, Torres N, Pepe C, Altcheh J, Freilij H. Seroprevalence of Chagas disease in 17 rural communities of "monte impenetrable", Chaco province. Medicina (Buenos Aires) 2003; 63:125-9. [ Links ]
17. Diosque P, Padilla AM, Cimino RO, et al. Chagas disease in rural areas of Chaco province, Argentina: Epidemiologic survey in humans, reservoirs, and vectors. Am J Trop Med Hyg 2004; 7: 590-3. [ Links ]
18. Moncayo A. Chagas disease: Current epidemiological trends after the interruption of vectorial and transfusional transmission in the southern cone countries. Mem Inst Oswaldo Cruz 2003; 98: 577-91. [ Links ]
19. Soares S, Moraes-Souza H, Tostes MA, Lourenco DM. Effects of two trypanosomicide drugs, gention violet and WR6026, on platelet concentrates preservation. Rev Soc Bras Med Trop 2004; 37: 248-51. [ Links ]
20. Moraes-Souza H, Pianetti GM, Barretto OC, Nonoyama K, Grolg M, Chiari E. Aminoquinolone WR6026 as a feasible substitute for gentian violet in Chagas' disease prophylaxis in preserved blood for transfusional purposes. Rev Soc Bras Med Trop 2002; 35: 563-9. [ Links ]
21. Zaidenberg M, Segovia A. Congenital Chagas disease in the city of Salta, Argentina. Rev Inst Med Trop Sao Paulo 1993; 35: 35-43. [ Links ]
22. Blanco SB, Segura EL, Cura EN, et al. Congenital transmission of Trypanosoma cruzi: An operational outline for detecting and treating infected infants in northwestern Argentina. Trop Med Int Health 2000; 5: 293-301. [ Links ]
23. Streiger M, Fabbro D, del Barco M, Beltramino R, Bovero N. Congenital Chagas disease in the city of Santa Fe. Diagnosis and treatment. Medicina (Buenos Aires) 1995; 55: 125-32. [ Links ]
24. Mora MC, Sanchez Negrette O, Marco D, et al. Early diagnosis of congenital Trypanosoma cruzi infection using PCR, hemoculture, and capillary concentration, as compared with delayed serology. J Parasitol 2005; 91: 1468-73. [ Links ]
25. Hermann E, Truyens C, Alonso-Vega C, et al. Congenital transmission of Trypanosoma cruzi is associated with maternal enhanced parasitemia and decreased production of interferon-gamma in response to parasite antigens. J Infect Dis 2004; 189: 1274-81. [ Links ]
26. Alonso-Vega C, Hermann E, Truyens C, et al. Immunological status of mothers infected with Trypanosoma cruzi. Rev Soc Bras Med Trop 2005;38 (Suppl 2):101-4. [ Links ]
27. Truyens C, Hermann E, Alonso-Vega C, et al. Immune responses of non-infected neonates of mothers infected with Trypanosoma cruzi. Rev Soc Bras Med Trop 2005; 38 (Suppl 2): 96-100. [ Links ]
28. Sanchez Negrette O, Mora MC, Basombrio MA. High prevalence of congenital Trypanosoma cruzi infection and family clustering in Salta, Argentina. Pediatrics 2005; 115: e668-72. [ Links ]
Recibido: 10-3-2008
Aceptado: 10-3-2009














