Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Medicina (Buenos Aires)
versión impresa ISSN 0025-7680versión On-line ISSN 1669-9106
Medicina (B. Aires) v.69 n.4 Ciudad Autónoma de Buenos Aires sep./oct. 2009
CASUÍSTICA
Ausencia del receptor CD16b en neutrófilos
Norma E. Riera1, Marisa Rosso Saltó2, Katia Canalejo1, Marta E. Felippo1, Guillermo Arrossagaray1, Mónica Aixala1, María M. de E. de Bracco1
1Instituto de Investigaciones Hematológicas, Academia Nacional de Medicina, Buenos Aires,
2Asociación Española Primera de Socorros Mutuos Montevideo, Uruguay
Dirección postal: Dra Norma E. Riera, Citometría de Flujo, IIHEMA, Academia Nacional de Medicina, Pacheco de Melo 3081, 1425 Buenos Aires, Argentina Fax: (54-11) 4803-9475 e-mail: nriera@hematologia.anm.edu.ar
Resumen
Se presentan dos pacientes (mujeres de 41 y 15 años de edad) con ausencia del receptor para el fragmento Fc de IgG, CD16b en neutrófilos (fenotipo "null"). El caso 1 fue referida al laboratorio con diagnóstico de hemoglobinuria nocturna paroxística y el caso 2) con diagnóstico presuntivo de neutropenia inmune. En ambos casos se comprobó por citometría de flujo la ausencia de expresión de CD16b, sin deficiencias en la expresión de otras moléculas del sistema de alloantígenos propios de neutrófilos ni defectos en el anclaje a membrana por glicosil fosfatidil inositol (GPI). Las manifestaciones clínicas en ambas pacientes: anemia en el caso 1 y leucopenia en el caso 2 no pueden ser atribuidas exclusivamente a la carencia de CD16b, ya que otros receptores para Fc de IgG (CD32 y CD64) podrían suplir la función de CD16b. Sin embargo, es importante tener en cuenta esta rara deficiencia (< 1% en la población) ante eventuales transfusiones y embarazos, ya que es posible generar ioanticuerpos anti CD16b y neutropenia isoinmune natal transitoria en niños nacidos de mujeres con fenotipo "null".
Palabras clave: Neutropenia; Neutrófilos; Receptor CD16b
Abstract
Neutrophils without CD16b receptors. Occurrence of the rare CD16b deficiency ("null" phenotype) in neutrophils from two female patients (41 and 15 years old) is reported. The first case was referred with a diagnosis of anemia related to paroxistic nocturnal hemoglobinuria and the second case, with presumptive diagnosis of immune neutropenia. In both cases, absence of CD16b expression was determined by flow cytometry without deficiencies of other neutrophil alloantigens or defects of membrane anchorage through glycosil phosphatydil inositol (GPI) linkage. Clinical manifestations in both patients could not be attributed exclusively to the absence of CD16b, as other receptors for the IgG Fc fragment (CD32 and CD64) could compensate this deficiency that occurs in < 1% of the caucasic population. Nevertheless, it is important to take this rare deficiency into account in order to prevent isoantibody formation after eventual blood transfusions, or transient neonatal immune neutropenia in children born to women with the "null" phenotype.
Key words: Neutropenia; Neutrophils; CD16b receptors
Los receptores para el fragmento Fc de las inmunoglobulinas (RFc) pertenecen a la superfamilia de las inmunoglobulinas. La estructura les confiere una naturaleza activadora de la cascada de fosforilación, como en el caso de RIFc? (CD64) y RIIaFc? (CD32) que se encuentran en macrófagos, células dendríticas y en neutrófilos polimorfonucleares (PMN) y eosinófilos estimulados, o bien una naturaleza inhibitoria como la que caracteriza al RIIb1Fc? (presente en linfocitos B) y al RIIa2Fc?1.
El RIIIFc? (CD16), es el único que presenta dos isoformas: a) de transmembrana (RIIIaFc?) con la capacidad de activar la cascada de fosforilación, presente en células natural killer, eosinófilos, macrófagos y mastocitos y b), una isoforma correspondiente a un receptor anclado a la membrana por el glicosil fosfatidil inositol (GPI) CD16b (RIIIbFc?), cuya estructura no le confiere naturaleza activadora ni inhibitoria2. El CD16b es un receptor expresado con alta densidad en la membrana celular en comparación con el CD323, con la particularidad de que en él se ubican antígenos específicos de los PMN: NA1, NA2 y SH o HNA-1a, HNA-1b y HNA-1c respectivamente, según la actual nomenclatura: HNA (human neutrophil alloantigens). Los fenotipos HNA-1a y HNA-1b difieren por cuatro aminoácidos y los genes correspondientes por cinco nucleótidos. Se han encontrado variaciones en la frecuencia de los genes en distintos grupos étnicos. En la población caucásica es mayor la frecuencia del HNA- 1b (75-90% vs. 44-74%), mientras que en la población asiática (China, Japón, Corea) y amerindia el HNA-1b es menos frecuente que el HNA-1a (36-80% vs. 83-91%)4, 5. Se han asociado las diferencias en la capacidad fagocítica de los PMN con el alotipo HNA expresado en cada individuo. Previamente evaluamos el fenotipo HNA en 124 individuos sanos, donantes voluntarios, y en 24 pacientes con diagnóstico presuntivo de neutropenia inmune. Los individuos sanos expresaron 73% HNA-1b vs. el 64% del HNA-1a, y los pacientes el 67% HNA-1b vs. 58% HNA- 1a (datos no publicados). Estas frecuencias son similares a las observadas en la población caucásica6, 7. Otro de los antígenos exclusivos de los PMN es el NB1 (HNA- 2a, CD177), una glicoproteína de membrana no anclada al GPI presente con mayor intensidad en mujeres, con una expresión variable4. La ausencia del receptor CD16b, fenotipo "null"8, se encuentra en muy baja frecuencia en la población caucásica (0-1.5%) y en menos del 1-2% en la población africana9. Además del receptor CD16b, en los PMN hay otras proteínas que se encuentran ligadas a la membrana por el GPI, desempeñando importantes funciones reguladoras, tales como la del factor acelerador de decaimiento (CD55) y el factor que inhibe el ensamblaje para la acción final del sistema complemento (CD59). La detección de sub-poblaciones celulares con menor expresión de membrana de ambos, tanto en PMN como en eritrocitos, contribuye al diagnóstico de los pacientes con hemoglobinuria paroxística nocturna (HPN). Esta enfermedad se describe como un desorden clonal adquirido originado por mutaciones del Gen PIG-A en células madre de la médula ósea. En consecuencia, ante el diagnóstico presuntivo de HPN se requiere estudiar la expresión de proteínas ancladas al GPI tanto en glóbulos rojos como en PMN. Sin embargo, no siempre el descenso en la expresión del CD16b se asocia a un defecto en el anclaje al GPI. En los PMN, la baja expresión de CD16b puede relacionarse con el incremento de la apoptosis. También la ausencia total del CD16b fue documentada y no relacionada con un defecto del anclaje al GPI.
Presentamos el hallazgo de 2 individuos con fenotipo "null": el primero fue referido a nuestro laboratorio con diagnóstico presuntivo de HPN y el segundo con diagnóstico presuntivo de neutropenia immune.
Caso 1
Sexo femenino de 41 años de edad, que consulta en diciembre de 2000 por anemia y cefalea. Presentaba metrorragias reiteradas, ocasionadas por un fibromioma, y en tratamiento con hierro parenteral. Fondo de ojo con hemorragias en "llama". Manifestaba además gonalgia derecha, estando medicada con antiinflamatorios. Hematocrito 26%, hemoglobina 7.7g/dl, leucocitos 2.8 x 109/l. (PMN 62%, linfocitos 28%, monocitos 10%), plaquetas 25 x 109/l, LDH elevada, ferritina 12ng/ml. Proteína C reactiva sérica: negativa. Se le indica meprednisona 60 mg/día y hierro intravenoso, recuperando los valores normales de plaquetas y hemoglobina. Seis meses después se presenta con leucopenia y trombocitopenia (leucocitos 4.0 x 109/l y plaquetas 75 x 109/l. IgG asociada a plaquetas: normal. Biopsia de médula ósea con cambios displásicos leves. Estudio citogenético normal. Prueba de Coombs Directa positiva (IgG) y presencia de anticuerpos irregulares antieritrocitos (JKa) en suero. Complemento normal, pruebas del látex para artritis reumatoidea, factor antinuclear (FAN) y anti DNA negativos. Complejos inmunes circulantes (CIC) negativos. Ac anticoagulante lúpico: negativo. Test de Ham y de sucrosa negativos.
Se realizó la técnica de marcación directa de las proteínas de la membrana celular y lisis de los glóbulos rojos. El mismo procedimiento se realizó en la muestra del dador voluntario sano del día del estudio. Se utilizaron los anticuerpos monoclonales anti CD55, anti CD59 y anti CD16 para evaluar la expresión en PMN, y anti CD55 y anti CD59 para detectar la expresión en glóbulos rojos. Se empleó un citómetro de flujo FACScan (Becton Dickinson). No se encontró diferencias en la expresión de CD55 y CD59 en PMN ni en los glóbulos rojos del paciente en relación al dador del día. Sin embargo, se encontró ausencia total del receptor CD16b. La expresión de CD14 en monocitos fue normal. Luego de confirmar la ausencia del CD16b en PMN se emplearon anticuerpos monoclonales específicos hacia el HNA-1a y el HNA-1b, y ambos fueron negativos.
Caso 2
Referido por diagnóstico presuntivo de neutropenia inmune. Sexo femenino, de 15 años de edad.
Datos clínicos: A los 4 meses de edad comenzó con una onfalitis y luego infecciones en las vías respiratorias altas, con anginas y faringo-amigdalitis reiteradas. En la edad escolar, sufrió una varicela muy grave. A partir de la menarca, a los 10 años de edad, las infecciones no fueron de gravedad. A los 11 años, a raíz de un sobrepeso brusco, se estudia desde el punto de vista hormonal, y como hallazgo de laboratorio se constató la leuco-neutropenia. Se efectuaron al menos 16 hemogramas, en un período de 4 años, con variaciones entre 3 y 4.9x109 células blancas totales/l, con valores absolutos de PMN 0.98 a 2.7x109 PMN/l, entre 24.7% y 58% de PMN, 38% y 63.9% de linfocitos y 4 y 16% de monocitos. Las evaluaciones arrojaron también recuento normal de plaquetas, niveles normales de fosfatasa alcalina, de inmunoglobulinas y de C3. No se detectaron anticuerpos antinucleares, ni se encontró reactividad en el suero en la evaluación para toxoplasmosis, virus de Epstein Barr o Citomegalovirus. Sólo fue positiva la serología para Parvovirus B19.
Por marcación y lisis se evaluó la expresión de CD16b y se determinó el fenotipo de los PMN, en el paciente y en el dador sano voluntario del día del estudio. El 99.95% de la población de PMN no expresó el CD16b comparado con el dador del día 0.63% (Fig. 1), que está dentro del valor de referencia del laboratorio: = 1.81% (![]() + 2DS= 0.55% + 1.26% = 1.81; n=81). Similar imagen e igual porcentaje para CD16b se encontró en el primer caso. En la Fig. 2 se muestra que también es negativa la expresión de NA1 (HNA-1a) y NA2 (HNA-1b), dado que estos antígenos están localizados en el receptor CD16b. En cuanto a otros antígenos propios del sistema HNA, el NB1 (HNA-2 CD177) se encontró presente tanto en la membrana de los PMN del paciente como en la del dador.
+ 2DS= 0.55% + 1.26% = 1.81; n=81). Similar imagen e igual porcentaje para CD16b se encontró en el primer caso. En la Fig. 2 se muestra que también es negativa la expresión de NA1 (HNA-1a) y NA2 (HNA-1b), dado que estos antígenos están localizados en el receptor CD16b. En cuanto a otros antígenos propios del sistema HNA, el NB1 (HNA-2 CD177) se encontró presente tanto en la membrana de los PMN del paciente como en la del dador.
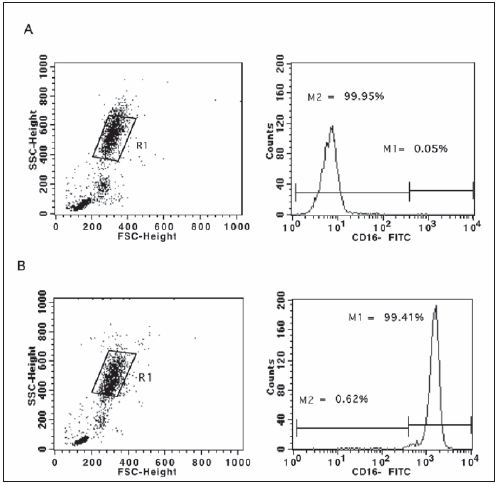
Fig. 1.– Expresión del receptor CD16b . La región de neutrófilos (R1) se ha definido sobre el gráfico de puntos FSC vs SSC. El histograma indica la expresión de CD16b. Se ha aplicado un marcador (M1) sobre la región normal y M2 sobre elárea de baja expresión de CD16b y los valores estadísticos. En A se indican los gráficos del paciente, con 0.05% de expresión normal y un 99.95% con baja expresión de CD16b. En B los resultados correspondientes al dador voluntario sano del día del estudio.
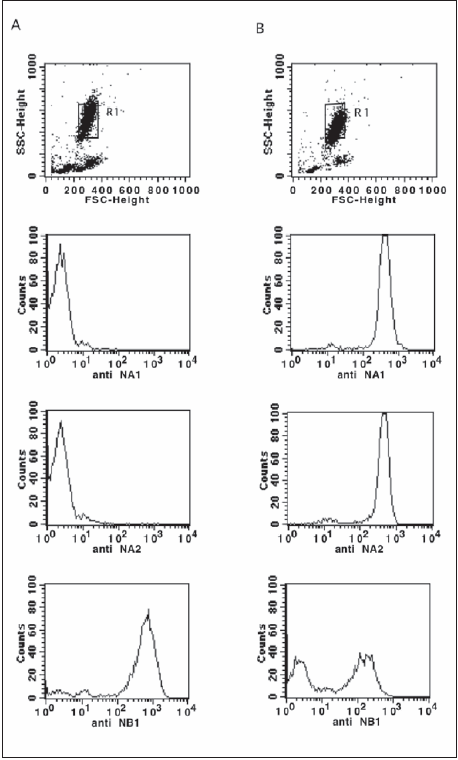
Fig. 2.– Antígenos específicos del neutrófilo. La región de neutrófilos (R1) se ha definido sobre el gráfico de puntos FSC vs SSC en A: células del paciente y los histogramas, sobre R1, en los que se observa la ausencia del antígeno NA1 (HNA-1a) y NA2 (HNA-1b). Similarmente en B: células del dador voluntario sano del día con los histogramas sobre R1 que muestran una expresión de ambos antígenos NA1 y NA2. Además ambos, el paciente y el dador, expresan el antígeno NB1 (HNA-2a/CD177).
Discusión
El RIIIbFc? es un receptor de baja afinidad para la inmunoglobulina IgG que se expresa constitutivamente, anclado a la membrana por el GPI en los PMN (CD16b)y como receptor de transmembrana en células natural killer.
La función principal de los receptores para el fragmento Fc de las inmunoglobulinas es la de desencadenar la fagocitosis de patógenos, lo que lleva a su destrucción intracelular.
Este receptor CD16b participa de la citotoxicidad anticuerpo- dependiente. Por sí mismo el CD16b no envía señales al medio interno celular; podría potenciar la unión de complejos inmunes al PMN10. La señalización a través del CD16b involucra la familia Tec de las tirosinaquinasas involucradas en la fosforilación y en la movilización de calcio11. La remoción del CD16b en PMN tratados con fosfolipasa C y factor de necrosis tumoral (TNFa), si bien inhibe la activación de PMN primados con complejos inmunes solubles, no afecta la fagocitosis ni la muerte de bacterias oposonizadas12. Asimismo, en adultos con periodontitis (AP), se ha demostrado que los alotipos HNA-1a y HNA-1b interactúan en forma diferente con partículas opsonizadas con IgG1 o IgG3. Además, el estudio de funcionalidad del CD16b con previo bloqueo del receptor CD32, sugiere que la heterogeneidad del CD16 puede influenciar el curso clínico en AP.
Uno de los primeros hallazgos de la ausencia del receptor CD16b es el de una madre cuyo hijo recién nacido cursaba una neutropenia neonatal. Posteriormente se detectó otro individuo durante una rutina de evaluación de antígenos específicos de los PMN. En estos individuos, la expresión de otras moléculas ancladas al GPI (CD24, CD67, CD14) además de las ya mencionadas fue normal. En 21 individuos de 14 familias con deficiencia del CD16b se encontró que no expresaban ni HNA-1a ni HNA-1b. Dos de ellos presentaban tiroiditis autoinmune, cuatro habían tenido múltiples episodios de infección, tres sólo infecciones incidentales y catorce no habían sufrido infecciones serias13. En otros 2 individuos, en forma casual se detectó ausencia del CD16b en PMN y monocitos y se confirmó la ausencia de estos receptores en otros 2 miembros de la familia, padre y hermana, todos ellos sanos, sin evidencia de incremento en la frecuencia, ni severidad en las infecciones habituales.
Como hallazgo de laboratorio, se comprobó la reversión del fenotipo "null" en una paciente con leucemia mieloide, transplantada con médula ósea de un hermano gemelo con idéntico HLA14. También se ha demostrado que los receptores CD32 y CD64 compensarían la falta de CD16b, por lo que no se encontraría afectada ni comprometida la defensa inmune del individuo deficiente15.
En conclusión, si bien la ausencia del CD16b no afectaría el funcionamiento del sistema inmune por el efecto compensador del receptor CD32, la importancia de nuestro hallazgo radica en la posibilidad de alertar a aquellos pacientes con fenotipo "null" (< 1% de la población caucásica) ante eventuales transfusiones dado que, potencialmente, inducirían la síntesis de isoanticuerpos anti-CD16b. Del mismo modo éstos pueden, potencialmente, ser la causa de la neutropenia neonatal isoinmune transitoria, en un bebé a cuya madre se le haya detectado ausencia de CD16b en la membrana de los PMN.
Conflictos de interés: No hay conflictos de interés a declarar.
1. Ravetch JV, Bolland S. IgG Receptors. Annu Rev Immunol 2001; 19: 275-90. [ Links ]
2. Huizinga TWJ, van del Schoot CD, Jost C, et al. The PI-kinked receptor FcRIII is released on stimulation of neutrophils. Nature; 1988; 333: 667-9. [ Links ]
3. Huizinga TW, van Kemenade F, Koendeman L, et al. The 40 KDa Fc gamma receptor (FcRII) on human neutrophils is essential for the IgG-induced respiratory burst and IgG-induced phagocytosis. J Immunol 1989; 142: 2365-9. [ Links ]
4. Bux J. Human neutrophil alloantigens. Vox Sang 2008; 94: 277-85. [ Links ]
5. Lalezari P, Radel E. Neutrophil-specific antigens: Immunology and clinical significance. Semin Hematol 1974; 11: 28-90. [ Links ]
6. Hessner MJ, Curtis BR, Endean DJ, Arter RH. Determination of neutrophil antiagen genes frequencies in five ethnics groups by polymerase chain reaction with sequence- specific primers. Transfusion 1996; 36: 895-9. [ Links ]
7. de la Vega ECD, Nogués N, Fernández Montoya A, Oyonarte S, Solís E. Muñiz-Díaz E. HNA-1a, HNA-1b and HNA-1c gene frequencies in Argentineans. Tissue Antigens 2008; 71: 475-7. [ Links ]
8. Huizinga TWJ, Kuijpers RWAM, Kleijer M, et al. Maternal Genomic Neutrophil FcRIII deficiency leading to neonatal isoimmune neutropenia. Blood 1990; 76: 1927-32. [ Links ]
9. Matsuo K, Procter J, Stroncek D. Variations in genes encoding neutrophil antigens NA1 and NA2. Transfusion 2000; 40: 645-53. [ Links ]
10. Fossati G, Bucknall RC, Edwards SW. Insoluble and soluble immune complexes activate neutrophils by distinct activation mechanisms: changes in functional response induced by priming with cytokines. Ann Rheum dis 2002; 61: 13-9. [ Links ]
11. Fernandez MJ, Lachance G, Paré G, Rollet-Labelle E, Naccache PH. Signaling through CD16b in human neutrophils involves the Tec family of tyrosine kinases. J Leukoc Bil 2005; 78: 524-32. [ Links ]
12. Fossati G, Moots RJ, Bucknall RC, Edwards SW. Differential role of Fcgamma receptor IIIB (CD16) in phagocytosis, bacterial killing and response to immune complexes. Arthritis Rheum 2002; 46: 1351-61. [ Links ]
13. de Hass M, Kleijher M, van Zwieten R, Roos D, von dem Borne AEG. Neutrophil Fc?RIIIb deficiency, nature, and clinical consequences: a study of 21 individuals from 14 families. Blood 1995; 86: 2403-13. [ Links ]
14. Minchinton RM, de Hass M, von dem Borne AE, Kleijer M, Roberts AW, Gillet EA. Abnormal neutrophil phenotype and neutrophil FcRIII deficiency corrected by bone marrow transplantation. Transfusion 1995; 35: 874-8 [ Links ]
15. C. Wagner, G.M. Hänsch GM. Genetic deficiency of CD16, the low-affinity receptor for immunoglobulin G, has no impact on the functional capacity of polymorphonuclear neutrophils. Eur J Clin Invest 2004; 34: 149-55. [ Links ]
Recibido: 7-1-2009
Aceptado: 8-4-2009














