Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Medicina (Buenos Aires)
Print version ISSN 0025-7680On-line version ISSN 1669-9106
Medicina (B. Aires) vol.69 no.6 Ciudad Autónoma de Buenos Aires Nov./Dec. 2009
ARTÍCULO ORIGINAL
Brote de dengue autóctono en el área metropolitana Buenos Aires. Experiencia del Hospital de Enfermedades Infecciosas F. J. Muñiz
Alfredo Seijo1, Yamila Romer1, Manuel Espinosa2, Jessica Monroig1, Sergio Giamperetti1, Diego Ameri1, Leslie Antonelli1
1Servicio de Zoonosis, Hospital Francisco J. Muñiz;
2Fundación Mundo Sano, Buenos Aires
Dirección postal: Dr. Alfredo Seijo, Servicio de Zoonosis, Hospital F. J. Muñiz, Uspallata 2272, 1282 Buenos Aires, Argentina Fax: (54-11) 4304-2386 e-mail: ceijo@intramed.net
Resumen
Como consecuencia de la epidemia de dengue que afectó a la República de Bolivia y provincias del norte argentino, se produjo por primera vez un brote de dengue autóctono en el Area Metropolitana Buenos Aires. A partir de enero de 2009 asistimos casos de dengue importado hasta la tercera semana de marzo, cuando aparecieron los primeros casos por transmisión local, tendencia que se mantuvo hasta mediados de mayo. La mayor concentración de casos autóctonos atendidos residía en la región oeste de la ciudad de Buenos Aires y en localidades de los partidos de 3 de Febrero y La Matanza, que limitan con ella. Existieron factores concurrentes para que se produjera este brote: alta densidad vectorial, viajeros provenientes de regiones epidémicas concentrados por su domicilio en las áreas donde luego se produjo la transmisión local. El 95% ingresaron en los primeros días de viremia y en un período climático caracterizado por temperaturas medias elevadas que se mantuvieron hasta mediados de otoño. De los nueve pacientes con signos de alarma para el desarrollo de dengue grave, siete fueron casos autóctonos que no tenían antecedentes de haber padecido previamente dengue. Se comunican los hallazgos clínicos y epidemiológicos y se analizan los factores que regularon la transmisión.
Palabras clave: Dengue; Dengue autóctono; Area Metropolitana Buenos Aires
Abstract
Outbreak of indigenous dengue in the Buenos Aires Metropolitan Area. Experience of the F.J. Muñiz Hospital. As a consequence of the dengue epidemic in the Bolivian Republic and the northern provinces of Argentina, an outbreak of indigenous dengue occurred for the first time in the Buenos Aires Metropolitan Area. Since January 2009 we assisted imported dengue cases coming from epidemic regions; later, around the end of March, and until middle autumn, indigenous cases appeared. The major concentration of these indigenous cases was in the west area of Buenos Aires City and in the neighboring localities 3 de Febrero and La Matanza. There were several factors that made the local transmission possible: a high vector density, people traveling from epidemic areas and clustering in the geographical zone where the indigenous epidemic occurred, during a period with high medium temperatures, entering 95% of the imported cases during the first days of the viremia. Of the nine patients with alarming signs for the development of severe dengue, seven were indigenous cases with no previous history of dengue infections. We report the clinical and epidemiological findings, and we analyze the factors which regulated the transmission.
Key words: Dengue; Indigenous dengue; Buenos Aires Metropolitan Area
La ciudad de Buenos Aires y los 24 municipios del Gran Buenos Aires que la rodean, constituyen un espacio geográfico de 3833 km2 con una población de 12 millones de habitantes, que es denominada Area Metropolitana Buenos Aires, con problemas comunes para sus habitantes, entre ellos los relacionados con la salud pública. Un número importante corresponde a personas que han migrado de países vecinos y de otras provincias argentinas. Según el censo 20011 estaban empadronados 427 mil habitantes originarios de países limítrofes, en la gran mayoría de las repúblicas de Paraguay y Bolivia, pero estimaciones oficiales2 y no oficiales3 indicarían que viven entre 500 mil y 1.5 millones sólo de habitantes de origen boliviano, la mayoría radicados en el Area Metropolitana. Parte de esta población, entre fines de diciembre y febrero retornan en forma temporaria a su lugar de origen. Por otra parte, en el primer trimestre de 2009 ingresaron 1.2 millones de turistas, de los cuales 700 mil lo hicieron de países limítrofes4. Este importante movimiento poblacional es un factor de riesgo para la introducción de enfermedades transmisibles.
La primer epidemia de dengue de Argentina, de 1916, afectó la región mesopotámica, pero no se registraron casos en la ciudad de Buenos Aires5 a pesar de la circulación de Aedes aegypti presente desde por lo menos 1858, primera epidemia de fiebre amarilla, hasta la última en 18966. De manera similar, la reintroducción del virus dengue (DEN2) en el noroeste argentino en 19987 y los brotes posteriores tanto en esa región como en el nordeste, tampoco produjeron brotes en el Area Metropolitana. Hasta la actualidad han circulado en la Argentina los serotipos DEN1, DEN2 y DEN3. Desde fines de 1999 hasta abril de 2000, Paraguay presentó una epidemia por DEN1, con una tasa de incidencia de 441.8 por 100 mil habitantes8, superior a la de los países que presentaban la mayor tasa hasta ese momento. El 60% de los pacientes provenientes de Paraguay, asistidos en nuestro servicio, ingresó al Area Metropolitana en viremia9; sin embargo, un estudio posterior de seroprevalencia no indicó transmisión local10. En 2007 el mismo país tuvo un brote extendido por DEN3, y en forma similar el 68% de los pacientes presentaba viremia pero sólo se comunicó un caso autóctono11. En los últimos meses de 2008 se produjo una epidemia extendida de dengue por serotipo DEN1 en varios departamentos de la República de Bolivia, y luego en varias provincias argentinas. Como en años anteriores, a partir de enero de 2009 se produjeron casos de dengue importado en residentes de Buenos Aires, que volvían de su país o provincia de origen. En una comunicación anterior9 se había advertido sobre el riesgo de transmisión local como consecuencia del flujo migratorio, y en otro estudio se analizaron los factores que regulan esa transmisión12. El objetivo del presente trabajo es comunicar los casos de dengue asistidos por el Servicio de Zoonosis del Hospital de Infecciosas F. J. Muñiz, la zona geográfica de residencia, la relación temporal y espacial y las condiciones locales de transmisión de esta enfermedad en el Area Metropolitana, en el período enero-mayo 2009.
Materiales y métodos
Los casos de dengue fueron definidos en: a) caso sospechoso: paciente con fiebre de inicio agudo sin foco en vía aérea superior, b) caso confirmado: paciente con síndrome febril agudo y detección en suero de IgM para virus dengue por enzimoinmunoensayo (ELISA), confirmado por el Instituto Nacional de Enfermedades Virales Humanas (INEVH) para descartar serorreactividad cruzada con otros flavivirus; o bien dentro de los cuatro primeros días de evolución una reacción en cadena de la polimerasa con transcriptasa reversa (PCR-RT) 13 positiva, c) caso autóctono (transmisión local del virus): enfermos que habían permanecido en el área en estudio en los diez días previos al comienzo de los síntomas14. Se analizan datos clínicos y bioquímicos.
Para el análisis de la distribución geográfica y la relación temporal y espacial de la ocurrencia de casos se georreferenciaron de acuerdo a su domicilio. En los casos importados se analizó la procedencia, fecha de comienzo de los síntomas y días de viremia al ingreso a la región. En los casos autóctonos, procedencia y fecha de comienzo de síntomas.
Para el análisis de las condiciones locales de transmisión consideramos: 1) la relación de la longevidad de la hembra de A. aegypti con la duración del ciclo extrínseco en función de la temperatura media, de forma tal que si la duración del ciclo extrínseco superara la expectativa de vida del vector no se produciría la transmisión de la enfermedad. Para estimar la duración de los ciclos extrínseco y gonadotrófico, se utilizó el modelo de cinética enzimática propuesto por Sharpe y De Micheli15. Para el presente trabajo se utilizaron los datos de temperaturas medias diarias obtenidas del Servicio Meteorológico Nacional, entre el 1 de diciembre de 2008 y el 31 de mayo de 2009 y se consideró una longevidad promedio de 17 días, estimada en estudios anteriores12. Estos datos permitieron estimar variaciones temporales del riesgo de transmisión16, y realizar gráficos de probabilidades para un período determinado12, 2) se utilizaron índices de abundancia vectorial estimados previamente. En diversos trabajos se ha demostrado la circulación del vector en el Area Metropolitana entre los meses de octubre y mayo17-21, 3) el período de viremia de los casos importados se estimó conociendo el día del ingreso con el comienzo de los síntomas, considerando que la viremia empieza 48 horas antes y dura hasta cinco días posteriores al inicio de la fiebre14, 22.
Resultados
Entre enero y abril de 2009 se asistieron 1654 pacientes, de los cuales 543 consultaron por síndrome febril agudo sospechoso de dengue. Cumplieron la definición de caso confirmado 227 enfermos (42%). De acuerdo al lugar de transmisión 122 (54.5%) fueron importados y 105 (45.5%) autóctonos.
Sexo femenino: 119 (53%). Importados femeninos: 55 (46%). Autóctonos femeninos: 64 (54%).
Edad promedio: 39 ± 16.8 años (3 a 84). Importados: promedio 37 ± 16.2 años (10 a 73). Autóctonos: promedio 41 ± 16.8 años (3 a 84).
En la Tabla 1 se observan los hallazgos clínicos más importantes.
TABLA 1.- Hallazgos clínicos y bioquímicos en 227 pacientes con dengue importado y autóctono (serotipo DEN1). Area Metropolitana Buenos Aires, enero-mayo 2009

Sobre 22 pacientes con manifestaciones hemorrágicas, 11 presentaron petequias, 1 púrpura, 8 gingivorragia o epistaxis y 1 metrorragia. Nueve de 17 pacientes con hemorragias tuvieron recuento de plaquetas normales. En todos los casos las hemorragias fueron autolimitadas y en sólo uno se asociaron a signos de alarma para dengue grave. Nueve pacientes presentaron signos de alarma para dengue grave14, 22, 23. Todos ellos tuvieron reagudización del dolor abdominal entre los días 4 y 7 de iniciada la fiebre. No se detectó extravasación plasmática (por ecografía o aumento de hematocrito), siete pacientes fueron autóctonos, dos requirieron internación y el resto fue hidratado por vía parenteral en forma ambulatoria, sin que se registraran complicaciones en los pacientes ambulatorios ni en los internados. Los casos autóctonos no tenían antecedentes de haber padecido un episodio anterior de dengue o viajado a regiones que en su momento tuvieran transmisión de la enfermedad.
El valor mínimo de leucocitos fue de 1.800/ml (promedio 3.500 ± 1477.8/ml) y de plaquetas 34.000/ml (promedio 123.319 ± 53109.7/ml).
En 20, el estudio PCR-RT fue positivo para DEN1. En la Fig.1 se observa la corrida electroforética del producto de PCR-RT de una muestra de suero correspondiente a un paciente autóctono, donde puede verse en calle 6 una banda de 482 pb que corresponde al serotipo DEN1 (en calle 7 control positivo). No se observan bandas correspondientes a los serotipos DEN2, 3 y 4 ni al virus de fiebre amarilla.
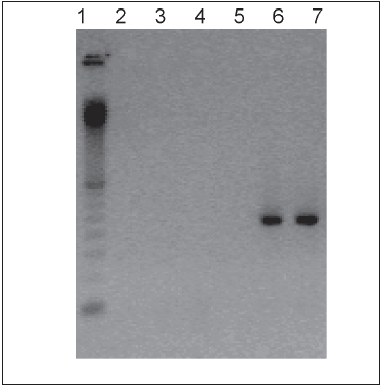
Fig. 1.- Electroforesis en gel de agarosa al 2% teñido con bromuro de etidio, de una muestra de sangre de un paciente con dengue.
Los casos se georreferenciaron por lugar de residencia según fueran importados o autóctonos (Fig. 2). Los casos autóctonos estuvieron agrupados en la región oeste y en menor medida en la sur. Treinta y tres (31.5%) residían en la ciudad de Buenos Aires, 33 (31.5%) en el partido de 3 de Febrero, 29 (28%) en el partido de La Matanza y 10 (9%) en otros partidos como Lanús, Ituzaingó y Luján. De acuerdo con la progresión temporal de casos importados a autóctonos (Fig. 3), se observó que en enero y febrero predominaron los casos importados desde Bolivia, domiciliados en la zona oeste de la ciudad de Buenos Aires y partidos de 3 de Febrero y de La Matanza. En tanto que, 10 casos provenientes de la provincia de Salta, tuvieron una mayor dispersión geográfica en el Area Metropolitana. En marzo asistimos 15 casos importados de Chaco también con distribución domiciliaria no concentrada, 2 de Bolivia y 1 de Salta.

Fig. 2.- Casos de dengue georreferenciados en el Area Metropolitana Buenos Aires, enero-mayo 2009. Obsérvese la agrupación de casos autóctonos en la zona oeste: Liniers, Mataderos y Villa Lugano (ciudad de Buenos Aires), Ciudadela (3 de Febrero) y localidades de La Matanza.
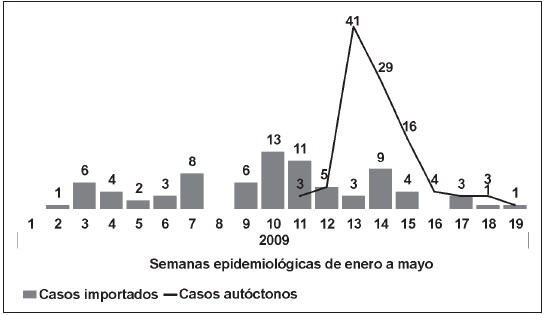
Fig. 3.- Casos semanales de dengue, importados y autóctonos. Area Metropolitana de Buenos Aires, enero-mayo 2009.
El primer caso autóctono vivía en un asentamiento denominado Villa 20 en la zona de Villa Lugano (Ciudad de Buenos Aires) y comenzó los síntomas el 20 de marzo. A fines de marzo se presentaron los primeros casos autóctonos en las localidades de Ciudadela (Partido de 3 de Febrero) y La Tablada (Partido de La Matanza). El último caso en la Ciudad de Buenos Aires (barrio de Mataderos) comenzó los síntomas el 16 de mayo y el último del conurbano el día 13 de mayo en La Matanza.
El 95% de los casos importados (n = 116) ingresaron al Area Metropolitana con viremia, con un promedio de 5.5 ± 2.4 días de evolución.
Calculando las tasas de desarrollo diario de los ciclos extrínseco y gonadotrófico y estimando la longevidad de Aedes aegypti para Buenos Aires, de 17 días12 se obtuvieron las probabilidades de transmisión (Fig. 4). En este gráfico, en el período comprendido entre el 15/12/08 y el 23/03/09, durante 98 días consecutivos, las hembras de Aedes aegypti completaron un ciclo gonadotrófico (ovipostura), en el cual necesitaron alimentarse (posibilidad de inocular el virus), habiendo completado el ciclo extrínseco (del virus en el vector) antes de morir.

Fig. 4.- Probabilidades de transmisión del dengue en el Area Metropolitana Buenos Aires, en el período diciembre 2008- mayo 2009, de acuerdo a las temperaturas medias diarias, para una expectativa de vida de Aedes aegypti de 17 días.
Discusión
La posibilidad de introducción del dengue como enfermedad de transmisión local en el Area Metropolitana está hasta este momento relacionada con la situación epidemiológica de la frontera norte de Argentina. Si bien existió un correlato temporal entre la situación epidemiológica de la República de Bolivia y las provincias del norte argentino, especialmente Salta y luego Chaco y la aparición de casos autóctonos en el Area Metropolitana, la concentración de los casos importados en un espacio geográfico delimitado, fue un factor crítico (Fig. 2). Casos importados de Salta y luego Chaco tuvieron un área de dispersión mayor que los procedentes de Bolivia, que se agruparon en la zona oeste (localidades de Liniers y Ciudadela), donde además de residir una importante comunidad boliviana se encuentra una terminal de ómnibus con frecuencias diarias a la zona norte y países limítrofes. Es muy probable que los primeros casos autóctonos no hayan sido detectados por el sistema de salud, pero en enero y febrero existía ya una "masa viral crítica" dada no sólo por el alto porcentaje de casos importados con viremia, 95% vs. 66% de los casos estudiados en 20009, sino además por el alto promedio de días de viremia (5.5 días). En la transmisión local es necesario considerar el tiempo necesario para que se cumpla el período de incubación extrínseco en el vector más el de incubación de la enfermedad, entre ambos alrededor de 15 días, lo cual explica la aparición de los primeros casos autóctonos a mediados de marzo. Otro hecho llamativo ha sido el mantenimiento de la transmisión local hasta mediados de mayo. La persistencia de temperaturas elevadas en otoño posibilitó la transmisión local a partir de fines de marzo, con un fuerte pico en abril y finalizando en mayo (Fig. 3). Existen registros históricos para la región de actividad de Aedes aegypti en meses avanzados de otoño, como ya se comentó. Sin embargo, esta actividad no es habitual por la situación geográfica de Buenos Aires (latitud 34º S, longitud 58º O), donde las probabilidades de transmisión son menores a las de la región subtropical16. En otro trabajo12 en el que se correlacionaron las variables de abundancia vectorial, ingreso de pacientes con viremia y estimación de la longevidad de Aedes aegypti y su relación con los ciclos extrínseco y gonadotrófico, se observó que la presencia del vector y del virus no eran condiciones suficientes para producir transmisión local, si bien la región oeste había sido definida de riesgo por la abundancia del vector17. Considerando que ambos ciclos son dependientes de la temperatura media (TM)24, 25, podemos comparar las probabilidades de transmisión en distintos períodos. En diciembre 1999-mayo 2000, según este modelo hubo escasas probabilidades en la semana epidemiológica 2 (08/01/00) como se observa en la Fig. 5. Esto se correlacionó con el ingreso de 38 pacientes provenientes de la República de Paraguay con DEN1, pero sin registro de transmisión local. En igual período de 2007 se estudiaron 88 pacientes también provenientes de Paraguay pero con DEN3, y sólo se registró un caso autóctono aislado11. En este período las probabilidades de transmisión aumentaron respecto al anterior, como se observa en la Fig. 6: semana epidemiológica 52 del 2006 (25/12), en las semanas epidemiológicas 3, 4 y 5 del 2007 (16/01/07 al 03/02/07) y en la semana epidemiológica 8 (20/2/07). Comparando estos gráficos con el de la Fig. 4, se observa que la prolongación de TM elevada desde diciembre 2008 a mayo de 2009 fue un factor crítico para la transmisión del dengue en la región, con 98 días continuos de riesgo. Si por otra parte se considerara, con base en los registros elevados de TM de este período, una expectativa de vida del vector de 20 días, las probabilidades de transmisión serían aún mayores. Además, un estudio reciente26 informó niveles de abundancia de Aedes aegypti elevados para el Area Metropolitana, con un índice de Breteau (recipientes positivos/casas inspeccionadas) del 62% y un incremento importante del índice de criaderos respecto de 2008. Sin embargo, la magnitud de un brote de dengue no es una relación lineal entre la abundancia vectorial y la carga viral presente en la comunidad, ya que intervendrían otros factores como susceptibilidad de la población, competencia vectorial y otros factores ambientales27, 28.
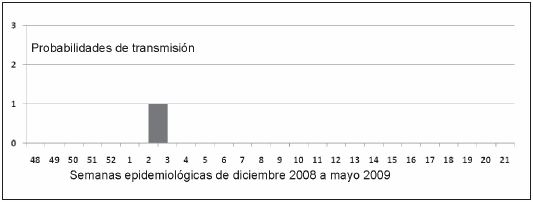
Fig. 5.- Probabilidades de transmisión del dengue en el Area Metropolitana Buenos Aires, en el período diciembre 1999- mayo 2000, de acuerdo a las temperaturas medias diarias, para una expectativa de vida de Aedes aegypti de 17 días.
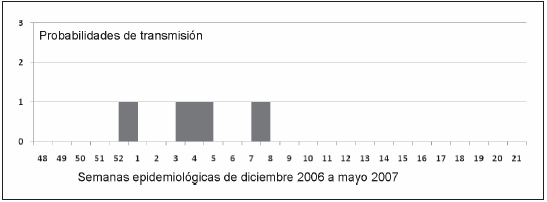
Fig. 6.- Probabilidades de transmisión del dengue en el Area Metropolitana Buenos Aires, en el período diciembre 2006- mayo 2007, de acuerdo a las temperaturas medias diarias, para una expectativa de vida de Aedes aegypti de 17 días.
El inicio del brote en otoño y las bajas temperaturas a partir de mediados de mayo fueron factores importantes que impidieron una mayor dispersión hacia otros conglomerados humanos. Existen ejemplos de regiones, incluidas las tropicales, donde previo a la generalización de la enfermedad se observó una progresión creciente de casos durante dos a tres años29-31.
Un estudio de seroprevalencia indicaría la verdadera incidencia de este brote, que podría ser quince o más veces mayor que los casos notificados32. Diversos estudios han mostrado que la infección por virus dengue puede ser muy alta, tanto como del 50% de la población33, 34. Estos datos, extrapolados al Area Metropolitana, muestran que un brote extendido sería un problema de salud pública con intensa repercusión social y económica. Una eficaz vigilancia clínica y epidemiológica, que detecte en forma precoz los primeros casos importados, podría focalizar las acciones de control vectorial y evitar la transmisión local extendida.
Hemos observado algunas diferencias clínicas respecto de pacientes con DEN1 oriundos de Paraguay asistidos en 20009. Exantema y diarrea fueron más frecuentes en esa serie que en la actual: 55% vs. 33% y 29% vs. 9%; sin embargo, leucopenia y trombopenia han sido más frecuentes en el brote actual: 45 vs. 79 y 13% vs. 71% respectivamente.
Un hecho importante ha sido la presentación de signos de alarma para dengue grave en 9 enfermos, de los cuales 7 fueron casos autóctonos y no registraban viajes previos a regiones de Argentina o del exterior con transmisión de dengue. En una revisión e historias clínicas de casos letales de dengue ocurridos en 2009 en el norte argentino, se detectaron casos por infección primaria. Esta patogenia del dengue grave es distinta a la teoría clásica de la inmunoamplificación propuesta por Halstead35 que fuera corroborada en varios brotes del sudeste asiático y América36. Es posible que la cepa circulante tenga atributos de virulencia capaces de producir dengue grave en infecciones primarias, hecho observado por otros autores37-40, lo cual es un alerta para el primer nivel de atención. En sólo el 42% de los pacientes con cuadro clínico sospechoso de dengue fue confirmado el diagnóstico por el laboratorio. En aquellos enfermos donde se pudo descartar por seguimiento serológico la infección por virus dengue, queda abierta la posibilidad de la circulación simultánea de otro virus.
Agradecimientos: A las doctoras Delia Enría y Alejandra Morales, del Instituto Nacional de Enfermedades Virales Humanas (INEVH), por la confirmación de los resultados de laboratorio, al personal técnico y administrativo del Hospital de Infecciosas F. J. Muñiz que colaboró en esta emergencia sanitaria y al Servicio Meteorológico Nacional (Fuerza Aérea Argentina) por la información climática.
Conflictos de interés: Ninguno
1. Instituto Nacional de Estadísticas y Censos (INDEC). Censo 2001. En: www.indec.gov.ar; consultado 15/8/09. [ Links ]
2. Ministerio del Interior. Dirección Nacional de Población. Población 2008; 1: 13-16. [ Links ]
3. Diario Perfil, Buenos Aires. La Argentina y la nueva inmigración. En: htpp://www.diarioperfil.com.ar/edimp/0373/articulo.php?art=15064&red=0373; consultado el 15/8/09. [ Links ]
4. Secretaría de Turismo de la Nación. Dirección de Estudios de Mercado y Estadística. Informe de Avance, primer trimestre 2009. En: www.turismo.gov.ar; consultado el 15/8/09. [ Links ]
5. Gaudino NM. El dengue. Algunas consideraciones sobre la epidemia de Entre Ríos. Rev San Milit Arg 1916; 15: 617-27. [ Links ]
6. Penna J. Lecciones Clínicas sobre Enfermedades Infecciosas. Buenos Aires: La Semana Médica, 1912, p 1-20. [ Links ]
7. Avilés G, Paz MV, Rangeon G, et al. Laboratory surveillance of dengue in Argentina, 1995-2001. Emerg Infect Dis 2002; 6: 738-42. [ Links ]
8. OPS/OMS. Prevención y control del dengue. CD43/12. 53a Sesión del Comité Regional. 43er Consejo Directivo. Washington DC. 2001. [ Links ]
9. Seijo A, Cernigoi B, Deodatto B. Dengue importado de Paraguay a Buenos Aires. Estudio clínico y epidemiológico de 38 casos. Medicina (Buenos Aires) 2001; 61: 137-41. [ Links ]
10. Seijo A, Avilés G, Enría D, et al. Estudio piloto sobre circulación de virus dengue en población adulta de diferentes regiones de la República Argentina. Libro de Resúmenes del IV Congreso Argentino de Zoonosis, Buenos Aires, Argentina, Abril 2004, p 32. [ Links ]
11. Natiello M, Ritacco V, Morales A, et al. Indigenous Dengue Fever, Buenos Aires, Argentina. Emerg Infect Dis 2008; 9: 1498-9. [ Links ]
12. Seijo A, Espinosa M, Morales A, Gardenal C, Coto H, Zaidenberg M. Investigación de las variables que limitan la ocurrencia de dengue en el Area Metropolitana de Buenos Aires y su análisis como nuevas herramientas para la vigilancia. Fondos para investigaciones operativas, PNUD 98/003. Ministerio de Salud de la Nación, 2005. [ Links ]
13. Sánchez-Seco MP, Rosario D, Hernández L, et al. Detection and subtyping of dengue 1-4 and yellow fever viruses by means of a multiplex RT-nested-PCR using degenerated primers. Trop Med and Int Health 2006; 9: 1432-41. [ Links ]
14. Mart{inez Torres Eric. Dengue. 3era ed. Río de Janeiro: Fundación Osvaldo Cruz, 2005, p 94. [ Links ]
15. Sharpe P, Demichele D. Reaction kinetics of poikilotherm development. J Theor Biol 1977; 64: 649-70. [ Links ]
16. Carbajo AE, Schweigmann N, Curto IS, de Garín A, Bejarán R. Dengue transmissión risk maps of Argentina. Trop Med and Int Health 2001; 6: 170-83. [ Links ]
17. Carbajo AE, Gómez SM, Curto SL, Schweigmann NJ. Variación espacio-temporal del riesgo de transmisión de dengue en la Ciudad de Buenos Aires. Medicina (Buenos Aires) 2004; 64: 231-4. [ Links ]
18. Alberti AI. Respuesta del sistema de salud ante la aparición de una enfermedad reemergente: dengue, en países no tropicales. Programa de control de criaderos de Aedes aegypti en un barrio de la Capital Federal. Tesis presentada en la Maestría en Administración de Sistemas y Servicios de Salud. Escuela de Salud Pública, Facultad de Medicina, Universidad de Buenos Aires. Octubre 2001. [ Links ]
19. Vezzani D, Velázquez SM, Soto S, Scheweigmann NJ. Environmental characteristics of the cementeries of Buenos Aires City (Argentina) and infestation levels of Aedes aegypti (Diptera: Culicidae). Mem Inst O Cruz 2001; 4: 467-71. [ Links ]
20. Curto SI, Boffi R, Carbajo AE, Plastina R, Schweigmann N. Reinfestación del territorio argentino por Aedes aegypti. Distribución geográfica (1994-1999). En: Actualizaciones en Artropodología Sanitaria Argentina, Serie Enfermedades Transmisibles. Buenos Aires: Fundación Mundo Sano, 2002, p 127-37. [ Links ]
21. Schweigmann N, Orellano P, Kuruc J, Vera MT, Vezzani D, Méndez A. Distribución y abundancia de Aedes aegypti (Diptera: Culicidae) en la Ciudad de Buenos Aires, en Actualizaciones en Artropodología Sanitaria Argentina, Serie Enfermedades Transmisibles. Buenos Aires: Fundación Mundo Sano, 2002, p 155-60. [ Links ]
22. Gubler DJ. Dengue and Dengue Hemorrhagic Fever. Clin Microbiol Rev 1998; 11: 480-96. [ Links ]
23. World Health Organization (WHO). Special Programme for Research and Training in Tropical Diseases (TDR), Geneva. Estudio DENCO (Validación de estudios en fase 3), 2009. [ Links ]
24. Focks DA, Haile D, Mount G. Dynamic life table model for Aedes aegypti (L) (Diptera: Culicidae). Analysis of the literature and model development. J Med Entomol. 1993a; 30: 1003-17. [ Links ]
25. Focks DA, Haile D, Mount G. Dynamic life table model for Aedes aegypti (L) (Diptera: Culicidae): Simulation results and validation. J Med Entomol 1993b; 30: 1018-28. [ Links ]
26. Apaz G, Zanotti G, Picasso P, et al. Abundancia de Aedes aegypti en Buenos Aires, durante la epidemia de dengue de 2009 en Argentina y características de sus criaderos. Libro de Resúmenes del XII Simposio Internacional sobre Control Epidemiológico de Enfermedades Transmitidas por Vectores. Buenos Aires, Argentina, Septiembre 2009, p 34. [ Links ]
27. Kuno G. Review of the factors modulating dengue transmission. Epidemiol Rev 1995; 17: 321-35. [ Links ]
28. Fernández-Salas I, Flores-Leal A. El papel del vector Aedes aegypti en la epidemiología del dengue en México. Apartado sobre la situación en Colonna. Salud Pub México 1995; 37: 45-52. [ Links ]
29. Fundação Nacional de Saúde. Coordenação Regional do Rio Grande do Norte. Epidemia de dengue em Natal e municípios circunvizinhos. Situação até a semana epidemiologica 31. Ministério de Saude, Brasil, 1997. [ Links ]
30. Ministerio de Salud del Perú. Oficina General de Epidemiología. Situación epidemiológica del dengue en Perú. Lima, febrero 2001. [ Links ]
31. Dias J, Pedral-Sampaio D, Jones T. Aedes aegypti surveillance and correlation with the occurrence of dengue fever in Bahia, Brazil. The Brazilian J Infect Dis 1997; 1: 37-42. [ Links ]
32. Castor de Lima V, Figuerido L, Correa E, et al. Dengue: inquérito serológico pós-epidêmico em zona urbana do estado de São Pablo (Brasil). Rev Sau Pub 1999; 6: 4-19. [ Links ]
33. Da Costa Vasconcelos P, Mota C, Straatmann A, Santos- Torres S, Travassos da Rosa A, Tavares Neto J. Epidemia de dengue en Ipupiara e Prado, Bahía. Inquérito soro-epidemiológico. Rev Soc Bras Med Trop 2000; 1: 57-69. [ Links ]
34. Venâncio da Cunha R, Maspero R, Miagostovich M, et al. Dengue infection in Paracambi, State of Rio de Janeiro, 1990-1995. Rev Soc Bras Med Trop 1997; 5: 379-83. [ Links ]
35. Halstead S. The patogénesis of dengue. Molecular epidemiology in infectious diseases. Am J Epidemiol 1981; 114: 632-648. [ Links ]
36. Ferguson N, Donnelly C, Anderson R. Transmission dynamics and epidemiology of dengue: insights from age-stratified sero-prevalence surveys. Phi Trans R Soc London B Biol Sci 1999; 354: 757-68. [ Links ]
37. Rosen L. Dengue in Greece in 1927 and 1928 and the pathogenesis of dengue hemorrhagic fever: new data and different conclusion. Am J Trop Med Hyg 1986; 35: 642-53. [ Links ]
38. Kourí G, Guzmán MG, Bravo JR, Triana C. Dengue hemorrhagic fever-dengue shock syndrome: lessons from de Cuban epidemic, 1981. Bull WHO 1989; 87: 375-80. [ Links ]
39. Thant KZ, Morita K, Igarashi A. Detection of the disease severity-related molecular differences among new Thai dengue-2 isolates in 1993, based on their structural proteins and major non-structural protein NS1 sequences. Microbiol Immunol 1996; 40: 205-16. [ Links ]
40. Seijo A. Dengue 2009: cronología de una epidemia. Comentarios. Arch Argent Pediatr 2009; 107: 387-9. [ Links ]
Recibido: 9-9-2009
Aceptado: 4-11-2009














