Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Medicina (Buenos Aires)
Print version ISSN 0025-7680On-line version ISSN 1669-9106
Medicina (B. Aires) vol.69 no.6 Ciudad Autónoma de Buenos Aires Nov./Dec. 2009
ARTÍCULO ORIGINAL
Distribución de vectores de leishmaniasis visceral en la Provincia de Corrientes, 2008
Oscar Daniel Salomón1 *, Ladys K. Ramos2, María Gabriela Quintana3 *, Soraya A. Acardi4 *, María Soledad Santini1 *, Adolfo Schneider2
1Centro Nacional de Diagnóstico e Investigación en Endemo-epidemias, Administración Nacional de Laboratorios e Institutos de Salud, Ministerio de Salud de la Nación,
2Ministerio de Salud Pública, Corrientes,
3Instituto Superior de Entomología, Facultad de Ciencias Naturales, Universidad Nacional de Tucumán,
4Laboratorio de Biología Molecular Aplicada, Facultad de Ciencias Exactas, Químicas y Naturales, Universidad Nacional de Misiones,
*Investigadores del CONICET (Consejo Nacional de Investigaciones Científicas y Técnicas)
Dirección postal: Dr. Oscar Daniel Salomón, Avenida Paseo Colón 568, 1063 Buenos Aires, Argentina Fax: (54-11) 4331 2536 e-mail: odanielsalomon@gmail.com
Resumen
La leishmaniasis visceral es una parasitosis de importancia en salud pública, producida por Leishmania infantum chagasi. A partir de la urbanización y emergencia en el sur de Brasil y Paraguay, se notificó la presencia del insecto vector Lutzomyia longipalpis en la Argentina; en Formosa, 2004, y en Misiones el primer caso humano en 2006. La notificación de casos de reservorios caninos infectados en la provincia de Corrientes, contigua a Misiones, determinó la búsqueda del vector. Mediante trampeos estandarizados en diciembre del 2008 se capturaron 376 Lu. longipalpis en Ituzaingó, Virasoro, Santo Tomé, Garruchos, Riachuelo, Corrientes y Monte Caseros. Se confirma el riesgo de transmisión vectorial autóctona de leishmaniasis visceral en la provincia de Corrientes. La distribución de vectores en áreas urbanas densamente pobladas, con intenso tránsito de reservorios caninos desde zonas de alta transmisión, y la presencia de reservorios infectados, implica a su vez riesgo epidémico.
Palabras clave: Leishmaniasis visceral; Lutzomyia longipalpis; Leishmania infantum chagasi; Corrientes; Argentina
Abstract
Distribution of vectors of visceral leishmaniasis in the Province of Corrientes, 2008. Visceral leishmaniasis (VL) is a relevant parasitic disease in public health, produced by Leishmania infantum chagasi. Since the urbanization and emergence in Southern Brazil and Paraguay, the vector Lutzomyia longipalpis in Formosa, 2004, and the first human visceral leishmaniasis case in Misiones, 2006, have been reported in Argentina. Due to the reports of canine VL, a search of the vector in the Province of Corrientes, contiguous to Misiones, was performed during December 2008. Standarized trapping detected 376 Lu. longipalpis in Ituzaingó, Virasoro, Santo Tomé, Garruchos, Riachuelo, Corrientes and Monte Caseros localities. The risk of autochtonous vectorial transmission was then confirmed in the Province of Corrientes. The distribution of vectors in populated urban areas, with intense transit of canine reservoirs from localities with high transmission, and the existence of infected reservoirs, also implies epidemic risk.
Keys words: Visceral leishmaniasis; Lutzomyia longipalpis; Leishmania infantum chagasi; Corrientes; Argentina
En las últimas décadas, la leishmaniasis visceral (LV) ha sido reconocida como una parasitosis de importancia en salud pública debido a su dispersión geográfica, asociación con HIV, y resistencia a las drogas terapéuticas1, 2. Presenta una incidencia anual mundial estimada de 500 000 casos/año y una mortalidad de 59 000/año3. En América Latina posee una tasa de letalidad promedio del 8%, que sin tratamiento llega a más del 90%, especialmente en niños4. En América se observó recientemente su rápida expansión hacia el sur del continente, con brotes epidémicos en ambientes urbanos debidos al parásito Leishmania infantum chagasi, con el perro como reservorio principal, y el insecto Phlebotominae Lutzomyia longipalpis como el vector más frecuente4-6,.
En la Argentina se realizó el estudio retrospectivo de fichas clínicas de casos de leishmaniasis con compromiso visceral registrados desde 1923 hasta el 2000, año en que se notificó la presencia del vector Lu. longipalpis en Corpus, Misiones. La ausencia del vector en los sitios con casos, y la dispersión de estos últimos en tiempo y espacio, sugirieron las hipótesis de manifestaciones clínicas viscerales en pacientes infectados, visceralización por especies de Leishmania distintas a L.i.chagasi, o un ciclo zoonótico esporádico sin potencial riesgo epidémico7. Sin embargo, dada la aparición de LV en el sur de Brasil y Paraguay se solicitó alerta amarilla, para generar un sistema de vigilancia de vectores en áreas de frontera, notificándose un paciente con infección importada de España8. De esta manera se encontró Lu. longipalpis por primera vez en Clorinda, Formosa, en el año 2004, solicitándose alerta naranja, y a partir de la misma instalar la vigilancia clínica de casos9, 10. En el año 2006 se notificó el primer caso autóctono de LV humana en Posadas, con presencia del vector y LV canina, confirmando la transmisión de LV en el país mediante la emisión del alerta roja, y promoviendo así las actividades relacionadas a su diagnóstico, tratamiento y control11. En el año 2007-2008 se realizaron capturas simultáneas de vectores para determinar la distribución del riesgo en diferentes focos potenciales de LV en Misiones: Posadas- Garupá (400 sitios de trampeo); Formosa: Clorinda-Laguna Blanca (150 sitios de trampeo) y Santiago del Estero: La Banda (100 sitios de trampeo)12.
En diciembre de 2008 la provincia de Misiones ya había notificado 34 casos humanos con cuatro óbitos, y en Corrientes se notificaban casos de LV canina. Por ello, se realizó un estudio para determinar la presencia de Lu. longipalpis en distintas localidades correntinas sobre la costa de los ríos Paraná, Uruguay y la frontera interprovincial, para determinar así el riesgo de transmisión autóctona de L.i.chagasi a humanos y canes.
Materiales y métodos
Se realizó la búsqueda de vectores de leishmaniasis visceral en la provincia de Corrientes, en los municipios de Riachuelo (27° 35' S-58° 45' O), Corrientes (27° 28' S- 58° 51' O), Laguna Brava (27° 29' S- 58° 48' O), San Cosme (27° 22' S- 58° 31' O), Paso de la Patria (28° 19' S-58° 35'O), Itatí (27° 16' S-58° 14' O), Ita-Ibaté (27° 25' S-57° 20' O), Villa Olivari (27° 37' S-56° 54' O), Ituzaingó (27° 36' S-56° 41' O), Apipé (27° 30' S-56° 54' O), San Carlos (27° 45' S-55° 54' O), Colonia Liebig (27° 55' S-55° 49' O), Garruchos (28° 10' S-55° 39' O), Garabí (28° 13' S-55° 47' O), Gobernador Virasoro (28° 04' S-56° 02' O), Santo Tomé (28° 33' S-56° 03' O), Monte Caseros (30° 17' S-57º 38'O). Para las capturas de Phlebotominae se utilizaron minitrampas de luz tipo CDC13 operando de 19:00 a 9:00 horas del día siguiente, desde el 8 de diciembre al 24 de diciembre del 2008, excepto las capturas de Monte Caseros que se realizaron del 16 al 22 de enero del 2009. Se colocaron entre 2 y 33 trampas por localidad en función de la cantidad de habitantes, área geográfica y riesgo (antecedentes de leishmaniasis visceral canina). Las trampas se instalaron bajo sombra, a 1.5 metros del suelo, una noche por sitio, en "peores escenarios" distantes entre sí, representativos de los distintos sectores y ambientes de la ciudad. "Peor escenario" es una definición operativa correspondiente al sitio, dentro del área de estudio, con mayor probabilidad de encontrar Phlebotominae, debido a las condiciones de hábitat y por ello con mayor significado biológico que el centro geométrico. Los "peores escenarios" se caracterizan por la presencia de sombra vegetal, tierra húmeda, detritos orgánicos, proximidad a parches de vegetación densa, densidad, calidad y accesibilidad de oferta de fuentes de ingesta sanguínea, no interferencia de luces externas, y presencia de casos recientes de leishmaniasis14, 15. Las coordenadas geográficas de cada sitio de trampeo se registraron mediante el Sistema de Posicionamiento Global (GPS), y se registraron las temperaturas nocturnas (máxima y mínima). Los Phlebotominae recolectados en cada trampa fueron separados de los otros insectos, mantenidos en seco, diafanizados con lactofenol, y su sexo y especie determinada bajo microscopio de contraste de fase según las clave de Young y Duncan (1994)16, con la modificación de Andrade Filho et al. (2003)17.
Resultados
Se colocaron el siguiente número de trampas por localidad: Riachuelo 4, Corrientes 33, Laguna Brava 3, San Cosme 2, Paso de la Patria 8, Itatí 6, Ita-Ibaté 6, Villa Olivari 6, Ituzaingó 30, Apipé 12 (8 en San Antonio), San Carlos 6, Colonia Liebig 4, Garruchos 4, Garabí 4, Gobernador Virasoro 12, Santo Tomé 11, Monte Caseros 8.
Se capturaron 436 flebotomíneos en 44 trampas, con un esfuerzo acumulado de 161 trampeos (trampa/noche). Las especies encontradas fueron Lu. longipalpis (86.3%), Lu. neivai (10.1%), Lu. migonei (2.5%), Lu. cortelezzii-salesi (0.7%), Lu. monticola (0.2%) y Brumptomyia avellari (0.2%) . Lu. longipalpis, vector de leishmaniasis visceral, se capturó en 29 ocasiones en 7 localidades (Fig. 1), Lu. neivai, vector de leishmaniasis cutánea18, 19, se encontró en 15 oportunidades en 8 localidades (Tabla 1). Lu. migonei y Lu cortelezzi, vectores secundarios de leishmaniasis cutánea19, se capturaron el primero en Santo Tomé y Corrientes, y el segundo en Paso de la Patria y Corrientes. Lu. monticola y Br. avellari, de hábitos silvestres, sólo fueron encontrados en la isla Apipé.

Fig. 1.- Presencia de Lu. longipalpis en localidades monitoreadas para el vector de leishmaniasis visceral. Corrientes, Argentina, 8-24/12/2008. Imagen tomada del Google Earth, versión 4.0.2416 (beta) http://earth.google.es
TABLA 1.- Capturas de Lutzomyia longipalpis y Lu. neivai según localidad, coordenadas geográficas, especie y sexo (H/M: hembras/machos). Sólo se muestran las capturas con al menos un Phlebotominae. Corrientes, Argentina, 8-24/12/2008
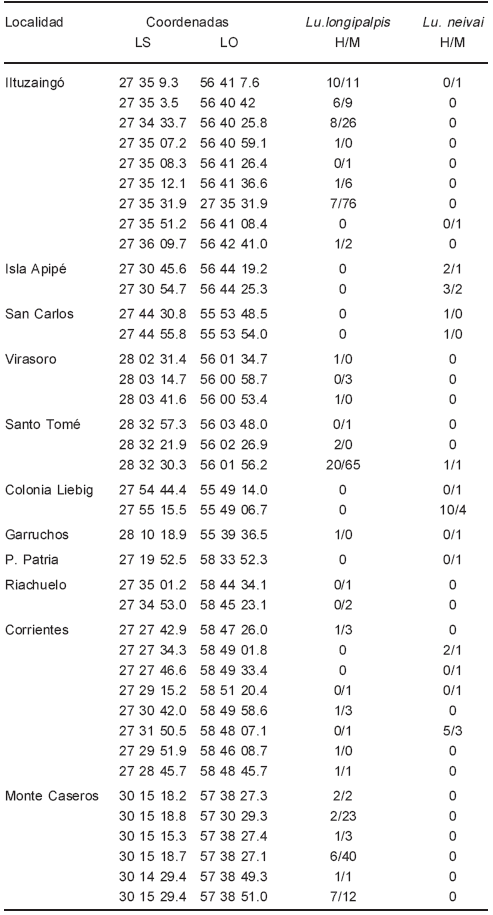
La densidad de captura de Lu.longipalpis fue baja (1- 7/trampa) en 21 trampas, moderada (15-46/trampa) en 6 trampas, y alta (83-85/trampa) en dos trampas.
La distribución de Lu. longipalpis en Ituzaingó demostró gran dispersión en el área urbana, y en Corrientes en periferia y área urbana (Fig. 2)

Fig. 2.- Distribución de Lu. longipalpis en las ciudades de Ituzaingó (A) y Corrientes (B) para el vector de leishmaniasis visceral. Corrientes, Argentina, 8-24/12/2008. Imágenes tomadas del Google Earth, versión 4.0.2416 (beta) http://earth.google.es
Discusión
Se demostró la presencia de Lu. longipalpis, vector de la leishmaniasis visceral, en ambiente peri-domiciliario, urbano, de diferentes localidades de Corrientes sobre los ríos Paraná y Uruguay: Ituzaingó, Virasoro, Santo Tomé, Garruchos, Riachuelo y Corrientes y Monte Caseros. El diseño de muestreo para determinar solamente presencia, así como las condiciones climáticas adversas para Lu. longipalpis como son la sequía y la colocación de trampas antes de la estación lluviosa20, 21, no permiten afirmar que el vector esté ausente de las localidades donde no se lo encontró, ni estimar tasas de abundancia por localidad. Por ello, se debe considerar en riesgo todo el territorio de Corrientes, con especial énfasis en las localidades que ya presenten vectores con casos humanos y caninos, luego las localidades con vectores y casos caninos, después aquellas con casos caninos, y finalmente las más vulnerables por proximidad y tránsito desde áreas con transmisión, aún sin vectores ni casos.
Hasta el momento en que se realizó el estudio se habían notificado a la Subdirección de Zoonosis y Control de Vectores de Corrientes, según ficha elaborada por la misma, 189 casos de LV canina, distribuidas 110 en Ituzaingó, 20 en Villa Olivari, 12 en Apipé, 23 en Santo Tomé, 20 en Virasoro, 1 en Paso de la Patria, 1 en Capital, 2 en Monte Caseros. Por sugerencia de dicha Subdirección la mayor parte de los municipios involucrados aprobaron ordenanzas de control de la leishmaniasis visceral. En los últimos días de diciembre del 2008, inmediatamente luego de concluir las capturas, se confirmó el diagnóstico de leishmaniasis visceral de un niño residente en la localidad de Virasoro (localidad sin ordenanza de control), derivado a Rosario, Santa Fe (Riarte A, Orduna T, comunicación personal).
Las capturas previas de phlebotominae realizadas en la provincia de Corrientes no habían registrado la presencia de esta especie22-25. Esto sugiere su introducción reciente, en forma simultánea o inmediatamente posterior al registro de Lu. longipalpis, al primer caso de LV humana en Argentina, y a la notificación de LV canina en la ciudad de Posadas, en el año 2006, riesgo que se advirtió oportunamente11.
En este sentido se debe recordar el rápido avance hacia el sur que registró, primero en Brasil y luego en Paraguay, el complejo Leishmania infantum chagasi - Lutzomyia longipalpis - reservorio canino infectado, que finalmente resultó en la aparición de leishmaniasis visceral humana epidémica4, 15, 26-29. Esta dispersión presentó, a su vez, un cambio en el patrón a transmisión de rural-periurbana a urbana, y se asoció en Mato Grosso do Sul a las autopistas que comunican al estado con el norte, y el súbito crecimiento de las ciudades a partir de población que migra con sus mascotas, atraídos por las grandes obras públicas o mejores expectativas de vida5, 15, 30-32. Precisamente, existe un tránsito intenso entre las ciudades de la provincia de Corrientes y las del área de transmisión activa de LV mediante personas que suelen trasladarse con sus perros de manera estacional, durante el verano (Ituzaingó) o durante el período de clases en la Universidad (Corrientes-Posadas). Esta situación se agrava por actitudes de tenencia irresponsable a partir del tráfico comercial de mascotas desde zonas con LV, nacionales y del exterior, y al abandono de perros enfermos en zonas de veraneo. Por el mismo motivo, la presencia del vector en Garruchos, Santo Tomé y Monte Caseros, deberá generar el alerta correspondiente en los estados de Brasil y departamentos de Uruguay próximos a dichas localidades. Como se desconoce el límite de dispersión de Lu. longipalpis, las provincias de Chaco, Entre Ríos y Santa Fe deberán intensificar las tareas de vigilancia.
Se ha desarrollado y distribuido un manual de control de vectores y reservorios, para unificar los criterios y metodología de intervención. En el mismo las actividades de vigilancia y de intervención se han estratificado según los antecedentes de transmisión o de riesgo de transmisión en cada localidad. El manual será discutido con los referentes de las provincias endémicas, a fin de incorporarlo al Programa Nacional de Leishmaniasis. El compromiso de funcionarios y de agentes de salud locales, la preocupación de la comunidad, la aprobación de ordenanzas municipales específicas, y la notificación activa de casos humanos y caninos, observadas durante el estudio, facilitarán la aplicación de las recomendaciones del Programa.
En conclusión, la presencia del vector Lu. longipalpis, de casos caninos de LV y un posible caso humano autóctono, confirman la posibilidad de transmisión vectorial activa de leishmaniasis visceral en la provincia de Corrientes. La distribución de vectores en áreas urbanas densamente pobladas, y con intenso tránsito de reservorios caninos desde zonas de alta transmisión, la presencia de reservorios infectados y de población humana/mascotas estacional, implica a su vez riesgo epidémico. Se recomienda la aplicación inmediata de las recomendaciones del Programa Nacional: a) vigilancia de casos humanos, de infección canina y de presencia de vectores, b) control de LV canina, c) intervenciones con insecticidas en un círculo de 150 metros alrededor de los sitios con muy alta densidad vectorial o transmisión activa de LV humana, (su efecto sobre los vectores es de muy corta duración), y d) manejo ambiental. Estas medidas deberán incluir a los distintos sectores involucrados: públicos, privados y sociales comunitarios. Se recomienda también la intensificación de la vigilancia de LV en las nuevas zonas vulnerables por proximidad espacial o tránsito intenso con el área de transmisión extendida, descripta en este trabajo.
Agradecimientos: Se agradece por la asistencia técnica y apoyo en campo a Adolfo Jaime y Felipa Ojeda, de Ita Ibaté, Vilma Salinas, de San Carlos, Zulma Ojeda, de Apipé, Alberto Jaborki y Manuel Díaz, de Villa Olivari, Rita M. de Chentola y Alejandro Etchenique, de Ituzaingó, Juan Marelli, Nelly Aguirre y Silvio Osorio, de Santo Tomé, Francisca Gadea de Garrucho, Romero Comas, de Garabí, Oscar Bedoya y Faustino Vallejo, de Itatí, Teresa Monjo y Ramón Alberto Fernández, de Paso de la Patria, y Oscar Aceval, de Corrientes.
Conflictos de interés: No existen conflictos financieros o personales que hayan influenciado inapropiadamente en el presente trabajo.
1. World Health Organization. Report of the scientific working group meeting on Leishmaniasis. TDR/SWG/04. Geneva: WHO, 2004. [ Links ]
2. World Health Organization. Sixtieth World Health Assembly. WHASS1/2006-WHA60/2007/REC/1. Geneva: WHO, 2007. [ Links ]
3. World Health Organization. Intensified control of neglected diseases: report of an international workshop. WHO/CDS/CPE/CEE/2004.5. Geneva: WHO, 2004. [ Links ]
4. Panaftosa. Informe final de la reunión de expertos OPS/OMS sobre Leishmaniasis Visceral en las Américas. Río de Janeiro: Panaftosa, 2006. [ Links ]
5. Gontijo CMF, Melo MNM. Leishmaniose visceral no Brasil: quadro atual, desafios e perspectivas. Rev bras epidemiol 2004; 7: 338-49. [ Links ]
6. Lainson R, Rangel EF. Lutzomyia longipalpis and the eco-epidemiology of American visceral leishmaniasis, with particular reference to Brazil: a review. Mem Inst Oswaldo Cruz 2005; 100: 811-27. [ Links ]
7. Salomón OD, Rossi G, Sosa Estani S, Spinelli G. Presencia de Lutzomyia longipalpis y situación de la leishmaniosis visceral en Argentina. Medicina (Buenos Aires) 2001; 61: 174-8. [ Links ]
8. Martín-Sánchez J, Navarro-Mari JM, Pasquau-Liano J, Salomón OD, Morillas-Marquez F. Visceral Leishmaniasis caused by Leishmania infantum in a Spanish patient in Argentina: What is the origin of the infection? Case Report. BMC Infectious Diseases 2004; 4: 20. [ Links ]
9. Salomón OD, Orellano PW. Lutzomyia longipalpis in Clorinda, Formosa province, an área of potential visceral leishmaniasis transmission in Argentina. Mem Inst Oswaldo Cruz 2005 100: 475-6. [ Links ]
10. Salomón OD. Visceral Leishmaniasis and Lutzomyia longipalpis in Argentina. En: Panaftosa (ed). Consulta de Expertos OPS/OMS sobre Leishmaniasis Visceral en las Américas. Informe final. Rio de Janeiro: Panaftosa/OPS Ed, 2006, p 21-3. [ Links ]
11. Salomón OD, Sinagra A, Nevot MC, et al. First visceral leishmaniasis focus in Argentina. Mem Inst Oswaldo Cruz 2008; 103: 109-11. [ Links ]
12. Salomón OD, Acardi SA, Rosa JR, Quintana MG. Eco-epidemiología de la leishmaniasis visceral en Argentina. Revista Médica de Rosario 2008; 74 (Supl): 12 [ Links ]
13. Sudia WD, Chamberlain RW. Battery operated light trap, an improved model. Mosquito News 1962; 22: 126-9. [ Links ]
14. Feliciangeli MD, Delgado O, Suarez B, Bravo A. Leishmania and sand flies: proximity to woodland as a risk factor for infection in a rural focus of visceral leishmaniasis in west central Venezuela. Trop Med Int Health 2006; 11: 1785-91. [ Links ]
15. Correa Antonialli SA, Torres TG, Paranhos Filho AC, Tolezano JE. Spatial analysis of american visceral leishmaniasis in Mato Grosso do Sul State, Central Brazil. J Infect 2007; 54: 509-14. [ Links ]
16. Young DG, Duncan MA. Guide to the identification and geographic distribution of Lutzomyia sand flies in Mexico, the West Indies, Central and South America (Diptera: Psychodidae). Mem Am Entomol Inst 1994; 54: 1- 881. [ Links ]
17. Andrade Filho JD, Galati EA, Falcão AL. Redescription of Nyssomyia intermedia (Lutz & Neiva 1912) and Nyssomyia neivai (Pinto 1926) (Diptera:Psychodidae). Mem Inst Oswaldo Cruz 2003; 98: 1059-65. [ Links ]
18. Córdoba-Lanús E, Lizarralde De Grosso M, Piñero JE, Valladares B, Salomón OD, 2006. Natural infection of Lutzomyia neivai with Leishmania spp. in northwestern argentina. Acta Tropica 2006; 98: 1-5. [ Links ]
19. Salomón OD, Rosa JR, Stein M, et al. Phlebotominae (Diptera: Psychodidae) fauna in the Chaco region and Cutaneous Leishmaniasis transmission patterns in Argentina. Mem Inst Oswaldo Cruz 2008; 103: 578-84. [ Links ]
20. Araujo e Silva E, Andreotti R, Honer MR. Comportamento de Lutzomyia longipalpis, vetor principal da leishmaniose visceral americana, em Campo Grande, Estado do Mato Grosso do Sul. Rev Soc Bras Med Trop 2007; 40: 420-5. [ Links ]
21. Oliveira AG, Galati EA, Fernandes CE, Dorval ME, Brazil RP. Seasonal variation of Lutzomyia longipalpis (Lutz & Neiva, 1912) (Diptera: Psychodidae: Phlebotominae) in endemic area of visceral leishmaniasis, Campo Grande, state of Mato Grosso do Sul, Brazil. Acta Trop 2008; 105: 55-61. [ Links ]
22. Salomón OD, Rossi GC, Spinelli GR. Ecological Aspects of Phelobotomine (Diptera, Psychodidae) in an Endemic Area of Tegumentary Leishmaniasis in the Northeastern Argentina, 1993-1998. Mem Inst Oswaldo Cruz 2002; 97: 163-8. [ Links ]
23. Salomón OD, Rossi GC, Cousiño B, et al. Phlebotominae Sand Flies in Paraguay. Abundance Distribution in the Southeastern Region. Mem Inst Oswaldo Cruz 2003; 98: 185-90. [ Links ]
24. Salomón OD, Sosa-Estani S, Ramos K, et al. Tegumentary leishmaniasis outbreak in Bella Vista City, Corrientes, Argentina during 2003. Mem Inst Oswaldo Cruz 2006; 101: 767-74. [ Links ]
25. Salomón OD, Mocarbel NJ, Pedroni E, Colombo J, Sandillú M. Phlebotominae: vectores de leishmaniasis en las provincias de Santa Fe y Entre Ríos, Argentina. Medicina (Buenos Aires) 2006; 66: 220-4. [ Links ]
26. Oliveira AL, Paniago AM, Dorval ME, Oshiro ET, Leal CR, Sanches M, Cunha RV, Bóia MN. Foco emergente de leishmaniose visceral em Mato Grosso do Sul. Rev Soc Bras Med Trop 2006; 39: 446-50. [ Links ]
27. Ministério de Saúde. Manual de vigilância e controle da Leishmaniose Visceral. Brasilia: Ministério da Saúde, Secretaría de Vigilancia em Saúde. 2006. [ Links ]
28. Cousiño B. Vigilancia y control de la leishmaniasis en Paraguay. En: Panaftosa (ed). Consulta de Expertos OPS/OMS sobre Leishmaniasis Visceral en las Américas. Informe final. Rio de Janeiro: Panaftosa/OPS Ed, 2006, p 34-6. [ Links ]
29. Maciel JD. Paraguay. En: Organización Panamericana de la Salud (ed). Informe de reunión de coordinadores de Programa Nacional de Leishmaniasis, 4-6 de junio del 2008, Medellín (Colombia). Brasilia: OPS Ed, 2008, p 32-3. [ Links ]
30. de Oliveira AG, Falcão AL, Brazil RP. Primeiro encontro de Lutzomyia longipalpis (Lutz & Neiva, 1912) na área urbana de Campo Grande, MS, Brasil Rev Saude Publica 2000; 34: 654-5. [ Links ]
31. de Oliveira AG, Andrade Filho JD, Falcão AL, Brazil RP. Estudo de flebotomíneos (Diptera, Psychodidae, Phlebotominae) na zona urbana da Cidade de Campo Grande, Mato Grosso do Sul, Brasil, 1999-2000. Cad Saúde Pública 2003; 19 : 933-44. [ Links ]
32. Mestre GLC, Fontes CJF. A expansão da epidemia da leishmaniose visceral no Estado de Mato Grosso, 1998- 2005. Rev Soc Bras Med Trop 2007; 40: 42-8. [ Links ]
Recibido: 1-4-2009
Aceptado: 23-7-2009














