Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Medicina (Buenos Aires)
Print version ISSN 0025-7680
Medicina (B. Aires) vol.70 no.6 Ciudad Autónoma de Buenos Aires Nov./Dec. 2010
ARTÍCULO ORIGINAL
Evaluación bioquímica de trabajadores rurales expuestos a pesticidas
María Fernanda Simoniello1,2, Elisa C. Kleinsorge1, Marta A. Carballo2
1Cátedra de Toxicología, Farmacología y Bioquímica Legal, FBCB, UNL, Ciudad Universitaria, Santa Fe,
2CIGETOX, Citogenética Humana y Genética Toxicológica, INFIBIOC, Departamento de Bioquímica Clínica, FFyB, Universidad de Buenos Aires
Dirección postal: Prof. Bioq. María Fernanda Simoniello, Cátedra de Toxicología, Farmacología y Bioquímica Legal, FBCB, UNL, Ciudad Universitaria, 3000 Santa Fe, Argentina. Fax: (54-0342) 4575206 Int. 155 e-mail: fersimoniello@yahoo.com.ar
Resumen
Los pesticidas utilizados en agricultura pueden representar un riesgo potencial para la salud de los agricultores expuestos y para el medio ambiente. El objetivo de este trabajo fue evaluar trabajadores frutihortícolas expuestos a plaguicidas, categorizados por: exposición directa (n = 45), exposición indirecta (n = 50) y controles (n = 50) mediante biomarcadores de exposición y efecto: colinesterasa (ChE), acetilcolinesterasa (AChE), catalasa (CAT), peroxidación de lípidos (TBARS), Indice de Daño Ensayo Cometa (IDEC) e Indice de Daño Ensayo Reparación (IDER). Los resultados indican: a) inhibición significativa de AChE (p < 0.001) en expuestos directos e indirectos; b) aumento en los niveles de TBARS (p < 0.001) en los directos; c) reducción de CAT significativa (p < 0.01) y d) aumento de IDEC e IDER (p < 0.001) en ambos grupos. Los resultados obtenidos reflejan modificaciones en el balance oxidativo junto con daño al ADN en los trabajadores estudiados. Estos hallazgos representan una contribución en la evaluación subclínica de exposición a agroquímicos en nuestro país.
Palabras clave: Estrés oxidativo; Genotoxicidad; Plaguicidas
Abstract
Biochemical evaluation on rural workers exposed to pesticides. Pesticides are used in agriculture to protect crops but may represent a potential risk to farmers and the environment. The aim of this work was to evaluate horticultural workers exposed to pesticide, categorized by: direct exposure (n = 45), indirect exposure (n = 50) and controls (n = 50) using exposure and effect biomarkers: cholinesterase (ChE), acetylcholinesterase (AChE), catalase (CAT), lipid peroxidation (TBARS), Damage Index Comet Assay (IDEC) and Damage Index Repair Assay (IDER). Our results show: a) an AChE inhibition in directly and indirectly exposed population (p < 0.001), b) significant increase in the levels of TBARS in direct exposure (p < 0.001), c) the CAT reduction was significant (p < 0.01), d) a significant increase in IDEC and IDER in both exposed groups (p < 0.001). Our results evidence variations in oxidative balance and DNA damage in exposed workers. These findings represent a contribution to the sub-clinical evaluation of subjects exposed to agrochemicals in our country.
Key words: Oxidative stress; Genotoxicity; Pesticides
Los plaguicidas se han convertido en imprescindibles en agricultura intensiva para mejorar la producción, proteger los cultivos almacenados y controlar los vectores de enfermedades. Aunque el uso de plaguicidas es necesario, resulta fundamental evaluar los riesgos para la salud en los seres humanos que están profesional y/o ambientalmente expuestos a estos agroquímicos. Esta exposición puede ocurrir durante la preparación de la mezcla, en el procesamiento de carga y/o lavado de los equipos de fumigación y en el momento de su aplicación1, 2. La exposición crónica a los plaguicidas se encuentra asociada a daños en la salud que incluyen neurotoxicidad, efectos carcinogénicos e inmunológicos, alteraciones de la reproducción y el desarrollo3. Estos hallazgos se encuentran descriptos en individuos que están expuestos frecuentemente a diferentes mezclas de pesticidas, ya sea simultáneamente o en serie, lo que hace difícil identificar los efectos de cada pesticida en forma individual.
La exposición a un agente químico, a partir de una concentración determinada, provoca una sucesión de respuestas que pueden evolucionar hacia un estado de enfermedad. La llegada del agente químico o su metabolito a un sitio biológico crítico puede provocar cambios reversibles o irreversibles y conducir a situaciones patológicas, pero en determinados escenarios no es suficiente valorar el riesgo químico al que están expuestos los trabajadores midiendo los niveles ambientales de las sustancias químicas y comparando los efectos tóxicos observados en el hombre en contacto con ellas.
Por otra parte, la medición del xenobiótico o sus metabolitos en medios biológicos del organismo no siempre es posible, debido a los requerimientos técnicos de la cuantificación, la exposición a mezclas de sustancias, la frecuencia y la duración de la exposición, entre otros factores.
Los exámenes de control y vigilancia ocupacionales investigan la exposición de los trabajadores a una variedad de productos químicos, biológicos o físicos para determinar si el resultado de dichas exposiciones implica un mayor riesgo de efectos adversos para la salud, utilizando biomarcadores de exposición y de efecto como herramientas fundamentales en la detección de acciones deletéreas sobre los organismos vivos.
Dentro de los biomarcadores de efecto se encuentran los de genotoxicidad que permiten establecer la interacción del xenobiótico con el material genético e indicar precozmente posibles daños en el ADN. En los últimos años se han estudiado varios biomarcadores y se han desarrollado técnicas que se convirtieron en nuevas herramientas para la evaluación de riesgo a la salud en diferentes áreas (ambiental, ocupacional, ecotoxicológica, etc.). Entre ellos se destaca el ensayo de electroforesis de una sola célula o Ensayo Cometa, que desde su creación hace 20 años, se ha empleado en epidemiología molecular como un biomarcador robusto en poblaciones humanas expuestas a un potencial riesgo. La capacidad de controlar poblaciones numerosas es una ventaja importante del ensayo que permite realizar evaluaciones a gran escala. Aunque este ensayo es capaz de evaluar daño en el ADN, aún son necesarios estudios adicionales para identificar los mecanismos moleculares que subyacen en el daño detectado4.
Los pesticidas son un grupo de agentes químicos capaces de actuar como pro-oxidantes y a nivel del material genético, generando efectos nocivos en diversos tejidos y órganos.
El objetivo de nuestro trabajo fue determinar la existencia de daño al ADN (evaluado a través del Ensayo Cometa) y encontrar una posible relación entre ese daño y las modificaciones en el equilibrio oxidativo (catalasa y peroxidación de lípidos) así como con otros biomarcadores utilizados en las exposiciones a organofosforados y metilcarbámicos (enzimas colinesterasas) en grupos de individuos expuestos laboralmente a mezclas de agroquímicos, en la provincia de Santa Fe, Argentina.
Materiales y métodos
El Comité de Etica del Hospital Provincial Dr. José M. Cullen de Santa Fe, estableció los reglamentos para el desarrollo del estudio y el consentimiento informado fue obtenido de cada uno de los participantes previo al inicio del estudio.
Los participantes en el estudio respondieron a un cuestionario destinado a reunir información sobre: a) datos demográficos (edad, sexo, etc.); b) estilo de vida (alimentación, hábito de fumar, consumo de alcohol y de medicamentos); c) datos laborales (horas de trabajo/día, años de exposición, uso de medidas de protección, etc.) y d) plaguicidas empleados.
En este estudio participaron 145 personas que fueron evaluadas en dos etapas. En una primera aproximación de tipo transversal se estudió una población que por su actividad productiva hortícola se hallaba expuesta a pesticidas utilizando el Ensayo Cometa y Ensayo de Reparación, actividad de colinesterasa plasmática y eritrocitaria. En la segunda etapa y también mediante un estudio transversal, en una población con características socio-demográficas y laborales similares, se amplió el conjunto de indicadores con las determinaciones de peroxidación de lípidos y CAT como marcadores del balance oxidativo.
En la primera parte del estudio (Grupo A), participaron 84 trabajadores frutihortícolas divididos en tres subgrupos. El primer subgrupo consistió de 27 aplicadores de plaguicidas (expuestos directos), un segundo subgrupo formado por 27 trabajadores hortícolas que no fumigaban (expuestos indirectos). El subgrupo control consistió de 30 personas sin antecedentes de exposición laboral a plaguicidas o cualquier otro agente genotóxico potencial, provenientes de la misma área de estudio.
En la segunda etapa del estudio (Grupo B), se incluyó a 61 trabajadores frutihortícolas también divididos en tres subgrupos: 18 aplicadores (expuestos directos), 23 trabajadores rurales (expuestos indirectos) y un subgrupo control de 20 personas en las que se consideraron los mismos factores de inclusión del grupo control anterior.
La muestra de sangre (10 ml de sangre heparinizada) fue dividida en dos tubos (5 ml cada uno), conservados a 4° C y procesados dentro de las dos primeras horas.
Previo al Ensayo Cometa se determinó viabilidad celular (naranja de acridina y bromuro de etidio), en un mínimo de 200 células por muestra registrando el número de células viables y células no-viables5.
En el Ensayo Cometa Alcalino se utilizó el procedimiento estándar originalmente descrito por Singh y col.6, con modificaciones. Se realizó una dilución 1:20 de la sangre entera con RPMI 1640, se centrifugó y con el sedimento se realizaron dos preparados por cada muestra. Se incluyeron en cada corrida controles internos tanto negativos como positivos (H2O2, 50 μM). Brevemente, las células a investigar se embebieron en agarosa de bajo punto de fusión al 1% y se colocaron sobre portaobjetos previamente acondicionados con agarosa de punto de fusión normal. Los vidrios así preparados se sumergieron en una solución salina que contiene detergentes y que asegura la lisis celular (2.5 M NaCl, 100 mM EDTA, 10 mM Tris-HCl, pH 10.1% tritón X-100, y 10% dimetil sulfoxido). Luego de una hora, los vidrios se sumergieron en una solución altamente alcalina por 20 minutos (300 mM NaOH, 1 mM EDTA, pH >13) con el objeto de lograr el desenrollamiento de la cadena de ADN. Se realizó posteriormente la electroforesis horizontal en el mismo buffer para lograr la migración de los fragmentos de ADN en función del campo eléctrico a 0.7 v/cm por 20 minutos. La etapa de neutralización se realizó con 0.4 M Tris-HCl (pH 7.5). Los preparados fueron teñidos con 50 μl de bromuro de etidio (2 μg/μl) para realizar la etapa de conteo, y se analizaron 100 células en cada uno de los dos geles duplicados en una escala de 1-4 (categorías en función de nivel de daño que presentaba el ADN, no incluyendo la categoría 0). La puntuación total, entre 100 y 400 unidades arbitrarias, se relaciona con la frecuencia de las roturas del ADN7. Se calculó el Índice de Daño Ensayo Cometa (IDEC) para cada muestra.
Para evaluar diferentes grados de daño en el ADN se realizó el Ensayo de Reparación del ADN8. Una dilución de sangre entera en RPMI 1640 (1:20) fue mezclada con H2O2 10 μM por 10 min a 37 °C para generar daño oxidativo en el ADN. Se detuvo la reacción agregando DMSO 1%. Las células se centrifugaron, se lavaron y resuspendieron en RPMI y suero fetal bovino al 10%. Se incubaron 30 minutos a 37 °C para generar procesos de reparación. Posteriormente, las células se mantuvieron en hielo para inhibir la reparación del ADN. Se realizaron dos preparados por muestra y se continuó con el Ensayo Cometa de la manera previamente descripta. Se calculó el Índice de Daño Ensayo Reparación (IDER).
La actividad de la acetilcolinesterasa en eritrocitos (AChE: CE 3.1.1.7) se obtuvo midiendo la velocidad de hidrólisis de Ioduro de acetiltiocolina (sustrato) de eritrocitos lavados (dilución 1:10 en agua destilada) por la reacción de ioduro de tiocolina con ácido ditionitrobenzoico (DTNB) a pH 7.6; 25 °C, a 405 nm9. Se expresó como U/l eritrocitos.
La colinesterasa plasmática (ChE: CE 3.1.1.8) fue evaluada por la tasa de hidrólisis de butiriltiocolina (sustrato) en plasma por la reacción de ioduro tiocolina con DTNB a pH 7.6; 25 °C, a 405 nm9. La actividad de la enzima se expresó como KU / l.
La determinación de hemoglobina se realizó por el método de Drabkin contra curva estándar.
La actividad de catalasa (CE 1.11.1.6) en los eritrocitos hemolizados se midió mediante la valoración espectrofotométrica de la disminución de la concentración de H2O2 a 240 nm, 25 °C durante 60 segundos10.
Como marcador de la peroxidación de lípidos en los glóbulos rojos se empleó la determinación de sustancias reactivas con el ácido tiobarbitúrico (TBARS) que mide la formación del color producido durante la reacción del ácido tiobarbitúrico con malondialdehído, principal producto de la peroxidación de lípidos, según el método de Buege y Aust11 a 535 nm.
Todos los experimentos se llevaron a cabo por duplicado. La distribución de las variables se evaluó por el test de Kolmogorov-Smirnov. Se utilizó el test de Dunnet para realizar las comparaciones de ambos grupos expuestos con respecto al grupo control, el test de Mann-Whitney para comparar las características demográficas de las poblaciones estudiadas. El nivel crítico para el rechazo de la hipótesis nula se consideró un valor de p del 5%, con dos colas. Todos los análisis se realizaron con software estadístico (SPSS 11.5 para Windows).
Resultados
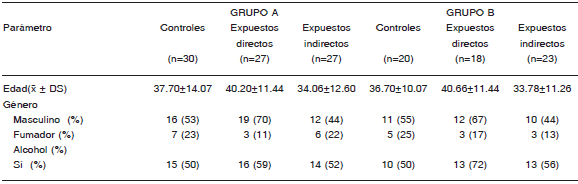
Las dos etapas de este trabajo están representadas por los grupos A y B. Las características demográficas de ambos grupos, tanto expuestos como controles, se muestran en la Tabla 1. La viabilidad celular evaluada, fue en todos los casos mayor al 85% y expresada como un porcentaje de células vivas.
TABLA 1.- Características demográficas de los controles y de los trabajadores expuestos directa e indirectamente a pesticidas de ambos grupos evaluados
Los niveles (media ± desvío estándar) de las actividades de AChE y ChE para el grupo A y el B se presentan en la Fig. 1. Las determinaciones de los ensayos Cometa y de Reparación para el grupo A y el B, se muestran en detalle en la Fig. 2 y la actividad de CAT y los ensayos de TBARS del grupo B en las Figs. 3 y 4 respectivamente. Las evaluaciones estadísticas de ambos grupos expuestos se comparan en todos los casos frente a su población control (test de Dunnet).
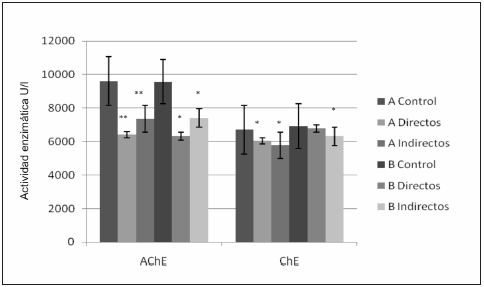
Fig. 1.- Actividad de las enzimas acetilcolinesterasa (AChE) y colinesterasa plasmática (ChE) en los Grupos A y B de controles, expuestos directos e indirectos. Test de Dunnett * p < 0.001.

Fig. 2.- Indice de daño, ensayo cometa (IDEC) e índice de daño, ensayo reparación (IDER) de los Grupos A y B en controles, expuestos directos e indirectos. Test de Dunnett *** p < 0.001.
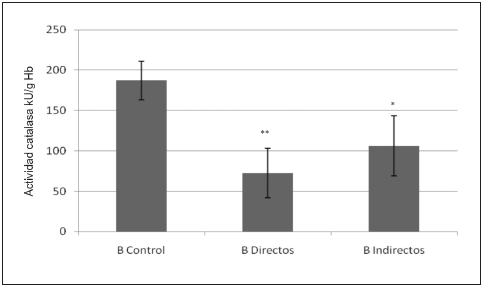
Fig. 3.- Actividad de catalasa del grupo B de controles, expuestos directos e indirectos. Test de Dunnett *p = 0.005; **p < 0.001.

Fig. 4.- Determinación de sustancias reactivas con ácido tiobarbitúrico (TBARS) del grupo de de controles, expuestos directos e indirectos. Test de Dunnett ** p < 0.001.
Analizando los resultados del grupo A (Fig. 1), se observa que ambos subgrupos de trabajadores expuestos mostraron una disminución significativa para AChE: 33% en los aplicadores y del 23% para los trabajadores rurales (p < 0.001 en ambos casos) y el descenso para ChE fue del 9.8 % en los expuestos directos y de 14% para los indirectos (p = 0.003 y p = 0.08). Por otra parte, en la Fig. 2 se observa un aumento de IDEC del 90% y 95% (directos e indirectos respectivamente) así como de IDER 88% y 93% en ambos subgrupos expuestos, en comparación con los controles (p < 0.001 en todos los casos). En el grupo B (Fig. 1), se observa una inhibición de AChE del 34% en los aplicadores y de 22% en los trabajadores agrícolas (p < 0.001) y una significativa disminución del 8.5% ChE (p = 0.03) sólo en el grupo de expuestos indirectos. El análisis de los valores obtenidos utilizando el Ensayo Cometa y el Ensayo de Reparación para el mismo grupo B (Fig. 2) indican un aumento significativo del 82% y 92% (en directos e indirectos) para IDEC, y de 81% y 89% para IDER (P < 0.001) cuando se compara ambos subgrupos con respecto al grupo control.
En la Fig. 3 se observa que en el grupo B la reducción de CAT fue del 47% en los directos (p < 0.001) y un 23% en el grupo expuesto indirectamente (p = 0.005). Además, se muestra en la Fig. 4 un aumento significativo del 27% en los niveles de TBARS en los aplicadores de plaguicidas (p < 0.001), pero no se observaron diferencias significativas en el grupo expuesto indirectamente (p > 0.05).
En el grupo A, cuando analizamos tanto IDEC como IDER en los aplicadores de plaguicidas (expuestos directos), no se observan diferencias estadísticamente significativas en relación con los factores de confusión como edad, sexo, tabaquismo y consumo de alcohol (Tabla 2). Debido a que el 93% de los trabajadores expuestos a plaguicidas utilizan un solo tipo de elemento de protección durante la preparación y aplicación de plaguicidas (guantes, máscaras de respiración, gafas, ropa protectora, botas, etc.) y ninguno utilizaba la protección completa, hemos considerado que han utilizado medidas protectivas (equipo de protección personal: EPP) cuando al menos 2 elementos de protección estaban presentes. Cuando se utiliza como factor de comparación el uso de EPP (Tabla 2) se puede observar una diferencia significativa (p < 0.05).
TABLA 2.- Valores de media ± desvío estándar de los ensayos Cometa y de Reparación (IDEC e IDER) para el Grupo A en función de los factores de confusión

Ensayo Cometa (IDEC); Ensayo de Reparación (IDER). EPP: equipo de protección personal
* p < 0.05 Test de Mann-Whitney
Cuando se evalúan los datos relacionados con los trabajadores rurales que no fumigan (expuestos indirectos), tampoco se detectan diferencias estadísticamente significativas en relación a los factores de confusión analizados (p > 0.05).
Considerando los mismos factores de confusión para este Grupo A pero para las variables AChE y ChE, las comparaciones no muestran diferencias significativas para ninguna de las variables de confusión evaluadas (p > 0.05). En la Tabla 3 se resumen los datos de las variables estudiadas estratificadas por factores de confusión en los aplicadores del Grupo B (expuestos directos). En tanto, en la Tabla 4 se exponen los correspondientes datos de los expuestos indirectos del mismo grupo.
TABLA 3.- Valores de la media ± desvío estándar de las actividades de AChE, ChE, y CAT y de los ensayos de TBARS, Cometa y de Reparación para los expuestos directos del grupo B estratificados por factores de confusión

AChE (U/l eritrocitos); ChE (U/l); CAT (kU/g Hb); TBARS (nmol/g Hb); Ensayo Cometa (IDEC); Ensayo de Reparación (IDER). EPP: equipo de protección personal.
* p<0.05 test de Mann-Whitney
TABLA 4.- Valores de la media ± desvío estándar de las actividades de AChE, ChE, y CAT y de los ensayos de TBARS, Cometa y de Reparación para los expuestos indirectos del grupo B estratificados por factores de confusión

AChE (U/l eritrocitos); ChE (U/l); CAT (kU/g Hb); TBARS (nmol/g Hb); Ensayo Cometa (IDEC); Ensayo de Reparación (IDER).
* p<0.05 test de Mann-Whitney
Cuando se compararon los datos obtenidos de ambos subgrupos expuestos (directos e indirectos) para las variables: AChE, ChE, IDEC e IDER para ambos grupos A y B, no se hallaron diferencias estadísticamente significativas en relación con la agrupación (p > 0.05; Figs. 1 y 2).
A través de los cuestionarios se identificaron los plaguicidas más utilizados por los trabajadores expuestos, tanto del grupo A como del B y son presentados en la Tabla 5.
TABLA 5.- Lista de pesticidas utilizados en el área de estudio

*Número registrado CAS (Chemical Abstract Service) de identificaciòn para compuestos quìmicos.
Discusión
En el enfoque epidemiológico molecular, la medición de biomarcadores moleculares o celulares como indicadores del riesgo de enfermedad o de exposición, tiene aplicaciones en los estudios de exposición ambiental y ocupacional12. El propósito principal de utilizar biomarcadores es la vigilancia, esto es la identificación de personas o poblaciones en riesgo, para permitir la aplicación de medidas preventivas o correctivas13.
Con el objeto de describir exposición a plaguicidas se utilizan una serie de parámetros que permiten circunscribir su efecto, tales como el consumo de plaguicidas (kg/año), la cantidad de productos químicos tóxicos que se utilizan, el número total de las formulaciones de plaguicidas utilizados, la extensión de las áreas de aplicación de plaguicidas, las condiciones de trabajo, la magnitud de la exposición, el uso de medidas de protección y las posibilidades concretas de evaluaciones de genotoxicidad de los plaguicidas empleados. Además, el tipo de cultivo y los factores ambientales pueden influir en la clase de formulaciones de plaguicidas utilizados, así como en la absorción química14.
La evaluación de exposición a plaguicidas individuales en exámenes de vigilancia en humanos es muy difícil porque la mayoría de los modelos agrotécnicos implican el uso regular de un gran número de pesticidas diferentes, junto con otros productos químicos como los coadyuvantes, que varían mucho en su toxicidad potencial15. Al considerar las mezclas de pesticidas utilizados en este estudio (Tabla 5) e intentar evaluar esos riesgos desde una perspectiva de salud pública, es necesario valorar si los productos químicos en una mezcla interactúan para causar ya sea un aumento o una respuesta general distinta, en comparación con la suma de las respuestas de los productos químicos presentes en la mezcla, o si el efecto global es simplemente una suma del efecto esperado de cada producto químico16.
Aunque varios estudios indican que los aplicadores representan el grupo más expuesto de los trabajadores agrícolas14, en nuestro estudio los trabajadores rurales no-aplicadores se incluyeron en el grupo expuesto, ya que estuvieron presentes durante todas las actividades agrícolas, incluidas las de aplicaciones de los plaguicidas. En la actividad agrícola, la inhalatoria y la cutánea constituyen importantes vías de ingreso de los plaguicidas y es necesario también considerar que la exposición puede fluctuar en intensidad en función de las obligaciones laborales de los trabajadores17. Además, algunas investigaciones han estimado la asimilación para-ocupacional considerando que los productos agroquímicos se movilizan desde los sitios de aplicación a las viviendas, ya sea por proximidad o por utilizar sus hogares como depósito18. En nuestro estudio hemos comprobado que los trabajadores agrícolas viven en la proximidad de los cultivos donde los productos son aplicados, los transportan en su cuerpo y sus ropas al hogar, ya que en algunos casos carecen de instalaciones sanitarias adecuadas, lo que prolonga el tiempo de exposición.
Diferentes investigaciones reconocen el papel de la AChE en la vigilancia de los trabajadores rurales en situación de alto riesgo de exposición a plaguicidas organofosforados y metilcarbámicos3. Puesto que ambos grupos han estado expuestos a mezclas de plaguicidas (inhibidores de colinesterasas y no inhibidores), el empleo único del examen de la actividad de las colinesterasas es insuficiente, y además se debe considerar la variación inter individual en la actividad enzimática19, 20 .
El Ensayo Cometa se ha utilizado para determinar el alcance de los daños al ADN en leucocitos de los trabajadores ocupacionalmente expuestos a una gran variedad de plaguicidas21, 22, 23. Nuestros resultados muestran (Fig. 2) que los aplicadores de plaguicidas y los trabajadores agrícolas presentaron un aumento significativo de IDEC en comparación con los sujetos control (p < 0.0001 en ambos grupos). Nuestro estudio además reveló índices similares en el Ensayo Cometa tanto en expuestos directos (aplicadores) como en expuestos indirectos (no-aplicadores), de acuerdo con estudios previos24.
El Ensayo de Reparación evalúa la sensibilidad de los linfocitos al ataque oxidativo por H2O2 in vitro. Si bien existió un incremento significativo de IDER respecto a los controles en los subgrupos expuestos, cuando analizamos cada población por separado, antes y después de la exposición a peróxido in vitro, el resultado de los procesos de reparación, tanto de los subgrupos expuestos como de los controles, para ambas poblaciones, no mostró diferencias estadísticamente significativas entre IDEC y su respectivo IDER (Fig. 2). Palus y col.25, informaron una reducción significativa en el número de células con daño en el ADN después de un proceso de reparación más prolongado (1 hora) en trabajadores de una fábrica de muebles de madera. Piperakis y col.26, 27, observaron que la eficacia de la reparación fue similar en los trabajadores agrícolas expuestos a pesticidas, coincidiendo con nuestros resultados.
Cuando se analiza la influencia de los factores de confusión de los grupos A y B sobre los efectos genotóxicos (IDEC e IDER) en las Tablas 3, 4 y 5, no se observan diferencias significativas teniendo en cuenta edad, sexo, tabaquismo y consumo de alcohol, pero sí se comprobó una diferencia significativa (p < 0.05 en el grupo A y p = 0.05 en el B) cuando se incorpora el EPP en la comparación. Los resultados de genotoxicidad positiva observados en los expuestos de este estudio, podrían deberse a las escasas medidas de protección (máscara, anteojos, vestimenta adecuada, guantes o botas). Por ejemplo, se ha informado un aumento de la frecuencia de micronúcleos en personas expuestas a plaguicidas que no usaban guantes28, aumento de aberraciones cromosómicas y de frecuencia de micronúcleos en un estudio de población portuguesa expuesta a plaguicidas que no usaban la protección recomendada24, así como en estudios previos realizados en nuestro país, en trabajadores con escasa o nula protección29. La importancia del EPP para prevenir los daños genotóxicos por exposición se comprobó en estudios donde la mayoría de los trabajadores utilizaron las medidas de protección (> 60%) y los resultados fueron negativos26, 27, 30-32.
Un mecanismo importante en la producción de daño por diferentes plaguicidas es el desbalance oxidativo sobre diferentes blancos moleculares1, 33. En nuestro estudio hallamos que la actividad de CAT disminuye significativamente en los grupos de aplicadores y no aplicadores de plaguicidas (p < 0.001 y p = 0.005, respectivamente). Los datos disponibles sobre animales de experimentación34, estudios in vitro35, 36 y estudios in vivo37, 38, indican que las enzimas asociadas al mecanismo de defensa antioxidante se modifican bajo la influencia de algunos plaguicidas. Estas enzimas actúan eficazmente sobre los radicales libres tóxicos y son en parte responsables de la protección frente a la peroxidación de lípidos33.
El elevado nivel de TBARS observado en este trabajo podría deberse a un aumento de peroxidación de membranas y/o una disminución de la actividad antioxidante, causada por la exposición a las mezclas de plaguicidas. Diversos estudios comprobaron que ciertos compuestos organofosforados inducen estrés oxidativo, que se manifiesta con el aumento de la producción de malondialdehído1, 35, 39, 40. Además, se ha propuesto que los carbamatos pueden inducir daño oxidativo mediante la generación de radicales libres y la alteración de enzimas antioxidantes o enzimas barredoras de radicales libres34, 41. Algunos piretroides afectan el flujo de membrana eritrocitaria y este aumento es debido a la peroxidación de lípidos42-44. Es probable que la producción de anión superóxido de los piretroides tenga una acción directa sobre la producción de glutation peroxidasa y ésta podría ser la causa del daño oxidativo28, 45.
Analizando los indicadores del balance oxidativo y los factores de confusión, se encontró correlación entre el consumo de alcohol y CAT en los aplicadores del grupo B, resultados que coinciden con otro estudio en el que analizan el desbalance oxidativo con el consumo de alcohol y pesticidas46. Por otra parte, también se encontró correlación significativa entre la edad y la actividad de CAT en los trabajadores expuestos indirectamente; esto podría deberse a que los efectos nocivos de los radicales libres producidos durante el metabolismo aeróbico que causan daños al ADN, lípidos y proteínas se acumulan en el tiempo47.
Nuestro estudio muestra que los trabajadores directa e indirectamente expuestos a plaguicidas tienen alteraciones enzimáticas, modificaciones en el equilibrio oxidativo y daño genotóxico, en las condiciones de este diseño experimental. Sería importante ampliar el tamaño de la muestra y realizar seguimientos sistemáticos de las poblaciones expuestas a mezclas de plaguicidas utilizando biomarcadores de exposición y efecto en nuestro país, Argentina, con vastas áreas destinadas a la producción agrícola.
Agradecimientos: Por su invaluable colaboración en este trabajo, los autores agradecen especialmente a J. Scagnetti, C. Mastandrea, R. Grigolato, G. Poletta y A. Paonessa.
Marta Ana Carballo agradece a UBACyT B034/PICT 38238, María Fernanda Simoniello y Elisa Carlotta Kleinsorge agradecen a CAI+D UNL PI 09-50.
Conflictos de interés: Los autores declaran que no existen conflictos financieros o personales que hayan influenciado inapropiadamente en su trabajo.
1. Prakasam AS, Sethupathy S, Lalitha S. Plasma and RBCs antioxidant status in occupational male pesticide sprayers. Clin Chim Acta 2001; 310: 107-12. [ Links ]
2. Abdollahi M, Ranjbar A, Shadnia S, Nikfar A, Rezaie A. Pesticides and oxidative stress: a review. Med Sci Moni 2004; 10: 141-7. [ Links ]
3. Mc Cauley LA, Anger WK, Keifer M, Langley R, Robson MG, Rohlman D. Studying Health Outcomes in Farmworker Populations Exposed to Pesticides. Health Perspect 2006; 114: 953-60. [ Links ]
4. Valverde M, Rojas E. Environmental and occupational biomonitoring using the Comet assay. Mutat Res 2009; 681: 93-109. [ Links ]
5. Mercille S, Massie B. Induction of apoptosis in nutrient-deprived cultures of hybridoma and myeloma cells. Biotech Bioeng 1994; 44: 1140-54. [ Links ]
6. Singh NP, McCoy MT, Tice RR, Schneider EL. A simple technique for quantification of low levels of DNA damage in individuals cells. Cell Res 1988; 175: 184-91. [ Links ]
7. Rodríguez Ferreiro G, Cancino Badias L, López-Nigro M, et al. DNA single strand breaks in peripheral blood lymphocytes induced by three nitroimidazole derivates. Toxicol Lett 2002; 132: 109-15. [ Links ]
8. Bowden RD, Buckwalter MR, McBride JF, Johnson DA, Murray BK, O'Neill KL. Tail proûle: a more accurate system for analyzing DNA damage using the Comet assay. Mutat Res 2003; 537: 1-9. [ Links ]
9. Ellman GL, Curtney KD, Andrews V, Featherstone RM. A new and rapid colorimetric determination of acetyl cholinesterase activity. Biochem Pharmacol 1961; 7: 88-95. [ Links ]
10. Aebi H. Catalase in vitro. Method Enzymol 1984; 105: 121-6. [ Links ]
11. Beuge JA, Aust SD. Microsomal lipid peroxidation. Method Enzymol 1978; 52: 302-10. [ Links ]
12. Collins AR, Dusinska M. Applications of the Comet Assay in Human Biomonitoring. In: Dhawan A, Anderson D (eds).The Comet Assay in Toxicology. Ed. Cambridge, U.K.: RSC Publishing, 2009, p 201-27. [ Links ]
13. De Zwart L, Meerman JHN, Commandeur JNM, Vermeulen NPE. Biomarkers of free radical damage applications in experimental animals and in humans. Free Radic Biol Med 1999; 26: 202-26. [ Links ]
14. Bolognesi C. Genotoxicity of pesticides: a review of human biomonitoring studies. Mutat Res 2003; 543: 251-72. [ Links ]
15. Bull S, Fletcher K, Boobis AR, Battershill JM. Evidence for genotoxicity of pesticides in pesticide applicators: A review. Mutagenesis 2006; 21: 93-103. [ Links ]
16. Hughes I, Wood HF. Risk assessment of mixtures of pesticides and similar substances. Committee on Toxicity of Chemicals in Food, Consumer Products and the Environment. Hughes I, Wood HF. (eds), Food Standards Agency Press, 2002. [ Links ]
17. Jakubowski M, Trzcinka-Ochocka M. Biological monitoring of exposure: trends and key developments. J Occup Hlth 2005; 47: 22-48. [ Links ]
18. Curl C, Fenske R, Kissel J, et al. Evaluation of take-home organophosphorus pesticide exposure among agricultural workers and their children. Environ Hlth Perspect 2002; 110: 787-92. [ Links ]
19. Panemangalore M, Dowla HA, Byers ME. Occupational exposure to agricultural chemicals: effect on the activities of some enzymes in the blood of farm workers. Int Arch Occup Environ Health 1999; 72: 84-8. [ Links ]
20. Hernández AF, Gómez MA, Vidal Pérez JV, et al. Influence of exposure to pesticides on serum components and enzyme activities of cytotoxicity among intensive agriculture farmers. Environ Res 2006; 102: 70-6. [ Links ]
21. Garaj-Vrhovac V, Zeljezic D. Evaluation of DNA damage in workers occupationally exposed to pesticides using single-cell gel electrophoresis (SCGE) assay Pesticide genotoxicity revealed by Comet assay. Mutat Res 2000; 469: 279-85. [ Links ]
22. Shadnia S, Azizi E, Hosseinil R, et al. Evaluation of oxidative stress and genotoxicity in organophosphorus insecticide formulators. Hum Exp Toxicol 2005; 24: 439-45. [ Links ]
23. Remor AP, Totti CC, Moreira DA, Dutra GP, Heuser VD, Boeira JM. Occupational exposure of farm workers to pesticides: Biochemical parameters and evaluation. Environ Int 2009; 35: 273-8. [ Links ]
24. Costa C, Teixeira J, Silva S, et al. Cytogenetic and molecular biomonitoring of a Portuguese population exposed to pesticides. Mutagenesis 2006; 21: 343-50. [ Links ]
25. Palus J, Dziubaltowska E, Rydzynski K. DNA damage detected by the Comet assay in the white blood cells of workers furniture plant. Mutat Res 1999; 444: 61-74. [ Links ]
26. Piperakis SM, Petrakou E, Tsilimigaki S, et al. Biomonitoring with the Comet assay of Greek greenhouse workers exposed to pesticides. Environ Mol Mutagen 2003; 41: 104-10. [ Links ]
27. Piperakis SM, Kontogianni K, Piperakis MM, Tsilimigaki S. Effects of Pesticides on Occupationally Exposed Humans. Sci World Journal 2006; 6: 1211-20. [ Links ]
28. Bolognesi C, Perrone E, Landini E. Micronucleus monitoring of a Floriculturist population from western Liguria, Italy. Mutagenesis 2002; 17: 391-7. [ Links ]
29. Dulout FN, Pastori MC, Olivero OA, et al. Sisterchromatid exchanges and chromosomal aberrations in a population exposed to pesticides. Mutat Res 1985; 143: 237-44. [ Links ]
30. Pastor S, Gutierrez S, Creus A, Xamena N, Piperakis S, Marcos R. Cytogenetic analysis of Greek farmers using the micronucleus assay in peripheral lymphocytes and buccal cells. Mutagenesis 2001; 16: 539-45. [ Links ]
31. Pastor S, Creus A, Xamena N, Siffel C, Marcos R. Occupational exposure to pesticides and cytogenetic damage: results of a Hungarian population study using themicronucleus assay in lymphocytes and buccal cells. Environ Mol Mutagen 2002; 40: 101-9. [ Links ]
32. Bolognesi C, Landini E, Perrone E, Roggieri P. Cytogenetic biomonitoring of a floriculturist population in Italy: Micronucleus analysis by fluorescence in situ hybridization (FISH) with an all chromosome centromeric probe. Mutat Res 2004; 557: 109-17. [ Links ]
33. Banerjee BD, Seth V, Bhattacharya A, Pasha ST, Chakraborty AK. Biochemical effects of some pesticides on lipid peroxidation and free-radical scavengers. Toxicol Lett 1999; 107: 33-47. [ Links ]
34. Seth V, Banerjee BD, Chakravorty AK. Lipid peroxidation, free radical scavenging enzymes, and Glutathione Redox System in blood of rats exposed to Propoxur. Pest Biochem Phys 2001; 71: 133-9. [ Links ]
35. Gultekin F, Ozturk M, Akdogan M. The effect of organophosphate insecticide chlorpyrifos-ethyl on lipid peroxidation and antioxidant enzymes (in vitro). Arch Toxicol 2000; 74: 533-8. [ Links ]
36. Prasanthi K, Muralidhara, Rajini PS. Morphological and biochemical perturbations in rat erythrocytes following in vitro exposure to Fenvalerate and its metabolite. Toxicol in Vitro 2005; 19: 449-56. [ Links ]
37. Ranjbar A, Pasalar P, Abdollahi M. Induction of oxidative stress and acetylcholinesterase inhibition in organophosphorous pesticide manufacturing workers. Hum Exp Toxicol 2002; 21: 179-82. [ Links ]
38. Lopez O, Hernandez AF, Rodrigo L, et al. Changes in antioxidant enzymes in humans with long-term exposure to pesticides. Toxicol Lett 2007; 171: 146-53. [ Links ]
39. Altuntas I, Delibas N, Doguc DK, Ozmen S, Gultekin F. Role of reactive oxygen species in organophosphate insecticide phosalone toxicity in erythrocytes in vitro. Toxicol in Vitro 2003; 17: 153-7. [ Links ]
40. Catalgol BK, Ozden S, Alpertunga B. Effects of trichlorfon on malondialdehyde and antioxidant system in human erythrocytes. Toxicol in Vitro 2007; 21: 1538-44. [ Links ]
41. Dettbarn WD, Milatovic D, Gupta R. Oxidative Stress in Anticholinesterase-induced Excitotoxicity. In: Fishbein JC (ed). Toxicology of Organophosphate and Carbamate Compounds. Ed. Baltimore, USA: Elsevier. 2006; 511-32. [ Links ]
42. Kale M, Rathore N, John S, Bhatnagar D. Lipid peroxidative damage on pyrethroid exposure and alterations in antioxidant status in rat erythrocytes: a possible involvement of reactive oxygen species. Toxicol Lett 1999; 105: 197-205. [ Links ]
43. Gabbianelli R, Falcioni G, Nasuti C, Cantalamessa F. Cypermethrin-induced plasma membrane perturbation on erythrocytes from rats: reduction of fluidity in the hydrophobic core and in glutathione peroxidase activity. Toxicology 2002; 175: 91-101. [ Links ]
44. Nasuti C, Cantalamessa F, Falcioni G, Gabbianelli R. Different effects of Type I and Type II pyrethroids on erythrocyte plasma membrane properties and enzymatic activity in rats. Toxicology 2003; 191: 233-44. [ Links ]
45. El-Demerdash FM. Lambda-cyhalothrin-induced changes in oxidative stress biomarkers in rabbit erythrocytes and alleviation effect of some antioxidants. Toxicol in Vitro 2007; 21: 392-7. [ Links ]
46. Sivapiriya V, Jayanthisakthisekaran, Venkatraman. Effects of dimethoate (0,0-dimethyl S-methyl carbamoyl methyl phosphorodithioate) and ethanol in antioxidant status of liver and kidney of experimental mice. Pestic Biochem Phys 2006; 85: 115-21. [ Links ]
47. Valko M, Leibfritz D, Moncola J, Cronin MTD, Mazura M, Telser J. Review Free radicals and antioxidants in normal physiological functions and human disease. Int J Biochem Cell Biol 2007; 39: 44-84. [ Links ]
Recibido: 11-3-2010
Aceptado: 30-9-2010














