Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Medicina (Buenos Aires)
versión impresa ISSN 0025-7680
Medicina (B. Aires) vol.70 no.6 Ciudad Autónoma de Buenos Aires nov./dic. 2010
ARTÍCULO ORIGINAL
Relación entre paraoxonasa, otros componentes de HDL y estado inflamatorio en hemodiálisis
Ana Inés González1, Fernando Brites1, Alicia Elbert2, Leonardo Gómez-Rosso1, Gabriela Berg1, Regina Wikinski1, Laura Schreier1
1Laboratorio de Lípidos y Lipoproteínas, Departamento de Bioquímica Clínica, Facultad de Farmacia y Bioquímica - INFIBIOC, Universidad de Buenos Aires,
2CEREHA (Centro de Enfermedades Renales e Hipertensión Arterial), Provincia de Buenos Aires
Dirección postal: Dra. Ana Inés González, Facultad de Farmacia y Bioquímica, Junín 956, 1113 Buenos Aires, Argentina Fax: (54-11) 4508-3641 e-mail:anagonz@ffyb.uba.ar
Resumen
La enfermedad renal crónica (ERC) se asocia estrechamente con un estado pro-inflamatorio, aumento de lipoproteínas ricas en triglicéridos y disminución de HDL. La HDL contiene enzimas antioxidantes asociadas como la paraoxonasa (PON), cuya actividad en ERC se encuentra disminuida. Nuestro objetivo fue evaluar la relación entre la actividad de PON, apoA1, colesterol(col)-HDL y Proteína C reactiva-altamente sensible (PCR-as) como marcador de inflamación en pacientes en hemodiálisis. Se estudiaron n = 42 pacientes; edad, mediana (rango) = 50 (25-67) años; sexo M/F = 22/20; antigüedad de hemodiálisis = 4.4 ± 0.5 años; índice de masa corporal (IMC) = 23 ± 0.5 kg/m2. Se obtuvo una muestra de sangre después de 12 h de ayuno y se determinaron los parámetros clásicos del perfil lipídico, se midieron los valores de apoproteínas A1 y B, PON a través de su actividad arilesterasa y PCR-as, la cual permitió dividir a los pacientes con PCR-as ≤ 1 (bajo riesgo, rango: 0.1 a 1.0 mg/l) y > 1 mg/l (moderado y alto riesgo, 1.1 a 10.7 mg/l). Los niveles de triglicéridos, col-LDL y apoB no fueron diferentes entre los grupos. Los pacientes con PCR-as > 1 presentaron menor col-HDL (40 ± 2 mg/dl) y apoA1 (118 ± 4 mg/dl) que los pacientes con PCR-as ≤ 1 (50 ± 4 y 133 ± 5, respectivamente); p < 0.05. La PON fue menor en PCR-as > 1: 90.5 ± 24.0 μmol/ml.min que en PCR-as ≤ 1: 105.2 ± 18.0. Consecuentemente, se obtuvieron correlaciones inversas entre apoA1 y PCR-as, r = -0.381 p = 0.013 y entre PON y PCR-as, r = -0.32, p = 0.042. Además, el aumento de PCR-as correlacionó positivamente con el IMC, r = 0.318, p = 0.042. La disminución de col-HDL, apoA1 y PON en los individuos con mayor estado inflamatorio explicaría, en parte, el aumento de riesgo cardiovascular de estos pacientes, dado los efectos antiinflamatorios de la apoA1 y antioxidantes de la PON.
Palabras clave: Hemodiálisis; Inflamación; Lipoproteínas; HDL; Paraoxonasa
Abstract
Relation between paraoxonase activity, other HDL components and inflammatory conditions in hemodialyzed patients. Advanced Chronic Renal Disease (CKD) is closely associated with a pro-inflammatory condition, with an increase in triglyceride-rich lipoproteins and decrease in HDL level. HDL contains antioxidant enzymes such as paraoxonase (PON), whose activity is diminished in CKD. The aim of our study was to evaluate the relationship between PON activity with HDL cholesterol, apo A1 and hs-CRP levels, which are known to be inflammatory markers in hemodialyzed patients. Forty-two patients were studied; age, median (range) = 50 (25-67) years old, gender M/F = 22/20, duration of hemodialysis = 4.4 ± 0.5 years, BMI: 23 ± 0.5 kg/m2. After a 12 h fast, a blood sample was obtained and classic components of lipid profile were determined, as well as apoproteins A1 and B, PON by means of its arylsterase activity and hs-CRP levels. On the basis of the latter, patients were divided into two groups: hs-CRP ≤ 1 (low risk, range: 0.1 to 1.0 mg/l) and >1 mg/l (moderate and high risk, 1.1 to 10.7 mg/l). No difference was found in triglycerides, LDL cholesterol and apo B in the groups. Patients with hs-CRP > 1 showed lower HDL cholesterol (40 ± 2 mg/dl) and apo A1 (118 ± 4 mg/dl) than patients with hs-CRP ≤ 1 (50 ± 4 and 133 ± 5, respectively); p < 0.05. PON was lower in hs-CRP > 1 = 90.5 ± 24.0 μmol/ml.min than in hs-CRP ≤ 1 = 105.2 ± 18.0. Consequently, inverse correlations were obtained between apo A1 and hs-CRP, r = -0.381, p = 0.013 and between PON and hs-CRP, r = -0.32, p = 0.042. Furthermore, increase in hs-CRP correlated positively with BMI r = 0.318, p = 0.042. Since apo A1 has an anti-inflammatory role and PON an antioxidant activity, the decrease in HDL and its components, cholesterol, apo A1 and PON, in subjects with higher chronic inflammatory condition might explain, in part, the increased cardiovascular risk in these patients.
Key words: Hemodialysis; Inflammation; Lipoproteins; HDL; Paraoxonase
La prevalencia de individuos bajo tratamiento sustitutivo renal mostró un crecimiento anual de 6% en veinte países de Latinoamérica. El 57% de esta población se encontraba en hemodiálisis y el resto en diálisis peritoneal o con un trasplante funcionante1.
En los pacientes con enfermedad renal crónica, la patología cardiovascular aterosclerótica constituye la principal causa de morbimortalidad. Entre las posibles causas de su desarrollo pueden señalarse: la dislipemia, la inflamación crónica, la insulino-resistencia y la malnutrición, frecuentes en estos pacientes.
En trabajos previos mostramos que pacientes en hemodiálisis, independientemente de la presencia de diabetes tipo 2, presentaban múltiples alteraciones cuali y cuantitativas, tanto en la composición como en el metabolismo de las lipoproteínas2, en concordancia con observaciones de otros autores3. El perfil más frecuente es la hipertrigliceridemia moderada, la disminución de col-HDL (high-density lipoprotein), el aumento de IDL (intermediate-density lipoprotein) y la composición alterada de VLDL (very low-density lipoprotein) y LDL (low-density lipoprotein) aun cuando el nivel de colesterol de LDL se encuentre normal o bajo.
Por otro lado, ya es bien aceptado que la enfermedad renal crónica y más aún la hemodiálisis constituyen un estado inflamatorio, que promueve la aterogénesis. La PCR evaluada por método de alta sensibilidad, es considerada muy buen marcador y predictor de eventos cardiovasculares, aun en personas con valores de lípidos normales4. Se ha señalado que el nivel de PCR-as es un indicador más potente de eventos cardiovasculares que el colesterol-LDL5. La medición de la PCR presenta ventajas porque es muy estable en suero, posee una vida media prolongada, no se altera por la ingesta y su determinación bioquímica es simple6. En la práctica clínica niveles de PCR-as inferiores a 1, entre 1.1 y 3 y mayores que 3 mg/dl están asociados con bajo, moderado y alto riesgo cardiovascular, respectivamente6.
En los pacientes en hemodiálisis se ha descripto el síndrome de malnutrición-inflamación-aterosclerosis (Síndrome MIA) que postula la interacción de estos tres fenómenos. Este síndrome ejercería un efecto confundidor entre los factores de riesgo clásicos y la evolución clínica, dado que los pacientes suelen ser delgados y/o muestran colesterol-LDL bajo7.
Por otro lado, la diálisis produce un aumento del estrés oxidativo8, de manera que resulta de interés evidenciar posibles mecanismos que permitan prevenirlo o reducirlo. En este sentido, cobra importancia el rol de las HDL, partículas multifuncionales que tienen la capacidad de proteger a las LDL de la oxidación, lo cual se debe, en parte, a la acción enzimática de la paraoxonasa 1 (PON)9. Esta enzima se encuentra asociada a HDL confiriéndole la capacidad de prevenir daños oxidativos en la pared vascular arterial10. La actividad de la enzima se encontró disminuida en pacientes con infarto de miocardio, diabetes mellitus, hipercolesterolemia e hipertrigliceridemia primarias11, 12, así como en pacientes en hemodiálisis13.
Con el fin de evaluar la posible asociación entre el proceso inflamatorio y el oxidativo en pacientes en tratamiento con hemodiálisis, nos propusimos estudiar el efecto del mayor grado de inflamación sobre la HDL y componentes como apo A-1 y paraoxonasa.
Materiales y métodos
Se estudiaron 42 pacientes en hemodiálisis de variada etiología: diabetes tipo 2 (n = 13), nefroangiosclerosis (n = 10), glomerulopatías (n = 8), riñón poliquístico (n = 4) y de origen desconocido (n = 7).
Todos los pacientes estaban sometidos a hemodiálisis con bicarbonato, utilizando filtros de acetato de celulosa de bajo flujo, 3 veces por semana durante 4-4,5 horas, y bajo infusión constante de heparina. Los pacientes fueron incluidos consecutivamente en un mismo mes, aplicando los siguientes criterios de exclusión: eventos cardiovasculares previos, disfunción hepática, tiroidea, enfermedades infecciosas agudas, insuficiencia renal aguda, tratamiento con esteroides, drogas inmunosupresoras o que afecten el metabolismo lipídico, así como el consumo de más de 15 g de alcohol/día y de más de 5 cigarrillos/día. Los pacientes recibían tratamiento habitual con vitamina B, C, ácido fólico y hierro. Se registró peso y altura de los pacientes para calcular el índice de masa corporal (IMC) en k/m2.
Se contó con el consentimiento informado escrito de los pacientes. El estudio fue aprobado por el Comité de Etica de la Facultad de Farmacia y Bioquímica de la Universidad de Buenos Aires.
A todos los sujetos se les realizó una extracción de sangre luego de 12 horas de ayuno para la obtención del suero, en el cual se determinó colesterol total y triglicéridos, por métodos enzimáticos-colorimétricos estandarizados (Roche Diagnostics, Mannheim, Germany), colesterol-HDL y colesterol-LDL, luego de la precipitación selectiva. Se dosaron también las apolipoproteínas A1 y B por inmunoturbidimetría (Roche Diagnostics, Mannheim, Germany).
Se midió la enzima PON por un método validado en nuestro Laboratorio14, a través de su actividad arilesterasa, utilizando fenilacetato como sustrato. A 2 ml de buffer Tris/Acetato (50 mmol/l, pH 7.8) conteniendo 20 mmol/l de CaCl2 y 4.4 mmol/l de fenilacetato (Sigma Chemical Co.) se le agregó la muestra (20 μl de una dilución 1/20 en agua destilada). La generación de fenol se determinó a 270 nm, a 25 °C en un espectrofotómetro Hitachi U-1100. El aumento de absorbancia se registró durante 5 minutos a intervalos de 30 segundos luego de una preincubación inicial de 30 segundos. Se incluyeron blancos para corregir la hidrólisis espontánea de fenilacetato. Se calculó la actividad enzimática según el coeficiente de extinción molar 1310 M-1 cm-1; los resultados se expresan como μmol/ml.min. La evaluación de la actividad enzimática proporcionó los siguientes datos KM= 860 μmol/ml; Vmáx= 190 μmol/ml.min.
Para la medida de la concentración sérica de PCR-as como marcador de inflamación, se utilizó un método inmunoturbidimétrico de alta sensibilidad Tina-quant CRP (Látex) con los correspondientes calibradores y controles comerciales (Roche Diagnostics, Mannheim, Germany).
Este parámetro permitió dividir a los pacientes transversalmente en dos grupos: con PCR-as 016 ≤ 1 (bajo riesgo cardiovascular, rango: 0.1 a 1.0 mg/l) y con PCR-as > 1 (moderado y alto riesgo cardiovascular, rango: 1.1 a 10.7 mg/l)6. No se observaron diferencias entre los dos grupos de pacientes en cuanto a la edad, etiología, antigüedad en hemodiálisis e IMC, y sus características se muestran en la Tabla 1.
TABLA 1.- Características de los pacientes en hemodiálisis, divididos en función de su estado inflamatorio

p=ns
Para el análisis de resultados se utilizó el test t de Student para grupos independientes. La correlación entre factores se estimó por Pearson o Spearman, según la distribución de los datos. Las diferencias se consideraron significativas con un p < 0.05. Los programas estadísticos utilizados fueron Excel® y SPSS® para Windows, versión 11.5.
Resultados
La concentración de PCR-as de todos los pacientes en hemodiálisis mostró un valor de 2.88 ± 0.46 mg/l. Dividiendo al grupo estudiado según el nivel de PCR-as y utilizando 1 mg/l como valor de corte, en la Tabla 2 se muestra el perfil de lípidos, colesterol-LDL y apoproteína B.
TABLA 2.- Perfil plasmático de lípidos, colesterol-LDL y apoproteína B en los pacientes en hemodiálisis, agrupados según el nivel de PCR-as
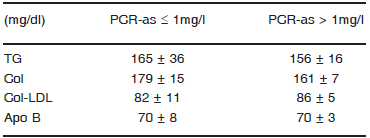
Col: colesterol; Apo: apoproteína. Los resultados se expresan como media ± ES. p = ns.
Los valores medios de triglicéridos, colesterol total, colesterol-LDL y apo B no mostraron diferencias entre los dos grupos de pacientes. En cambio, los pacientes con PCR-as > 1 mg/l presentaron menor concentración de colesterol-HDL y apoproteína A1 (Fig. 1).
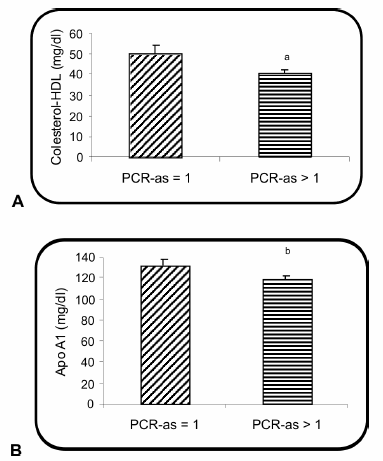
Fig. 1.- Nivel de colesterol-HDL (A) y apoproteína A1 (B) en los pacientes en hemodiálisis, agrupados según el nivel de PCR-as. ap = 0.029; bp = 0.045.
La paraoxonasa, medida a través de su actividad arilesterasa, fue menor en los pacientes con mayor estado inflamatorio (Fig. 2).
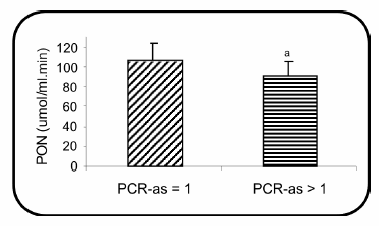
Fig. 2.- Medida de PON a través de su actividad arilesterasa en los pacientes en hemodiálisis, agrupados según el nivel de PCR-as. ap = 0.045.
Por otra parte, se evidenció una asociación inversa y significativa de PCR-as con apo A1 (y = -0.0499x + 9.297; r = -0.38, p = 0.013) y con PON (y = -0.018x + 6.884; r = -0.32, p = 0.042).
El grado inflamatorio también correlacionó directamente con el índice de masa corporal (y = 0.305x -4.192; r = 0.32, p = 0.042).
Discusión
Dado que los factores de riesgo clásicos para la población general no permiten explicar la elevada morbi-mortalidad por eventos cardiovasculares que presentan los pacientes con enfermedad renal crónica, en el presente trabajo se evaluaron componentes de HDL, como la apo A1 y la enzima paraoxonasa, en relación con el estado inflamatorio, implementando PCR-as como marcador, en pacientes bajo tratamiento con hemodiálisis. Se observó una correlación inversa y significativa entre PCR-as y los valores de PON y apo A1.
La enfermedad renal, especialmente en la hemodiálisis, representa un estado inflamatorio constante; por lo tanto, consideramos importante medir la PCR-as como biomarcador de inflamación. Sin embargo, no existe consenso con respecto al valor de corte óptimo de PCR-as que indique la presencia de inflamación en pacientes sometidos a diálisis, de manera que se adoptaron los niveles definidos para la población general6, 15. Considerando el valor de corte de 1 mg/l, se agruparon los pacientes con riesgo bajo (PCR-as d 1 mg/l) y riesgo moderado y alto (PCR-as > 1 mg/l).
Ambos grupos de pacientes en hemodiálisis presentaron características similares con respecto a la edad, antigüedad de diálisis y al índice de masa corporal. No se observaron diferencias en el perfil lipídico entre grupos y, como era de esperar, los valores medios de triglicéridos fueron mayores que el valor deseable establecido para la población general16. Si bien el valor medio de colesterol total estuvo dentro de los valores deseables, es significativo que el valor medio de colesterol-LDL fue de 82 y 86 mg/dl en los grupos con PCR-as ≤ 1 mg/l y >1 mg/l, respectivamente. Es importante señalar que estos pacientes son considerados como de alto riesgo o riesgo equivalente a los que presentaron enfermedad coronaria15, 16. Evidentemente, el nivel de colesterol-LDL no constituye un marcador de riesgo aterogénico en estos pacientes. En concordancia, los valores de apo B también fueron bajos, indicando menor cantidad de partículas de LDL en circulación. Esto estaría relacionado con un efecto de disminución del colesterol producto de la inflamación sistémica y la malnutrición, frecuentes en estos pacientes, que dio lugar al concepto de epidemiología reversa, fenómeno paradójico con distorsiones en la relación entre un factor de riesgo aceptado para la población general y la evolución clínica esperada17.
El tejido adiposo es un órgano dinámico productor de una serie de citoquinas proinflamatorias; por lo tanto, pacientes obesos presentan un estado inflamatorio incrementado18. En este trabajo, la correlación entre el IMC como indicador del grado de sobrepeso y la PCR-as, indicador del grado de inflamación, demostró una asociación positiva significativa, aunque débil. Estos resultados también constituyen un ejemplo de epidemiología reversa, dado que la supervivencia de los pacientes con sobrepeso en hemodiálisis es consistentemente superior a la de aquellos que tienen un IMC dentro del rango normal 7.
En cuanto a la HDL, su contenido en colesterol, apo A1 y actividad de PON fue menor en los pacientes con mayor estado inflamatorio, sin embargo la correlación entre la actividad de PON y los componentes de HDL no alcanzó a ser significativa (datos no mostrados). Por lo tanto, no fue necesario el ajuste para confirmar la reducción de PON. El efecto de la disminución de apo A1 incrementaría el estado inflamatorio y la de PON reduce la capacidad inhibitoria de HDL frente al estrés oxidativo. Cabe aclarar que también se ha descripto la capacidad antioxidante de apo A119.
Por un lado, se ha señalado que la inflamación reduce los niveles de HDL porque disminuye la expresión del transportador ATP binding cassette A-1 (ABCA-1) en los macrófagos, reduciendo el eflujo de colesterol a la forma naciente de HDL, preβ-HDL. Además, la inflamación se asoció con niveles reducidos de apo A1, la cual es desplazada de la HDL por el amiloide sérico A, que en condiciones inflamatorias es sintetizado por el hígado como reactante de fase aguda20, resultando en la reducción del número de partículas de HDL. En contraste con el amiloide sérico A, la apo A1 es una proteína negativa de fase aguda y sus niveles de ARNm disminuyen como consecuencia de la inflamación. Esta explicación es compatible con los resultados obtenidos en este trabajo, ya que no sólo se ha observado una disminución de apo A1 en los pacientes con mayor grado de inflamación, sino que se obtuvo una correlación inversa significativa entre este parámetro y PCR. Los hallazgos sugirieren que la HDL en los pacientes en hemodiálisis no cumple su papel anti-inflamatorio, y hasta podría transformarse en una lipoproteína pro-inflamatoria21, 22.
En términos generales, el papel protector de HDL no sólo depende de su concentración sino también de su funcionalidad. Su comportamiento dependería de numerosos factores relacionados con su composición, como su contenido en triglicéridos, apo A1 y enzimas asociadas como PON.
En los últimos años diferentes autores revelan la disminución de la actividad de PON en distintos grupos con enfermedad renal crónica, sin relacionarla con el estado inflamatorio23-25. Recientemente, midiendo el grosor íntima-media de la carótida de pacientes en hemodiálisis, Saeed y col sugieren que la disminución de la actividad de PON podría ser un importante factor causante de la enfermedad vascular en esos pacientes, aunque los sujetos incluidos presentan valores de PCR de 16 a 51 mg/dl, con criterios de exclusión que no permiten descartar la presencia de infecciones26. Cabe recordar que en el presente trabajo se excluyeron pacientes con infecciones.
Por lo tanto, el descenso de PON que observamos en el grupo de mayor estado inflamatorio es un fenómeno poco estudiado hasta el momento. Se interpreta que la disminución de PON se incrementaría con el grado de inflamación, tal como lo evidenció la correlación significativa obtenida. El sinergismo entre la disminución de la capacidad antioxidante y por ende, el aumento del estrés oxidativo, con la situación proinflamatoria contribuiría a la disfunción endotelial y al aumento significativo del riesgo cardiovascular27. Por otro lado, la relación inversa entre PCR y PON se describió más claramente en pacientes diabéticos tipo 1 y 228.
Algunos resultados controvertidos en la literatura con respecto a PON pueden atribuirse a la metodología implementada para la medida de la actividad enzimática. La característica de esta enzima es que presenta un polimorfismo cuando se utiliza el paraoxón como sustrato, en cambio no existe este polimorfismo utilizando fenilacetato14. Este fue el sustrato utilizado en el presente trabajo, el cual permite evaluar la actividad arilesterasa de la enzima de manera confiable. Sin embargo, en otros estudios realizados en este Laboratorio, aún no publicados, también hemos demostrado disminución de la enzima evaluada a través del paraoxón en pacientes en hemodiálisis en comparación con personas sanas. Finalmente, los resultados del presente trabajo contribuirán a la comprensión de los mecanismos aterogénicos en pacientes en hemodiálisis, dado que la disminución de apo A1 y de paraoxonasa, indicadoras de HDL disfuncional, intensificarían los factores que inducen el proceso inflamatorio en la hemodiálisis, aumentando la susceptibilidad a la aterosclerosis.
Agradecimientos: Este trabajo se ha llevado a cabo con subsidios recibidos de la Universidad de Buenos Aires B070, y de la Agencia Nacional de Promoción Científica y Tecnológica (ANPCyT) PICT 195.
Conflictos de interés: No existen conflictos financieros o personales que hayan influenciado inapropiadamente este trabajo.
1. Cusumano A, Garcia Garcia G, Gonzalez Bedat C. The Latin-American Dialysis and Transplant Registry: Report 2006. Ethn Dis 2009; 19 (Suppl 1): S3-6. [ Links ]
2. González AI, Schreier L, Elbert A, et al. Lipoprotein alterations in hemodialysis: differences between diabetic and nondiabetic patients. Metabolism 2003; 52: 116-21. [ Links ]
3. Lee DM, Knight-Gibson C, Samuelsson O, Attman PO, Wang CS, Alaupovic P. Lipoprotein particle abnormalities and the impaired lipolysis in renal insufficiency. Kidney Int 2002; 61: 209-18. [ Links ]
4. Ajani U, Ford E, Mokdad A. Prevalence of high C-Reactive Protein in persons with serum lipid concentrations within recommended values. Clin Chem 2004; 50: 1618-22. [ Links ]
5. Ridker PM, Rifai N, Rose L, Buring JE, Cook NR. Comparison of C-reactive protein and low-density lipoprotein cholesterol levels in the prediction of first cardiovascular events. N Engl J Med 2002: 347: 1557-65. [ Links ]
6. Pearson T, Mensah G, Alexander R, et al. Markers of inflammation and cardiovascular disease: application to clinical and public health practice a statement for healthcare professionals from the Centers for Disease Control and Prevention and the American Heart Association. Circulation 2003; 107: 499-511. [ Links ]
7. Kalantar-Zadeh K, Abbott KC, Salahudeen AK, Kilpatrick RD, Horwich TB. Survival advantages of obesity in dialysis patients. Am J Clin Nutr 2005; 81: 543-54. [ Links ]
8. Himmelfarb J. Oxidative stress in hemodialysis. Contrib Nephrol 2008; 161: 132-7. [ Links ]
9. Mackness MI, Mackness B, Durrington PN, et al. Paraoxonase and coronary heart disease. Curr Opin Lipidol 1998; 9: 319-24. [ Links ]
10. Soran H, Younis N, Charlton-Menys V, Durrington P. Variation in paraoxonase-1 activity and atherosclerosis. Curr Opin Lipidol 2009; 20: 265-74. [ Links ]
11. Aviram M, Rosemblat M. Paraoxonases 1, 2 and 3, oxidative stress, and macrophage foam cell formation during atherosclerosis development. Free Radic Biol Med 2004; 37: 1304-16. [ Links ]
12. Brites FD, Verona J, Schreier LE, Fruchart JC, Castro GR, Wikinski RL. Paraoxonase 1 and platelet-activating factor acetylhydrolase activities in patients with low HDL-cholesterol levels with or without primary hypertriglyceridemia. Arch Med Res 2004; 35: 235-40. [ Links ]
13. Suehiro T, Ikeda Y, Shiinoki T, et al. Serum paraoxonase concentration in patients undergoing hemodialysis. J Atheroscler Tromb 2002; 9: 133-8. [ Links ]
14. Sanguinetti S, Brites F, Fasulo V, et al. HDL oxidability and its protective effect against LDL oxidation in Type 2 diabetic patients. Diab Nutr Metab 2001; 14: 27-36. [ Links ]
15. Kidney Disease Outcomes Quality Initiative Group, National Kidney Foundation. Clinical practice guidelines for managing dyslipemias in chronic kidney disease. Am J Kidney Dis 2003; 4 Suppl 3: S1 - 91. [ Links ]
16. Expert Panel on Detection, Evaluation and Treatment of High Blood Cholesterol in Adults. (Adult Treatment Panel III), National Cholesterol Education Program. Executive Summary of the Third Report. JAMA 2001; 285: 2486-97. [ Links ]
17. Kopple JD. The phenomenon of altered risk factor patterns or reverse epidemiology in persons with advanced chronic kidney failure. Am J Clin Nutr 2005; 81: 1257-66. [ Links ]
18. Rasouli N, Ken PA. Adipocitokines and the metabolic complications of obesity. J Clin Endocrinol Metab 2008; 93 (Suppl 1): S64-73. [ Links ]
19. Navab M, Reddy S, Van Lenten B, Anantharamaiah G, Fogelman A. The role of dysfunctional HDL in atherosclerosis. J Lipid Res 2009; S145-9. [ Links ]
20. Van Lenten B, Hama S, de Beer F, et al. Anti-inflammatory HDL becomes pro-inflammatory during the acute phase response. Lost of protective effect of HDL against LDL oxidation in aortic wall cell cocultures. J Clin Invest 1995; 96: 2758-67. [ Links ]
21. Kaysen GA. Disorders in high-density metabolism with insulin resistance and chronic renal disease. J Ren Nutr 2007; 17: 4-8. [ Links ]
22. Ansell BJ, Fonarow GC, Fogelman AM. The paradox of dysfunctional high-density lipoprotein. Curr Opin Lipidol 2007; 18: 427-34. [ Links ]
23. Jurek A, Turyna B, Kubit P, Klein A. LDL susceptibility to oxidation and HDL antioxidant capacity in patients with renal failure. Clin Biochem 2006; 39: 19-27. [ Links ]
24. Ece A, Atamer Y, Gürkan F, et al. Paraoxonase, anti-oxidant response and oxidative stress in children with chronic renal failure. Pediatr Nephrol 2006; 21: 239-245. [ Links ]
25. Moradi H, Pahl M, Elahimehr R, Vaziri ND. Impaired antioxidant activity of high-density lipoprotein in chronic kidney disease. Traslational Res 2009; 153: 77-85. [ Links ]
26. Saeed SA, Elsharkawy M, Elsaeed K, Fooda O. Paraoxonase-1 (PON 1) activity as a risk factor for atherosclerosis in chronic renal failure patients. Hemodial Int 2008; 12: 471-9. [ Links ]
27. Oberg BP, McMenamin E, Lucas FL, et al. Increased prevalence of oxidant stress and inflammation in patients with moderate to severe chronic renal disease. Kidney Int 2004; 64: 1009-16. [ Links ]
28. Mackness B, Hine D, McElduff P, Mackness M. High C-reactive protein and low paroxonase 1 in diabetes as risk factors for coronary heart disease. Atherosclerosis 2006; 186: 396-401. [ Links ]
Recibido: 1-3-2010
Aceptado: 14-9-2010














