Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Medicina (Buenos Aires)
Print version ISSN 0025-7680
Medicina (B. Aires) vol.70 no.6 Ciudad Autónoma de Buenos Aires Nov./Dec. 2010
ARTÍCULO ESPECIAL
Desarrollo de vacunas contra el virus de la inmunodeficiencia humana tipo 1. Relevancia de la inmunidad celular contra subtipos
Ana María Rodríguez, Gabriela Turk, María Fernanda Pascutti, Juliana Falivene, María Magdalena Gherardi
Centro Nacional de Referencia para el Sida, Departamento de Microbiología, Parasitología e Inmunología, Facultad de Medicina, Universidad de Buenos Aires.
Dirección postal: Dra. Ana María Rodríguez, Paraguay 2155, Piso 11,1121 Buenos Aires, Argentina Fax: (54-11) 4508-3705 e-mail: amrodriguez@fmed.uba.ar
Resumen
Han pasado casi 30 años de la detección de los primeros casos de infección con HIV-1 y aún no se ha conseguido desarrollar una vacuna efectiva y segura. A pesar del impacto positivo sobre la pandemia que se ha conseguido gracias a los avances en la terapia antirretroviral (TARV), el HIV/sida sigue constituyendo un grave problema para la salud pública, especialmente en los países en desarrollo, donde es difícil el acceso al tratamiento. En el mundo, 33 millones de personas viven con el virus del sida, mientras que en la Argentina se calcula que habría unos 120 000 infectados. Uno de los desafíos para lograr una vacuna contra el HIV es la variabilidad viral. El grupo M, responsable de la pandemia, se encuentra dividido en 10 subtipos y varios sub-subtipos, además de las 48 formas recombinantes circulantes y más de cien formas recombinantes únicas. La epidemia de HIV en nuestro país es tan compleja como en el resto del mundo, con la co-circulación principalmente de virus pertenecientes al subtipo B y recombinantes BF (CRF12_BF y derivadas). A pesar de la cantidad de trabajos dedicados a la caracterización de la respuesta inmune y al desarrollo de vacunas, no queda claro cuál es el impacto de la variabilidad en la elección del antígeno. Trabajos realizados en nuestro laboratorio demuestran el papel que juega la inmunidad celular con respecto a las variantes recombinantes BF, tanto en humanos como en modelos animales. Estos resultados son de importancia en el desarrollo de futuras vacunas para nuestra región.
Palabras clave: HIV; Vacunas; Inmunidad celular; CRF12_BF
Abstract.
Development of vaccines for HIV-1. Relevance of subtype-specific cellular immunity. It has been almost 30 years since the detection of the first HIV-1 cases and yet an effective and safe vaccine has not been developed. Although, advances in antiretroviral therapy (HAART) have produced a major impact on the pandemic, and even though HIV/aids remains a major concern for developing countries, where access to therapy is limited. The last report from UNAIDS notified 33 million people living with HIV/aids, worldwide, while in Argentina it is estimated that 120 000 persons have been infected. One of the challenges to address and ultimately overcome when developing a vaccine is the high variability of HIV-1. The M group, responsible for the pandemic, is divided into 10 subtypes and several sub-subtypes, in addition to the 48 circulating recombinant forms (CRF) and over one hundred unique recombinant forms (URF). The HIV epidemic in Argentina is as complex as in the rest of the world, characterized by the high prevalence of infections caused by subtype B and BF variants. Despite the wide range of publications focused on the immune response against HIV as well as to vaccine development, how to overcome variability on vaccine antigen selection is still unclear. Studies performed in our laboratory showed the impact of the immunogenicity of BF recombinant variants, both in humans and in animal models. These results are of great concern in vaccine development for our region.
Key words: HIV; Vaccines; Cellular immunity; CRF12_BF
La epidemia de HIV/sida
Han pasado 29 años del primer caso notificado de sida y 27 del descubrimiento de su agente etiológico y aún no se ha conseguido controlar la pandemia en su totalidad. Más de 60 millones de personas se han infectado con el virus y más de la mitad han fallecido por esta causa1.
Actualmente, el HIV/sida constituye una de las mayores problemáticas para los países en desarrollo, donde es difícil el acceso a la terapia antirretroviral (TARV). En estos países sólo una pequeña parte de la población que necesita terapia tiene acceso a ella2.
Como ocurre con otras epidemias, para erradicar un virus habría que curar a los pacientes infectados y evitar nuevas infecciones. En el caso de HIV, la primera opción se dificulta debido a la existencia de células que funcionan como reservorio del virus, mientras que la segunda sería posible con cambios en las conductas de la población, mediante el uso de condones y la utilización de TARV como profilaxis para prevenir la transmisión vertical, entre otras. Pero no hay dudas de que la mejor opción para evitar las nuevas infecciones y erradicar al virus sería contar con una vacuna segura y efectiva3.
A pesar de los esfuerzos de la comunidad científica aún no se ha conseguido este objetivo debido a que varias características virales dificultan el desarrollo de una vacuna. Entre ellas podemos nombrar el hecho de que el virus se integra al genoma de la célula huésped estableciendo reservorios virales. Por otro lado, su alta variabilidad, ocasionada por una tasa de mutación elevada, le permite escapar constantemente de la presión del sistema inmune3.
Situación epidemiológica actual
Según el último informe de la Organización de las Naciones Unidas para la lucha contra el sida, el número estimado de personas infectadas con HIV en el mundo alcanzó los 33.4 millones a fines de 2 0081. Cada día, más de 7 400 personas se infectan con HIV y más de 5 500 fallecen a causa del sida, en la mayoría de los casos debido a un acceso inadecuado a los servicios de prevención y tratamiento1.
En la Argentina, se estima que el número de personas infectadas es cercano a 120 000 [80 000-220 000]4, aunque sólo 75 009 casos se habían notificado hasta diciembre de 2 0085. De estos últimos, el 51% habría desarrollado en algún momento una enfermedad marcadora de sida5.
En los últimos años se han observado reducciones localizadas en la prevalencia de HIV en algunos países, como en Zimbabwe y Kenya4. Así mismo, se ha detectado una reducción en la mortalidad asociada al HIV, atribuible al reciente aumento en el acceso al tratamiento, lo que también tiene como consecuencia una reducción del número de nuevas infecciones anuales a nivel mundial.
A pesar de estos datos alentadores, la pandemia de HIV sigue constituyendo uno de los desafíos más importantes en enfermedades infecciosas para la salud pública mundial.
Filogenia y epidemiología molecular
Una característica importante del HIV es la amplia diversidad genética generada por el hecho de que la transcriptasa reversa no posee actividad de prueba de lectura o proof reading (que permite corroborar que el nucleótido insertado es el correcto), llevando a una tasa de mutación elevada. Esto le da la posibilidad de evadir al sistema inmune y a la TARV. Otro mecanismo por el cual el virus adquiere variabilidad es la generación de formas recombinantes, lo que puede ocurrir cuando una persona es infectada por virus de distintos subtipos y éstos se multiplican en la misma célula.
El grupo M de HIV-1 es el responsable de la pandemia, y se ha diversificado en al menos 10 subtipos y sub-subtipos6. La diferencia genética dentro de un subtipo puede ser entre un 15 o 20% de la secuencia, mientras que la variabilidad entre subtipos puede llegar hasta un 35%6. A partir de la secuenciación de genomas enteros se han podido identificar las formas recombinantes circulantes (circulating recombinant form, CRF) y las formas recombinantes únicas (unique recombinant forms, URF). Un virus recombinante es clasificado como CRF si se lo ha identificado en 3 o más pacientes que no posean una relación epidemiológica directa. Si no cumplen con esta característica se lo clasifica como URF. Actualmente existen 48 CRFs y más de una centena de URFs6, 7.
A excepción de Africa Sub-Sahariana, donde se encuentran representados prácticamente todos los subtipos de HIV-1, CRFs y URFs, estudios de epidemiología molecular muestran que en el resto del mundo las variantes de HIV han sido detectadas con una distribución geográfica específica7-9.
Existen numerosos trabajos acerca de la caracterización molecular de la epidemia de HIV en distintas poblaciones argentinas. En ellos se describe la presencia de subtipo B, tanto como CRF12_BF (descripta en 2 00110) y otras recombinantes BF relacionadas, mientras que el subtipo C se encuentra en forma minoritaria11-15. Infecciones causadas por variantes recombinantes BF fueron notificada por otros países latinoamericanos como Brasil y Uruguay10, donde son relativamente comunes, mientras que una menor proporción de casos de recombinantes BF fueron detectados en Bolivia10, Venezuela16, 17, Chile y España17. Recientes comunicaciones indican nuevos casos de infecciones con CRF12_BF en España18 y Paraguay19. Por otro lado, recientemente se ha descripto una nueva recombinante BF circulante en Uruguay, la que fue denominada CRF38_BF120.
Estos datos epidemiológicos, junto con el hecho de que aún no está claro cuál es la relevancia de la inmunidad subtipo específica y el grado de reactividad cruzada de células T entre diferentes subtipos de HIV21-23, resaltan la importancia de considerar los patrones de la epidemia molecular en los diseños de vacunas que se usarán en esta zona de Latinoamérica.
Una vacuna
El desarrollo de una amplia variedad de antirretrovirales ha llevado a un importante descenso en la mortalidad asociada al sida, junto con un aumento en la calidad de vida de las personas infectadas con HIV4, 24. Esto ha ocurrido especialmente en países desarrollados, donde el acceso a las terapias está al alcance de todos los individuos que viven con HIV, aunque últimamente se está ampliando en países en desarrollo24. En la Argentina el tratamiento antirretroviral es gratuito, proporcionado por el Ministerio de Salud o por los servicios de salud. En el último boletín del Ministerio de Salud se informó que de los 75 009 casos notificados, 41 000 reciben TARV gratuita (55%), siendo en la mayoría de los casos (69%) proporcionada por la Dirección de Sida y Enfermedades de Transmisión Sexual del Ministerio de Salud de la Nación (DSyETS) y el resto a través de la Seguridad Social y los servicios de salud prepagos. Durante el 2 008, 28 168 personas recibieron TARV provista por la DSyETS, un 10% más que en 2 0075.
Sin embargo, aunque en los últimos años se ha progresado en este sentido, la Organización de las Naciones Unidas estimó que en el año 2007 sólo entre el 27 y el 34% de las personas que necesitaban TARV en el mundo tuvieron acceso a ella1, 2. Sin dudas, el desarrollo de una vacuna segura y eficaz contra el HIV es crítico para el control de la pandemia.
La finalidad de una vacuna ideal para HIV-1 debería ser prevenir la infección o bien, al menos, reducir la carga viral y la progresión a sida. Esto se lograría mediante el bloqueo de la infección a través de la inmunidad esterilizante. Pero la realidad es que la mayoría de las vacunas antivirales que existen en el mercado funcionan controlando la replicación viral sub-clínicamente y previniendo la enfermedad25.
El avance del conocimiento sobre la patogénesis de HIV y sobre cómo la respuesta inmune contribuye al control de la replicación viral, ha llevado a que las nuevas investigaciones se focalicen en la inmunidad celular24. Existen numerosos trabajos que demuestran la importancia de la respuesta celular en el control del HIV, así como de SIV (Virus de la Inmunodeficiencia Simiana)26-31.
Inmunizaciones en primates no humanos con vacunas que inducen principalmente respuesta celular, producen una reducción de la viremia inicial, generando un menor set point (valor de carga viral, CV, característico de la infección crónica alcanzado al estabilizarse la misma luego de la infección aguda) y una reducción en los niveles totales de virus producidos durante los estadios tempranos de la infección24, 32-34. La progresión a la enfermedad ocurre más tardíamente en estos casos y este retraso se correlacionó con los niveles de la respuesta celular inducida por la vacuna32-34.
A partir de esto surge la pregunta de si una vacuna que no prevenga la infección, pero que disminuya la viremia y retrase la progresión a sida sería beneficiosa, y al mismo tiempo, más factible de ser generada25. Estudios de cohortes para analizar la historia natural de la infección han mostrado que los niveles de la carga viral en el momento del set point correlacionan inversamente con la progresión a la enfermedad24, 35. Por otro lado, en el trabajo de Turk y colaboradores, se encontró una asociación entre la mayor polifuncionalidad de las células específicas para antígenos de HIV y una mejor contención de la carga viral en pacientes con infección primaria36.
Entonces, si los modelos animales y el curso natural de la infección pueden ser predictores del desarrollo de la enfermedad, se podría hipotetizar que las personas que recibiesen vacunas inductoras de respuestas celulares, al ser posteriormente infectadas, podrían permanecer sin enfermedad por más tiempo, o incluso no desarrollar sida, aun en ausencia de TARV24, 35. Estos individuos podrían controlar el pico de viremia inicial, con un menor set point, lo que llevaría asociado una menor destrucción inicial de tejido linfoide asociado a intestino y a un menor establecimiento de reservorios24. También es importante resaltar que este tipo de respuestas no sólo podría evitar la progresión a sida, sino que disminuiría la tasa de transmisión37. En este sentido, existen publicaciones donde se observa que con una CV de 1 700 copias de ARN viral/ml de plasma o menor, la probabilidad de contagio es muy baja o nula38, 39.
Diseño racional de vacunas para HIV
Los primeros intentos de generar una vacuna contra el HIV fueron mediante la utilización de la proteína de la envoltura (Env), gp160 o gp120, los que en 1 998 fueron evaluados en ensayos clínicos de fase III (Vax 003 y Vax 004)40-42. Al finalizar los ensayos se observó que la vacunación no protegió frente a la infección con HIV, ya que no se encontraron diferencias significativas en la incidencia entre el grupo vacunado con la proteína recombinante y el grupo placebo. Tampoco se encontró diferencia en la CV y recuento de CD4+ de los pacientes vacunados y posteriormente infectados43, 44. Estos candidatos fallaron en la generación de anticuerpos neutralizantes eficaces frente a los virus circulantes, debido a que las zonas conservadas de Env se encuentran altamente glicosiladas. Los anticuerpos generados reconocieron principalmente las zonas variables de la glicoproteína, pero en pocas ocasiones el sitio de unión al receptor, que se encuentra oculto en el interior de la proteína45.
Recientemente, se han desarrollado algunos anticuerpos con alta capacidad neutralizante, capaces de proteger macacos de desafíos por rutas de mucosas. Estos anticuerpos, denominados 2F5 y 4E10, están dirigidos contra la región externa próxima a la membrana de la proteína gp41, la que está altamente conservada, considerada de crucial importancia para la fusión del virus con la célula46, pero aún no se han probado en ensayos clínicos.
Como se mencionó anteriormente, en los últimos años se ha focalizado el diseño de vacunas en aquellas que sean capaces de generar una respuesta inmune celular, ya que existen distintas evidencias que demuestran que la respuesta celular mediada por linfocitos T citotóxicos (células T CD8+, CTL) juega un rol central en el control de la infección por HIV y progresión a sida26-31. A su vez, diferentes hallazgos surgidos del área de investigación básica en el desarrollo de vacunas sugieren que tres características de la respuesta T CD8+ podrían estar involucradas en el control de la viremia: frecuencia, amplitud de los epítopes reconocidos y la calidad funcional de las células47.
Recientemente, han ocurrido dos acontecimientos importantes en el campo del desarrollo de vacunas de HIV: la finalización de los dos ensayos clínicos con mayor número de pacientes que estaban en curso, uno de fase IIb o “prueba de concepto” y otro de fase III (Tabla 2).
El primero de ellos, cuya etapa de reclutamiento finalizó en 2 007/2 008, constaba de 3 dosis de Adenovirus recombinante para las proteínas Gag, Pol y Nef. El ensayo fue finalizado antes de lo planeado, debido a que hubo una mayor proporción de voluntarios infectados en el grupo vacunado que en aquel que recibió placebo. Análisis posteriores revelaron que el mayor riesgo de infección estaba relacionado a la preexistencia de anticuerpos neutralizantes para Adenovirus asociada a la variable hombre no circuncidado47.
El otro ensayo finalizado recientemente se desarrolló en Tailandia con un resultado que aparenta ser una luz de esperanza. La vacuna consistió en cuatro dosis de virus Canarypox recombinante que expresaba Gag y Pro del subtipo B (cepa LAI) y gp120 de la CRF01_AE (recombinante inicialmente clasificada como subtipo E y luego renombrada como CRF01_AE48) unida a la porción de anclaje de gp41 del subtipo B (LAI), seguidas de dos dosis de una mezcla bivalente compuesta de proteínas recombinantes gp120 pertenecientes al subtipo B (cepa MN) y a la CRF01_AE49. El subtipo B es prevalente en EE.UU., Europa y gran parte de América Latina, Asia y Oceanía, mientras que la CRF01_AE es prevalente en Tailandia, otros países de Asia y algunos de Africa6. Se aplicaron vacuna y placebo a 16 402 voluntarios sanos. Se observó una efectividad de la vacuna del 31.2%, es decir que en el grupo inmunizado se infectaron un 31.2% menos de personas. Sin embargo, no se observaron diferencias en la CV ni el recuento de células T CD4+ en las personas que se infectaron, independientemente de que hubiesen recibido la vacuna o el placebo. Aún no están dilucidados los mecanismos inmunes que median los resultados observados, aunque en base a ellos los autores del estudio sugieren la posibilidad de que los mecanismos inmunológicos que median la protección frente a la infección con HIV serían distintos de aquellos que mediarían el control de la replicación en la infección temprana49. Un dato a resaltar de este ensayo es que a diferencia del que fue finalizado tempranamente, aquí se inmunizó con antígenos del subtipo prevalente en la región en que se ensayó la vacuna. Si bien los porcentajes de protección no son muy alentadores, éste es el primer ensayo donde se observa algún grado de protección en humanos, siendo un gran avance en el camino de la búsqueda de una vacuna frente a HIV49.
Importancia de la variabilidad en el desarrollo de una vacuna
Un obstáculo crítico en el desarrollo de vacunas para HIV-1 es cómo inducir una respuesta comandada por células T específicas capaces de sortear la variabilidad intra- e inter-subtipos o formas recombinantes. En una persona infectada, las células T CD4+ y CD8+ específicas pueden exhibir cierto grado de reactividad frente a epítopes conservados de otro subtipo, pero la respuesta tiende a ser mayor frente al subtipo infectante. Así, un paciente infectado con un subtipo de HIV-1, tiene respuestas celulares y humorales frente al virus que lo infecta y, aunque se ha demostrado que existen respuestas cruzadas a otros subtipos virales, la fuerza y la amplitud de estas respuestas suelen ser limitadas21-23, 36. Un ejemplo claro de la importancia que puede tener la variabilidad de un virus en la efectividad de una vacuna se pone de manifiesto en la necesidad de un cambio anual en la vacuna frente al virus de la gripe. El virus influenza sufre un 2% de cambios aminoacídicos de manera interanual, los cuales pueden causar falla en la reactividad cruzada de la respuesta policlonal inducida tras la inmunización, generando la necesidad de cambiar la cepa de la vacuna cada año50.
La diversidad de epítopes entre subtipos hace poco probable que la utilización como inmunógeno de un aislamiento natural proteja frente a otros subtipos virales o variantes dentro del mismo. Los virus pertenecientes al mismo clado pueden variar hasta un 20% en la secuencia proteica de la envoltura, mientras que esta diferencia puede ser de hasta un 35% entre virus pertenecientes a distintos subtipos51, 52. A pesar de la gran diversidad del HIV, la mayor parte de los candidatos a vacunas que se utilizaron en los primeros ensayos clínicos contenían inmunógenos del subtipo B, dominante en EE.UU. y Europa. Recientemente, para enfrentar la variabilidad viral se han incluido otros subtipos y CRFs, tanto en ensayos clínicos49, 50, 53 como pre-clínicos54-58 (Tabla 1). Otras estrategias que han sido utilizadas son la combinación de inmunógenos de diferentes subtipos49, 53, 55-59, secuencias consenso entre varios subtipos60, o la utilización de inmunógenos mosaico, formados por la optimización de fragmentos de secuencias naturales, así como la construcción de inmunógenos provenientes de regiones conservadas60. Otra metodología empleada es la utilización de antígenos de subtipos o variantes circulantes del lugar donde se utilizará la vacuna50, como en el caso del último ensayo clínico de fase III desarrollado en Tailandia49. En la Tabla 1 se resumen los ensayos clínicos más importantes que se están llevando a cabo actualmente, donde se puede observar la diversidad de antígenos que se utilizan, pertenecientes a distintos subtipos53.
TABLA 1.- Resumen de ensayos clínicos en curso53
Candidatos para vacunas contra HIV/sida en ensayos clínicos actuales

TR: Transcriptasa reversa
ANRS: Agence Nationale de Recherches sur le Sida (France)
HVTN: HIV Vaccine Trials Network
IAVI: International AIDS Vaccine Initiative
MHRP: United States Military HIV Research Program
MoPH: Ministry of Public Health of Thailand
MUCHS: Muhimbili University College of Health Sciences
IN: Intedrasa
NIAID: National Institute of Allergy and Infectious Diseases
NIH: National Institutes of Health
SAAVI: South African AIDS Vaccine Initiative
SMI: Swedish Institute for Infectious Disease Control
VRC: Vaccine Research Center
G.B.= Gran Bretaña
* Finalizado48
** Concluyó el enrrolamiento en septiembre 2007, pero continúa el seguimiento y análisis de datos
Estrategia “Prime-Boost”:
Uno de los mayores logros de la humanidad sin duda ha sido el control de las enfermedades infecciosas mediante el desarrollo de vacunas. Algunos de los planes de vacunación más exitosos han logrado eliminar o controlar completamente a los virus causantes de la viruela y polio, respectivamente. Sin embargo, aún no se ha logrado controlar totalmente a ciertos patógenos utilizando las estrategias de vacunación tradicionales, que son principalmente inductoras de respuestas de anticuerpos de larga duración. Dichos patógenos incluyen a HIV, Mycobacterium tuberculosis y el parásito de la malaria (Plasmodium falciparum), compartiendo la característica de que la respuesta inmune celular es primordial en la protección frente a los mismos61-63.
Se ha observado que la administración de dosis repetidas de una vacuna conformada por un único vector es efectiva para incrementar los títulos de anticuerpos generados (dosis homólogas). Sin embargo, este tipo de estrategia resulta ineficiente para aumentar respuestas celulares, debido a que la respuesta inmune preexistente frente al vector evita una eficiente presentación de los antígenos64. Para vencer esta limitación, en los últimos años se ha aplicado un esquema de inmunización capaz de potenciar la respuesta celular, basado en dosis seriadas, expresando el mismo antígeno desde distintos vectores (dosis heterólogas). Esta estrategia es conocida ampliamente por su designación en ingles “prime-boost” y fue en un principio utilizada para generar respuesta de células CD8+ frente a malaria, inmunizando primeramente con un vector basado en el virus influenza y luego administrando el antígeno en una segunda dosis desde un vector basado en el virus Vaccinia65.
Actualmente, ésta es una de las estrategias más utilizadas en el campo del desarrollo de vacunas para HIV/sida, donde se puede encontrar combinación de vectores de ADN, como prime, y refuerzos o boost con vectores virales recombinantes57, 58, 66-69. De los ensayos en fase I, II y III en curso, 12 utilizan esquemas de prime-boost, que combinan ADN y vectores virales (Adenovirus o Poxvirus) (Tabla 1). Dentro de esta estrategia, los vectores más utilizados como boost son los virus de la familia Poxviridae, como el virus Vaccinia en su variante atenuada MVA (modified Vaccinia virus Ankara), Canarypox (empleado en el ensayo de fase III de Tailandia49) y Fowlpox.
Aportes de nuestro grupo al desarrollo de vacunas para HIV/sida
Dada la complejidad a nivel molecular que muestra el HIV, es importante evaluar cuál es el impacto de esta variabilidad en el desarrollo de vacunas para nuestra región.
Aunque los extensivos datos epidemiológicos demuestran la importancia de la CRF12_BF y variantes recombinantes relacionadas con ésta en la Argentina y otros países de Latinoamérica, no existen trabajos relacionados con la inmunogenicidad de antígenos BF salvo los realizados durante los últimos años en nuestro laboratorio. Por un lado, analizamos la importancia de las secuencias B y BF de Nef en la respuesta inmune celular en pacientes recientemente infectados en la Argentina36, mientras que por otro desarrollamos vectores vacunales que expresan las proteínas Nef54 y Env70 de la CRF12_BF para ensayar su inmunogenicidad en ratones, evaluando la relevancia de la inmunidad subtipo específica54, 71.
Respuesta inmune frente a Nef durante la seroconversión
Nef es una de las proteínas accesorias del HIV que ha sido objeto de estudio de muchos trabajos científicos vinculados a la evaluación de la respuesta inmune y al desarrollo de vacunas55, 67, 68, 72-74. Esto se debe a que Nef posee varias características que hacen de esta proteína un buen candidato vacunal. Es una de las primeras proteínas que se expresa en el ciclo viral75, convirtiéndola en un blanco temprano en la infección. En un estudio realizado con pacientes cursando la infección por HIV en diferentes estadios, se observó que Nef, junto con Gag, contienen la mayor densidad de epítopes siendo las proteínas del virus más reconocidas en los pacientes de este estudio. Otro dato interesante que se obtuvo de ese trabajo fue que los dos péptidos reconocidos con mayor frecuencia en esos pacientes pertenecían a Nef76. Por otro lado, Nef y Env, son las proteínas más variables del genoma viral, llegando a variar hasta un 30% en la secuencia aminoacídica entre distintos subtipos virales50. En el caso de NefBF y NefB existe un 24% de diferencia entre sus secuencias aminoacídicas. Finalmente, la cualidad más importante por la cual Nef se convierte en un buen candidato para ser utilizado como antígeno vacunal, es que la respuesta celular específica dirigida contra esta proteína durante la infección aguda y temprana representa el 94 y 46% del total de la magnitud de la respuesta total anti-HIV77, respectivamente. En el trabajo de Lichterfeld y col. se describió que durante la primo-infección, la respuesta T CD8+ fue preferencialmente dirigida contra Nef, mientras que en la infección crónica esta respuesta se dirigió contra Gag, Pol y Env77. Esto muestra cómo va cambiando el blanco de la respuesta a lo largo del curso de la infección77. Estas evidencias demuestran que, durante la infección temprana, gran cantidad de la respuesta vinculada al descenso del pico inicial de la viremia26 está dirigida frente a Nef76, 77.
A partir de estos antecedentes, decidimos evaluar la respuesta inmune celular presente en pacientes infectados con virus perteneciente al subtipo B o recombinantes BF, durante la infección temprana. Describimos la respuesta inmune dirigida frente a NefB o BF durante la seroconversión36, donde la respuesta inmune frente a esta proteína es dominante77. Encontramos una respuesta específica para cada clado, así como respuesta cruzada. El análisis detallado demostró que los pacientes infectados con variantes BF tenían una respuesta menos amplia, con reconocimiento de menos epítopes, pero de mayor magnitud (Fig. 1). En particular, el reconocimiento de la secuencia del loop de la proteína fue mayor al publicado previamente77-80. Otro importante aporte de este trabajo fue que cuando analizamos la polifuncionalidad de las células específicas, encontramos una asociación directa entre la mayor frecuencia de células polifuncionales (es decir, mayor calidad de la respuesta) y una mejor contención de la carga viral36.

Fig. 1.- Histogramas mostrando la frecuencia de reconocimiento (A y B) y la magnitud (mediana ± DS; C y D) de la respuesta frente a péptidos B (A y C) y péptidos BF (B y D). Las barras representan todas las respuestas positivas de pacientes B (barras blancas) y pacientes BF (barras negras). Los rectángulos al pie de la figura indican la numeración de aa, el número de péptido de cada set respectivo (NefB y NefBF) y los dominios estructurales de la proteína: 1, dominio N-terminal, 2, dominio core N-terminal; 3, dominio de oligomerización; 4, core central; 5, loop; 6, dominio C-terminal. Las regiones que comprenden cada dominio se muestran con distintos tonos de gris (Journal of Virology36, 2008, Vol. 82, p. 2853-66, DOI and reproduced with permission from American Society for Microbiology)36.
Modelos de vacunas
A pesar de que el primer virus Vaccinia recombinante para el gen env de HIV, basado en la cepa replicativa, resultó seguro y fue considerado inmunogénico81, la aparición de efectos adversos poco frecuentes, en personas inmunocomprometidas, impulsó el desarrollo y uso de cepas atenuadas, como MVA y NYVAC, para mejorar la seguridad del vector.
Actualmente, la cepa atenuada del virus Vaccinia mayormente usada es MVA, la que ha demostrado ser inocua tanto en animales normales como inmunocomprometidos, y no mostró efectos adversos al utilizarse para vacunar a 120 000 personas durante la erradicación de la viruela82. MVA es incapaz de replicar en células de mamífero83, donde el bloqueo en la replicación ocurre en el ensamblado del virión, lo que permite expresar los genes tempranos, intermedios y tardíos82.
Para evaluar la relevancia de la inmunidad subtipo específica en el desarrollo de potenciales vacunas, en nuestro laboratorio se desarrollaron vectores virales y de ADN (los que son ampliamente usados en ensayos clínicos y preclínicos) que expresan las proteínas Nef y Env de la CRF12_BF, para evaluar su inmunogenicidad en ratones54, 70, 71.
Como parte de su caracterización, luego del desarrollo de los vectores virales, MVAnefBF y VVenvBF (Virus Vaccinia, cepa replicativa), corroboramos la estabilidad genética de los mismos y que su replicación no se viera alterada por la presencia de las proteínas recombinantes54, 70. Del mismo modo, analizamos la capacidad de los vectores virales y de ADN (ADNnefBF y ADNenvBF), de expresar las proteínas de interés. El siguiente paso fue evaluar la inmunogenicidad de los vectores generados combinándolos en diferentes esquemas de inmunización en el modelo murino.
Nef: Para continuar y extender el análisis de la inmunogenicidad de NefBF, evaluamos la respuesta celular inducida en ratones, a partir de la inmunización con los vectores generados (ADN y MVA), analizando la respuesta específica y el grado de reactividad cruzada frente a la proteína Nef del subtipo B. Para esto, inmunizamos ratones con dos o tres dosis de ADN (2xADN o 3xADN) o combinaciones ADN/MVA o 3 dosis de ADN seguida por una de MVA (3xADN/MVA) (Fig. 2 A).
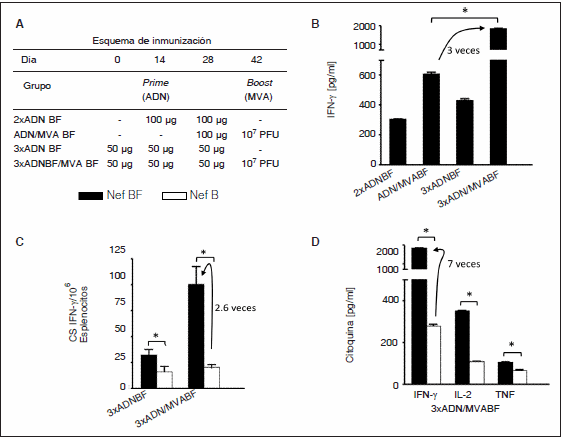
Fig. 2.- Respuesta inmune generada en ratones a partir de la inmunización con vectores que expresan Nef. A- Esquema de inmunización: grupos de 4 ratones recibieron las dosis indicadas. B- Diez días después de la última dosis, la respuesta celular fue evaluada, cuantificando IFN-γ en el sobrenadante de células de bazo reestimuladas durante 72 hs. C- Cuantificación de células secretoras IFN-γ específicas en los grupos indicados. D- Cuantificación de IFN-γ, IL-2 y TNF presente en los sobrenadantes de esplenocitos de los ratones inmunizados con 3xADN/MVA. En todos los casos, las células fueron reestimuladas con antígenos BF, B (valores del control negativo restados). Diferencias significativas entre los valores frente a BF y B están indicadas con un *. CS IFN-γ: células secretoras de IFN-γ. (Reprinted from Virus Research, 2009;146: 1-12. Copyright (2009), with permission from Elsevier)54.
Cuando evaluamos la respuesta inmune, midiendo IFN-γ en el sobrenadante de las células del bazo reestimuladas con el antígeno, observamos que la mayor respuesta se encontró en el grupo de animales que recibió el esquema 3xADN/MVA (Fig. 2 B).
La reactividad cruzada fue analizada por dos métodos: cuantificando las células específicas secretoras de IFN-γ (Fig. 2 C) o cuantificando IFN-γ, IL-2 y TNF en el sobrenadante de las células en cultivo durante 72 h (Fig. 2 D). Detectamos una respuesta específica frente al antígeno homólogo, mientras que la respuesta cruzada frente al antígeno del subtipo B fue de una magnitud entre 2.6 y 7 veces menor (Figs. 2 C y D). Al cuantificar otras citoquinas de importancia en la respuesta celular, como IL-2 y TNF en el sobrenadante de las mismas células, se observó presencia de ambas, aunque nuevamente se encontró menor respuesta frente al antígeno heterólogo (Fig. 2 D)54.
Env: Con el fin de evaluar la inmunogenicidad de EnvBF, contrastándola con la respuesta inmune generada por la envoltura del subtipo B, se aplicaron esquemas de inmunización prime boost, consistiendo de una dosis de ADN en el prime seguida de un boost con VV. Comparamos las respuestas generadas por los vectores que expresan EnvBF versus los que expresan EnvB. En primer lugar evaluamos la respuesta inmune generada frente a las regiones constantes y variables de gp120 y gp41. Tras la inmunización con el subtipo B se reconocieron varios péptidos ubicados en dos regiones constantes y en una variable de la secuencia homóloga EnvB, mientras que la respuesta inmune generada por la vacunación con EnvBF sólo reconoció una de las regiones constantes. El análisis de la secuencia indicó que la reactividad cruzada se halló en regiones conservadas entre ambas proteínas, o con cambios mínimos en la secuencia71.
En resumen, estos resultados al igual que los hallados con las inmunizaciones con Nef, mostraron una respuesta celular subtipo específica con bajos niveles de reactividad cruzada entre antígenos BF y B.
En conclusión, habiendo transcurrido ya casi 30 años de la descripción original del sida, aún no se ha logrado controlar la pandemia, ya sea mediante el uso de antivirales como tampoco mediante la generación de una vacuna. Se ha avanzado en el campo, pero aún quedan muchos interrogantes. En este sentido, el ensayo de Tailandia (fase III) se puede ver como un gran avance, ya que es la primera vez que se describe algún grado de protección en humanos, aunque de todas formas, un 30% de protección no es suficiente.
El avance en el conocimiento de la patogenia viral y la respuesta inmune del huésped ha llevado a que las nuevas investigaciones se focalicen en la respuesta inmune celular. Queda claro que la variabilidad del HIV es de suma importancia en el momento de elegir los antígenos involucrados en una vacuna. Se ha demostrado que la inmunidad subtipo específica y la reactividad cruzada juegan un rol importante en el reconocimiento de diferentes subtipos virales, lo que no garantiza la protección frente a todos los subtipos a partir de la inmunización con una variante aislada.
Dada la importancia de las variantes recombinantes BF en la Argentina y países limítrofes, nuestro grupo ha encarado los primeros estudios en cuanto a la inmunogenicidad de sus proteínas y la reactividad cruzada con el subtipo B. A partir de nuestros resultados, donde observamos que existe reactividad cruzada entre estos antígenos, pero de menor magnitud que la respuesta autóloga, sería importante considerar la inclusión de estos antígenos virales en el diseño de futuras vacunas para nuestra región, donde circulan variantes virales recombinantes BF y virus perteneciente al subtipo B, lo que podría facilitar la generación de una respuesta inmune efectiva en la población frente a ambos virus.
Agradecimientos: Este trabajo ha recibido financiación de la Agencia Nacional de Promoción Científica y Tecnológica (PICT 34410), y de la Agencia Española de Cooperación Internacional para el Desarrollo de España (A/025293/09). A. M. Rodríguez y M. F. Pascutti han recibido becas financiadas por la Agencia Nacional de Promoción Científica y Tecnológica.
1. ONUSIDA. Situación de la epidemia de sida, En: http://www.unaids.org/es/KnowledgeCentre/HIVData/EpiUpdate/EpiUpdArchive/2009/default.asp, 2009. [ Links ]
2. ONUSIDA. Towards Universal access: Scaling up priority HIV/AIDS interventions in the health sector. In: http://www.who.int/hiv/pub/2008progressreport/en/print.html; 2008, consultado en abril de 2010. [ Links ]
3. Fauci AS. 25 years of HIV. Nature 2008; 453: 289-90. [ Links ]
4. ONUSIDA. Situación de la epidemia de sida. En: http://data.unaids.org/pub/EPISlides/2007/2007_epiupdate_es.pdf, 2007. [ Links ]
5. Ministerio de Salud, PdlN. Boletín sobre el VIH-sida en la Argentina. 2009. [ Links ]
6. Taylor BS, Sobieszczyk ME, McCutchan FE, Hammer SM. The challenge of HIV-1 subtype diversity. N Engl J Med 2008; 358: 1590-602. [ Links ]
7. Los Alamos HIV Database HMID. En: http://www.hiv.lanl.gov/content/sequence/HIV/CRFs/CRFs.html, consultado en abril de 2010. [ Links ]
8. Hemelaar J, Gouws E, Ghys PD, Osmanov S. Global and regional distribution of HIV-1 genetic subtypes and recombinants in 2004. Aids 2006; 20: W13-23. [ Links ]
9. Osmanov S, Pattou C, Walker N, Schwardlander B, Esparza J. Estimated global distribution and regional spread of HIV-1 genetic subtypes in the year 2000. J Acquir Immune Defic Syndr 2002; 29: 184-90. [ Links ]
10. Carr JK, Avila M, Gomez Carrillo M, et al. Diverse BF recombinants have spread widely since the introduction of HIV-1 into South America. Aids 2001; 15: F41-7. [ Links ]
11. Pando MA, Eyzaguirre LM, Carrion G, et al. High genetic variability of HIV-1 in female sex workers from Argentina. Retrovirology 2007; 4: 58. [ Links ]
12. Gomez-Carrillo M, Pampuro S, Duran A, et al. Analysis of HIV type 1 diversity in pregnant women from four Latin American and Caribbean countries. AIDS Res Hum Retroviruses 2006; 22: 1186-91. [ Links ]
13. Segura EL, Sosa Estani S, Marone R, et al. Buenos Aires cohort of men who have sex with men: prevalence, incidence, risk factors, and molecular genotyping of HIV type 1. AIDS Res Hum Retroviruses 2007; 23: 1322-9. [ Links ]
14. Pando MA, De Salvo C, Bautista CT, et al. Human immunodeficiency virus and tuberculosis in Argentina: prevalence, genotypes and risk factors. J Med Microbiol 2008; 57: 190-7. [ Links ]
15. Gómez-Carrillo M., Salomon H., Pando M.A., Kijak G., M.M. A. Distribución de subtipos y recombinantes del HIV situacion en la Argentina. Medicina (Buenos Aires) 2001; 61: 881-9. [ Links ]
16. Castro E, Echeverria G, Deibis L, et al. Molecular epidemiology of HIV-1 in Venezuela: high prevalence of HIV-1 subtype B and identification of a B/F recombinant infection. J Acquir Immune Defic Syndr 2003; 32: 338-44. [ Links ]
17. Sierra M, Thomson MM, Rios M, et al. The analysis of near full-length genome sequences of human immunodeficiency virus type 1 BF intersubtype recombinant viruses from Chile, Venezuela and Spain reveals their relationship to diverse lineages of recombinant viruses related to CRF12_BF. Infect Genet Evol 2005; 5: 209-17. [ Links ]
18. Holguin A, de Mulder M, Yebra G, Lopez M, Soriano V. Increase of non-B subtypes and recombinants among newly diagnosed HIV-1 native Spaniards and immigrants in Spain. Curr HIV Res 2008; 6: 327-34. [ Links ]
19. Aguayo N, Laguna-Torres VA, Villafane M, et al. Epidemiological and molecular characteristics of HIV-1 infection among female commercial sex workers, men who have sex with men and people living with AIDS in Paraguay. Rev Soc Bras Med Trop 2008; 41: 225-31. [ Links ]
20. Ruchansky D, Casado C, Russi JC, Arbiza JR, Lopez-Galindez C. Identification of a new HIV Type 1 circulating recombinant form (CRF38_BF1) in Uruguay. AIDS Res Hum Retroviruses 2009; 25: 351-6. [ Links ]
21. Geldmacher C, Currier JR, Gerhardt M, et al. In a mixed subtype epidemic, the HIV-1 Gag-specific T-cell response is biased towards the infecting subtype. Aids 2007; 21: 135-43. [ Links ]
22. Currier JR, Dowling WE, Wasunna KM, et al. Detection of high frequencies of HIV-1 cross-subtype reactive CD8 T lymphocytes in the peripheral blood of HIV-1-infected Kenyans. Aids 2003; 17: 2149-57. [ Links ]
23. Currier JR, deSouza M, Chanbancherd P, Bernstein W, Birx DL, Cox JH. Comprehensive screening for human immunodeficiency virus type 1 subtype-specific CD8 cytotoxic T lymphocytes and definition of degenerate epitopes restricted by HLA-A0207 and -C(W)0304 alleles. J Virol 2002; 76: 4971-86. [ Links ]
24. Johnston MI, Fauci AS. An HIV vaccine-evolving concepts. N Engl J Med 2007; 356: 2073-81. [ Links ]
25. Barouch DH. Challenges in the development of an HIV-1 vaccine. Nature 2008; 455: 613-9. [ Links ]
26. Koup RA, Safrit JT, Cao Y, et al. Temporal association of cellular immune responses with the initial control of viremia in primary human immunodeficiency virus type 1 syndrome. J Virol 1994; 68: 4650-5. [ Links ]
27. Jin X, Bauer DE, Tuttleton SE, et al. Dramatic rise in plasma viremia after CD8(+) T cell depletion in simian immunodeficiency virus-infected macaques. J Exp Med 1999; 189: 991-8. [ Links ]
28. Borrow P, Lewicki H, Wei X, et al. Antiviral pressure exerted by HIV-1-specific cytotoxic T lymphocytes (CTLs) during primary infection demonstrated by rapid selection of CTL escape virus. Nat Med 1997; 3: 205-11. [ Links ]
29. Goulder PJ, Phillips RE, Colbert RA, et al. Late escape from an immunodominant cytotoxic T-lymphocyte response associated with progression to AIDS. Nat Med 1997; 3: 212-7. [ Links ]
30. Kaslow RA, Carrington M, Apple R, et al. Influence of combinations of human major histocompatibility complex genes on the course of HIV-1 infection. Nat Med 1996; 2: 405-11. [ Links ]
31. Scherer A, Frater J, Oxenius A, et al. Quantifiable cytotoxic T lymphocyte responses and HLA-related risk of progression to AIDS. Proc Natl Acad Sci USA 2004; 101: 12266-70. [ Links ]
32. Letvin NL, Mascola JR, Sun Y, et al. Preserved CD4+ central memory T cells and survival in vaccinated SIV-challenged monkeys. Science 2006; 312: 1530-3. [ Links ]
33. Polacino PS, Stallard V, Klaniecki JE, et al. Role of immune responses against the envelope and the core antigens of simian immunodeficiency virus SIVmne in protection against homologous cloned and uncloned virus challenge in Macaques. J Virol 1999; 73: 8201-15. [ Links ]
34. Amara RR, Villinger F, Altman JD, et al. Control of a mucosal challenge and prevention of AIDS by a multiprotein DNA/MVA vaccine. Science 2001; 292: 69-74. [ Links ]
35. Gupta SB, Jacobson LP, Margolick JB, et al. Estimating the benefit of an HIV-1 vaccine that reduces viral load set point. J Infect Dis 2007; 195: 546-50. [ Links ]
36. Turk G, Gherardi MM, Laufer N, et al. Magnitude, breadth, and functional profile of T-cell responses during human immunodeficiency virus primary infection with B and BF viral variants. J Virol 2008; 82: 2853-66. [ Links ]
37. IAVI. IAVI Report 2005; 9. [ Links ]
38. Garcia PM, Kalish LA, Pitt J, et al. Maternal levels of plasma human immunodeficiency virus type 1 RNA and the risk of perinatal transmission. Women and Infants Transmission Study Group. N Engl J Med 1999; 341: 394-402. [ Links ]
39. Gray RH, Wawer MJ, Brookmeyer R, et al. Probability of HIV-1 transmission per coital act in monogamous, heterosexual, HIV-1-discordant couples in Rakai, Uganda. Lancet 2001; 357: 1149-53. [ Links ]
40. Pitisuttithum P, Gilbert P, Gurwith M, et al. Randomized, double-blind, placebo-controlled efficacy trial of a bivalent recombinant glycoprotein 120 HIV-1 vaccine among injection drug users in Bangkok, Thailand. J Infect Dis 2006; 194: 1661-71. [ Links ]
41. IAVI. Database of AIDS Vaccine Candidates in Clinical Trials, En: http://www.iavireport.org/trials-db/Pages/default.aspx; consultado en abril de 2010 [ Links ]
42. Flynn NM, Forthal DN, Harro CD, Judson FN, Mayer KH, Para MF. Placebo-controlled phase 3 trial of a recombinant glycoprotein 120 vaccine to prevent HIV-1 infection. J Infect Dis 2005; 191: 654-65. [ Links ]
43. Gilbert PB, Ackers ML, Berman PW, et al. HIV-1 virologic and immunologic progression and initiation of antiretroviral therapy among HIV-1-infected subjects in a trial of the efficacy of recombinant glycoprotein 120 vaccine. J Infect Dis 2005; 192: 974-83. [ Links ]
44. Gilbert PB, Peterson ML, Follmann D, et al. Correlation between immunologic responses to a recombinant glycoprotein 120 vaccine and incidence of HIV-1 infection in a phase 3 HIV-1 preventive vaccine trial. J Infect Dis 2005; 191: 666-77. [ Links ]
45. Robinson HL. New hope for an AIDS vaccine. Nat Rev Immunol 2002; 2: 239-50. [ Links ]
46. Hessell AJ, Rakasz EG, Tehrani DM, et al. Broadly neutralizing monoclonal antibodies 2F5 and 4E10 directed against the human immunodeficiency virus type 1 gp41 membrane-proximal external region protect against mucosal challenge by simian-human immunodeficiency virus SHIVBa-L. J Virol; 84: 1302-13. [ Links ]
47. McElrath MJ, De Rosa SC, Moodie Z, et al. HIV-1 vaccine-induced immunity in the test-of-concept Step Study: a case-cohort analysis. Lancet 2008; 372: 1894-905. [ Links ]
48. Kijak GH, McCutchan FE. HIV diversity, molecular epidemiology, and the role of recombination. Curr Infect Dis Rep 2005; 7: 480-8. [ Links ]
49. Rerks-Ngarm S, Pitisuttithum P, Nitayaphan S, et al. Vaccination with ALVAC and AIDSVAX to Prevent HIV-1 Infection in Thailand. N Engl J Med 2009; 361: 2209-20. [ Links ]
50. Gaschen B, Taylor J, Yusim K, et al. Diversity considerations in HIV-1 vaccine selection. Science 2002; 296: 2354-60. [ Links ]
51. Kostrikis LG, Bagdades E, Cao Y, Zhang L, Dimitriou D, Ho DD. Genetic analysis of human immunodeficiency virus type 1 strains from patients in Cyprus: identification of a new subtype designated subtype I. J Virol 1995; 69: 6122-30. [ Links ]
52. Buonaguro L, Tornesello ML, Buonaguro FM. Human immunodeficiency virus type 1 subtype distribution in the worldwide epidemic: pathogenetic and therapeutic implications. J Virol 2007; 81: 10209-19. [ Links ]
53. AVAC-Global Advovavy for HIV Prevention, En: www.avac.org/trials_table.htm; consultado en abril de 2010. [ Links ]
54. Rodriguez AM, Turk G, Pascutti MF, et al. Characterization of DNA and MVA vectors expressing Nef from HIV-1 CRF12_BF revealed high immune specificity with low cross-reactivity against subtype B. Virus Res 2009; 146: 1-12. [ Links ]
55. Gomez CE, Najera JL, Jimenez V, et al. Generation and immunogenicity of novel HIV/AIDS vaccine candidates targeting HIV-1 Env/Gag-Pol-Nef antigens of clade C. Vaccine 2007; 25: 1969-92. [ Links ]
56. Chen Z, Huang Y, Zhao X, Ba L, Zhang W, Ho DD. Design, construction, and characterization of a multigenic modified vaccinia Ankara candidate vaccine against human immunodeficiency virus type 1 subtype C/B'. J Acquir Immune Defic Syndr 2008; 47: 412-21. [ Links ]
57. Shephard E, Burgers WA, Van Harmelen JH, et al. A multigene HIV type 1 subtype C modified vaccinia Ankara (MVA) vaccine efficiently boosts immune responses to a DNA vaccine in mice. AIDS Res Hum Retroviruses 2008; 24: 207-17. [ Links ]
58. Burgers WA, Shephard E, Monroe JE, et al. Construction, characterization, and immunogenicity of a multigene modified vaccinia Ankara (MVA) vaccine based on HIV type 1 subtype C. AIDS Res Hum Retroviruses 2008; 24: 195-206. [ Links ]
59. Earl PL, Cotter C, Moss B, et al. Design and evaluation of multi-gene, multi-clade HIV-1 MVA vaccines. Vaccine 2009; 27: 5885-95. [ Links ]
60. Letourneau S, Im EJ, Mashishi T, et al. Design and pre-clinical evaluation of a universal HIV-1 vaccine. PLoS One 2007; 2: e984. [ Links ]
61. Seder RA, Hill AV. Vaccines against intracellular infections requiring cellular immunity. Nature 2000; 406: 793-8. [ Links ]
62. Woodland DL. Jump-starting the immune system: prime-boosting comes of age. Trends Immunol 2004; 25: 98-104. [ Links ]
63. Miceli IN, de Kantor IN. Vaccine against tuberculosis: between new and old technologies. Medicina (Buenos Aires) 1999; 59: 300-4. [ Links ]
64. Gherardi MM, Esteban M. Recombinant poxviruses as mucosal vaccine vectors. J Gen Virol 2005; 86: 2925-36. [ Links ]
65. Li S, Rodrigues M, Rodriguez D, et al. Priming with recombinant influenza virus followed by administration of recombinant vaccinia virus induces CD8+ T-cell-mediated protective immunity against malaria. Proc Natl Acad Sci U S A 1993; 90: 5214-8. [ Links ]
66. Gherardi MM, Najera JL, Perez-Jimenez E, Guerra S, Garcia-Sastre A, Esteban M. Prime-boost immunization schedules based on influenza virus and vaccinia virus vectors potentiate cellular immune responses against human immunodeficiency virus Env protein systemically and in the genitorectal draining lymph nodes. J Virol 2003; 77: 7048-57. [ Links ]
67. Cosma A, Nagaraj R, Buhler S, et al. Therapeutic vaccination with MVA-HIV-1 nef elicits Nef-specific T-helper cell responses in chronically HIV-1 infected individuals. Vaccine 2003; 22: 21-9. [ Links ]
68. Brave A, Gudmundsdotter L, Gasteiger G, et al. Immunization of mice with the nef gene from Human Immunodeficiency Virus type 1: Study of immunological memory and long-term toxicology. Infect Agent Cancer 2007; 2: 14. [ Links ]
69. Gherardi MM, Perez-Jimenez E, Najera JL, Esteban M. Induction of HIV immunity in the genital tract after intranasal delivery of a MVA vector: enhanced immunogenicity after DNA prime-modified vaccinia virus Ankara boost immunization schedule. J Immunol 2004; 172: 6209-20. [ Links ]
70. Mónaco D, Carobene M, Rodríguez A, et al. Generación y caracterización de un Vector Viral que expresa la proteína gp160 de la forma recombinante circulante del HIV, CRF12_BF. Actualizaciones en SIDA 2007; 15: 39. [ Links ]
71. Mónaco D, Pascutti M, Rodríguez A, et al. Comparison of the cellular immune response induced in Balb/c mice against Env of the more prevalent HIV variants in Argentina, Subtype B and CRF12_BF. AIDS Res Hum Retroviruses 2008; (Suppl 1) 56. [ Links ]
72. Gomez CE, Najera JL, Jimenez EP, et al. Head-to-head comparison on the immunogenicity of two HIV/AIDS vaccine candidates based on the attenuated poxvirus strains MVA and NYVAC co-expressing in a single locus the HIV-1BX08 gp120 and HIV-1(IIIB) Gag-Pol-Nef proteins of clade B. Vaccine 2007; 25: 2863-85. [ Links ]
73. Hinkula J, Svanholm C, Schwartz S, et al. Recognition of prominent viral epitopes induced by immunization with human immunodeficiency virus type 1 regulatory genes. J Virol 1997; 71: 5528-39. [ Links ]
74. Erfle V, Goebel FD, Guzman CA, Le Grand R. Vaccines based on Nef and on Nef/DeltaV2 Env. Microbes Infect 2005; 7: 1400-4. [ Links ]
75. Christian Hoffmann JKRyBSK. HIV Medicine. 15th Edition En: http://www.hivmedicine.com/hivmedicine2006.pdf; 2007. [ Links ]
76. Addo MM, Yu XG, Rathod A, et al. Comprehensive epitope analysis of human immunodeficiency virus type 1 (HIV-1)-specific T-cell responses directed against the entire expressed HIV-1 genome demonstrate broadly directed responses, but no correlation to viral load. J Virol 2003; 77: 2081-92. [ Links ]
77. Lichterfeld M, Yu XG, Cohen D, et al. HIV-1 Nef is preferentially recognized by CD8 T cells in primary HIV-1 infection despite a relatively high degree of genetic diversity. Aids 2004; 18: 1383-92. [ Links ]
78. Inwoley A, Recordon-Pinson P, Dupuis M, et al. Cross-clade conservation of HIV type 1 Nef immunodominant regions recognized by CD8+ T cells of HIV type 1 CRF02_AG-infected Ivorian (West Africa). AIDS Res Hum Retroviruses 2005; 21: 620-8. [ Links ]
79. Currier JR, Visawapoka U, Tovanabutra S, et al. CTL epitope distribution patterns in the Gag and Nef proteins of HIV-1 from subtype A infected subjects in Kenya: use of multiple peptide sets increases the detectable breadth of the CTL response. BMC Immunol 2006; 7: 8. [ Links ]
80. Malhotra U, Li F, Nolin J, et al. Enhanced detection of human immunodeficiency virus type 1 (HIV-1) Nef-specific T cells recognizing multiple variants in early HIV-1 infection. J Virol 2007; 81: 5225-37. [ Links ]
81. Cooney EL, Collier AC, Greenberg PD, et al. Safety of and immunological response to a recombinant vaccinia virus vaccine expressing HIV envelope glycoprotein. Lancet 1991; 337: 567-72. [ Links ]
82. Moss B, Carroll MW, Wyatt LS, et al. Host range restricted, non-replicating vaccinia virus vectors as vaccine candidates. Adv Exp Med Biol 1996; 397: 7-13. [ Links ]
83. Hochstein-Mintzel V HH, Stickl H. Virulenz und immunogenitat eines modiftzierten vaccinia-virus (Stamm MVA). Z Immun-Forsch 1972: 140-145. [ Links ]
Recibido: 13-5-2010
Aceptado: 20-8-2010














