Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Medicina (Buenos Aires)
versión impresa ISSN 0025-7680
Medicina (B. Aires) vol.70 no.6 Ciudad Autónoma de Buenos Aires nov./dic. 2010
ARTÍCULO ESPECIAL
Inmunoterapia del cáncer. Importancia de controlar la inmunosupresión
Mariana Malvicini1, Guillermo Puchulo1,2, Pablo Matar3, Guillermo Mazzolini1,2
1Laboratorio de Terapia Génica,
2Cátedra de Fisiopatología, Facultad de Ciencias Biomédicas, Universidad Austral;
3Instituto de Genética Experimental, Facultad de Ciencias Médicas, Universidad Nacional de Rosario
Dirección postal: Dr. Guillermo Mazzolini, Cátedra de Fisiopatología, Laboratorio de Terapia Génica, Facultad de Ciencias Biomédicas y Hospital Universitario Austral, Av. Pte. Perón 1500, 1635 Derqui-Pilar, Buenos Aires, Argentina Fax: (54-2322)482204 e-mail: gmazzoli@cas.austral.edu.ar
Resumen
Es cada vez mayor la evidencia experimental y clínica de que el sistema inmunitario interviene activamente en la patogénesis y el control de la progresión tumoral. Una respuesta antitumoral efectiva depende de la correcta interacción de varios componentes del sistema inmunitario, como las células presentadoras de antígeno y diferentes sub-poblaciones de linfocitos T. Sin embargo, los tumores malignos desarrollan numerosos mecanismos para evadir el reconocimiento y su eliminación por parte del sistema inmunitario. En esta revisión discutiremos algunos de esos mecanismos y posibles estrategias terapéuticas para contrarrestarlos.
Palabras clave: Cáncer; Inmunoedición; Linfocitos T reguladores; Células mieloides inmaduras; Inmunoterapia
Abstract
Cancer immunotherapy. Importance of overcoming immune suppression. Increasing evidence indicates that the immune system is involved in the control of tumor progression. Effective antitumor immune response depends on the interaction between several components of the immune system, including antigen-presenting cells and different T cell subsets. However, tumor cells develop a number of mechanisms to escape recognition and elimination by the immune system. In this review we discuss these mechanisms and address possible therapeutic approaches to overcome the immune suppression generated by tumors.
Key words: Cancer; Immunoediting; Regulatory T cells; Immature myeloid cells; Immunotherapy
La historia natural de un tumor incluye las fases de crecimiento in situ, invasión, extravasación y metástasis1. Durante esas fases, las células tumorales interaccionan con su microambiente tolerogénico y son influenciadas por señales que provienen del estroma, del endotelio vascular y del sistema inmunitario (SI). En este contexto, los tumores sólidos están infiltrados por diferentes tipos celulares, como linfocitos, macrófagos y mastocitos. Generalmente se ha asociado a estos últimos con la producción de factores relacionados con la inflamación crónica y la progresión tumoral2, mientras que el infiltrado de sub-poblaciones de linfocitos B y T, células NK y células dendríticas (CD) se ha relacionado con el control de la enfermedad y mejor pronóstico en muchos tipos de cáncer como melanoma, mama, ovario, linfoma no Hodkin, cáncer de cuello uterino, carcinoma urotelial, y carcinoma de colon3-5 . El SI se encuentra íntimamente relacionado con el desarrollo tumoral a través del papel protector ejercido por ciertas poblaciones celulares y otras implicadas en la promoción del tumor.
La teoría de la inmunoedición
El SI puede reconocer y eliminar de manera natural las células tumorales, ejerciendo cierta presión selectiva que los tumores deben evadir para poder crecer. La teoría de la inmunoedición6 propone un proceso de 3 fases: eliminación, mediante la cual el SI puede reconocer y deshacerse de las células tumorales recientemente originadas; equilibrio, donde el SI puede seleccionar y/o promover variantes de células tumorales que sobrevivan al control inmunológico, y escape, en la cual el tumor, a través del desarrollo de mecanismos de resistencia, puede evadir la respuesta inmunitaria.
Entre los principales mecanismos utilizados por los tumores para evitar el reconocimiento inmunológico se encuentran la inducción de una presentación antigénica inadecuada, la producción de factores inmunosupresores (como describiremos más adelante), la expresión de galectina-17 la activación de las señales negativas de co-estímulo8. Además, las células tumorales pueden promover la expansión, activación y migración de ciertos tipos de células reguladoras capaces de suprimir la respuesta inmunitaria antitumoral, tales como linfocitos T reguladores (Tregs), células supresoras mieloides (MDSCs), macrófagos asociados al tumor (TAM) y distintos subtipos de CD maduras e inmaduras9 (Fig. 1).
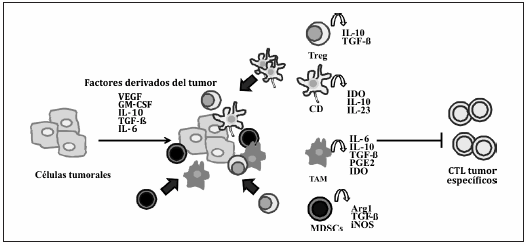
Fig. 1.- Reclutamiento de células al sitio del tumor y supresión de la respuesta antitumoral. La producción de factores inmunosupresores como TGF-β , VEGF, IL-6 o IL-10 por parte del tumor induce la movilización de células de fenotipo y actividad supresora como las células T reguladoras, las mieloides supresoras, las células dendríticas tolerogénicas y los macrófagos asociados al tumor. Estas células pueden inhibir la proliferación de linfocitos T específicos del tumor, inducirlos a un estado de anergia o conducirlos a la apoptosis a través de distintos mecanismos como la secreción de TGF-β, IL-6, IL-10, IL-13, IL-23, prostaglandina-E2 (PGE2) o la expresión de enzimas como IDO, arginasa I o iNOS.
Células T reguladoras
Las Tregs fueron identificadas como un subtipo de linfocitos T CD4+ que constitutivamente expresan la molécula CD25 y suprimen respuestas de linfocitos T efectores (CD4+ y CD8+) in vivo10. Se ha sugerido que el factor de transcripción forkhead box P3 (Foxp3) representa un marcador intracelular altamente específico de estas células, sobre todo cuando está co-expresado con otros marcadores como CTLA-4, GITR, LAG-3 y neuropilina11. Se han identificado al menos dos sub-poblaciones celulares CD4+CD25+; por un lado, las “naturales” que tiene su origen en el timo, actúan por contacto célula-célula y cuya función depende en gran medida de la expresión de Foxp310, y las “inducidas” por diferentes entornos periféricos, que inhiben la respuesta efectora a través de la secreción de citoquinas. Estas son las células Tr-1 que producen IL-1012 y las células Th3, productoras de IL-10 y TGF-β13. Las Tregs inhiben la respuesta antitumoral a través de diversos mecanismos. Pueden bloquear la activación de células T CD8+ y CD4+9 e inhibir la actividad citotóxica y la producción de citoquinas por parte de células NK14. Además, modulan la presentación antigénica de las células dendríticas (CDs), volviéndolas tolerantes. A través de la expresión de CTLA-4, las Tregs pueden regular negativamente la expresión de las moléculas de co-estímulo10 e inducir un aumento de la actividad de la enzima indoleamina 2,3 dioxigenasa (IDO)15. Debido a la degradación exacerbada de triptófano y la producción de kinurenina, las células CD4+ y CD8+ mueren por apoptosis en un microambiente deplecionado del aminoácido11.
Células supresoras de origen mieloide (MDSC)
Constituyen una población heterogénea de células inmaduras compuesta por macrófagos, granulocitos, y otras poblaciones de origen mieloide en estadios tempranos de diferenciación. En ratones, las MDSC se definen como células con un fenotipo Gr-1+ CD11b+16 que se acumulan en el bazo y, en algunos casos, en ganglios linfáticos de animales portadores de tumor17. Se ha demostrado que diferentes factores de crecimiento producidos por células tumorales, como GM-CSF y VEGF, pueden movilizar MDSC desde la médula ósea hacia el sitio del tumor e inducir un fenotipo inmunosupresor18. Varios estudios han indicado que el metabolismo del aminoácido L-arginina, mediado por la sintetasa inducible del óxido nítrico (iNOS) o Arginasa 1 (Arg 1), cumpliría un papel central en su actividad supresora19. La expresión de Arg 1 en MDSC disminuye la disponibilidad de arginina, y conduce a la pérdida de expresión de CD3ξ y deterioro de la función de linfocitos T20. Se ha observado que la ciclooxigenasa-2 (COX-2) producida por células tumorales de pulmón induce un aumento en la expresión de Arg 1 en MDSC humanas21. Por otro lado, la generación de NO a través de iNOS también puede bloquear la respuesta celular T22. Además de inhibir in vitro la proliferación de linfocitos T, las MDSC promueven la expansión de Tregs in vivo de manera dependiente de IFN-γ e IL-1022.
Macrófagos asociados al tumor
Los macrófagos asociados al tumor (TAM) son células con varias funciones pro-tumorales incluyendo promoción de la angiogénesis, remodelación de la matriz extracelular y supresión de la respuesta inmunitaria antitumoral efectora. Pueden inhibir la respuesta T antitumoral mediante la producción de ROS, de kinureninas (productos de la actividad de IDO)19, 23 y atrayendo Tregs al sitio del tumor24. Además, pueden bloquear la respuesta efectora a través de la expresión de B7-H4 regulando negativamente la activación de los LT25 y participar en la remodelación de la matriz extracelular a través de la producción de altos niveles de diferentes metaloproteasas26. Por otro lado, pueden producir VEGF, estimulando la formación de nuevos vasos sanguíneos y facilitando la entrada de células tumorales en el torrente sanguíneo, un paso muy importante en el proceso de metástasis27.
Células dendríticas
Las CDs son las células presentadoras de antígeno por excelencia. Tienen su origen en la médula ósea y pueden pertenecer al linaje mieloide o linfoide. Las CDs inmaduras no expresan niveles significativos de las moléculas de co-estímulo CD80, CD86 o CD40 y producen cantidades muy reducidas de IL-1228. En cambio, las CDs maduras inducidas por productos microbianos o células necróticas se caracterizan por expresar mayores niveles de moléculas co-estimulatorias y por secretar cantidades elevadas de IL-12; este fenotipo le permite a las CDs originar una respuesta inmunitaria antígeno-específica mediada por linfocitos T28. En cáncer, las CDs pueden presentar una función dual. En su estado maduro son capaces de inducir una respuesta inmunitaria antitumoral, pero en un estado inmaduro pueden inducir tolerancia, fracasando en la eliminación de células tumorales29. Se ha demostrado que ciertos defectos en el proceso de maduración de las CDs son responsables de facilitar el escape tumoral del SI. Se ha identificado la participación activa de diferentes factores de crecimiento en el proceso de inhibición de la diferenciación y maduración de CDs, como VEGF, M-CSF, IL-10 e IL-6.
Evidencias clínicas
Estudios epidemiológicos demuestran los efectos de la inflamación crónica en la promoción del cáncer. El proceso de inflamación crónica puede originarse luego de una infección, como es el caso del Helicobacter pylori en el cáncer gástrico30, o el virus de la hepatitis B en el hepatocarcinoma31, 32, así como también durante enfermedades autoinmunes, como la enfermedad de Crohn o la colitis ulcerosa asociadas al cáncer colo-rectal 3, 34. Uno de los principales tipos celulares involucrados en este proceso es el macrófago, a través de la producción de diferentes factores solubles promotores de proliferación celular, angiogénesis, quimiotaxis e invasión, y al mismo tiempo inhibición de la respuesta inmunitaria.
Las primeras publicaciones acerca de la función de las Tregs en tumores humanos son muy recientes. En el año 2004, Curiel y col.34, demostraron por primera vez que la presencia de un alto contenido de células CD3+ CD4+ CD25+ Foxp3+ en el líquido ascítico de pacientes con carcinoma de ovario se correlacionaba con los estadios más avanzados del tumor y con menor supervivencia. Resultados similares se observaron en otros tipos de tumores como adenocarcinoma ductal pancreático35 y hepatocarcinoma36. Aunque la mayoría de las Tregs son células CD4+, una población de células CD8+ inducidas por las CD plasmocitoides han sido identificadas en pacientes con cáncer de ovario37. Así, la inducción de Tregs podría ser uno de los principales mecanismos de escape de los tumores al rechazo inmunológico, constituyendo un marcador pronóstico de la enfermedad y un blanco celular atractivo para el diseño de inmunoterapias. Un estudio reciente reveló que en una población de pacientes con cáncer de mama, próstata o glioma, la proporción de CD circulantes se encontraba disminuida38. La presencia de un número menor de CD en el microambiente tumoral traería como consecuencia el desarrollo de una respuesta inmunitaria menos efectiva.
Por el contrario, otros estudios indicaron que la infiltración tumoral de algunas sub-poblaciones linfocitarias se correlaciona con un mejor pronóstico y/o mayor supervivencia. Esta correlación ha sido observada en pacientes con melanoma39, carcinomas de próstata40, mama41, 42, colo-rectal43, y ovario44. La naturaleza del infiltrado T en pacientes con cáncer de colon resultó ser un factor pronóstico superior al estadio histológico que se utiliza clásicamente45. En este estudio, los pacientes que presentaron tumores infiltrados por células T con marcadores específicos de respuesta Th1 y función citotóxica o de memoria tuvieron una menor tasa de recidivas. Estos resultados refuerzan el concepto de la inmunovigilancia en las neoplasias humanas.
Estrategias terapéuticas
Las estrategias terapéuticas destinadas a revertir el estado de inmunosupresión de los portadores de tumor constituye un área de investigación muy activa46. Con este objetivo, se han desarrollado anticuerpos monoclonales dirigidos contra epitopes específicos ubicados en la superficie de linfocitos Tregs, como CD25 y CTLA-4, con el propósito de disminuir su cantidad y/o bloquear su función. En un estudio reciente, el uso de anti-CTLA-4, anti-CD25 o anti-GITR en ratones portadores de tumor (sarcoma y cáncer de colon) mostraron una leve disminución en el crecimiento tumoral. Solamente la combinación entre anti-CTLA-4 y anti-GITR condujo al rechazo tumoral en el 80% de los casos47. A nivel clínico, actualmente se encuentran en evaluación protocolos que utilizan un anticuerpo humanizado anti-CD25 (daclizumab) o una inmunotoxina recombinante (RFT5-SMPT-dgA) dirigida también contra el CD25 con el objeto de deplecionar las Tregs48-50. Aun así, estos agentes poseen baja especificidad, ya que también neutralizan los mismos epitopes ubicados sobre otros tipos celulares51.
Una estrategia terapéutica alternativa consiste en la utilización de drogas inmunomoduladoras. La ciclofosfamida (Cy) es un agente alquilante con efecto antitumoral ampliamente documentado en modelos experimentales y humanos52, 53. Como modulador de la respuesta inmunitaria en cáncer, se ha demostrado que Cy, en dosis bajas, induce la regresión de tumores y metástasis54 a través de un cambio en el perfil de citoquinas, de Th2 a Th1, y un aumento en la capacidad proliferativa de linfocitos T activados55. Un hallazgo importante fue que la Cy elimina selectivamente las células CD4+ CD25+56. Hemos observado un resultado similar en nuestro laboratorio trabajando con un modelo murino de cáncer de colon (células CT26). El tratamiento combinado de Cy con terapia génica, utilizando un adenovirus que codifica para los genes de la IL-12 (Ad-IL12), resultó sinérgico en la erradicación de tumores, con regresiones completas en el 50% de los animales, prolongando de manera significativa su supervivencia57. La mayor potencia terapéutica de la combinación Cy+Ad-IL-12 se debió a la eliminación de mecanismos supresores de la respuesta antitumoral, mediante la reducción e inhibición específica del número y funcionalidad de las Tregs (datos no publicados).
En cuanto a la posibilidad de inhibir la función de MDSC se han investigado los efectos de algunos fármacos como el retinol, la vitamina D, inhibidores de COX-2 y otros. Estas terapias están dirigidas a promover la diferenciación de las MDSC a células maduras sin actividad supresora58. Por otra parte, un estudio de Kao y col.59 demostró que la administración de sunitinib, un inhibidor de receptores tirosina-kinasa, impide la acumulación de MDSC en modelos murinos de carcinoma de mama, colon o riñón y también en sangre periférica de pacientes con carcinoma renal. Otras drogas utilizadas en la terapia del cáncer como gemcitabina o 5-fluoruracilo pueden promover la respuesta inmunitaria antitumoral eliminando de manera selectiva las MDSCs60. En nuestro modelo experimental de cáncer de colon (CT26) hemos observado que la combinación Cy+AdIL-12 fue capaz de disminuir el porcentaje de MDSC en el bazo de ratones portadores de tumor. Además de suprimir los mecanismos que impiden el desarrollo de una respuesta antitumoral efectiva, la terapia combinada indujo un aumento significativo en la proporción de CDs maduras, lo que facilitaría el desarrollo de una respuesta inmune efectora capaz de inhibir el crecimiento tumoral57.
En conclusión, la identificación del amplio universo de células reguladoras es crucial para comprender los mecanismos de inmunosupresión que impiden el desarrollo de una respuesta inmunitaria antitumoral y obstaculizan el éxito de estrategias inmunoterapéuticas. Cada vez son más importantes los trabajos dirigidos a conocer cómo se reclutan en forma diferencial dichas células al entorno tumoral y qué factores controlan la interacción entre los diferentes tipos de células reguladoras. Como concepto emergente de este análisis postulamos la necesidad de considerar a futuro la incorporación de estrategias que controlen la actividad de factores y/o células con actividad inmunosupresora junto con las herramientas terapéuticas antitumorales tradicionales.
Agradecimientos: El trabajo de nuestro laboratorio es financiado parcialmente por la Agencia Nacional de Promoción Científica y Tecnológica (PICT 2005-34788, PICTO-CRUP 2005/31179) y por CONICET (PIP-CONICET).
Conflictos de interés: Los autores declaran no tener conflictos de interés respecto de esta publicación.
1. Laconi E, Sonnenschein C. Cancer development at tissue level. Semin Cancer Biol 2008; 18: 303-4. [ Links ]
2. Coussens LM, Werb Z. Inflammation and cancer. Nature 2002; 420: 860-7. [ Links ]
3. Sato E, Olson SH, Ahn J, et al. Intraepithelial CD8+ tumor-infiltrating lymphocytes and a high CD8+/regulatory T cell ratio are associated with favorable prognosis in ovarian cancer. Proc Natl Acad Sci USA 2005; 102: 18538-43. [ Links ]
4. Salama P, Phillips M, Grieu F, et al. Tumor-infiltrating FOXP3+ T regulatory cells show strong prognostic significance in colorectal cancer. J Clin Oncol 2009; 27: 186-92. [ Links ]
5. Sharma P, Shen Y, Wen S, et al. CD8 tumor-infiltrating lymphocytes are predictive of survival in muscle-invasive urothelial carcinoma. Proc Natl Acad Sci USA 2007; 104: 3967-72. [ Links ]
6. Dunn GP, Old LJ, Schreiber RD. The three Es of cancer immunoediting. Annu Rev Immunol 2004; 22: 329-60. [ Links ]
7. Rabinovich GA, Rubinstein N. Galectinas: una nueva familia de proteínas involucradas en la regulación de la respuesta inmune. Implicancias en procesos inmunopatológicos. Medicina (Buenos Aires) 2001;61: 85-92. [ Links ]
8. Rivoltini L, Carrabba M, Huber V, et al. Immunity to cancer: attack and escape in T lymphocyte-tumor cell interaction. Immunol Rev 2002; 188: 97-113. [ Links ]
9. Zou W. Regulatory T cells, tumour immunity and immunotherapy. Nat Rev Immunol 2006; 6: 295-307. [ Links ]
10. Sakaguchi S. Naturally arising CD4+ regulatory t cells for immunologic self-tolerance and negative control of immune responses. Annu Rev Immunol 2004; 22: 531-62. [ Links ]
11. Beissert S, Schwarz A, Schwarz T. Regulatory T cells. J Invest Dermatol 2006; 126: 15-24. [ Links ]
12. Roncarolo MG, Bacchetta R, Bordignon C, Narula S, Levings MK. Type 1 T regulatory cells. Immunol Rev 2001; 182: 68-79. [ Links ]
13. Weiner HL. Induction and mechanism of action of transforming growth factor-beta-secreting Th3 regulatory cells. Immunol Rev 2001; 182: 207-14. [ Links ]
14. Ralainirina N, Poli A, Michel T, et al. Control of NK cell functions by CD4+CD25+ regulatory T cells. J Leukoc Biol 2007; 81: 144-53. [ Links ]
15. Fallarino F, Grohmann U, Hwang KW, et al. Modulation of tryptophan catabolism by regulatory T cells. Nat Immunol 2003;4:1206-12. [ Links ]
16. Kusmartsev S, Gabrilovich DI. Immature myeloid cells and cancer-associated immune suppression. Cancer Immunol Immunother 2002; 51: 293-8. [ Links ]
17. Gabrilovich DI, Velders MP, Sotomayor EM, Kast WM. Mechanism of immune dysfunction in cancer mediated by immature Gr-1+ myeloid cells. J Immunol 2001; 166: 5398-406. [ Links ]
18. Bronte V, Chappell DB, Apolloni E, et al. Unopposed production of granulocyte-macrophage colony-stimulating factor by tumors inhibits CD8+ T cell responses by dysregulating antigen-presenting cell maturation. J Immunol 1999; 162: 5728-37. [ Links ]
19. Bronte V, Serafini P, Mazzoni A, Segal DM, Zanovello P. L-arginine metabolism in myeloid cells controls T-lymphocyte functions. Trends Immunol 2003; 24: 302-6. [ Links ]
20. Zea AH, Rodriguez PC, Atkins MB, et al. Arginase-producing myeloid suppressor cells in renal cell carcinoma patients: a mechanism of tumor evasion. Cancer Res 2005; 65: 3044-8. [ Links ]
21. Rodriguez PC, Hernandez CP, Quiceno D, et al. Arginase I in myeloid suppressor cells is induced by COX-2 in lung carcinoma. J Exp Med 2005; 202: 931-9. [ Links ]
22. Huang B, Pan PY, Li Q, et al. Gr-1+CD115+ immature myeloid suppressor cells mediate the development of tumor-induced T regulatory cells and T-cell anergy in tumor-bearing host. Cancer Res 2006; 66: 1123-31. [ Links ]
23. Pollard JW. Tumour-educated macrophages promote tumour progression and metastasis. Nat Rev Cancer 2004; 4: 71-8. [ Links ]
24. Woo EY, Chu CS, Goletz TJ, et al. Regulatory CD4(+)CD25(+) T cells in tumors from patients with early-stage non-small cell lung cancer and late-stage ovarian cancer. Cancer Res 2001;61:4766-72. [ Links ]
25. Kryczek I, Zou L, Rodriguez P, et al. B7-H4 expression identifies a novel suppressive macrophage population in human ovarian carcinoma. J Exp Med 2006; 203: 871-81. [ Links ]
26. Condeelis J, Pollard JW. Macrophages: obligate partners for tumor cell migration, invasion, and metastasis. Cell 2006; 124: 263-6. [ Links ]
27. Wyckoff J, Wang W, Lin EY, et al. A paracrine loop between tumor cells and macrophages is required for tumor cell migration in mammary tumors. Cancer Res 2004; 64: 7022-9. [ Links ]
28. Guermonprez P, Valladeau J, Zitvogel L, Thery C, Amigorena S. Antigen presentation and T cell stimulation by dendritic cells. Annu Rev Immunol 2002; 20: 621-67. [ Links ]
29. Tuyaerts S, Aerts JL, Corthals J, Neyns B, Heirman C, Breckpot K, Thielemans K, Bonehill A. Current approaches in dendritic cell generation and future implications for cancer immunotherapy. Cancer Immunol Immunother 2007; 56: 1513-37. [ Links ]
30. Hohenberger P, Gretschel S. Gastric cancer. Lancet 2003; 362: 305-15. [ Links ]
31. Teres J, Guardia J, Bruguera M, Rodes J. Hepatitis-associated antigen and hepatocellular carcinoma. Lancet 1971; 2: 215. [ Links ]
32. Blumberg BS, Larouze B, London WT, et al. The relation of infection with the hepatitis B agent to primary hepatic carcinoma. Am J Pathol 1975; 81: 69-82. [ Links ]
33. Brown JR, DuBois RN. COX-2: a molecular target for colorectal cancer prevention. J Clin Oncol 2005; 23: 2840-55. [ Links ]
34. Castellone MD, Teramoto H, Williams BO, Druey KM, Gutkind JS. Prostaglandin E2 promotes colon cancer cell growth through a Gs-axin-beta-catenin signaling axis. Science 2005; 310: 1504-10. [ Links ]
35. Hiraoka N, Onozato K, Kosuge T, Hirohashi S. Prevalence of FOXP3+ regulatory T cells increases during the progression of pancreatic ductal adenocarcinoma and its premalignant lesions. Clin Cancer Res 2006; 12: 5423-34. [ Links ]
36. Fu J, Xu D, Liu Z, et al. Increased regulatory T cells correlate with CD8 T-cell impairment and poor survival in hepatocellular carcinoma patients. Gastroenterology 2007; 132: 2328-39. [ Links ]
37. Wei S, Kryczek I, Zou L, et al. Plasmacytoid dendritic cells induce CD8+ regulatory T cells in human ovarian carcinoma. Cancer Res 2005; 65: 5020-6. [ Links ]
38. Pinzon-Charry A, Ho CS, Laherty R, et al. A population of HLA-DR+ immature cells accumulates in the blood dendritic cell compartment of patients with different types of cancer. Neoplasia 2005; 7: 1112-22. [ Links ]
39. Clemente CG, Mihm MC, Jr., Bufalino R, Zurrida S, Collini P, Cascinelli N. Prognostic value of tumor infiltrating lymphocytes in the vertical growth phase of primary cutaneous melanoma. Cancer 1996; 77: 1303-10. [ Links ]
40. Karja V, Aaltomaa S, Lipponen P, Isotalo T, Talja M, Mokka R. Tumour-infiltrating lymphocytes: A prognostic factor of PSA-free survival in patients with local prostate carcinoma treated by radical prostatectomy. Anticancer Res 2005; 25: 4435-8. [ Links ]
41. Marrogi AJ, Munshi A, Merogi AJ, et al. Study of tumor infiltrating lymphocytes and transforming growth factor-beta as prognostic factors in breast carcinoma. Int J Cancer 1997; 74: 492-501. [ Links ]
42. Menegaz RA, Michelin MA, Etchebehere RM, Fernandes PC, Murta EF. Peri- and intratumoral T and B lymphocytic infiltration in breast cancer. Eur J Gynaecol Oncol 2008; 29: 321-6. [ Links ]
43. Naito Y, Saito K, Shiiba K, et al. CD8+ T cells infiltrated within cancer cell nests as a prognostic factor in human colorectal cancer. Cancer Res 1998; 58: 3491-4. [ Links ]
44. Zhang L, Conejo-Garcia JR, Katsaros D, et al. Intratumoral T cells, recurrence, and survival in epithelial ovarian cancer. N Engl J Med 2003; 348: 203-13. [ Links ]
45. Pages F, Berger A, Camus M, et al. Effector memory T cells, early metastasis, and survival in colorectal cancer. N Engl J Med 2005; 353: 2654-66. [ Links ]
46. Copier J, Dalgleish AG, Britten CM, et al. Improving the efficacy of cancer immunotherapy. Eur J Cancer 2009; 45: 1424-31. [ Links ]
47. Mitsui J, Nishikawa H, Muraoka D, et al. Two distinct mechanisms of augmented antitumor activity by modulation of immunostimulatory/inhibitory signals. Clin Cancer Res; 16: 2781-91. [ Links ]
48. Rech AJ, Vonderheide RH. Clinical use of anti-CD25 antibody daclizumab to enhance immune responses to tumor antigen vaccination by targeting regulatory T cells. Ann N Y Acad Sci 2009; 1174: 99-106. [ Links ]
49. Powell DJ, Jr., Felipe-Silva A, Merino MJ, et al. Administration of a CD25-directed immunotoxin, LMB-2, to patients with metastatic melanoma induces a selective partial reduction in regulatory T cells in vivo. J Immunol 2007; 179: 4919-28. [ Links ]
50. Golovina TN, Vonderheide RH. Regulatory T cells: overcoming suppression of T-cell immunity. Cancer J; 16: 342-7. [ Links ]
51. Nizar S, Copier J, Meyer B, e al. T-regulatory cell modulation: the future of cancer immunotherapy? Br J Cancer 2009; 100: 1697-703. [ Links ]
52. Calabresi P, Welch AD. Chemotherapy of neoplastic disease. Annv Rev Med 1962; 13: 147-202. [ Links ]
53. De Vita VT. Principles of cancer management: chemotherapy. In: De Vita VT, Hellman S, Rosemberg SA, eds. Cancer-principles & Practice of Oncology. Philadelphia: Lippincott-Raven, 1997, p 333-47. [ Links ]
54. Matar P, Rozados VR, Gervasoni SI, Scharovsky OG. Down regulation of T-cell-derived IL-10 production by low-dose cyclophosphamide treatment in tumor-bearing rats restores in vitro normal lymphoproliferative response. Int Immunopharmacol 2001; 307-19. [ Links ]
55. Matar P, Rozados VR, Gervasoni SI, Scharovsky GO. Th2/Th1 switch induced by a single low dose of cyclophosphamide in a rat metastatic lymphoma model. Cancer Immunol Immunother 2002; 50: 588-96. [ Links ]
56. Zacarias Fluck MF, Rico MJ, Gervasoni SI, et al. Low-dose cyclophosphamide modulates galectin-1 expression and function in an experimental rat lymphoma model. Cancer Immunol Immunother 2007; 56: 237-48. [ Links ]
57. Malvicini M, Rizzo M, Alaniz L, et al. A novel synergistic combination of cyclophosphamide and gene transfer of interleukin-12 eradicates colorectal carcinoma in mice. Clin Cancer Res 2009; 15: 7256-65. [ Links ]
58. Gabrilovich DI, Nagaraj S. Myeloid-derived suppressor cells as regulators of the immune system. Nat Rev Immunol 2009; 9: 162-74. [ Links ]
59. Kao J, Ko EC, Eisenstein S, Sikora AG, Fu S, Chen SH. Targeting immune suppressing myeloid-derived suppressor cells in oncology. Crit Rev Oncol Hematol 2010 Mar 19 [Epub ahead of print] [ Links ]
60. Vincent J, Mignot G, Chalmin F, et al. 5-Fluorouracil selectively kills tumor-associated myeloid-derived suppressor cells resulting in enhanced T cell-dependent antitumor immunity. Cancer Res; 70: 3052-61. [ Links ]
Recibido: 27-9-10
Aceptado: 10-11-10














