Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Medicina (Buenos Aires)
Print version ISSN 0025-7680
Medicina (B. Aires) vol.71 no.1 Ciudad Autónoma de Buenos Aires Jan./Feb. 2011
ARTÍCULO ESPECIAL
Profilaxis con drogas antiepilépticas en enfermedades neurológicas
Luciano A. Sposato1,2, Alfredo Thomson3, Patricia M. Riccio1, Analía Calle3, Francisco R. Klein1,4
1Centro de Stroke, Instituto de Neurociencias de la Fundación Favaloro,
2Unidad de Investigación Neurovascular, INECO,
3División Epilepsia, Instituto de Neurociencias de la Fundación Favaloro,
4Unidad de Terapia Intensiva, Hospital Universitario, Fundación Favaloro, Buenos Aires
Dirección postal: Dr. Luciano A. Sposato, Instituto de Neurociencias de la Fundación Favaloro, Solís 461, 1078 Buenos Aires, Argentina Fax: (54-11) 4378-1200 e-mail: lucianosposato@gmail.com
Resumen
El uso profiláctico de drogas antiepilépticas en enfermedades neurológicas como el accidente cerebrovascular isquémico y hemorrágico, la hemorragia subaracnoidea, el traumatismo de cráneo y los tumores cerebrales ha sido motivo de controversia durante muchos años. Estas drogas son indicadas con el fin de disminuir el daño neurológico secundario a las crisis epilépticas. Sin embargo, la escasa evidencia científica disponible para avalar esta hipótesis, las potenciales interacciones farmacológicas, los efectos adversos y algunos informes sobre neurotoxicidad generan dudas en cuanto a esta conducta terapéutica.
En esta revisión, analizamos la evidencia acerca del uso profiláctico de drogas epilépticas en las enfermedades neurológicas arriba mencionadas.
Palabras clave: Drogas antiepilépticas; Accidente cerebrovascular; Tumores cerebrales; Traumatismo de cráneo; Hemorragia subaracnoidea
Abstract
Prophylactic treatment with antiepileptic drugs in neurological conditions. Prophylactic use of antiepileptic drugs in neurological conditions such as ischemic and hemorrhagic stroke, subarachnoid hemorrhage, head injury, and brain tumors has been matter of debate for many years. These drugs are used for reducing secondary neurological damage caused by epileptic seizures. However, the evidence supporting this indication is scarce. Potential drug interactions, side effects, and even neurotoxicity related to these drugs have raised concern about this therapeutic approach. In this review, we examine the evidence on the prophylactic use of antiepileptic drugs in the neurological disorders above mentioned.
Key words: Antiepileptic drugs; Stroke; Brain tumors; Traumatic brain injury; Subarachnoid hemorrhage
Determinadas enfermedades neurológicas como el accidente cerebrovascular (ACV) isquémico y hemorrágico, la hemorragia subaracnoidea (HSA), el traumatismo de cráneo y los tumores cerebrales requieren tratamientos específicos y otras medidas de orden general orientadas a prevenir complicaciones. Entre estas medidas, el uso profiláctico de drogas antiepilépticas (DAEs) ha sido motivo de controversia durante décadas. Las enfermedades neurológicas antes mencionadas son condiciones que pueden favorecer el desarrollo de crisis epilépticas, las que a su vez, pueden agravar aún más los propios cuadros neurológicos. Por otra parte, las DAEs podrían mitigar este daño neurológico a través de la reducción del número de crisis, aunque también podrían retrasar la recuperación. Por ejemplo, las nuevas DAEs han evidenciado un efecto neuroprotector en modelos animales de isquemia cerebral1. Sin embargo, las de primera generación se han asociado a retrasos en la recuperación neurológica, tanto en modelos animales como en ensayos clínicos de pacientes con ACV isquémico1. Además, las DAEs parecen asociarse con menor sinaptogénesis y conectividad, interfiriendo con la rehabilitación, asociándose a un peor pronóstico funcional y cognitivo2. Algunas incrementan la neurotransmisión gabaérgica inhibitoria y en animales experimentales favorecen la neurodegeneración apoptótica2.
La intrincada red de interacciones entre las enfermedades neurológicas antes mencionadas, las crisis epilépticas y las DAEs merece ser analizada considerando la evidencia científica para cada condición en particular.
Profilaxis antiepiléptica en el accidente cerebrovascular isquémico y hemorrágico
El ACV es la primera causa de epilepsia secundaria. A su vez, las crisis epilépticas ocurren hasta en el 4% de los pacientes con ACV isquémico y en el 17% de aquellos con ACV hemorrágico1, 3. La localización cortical, la gravedad del ACV y el mecanismo embólico han sido propuestos como factores predisponentes para el desarrollo de crisis luego del ACV isquémico, mientras que la proximidad cortical del sangrado, su volumen y la sepsis han sido asociados con su aparición en el ACV hemorrágico. Las crisis post-ACV pueden clasificarse en tempranas (≤ 14 días luego del ACV) o tardías. En el ACV isquémico se presentan más frecuentemente como crisis focales (parciales simples), pero pueden hacerlo como crisis con alteraciones de la cognición (parciales complejas), crisis tónico-clónicas generalizadas y hasta status epiléptico (SE). La frecuencia de SE luego del ACV varía entre el 0.2% y 0.8%1. En el ACV hemorrágico, más del 50% de las crisis son no convulsivas y solo se manifiestan por deterioro del nivel de conciencia4. Esto último puede dificultar el diagnóstico si no se realiza un electroencefalograma, ya que el deterioro del nivel de conciencia es una manifestación relativamente frecuente del ACV. En nuestra población hospitalaria hemos detectado status epilépticos no convulsivos hasta en el 5% de los pacientes con ACV isquémico, al seguir un protocolo de evaluación electroencefalográfica en casos de deterioro del nivel de conciencia sin causa evidente y no explicado por el mismo ACV5. Este es un dato de importancia ya que se ha notificado una mayor mortalidad en pacientes con ACV que desarrollaron crisis epilépticas no convulsivas6, así como también un mayor riesgo de demencia7. Con respecto a las crisis epilépticas convulsivas, no se ha demostrado un peor pronóstico en términos de discapacidad, mortalidad o mayores tasas de recurrencia del ACV.
Las DAEs reducen las tasas de recurrencia de crisis epilépticas pero no disminuyen el riesgo de epilepsia en pacientes con ACV isquémico o hemorrágico1, 3. Además, no existen estudios prospectivos y aleatorizados de DAEs utilizadas en forma profiláctica en pacientes con ACV. Por este motivo, factores como la toxicidad sistémica o neurológica, así como potenciales interacciones farmacológicas deben ser siempre considerados.
Las guías internacionales desaconsejan el uso de las DAEs en pacientes con ACV isquémico agudo que no hayan tenido crisis epilépticas8. Estas recomendaciones se basan en la baja frecuencia de crisis y en los potenciales efectos adversos de las DAEs, incluyendo sus interacciones con antiagregantes y anticoagulantes orales (Fig. 1). En cuanto al ACV hemorrágico las guías para el manejo de la hemorragia intraparenquimatosa de la American Heart Association no recomiendan el uso profiláctico de DAEs pero sí recomiendan estas drogas para pacientes con manifestaciones epilépticas clínicas o electroencefalográficas. Además sugieren el uso de monitoreo electroencefalográfico continuo para casos con alteración del nivel de conciencia9.
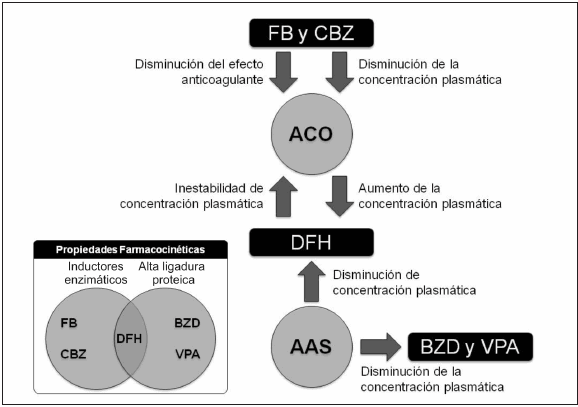
FB: fenobarbital. CBZ: carbamazepina. ACO: anticoagulantes orales. DFH: fenitoína. AAS: aspirina. BZD: benzodiacepinas. VPA: valproato.
Fig. 1.- Interacciones de DAEs de primera generación con antitrombóticos.
Profilaxis de las crisis en la hemorragia subaracnoidea aneurismática
El riesgo de crisis post HSA aneurismática se encuentra entre el 4 y el 27% (con los mejores datos alrededor del 5 al 8%). La mayoría son prehospitalarias o precoces, en el momento de la ruptura aneurismática o poco después, con un pico ictal y otro entre los 8 y los 14 días. La frecuencia de crisis decrece progresivamente con niveles extremadamente bajos luego del año. Las crisis postoperatorias en pacientes sin tratamiento con DAEs se observan entre el 3 y el 22% de los casos10.
Los fenómenos inflamatorios, el efecto de masa y las complicaciones serían responsables de las crisis precoces, mientras que en las tardías se implican la gliosis y la cicatrización meningo-parenquimatosa. Las indicaciones y duración del tratamiento con DAEs son controvertidas. Por un lado se ha planteado que su uso en forma preventiva podría reducir la morbilidad funcional, pero a su vez los efectos potencialmente deletéreos podrían actuar en sentido contrario. Los mecanismos de la morbimortalidad en las crisis post HSA aneurismática incluyen la precipitación del resangrado por hipertensión arterial, el desarrollo de hipertensión endocraneana o el aumento de la tasa metabólica cerebral. Por otra parte, las crisis parecen ser más un subrogante de gravedad que un marcador pronóstico independiente11.
Trabajos cooperativos encontraron que 66% de quienes fueron hospitalizados por una HSA aneurismática recibieron DAEs, siendo la fenitoína la más usada, seguida por fenobarbital. La profilaxis se asoció a empeoramiento neurológico, mayor vasoespasmo e infarto cerebral, mayor aparición de fiebre hasta los 8 días y peor pronóstico a tres meses. En el cálculo del riesgo-beneficio del tratamiento profiláctico, y dado que los efectos colaterales intolerables de la fenitoína tienen una frecuencia del 8% al 18%, la tasa de crisis debe igualarlos o superarlos para justificar su uso. En algunos estudios la tasa de crisis intrahospitalarias fue del 4%, con un 7% de efectos colaterales de la fenitoína12. No existen trabajos controlados con el uso de valproato. Un paciente con HSA aneurismática sería candidato a recibir tratamiento con DAEs en forma profiláctica si perteneciera al grupo de riesgo para el desarrollo de crisis. Los estudios prospectivos no lograron aún definir con claridad esta población, aunque podrían incluirse en ella a los pacientes con injuria cortical extensa (por la hemorragia inicial o post-quirúrgica), aquellos con edema cerebral grave, o cuando el aneurisma no pudiera ser tratado. En el resto, y con los datos corrientes, no parece justificado el uso rutinario de DAEs.
Profilaxis con drogas antiepilépticas en tumores cerebrales
La incidencia de epilepsia en pacientes con tumores cerebrales varía entre el 30% y el 70%. El riesgo depende del tipo de tumor y su localización2. Es más frecuente en los gliomas de bajo grado (60% a 85%) que en los de alto grado (20% a 40%) y los metastásicos (15% a 20%). El riesgo es mayor en tumores de localización cortical13.
Si bien existen estudios de profilaxis con carbamazepina, fenitoína, valproato y fenobarbital, no han sido identificados estudios con DAEs nuevas. Ninguno de estos trabajos demostró efectividad para reducir el número de crisis en ningún tipo de tumor14.
Cuando estos pacientes requieren cirugía, el tratamiento profiláctico reduce el riesgo de crisis sintomáticas tempranas hasta en un 40 a 50%, pero no reduce la incidencia de crisis tardías. Hallazgos similares se obtuvieron luego de craniectomías por otras causas, incluyendo malformaciones vasculares y abscesos. Un metaanálisis de estudios controlados aleatorizados exploró la profilaxis con DAEs posterior a cirugías supratentoriales, favoreciendo el uso de fenitoína para prevenir crisis tempranas, aunque sin evidencia para prevenir las crisis tardías15.
Los eventos adversos típicos de las DAEs, incluyendo trastornos cognitivos, mielosupresión, disfunción hepática y reacciones dermatológicas, ocurren más frecuentemente en pacientes con tumores cerebrales que en otros pacientes con epilepsia16. Los eventos adversos de las DAEs llevaron a la discontinuación del tratamiento en alrededor de un cuarto de los pacientes13.
El riesgo de interacciones con quimioterápicos es un aspecto de importancia. Las DAEs inductoras (carbamazepina, fenitoína, fenobarbital) inducen el citocromo P450 resultando en un aumento del metabolismo de muchos quimioterápicos13. Esta interacción es recíproca: estos fármacos también afectan el metabolismo de las DAEs, pudiendo llevarlas tanto a niveles tóxicos como subterapéuticos. Con respecto a la interacción con corticoides, las DAEs inductoras reducen la eficacia de los mismos13.
En pacientes con tumores cerebrales, las DAEs no han demostrado ser útiles para prevenir crisis. Debido a su falta de eficacia y la potencialidad de efectos adversos e interacciones farmacológicas, la profilaxis con DAEs no debería ser utilizada sistemáticamente en estos pacientes16. En pacientes con tumores cerebrales libres de crisis que requieran tratamiento quirúrgico, se recomienda la utilización de DAEs durante la primera semana postquirúrgica y su posterior discontinuación gradual, particularmente en aquellos médicamente estables y que han presentado efectos adversos16.
Profilaxis con drogas antiepilépticas en pacientes con traumatismo encefalocraneano
El traumatismo encefalocraneano (TEC) puede producir crisis epilépticas recurrentes. Las mismas se clasifican, de acuerdo al momento de su aparición, en inmediatas (< 24 horas), tempranas (≤ 7 días) o tardías (> 7 días)17. La incidencia de epilepsia post traumática (EPT) es mayor en adultos jóvenes y representa el 20% de las epilepsias sintomáticas en la población general y el 5% de las consultas referidas a centros especializados de epilepsia18. Entre el 80 y 90% de las crisis se manifiestan en los primeros 2 años luego del trauma, y el riesgo permanece elevado hasta 10 años después, pudiendo ser focales con o sin generalización secundaria.
Los factores de riesgo para desarrollar EPT son la duración de la alteración del nivel de conciencia, las lesiones penetrantes, la hemorragia intracerebral, las contusiones cerebrales difusas, la amnesia postraumática prolongada (≥ 3 días), el hematoma subdural quirúrgico, las crisis postraumáticas tempranas y la fractura de cráneo con hundimiento19.
Múltiples mecanismos están implicados en la génesis de la EPT: alteración en la expresión de los receptores de los neurotransmisores y canales iónicos; neurodegeneración, neurogénesis, lesión axonal, respuesta inflamatoria, daño de la barrera hematoencefálica y angiogénesis20. En modelos animales de EPT las DAEs han demostrado ser neuroprotectoras, disminuyendo el daño axonal por hipoxia, pero tal como fuera mencionado previamente, también pueden producir toxicidad neurológica.
Existe una amplia variedad de DAEs que pueden utilizarse, de las cuales 3 tienen presentación endovenosa: fenitoína, valproato y fenobarbital. Lamentablemente, no existen estudios controlados que demuestren la superioridad de ninguna de ellas para la EPT. Su uso profiláctico se justificaría en la primera semana post trauma. Luego de este período, es recomendable la discontinuación gradual en caso de no haberse comprobado crisis epilépticas. En lesiones que aumentan el riesgo de EPT se pueden utilizar más allá de los 7 días. Las DAEs disminuyen el riesgo de crisis precoces pero no hay evidencia acerca de que su utilización temprana disminuya el riesgo de desarrollar EPT hasta 2 años después del TEC.
En conclusión, la evidencia relacionada con la indicación de DAEs en forma profiláctica es escasa. Solo para pacientes con tumores intervenidos quirúrgicamente, con traumatismos craneoencefálicos y algunos con HSA pertenecientes a grupos de riesgo se recomienda el uso de DAEs durante una semana, con posterior discontinuación gradual. En el caso del ACV y de tumores cerebrales no quirúrgicos, se desaconseja utilizar estas drogas por la falta de evidencia acerca de su utilidad, su potencial neurotoxicidad, y la posibilidad de interacciones farmacológicas.
Conflictos de interés: Los autores no tienen conflictos de interés relacionados con esta revisión.
1. Camilo O, Goldstein LB. Seizures and epilepsy after ischemic stroke. Stroke 2004; 35: 1769-75. [ Links ]
2. Naidech AM, Kreiter KT, Janjua N, et al. Phenytoin exposure is associated with functional and cognitive disability after subarachnoid hemorrhage. Stroke 2005; 36: 583-7. [ Links ]
3. Gilmore, E, Choi A, Hirsch L, Claasen J. Seizures and CNS hemorrhage. Spontaneous intracerebral and aneurismal subarachnoid hemorrhage. The Neurologist 2010; 16: 165-75. [ Links ]
4. Vespa PM, O'Phelan K, Shah M, et al. Acute seizures after intracerebral hemorrhage: a factor in progressive midline shift and outcome. Neurology 2003; 60: 1441-6. [ Links ]
5. Riccio PM, Scocco D, Calle A, et al. Non-convulsive status epilepticus after acute ischemic stroke. Not so unusual, nor so unpredictable if systematically investigated. Stroke 2010, 41: e126. Abstract. [ Links ]
6. Burneo JG, Fang J, Saposnik G, for the Investigators of the Registry of the Canadian Stroke Network. Impact of seizures on morbidity and mortality after stroke: a Canadian multi-centre cohort study. Eur J Neurol 2010; 17: 52-8. [ Links ]
7. Cordonnier C, Hénon H, Derambure P, Pasquier F, Leys D. Early epileptic seizures after stroke are associated with increased risk of new-onset dementia. J Neurol Neurosurg Psychiatry 2010; 78: 514-6. [ Links ]
8. Adams HP, del Zoppo G, Alberts MJ, et al. Guidelines for the early management of adults with ischemic stroke. A Guideline From the American Heart Association/American Stroke Association Stroke Council, Clinical Cardiology Council, Cardiovascular Radiology and Intervention Council, and the Atherosclerotic Peripheral Vascular Disease and Quality of Care Outcomes in Research Interdisciplinary Working Groups. Stroke 2007; 38: 1655-711. [ Links ]
9. Morgenstern LB, hemphill III, JC, Anderson C, et al. Guidelines for the Management of Spontaneous Intracerebral Hemorrhage. A Guideline for Healthcare Professionals From the American Heart Association/Am. Stroke Association. Stroke 2010; 41: 2108-29. [ Links ]
10. Claassen J, Peery S, Kreiter KT, et al. Predictors and clinical impact of epilepsy after subarachnoid hemorrhage. Neurology 2003; 60: 208-14. [ Links ]
11. Lin YJ, Chang WN, Chang HW, et al. Risk factors and outcome of seizures after spontaneous aneurismal subarachnoid hemorrhage. Eur J Neurol 2008; 15: 451-7. [ Links ]
12. Rosengart AJ, Huo D, Tolentino J, et al. Outcome in patients with subarachnoid hemorrhage treated with antiepileptic drugs. J Neurosurg 2007; 107: 253-60. [ Links ]
13. Vecht CJ, van Breemen M. Optimizing therapy of seizures in patients with brain tumors. Neurology 2006; 67: S10-3. [ Links ]
14. Tremont-Lukats IW, Ratilal BO, Armstrong T, Gilbert MR. Antiepileptic drugs for preventing seizures in people with brain tumors. Cochrane Database Syst Rev 2008:CD004424. [ Links ]
15. Temkin NR. Antiepileptogenesis and seizure prevention trials with antiepileptic drugs: meta-analysis of controlled trials. Epilepsia 2001; 42: 515-24. [ Links ]
16. Glantz MJ, Cole BF, Forsyth PA, et al. Practice parameter: anticonvulsant prophylaxis in patients with newly diagnosed brain tumors. Report of the Quality Standards Subcommittee of the American Academy of Neurology. Neurology 2000; 54: 1886-93. [ Links ]
17. Agrawal A. Timothy J, Pandit L, Manju M. Post-traumatic epilepsy: An overview. Clin Neurol and Neurosurg 2006; 108: 433-9. [ Links ]
18. Post-traumatic epilepsy. In: Mild head injury: A Guide to Management. Wrightson P, Gronwall D; London: Oxford University Press; 1999, 72-5. [ Links ]
19. Christensen J, Pedersen MG, Pedersen CB, et al. Long-term risk of epilepsy after traumatic brain injury in children and young adults: a population-based cohort study. Lancet 2009; 373: 1105-10. [ Links ]
20. Kharatishvili I, Pitkänen A. Postraumatic epilepsy. Curr Opin Neurol 2010, 23: 183-8. [ Links ]
Recibido: 17-6-2010
Aceptado: 11-8-2010














