Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Medicina (Buenos Aires)
versión impresa ISSN 0025-7680
Medicina (B. Aires) vol.71 no.2 Ciudad Autónoma de Buenos Aires mar./abr. 2011
ARTÍCULO ESPECIAL
Regulación por proteasas del canal de sodio sensible al amiloride (ENaC)
Luciano Galizia, Alejandro Ojea, Basilio A. Kotsias
Laboratorio de Canales Iónicos, Instituto de Investigaciones Médicas Alfredo Lanari, Universidad de Buenos Aires
Dirección postal: Dr. Luciano Galizia, Instituto de Investigaciones Médicas Alfredo Lanari, Combatientes de Malvinas 3150, 1427 Buenos Aires, Argentina. Fax: (54-11) 4523-6619 e-mail: igalizia@gmail.com
Resumen
El ENaC es un canal que permite el movimiento de Na+ desde el líquido luminal hacia las células en numerosos epitelios reabsortivos y también en otros tejidos como la placenta. ENaC juega un papel crucial en la homeostasis de los electrolitos y volumen de líquido extracelular. Es regulado por numerosas hormonas, incluyendo la aldosterona y bloqueado por el diurético amiloride. El ENaC está formado por tres subunidades homólogas α, β y γ que forman el poro por el cual se mueven los iones Na+. Dos factores regulan la actividad del ENaC. 1) el número de canales insertos en la membrana celular y 2) la probabilidad de apertura o tiempo en que se encuentra abierto el canal. El número de canales es el resultado de un balance entre su síntesis y degradación. La probabilidad de apertura depende de la proteólisis de zonas específicas de las subunidades α y γ por múltiples proteasas dentro de la célula y en el espacio extracelular. Entre las proteasas más estudiadas se encuentran la furina, prostasina, elastasa, plasmina y tripsina. Existen sustancias endógenas que bloquean la actividad de estas proteasas como la aprotinina, la bikunina y la nexina-1 y la expresión de las proteasas y sus inhibidores es regulada a su vez por la aldosterona, la tasa de movimiento de Na y el TFGβ. En este trabajo presentamos algunos ejemplos de esta regulación y su potencial papel en condiciones normales y en ciertas enfermedades como la fibrosis quística, renales e hipertensión.
Palabras clave: ENaC; Regulación; Aldosterona; Proteasas; Inhibidores de las proteasas
Abstract
Amiloride sensitive sodium channels (ENaC) and their regulation by proteases. ENaC is a channel that mediates entry of Na+ from the luminal fluid into the cells in many reabsorbing epithelia and it is also expressed in human placenta. ENaC is crucial in the control of electrolyte and extracellular volume homeostasis. ENaC is regulated by several hormones, including aldosterone and blocked by amiloride and its analogs. ENaC channels are composed by three homologous subunits, α, β and γ that form the pore where Na ions are transported. Two factors regulate the activity of ENaC channels: 1) the number of channels inserted in the membrane and 2) the open probability of the channels or time that the channel is open. The number of channels is the result of a balance between the synthesis and degradation of ENaC channels. The open probability depends on the proteolysis of specific segments in the α and γ subunits of ENaC by multiple proteases inside of the cell or in the extracellular space. Among the most studied proteases are furin, prostasin, elastase, plasmin and trypsin. There are endogenous substances that block the activity of these proteases such as aprotinin, bikunin and nexin-1 and the expression of both, proteases and their inhibitors are controlled by the rate of Na+ movement, aldosterone and TFG-β levels. In this work we present some examples of this regulation and the potential role that this process may play under normal and pathological conditions such as cystic fibrosis, kidney diseases and hypertension.
Key words: ENaC; Regulation; Aldosterone; Proteases; Inhibitors of proteases
El contenido total de Na+ es el principal determinante del volumen del líquido extracelular debido a que la Na-K ATPasa impone una baja concentración de Na+ intracelular, mientras que la concentración extracelular de Na+ es mantenida en un valor constante por movimientos de agua. Uno de los principales mecanismos de transporte de Na+ es el canal de sodio sensible al amiloride (ENaC).
El canal epitelial de sodio sensible al amiloride
El ENaC presente en la cara apical de las células principales de los túbulos colectores corticales de mamíferos es el regulador del movimiento del catión desde el líquido tubular hacia el citoplasma. En la superficie del epitelio de las vías aéreas mantiene el volumen de líquido ayudando a la eliminación de las partículas y patógenos inhalados1. El ENaC se expresa en otros tipos celulares y en nuestro laboratorio hemos demostrado su presencia estructural y funcional en las células BeWo derivadas del trofoblasto humano2-5. El mal funcionamiento del ENaC es importante en enfermedades humanas como el pseudohipoaldosteronismo tipo I, síndrome de Liddle6 y la fibrosis quística7. De esto se infiere su importancia, y conocer su regulación lleva a entender mejor los mecanismos fisiopatogénicos cuando el canal no se expresa, o su densidad en la membrana celular está alterada o falla su regulación.
Estructura del ENaC
Hasta hace pocos años la mayor cantidad de evidencias parecían indicar que el ENaC está compuesto por cuatro subunidades homólogas en la relación 2α, β, γ, formando un tetrámero, lo que ahora se considera erróneo. En 2005 Staruschenko et al.8 con técnicas electrofisiológicas habían mostrado que las subunidades formadoras del ENAC eran tres y no cuatro, lo que fue también demostrado en 2007 por Jasti et al.9 al publicar sus resultados sobre la estructura del canal iónico sensible al ácido (ASIC). El ASIC, al igual que el ENaC, pertenece a las degenerinas, una superfamilia que codifica proteínas que intervienen en procesos biológicos como la nocicepción, sentido del gusto salado y táctil, homeostasis del Na+ y mecanotransducción10. La estructura del ASIC se estudió con una resolución de 1.9 Å, concluyendo que el canal al igual que el ENaC está formado por tres subunidades homólogas, α, β, γ; en otras palabras, un trímero alrededor del poro por el cual se mueven los iones Na+ (Fig. 1). Cada subunidad posee extremos amino y carboxílicos en la superficie extracelular de la membrana, un largo loop extracelular y dos hélices transmembrana M1 y M2.
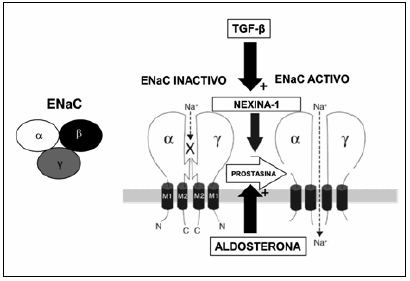
Fig. 1.- Regulación del ENaC por proteasas y sus inhibidores. Se esquematizan sólo las subunidades α y γ del ENaC, cada una con los segmentos transmembrana 1 y 2 y los extremos amino (N) y carboxilos (C). Debido a la acción de la prostasina se eliminan secuencias de aminoácidos inhibitorios de cada una de las subunidades (líneas cortadas) permitiendo el movimiento de Na+ por el canal. La prostasina es bloqueada por la nexina-1. Tanto el TGF-β como la aldosterona aumentan la expresión de la nexina-1 y prostasina de modo que del balance entre estos factores depende el grado de activación del ENaC.
Regulación del ENaC
La regulación del ENaC es compleja, activado por la aldosterona y la vasopresina, es sensible al amiloride y sus análogos que se unen en forma simultánea a las tres subunidades del ENaC bloqueando el poro iónico11. Los cambios en la presión hidrostática y el estiramiento regulan el ENaC12 y por su relación con el citoesqueleto podría ser el nexo entre determinados estímulos mecánicos y la migración celular3. Uno de los principales reguladores del ENaC son las proteasas que escinden al ENaC y lo activan13, 14.
El ENaC es un canal que en condiciones fisiológicas permite el pasaje de Na+ en forma continua a diferencia de los canales de Na+ que dependen de un estímulo eléctrico para activarse. Su actividad es regulada por dos mecanismos: 1) cambios en el tiempo en que están abiertos (probabilidad de apertura), y 2) número de canales insertos en la membrana, un balance entre su síntesis y degradación15. Existe una proteólisis de sitios específicos extracelulares de las subunidades α y γ por las proteasas incluyendo la furina en el sistema Golgi, la prostasina localizada en la membrana celular del riñón, pulmón y próstata entre otros órganos, las elastasas tripsina y plasmina entre otras14. La eliminación de estos péptidos inhibitorios -identificados por medio de mutaciones en los canales- es específica para cada una de las proteasas estudiadas, produciendo un cambio estructural en el canal, aumentando la probabilidad de apertura y permitiendo el paso de los iones Na+. Completando estos datos, Carattino et al.16 han comprobado una inhibición de ENaC en células renales cuando son expuestos a un péptido sintético similar al fragmento inhibitorio eliminado luego de la acción de la proteasa. La gran variabilidad en la probabilidad de apertura de ENaC que se comprueba en los distintos tejidos sería una consecuencia del grado de proteólisis que experimentan estos canales de acuerdo a las necesidades funcionales.
La Fig. 1 (derecha) muestra la regulación del ENaC por proteasas y sus inhibidores. Debido a la acción de la prostasina se elimina una secuencia de aminoácidos inhibitorios de cada una de las subunidades (líneas cortadas) activando el ENaC y permitiendo el movimiento de Na+ por el poro del canal. La prostasina cliva las subunidades α y γ con la eliminación de un péptido inhibitorio de cada una de las subunidades (líneas cortadas) permitiendo el movimiento de Na+ por el canal.
Las proteasas son a su vez reguladas por inhibidores endógenos como la aprotinina, la bikunina y la nexina-1, y su expresión es influenciada por la aldosterona17, 18 y por la tasa de movimiento de Na+ por el ENaC y la concentración intracelular de Na+19.
La furina cliva la subunidad α en dos sitios y en uno a la subunidad γ. Los ENaC que carecen de estos segmentos inhibitorios en las subunidades α y γ se expresan en ovocitos de Xenopus laevis tienen una probabilidad de apertura cercana a 1, es decir permanecen casi siempre activos en contraste con los ENaC control que presentan una probabilidad de apertura diez veces menor20. Diakov et al.21 han demostrado que el clivaje de la subunidad γ por la tripsina parece ser el paso esencial en la activación, aunque la actividad proteolítica ocurre en las subunidades α y γ. Los canales insertos en la membrana y que no han sido sometidos a este fenómeno pueden ser activados por proteasas extracelulares, así que la modulación de la actividad del ENaC se considera de importancia en diversos estados patológicos incluyendo la injuria glomerular, la reducción en el volumen de líquido extracelular y en la fibrosis quística. Nos detendremos en forma breve en esto y veremos que el balance entre las proteasas y sus inhibidores son reguladores claves en la actividad del ENaC.
Se ha demostrado una hiperactividad de elastasa durante los estados inflamatorios y como consecuencia un incremento en la absorción de Na+ al activarse los canales ENaC. Debido a esto se deshidratan las vías aéreas con disminución de la actividad ciliar, un fenómeno importante en la patogénesis de la fibrosis quística7. El plasminógeno está ausente en la orina pero se detecta en el síndrome nefrótico al atravesar el glomérulo dañado, transformado a plasmina por la urokinasa secretada por las células tubulares. La plasmina activa la subunidad γ del ENaC en dos formas, dependiendo de su concentración. A altas concentraciones (> 10 μg/ml) activa en forma directa al ENaC mientras que a baja concentración lo hace a través de la prostasina asociada a la membrana celular. De las dos formas hay un aumento en la reabsorción de Na+ y expansión del volumen extracelular14, 22. También se ha demostrado una excesiva activación de ENaC en los segmentos distales del nefrón sensibles a aldosterona en modelos animales de hiperaldosteronismo, baja dieta en sodio y proteinuria23-25 así como en el síndrome de Liddle, una forma hereditaria de hipertensión6.
La nexina-1 forma una unión covalente con la prostasina inhibiendo en forma irreversible su acción, mientras que el bloqueo de su expresión en células derivadas de túbulos corticales de riñón de ratón lleva a un aumento en las corrientes de sodio sensibles al amiloride. La aldosterona y el TGF-β regulan en forma coordinada la expresión de prostasina y nexina-1 en células renales, la aldosterona aumentando la de prostasina y el TGF-β la de la nexina-1 y de su balance resultaría una retención de sodio o una natriuresis26. Es importante señalar que hace años que Ying et al.27 demostraron que TGF-β1 es sintetizado en los glomérulos y túbulos renales y que su producción aumenta en los animales sometidos a una dieta alta en sodio, siendo la natriuresis la respuesta a la sobrecarga del mismo.
Las proteasas pueden activar el ENaC por un mecanismo no proteolítico. Bengrine et al.28 han demostrado que la exposición a concentraciones bajas de tripsina, del orden de los nanomololes, lleva a la activación del ENaC por un mecanismo indirecto, no proteolítico, con la participación del sistema de la proteína G activado a través de un mecanismo no bien dilucidado. La Fig. 2 muestra registros típicos de corrientes sensibles a amiloride utilizando la técnica de Voltage-Clamp de ovocitos de Xenopus Laevis que expresan el canal ENaC. La Fig. 3 muestra el aumento en la corriente de Na+ por el ENaC en ovocitos de Xenopus laevis al incubarse por una hora en 20 ng/ml de tripsina y se verifica que es una corriente sensible al amiloride al ser bloqueada por 10 μM del diurético.
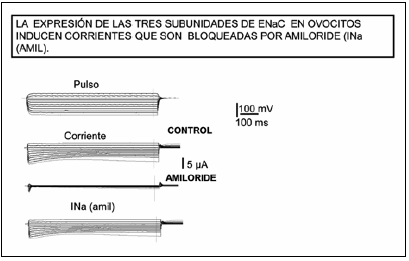
Fig. 2.- Registros de corriente en ovocitos inyectados con el ARNm de cada una de las tres subunidades del ENaC. La aplicación de pulsos desde -160 mV hasta +40 mV genera corrientes del orden de los microamperes en los ovocitos inyectados con ENaC que son bloqueadas incubando los ovocitos por 3-5 minutos con 10 μM de amiloride. De la resta entre los registros antes y después del amiloride se extrae la corriente sensible al amiloride (INa (amil)), el dato que se mide en forma habitual en los estudios funcionales del ENaC.
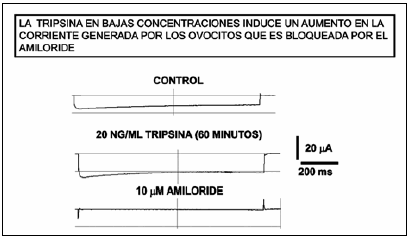
Fig. 3.- Registros de corriente en ovocitos de Xenopus laevis estimulados con un pulso de -100 mV. Los trazos corresponden al registro control, luego de 60 minutos de exposición a 20 ng/ml de tripsina y luego de 5 minutos en 10 μM de amiloride.
Dada la importancia de este sistema regulatorio del ENaC por las proteasas endógenas y sus inhibidores, se están estudiando potenciales inhibidores de la elastasa como agentes terapéuticos en la fibrosis quística7 y en el control de la presión sanguínea de varias proteasas al inhibir la actividad del ENaC en el riñón29.
Agradecimientos: L. Galizia es becario postdoctoral del CONICET, A. Ojea es estudiante de la Licenciatura de Biología en la FCEyN, UBA y B.A. Kotsias es miembro de la Carrera del Investigador del CONICET.
1. Donaldson SH, Boucher RC. Sodium channels and cystic fibrosis. Chest 2007; 132: 1631-6. [ Links ]
2. del Monaco S, Assef Y, Damiano A, Zotta E, Ibarra C, Kotsias BA. Caracterización del canal de sodio epitelial en sinciciotrofoblasto de placenta humana preeclámptica. Medicina (Buenos Aires) 2006; 66: 31-5. [ Links ]
3. del Mónaco SM, Marino G, Assef Y, Kotsias BA. Preeclampsia, migración celular y canales iónicos. Medicina (Buenos Aires) 2008a; 68: 405-10. [ Links ]
4. del Mónaco S, Assef Y, Kotsias BA. Epithelial sodium channel in a human trophoblast cell line (BeWo). J Membr Biol 2008b; 223: 127-39. [ Links ]
5. del Mónaco SM, Marino GI, Assef YA, Damiano AE, Kotsias BA. Cell migration in BeWo cells and the role of epithelial sodium channels. J Membr Biol 2009; 232: 1-13. [ Links ]
6. Knight KK, Olson DR, Zhou R, Snyder PM. Liddle's syndrome mutations increase Na+ transport through dual effects on epithelial Na+ channel surface expression and proteolytic cleavage. Proc Natl Acad Sci USA 2006; 103: 2805-8. [ Links ]
7. Prulière-Escabasse V, Clerici C, Vuagniaux G, Coste A, Escudier E, Planès C. Effect of neutrophil elastase and its inhibitor EPI-hNE4 on transepithelial sodium transport across normal and cystic fibrosis human nasal epithelial cells. Respiratory Res 2010; 11 (in press). [ Links ]
8. Staruschenko A, Adams E, Booth RE, Stockand JD. Epithelial Na+ channel subunit stoichiometry. Biophys J 2005; 88: 3966-75. [ Links ]
9. Jasti J, Furukawa H; Gonzales EB, Goaux E. Structure of acid-sensing ion channel 1 at the 1.9 Å resolution and low pH. Nature 2007; 449: 316-23. [ Links ]
10. Drummond HA, Grifoni SC, Jernigan NL. A new trick for old dogma: ENaC proteins as mechanotransducers in vascular smooth muscle. Physiology 2007; 23: 23-31. [ Links ]
11. Kashlan OB, Sheng S, Kleyman TR. On the interaction between amiloride and its putative alpha-subunit epithelial Na+ channel binding site. J Biol Chem 2005; 280: 26206-15. [ Links ]
12. Carattino MD, Sheng S, Kleyman TR. Epithelial Na+ channels are activated by laminar shear stress. J Biol Chem 2004; 279: 4120-6. [ Links ]
13. Passero CJ, Mueller GM, Rondon-Berrios H, Tofovic SP, Hughey RP, Kleyman TR. Plasmin activates epithelial Na+ channels by cleaving the gamma subunit. J Biol Chem 2008; 283: 36586-91. [ Links ]
14. Passero CJ, Carattino MD, Kashlan OB, Myerburg MM, Hughey RP, Kleyman TR. Defining an inhibitory domain in the gamma subunit of the epithelial sodium channel. Am J Physiol Renal Physiol 2010; 299: F854-61. [ Links ]
15. Kotsias BA. El sistema ubiquitina-protesoma. El beso de la muerte. Medicina (Buenos Aires) 2010; 70: 194-6 [ Links ]
16. Carattino MD, Sheng S, Bruns JB, Pilewski JM, Hughey RP, Kleyman TR. The epithelial Na+ channel is inhibited by a peptide derived from proteolytic processing of its alpha subunit. J Biol Chem 2006; 281: 18901-7 [ Links ]
17. Narikiyo T, Kitamura K, Adachi M, et al. Regulation of prostasin by aldosterone in the kidney. J Clin Invest 2002; 109, 401-8. [ Links ]
18. Wakida N, Kitamura K, Tuyen DG, et al. Inhibition of prostasin- induced ENaC activities by PN-1 and regulation of PN-1 expression by TGF-beta1 and aldosterone. Kidney Int 70: 1432-8. [ Links ]
19. Knight KK, Wentzlaff DM, Snyder PM. Intracellular sodium regulates proteolytic activation of the epithelial sodium channel. J Biol Chem 2008; 283: 27477-82. [ Links ]
20. Sheng S, Carattino MD, Bruns JB, Hughey RP, Kleyman TR. Furin cleavage activates the epithelial Na channel by relieving Na self inhibition. Am J Physiol Renal Physiol 2006; 290: F1488-96. [ Links ]
21. Diakov A, Bera K, Mokrushina M, Krueger B, Korbmacher C. Cleavage in the {gamma}-subunit of the epithelial sodium channel (ENaC) plays an important role in the proteolytic activation of near-silent channels. J Physiol 2008; 586: 4587-608. [ Links ]
22. Svenningsen P, Uhrenholt TR, Palarasah Y, Skjødt K, Jensen BL, Skøtt O.Prostasin-dependent activation of epithelial Na channels by low plasmin concentrations. Am J Physiol Regul Integr Comp Physiol 2009; 297: R1733-41. [ Links ]
23. Frindt G, Palmer LG. Surface expression of sodium channels and transporters in rat kidney: effects of dietary sodium. Am J Physiol Renal Physiol 2009; 297: F1249-55. [ Links ]
24. Kastner C, Pohl M, Sendeski M, et al. Effects of receptor-mediated endocytosis and tubular protein composition on volume retention in experimental glomerulonephritis. Am J Physiol Renal Physiol 2009; 296: F902-11. [ Links ]
25. Masilamani S, Kim GH, Mitchell C, Wade JB, Knepper MA. Aldosterone- mediated regulation of ENaC alpha, beta, and gamma subunit proteins in rat kidney. J Clin Invest 1999; 104: R19-R23. [ Links ]
26. Kitamura K, Tomita K. Regulation of renal sodium handling through the interaction between serine proteases and serine protease inhibitors. Clin Exp Nephrol 2010; 14: 405-10. [ Links ]
27. Ying WZ, Sanders PW. Dietary salt modulates renal production of transforming growth factor-beta in rats. Am J Physiol 1998; 274: F635-41. [ Links ]
28. Bengrine A, Li J, Hamm LL, Awayda MS. Indirect activation of the epithelial Na+ channel by trypsin. J Biol Chem 2007; 282: 26884-96. [ Links ]
29. Soundararajan R, Pearce D, Hughey RP, Kleyman TR. Role of epithelial sodium channels and their regulators in hypertension. J Biol Chem 2010; 285: 30363-9. [ Links ]
Recibido: 9-11-2010
Aceptado: 17-11-2010














