Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Medicina (Buenos Aires)
versión impresa ISSN 0025-7680
Medicina (B. Aires) vol.71 no.3 Ciudad Autónoma de Buenos Aires jun. 2011
ARTÍCULO ORIGINAL
Distribución de Lutzomyia longipalpis en el Chaco Argentino, 2010
Oscar D. Salomón1, Juan R. Rosa2, Mariela Fabiani3, Silvia R. San Miguel4, Enrique A. Szelag2, Marcelo Nepote5, Matías A. Parras2
1Instituto Nacional de Medicina Tropical. Ministerio de Salud de la Nación, Puerto Iguazú, Misiones,
2Instituto de Medicina Regional, Universidad Nacional del Nordeste, Chaco,
3Dirección de Epidemiología, Ministerio de Salud Pública de la Provincia del Chaco,
4Ministerio de Desarrollo Humano de la Provincia de Formosa,
5Dirección Provincial de Promoción y Protección de la Salud, Ministerio de Salud de la Provincia de Santa Fe
Dirección Postal: Dr. Oscar Daniel Salomon, Neuquén y Jujuy, 3370, Puerto Iguazú, Argentina
Fax: (54-11) 4331 2536 e-mail: odanielsalomon@gmail.com
Resumen
El riesgo de leishmaniasis visceral (LV) urbana epidémica se registró por primera vez en la Argentina en el año 2004, por presencia del vector Lutzomyia longipalpis en la provincia de Formosa, la provincia de Misiones registra casos de LV humana, LV canina y vector en el año 2006, y la provincia de Corrientes en el verano 2008-2009. En la provincia de Santiago del Estero los casos de LV humana y LV canina en el año 2008 estuvieron asociados posiblemente a vectores secundarios. Por ello, para conocer la distribución del riesgo en la región del Chaco, entre enero y abril del 2010 se realizó la búsqueda sistemática del vector de LV en 30 localidades de las provincias de Formosa, Chaco y en la ciudad de Reconquista, Santa Fe (224 trampas/noche). Se comprobó la presencia de Lu. longipalpis, por primera vez, en las localidades de Resistencia y Puerto Antequera (Chaco). En Clorinda y Puerto Pilcomayo (Formosa) se obtuvieron las trampas con más ejemplares, 158 y 241 Lu. longipalpis trampa/sitio/noche respectivamente. Los resultados muestran que el vector de la LV urbana epidémica continúa dispersándose en el territorio argentino, habiendo ingresado a la provincia de Chaco. La notificación de casos esporádicos en la región chaqueña, transmitidos por vectores secundarios, como Lu. migonei, podría aumentar también debido a la vigilancia intensificada, y a la dispersión del parásito asociada al tránsito de perros infectados, sintomáticos o asintomáticos.
Palabras clave: Lutzomyia longipalpis; Leishmaniasis visceral; Santa Fe; Chaco; Formosa
Abstract
Distribution of Lutzomyia longipalpis in the Chaco region, Argentina, 2010. The appearance of the vector of visceral leishmaniasis (VL) Lutzomyia longipalpis in the province of Formosa in 2004 was associated with urban epidemic risk for the first time in Argentina. During 2006, vectors, canine and human cases of VL were reported in the province of Misiones, and in summer 2008-2009, in the province of Corrientes. In Santiago del Estero province in 2008, cases of human and canine VL were associated with secondary vectors. Therefore, with the aim to know the current distribution of VL risk in the Chaco region, systematic captures of the vector were performed between January and April 2010 in 30 localities of Formosa and Chaco, and in the city of Reconquista, province of Santa Fe (224 traps/night). Lu. longipalpis was reported for the first time in the cities of Resistencia and Puerto Antequera (Chaco). Clorinda and Puerto Pilcomayo (Formosa) are the localities where the traps with more individuals were obtained, 158 and 241 Lu. longipalpis trap / site / night respectively. These results showed that the vector of urban epidemic VL is still spreading in Argentina, and already reached the province of Chaco. Sporadic cases reported in the Chaco region, transmitted by secondary vectors as Lu. migonei would also increase due to intensified surveillance, and the dispersion of the parasite associated with the transit of asymptomatic or symptomatic infected dogs.
Key words: Lutzomyia longipalpis; Visceral leishmaniasis; Santa Fe; Chaco; Formosa
Lutzomyia longipalpis, vector de la leishmaniasis visceral (LV), se registró en Clorinda, provincia de Formosa, en el año 20041, por primera vez en la Argentina, asociado a los focos de LV urbana que estaban ocurriendo en Paraguay2.
Previamente, sólo se habían encontrado pocos ejemplares del insecto vector en Misiones, aunque los casos aislados de LV humana hasta la década de 1970, se concentraban en la región chaqueña3. Sin embargo, a partir de la emergencia de la LV urbana y su dispersión epidémica, en el estado de Mato Grosso do Sul, Brasil4, 5, y en la ciudad de Asunción, Paraguay, en el año 20002, se confirmó el primer caso de LV humana autóctono en Argentina en Posadas, provincia de Misiones, en el año 20066, dispersándose luego el vector a la provincia de Corrientes7.
Superpuesta a la expansión de la LV urbana epidémica, que implica en Sudamérica gran cantidad de casos de LV canina y Lu. longipalpis s.l. como vector8, 9, se sugirió la existencia de una forma no epidémica, con casos esporádicos humanos y caninos, y Lu. migonei como vector posible. Se deberá definir aún experimentalmente si Lu. migonei es un vector primario capaz de sostener la circulación del patógeno indefinidamente en el tiempo como Lu. longipalpis, es un vector secundario y sólo puede hacer circular al parásito por un tiempo finito pero en ausencia del vector primario la transmisión se interrumpe, o es un vector permisivo sin mecanismo molecular de reconocimiento específico Leishmania-Lutzomyia y transmisión ocasional. La hipótesis de Lu. migonei como vector de LV, al menos para la región chaqueña, se fundamentó en los resultados obtenidos en el foco de LV humana de La Banda (4 casos humanos), provincia de Santiago del Estero, en el año 200810.
En la Cuarta Reunión Nacional del Programa Nacional de Leishmaniasis realizada en Posadas, el 24 y 25 de noviembre del año 2009, se acordó realizar un muestreo en el área vulnerable de LV para determinar la expansión del vector. En la región chaqueña, esta búsqueda corresponde tanto al vector primario de la transmisión epidémica Lu. longipalpis como al vector posible de la transmisión esporádica Lu. migonei, pues generan diferente nivel de riesgo, y consecuentemente diferentes estrategias de vigilancia e intensidad de respuesta de intervención frente a casos de LV humana y LV canina.
En este trabajo se muestran los resultados de la actividad de muestreo en las provincias de Formosa, Chaco y en la ciudad de Reconquista, Santa Fe, donde hasta diciembre del año 2010 no se registraron casos de leishmaniasis visceral humana (Sistema Nacional de Vigilancia de la Salud, Dirección de Epidemiología. Ministerio de Salud, Argentina).
Materiales y métodos
Se realizó la búsqueda de vectores de LV en la provincia de Santa Fe, en el municipio de Reconquista (29º 08-14' S - 59º 37-43' O). En la provincia de Chaco, en los municipios de Resistencia (27° 25'-28'S - 58° 58-59' O), Puerto Antequera (27° 24-26' S - 58° 50-51' O), Puerto Vilelas (27° 30-31' S - 58° 56' O), Tres Isletas (26° 19-20' S - 60° 25-26' O), Presidencia Roque Sáenz Peña (26° 47-49' S - 60° 24-28' O), Las Breñas (27° 04-06' S - 61° 04-05' O), General Vedia (26° 55-56' S - 58° 39' O) y Machagai (26° 54-56' S - 60° 02-03' O). En la provincia de Formosa, en los municipios de Formosa (26° 09-12' S - 58° 09-12' O), Villa del Carmen (26° 15' S - 58° 15' O), Misión Laishi (26° 14' S - 58° 37-38' O), Tatané (26° 24' S - 58° 21' O), Herradura (26° 28-29' S - 58° 18-19' O), Clorinda (25° 15-18' S - 57° 41-43' O), Puerto Pilcomayo (25° 21' S - 57° 39-40' O), Villa Lucero/Laguna Naick Neck (25° 13-14' S - 58° 04-07' O), Riacho He He (25° 20-21' S - 58° 16-17' O), La Primavera (25° 11' S - 58° 15' O), Espinillo (24° 57-59' S - 58° 31-33' O), Puente Negro (24° 57' S - 58° 44' O), Tacaagle (24° 57-58' S - 58° 48-49' O), Belgrano (25° 55-56' S - 59° 00-02' O), Lomitas (24° 41-43' S - 60° 35-36' O), Bañado La Estrella (24° 23-22' S - 60° 19' O), Ingeniero Juárez (23° 53-54' S - 61° 50-51' O), Reserva Formosa (24° 18' S - 61° 48' O), El Simbolar (24° 14' S - 61° 56' O), Las Maravillas (24° 13' S - 62° 00-01' O) y El Trébol (23° 57' S - 61° 51' O (Fig. 1). Las coordenadas geográficas de cada sitio de trampeo se registraron mediante el Sistema de Posicionamiento Global (GPS) para contribuir al registro internacional de vectores de leishmaniasis.
Para las capturas de Phlebotominae se utilizaron minitrampas de luz tipo CDC11 operando de 19:00 a 9:00 horas del día siguiente, el 27 y 28 de enero del año 2010 en Reconquista, y desde el 25 de marzo al 27 de abril del mismo año en las provincias de Chaco y Formosa. Se instalaron entre 1 y 22 trampas por localidad, en función de la cantidad de habitantes, área geográfica, riesgo (antecedentes de LV canina), o interés epidemiológico.
Las trampas funcionaron una noche por sitio, en el caso que la primera noche se registraran situaciones adversas a la actividad de los Phlebotominae, tales como precipitaciones pluviales, vientos o temperaturas por debajo de 18 °C, se volvía a muestrear a la noche siguiente. Las trampas se ubicaron a 1.5 metros del suelo, en "peores escenarios" distantes entre sí no menos de 400 m, representativos de los distintos sectores y ambientes de la ciudad. "Peor escenario" es una definición operativa correspondiente al sitio, dentro del área de estudio, con mayor probabilidad de encontrar Phlebotominae, debido a las condiciones de hábitat12, 13. En la ciudad de Clorinda-Puerto Pilcomayo, dados los antecedentes de capturas previas y transmisión de LV canina, se realizó una captura intensiva de 56 trampas/noche.
Los Phlebotominae recolectados en cada trampa fueron separados de los otros insectos, mantenidos en seco y diafanizados con lactofenol. Las determinaciones por especie y sexo fueron realizadas bajo microscopio según las clave de Young y Duncan (1994)14, con la modificación de Andrade Filho et al. (2003)15. Dado que las claves morfológicas en uso no distinguen entre las hembras de Lu. cortelezzii y las de Lu. sallesi, porque las diferencias discriminantes cuantitativas entre especies no llegan a ser estadísticamente significativas16, 17, con el objeto de determinar la abundancia relativa de este complejo se denominan a los ejemplares obtenidos como pertenecientes a la especie Lu. cortelezii-sallesi, y en la tabla respectiva se discriminan los machos de cada especie identificados según Galati17.
Resultados
En el presente estudio se capturaron 1113 Phlebotominae pertenecientes a las especies Lu. longipalpis (55.3%), Lu. migonei (38.6%), Lu. cortelezzii-sallesi (3.8%), Lu. neivai (1.3%), Brumptomyia brumpti (0.3%) y Lu. evansi (< 0.1%). De las 224 trampas/noche colocadas, 44 presentaron al menos un Phlebotominae, 12 de ellas con Lu. longipalpis distribuidas en 4 localidades (Tabla 1).
TABLA 1.- Capturas de Phlebotominae mediante minitrampas de luz tipo CDC por especie, sexo (hembras/machos), y localidad. Provincias de Chaco, Formosa y Santa Fe (Reconquista), Argentina, enero-abril 2010

Tr+Ll/Tr+/Tr: Nº de trampas con Lu. longipalpis/Nº de trampas con algún Phlebotominae/N° total trampas colocadas en el sitio, Llong: Lu. longipalpis. Lmig: Lu. migonei, Lnei: Lu. neivai. Lcor: Lu. cortelezzii-sallesi. Lpes: Lu. pessoai. Leva: Lu. evandroi. Bru: Brumptomyia brumpti.
* 4 machos Lu. cortelezzii, todos los demás machos en la tabla Lu. sallesi. Incluye aVilla Hermosa, bVilla Lucero, cPuente Negro y Tacaagle, dBañado La Estrella, eReserva Formosa, El Simbolar, Las Maravillas y El Trébol
Se comprobó la presencia de Lu. longipalpis, el vector de LV, por primera vez, en las localidades de Resistencia y Puerto Antequera, provincia de Chaco, y se volvió a registrar en Clorinda y Puerto Pilcomayo, provincia de Formosa (Fig. 1), localidades donde se obtuvieron las trampas con más ejemplares en una noche, 158 y 241 Lu. longipalpis trampa/sitio respectivamente. Se encontraron Lu. migonei y Lu cortelezzii-sallesi en 9 de las localidades muestreadas (Tabla 1).
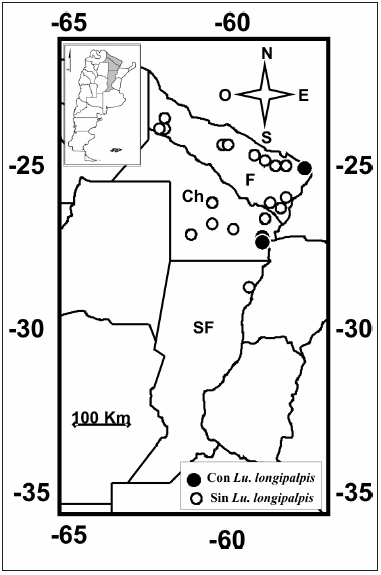
Fig. 1.- Localidades en las que se tomaron muestras en las provincias de Formosa (F), Chaco (Ch) y Santa Fe (SF), Argentina, enero-abril del año 2010.
La razón de sexos hembras:machos para Lu. longipalpis resultó 1:0.9 mientras para Lu. migonei fue de 1:4.1 (Tabla 1).
Discusión
Se demostró presencia de Lu. longipalpis, vector de la LV, en ambiente peri-domiciliario, urbano, en Resistencia y Puerto Antequera (Chaco), y se volvió a confirmar la colonización observada previamente en Clorinda (Formosa)1. En las capturas se destaca la presencia de Lu. migonei en Chaco y Formosa, vector posible de la LV esporádica de la región chaqueña10, especie cuya infección natural por L. infantum (syn. chagasi) ya fue descripta en focos de LV de Brasil, sin presencia de Lu. longipalpis18. La hematofagia está restringida a las hembras, pero los machos pueden ser más atraídos por la luz de las trampas; por ello, una razón de sexos con mayor proporción de hembras, como ocurre con Lu. longipalpis en los sitios muestreados, sugiere mayor riesgo de transmisión de LV y mayor proximidad a los sitios de reproducción-cría.
No se encontraron vectores de leishmaniasis en el ejido urbano y puerto de Reconquista, provincia de Santa Fe. Las trampas se colocaron en el patio de la vivienda de un posible caso de LV canina (animal ausente), en viviendas vecinas con perros, y en los "peores escenarios" para LV distribuidos en la ciudad. No se puede descartar la existencia de vectores de leishmaniasis cutánea en áreas ribereñas de vegetación cerrada y en zonas aledañas de cuña boscosa remanente. El caso de LV canina presuntamente autóctono se origina en un diagnóstico privado a comienzos de mayo de 2009. El norte de la provincia de Santa Fe ya se había reconocido como vulnerable a leishmaniasis tegumentaria en el año 2004, con presencia de Lu. neivai en El Rabón, Villa Ocampo, Cayastá y Tartagal19, y vulnerable a la LV en diciembre del año 2008 por la aparición de focos de transmisión en Corrientes, con presencia del vector y perros infectados7. En El Rabón y Tartagal también se registró la presencia de Lu. migonei. Se propusieron medidas de vigilancia en la zona norte de la provincia y el tamizaje serológico de canes alrededor del posible caso.
En la provincia de Chaco se encontró Lu. longipalpis, con escasa frecuencia, en Resistencia y Puerto Antequera. Las localidades de Tres Isletas, General Vedia, Machagai, Presidencia Roque Sáenz Peña y Las Breñas no registraron presencia del vector de LV, pero sí Lu. migonei y Lu. cortelezzii-sallesi, las especies de Phlebotominae dominantes del área chaqueña20-22. Estas dos especies podrían estar asociadas en la región del Chaco seco tanto a los casos históricos, esporádicos, de leishmaniasis con sintomatología visceral3, como a los casos esporádicos cutáneos (comunidades Raíz Chaqueña, Losina A., com pers.). Lu. neivai, el vector epidémico de leishmaniasis tegumentaria fue descripto en General Vedia asociado a brotes de leishmaniasis cutánea en 199623. Lutzomyia evandroi fue registrada recientemente por primera vez en el país, en Posadas, Misiones24, siendo la del presente trabajo la primera cita para la región del Chaco. La baja abundancia de Lu. longipalpis en el área de Resistencia, y ausencia de registros en las capturas previas realizadas en Resistencia, Margarita Belén y Misión Nueva Pompeya hasta el año 200722, contribuyen a la hipótesis de una colonización incipiente de Lu. longipalpis en dispersión activa, con riesgo de LV urbana, al menos en la región del Chaco húmedo, mientras pueden registrarse casos aislados de LV en la región del Chaco seco trasmitidos por Lu. migonei.
En la provincia de Formosa se encontró, como en los años 2004 y 2007, el vector de LV restringido a Clorinda-Puerto Pilcomayo, con capturas de alta abundancia, indicando el alto riesgo de transmisión activa, al que contribuye el continuo tránsito y tráfico de perros desde Asunción, Paraguay1, 25. Como se observó en el párrafo anterior para la provincia de Chaco, las localidades de Formosa, Villa del Carmen, Herradura, La Primavera, Lomitas e Ingeniero Juárez presentaron la diversidad de especies propia de la región chaqueña.
En las últimas décadas se han registrado casos de leishmaniasis cutánea (LC), esporádicos o de posible exposición simultánea familiar, en Villa del Carmen y Herradura. En Misión Laishi, donde se encontró sólo Brumptomyia brumpti, especie sin importancia epidemiológica, se habría producido un brote de LC en la década de 1980, según relatos de personal de salud, aunque no se pudo recuperar información de registro o en entrevistas a los pobladores, por lo que debe haber afectado a un número muy limitado de personas y posiblemente con las características mencionadas de exposición simultánea (fuente común) a un foco de poca extensión espacial (punto caliente). En Las Lomitas, donde ocurrieron brotes de LC asociados a la selva en galería del río Bermejo, la presencia de especies chaqueñas con baja competencia vectorial o incapaces de mantener el parásito en el tiempo, en la ciudad y en el Bañado La Estrella ya había sido descripta en estudios anteriores26, 27. En Ingeniero Juárez la ausencia de Lu. longipalpis sugiere que los casos esporádicos históricos o actuales de LV en las zonas aledañas corresponderían a la trasmisión esporádica de LV por otros vectores de la región chaqueña.
En conclusión, la experiencia de Reconquista, Santa Fe, demuestra la necesidad del contacto inmediato con las autoridades sanitarias ante la presencia de animales con LV, presuntamente autóctonos, en un sitio sin transmisión previa. De esta forma se puede coordinar el estudio de foco con certeza diagnóstica de la especie de parásito, en tiempo y forma, con recursos existentes en el país, para tomar las medidas de control que correspondan.
La incidencia de LV transmitida probablemente por Lu. migonei u otro vector de la región del Chaco, a su vez, podría incrementarse en los próximos años, sin generar fenómenos epidémicos. Este aumento de notificación esperado de casos esporádicos se debería a la circulación de parásitos mediante tránsito de mascotas infectadas desde áreas con LV epidémica urbana. Sin embargo, también se debe esperar un aumento del registro por el mejoramiento de la capacidad diagnóstica y el flujo de información en el sistema de vigilancia, ya que se demostró que existe sub-registro para LC en la región chaqueña28, 29. Para LV en Brasil, con años de funcionamiento del programa de vigilancia, el sub-registro alcanzaría aún el 45% de los casos reales30.
Los resultados presentados en este trabajo muestran que la dispersión del vector de LV, observada previamente6, 7, 31, continúa expandiéndose hacia el oeste, en la provincia de Chaco, y se mantiene en Clorinda, Formosa. El Programa Nacional de Leishmaniasis ha propuesto la intensificación de la vigilancia de casos humanos y caninos, importados y autóctonos, en todo el territorio nacional, mediante difusión, capacitación, y una red nacional de laboratorios jurisdiccionales de referencia, para realizar diagnósticos estandarizados con control de calidad. Los insumos diagnósticos y drogas terapéuticas recomendados para casos humanos, según criterios clínicos y de laboratorio, por la Guía del Programa (Leishmaniasis Visceral: Guía para el Equipo de salud. http://www.msal.gov.ar/htm/site/epidemiologia.asp) se encuentran disponibles en el sistema público asistencial. Se recomiendan a su vez diferentes acciones de prevención y control de acuerdo a la presencia y especie de vector (Lu. longipalpis o Lu. migonei), a la tasa de incidencia en humanos y en caninos, y en localidades sin transmisión a la vulnerabilidad por tránsito intenso o proximidad a zonas con transmisión activa de LV. Sin embargo, para todos los niveles de riesgo se debe realizar simultáneamente: a) saneamiento ambiental para reducir el éxito reproductivo de los vectores: aumentar insolación de la tierra mediante desmalezamiento y eliminación de refugios húmedos y sombríos, reducir la hojarasca, excrementos de animales y materia orgánica, rotar anualmente y alejar del domicilio los sitios de dormir de los animales domésticos; b) control de reservorios: evitar la infección de los perros sanos, adoptar mascotas libres de leishmaniasis, eliminar los reservorios caninos infectados, fuente de parásitos para el vector y para la trasmisión vertical y horizontal en perros; d) control de vector: la acción de los insecticidas es de muy corta duración, por lo que sólo se recomienda el control de foco por rociados intensivos alrededor del caso humano o los primeros casos caninos, en conjunto con las medidas precedentes, y un sistema de diagnóstico temprano y tratamiento oportuno de LV humana. Finalmente, dado el tránsito de mascotas infectadas en todo el territorio argentino, es necesaria la difusión de información sobre el riesgo para la salud que este tránsito implica, por parte de los profesionales de la salud humana y veterinaria, tanto desde el ámbito público como privado, con el objetivo de evitar la dispersión del parásito, responsable de una enfermedad con alta letalidad humana.
Agradecimientos: A las familias que permitieron la colocación de las trampas en sus casas, a las personas que facilitaron dicho trabajo. A la Dirección Nacional de Enfermedades Transmisibles por vectores: Sergio Sosa Estani, Jorge Kuruk, Jorge "Coqui" Freis. Al Ministerio de Salud de la provincia de Santa Fe: Andrea Uboldi, Javier Colombo, Mariana Maglianesi; Reconquista: Gloria Torterola, Raúl Gauna, Sonia Perna, y al veterinario Eduardo Ciepielak. Al Ministerio de Salud Pública de la provincia del Chaco: Mario Echevarría, Julio Beltrán, Maria Rosa Strumia; Presidencia Roque Sáenz Peña: Omar Cruz, Marianela Campias, Rubén Sosa, Agustín Cuenca; Tres Isletas: Andrés Losina, Dante Franco, Marta Álvarez. Al Ministerio de Desarrollo Humano de la provincia de Formosa: Eugenia Ruiz, Angel Tijera, Alejandro Romero, Neri Grael; Clorinda: Osvaldo Espínola; Lomitas: Lucía Dri, Ingeniero Juárez: Rafael Silva.
Oscar Daniel Salomón es miembro de la CIC-CONICET; este trabajo ha sido parcialmente financiado por la Administración Nacional de Laboratorios e Institutos de Salud mediante el subsidio FOCANLIS 2009.
Conflictos de interés: Los autores expresan que el presente trabajo no presenta conflictos de interés
1. Salomón OD, Orellano PW. Lutzomyia longipalpis in Clorinda, Formosa province, an area of potential visceral leishmaniasis transmission in Argentina. Mem Inst Oswaldo Cruz 2005; 100: 475-6. [ Links ]
2. Cousiño B. Vigilancia y control de la leishmaniasis en Paraguay. En: Panaftosa (ed). Consulta de Expertos OPS/OMS sobre Leishmaniasis Visceral en las Américas. Informe final. Rio de Janeiro: Panaftosa/OPS, 2006, p 34-6. [ Links ]
3. Salomón OD, Rossi G, Sosa Estani S, Spinelli G. Presencia de Lutzomyia longipalpis y situación de la leishmaniosis visceral en Argentina. Medicina (Buenos Aires) 2001; 61: 174-8. [ Links ]
4. de Oliveira AG, Falcão AL, Brazil RP. Primeiro encontro de Lutzomyia longipalpis (Lutz & Neiva, 1912) na área urbana de Campo Grande, MS, Brasil Rev Saude Publica 2000; 34: 654-5. [ Links ]
5. Mestre GLC, Fontes CJF. A expansão da epidemia da leishmaniose visceral no Estado de Mato Grosso, 1998-2005. Rev Soc Bras Med Trop 2007; 40: 42- 8. [ Links ]
6. Salomón OD, Sinagra A, Nevot MC, et al. First visceral leishmaniasis focus in Argentina. Mem Inst Oswaldo Cruz 2008; 103: 109-11. [ Links ]
7. Salomón OD, Ramos LK, Quintana MG, Acardi SA, Santini MS, Schneider A. Distribución de vectores de leishmaniasis visceral en la provincia de Corrientes. Medicina (Buenos Aires) 2009; 69: 625-30. [ Links ]
8. Gontijo CMF, Melo MNM. Leishmaniose visceral no Brasil: quadro atual, desafios e perspectivas. Rev Bras Epidemiol 2004; 7: 338-49. [ Links ]
9. Lainson R, Rangel EF. Lutzomyia longipalpis and the eco-epidemiology of American visceral leishmaniasis, with particular reference to Brazil: a review. Mem Inst Oswaldo Cruz 2005; 100: 811-27. [ Links ]
10. Salomón OD, Quintana MG, Bezzi G, Morán ML, Betbeder E, Valdéz DV. Lutzomyia migonei as putative vector of visceral leishmaniasis in La Banda, Argentina. Acta Tropica 2010; 113: 84-7. [ Links ]
11. Sudia WD, Chamberlain RW. Battery operated light trap, an improved model. Mosquito News 1962; 22: 126 -9. [ Links ]
12. Feliciangeli MD, Delgado O, Suarez B, Bravo A. Leishmania and sand flies: proximity to woodland as a risk factor for infection in a rural focus of visceral leishmaniasis in west central Venezuela. Trop Med Int Health 2006; 11: 1785-91. [ Links ]
13. Correa Antonialli SA, Torres TG, Paranhos Filho AC, Tolezano JE. Spatial analysis of american visceral leishmaniasis in Mato Grosso do Sul State, Central Brazil. J Infect 2007; 54: 509-14. [ Links ]
14. Young DG, Duncan MA. Guide to the identification and geographic distribution of Lutzomyia sand flies in Mexico, the West Indies, Central and South America (Diptera: Psychodidae). Mem Am Entomol Inst 1994; 54: 1- 881. [ Links ]
15. Andrade Filho JD, Galati EA, Falcão AL. Redescription of Nyssomyia intermedia (Lutz & Neiva 1912) and Nyssomyia neivai (Pinto 1926) (Diptera:Psychodidae). Mem Inst Oswaldo Cruz 2003; 98: 1059-65. [ Links ]
16. Galati EAB, Nunes V, Oshiro E, Rego F. Nova espécie de Phlebotominae, Lutzomyia corumbaensis sp. n. (Diptera, Psychodidae) do complexo Lutzomyia cortelezzii. Rev Bras Entomol 1989; 33: 465-75. [ Links ]
17. Galati EAB. Bioecologia e Identificação de Phlebotominae 2010. Atualização do capítulo 2 - Morfologia e Taxonomia: 2,1, Classificação de Phlebotominae, p. 23-51 e 2.2. Morfologia,Terminologia de Adultos e Identificação dos táxons da América, p. 53-75. In: Rangel EF & Lainson R. (org.) Flebotomíneos do Brasil, Rio de Janeiro: FIOCRUZ, 2003, 367 p. Universidade de São Paulo Ed. São Paulo, 2010, p 1-126. [ Links ]
18. de Carvalho MR, Valença HF, da Silva FJ, et al. Natural Leishmania infantum infection in Migonemyia migonei (França, 1920) (Diptera:Psychodidae:Phlebotominae) the putative vector of visceral leishmaniasis in Pernambuco State, Brazil. Acta Tropica 2010; 116: 108-10. [ Links ]
19. Salomón OD, Mocarbel NJ, Pedroni E, Colombo J, Sandillú M. Phlebotominae: vectores de leishmaniasis en las provincias de Santa Fe y Entre Ríos, Argentina. Medicina (Buenos Aires) 2006; 66: 220-4. [ Links ]
20. Salomón OD, Quintana MG, Rosa JR. Ecoepidemiología de la leishmaniasis cutánea en Argentina. SaludiCiencia 2008; 16: 514-20. [ Links ]
21. Salomón OD, Rosa JR, Stein M, et al. Phlebotominae (Diptera: Psychodidae) fauna in the Chaco region and Cutaneous Leishmaniasis transmission patterns in Argentina. Mem Inst Oswaldo Cruz 2008; 103: 578-84. [ Links ]
22. Rosa JR, Salomón OD, Andrade Filho JD, et al. Distribution of Sandflies (Diptera: Psychodidae) in the province of Chaco, Argentina. Neotropical Entomology 2010; 39: 303-5. [ Links ]
23. Salomón OD, Bogado de Pascual M, Molinari ML, Verri V. Study of a cutaneous leishmaniasis outbreak in General Vedia, Province of Chaco, 1996. Rev Inst Med Trop São Paulo 2001; 43: 99-104. [ Links ]
24. Salomón Oscar D, Andrade Filho Jose D, Fernández María S, Rosa Juan R, Szelag Enrique A, Santini María S. Nuevos registros de Phlebotominae (Diptera: Psychodidae) para la Argentina. Revista Soc Entomológica Argentina (en prensa). [ Links ]
25. Salomón OD, Quintana MG, Bruno MR, Quiriconi RV, Cabral V. Visceral leishmaniasis in border areas: clustered distribution of phlebotomine sand flies in Clorinda, Argentina. Memorias do Inst Oswaldo Cruz 2009; 104: 801-4. [ Links ]
26. Salomón OD, Sosa Estani S, Drí L, et al. Leishmaniosis tegumentaria en Las Lomitas, provincia de Formosa, Argentina, 1992-2001. Medicina (Buenos Aires) 2002; 62: 562-8. [ Links ]
27. Salomón OD, Orellano PW, Lamfri M, et al. Phlebotominae spatial distribution associated with a focus of tegumentary leishmaniasis in Las Lomitas, Formosa, Argentina, 2002. Mem Inst Oswaldo Cruz 2006; 101: 295-9. [ Links ]
28. Basualdo M, Muracciole D, Rodriguez C. Leishmaniosis y la información. Medicina (Buenos Aires) 2000; 60 supl III: 65. [ Links ]
29. Yadón ZE, Quigley MA, Davies CR, Rodrigues LC, Segura EL. Assessment of Leishmaniasis notification system in Santiago del Estero, Argentina, 1990-1993. Am J Trop Med Hyg 2001; 65: 27-30. [ Links ]
30. Maia-Elkhoury ANS, Carmo EH, Sousa-Gomes ML, Mota E. Análise dos registros de leishmaniose visceral pelo método de captura-recaptura. Rev Saude Publica 2007; 41: 931-7. [ Links ]
31. Salomón OD, Fernández MS, Santini MS, et al. Distribución de Lutzomyia longipalpis en la mesopotamia argentina, 2010. Medicina (Buenos Aires) (en prensa). [ Links ]
Recibido: 26-10-2010
Aceptado: 28-3-2011














