Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Medicina (Buenos Aires)
versión impresa ISSN 0025-7680
Medicina (B. Aires) vol.71 no.3 Ciudad Autónoma de Buenos Aires jun. 2011
ARTÍCULO ESPECIAL
Terapia anticoagulante en fibrilación auricular
Sebastián Prieto1, Pablo Young2, José M. Ceresetto1, Eduardo O. Bullorsky1
1Servicio de Hematología,
2Servicio de Clínica Médica, Hospital Británico de Buenos Aires
Dirección postal: Dr. Pablo Young, Servicio de Clínica Médica, Hospital Británico, Perdriel 74, 1280 Buenos Aires, Argentina
Fax (54-11) 43043393 e-mail: pabloyoung2003@yahoo.com.ar
Resumen
La fibrilación auricular es la taquiarritmia cardíaca más frecuente. Su incidencia aumenta con la edad, presentándose en un 1.5% entre los 50 a 59 años, y en un 8-10% entre los 80 a 89 años. Esta arritmia incrementa en cinco veces el riesgo de sufrir un evento cerebrovascular isquémico cardioembólico y causa el 15% de todos los accidentes cerebrovasculares isquémicos. Su manejo se enfoca en la prevención de los fenómenos tromboembólicos y el control de la frecuencia y ritmo cardíaco. El tratamiento anticoagulante ha demostrado ser la principal herramienta en la prevención de eventos cardioembólicos. Aunque las complicaciones hemorrágicas por el tratamiento son esperables y aumentan con la edad, el beneficio de usar anticoagulación sobrepasa por mucho al riesgo de sangrado. Precisamente debido a la heterogeneidad clínica de esta arritmia y a la dificultad de establecer un tratamiento adecuado para cada caso en particular, el American College of Cardiology, la American Heart Association, la European Society of Cardiology y el American College of Chest Physicians han establecido guías para mejorar el tratamiento de estos pacientes. La revisión de esta enfermedad y de las directrices propuestas puede facilitar y mejorar notablemente el tratamiento de los pacientes con fibrilación auricular.
Palabras clave: Terapéutica antitrombótica; Anticoagulación; Tromboembolismo; Fibrilación auricular; Accidente cerebrovascular
Abstract
Anticoagulation and atrial fibrillation. Atrial fibrillation is the most frequent cardiac arrhythmia in adults. Its frequency increases with age, being its incidence 1.5% in individuals 50 to 59 years old and 8-10% from 80 to 89 years. Atrial fibrillation increases 5 fold the risk of suffering stroke and actually causes 15% of all strokes. Its management focuses primary in the prevention of thromboembolic phenomena, heart rate and rhythm control. Anticoagulation, when indicated, has demonstrated to be the main tool in the prevention of these thromboembolic events. Although the bleeding complication is frequent in this population and increases with age, anticoagulation benefits are greater than the risks of bleeding. Due to the clinically heterogeneous nature of this arrythmia and the difficulty of establishing appropriate treatment for each particular case, the American College of Cardiology, the American Heart Association, European Society of Cardiology and American College of Chest Physicians have established guidelines to improve the management of these patients. The review of this condition and the proposed directives can notably facilitate and improve the management of the patients with atrial fibrillation.
Key words: Antithrombotic therapy; Anticoagulation; Thromboembolism; Atrial fibrillation; Stroke
La fibrilación auricular (FA) es una taquiarritmia supraventricular que fue demostrada por Einthoven en 1906, y que había descripto Harvey1. Se caracteriza por la activación auricular no coordinada, que lleva al deterioro de la función y mecánica provocando una pérdida de la sístole auricular. La importancia clínica de la FA estriba en la pérdida de la contractilidad auricular, la respuesta ventricular excesivamente rápida y por sobre todo la pérdida de la contractilidad y vaciamiento de las orejuelas auriculares, lo que aumenta el riesgo de que se formen coágulos y eventos tromboembólicos subsiguientes. Es el ritmo más común después del ritmo sinusal. La FA es la arritmia cardíaca más frecuente que se encuentra en la práctica clínica y su prevalencia aumenta con la edad hasta alcanzar características epidémicas. Su prevalencia es de menos del 1% en menores de 40 años, y aproximadamente de 10% en mayores de 80 años, siendo el principal factor de riesgo para la isquemia cerebral por embolia2. La mayoría de los pacientes con FA tienen una edad superior a 65 años3. Además, los accidentes cerebro vasculares (ACV) de etiología cardioembólica son más graves y extensos que los de etiología aterotrombótica, y confieren una mayor morbilidad post ACV y una mayor fatalidad relacionada al evento embólico4, 5.
Epidemiología
Se calcula que alrededor de 2.3 millones de personas en Norteamérica y 4.5 millones en la Unión Europea tienen FA paroxística o persistente4. Durante los últimos 20 años, los ingresos hospitalarios por FA se han incrementado en un 66% debido al envejecimiento de la población y al aumento de la prevalencia de cardiopatías crónicas, que conllevan a mayor riesgo de desarrollo de FA, y se espera que esta tendencia aumente y se mantenga en los próximos años6, 7. La FA constituye un problema de salud pública extremadamente costoso (aproximadamente 3 000 euros o 3 600 dólares por paciente/año); el costo total en la Unión Europea se aproxima a los 13 500 millones de euros7.
Prevalencia e incidencia
La prevalencia estimada de FA en la población general es de un 0.4-1%, aumentando con la edad al 8-10% en los pacientes mayores de 80 años, y alcanzando un 18% en los mayores de 85 años2, 8-10. La edad media de los pacientes con FA es de 71 a 75 años, hecho que se ha notificado también en nuestro país11. El número de varones y mujeres con FA es prácticamente igual, pero alrededor del 60% de los mayores de 75 años son mujeres, debido a la mayor supervivencia. En los varones, la prevalencia es mayor que en las mujeres (es en promedio 1.5 veces mayor en el hombre que en la mujer) para todos los rangos de edad12, 13.
El riesgo ajustado por la edad de desarrollar FA en personas de raza negra parece menos de la mitad que en blancos, a pesar de que en los individuos de raza negra son más prevalentes las enfermedades cardiovasculares14.
En pacientes tratados por insuficiencia cardíaca, la incidencia de FA a los 3 años es de cerca del 10%; la insuficiencia cardíaca aumenta el riego de FA entre 8 y 20 veces15, 16. Los inhibidores de la enzima convertidora de angiotensina y del receptor de angiotensina II pueden estar asociados con una reducción de la incidencia de la FA en pacientes con insuficiencia cardíaca e hipertensión, probablemente relacionado a la disminución del desarrollo de disfunción diastólica17, 18.
Diagnóstico y etiología
Definimos la FA como una actividad auricular irregular, rápida (entre 400 y 700 ciclos por minuto) y que ocasiona una respuesta ventricular variable (entre 70 y 170 latidos por minuto). En el electrocardiograma (ECG) encontramos la característica ausencia de ondas "p", sustituidas por las ondas "f", intervalos R-R irregulares con complejos QRS angostos. El mecanismo responsable depende de la coexistencia de múltiples circuitos de micro-reentrada que invaden, se fragmentan y se extinguen en el tejido auricular.
Los síntomas varían con la respuesta ventricular, el estatus clínico, la duración de la FA y la percepción individual del paciente. Clínicamente puede cursar con palpitaciones, disnea, dolor torácico, mareos, síncope, déficit neurológicos por ACV, edema agudo de pulmón o fenómenos embólicos. Pero puede ser totalmente asintomática y realizarse el diagnóstico de forma casual en el consultorio19. Al examen físico se encuentra pulso irregular, con primer ruido de intensidad variable. El diagnóstico se hace en base a la clínica y el ECG o Holter de ritmo.
La FA se asocia a cardiopatía estructural en el 70-80% de los casos. Las causas más frecuentes son la cardiopatía isquémica y la hipertensión arterial con hipertrofia del ventrículo izquierdo, debido a que estas dos patologías son la primera y la segunda causa, respectivamente, de disfunción diastólica en Europa y América del Norte (anteriormente era la valvulopatía reumática); estas patologías (solas o asociadas) están presentes en más del 50% de los casos20, 21. En los países desarrollados es más frecuente la cardiopatía isquémica como primera causa de disfunción diastólica, debido al mejor control de la hipertensión (HTA). Cabe destacar otras enfermedades asociadas, como son: diabetes mellitus, insuficiencia cardíaca, miocardiopatía hipertrófica, miocardiopatía dilatada, enfermedad del nodo sinusal, hipertensión pulmonar, embolismo pulmonar, hipertiroidismo, hipotiroidismo (por la disfunción diastólica que produce), enfermedad pulmonar obstructiva crónica (EPOC), síndrome metabólico, obesidad, anemia, depleción hidroelectrolítica, fiebre, stress emocional, anomalía de Ebstein, síndrome de Wolff-Parkinson-White, consumo de cafeína, cocaína y alcohol22, 23.
El término FA idiopática o aislada (lone atrial fibrillation) se reserva para el resto de los casos en que no se objetiva cardiopatía ni HTA (20-30%), siendo de buen pronóstico, en especial cuando se presenta en pacientes menores de 60 años24, 25. Estos pacientes tienen un pronóstico inicialmente favorable, con bajo riesgo de fenómenos embólicos en los primeros dos años, luego adquieren el riesgo similar a FA permanente25.
Existen también casos de fuerte asociación familiar26, 27. Se han identificado desde 1997 genes en los cromosomas 5, 6, 10 y 11 que se pensaba eran los responsables de la FA familiar28-31. Posteriormente, en otros casos de franca incidencia familiar no se encontraron dichos genes, por lo que actualmente se considera que la FA familiar es una enfermedad heterogénea que en la mayoría de los casos es de herencia poligénica y multifactorial32, 33.
Clasificación
El American College of Cardiology, la American Heart Association y la European Society of Cardiology han establecido el esquema de clasificación que proponemos en este trabajo, representando una opinión consensuada basada en la importancia clínica en el momento de la toma de decisiones9, 23, 32. Se admiten actualmente tres formas de FA de acuerdo con el tiempo de aparición y su duración, que son la paroxística, la persistente y la permanente (Fig. 1).
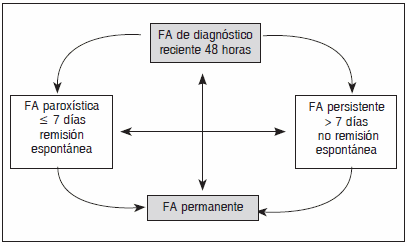
Fig. 1.- Evolución entre los distintos tipos de FA según su clasificación clínica
El médico debe distinguir el primer episodio detectado de FA, ya sea sintomático o no, y asumir la incertidumbre sobre la duración del episodio. Luego de dos o más episodios, la FA se considera recurrente. Si la arritmia se resuelve espontáneamente (la mayoría en menos de 24 horas), la FA recurrente se define como paroxística; cuando se mantiene durante siete días o más, se denomina persistente (la resolución mediante tratamiento farmacológico o cardioversión (CV) eléctrica directa no altera esta clasificación y es menos probable su reversión espontánea). Cuando FA persistente mantiene su ritmo y nunca vuelve a ritmo sinusal se llama permanente o crónica, en donde la CV ha fracasado o ha sido descartada. Cabe destacar que esta terminología se aplica a los episodios de FA que duran más de 30 segundos y no se relacionan con causas reversibles. Estas categorías no son mutuamente excluyentes, de forma que un paciente puede tener varios episodios de FA paroxística y FA persistente ocasional, o a la inversa.
La FA secundaria a infarto agudo de miocardio (IAM), cirugía cardíaca, pericarditis, miocarditis, hipertiroidismo o enfermedad pulmonar aguda se considera de forma separada. En estos casos, la FA no es el problema principal y el tratamiento de la enfermedad subyacente generalmente resuelve la arritmia.
El término de FA no valvular se refiere a los casos en los que no hay enfermedad valvular reumática, de otra etiología, prótesis valvular cardíaca o reparación valvular.
Riesgo de tromboembolia
La FA es la causa más frecuente de ACV isquémico de origen cardiembólico, debido a su elevada prevalencia en la población general. A pesar de que los accidentes isquémicos y la oclusión arterial sistémica en la FA se atribuyen generalmente a la embolización de trombos de la aurícula izquierda, la patogénesis de las tromboembolias es compleja34. Hasta el 25% de los ACV isquémicos en pacientes con FA pueden estar causados por enfermedad cerebrovascular intrínseca (trombóticos), por otras fuentes de embolia cardíaca o por afección ateromatosa en la aorta proximal o de las arterias carótidas internas35-37. Alrededor de la mitad de los pacientes mayores con FA tiene hipertensión (importante factor de riesgo de ACV) y, aproximadamente, el 12% tiene estenosis de las arterias carótideas38. El riesgo anual de ACV en pacientes con FA es de un 3-8% al año, con una media de 5%, y en nuestro país se ha establecido en 6%11, 39. El riesgo de ACV es 17 veces mayor en la FA con enfermedad reumática y 5 veces en la FA no reumática.
En cuanto al porcentaje de eventos isquémicos desencadenados por la FA, el ACV representa un 80%, y las embolias sistémicas 20%; de estos últimos la isquemia mesentérica es la de mayor letalidad (70%) pero con una baja incidencia (0.14%)40.
Es por esta diferencia en el riesgo de fenómenos embólicos que se desarrolló un score para estimar el riesgo de eventos isquémicos mayores, principalmente de ACV.
El score de riesgo más utilizado y recomendado es el denominado CHADS2, que surge del acrónimo: Congestive heart failure (insuficiencia cardíaca), Hypertension, Age (edad mayor a 75 años), diabetes mellitus, y Stroke o ACV o ataque isquémico transitorio (AIT)41. En el análisis de los trabajos todos los factores de riesgo recibieron un puntaje de uno, a excepción de la isquemia neurológica, a la que se le otorgaron dos puntos; es decir que el puntaje máximo era seis. Un puntaje de 3 o más resultó de alto riesgo. El score CHADS2 se relacionó muy bien con la frecuencia de eventos por 100 pacientes/año de los estudios Atrial Fibrillation Investigators (AFI)42, The Stroke Prevention in Atrial Fibrillation Study (SPAF I-III)43 y el American College of Chest Physicians Antithrombotic Therapy in Atrial Fibrillation Manning (8th Edition) (ACCP)44 y se concluyó que el CHADS2 es útil para cuantificar el riesgo de ACV en pacientes con FA y que es de utilidad para establecer el riesgo de embolia y en base a ello seleccionar la terapéutica antitrombótica adecuada (Fig. 2).
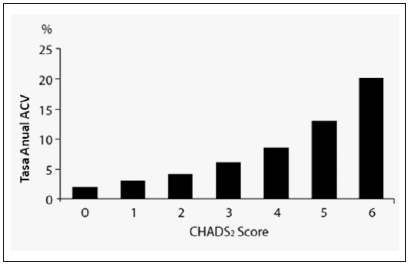
Fig. 2.- Riesgo anual de ACV según el índice CHADS2 en pacientes con FA no anticoagulados44
Los factores de riesgo para ACV y embolismo sistémico en pacientes con FA no valvular son, en orden decreciente: historia previa de ACV, riesgo relativo (RR) de 2.5; diabetes mellitus, RR de 1.7; historia de HTA, RR de 1.6; enfermedad coronaria, RR de 1.5; insuficiencia cardíaca congestiva, RR de 1.4; y edad mayor a 75 años, RR de 1.4; además de dilatación de la aurícula izquierda mayor a 5 cm y contraste espontáneo en el ecocardiograma (Tabla 1). Se considera a los pacientes de bajo riesgo con 0 puntos, de moderado riesgo con 1 o 2 puntos y de alto riesgo de 3 o más puntos o que tenga antecedente de ACV lo cual lo categoriza como alto riesgo a pesar de tener 2 puntos.
TABLA 1.- Indice CHADS2
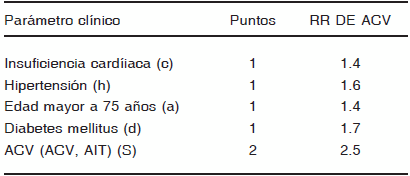
Abreviaturas: AIT, accidente isquémico transitorio; ACV, accidente cerebrovascular; RR, riesgo relativo.
En todos los casos, el RR se refiere a la comparación con pacientes que tienen FA sin estos factores de riesgo asociados. Estos resultados proceden del análisis conjunto de 5 ensayos de prevención primaria y deben estar presentes siempre en el momento de la prescripción del tratamiento adecuado al riesgo de embolia42.
En las últimas guías para el manejo de la FA se ha propuesto el score CHA2DS2-VASc, que agrega al ya conocido las siguientes diferencias: si el paciente tiene más de 75 años se le da 2 puntos (A2), si el paciente tiene antecedentes de enfermedad coronaria, infarto agudo de miocardio, enfermedad vascular periférica se le da 1 punto (V), si el paciente tiene entre 65-74 años se les da 1 punto (A), y si el paciente es de sexo femenino se le da un punto más (Sc), para definir la categoría de riesgo es la misma que para el CHADS2. La ventaja de este score es que es más acertado en cuanto a la predicción de eventos cerebrovasculares al incluir más variables en el análisis, pero debe aguardar hasta ser validado45.
Tratamiento
El tratamiento de los pacientes con FA tiene tres objetivos que no son mutuamente excluyentes: control de frecuencia cardíaca, corrección de alteraciones del ritmo cardíaco y prevención de eventos tromboembólicos.
Se prestará atención aquí al tratamiento antitrombótico, para el manejo práctico de las drogas anticoagulantes, se refiere a los lectores a las revisiones de Gimpel y Ansell39, 46. No se desarrollarán los temas de control de frecuencia cardíaca y reversión de la arritmia.
Terapéutica antitrombótica en fibrilación auricular y aleteo auricular
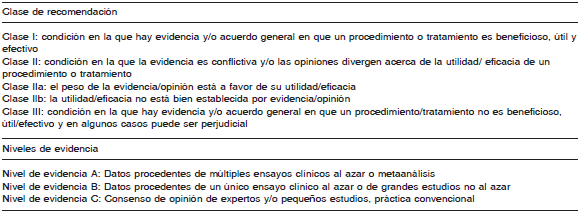
Para transitar por los diferentes escenarios de la terapia antitrombótica en la FA se tendrá en cuenta el sistema de clase de recomendación y nivel de evidencia del American College of Chest Physicians Evidence44 y de American Collage of Cardiology, American Heart Association, European Society of Cardiology (ACC/AHA/ESC), (Tabla 2)47.
TABLA 2.- Sistema de clasificación de recomendación y evidencia,44, 45
Como medida de anticoagulación (ACO) utilizaremos el rango internacional normalizado (RIN) que expresa el cociente entre el tiempo de Quick (TQ) del paciente y el TQ control, elevado al índice de sensibilidad de la tromboplastina utilizada debido a que existe una gran variación en las tromboplastinas (reactivos utilizados para estimar el TQ).
Prevención primaria de fibrilación auricular no valvular: En pacientes con FA, incluidos aquellos con FA paroxística, que tienen 2 o más puntos en el score CHADS2, se recomienda ACO de tiempo indefinido con dicumarínicos (warfarina o acenocumarol) logrando un RIN de 2.5 (rango: 2 a 3) debido al alto riesgo futuro de ACV (recomendación grado 1, evidencia A). Cuando se menciona "tiempo indefinido" se interpreta como "de por vida, o hasta que aparezca una contraindicación para ACO".
Los dicumarínicos son útiles en prevención primaria de tromboembolismo en pacientes con FA. Dos metaanálisis mostraron una reducción de riesgo relativo (RRR) del 62% con un intervalo de confianza (IC) 95 del 48% al 72% en comparación con el placebo40, 42. La ACO redujo significativamente la mortalidad: RRR 26%; (IC 95%: 4% al 43%); reducción de riesgo absoluto (RRA) 1.6%/año. Los pacientes que tienen RIN entre 2 y 3, disminuyen un 80% las posibilidades de tener un ACV.
En pacientes con FA, incluyendo aquellos pacientes con FA paroxística, con sólo un punto de score CHADS2, se recomienda ACO de tiempo indefinido con dicumarínicos logrando un RIN de 2.5 (rango: 2 a 3) (grado 1A) o aspirina (AAS) en dosis de 75 a 325 mg/día (grado 1B). A estos pacientes con riesgo intermedio se sugiere ACO con dicumarínicos frente a AAS (grado 2A).
En pacientes con FA, incluyendo aquellos con FA paroxística, sin puntos de score CHADS2, se recomienda AAS en dosis de 75 a 325 mg/d (grado 1B) debido al bajo riesgo de ACV.
Un metaanálisis en una población de 3337 pacientes que comparó AAS con placebo mostró una reducción en la tasa de ACV del 22% (IC 95%: 2% al 38%). La RRA anual de ACV en prevención primaria fue del 1.5% y el número de pacientes necesario a tratar (NNT) por año para prevenir un ACV fue de 67. La reducción de riesgo de ACV invalidante fue del 17%, p = no significativa (NS) y la de ACV no invalidante fue del 62% (p = 0.008) considerando un valor de p ≤ 0.05 como estadísticamente significativo. La AAS no modificó la incidencia de muerte: RRR 16%, (IC 95%: 5% al 32%)44, 47. Otro metaanálisis en una población de 2837 pacientes confirmó que los dicumarinicos en dosis ajustadas redujeron la incidencia de ACV total44, 47. El mayor riesgo de la ACO es la hemorragia. El nivel de complicación hemorrágicas es cercano al 1.4%, pero en los pacientes octogenarios llegó al 3-4% paciente/año48.
La publicación de una cohorte de pacientes con ACV isquémico y FA mostró que cuando el RIN estaba por debajo de 2, el riesgo de ACV isquémico grave y la mortalidad aumentan significativamente y se considera inefectiva con un RIN menor a 1.649.
El aumento del RIN se asoció con mayor tasa de hemorragia. En estudios recientes la tasa de hemorragias intracerebrales por cien personas/año aumentó del 0.5% al 2.7% (IC 95%: 1.0-7.3) con un RIN mayor de tres48.
Se expone en la Tabla 3 un resumen de la efectividad de la terapia antitrombótica, y el NNT para la prevención de ACV isquémico por cada cien pacientes por año con FA no valvular según los puntos del score CHADS249.
TABLA 3.- Eventos cerebrovasculares por cada cien pacientes año en pacientes tratados o no con warfarina de acuerdo al índice de CHADS2 47
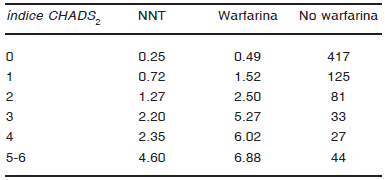
Abreviaturas: NNT, número necesario a tratar.
Prevención secundaria en fibrilación auricular no valvular: En pacientes con FA, incluyendo aquellos con FA paroxística, que han tenido un episodio de ACV o AIT o embolia sistémica se recomienda ACO por tiempo indefinido con dicumarínicos, logrando obtener un RIN de 2.5 (rango: 2 a 3) debido al alto riesgo de futuro de ACV (Grado 1A). Los dicumarínicos redujeron los eventos embólicos en un 68%. La RRA anual de ACV fue de 8.4% (NNT = 12). La RRA anual de ACV con AAS fue de 2.5% (NNT = 40)50.
El estudio EAFT en una población de 1007 pacientes comparó ACO con RIN 2.5-4.0 versus AAS 300 mg/día o placebo, y analizó recurrencia de eventos vasculares en pacientes con FA no valvular y antecedentes de ACV. La edad media fue 73 años. La tasa de eventos isquémicos cuando el RIN estaba entre 2.0 y 3.9 fue del 3.5% anual. El AAS redujo la tasa de eventos primarios en un 19%; en el grupo placebo la reducción fue del 15% (p = 0.12). El AAS previene 40 ACV isquémicos por 1000 pacientes tratados por año. Los dicumarínicos redujeron el riesgo de eventos vasculares serios a la mitad en relación con el AAS odds ratio (OR) de 0.55; (IC 95%: 0.36-0.83) y el riesgo de ACV en dos tercios (OR 0.35; IC 95%: 0.22-0.59) con una disminución de 60 ACV por mil pacientes tratados. La ACO se relacionó con mayor frecuencia a hemorragias mayores, pero la diferencia anual absoluta fue pequeña (2.8% versus 0.9%). El grupo que se benefició con respecto a la reducción de ACV fue el de más de 65 años51.
Fibrilación auricular con valvulopatía o reemplazo valvular protésico: En pacientes con FA y estenosis mitral, se recomienda ACO de tiempo indefinido con dicumarínicos logrando obtener un RIN de 2.5 (rango: 2 a 3) (grado 1B).
En pacientes con FA y válvulas protésicas, se recomienda ACO de tiempo indefinido con un RIN de 2.5 (rango: 2 a 3) (grado 1B).
Fibrilación auricular en postoperatorio de cirugía cardiovascular: En pacientes con FA en el postoperatorio de cirugía cardiovascular (menos de 48 horas), se sugiere ACO con dicumarínicos, logrando obtener un de RIN de 2.5 (rango: 2 a 3) (grado 2C) y se sugiere continuar la ACO en las 4 semanas posteriores a la recuperación del ritmo sinusal, particularmente en aquellos pacientes con factores de riesgo de embolias (Grado 2C).
Fibrilación auricular en contexto de procedimiento de cardioversión: En pacientes con FA de tiempo desconocido o más de 48 horas de diagnóstico, en los que se planea la cardioversión (CV) farmacológica o eléctrica, se recomienda ACO con dicumarínicos logrando obtener un de RIN de 2.5 (rango: 2 a 3) por tres semanas previas al procedimiento de cardioversión, y se recomienda continuar la ACO por 4 semanas posteriores a la recuperación del ritmo sinusal (grado 1C). Esta medida es aplicable a todos los pacientes independientemente de los factores de riesgo debido a que el riesgo de embolia es elevado posterior al procedimiento de cardioversión y debe considerarse como alto riesgo.
En pacientes con FA de tiempo desconocido o mayor a 48 horas de diagnóstico, en los que se planea la CV farmacológica o eléctrica se recomienda ACO inmediata con heparina no fraccionada intravenosa llevando el tiempo de tromboplastina parcial activada (KPTT) entre 1.5 a 2 veces el basal, o heparinas de bajo peso molecular en dosis de ACO (enoxaprina 1 mg/kg cada 12 horas SC)52 sumado al inicio de dicumarínicos con un RIN de 2.5 (rango: 2 a 3) al menos 5 días previos al procedimiento de CV y un ecocardiograma trans-esofágico multiplanar sin evidencia de trombo intra-auricular, debiendo continuar la ACO por 4 semanas posteriores a la recuperación del ritmo sinusal (grado 1B). En el caso de que se observe un trombo intra-auricular se pospondrá el procedimiento de CV y se deberá mantener la ACO por tiempo indefinido (grado 1B). Si se planease posteriormente un nuevo procedimiento de CV, se deberá realizar un nuevo ecocardiograma trans-esofágico multiplanar y se procederá según el resultado del mismo como se expuso previamente (grado 1B).
En pacientes con FA de menos de 48 horas de diagnóstico, en los que se planea la CV farmacológica (incluye CV con amiodarona intravenosa) o eléctrica, se recomienda ACO inmediata con heparina no fraccionada intravenosa llevando el KPTT entre 1.5 a 2 veces el basal, o heparinas de bajo peso molecular en dosis de ACO sumado al inicio de dicumarínicos con un RIN de 2.5 (rango: 2 a 3), y debiendo continuar la ACO por 4 semanas posteriores a la recuperación del ritmo sinusal (grado 2C). Esto se explica porque al hacer una CV se recupera inicialmente el ritmo eléctrico, pero no el mecánico, por lo que el riesgo de embolia se mantiene por aproximadamente 4 semanas. Se estima que en promedio es 3-4 semanas el tiempo de recuperación de la actividad mecánica auricular. Si el paciente presenta recurrencia de los episodios de FA paroxística se recomienda prolongar la ACO por tiempo indefinido.
En el caso de CV eléctrica de urgencia por descompensación hemodinámica se recomienda ACO inmediata con heparina no fraccionada intravenosa llevando el KPTT entre 1.5 a 2 veces el basal, o heparinas de bajo peso molecular en dosis de ACO sumado al inicio de dicumarínicos con un RIN de 2.5 (rango: 2 a 3), y debiendo continuar la ACO por 4 semanas posteriores a la recuperación del ritmo sinusal (grado 2C). Esta conducta es también aplicable a aleteo auricular (grado 2C).
En pacientes sometidos a CV eléctrica que no recibieron ACO, la incidencia de ACV fue del 6.8% versus el 1.1% de los que la recibieron. Se recomienda ACO (RIN 2-3). El riesgo de embolias en pacientes con FA paroxística es similar al de los pacientes con FA permanente, por lo que se recomienda la misma conducta terapéutica en ambos casos.
Riesgo de sangrado
El sangrado en los pacientes con dicumarínicos está dado por los siguientes factores de riesgo: edad mayor a 65 años, historia de ACV, historia de hemorragia digestiva, diabetes mellitus, creatinina mayor a 1.5 mg/dl, presencia de angiopatía amiloide, hematocrito menor a 30%53. El riesgo anual de sangrado mayor (definido como sangrado con descompensación hemodinámica, sangrado que requiera transfusiones de glóbulos rojos, hemorragia intracraneal o muerte) es aproximadamente un 3% para todo el grupo de pacientes ACO con dicumarínicos.
El score HAS-BLED54 (Tabla 4) ha sido propuesto para definir más acertadamente los pacientes que tienen mayor riesgo de sangrado, y es muy útil para definir tratamiento en los pacientes con riesgo intermedio55, ya que aquellos que presentan más de 3 puntos son considerados de alto riesgo de sangrado, con más del 10% de posibilidades de tener un sangrado mayor al año (RR 3.74)56.
TABLA 4.- Indice HAS BLED

Drogas y/o alcohol: 1 punto si consume algún antiplaquetario y 1 punto si consume 8 o más medidas de alcohol por semana, o 2 puntos ambos.
Por último, mencionar que ya se encuentran en el mercado nuevos agentes anticoagulantes directos orales como el dabigatran etexilato, que es un antitrombínico con eficacia y seguridad probada, pero con limitaciones por la necesidad de ajuste de dosis y falta de antídoto, además de su alto costo, quedando aún la pregunta abierta para la utilización de estos fármacos57, 58.
Podemos concluir que la FA es la arritmia más frecuente en la práctica clínica y es un importante factor de riesgo para el desarrollo de ACV. Los ACV embolígenos con foco embolígeno cardíaco tienen en general mayor extensión anatómica, y generan mayores secuelas neurológicas y mayor mortalidad relacionada al evento. Los que sobreviven a dicho evento, arrastrarán las secuelas físicas, mentales, funcionales y sociales, así como sus familias y cuidadores, generando grandes costos en salud. Actualmente, existe evidencia clara sobre las pautas que se deben asumir en el manejo óptimo y oportuno de la FA, enfocado principalmente en la prevención primaria y secundaria del fenómeno tromboembólico.
Conflictos de interés: El Dr. José Ceresetto recibe subsidios para investigación de Pfizer y Bristol-Myers Squibb. El resto de los autores no tienen conflictos de interés.
1. Eithoven W Le tele cardiograme. Arch Intern Physiol 1906; 4: 132-64. [ Links ]
2. Mehta NN, Greenspon AJ. Atrial fibrillation: rhythm versus rate control. Geriatrics 2003; 58: 39-44. [ Links ]
3. McClennen S, Zimetbaum PJ. Pharmacologic management of atrial fibrillation in the elderly: rate control, rhythm control, and anticoagulation. Current Cardiology Reports 2003; 5: 380-6. [ Links ]
4. Lamassa M, Di Carlo A, Pracucci G, et al. Characteristics, Outcome, and Care of Stroke Associated With Atrial Fibrillation in Europe Data From a Multicenter Multinational Hospital-Based Registry (The European Community Stroke Project). Stroke 2001; 32: 392-8. [ Links ]
5. Go AS, Hylek EM, Phillips KA, et al. Prevalence of diagnosed atrial fibrillation in adults: national implications for rhythm management and stroke prevention: the AnTicoagulation and Risk Factors in Atrial Fibrillation (ATRIA) Study. JAMA 2001; 285: 2370-5. [ Links ]
6. Friberg J, Buch P, Scharling H, Gadsbphioll N, Jensen GB. Rising rates of hospital admissions for atrial fibrillation. Epidemiology 2003; 14: 666-72. [ Links ]
7. Le Heuzey JY, Paziaud O, Piot O, et al. Cost of care distribution in atrial fibrillation patients: the COCAF study. Am Heart J 2004; 147: 121-6. [ Links ]
8. Fuster V, Rydén LE, Cannom DS, et al. [Guidelines for the management of patients with atrial fibrillation. Executive summary]. Rev Esp Cardiol 2006; 59: 1329-64. [ Links ]
9. Furberg CD, Psaty BM, Manolio TA, Gardin JM, Smith VE, Rautaharju PM. Prevalence of atrial fibrillation in elderly subjects (the Cardiovascular Health Study). Am J Cardiol 1994; 74: 236-41. [ Links ]
10. Heeringa J, van der Kuip DA, Hofman A, et al. Prevalence, incidence and lifetime risk of atrial fibrillation: the Rotterdam study. Eur Heart J 2006; 27: 949-53. [ Links ]
11. Labadet C, Liniado G, Ferreirós ER, et al. [Resultados del Primer Estudio Nacional, Multicéntrico y Prospectivo de Fibrilación Auricular Crónica en la República Argentina]. Rev Argent Cardiol 2001; 69: 49-67. [ Links ]
12. Kannel WB, Abbott RD, Savage DD, McNamara PM. Coronary heart disease and atrial fibrillation: the Framingham Study. Am Heart J 1983; 106: 389-96. [ Links ]
13. Friberg J, Scharling H, Gadsbøll N, Jensen GB. Sex-specific increase in the prevalence of atrial fibrillation (The Copenhagen City Heart Study). Am J Cardiol 2003; 92: 1419-23. [ Links ]
14. Furberg CD, Psaty BM, Manolio TA, Gardin JM, Smith VE, Rautaharju PM. Prevalence of atrial fibrillation in elderly subjects (the Cardiovascular Health Study). Am J Cardiol 1994; 74: 236-41. [ Links ]
15. Psaty BM, Manolio TA, Kuller LH, et al. Incidence of and risk factors for atrial fibrillation in older adults. Circulation 1997; 96: 2455-61. [ Links ]
16. Crijns HJ, Tjeerdsma G, De Kam PJ, et al. Prognostic value of the presence and development of atrial fibrillation in patients with advanced chronic heart failure. Eur Heart J 2000; 21: 1238-45. [ Links ]
17. Madrid AH, Bueno MG, Rebollo JM, et al. Use of irbesartan to maintain sinus rhythm in patients with long-lasting persistent atrial fibrillation: a prospective and randomized study. Circulation 2002; 106: 331-6. [ Links ]
18. Wachtell K, Lehto M, Gerdts E, et al. Angiotensin II receptor blockade reduces new-onset atrial fibrillation and subsequent stroke compared to atenolol: the Losartan Intervention For End Point Reduction in Hypertension (LIFE) study. J Am Coll Cardiol 2005; 45: 712-9. [ Links ]
19. Chatap G, Giraud K, Vincent JP. Atrial fibrillation in the elderly: facts and management. Drugs Aging 2002; 19: 819-46. [ Links ]
20. Nishimura RA, Holmes DR Jr. Clinical practice. Hypertrophic obstructive cardiomyopathy (Review). N Engl J Med 2004; 350: 1320-7. [ Links ]
21. Zile MR, Brutsaert DL. New concepts in diastolic dysfunction and diastolic heart failure: Part I: diagnosis, prognosis, and measurements of diastolic function (Review). Circulation 2002; 105: 1387-93. [ Links ]
22. Lairikyengbam SKS, Anderson MH, Davies AG. Present treatment options for atrial fibrillation (Review). Postgrad Med J 2003; 79: 67-73. [ Links ]
23. Page RL. Newly diagnosed atrial fibrillation. N Engl J Med 2004; 351: 2408-16. [ Links ]
24. Ezekowitz MD, Falk RH. The increasing need for anticoagulant therapy to prevent stroke in patients with atrial fibrillation. Mayo Clin Proc 2004; 79: 904-13. [ Links ]
25. Kopecky SL, Gersh BJ, McGoon MD, et al. The natural history of lone atrial fibrillation. A population based study over three decades. N Engl J Med 1987; 317: 669-74. [ Links ]
26. Fox CS, Parise H, D'Agostino RB Sr, et al. Parental atrial fibrillation as a risk factor for atrial fibrillation in offspring. JAMA 2004; 291: 2851-5. [ Links ]
27. Arnar DO, Thorvaldsson S, Manolio TA, et al. Familial aggregation of atrial fibrillation in Iceland. Eur Heart J 2006; 27: 708-12. [ Links ]
28. Brugada R, Tapscott T, Czernuszewicz GZ, et al. Identification of a genetic locus for familial atrial fibrillation. N Engl J Med 1997; 336: 905-11. [ Links ]
29. Chen YH, Xu SJ, Bendahhou S, et al. KCNQ1 gain-of-function mutation in familial atrial fibrillation. Science 2003; 299: 251-4. [ Links ]
30. Oberti C, Wang L, Li L, et al. Genome-wide linkage scan identifies a novel genetic locus on chromosome 5p13 for neonatal atrial fibrillation associated with sudden death and variable cardiomyopathy. Circulation 2004; 110: 3753-9. [ Links ]
31. Ellinor PT, Shin JT, Moore RK, Yoerger DM, MacRae CA. Locus for atrial fibrillation maps to chromosome 6q14-16. Circulation 2003; 107: 2880-3. [ Links ]
32. Darbar D, Herron KJ, Ballew JD, et al. Familial atrial fibrillation is a genetically heterogeneous disorder. J Am Coll Cardiol 2003; 41: 2185-92. [ Links ]
33. Peters NS, Schilling RJ, Kanagaratnam P, Markides V. Atrial fibrillation: strategies to control, combat, and cure. Lancet 2002; 359: 593-603. [ Links ]
34. Halperin JL, Hart RG. Atrial fibrillation and stroke: new ideas, persisting dilemmas. Stroke 1988; 19: 937-41. [ Links ]
35. Sacco RL, Adams R, Albers G, et al. Guidelines for prevention of stroke in patients with ischemic stroke or transient ischemic attack: a statement for healthcare professionals from the American Heart Association/American Stroke Association Council on Stroke: co-sponsored by the Council on Cardiovascular Radiology and Intervention: the American Academy of Neurology affirms the value of this guideline. Stroke 2006; 37: 577-617. [ Links ]
36. Bogousslavsky J, Van Melle G, Regli F, Kappenberger L. Pathogenesis of anterior circulation stroke in patients with nonvalvular atrial fibrillation: the Lausanne Stroke Registry. Neurology 1990; 40: 1046-50. [ Links ]
37. Miller VT, Rothrock JF, Pearce LA, Feinberg WM, Hart RG, Anderson DC. Ischemic stroke in patients with atrial fibrillation: effect of aspirin according to stroke mechanism. Stroke Prevention in Atrial Fibrillation Investigators. Neurology 1993; 43: 32-6. [ Links ]
38. Kanter MC, Tegeler CH, Pearce LA, et al. Carotid stenosis in patients with atrial fibrillation. Prevalence, risk factors, and relationship to stroke in the Stroke Prevention in Atrial Fibrillation Study. Arch Intern Med 1994; 154: 1372-7. [ Links ]
39. Gimpel N. Anticoagulación en pacientes con fibrilación auricular. Evid Actual Pract Ambul 2004; 7: 143-6. [ Links ]
40. Menke J, Lüthje L, Kastrup A, Larsen J. Thromboembolism in Atrial Fibrillation. Am J Cardiol 2010; 105: 502-10. [ Links ]
41. Gage BF, Waterman AD, Shannon W, Boechler M, Rich MW, Radford MJ. Validation of clinical classification schemes for predicting stroke: results from the National Registry of Atrial Fibrillation. JAMA 2001; 285: 2864-70. [ Links ]
42. Risk factors for stroke and efficacy of antithrombotic therapy in atrial fibrillation. Analysis of pooled data from five randomized controlled trials. Arch Intern Med 1994; 154: 1449-57. [ Links ]
43. Hart RG, Pearce LA, McBride R, Rothbart RM, Asinger RW. Factors associated with ischemic stroke during aspirin therapy in atrial fibrillation: analysis of 2012 participants in the SPAF I-III clinical trials. The Stroke Prevention in Atrial Fibrillation (SPAF) Investigators. Stroke 1999; 30: 1223-9. [ Links ]
44. Singer DE, Albers GW, Dalen JE. Evidence-Based Clinical Practice Guidelines: American College of Chest Physicians Antithrombotic Therapy in Atrial Fibrillation Manning (8th Edition) Chest 2008; 133; 546S-592S. [ Links ]
45. Lip GY. Implications of the CHA(2)DS(2)-VASc and HAS-BLED Scores for Thromboprophylaxis in Atrial Fibrillation. Am J Med 2010; 123: 484-8. [ Links ]
46. Ansell J. Long-term patient self-management of oral anticoagulation. Arch Intern Med 1995; 155: 2185-9. [ Links ]
47. Fuster V, Rydén LE, Cannom DS, et al. ACC/AHA/ESC guidelines for the management of patients with atrial fibrillation. A report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines and the European Society of Cardiology Committee for Practice Guidelines. J Am Coll Cardiol 2006; 48: 854-906. [ Links ]
48. Fihn SD, Callahan CM, Martin DC, McDonell MB, Henikoff JG, White RH. The risk for and severity of bleeding complications in elderly patients treated with warfarin. The National Consortium of Anticoagulation Clinics. Ann Intern Med 1996; 124: 970-9. [ Links ]
49. Go AS, Hylek EM, Chang Y, et al. Anticoagulation therapy for stroke prevention in atrial fibrillation: how well do randomized trials translate into clinical practice? JAMA 2003; 290: 2685-92. [ Links ]
50. Fuster V, Rydén LE, Asinger RW, et al. American College of Cardiology/American Heart Association/ European Society of Cardiology Board. ACC/AHA/ESC guidelines for the management of patients with atrial fibrillation: executive summary. A Report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines and the European Society of Cardiology Committee for Practice Guidelines and Policy Conferences developed in collaboration with the North American Society of Pacing and Electrophysiology. J Am Coll Cardiol 2001; 38: 1231-66. [ Links ]
51. Mant J, Hobbs F, Fletcher K, et al. Warfarin versus aspirin for stroke prevention in an elderly community population with atrial fibrillation (the Birmingham Atrial Fibrillation Treatment of the Aged Study, BAFTA): a randomised controlled trial. Lancet 2007; 370: 493-503. [ Links ]
52. Stellbrink C, Nixdorff U, Hofmann T, et al. Safety and efficacy of enoxaparin compared with unfractionated heparin and oral anticoagulants for prevention of thromboembolic complications in cardioversion of nonvalvular atrial fibrillation: the Anticoagulation in Cardioversion using Enoxaparin (ACE) trial. Circulation 2004; 109: 997-1003. [ Links ]
53. Aspinall SL, DeSanzo BE, Trilli LE, Good CB. Bleeding Risk Index in an anticoagulation clinic. Assessment by indication and implications for care: Outpatient Bleeding. Risk Index predicted major bleeding inpatients taking warfarin. J Gen Intern Med 2005; 20: 1008-13. [ Links ]
54. Pisters R, Lane DA, Nieuwlaat R. A novel user-friendly score (HAS-BLED) to assess 1-year risk of major bleeding in patients with atrial fibrillation: the Euro Heart Survey. Chest 2010; 138: 1093-100. [ Links ]
55. Boriani G, Diemberger I, Biffi M, Martignani C. Balancing the risk of hemorrhage vs thromboembolism in patients with atrial fibrillation: how to navigate between Scylla and Charybdis?. Chest 2010; 138: 1032-3. [ Links ]
56. Lip GY, Frison L, Halperin JL, Lane DA. Comparative Validation of a Novel Risk Score for Predicting Bleeding Risk in Anticoagulated Patients With Atrial Fibrillation The HAS-BLED (Hypertension, Abnormal Renal/Liver Function, Stroke, Bleeding History or Predisposition, Labile INR, Elderly, Drugs/Alcohol Concomitantly) Score. J Am Coll Cardiol 2011; 57: 173-80. [ Links ]
57. Connolly SJ, Ezekowitz MD, Yusuf S, et al. Dabigatran versus warfarin in patients with atrial fibrillation. N Engl J Med 2009; 361: 1139-51. [ Links ]
58. Ceresetto JM. Tromboprofilaxis: La Inyección o la Pastilla? Revista Fronteras en Medicina 2010; 3: 27-43. [ Links ]
Recibido: 16-11-2010
Aceptado: 15-4-2011














