Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Medicina (Buenos Aires)
Print version ISSN 0025-7680
Medicina (B. Aires) vol.71 no.4 Ciudad Autónoma de Buenos Aires July/Aug. 2011
ARTÍCULO ESPECIAL
Actualización en el tratamiento del síndrome urémico hemolítico endémico. Patogénesis y tratamiento de la complicación sistémica más grave de las infecciones por Escherichia coli productor de toxina Shiga
Romina J. Fernández-Brando1, Leticia V. Bentancor1, Maria Pilar Mejías1, Analía C. Panek1, Gabriel G. Cabrera1, Ramón A. Exeni2, Marina S. Palermo1
1División Inmunología, Instituto de Investigaciones Hematológicas, Academia Nacional de Medicina, Buenos Aires;
2Departamento de Nefrología, Hospital Municipal del Niño, San Justo, Provincia de Buenos Aires
Dirección postal: Dra. Marina S. Palermo, División Inmunología, Instituto de Investigaciones Hematológicas, Academia Nacional de Medicina, Pacheco de Melo 3081, 1425 Buenos Aires, Argentina
Fax: (54-11) 4803-9475 e-mail: mspalermo@hematologia.anm.edu.ar
Resumen
La forma típica o post-diarreica del síndrome urémico hemolítico (SUH) es la complicación más grave de las infecciones por cepas de Escherichia coli productoras de toxina Shiga (STEC). En la Argentina el SUH es un problema crítico de salud pública, ya que representa la principal causa de falla renal aguda en la infancia, la segunda causa de falla renal crónica, y aporta el 20% de los casos de transplante renal durante la infancia y la adolescencia. A pesar de los avances en el conocimiento de su patogénesis, el único tratamiento actual de los pacientes con SUH es de sostén, y no existen terapias específicas ni preventivas. En la presente revisión expondremos los conocimientos básicos de los mecanismos patogénicos y discutiremos los enfoques terapéuticos tradicionales e innovadores, con especial foco en la situación nacional y los aportes hechos por grupos de la Argentina.
Palabras clave: Síndrome urémico hemolítico; Escherichia coli O157:H7; Toxina Shiga; Diarreas; Tratamiento; SUH típico
Abstract
Update on the treatment of endemic hemolytic uremic syndrome. Pathogenesis and treatment of the most severe systemic complication of infections by Shiga toxin-producing Escherichia coli. The typical form of hemolytic uremic syndrome (HUS) is the major complication of Shiga toxin-producing Escherichia coli (STEC) infections. HUS is a critical health problem in Argentina since it is the main cause of acute renal failure in children and the second cause of chronic renal failure, giving account for 20% of renal transplants in children and adolescents in our country. In spite of the extensive research in the field, the mainstay of treatment for patients with HUS is supportive therapy, and there are no specific therapies preventing or ameliorating the disease course. In this review, we present the current knowledge about pathogenic mechanisms and discuss traditional and innovative therapeutic approaches, with special focus in national status and contributions made by Argentinean groups.
Key words: Hemolytic uremic syndrome; Escherichia coli O157:H7; Shiga toxin; Diarrhea; Treatment; Typical HUS
El síndrome urémico hemolítico típico o post-entérico (SUH), descripto por primera vez en 19551, es una enfermedad de comienzo agudo con anemia hemolítica microangiopática, trombocitopenia y daño renal, que se presenta generalmente a continuación de un episodio de diarrea con sangre o sin ella, principalmente en lactantes y niños en la primera infancia. El grupo de Gianantonio fue el primero en publicar en 1964 la descripción completa de los aspectos clínicos y la evolución de 64 casos de SUH2, y más importante aún, ellos propusieron la diálisis peritoneal como tratamiento para el período agudo3. Esta innovación terapéutica redujo la mortalidad durante el período agudo del 50% al 5%, siendo actualmente del 2 al 3%. En 1983, Karmali y col. describieron la asociación entre Escherichia coli, toxina Shiga (Stx) y SUH4, hecho que representó un avance significativo en el conocimiento del agente causal y los mecanismos patogénicos y permitió diferenciar al SUH de otras microangiopatías trombóticas.
Los niños afectados son fundamentalmente menores de 5 años, de ambos sexos, eutróficos, con buenas condiciones higiénico-sanitarias. En Argentina, esta enfermedad infantil constituye la primera causa de insuficiencia renal aguda en la edad pediátrica y la segunda de insuficiencia renal crónica; además, es responsable del 20% de los trasplantes renales en niños y adolescentes5.
Es importante señalar que el riñón no es el único órgano afectado durante el SUH. Muchos pacientes presentan en el período agudo síntomas neurológicos (20%) que incluyen letargia, cefaleas, convulsiones y coma, hipertensión arterial (25-30%) insuficiencia pancreática (8-10%) y/o complicaciones gastrointestinales (afectación colónica grave y prolapso rectal)6, 7. Los casos muy graves de SUH y generalmente las muertes están asociadas al compromiso neurológico. Un porcentaje alto de estos pacientes (20-30%) presentarán secuelas a medianolargo plazo, fundamentalmente renales, requiriendo en muchos casos el transplante renal6, 7, y en mucho menor grado se presentan secuelas neurológicas, pancreáticas y excepcionalmente alteraciones de la visión.
Epidemiología
Escherichia coli productor de Stx (STEC) es el agente etiológico más comúnmente asociado al SUH en Argentina, y el serotipo más frecuente es O157:H78. También se han descripto otros serotipos asociados a colitis hemorrágica y SUH, que se denominan genéricamente E.coli enterohemorrágico, en particular: O26:H11; O103:H2; O111:NM; O121:H19; O145:NM, O8:H19 y O145:H259. Es importante señalar que las cepas STEC no-O157 son mucho más difíciles de detectar por las técnicas microbiológicas convencionales, y por esta razón el número de casos de SUH asociados a cepas no-O157 puede ser subestimado. Los registros oficiales en la Argentina muestran que la enfermedad es endémica y presenta la mayor incidencia en el mundo con un reporte de 15 casos/100 000 niños menores de 5 años, y más de 400 nuevos casos cada año9. Estos valores son cinco veces mayores a los ocurridos en el resto del mundo, incluso en países con características geográficas y sociales similares como Chile y Uruguay. Desde 1965 y hasta el presente se han acumulado más de 7 000 casos10. La frecuencia de aparición de SUH es mayor en las provincias del centro y sur durante los meses cálidos, aunque se registran casos durante todo el año8.
En la Argentina, como en el resto del mundo, el ganado bovino es el reservorio natural y más importante de E. coli O157:H711. Cepas de STEC han sido recuperadas de muestras de materia fecal en el 39% de animales sanos, según se comunica en un estudio reciente en Argentina12. Los STEC se transmiten al hombre a través de los alimentos y el agua contaminados con la materia fecal de los animales portadores13. Otras rutas de trasmisión propuestas se asocian al contacto directo con personas o animales portadores, a través de la vía fecal-oral14. Las fuentes de infección que se han encontrado con mayor frecuencia asociadas a SUH en nuestro país son: alimentos con carne picada insuficientemente cocidos, jugos de manzana o productos lácteos no pasteurizados, vegetales crudos, salame y morcilla13. Otras conductas asociadas a infección incluyen: asistencia a natatorios insuficientemente clorados, bañarse en ríos o pozos de agua usados por el ganado para beber, visita a granjas, zoológicos, acampar en áreas usadas anteriormente para pastura de ganado, asistencia a jardines maternales donde acuden niños con diarrea14, 15. Distintas evidencias, epidemiológicas y experimentales, sostienen que en Argentina la ruta de transmisión persona-persona juega un papel central en el comportamiento endémico de la enfermedad. Una dosis infectiva muy baja -100 a 500 organismos son suficientes para producir enfermedad-, y la existencia de un número alto de adultos y menores portadores asintomáticos de estas bacterias patógenas, dan base a esta hipótesis15, 16.
Mecanismo patogénico
La infección comienza comúnmente con la ingesta de agua o alimentos contaminados. Las bacterias STEC presentan resistencia a la acidez, facilitando su supervivencia en el estómago. Al alcanzar el colon se adhieren a los enterocitos a través de un mecanismo regulado por una serie de genes de virulencia, que inducen lesiones características conocidas como attaching and effacing (A/E)17, caracterizadas por una estrecha interacción entre la bacteria y las células epiteliales intestinales, el borrado de las microvellosidades y la desorganización del citoesqueleto, causando diarrea e inflamación intestinal17. La diarrea sanguinolenta, uno de los signos principales de alerta en estos cuadros, se produce como consecuencia del daño local en los vasos del colon producido por la Stx liberada. Por un mecanismo aún no completamente esclarecido, la toxina Stx podría alcanzar la circulación sistémica y junto a otros factores tanto bacterianos como del huésped, producir daño vascular en sitios del endotelio ricos en receptores específicos para la Stx (Fig. 1).
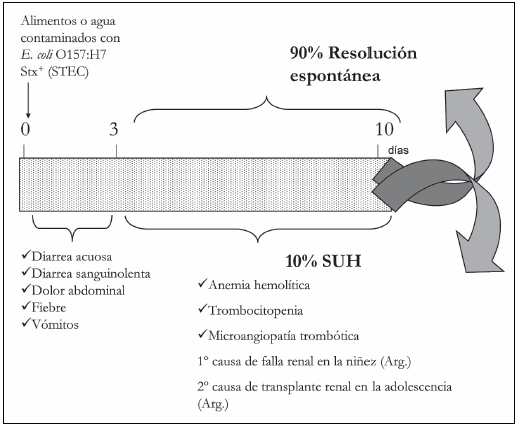
Fig. 1.- Progresión en niños de la infección con Escherichia coli O157:H7. Durante los tres primeros días posteriores a la ingestión del agente patógeno el paciente comienza con fiebre, vómitos y diarrea acuosa. En un 80-90% de los casos la diarrea se transforma luego en sanguinolenta. Posteriormente, en un tiempo variable entre 3 y 10 días del comienzo de los síntomas, un 10-15% de los pacientes presenta trombocitopenia, eritrocitos fragmentados, y grados variables de falla renal evidenciada por niveles elevados de creatinina, oligo-anuria y desequilibrio electrolítico
Toxina Shiga (Stx)
Stx es el factor de virulencia central e indispensable de las STEC para desarrollar SUH. El gen de Stx se encuentra codificado en un bacteriófago lisogénico incorporado al DNA bacteriano. La producción de Stx depende del ciclo replicativo del fago Stx y de su liberación tras la lisis bacteriana18. Existen dos familias de toxinas Stx: la Stx1 y la Stx2, cada una de las cuales presenta a su vez distintas variantes. Aunque todas las variantes han sido aisladas de pacientes con diarrea, no todas tienen el mismo grado de asociación con el desarrollo de las formas clínicas más severas. Efectivamente, estudios epidemiológicos han demostrado que las bacterias que expresan variantes de la familia de Stx2 (ej.: Stx2, Stx2c, Stx2d, Stx2d activable) se asocian más comúnmente a colitis hemorrágica o SUH, mientras que las que expresan Stx1 y sus variantes se aíslan de pacientes con diarreas sin complicaciones o infecciones asintomáticas19. En nuestro país la mayoría de las cepas STEC caracterizadas y aisladas de pacientes, son productoras de Stx2 y Stx2c, siendo ésta una de las razones probables de la alta incidencia de SUH.
Todas las variantes de Stx presentan una estructura conservada que incluye una unidad catalítica (subunidad A) y 5 subunidades B que median la unión a su receptor específico: el globotriaosilceramida (Gb3). Luego de la interacción con su receptor, las Stx inducen diferentes efectos biológicos dependiendo del tipo celular y la dosis. Por ejemplo, en dosis subletales y en células endoteliales las Stx tienen marcados efectos sobre la regulación genética, induciendo la expresión de genes asociados a fenómenos de adhesión, trombosis e inflamación. A dosis mayores, y luego del transporte retrógrado desde la membrana plasmática hacia el citosol, la internalización de la Stx a través del Gb3 resulta en la inhibición de la síntesis proteica y la muerte celular mediada por la interacción de la subunidad A con el RNAr 28S20.
Otros factores patogénicos
La etiología del SUH es multifactorial, involucrando complejas interacciones entre factores bacterianos y del huésped, y se debe tener en cuenta que no todas las infecciones con STEC resultan en SUH. Efectivamente, puede presentarse portación asintomática de STEC, o conducir a diarreas acuosas, diarreas sanguinolentas, y solo en un 5-10% de los niños infectados se observa el desarrollo de las formas completas de SUH21. El inóculo bacteriano inicial, el tipo de Stx producido, factores patogénicos adicionales de la bacteria (incluyendo adhesinas, otras toxinas y proteasas)9 y las características particulares de las respuestas trombótica e inflamatoria del huésped son algunos de los factores que influyen en la evolución a SUH, e incluso en la severidad del cuadro.
Tratamiento
La base del tratamiento para los pacientes con SUH es la terapia de apoyo, que generalmente incluye: control de fluidos y electrolitos, control de la hipertensión, y uso de diálisis y transfusiones de sangre, de acuerdo al estado de la función renal y el grado de anemia
Tratamientos durante el período pre-SUH
En los últimos años se ha propuesto como tratamiento en infecciones con E. coli O157:H7 durante la fase anterior al desarrollo de la falla renal, la expansión parenteral de la volemia con fluidos isotónicos22. Se ha sugerido que dicha expansión podría atenuar la falla renal y disminuir la nefrotoxicidad de los uratos y hemoglobina, disminuyendo las posibilidades de desarrollo del SUH. Sin embargo, esta recomendación debe ser estrictamente analizada en cada caso particular y requiere la hospitalización del niño para un continuo y estricto control de la función renal y el medio interno. Habiendo sido propuesto por un único centro, también seria importante más estudios aleatorios evaluando este protocolo antes de su generalización. El uso de drogas que inhiben la motilidad intestinal, o agentes anti-diarreicos en general, está contraindicado en niños con diarreas agudas ya que se han registrado mayor número de complicaciones y prolongación de la sintomatología, debido probablemente a la retención de toxina en el colon que favorece su absorción sistémica23.
Tratamiento con antibióticos
Se ha discutido mucho acerca de las ventajas y desventajas del uso de antibióticos durante las diarreas debidas a STEC. Un extenso análisis de un brote con E. coli O157:H7 en Japón, había sugerido que el uso de fosfomicina prevenía el riesgo de evolución a SUH. Sin embargo, este estudio presenta varias limitaciones. En particular, se analizó el efecto del tratamiento con fosfomicina comparándolo con otros antibióticos, pero no con un grupo sin tratamiento antibiótico24. Por el contrario, diversos estudios demostraron que aquellos niños con colitis hemorrágicas por STEC, que son tratados con antibióticos tienen mayores posibilidades de evolucionar a las formas más severas o SUH, comparado con aquellos que no reciben antibióticos24. Experimentalmente se ha demostrado que los antibióticos no sólo incrementan la inducción y subsecuente expresión del fago Stx, sino que como consecuencia de la lisis bacteriana, también aumentan la liberación de Stx. Asimismo, un estudio prospectivo reciente que analizó los resultados de 47 centros de diferentes estados de EE. UU., confirmó que la administración de antibióticos de la familia de las sulfas y los betalactámicos a niños infectados con E. coli O157:H7 aumenta el riesgo de desarrollar SUH.
Por lo tanto, actualmente hay consenso en que el tratamiento con antibióticos está contraindicado en casos de sospecha o confirmación de infecciones con STEC entéricos26.
Intervenciones durante el SUH
En un estudio reciente, se revisaron los resultados de siete ensayos clínicos controlados y aleatorios para evaluar la efectividad de distintas intervenciones en la evolución del SUH27. En el mismo, se comunicó que desde el primer ensayo clínico realizado en la Argentina28, se han analizado distintos tratamientos anticoagulantes incluyendo el uso de heparina, o heparina en combinación con uroquinasa o dipiridamole27. Sin embargo, y a pesar de la heterogeneidad entre los estudios, no hubo diferencias significativas entre los grupos en cuanto a mortalidad, eventos neurológicos y proteinuria o hipertensión a largo plazo. Debido a la existencia de efectos adversos del tratamiento anticoagulante, como el sangrado, este tipo de tratamientos han sido desalentados.
Otro estudio realizado por un grupo argentino con 94 pacientes comparó el tratamiento esteroideo con placebo, arrojando resultados que no justifican su implementación. Otros tratamientos han ensayado la administración de plasma fresco, comunicando beneficios adicionales respecto a la terapia de sostén29, aunque esta terapia está más precisamente indicada en el SUH atípico.
A partir de nuestros estudios demostrando que los niños con SUH presentan una inadecuada síntesis de eritropoietina (EPO)30, ha sido propuesto recientemente el tratamiento con esta hormona. Aunque este nuevo tratamiento reduce los requerimientos de transfusiones sanguíneas durante la etapa aguda31, alentando su generalización, deberá ser validado por futuros estudios multicéntricos.
Finalmente, para casos de SUH extremadamente agudos y severos, que se presentan con parámetros hemodinámicos compatibles con shock séptico y disfunción neurológica, Vallés y col, en Mendoza, Argentina, han propuesto un tratamiento no-convencional32. El protocolo incluye infusiones de plasma fresco, pulsos de metilprednisolona (10 mg/kg/día) durante tres días consecutivos y plasmaféresis por cinco días consecutivos, a partir de la admisión en la unidad de terapia intensiva. Los autores sugieren la introducción de este tratamiento en los casos de presentación con inestabilidad hemodinámica y compromiso neurológico, ya que en su comunicación, nueve de doce pacientes sobrevivieron con este tratamiento, mientras que de seis pacientes tratados convencionalmente murieron cinco.
Diálisis
La mayoría de los niños con SUH desarrollan algún grado de insuficiencia renal, y aproximadamente dos tercios de los pacientes con SUH requieren diálisis. En la mayoría de los centros asistenciales de la Argentina se prefiere la diálisis peritoneal a la hemodiálisis, especialmente cuando los pacientes son menores de 2 años33. Algunos grupos de Europa o EE.UU. han cuestionado su uso por aumentar el riesgo de peritonitis, aunque no existen informes bibliográficos que apoyen este concepto, y la enorme cantidad de niños que se trataron exitosamente con diálisis peritoneal en Argentina, más de 3 000 niños, hace irrelevante esta discusión.
Nuevas estrategias terapéuticas específicas
Uno de los primeros enfoques en la búsqueda de tratamientos específicos que despertó gran interés entre los nefrólogos pediátricos fue la idea de adsorber la Stx libre en el intestino a través de compuestos amorfos o inertes. Con este fin, se desarrolló y ensayó un compuesto derivado de diatomeas unido a una cadena de oligosacárido conocido con el nombre comercial Synsorb® Pk. Sin embargo, a pesar de su alto potencial para unir y neutralizar la Stx in vitro, cuando se la probó en ensayos clínicos no resultó beneficioso en prevenir o disminuir la severidad de las complicaciones sistémicas29. Luego se desarrollaron diversas estrategias con fines similares, que incluyeron polímeros de Gb3, o bacterias recombinantes que expresan el receptor Gb3 en su membrana, que si bien arrojaron buenos resultados al ser ensayados en modelos animales nunca fueron probados en humanos34. El mayor inconveniente que tienen estos tratamientos experimentales es que aun trazas de Stx que logren escapar de sus agentes bloqueantes en el intestino e ingresar a la circulación, serían suficientes para inducir el SUH. Debido a estas consideraciones, se comenzaron a desarrollar polímeros del receptor para Gb3 para ser administrados por vía sistémica. Entre ellos, Starfish es un nuevo compuesto que une Stx con 1 000 veces mayor eficiencia que Synsorb® Pk y se administra por vía endovenosa. Sin embargo, este compuesto mostró buena capacidad para unir y neutralizar Stx1 pero no Stx2. Dado que la variante Stx2, es la que presenta mayor potencial para desencadenar SUH, se desarrolló un nuevo compuesto denominado Daisy, que al menos experimentalmente tiene capacidad para neutralizar la Stx1 y la Stx2. Con este mismo objetivo, un grupo japonés creó otro compuesto llamado SUPER TWIGS, que está formado por 18 trisacáridos de Gb3, que no sólo une la Stx en circulación sino que induce su captación y eliminación por los macrófagos35.
Adicionalmente, se está investigando sobre estrategias terapéuticas alternativas, como el uso de inhibidores farmacológicos de la síntesis del receptor Gb3, ya usados para otras enfermedades36 y diversos anticuerpos monoclonales, humanizados, dirigidos contra las distintas subunidades de las Stx1 y/o Stx2. En este sentido, el intento de usar anticuerpos para neutralizar la Stx circulante, ha dado buenos resultados en modelos animales. Se ha visto que estos anticuerpos no presentan actividad protectora cruzada entre la Stx1 y la Stx2, siendo específicos contra la familia con que se desarrollaron, y mostraron mejor capacidad protectora aquellos que interactúan con la subunidad A respecto a los que lo hacen sólo con la subunidad B37.
Algunos de estos anticuerpos, han sido recientemente aprobados con la categoría de medicamento huérfano por los organismos reguladores de medicamentos de EE.UU. (Food and Drug Administration) y de Europa (European Medicines Evaluation Agency) para prevenir el SUH en ensayos clínicos de fase 1 para ser administrado a pacientes pediátricos infectados con STEC. Un punto importante, especialmente para nuestro país, es que solo han mostrado ser efectivos si son administrados dentro de los dos días de comenzada la diarrea37.
Aunque la mayoría de las estrategias terapéuticas están dirigidas a neutralizar los factores patogénicos del agente causal, también se ha propuesto bloquear los factores del huésped que contribuyen al proceso patogénico. En este sentido, recientemente se ha postulado que durante el SUH típico la activación del complemento a través de la vía alternativa también cumple un papel importante, similar a lo que ocurre durante el SUH atípico. Por este motivo el uso de inhibidores de la cascada del complemento podría ser beneficioso. Por otro lado, dado que diversas evidencias han mostrado que la reacción inflamatoria es esencial en la evolución a SUH, la inhibición de TNF y otras citoquinas /quimioquinas podrian ser blancos terapéuticos potenciales29.
Diagnóstico de las infecciones por STEC
El diagnóstico para establecer la asociación entre SUH e infección por STEC se basa en tres criterios: aislamiento y caracterización del patógeno; detección de Stx libre en materia fecal y detección de anticuerpos anti-Stx en suero8. Aunque en países de Europa y EE. UU. el 95% de casos de SUH se asocian a infecciones con STEC29, en Argentina esta asociación se puede confirmar sólo en un 60% de los casos29. Estos resultados discrepantes podrían atribuirse a las deficiencias en los sistemas locales de diagnóstico y vigilancia de diarreas.
Una de las limitaciones para la aplicación de todos los enfoques terapéuticos nuevos y específicos es que la ventana de tiempo entre el diagnóstico de infección por STEC y la aplicabilidad de los mismos es muy estrecha. Efectivamente, el diagnóstico de la infección por STEC debería realizarse dentro de las 48 h posteriores a la iniciación de la diarrea, objetivo que no es fácilmente alcanzable, al menos en Argentina. Distintas razones dificultan este diagnóstico precoz. Entre ellas, la dificultad de aislar y caracterizar a las STEC a partir de la materia fecal del niño aún en áreas donde los sistemas de vigilancia epidemiológica funcionan con relativa eficacia.
Perspectivas presentes y futuras de control
Dado que no hay perspectivas de aplicar, a corto plazo, planes de inmunización en ganado bovino o en humanos, y/o tratamientos específicos para prevenir o controlar el daño durante el SUH, nuestra mejor forma de disminuir los casos de SUH es la prevención, y para esto lo mejor es prevenir las infecciones primarias con STEC. Particularmente en nuestro país, se requieren controles más estrictos en todos los puntos de la cadena alimentaria que aseguren el cumplimiento de las leyes y normativas de control bromatológico en todos los niveles, juntamente con políticas educativas dirigidas a toda la población, específicas y sostenidas en el tiempo, que permitan a todos los consumidores y especialmente a aquellos que manipulan alimentos para la población de riesgo, conocer las medidas sanitarias necesarias para tener una alimentación segura. La amplia difusión de las medidas de prevención básicas aconsejadas por la Sociedad Argentina de Pediatría y organizaciones no gubernamentales que trabajan para el control de esta enfermedad (www.lusuh.org.ar) podría ser una ayuda importante.
Para un futuro, cuando alguno de los tratamientos específicos que están siendo ensayados resulte aprobado para su aplicación, la eficacia de los mismos dependerá de su implementación sumamente temprana. Por lo tanto son imperativos: la educación de la comunidad que permita una consulta rápida con los especialistas ante la presencia de diarrea, el mejoramiento de los sistema de vigilancia y salud, que permitan la toma de muestra biológica con la suficiente premura, y el desarrollo de métodos de diagnóstico simples y económicos que posibiliten su implementación en todos los puntos del país. Todo esto unido a la identificación de indicadores o predictores de mala evolución, para identificar aquellos niños con alta probabilidad de desarrollar complicaciones. Cabe recordar en este sentido las palabras de Gianantonio, cuando afirmaba que "los niños hacen el SUH en sus casas", haciendo referencia a que cuando son diagnosticados, los mecanismos patogénicos ya han sido totalmente desencadenados. La idea de todos los tratamientos experimentales actuales apunta justamente a evitarlos, impedir que dichos mecanismos se inicien o disminuir significativamente la potencia impidiendo el daño inicial.
Conflictos de interés: Los autores declaran no tener conflicto de interés alguno.
1. Gasser C, Gautier E, Steck A, Siebenmann RE, Oechslin R. Hemolytic-uremic syndrome: bilateral necrosis of the renal cortex in acute acquired hemolytic anemia. Schweiz Med Wochensch 1955; 85: 905-9. [ Links ]
2. Gianantonio C, Vitacco M, Mendilaharzu F, Rutty A, Mendilaharzu J. The Hemolytic-Uremic Syndrome. J Pediatr 1964; 64: 478-91. [ Links ]
3. Gianantonio CA, Vitacco M, Mendilaharzu J, Mendilaharzu F, Rutty A. Acute renal failure in infancy and childhood. Clinical course and treatment of 41 patients. J Pediatr 1962; 61: 660-78. [ Links ]
4. Karmali MA, Steele BT, Petric M, Lim C. Sporadic cases of haemolytic-uraemic syndrome associated with faecal cytotoxin and cytotoxin-producing Escherichia coli in stools. Lancet 1983; 1: 619-20. [ Links ]
5. Repetto HA. Long-term course and mechanisms of progression of renal disease in hemolytic uremic syndrome. Kidney Int Suppl 2005; 97: S102-6. [ Links ]
6. Lopez EL, Devoto S, Fayad A, Canepa C, Morrow AL, Cleary TG. Association between severity of gastrointestinal prodrome and long-term prognosis in classic hemolytic-uremic syndrome. J Pediatr 1992; 120: 210-5. [ Links ]
7. Exeni RA. Síndrome urémico hemolítico. Manifestaciones clínicas.Tratamiento. Medicina (Buenos Aires) 2006; 66 (Supl 3): 6-10. [ Links ]
8. Rivas M, Miliwebsky E, Chinen I, Deza N, Leotta GA. La epidemiología del síndrome urémico hemolítico en la Argentina. Diagnóstico del agente etiológico, reservorios y rutas de transmisión. Medicina (Buenos Aires) 2006; 66 (Supl 3): 27-32. [ Links ]
9. Rivas M, Miliwebsky E, Chinen I, et al. The Case-Control. Study Group: Characterization and epidemiologic subtyping of Shiga toxin producing Escherichia coli strains isolated from hemolytic uremic syndrome and diarrhea cases in Argentina. Foodborne Pathg Dis 2006; 3: 88-96. [ Links ]
10. Comité de Nefrología de la Sociedad Argentina de Pediatría: Incidencia del Síndrome Urémico Hemolítico (SUH) en la República Argentina. Arch Argent Pediatr 1995; 93: 407-11. [ Links ]
11. Parma AE, Sanz ME, Blanco JE, et al. Virulence genotypes and serotypes of verotoxigenic Escherichia coli isolated from cattle and foods in Argentina. Importance in public health. Eur J Epidemiol 2000; 16: 757-62. [ Links ]
12. Meichtri L, Miliwebsky E, Gioffre A, et al. Shiga toxin-producing Escherichia coli in healthy young beef steers from Argentina: prevalence and virulence properties. Int J Food Microbiol 2004; 96: 189-98. [ Links ]
13. Chinen I, Epszteyn S, Melamed CL, et al. Shiga toxin-producing Escherichia coli O157 in beef and chicken burgers, and chicken carcasses in Buenos Aires, Argentina. Int J Food Microbiol 2009; 132: 167-71. [ Links ]
14. Rivas M, Sosa-Estani S, Rangel J, et al. Risk factors for sporadic ShigaToxin-producing Escherichia coli infections in children, Argentina. Emerging Infectious Diseases 2008; 14: 763-71. [ Links ]
15. Miliwebsky E, Deza N, Chinen I, et al. Prolonged fecal shedding of Shiga toxin-producing Escherichia coli among children attending day-care centers in Argentina. Rev Argent Microbiol 2007; 39: 90-2. [ Links ]
16. Fernandez-Brando RJ, Bentancor LV, Mejías MP, et al. Antibody response to Shiga toxins in Argentinean children with enteropathic Hemolytic Uremic Syndrome at acute and long-term follow-up periods. Plos One 2011; 6: e19-136. [ Links ]
17. Spears KJ, Roe AJ, Gally DL. A comparison of enteropathogenic and enterohaemorrhagic Escherichia coli pathogenesis. FEMS Microbiol Lett 2006; 255: 187-202. [ Links ]
18. Herold S, Karch H, Schmidt H. Shiga toxin-encoding bacteriophages- genomes in motion. Int J Med Microbiol 2004; 294: 115-21. [ Links ]
19. Friedrich AW, Bielaszewska M, Zhang WL, et al. Escherichia coli harboring Shiga toxin 2 gene variants: frequency and association with clinical symptoms. J Infect Dis 2002; 185: 74-84. [ Links ]
20. Johannes L, Römer W. Shiga toxins-from cell biology to biomedical applications. Nat Rev Microbiol 2010; 8: 105-16. [ Links ]
21. Tarr PI, Gordon CA, Chandler WL. Shiga-toxin-producing Escherichia coli and haemolytic uraemic syndrome. Lancet 2005; 365: 1073-86. [ Links ]
22. Ake JA, Jelacic S, Ciol MA, et al. Relative nephroprotection during Escherichia coli O157:H7 infections: association with intravenous volume expansion. Pediatrics 2005; 115: e673-80. [ Links ]
23. Siegler R, Oakes R. Hemolytic uremic syndrome; pathogenesis, treatment, and outcome. Curr Opin Pediatr 2005; 17: 200-4. [ Links ]
24. Ikeda K, Ida O, Kimoto K, Takatorige T, Nakanishi N, Tatara K. Effect of early fosfomycin treatment on prevention of hemolytic uremic syndrome accompanying Escherichia coli O157:H7 infection. Clin Nephrol 1999; 52: 357-62. [ Links ]
25. Zimmerhackl LB. E. coli, antibiotics, and the hemolytic-uremic syndrome. N Engl J Med 2000; 342: 1990-1. [ Links ]
26. Wong CS, Jelacic S, Habeeb RL, Watkins SL, Tarr PI. The risk of the hemolytic-uremic syndrome after antibiotic treatment of Escherichia coli O157:H7 infections. N Engl J Med 2000; 342: 1930-6. [ Links ]
27. Michael M, Elliott EJ, Craig JC, Ridley G, Hodson EM. Interventions for hemolytic uremic syndrome and thrombotic thrombocytopenic purpura: a systematic review of randomized controlled trials. Am J Kidney Dis 2009; 53: 259-72. [ Links ]
28. Vitacco M, Sanchez Avalos J, Gianantonio CA. Heparin therapy in the hemolytic-uremic syndrome. J Pediatr 1973; 83: 271-5. [ Links ]
29. Palermo MS, Exeni RA, Fernández GC. Hemolytic uremic syndrome: pathogenesis and update of interventions. Expert Rev Anti Infect Ther 2009; 7: 697-707. [ Links ]
30. Exeni R, Donato H, Rendo P, et al. Low levels of serum erithropoietin in children with endemic hemolytic uremic syndrome. Pediatr Nephrol 1998; 12; 226-30. [ Links ]
31. Pape L, Ahlenstiel T, Kreuzer M, et al. Early erythropoietin reduced the need for red blood cell transfusion in childhood hemolytic uremic syndrome-a randomized prospective pilot trial. Pediatr Nephrol 2009; 24: 1061-4. [ Links ]
32. Valles PG, Pesle S, Piovano L, et al. Postdiarrheal Shiga toxin-mediated hemolytic uremic syndrome similar to septic shock. Medicina (Buenos Aires) 2005; 65: 395-401. [ Links ]
33. Cobenas CJ, Alconcher LF, Spizzirri AP, Rahman RC. Long-term follow-up of Argentinean patients with hemolytic uremic syndrome who had not undergone dialysis. Pediatr Nephrol 2007; 22: 1343-7. [ Links ]
34. Paton AW, Morona R, Paton JC. Neutralization of Shiga toxins Stx1, Stx2c, and Stx2e by recombinant bacteria expressing mimics of globotriose and globotetraose. Infect Immun 2001; 69: 1967-70. [ Links ]
35. Nishikawa K, Matsuoka K, Watanabe M, et al. Identification of the optimal structure required for a Shiga toxin neutralizer with oriented carbohydrates to function in the circulation. J Infect Dis 2005; 191: 2097-105. [ Links ]
36. Silberstein C, Copeland DP, Chiang W, Repetto HA, Ibarra C. A Glucosylceramide synthase inhibitor prevents the cytotoxic effects of Shiga Toxin-2 on human renal tubular epithelial cells. J Epithel Biol Pharmacol 2009; 1: 71-5. [ Links ]
37. Mukherjee J, Chios K, Fishwild D, et al. Human Stx2-specific monoclonal antibodies prevent systemic complications of Escherichia coli O157:H7 infection. Infect Immun 2002; 70: 612-9. [ Links ]
Recibido: 12-1-2011
Aceptado: 8-6-2011














