Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Medicina (Buenos Aires)
versión impresa ISSN 0025-7680
Medicina (B. Aires) vol.71 no.5 Ciudad Autónoma de Buenos Aires oct. 2011
ARTÍCULO ORIGINAL
Rol del sistema kallicreína kinina y su interrelación con sistemas vasoactivos durante la preñez
Elisabet Oddo, Elvira E. Arrizurieta
Servicio de Nefrología Experimental, Instituto de Investigaciones Médicas Alfredo Lanari, Universidad de Buenos Aires
Dirección postal: Dra. Elisabet Oddo, Servicio de Nefrología Experimental, Instituto de Investigaciones Médicas Alfredo Lanari, Combatientes de Malvinas 3150, 1427 Buenos Aires, Argentina
Fax (54-11) 4523-4094 e-mail: elioddo@yahoo.com.ar
Resumen
La hiperfiltración glomerular y el aumento de la reabsorción de sodio son factores fundamentales para el desarrollo de la unidad feto placentaria. Dichos factores resultan de adaptaciones hemodinámicas y renales en las que participan sistemas vasoactivos. Se pudo demostrar en ratas que la activación del sistema kallicreína kinina (SKK) precede a la instalación de la hiperfiltración glomerular, dado que su inhibición por aprotinina previene el aumento del filtrado glomerular. Además, la inhibición individual o asociada de los efectores específicos del SKK, las prostaglandinas (PGs) y el óxido nítrico (ON), confirman la dependencia del filtrado glomerular del SKK durante la preñez. Encontramos también que el sistema renina angiotensina (SRA) participa en la generación de la hiperfiltración glomerular dado que ésta es afectada por la administración de bloqueantes del SRA. La inhibición máxima sobre el pico de hiperfiltración se obtuvo con el bloqueo de ambos sistemas (SKK y SRA). Además, estrategias para alterar la hiperfiltración glomerular y la reabsorción de sodio de la preñez evidenciaron alteraciones en el desarrollo de la unidad feto placentaria, menor número de crías, mayor cantidad de reabsorciones intrauterinas y retardo en el crecimiento. El tratamiento combinado de inhibidores del SKK asociados a bloqueantes del SRA o de óxido nítrico mostraron los mayores efectos. En consecuencia, demostramos que el SKK juega un rol central en los fenómenos de adaptación que acompañan la preñez normal. La interrelación del SKK con varios sistemas vasoactivos parecería formar una red que participa en las adaptaciones hemodinámicas para un adecuado desarrollo de la gestación y de la unidad feto-placentaria.
Palabras clave: Sistema kallicreína kinina; Preñez; Hiperfiltración glomerular; Óxido nítrico; Sistema renina angiotensina
Abstract
Role of the kallikrein kinin system and its interrelationship with vasoactive systems in pregnancy. Glomerular hyperfiltration and increased sodium reabsorption are key factors for the development of the fetus and placenta in pregnancy. These adjustments result from hemodynamic and renal factors involving vasoactive systems. It was demonstrated in rats that activation of KKS precedes the installation of glomerular hyperfiltration as aprotinin prevents the increase in glomerular filtration. In addition, individual or associated inhibition of specific kallikrein kinin system effectors, prostaglandins (PGs) and nitric oxide (NO), confirm the glomerular filtration rate dependence of KKS during pregnancy. It was also found that the renin-angiotensin system (RAS) contributes to glomerular hyperfiltration as this is affected by the administration of RAS blockers. The peak of hyperfiltration maximum inhibition was obtained by the blockade of both systems (KKS and RAS). In addition, strategies used to alter the glomerular hyperfiltration and increased sodium reabsorption during pregnancy, showed abnormalities in the development of the fetus and placenta, fewer offspring, more fetus resorptions and intrauterine growth retardation. KKS inhibitors associated with RAS or nitric oxide blockers showed the greatest impact. As a consequence, it was demonstrated that KKS plays a central role in the adaptation phenomenom that accompanies normal pregnancy. The interplay of KKS with several vasoactive systems, seem to arrange a network involved in the hemodynamic adaptations to allow the proper development of pregnancy and the fetus and placenta.
Key words: Kallikrein-kinin system; Pregnancy; Glomerular hyperfiltration; Nitric oxide; Renin angiotensin system
El embarazo es una condición fisiológica que se caracteriza por un aumento del volumen minuto cardíaco acompañado de una disminución de la resistencia vascular periférica, con la consecuente caída de la presión arterial, expansión del volumen extracelular y ganancia de sodio. Estos cambios se acompañan de un aumento del flujo sanguíneo renal (FSR) y filtrado glomerular (FG), con conservación del balance glomérulo tubular y variaciones en el perfil hormonal consistentes en una activación de sistemas vasodilatadores y vasoconstrictores y hormonas que regulan el balance de agua y sodio.
Durante el embarazo, la tasa de excreción urinaria de prostaglandinas (PGs) aumenta no sólo en humanos1, sino también en ratas2 y conejos preñados. También el sistema renina angiotensina (SRA) se encuentra activado; este aumento podría mantener la presión sanguínea y una adecuada perfusión de órganos ante el aumento de la actividad de PGs o un shunt arterio-venoso de la unidad feto-placentaria. Una disminución de la resistencia periférica permitiría expandir la capacidad intra-vascular llevando a una disminución en la presión sanguínea. La elevación de la angiotensina II mantiene la presión sanguínea arterial y además es un factor angiogénico que induce el crecimiento de vasos sanguíneos nuevos en circunstancias experimentales. La prorrenina uterina podría estar involucrada en la neovascularización que ocurre en útero y placenta durante el embarazo3.
La relajación del endotelio dependiente de óxido nítrico (ON), ocurre en respuesta a una variedad de sustancias, tales como acetilcolina, nucleótidos de adenina, trombina, sustancia P, ionóforo de calcio A 23187, y bradikinina. El oxígeno reacciona rápidamente con el ON formando NO2, el cual en solución forma nitritos (NO2-) y nitratos (NO3-). Algunos estudios demostraron que los niveles de nitratos tanto urinarios como plasmáticos (metabolitos estables del ON), también como el GMPc, el segundo mensajero de la dilatación inducida por el ON, están aumentados durante la gestación en humanos y en ratas4. Estudios in vitro, sugieren que el incremento en la producción de ON sería el responsable del efecto refractario a vasoconstrictores asociado al embarazo.
Las evidencias encontradas hasta este momento sugieren que la kallicreína renal estaría involucrada en la regulación del flujo sanguíneo renal5, FG, excreción de agua, electrolitos y síntesis de PGs pudiendo ser éstas responsables de los cambios observados en el embarazo. También, el sistema kallicreína kinina (SKK) podría contrabalancear el aumento en la actividad del SRA en el embarazo normal, encontrándose una caída significativa de los niveles de kallicreína urinaria en pacientes que desarrollan hipertensión en el embarazo y preeclampsia6. La kallicreína es sintetizada en las células del túbulo conector cortical. Como el túbulo conector y el túbulo colector cortical son estructuras asociadas en forma íntima con el glomérulo, se propuso que, en este segmento, la kallicreína podría actuar como un mecanismo paracrino modulando el tono glomerular. Las kininas son producidas continuamente y hay clara evidencia de un fuerte efecto sobre la resistencia de la vasculatura renal, excreción de agua, electrólitos y moduladores de la función renal (tales como renina, angiotensina, prostaglandinas, catecolaminas, óxido nítrico, vasopresina y endotelinas) en base a ello, nuestra hipótesis es que el SKK podría contribuir a los cambios fisiológicos de la preñez, ya sea actuando per se o como estimulador de otros sistemas.
En base a lo expuesto, el objetivo de este trabajo fue estudiar el rol del SKK sobre la hiperfiltración de la preñez y su interrelación con otras sustancias vasoactivas estimuladas durante la gestación, utilizando inhibidores y antagonistas durante los períodos de máximos cambios hemodinámicas. Asimismo se estudió el efecto de esta estrategia sobre el manejo de sodio y agua y el número y desarrollo de las crías.
Materiales y métodos
Se utilizaron 54 ratas Wistar hembra, de 200-250g de peso corporal. Los animales fueron provistos por el bioterio del Instituto de Investigaciones Médicas Alfredo Lanari, donde se alojaron a una temperatura ambiente de 22 °C y con un ciclo de luz: oscuridad de 12:12 horas. Recibieron como alimento una dieta estándar (alimento balanceado Cargill, Buenos Aires, Argentina) y agua corriente como bebida.
Los grupos estudiados fueron:
- Preñadas normal (PN) (n = 6)
- Preñadas tratadas (PT) (n = 48)
1. Inhibición del sistema kallicreína-kinina: se utilizó aprotinina (Apro), un inhibidor de kallicreína, en una dosis 40 000 UIK7 (unidades inhibidoras de kallicreína), durante 4 días, entre los días 10 y 13 de preñez, vía intra-peritoneal, administrada en dos dosis diarias.
2. Inhibición de prostaglandinas: se utilizó indometacina (IMT) como inhibidor de la síntesis de PGs. Las ratas preñadas se inyectaron con 3.0 mg/kg/día de IMT8, vía subcutánea, en dos dosis diarias durante 4 días, los días 14 a 18 de preñez.
3. Inhibición secuencial de los SKK y PGs: se administró Apro e IMT en igual dosis y tiempo que los descriptos más arriba.
4. Inhibición del SRA: se administró un inhibidor de la enzima de conversión de angiotensina, enalapril (E), en una dosis de 50 mg/kg/día9 o un bloqueante de receptores de angiotensina I, losartan (L), 25 a 30 mg/kg/día10, administrada en el agua de bebida, durante 4 días, 14 a 18 días de preñez
5. Inhibición secuencial de los SKK y SRA: se administró Apro y enalapril en iguales dosis y tiempos descriptos en los puntos anteriores.
6. Inhibición de la óxido nítrico sintasa (ONS): se administró N-W-nitro-L-arginina metil ester (L-NAME)1 mg/ml en el agua de bebida, desde el día 10 al 18 día de preñez11.
7. Inhibición secuencial de los SKK y ON: se administró Apro, durante los días 7 a 13, y L-NAME, durante los días 14 a 18 de preñez, en las dosis descriptas con anterioridad.
Las ratas fueron estudiadas en situación basal (B) y luego fueron apareadas con machos de la misma cepa durante 4 a 5 días realizando, diariamente, tomas de muestras de lavado vaginal, para detectar el comienzo de la preñez. Las muestras se estudiaron en fresco por microscopia óptica y se confirmó el día 0 de gestación por la presencia de espermatozoides en el lavaje vaginal. Las ratas preñadas se estudiaron a lo largo de la gestación, cuya duración total es de 21 días. La 1er, 2da y 3er semana de gestación en las ratas son homologables al 1er, 2do y 3er trimestre de embarazo en humanos. Especialmente, se estudiaron la segunda semana y primera y segunda mitad de la tercer semana en forma secuencial (períodos denominados I, II y III correspondientes a los días 7 a 13, 14 a 18 y 19 a 21 de preñez, respectivamente) por ser el momento donde se han descripto los mayores cambios hemodinámicos del embarazo.
Todos los grupos de ratas preñadas, PN y PT, fueron alojadas en jaulas metabólicas, realizando colecciones de orina de 24 h en situación basal, y durante los periodos I, II y III. En las muestras obtenidas se determinó: diuresis (ml/día), creatinina (mg/dl) por método de Jaffé modificado, excreción de sodio y potasio (mEq/día) por fotometría de llama y osmolalidad urinaria (mOsm/día) por descenso crioscópico. La excreción de kallicreína urinaria (Ku) se determinó en orinas que fueron previamente diluidas 1:250, midiendo la actividad amidolítica de la enzima sobre un sustrato cromogénico sintético, S-2266 (Kabi Diagnostica) (H-D-Val-Leu-Arg-pNA) en buffer Tris, a pH 8.2. La liberación de para-nitroanilina se detectó, después de 30 minutos de incubación a 37 °C, a 405 nm. Los resultados fueron expresados en nanokatales (1 nka t= 1 nmol/seg de incubación). Las variaciones intra e inter-ensayo del método fueron de 4.4% y 8.1% respectivamente(n = 15). Al finalizar los períodos I, II y III también se realizó la extracción de una muestra de sangre donde se midió creatinina y electrólitos. Durante el P II de preñez se determinó la concentración de aldosterona plasmática (CAP) (pg/ml), con un ensayo competitivo radioinmunológico (IMMUNOTECH). Muestras de estándar y del plasma se incubaron en tubos recubiertos con anticuerpo antialdosterona, utilizando aldosterona marcada con I125 como trazador. Después de la incubación, se aspiró el contenido de los tubos descartándolo y la reactividad unida al anticuerpo que recubre el tubo se midió en un contador gamma. Se realizaron cálculos de clearance de creatinina (ml/min) y excreción fraccional de sodio (EFNa%), utilizando fórmulas convencionales.
Al término de la gestación se determinó peso y número de crías, cantidad de reabsorciones intrauterinas (RIU), que representan la presencia de abortos en la rata, y retardo en el crecimiento (RC). Se realizó registro de presión arterial sistólica (PAS) durante el período final de la preñez, por método indirecto, utilizando un electrofisiógrafo (Physiograph MK III S, Narco Biosystem, Austin, Tx, USA). Para medir la presión, las ratas fueron alojadas en un receptáculo plástico sobre una placa termostatizada mantenida a una temperatura superior a los 37 °C que permite la vasodilatación de la arteria de la cola. Las determinaciones se realizaron por oclusión de la circulación de la cola de la rata por medio de un manguito anular, y la detección del pulso cuando la presión del manguito baja. La presión a la cual el primer pulso aparece es una medida de la presión sistólica sanguínea. La PAS se calculó como el promedio de 10 registros. Además, al final del experimento, se realizó la extracción de los riñones de la madre para su análisis histopatológico.
Los resultados fueron expresados como medias y error estándar de la media (![]() ± ES). Las variaciones “intra” y “entre” grupos, a lo largo del tiempo, fueron estudiadas utilizando análisis de varianza de dos vías, y el test de Tukey para comparar medias. Se aplicó test t de Student cuando fue necesario, tomando una p < 0.05 como estadísticamente significativa.
± ES). Las variaciones “intra” y “entre” grupos, a lo largo del tiempo, fueron estudiadas utilizando análisis de varianza de dos vías, y el test de Tukey para comparar medias. Se aplicó test t de Student cuando fue necesario, tomando una p < 0.05 como estadísticamente significativa.
Resultados
Los resultados obtenidos estudiando ratas normales en situación basal (B) y a lo largo de su preñez, muestran que el filtrado glomerular, aumenta casi al doble al comienzo de la tercer semana de preñez, los días 14 a 18 de preñez, (B 0.97 ± 0.07 vs PII 1.85 ± 0.23 ml/min, p < 0.05), para descender al final de la 3er semana (PIII: 1.45 ± 0.06 ml/min) (Fig. 1). La excreción de agua sufre cambios similares a los de la filtración glomerular (B: 7.43 ± 0.69 vs PII 15.59 ± 2.70 ml/día, p < 0.05). La excreción de sodio, en cambio, muestra una disminución en los últimos dos períodos de preñez (B: 1.06 ± 0.13 vs PII: 0.32 ± 0.09 y PIII: 0.36 ± 0.2 mEq/día, p < 0.05) (Fig. 2). Del mismo modo, al estudiar la excreción fraccional de sodio también se observa que existe una reabsorción máxima durante la gestación en la 3ra semana de gestación (PII y PIII). La excreción de potasio no sufre cambios significativos aunque se observa un aumento del 17% a lo largo de la gestación. Precediendo a los cambios de la máxima hiperfiltración glomerular y retención de sodio, se detecta un aumento del 80% en la excreción de kallicreína urinaria (B: 54.27 ± 4.48 vs. PI 97.53 ± 8.57 nkat/día, p < 0.05) que luego desciende significativamente al final de la preñez (PIII 40.92 ± 4.70 vs. PI, p < 0.05) (Fig. 3).
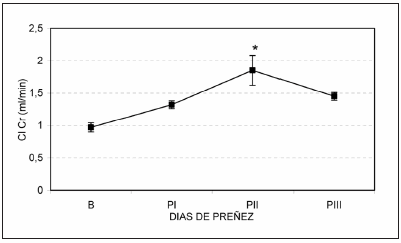
Fig. 1.-Clearance de creatinina en ratas preñadas, no tratadas. La curva representa el valor medio ± el error estándar de 6 ratas preñadas en situación basal (B), antes del apareamiento y durante los períodos I, II y III correspondientes a los días 7 a 13, 14 a 18 y 19 a 21 días de preñez respectivamente. *p < 0.05 vs. B
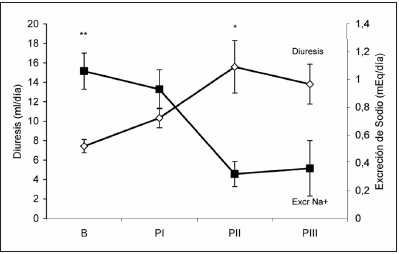
Fig. 2.-Diuresis y excreción de sodio en ratas preñadas normales. *p < 0.05 vs. B. **p < 0.05 vs. PII y PIII

Fig. 3.-Clearance de creatinina y excreción de kallicreína durante la preñez en ratas. *p < 0.05 vs. B y PIII. **p < 0.05 vs. B
La concentración de aldosterona plasmática durante el pico de hiperfiltración de la preñez muestra niveles muy elevados comparados con ratas hembras de la misma edad no preñadas (CAP en ratas controles 600 ± 120 vs. ratas preñadas 1910 ± 343 (pg /ml). El número de crías promedio al final de la preñez fue 11.2 ± 1.70 con un peso promedio de 6.6 ± 0.12 gr.
El efecto de los distintos tratamientos (indometacina, aprotinina, enalapril o losartán y L-NAME) disminuyó en todos los casos el pico de hiperfiltración glomerular normal de la preñez, alcanzando significación estadística en el tratamiento con IMT, E y L. (Fig. 4), (B 0.97 ± 0.07 vs. PII PN 1.85 ± 0.23, vs. PII P+ Apro: 1.45 ± 0.12, p < 0.01, vs. P+IMT: 1.19 ± 0.15, P+E: 1.32 ± 0.64, P+L: 1.25 ± 0.13 N.S., vs. P+ NAME: 1.56 ± 0.22, p < 0.02). Al inhibir secuencialmente el SKK (con Apro) y otros sistemas vinculados como SRA y óxido nítrico, se detectó una inhibición máxima (PN PII: 1.85 ± 0.23, PII Apro+E: 0.51 ± 0.15, PII PApro+NAME: 0.74 ± 0.10, p < 0.05), (Fig. 4).

Fig. 4.-Efecto de los distintos tratamientos sobre el clearance de creatinina durante el PII de preñez. PN: preñada normal; IMT: indometacina, AP: aprotinina; E: enalapril; L: losartan, NAME: inhibidor de la óxido nítrico sintasa. ***p < 0.01 vs. B; *p < 0.05 PII P+IMT; Ap+E; Ap+NAME vs. PII PN
Durante la preñez, la reabsorción de sodio es máxima en PII (B: 0.43 ± 0.11 vs. PII 0.11 ± 0.02 p < 0.05). Esta se ve alterada por los distintos tratamientos, situándose por encima de los valores de PII en la mayoría de los casos y disminuyendo sólo con el tratamiento con L-NAME solo o combinado con Apro ( PII PN: 0.11 ± 0.02 vs. P+NAME: 0.02 ± 0.009, vs. P+Apro+NAME: 0.08 ± 0.04, p < 0.001). El balance de agua no es afectado por la administración de Apro o IMT pero sí al asociar ambos tratamientos (PII P+IMT: 15.9 ± 1.21 y P+Apro: 14.1 ± 1.85 vs. PApro+IMT: 34.4 ± 3.11 ml/día, p < 0.05 y p < 01 respectivamente). Del mismo modo la asociación de Apro con L-NAME afecta la excreción de agua disminuyéndola un 30% (p < 0.001). Estas alteraciones de la excreción de agua afectan la capacidad de concentración de la orina registrándose en el grupo de preñadas tratadas con Apro+IMT una osmolaridad urinaria baja (PII PN: 1985 ± 204.8 vs. Apro+IMT: 845 ± 76.8 mOsm/kg de agua, p < 0.01).
Durante la gestación, en la rata, la excreción de kallicreína urinaria aumenta previo al pico de hiperfiltración de la preñez (Fig 3). Al mismo tiempo se detecta altos niveles de aldosterona en el periodo II. El tratamiento con Apro sola o asociada a enalapril o L-NAME disminuye, significativamente, la excreción de kallicreína (PII PN: 61.8 ± 4.28 vs. PApro+E: 22.8±6.84, PApro+NAME: 13.3 ± 3.20, p < 0.001). Por otra parte, los niveles de aldosterona descendieron con todos los tratamientos excepto al combinar Apro e inhibidores de la enzima óxido nítrico sintasa (Tabla 1).
TABLA 1.-Excreción de kallikreína urinaria (KU) y concentracion de aldosterona plasmática (CAP) durante el PII en ratas preñadas normales (PN) y tratadas con inhibidores
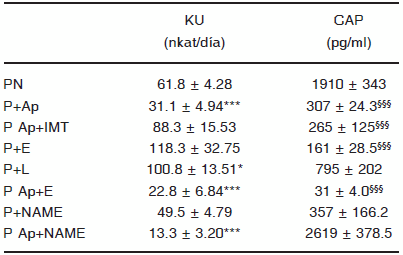
*PN vs. P+L p < 0.05; ***P+Ap, P Ap+E, P Ap+NAME vs. PN p < 0.001; §§§PN vs. P+Ap p < 0.01; vs. Pap+IMT p < 0001; vs. P+E p < 0.01; vs. Ap+E p < 0.001. PII: período II.
En la Tabla 2 se describe el efecto de los distintos inhibidores sobre el número y desarrollo de los fetos. Como se muestra, la IONS sola y la asociación inhibitoria del SKK y renina angiotensina o SKK y ONS durante la preñez, afectó especialmente el número de crías, observándose un mayor porcentaje de reabsorciones intrauterinas y retardo en el crecimiento fetal.
TABLA 2.-Número y características de las crías
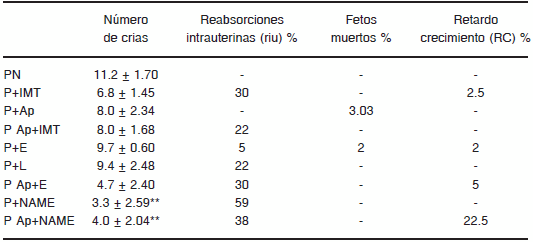
** p < 0.02 vs. PN
La presión arterial sistólica no sufrió cambios significativos, excepto en las ratas tratadas en forma secuencial con inhibidores del SKK y ON (PAS PN: 80 ± 7.5 vs. P Apro+NAME: 174 ± 2.02 mm Hg, p < 0.001)
El estudio histopatológico de los riñones de las ratas preñadas tratadas no mostró cambios significativos excepto en el grupo tratado en forma secuencial con inhibidores del SKK y ON. Se observó glomérulos conservados y dilatación, vacuolización y aplanamiento del epitelio tubular, alteraciones renales compatibles con una necrosis tubular aguda isquémica (Fig. 5).
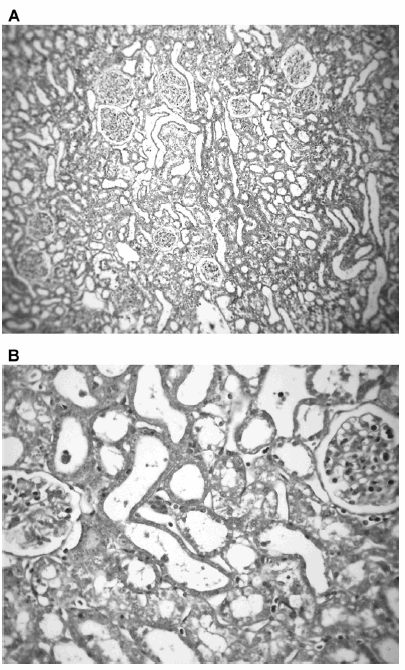
Fig. 5.-Histología de tejido renal de ratas preñadas tratadas secuencialmente con aprotinina e inhibidores de la óxido nítrico sintasa. Coloración tricrómica de Masson. A: Aumento 100x; B: Aumento 400x. Se observan glomérulos conservados, dilatación, vacuolización y aplanamiento del epitelio tubular, lesiones compatibles con una necrosis tubular.
Discusión
En un trabajo previo realizado en nuestro laboratorio detectamos, en ratas Wistar, mediante clearance de creatinina realizados en forma secuencial, la existencia de un pico de hiperfiltración glomerular en el último tercio de la gestación comparable al descripto en humanos. Asimismo, se pudo observar un aumento de la excreción de kallicreína, marcador de la actividad del SKK renal, previo al pico de hiperfiltración glomerular12. El incremento de la actividad del SKK nos llevó a estudiar la contribución que éste y otros sistemas vasoactivos interrelacionados (PGs, SRA, ON), pudieran tener con los mencionados cambios hemodinámicos del embarazo.
Para ello, tratamos a ratas preñadas, desde la mitad de la preñez y por cuatro días, con un inhibidor de kallicreína (aprotinina). Esta estrategia indujo una disminución del 25% del pico de hiperfiltración glomerular; un leve aumento en la excreción de sodio a pesar del menor FG; un nivel disminuido de aldosterona plasmática y un menor número de crías al tiempo del parto, con mayor porcentaje de fetos muertos, certificando la importancia del SKK en la preñez.
La inhibición de mediadores del efecto vasodilatador del SKK durante la preñez, como PGs y ON, afectó del mismo modo el pico de hiperfiltración glomerular, alterando la excreción de sodio, aldosterona y el número de crías.
Cuando se administraron dos tipos diferentes de inhibidores del SRA, sistema que interactúa con el SKK, como son el enalapril y el losartán, durante el pico de hiperfiltración de la preñez, provocaron también una disminución del filtrado glomerular de alrededor del 30%, aumentó la diuresis, excreción de sodio y elevó los niveles de kallicreína urinaria especialmente en las ratas tratadas con enalapril. También se observó menor nivel de aldosterona plasmática y un mayor número de reabsorciones intrauterinas.
El efecto de la asociación de los distintos inhibidores con Apro acentúo las alteraciones observadas al administrar los bloqueantes por separado, especialmente cuando se asoció a inhibidores del SRA y de ON (P Apro+E y P Apro+NAME).
Los resultados obtenidos en este trabajo, destacan la importancia de la interrelación entre el SKK y otros sistemas vasoactivos involucrados en la fisiología y fisiopatología de la preñez en la rata, necesarios para dar lugar a la adaptación en la hemodinamia renal y a la regulación del balance de sodio, indispensables para el desarrollo feto-placentario.
La importancia del SKK per se está demostrada, porque la sola administración de aprotinina disminuye la hiperfiltración normal de la preñez, afecta la reabsorción de sodio y disminuye el número de crías con mayor porcentaje de fetos muertos. También comprueba la importancia del SKK como estimulador de otros sustancias vasoactivas durante la preñez, dado que la asociación de aprotinina con bloqueantes de algunos de los sistemas interrelacionados agrava los efectos encontrados con los tratamientos individuales, tanto sobre la hiperfiltración glomerular como sobre el número y características de las crías. Además, la inhibición individual o asociada de los efectores específicos del SKK, las prostaglandinas y el óxido nítrico, confirman la dependencia del filtrado glomerular del SKK. Encontramos también que el SRA interviene en la generación de la hiperfiltración glomerular dado que ésta es afectada por la administración de enalapril. El efecto máximo sobre el pico de hiperfiltración se obtiene con el bloqueo de ambos sistemas (SKK y SRA).
El aumento de la reabsorción de sodio en la preñez normal, del orden del 25-70% durante el período de hiperfiltración, contribuye al desarrollo feto-placentario. El bloqueo del SKK directamente por Apro o por el bloqueo de uno de sus mediadores, las PGs, disminuye la reabsorción de sodio que se genera en la preñez y vuelve los valores a cifras iguales o mayores a los niveles basales (no preñadas), del mismo modo se afecta la reabsorción de sodio por el bloqueo del SRA con enalapril. En cambio el ON, conocida sustancia natriurética, al ser bloqueada durante la preñez produce una mayor reabsorción de sodio que se acentúa al sumarse el bloqueo del SKK.
La interrelación entre kininas y PGs está mediada por la activación de la fosfolipasa A213; ambas se encuentran disminuidas en la hipertensión inducida por el embarazo14. Sin embargo, la inhibición de las PGs no necesariamente se traduce en una caída de las kininas sino que, tal vez, como un mecanismo de retroalimentación se estimula el SKK para tratar de aumentar la enzima fosfolipasa A2 y compensar la inhibición.
Se sabe que el efecto vasodilatador de las kininas también está mediado parcialmente por ON dado que ellas activan la enzima óxido nítrico sintasa15. Algunos estudios han demostrado que la administración de L-NAME bloquea parcial o completamente la respuesta del filtrado glomerular y flujo plasmático renal a la infusión de aminoácidos, sugiriendo que el ON es un modulador final de la acción de las kininas sobre el glomérulo16. La administración crónica de inhibidores de la ONS a ratas grávidas causa hipertensión, disminución del volumen plasmático, retardo del crecimiento, proteinuria y trombocitopenia, anormalidades semejantes a las encontradas en la preeclampsia17-18. Nosotros, al estudiar la interacción entre el SKK y el ON encontramos un descenso en la actividad de KU. Los niveles de aldosterona también se encontraron disminuidos detectándose también un leve descenso en el pico de hiperfiltración glomerular. De igual forma Salas y col.19 encontraron que la administración de inhibidores de la ONS durante la preñez producía una disminución de la actividad de KU y de la actividad de renina plasmática, encontrando lesión glomerular y atrofia tubular, particularmente en el túbulo conector, zona en la cual se produce la síntesis de kallicreína. La bradikinina, efector final del SKK, es un potente estímulo de la ONS endotelial y la producción de ON a través de mecanismos mediados por calcio, encontrando en la bibliografía que el efecto del factor de crecimiento de endotelio vascular (VEGF), fundamental para la placentación, aumenta por bradikinina20, 21. Nosotros, al asociar inhibidores del SKK y de ONS observamos un mayor descenso en la actividad de kallicreína durante los tres períodos estudiados y aumento de la presión arterial sistólica. Se encontró un efecto aditivo sobre la reducción del pico de hiperfiltración glomerular y alteraciones de mayor severidad en el número y características de las crías. En este grupo, los niveles de aldosterona se encontraron elevados con valores máximos en la reabsorción de sodio al final de la gestación. Los hallazgos histopatológicos mostraron riñones con parámetros de necrosis tubular aguda isquémica. Nosotros concluimos que la isquemia producida por el tratamiento combinado de inhibidores del SKK y ON podría afectar el flujo de la unidad útero placentario que daría como consecuencia las mayores alteraciones vistas en el desarrollo de las crías. Por lo tanto, pensamos que la interrelación del SKK y ON podría estar involucrada en los procesos angiogénicos indispensables para una buena placentación y desarrollo de la unidad feto placentaria.
Existen también varios niveles de interacción entre SRA y SKK. Se ha encontrado que la kallicreína urinaria en humanos activa la pro-renina plasmática22, y que la de rata libera renina activa de células corticales renales23. Además, la enzima convertidora de angiotensina, que convierte la ANG I en ANG II, es la misma kininasa II, enzima que degrada las kininas a productos inactivos24. Otro nivel de interacción es entre aldosterona y kallicreína, dado que en pacientes con aldosteronismo primario, secundario o con dietas con bajo contenido en sodio y alto en potasio, muestran un aumento en los niveles de kallicreína. También se sabe que la kallicreína es sintetizada en el túbulo conector cortical en la zona sensible a la aldosterona25. Además, como ya se describió, la actividad de renina, tanto inactiva como activa, angiotensinógeno, Ang II y aldosterona, están aumentados en el embarazo normal. Baylis y col.26 encontraron que la saralasina, antagonista de la angiotensina II, no afectaba el FG y FPR y que el captopril, bloqueante de la conversión de Ang I en Ang II, administrada a ratas en el día 20 de preñez, disminuía la vasoconstricción renal pero no restauraba los valores de flujo a los niveles observados durante la gestación media. En cambio nosotros, estudiando el efecto de la administración de dos tipos de inhibidores del SRA, enalapril y losartán, durante el pico de hiperfiltración de la preñez, encontramos una disminución del 30% del FG. Al asociar inhibidores del SKK y SRA se observó la mayor disminución en el filtrado glomerular, menor número de crías y mayor porcentaje de reabsorciones intrauterinas.
Nuestros resultados muestran que la interrelación del SKK con varios sistemas vasoactivos formaría una red que participaría en las adaptaciones hemodinámicas de la madre, siendo fundamental la integridad del sistema para un adecuado desarrollo de la gestación y de la unidad feto placentaria.
Agradecimientos: Este trabajo ha sido realizado con subsidios y becas de la Universidad de Buenos Aires y el CONICET.
Conflictos de interés: No existen conflictos de interés financieros o personales en el presente trabajo.
1. Bernheim J, Shapira J, David F, Behari C, Gelerntner I, Rathaus M. Renal prostaglandins E2 and F2a throughout normal human pregnancy. Eur Jour Clin Invest 1986; 16: 113-6. [ Links ]
2 . Conrad K P, Dunn M. Renal synthesis and urinary excretion of eicosanoids during pregnancy in rats. Am J Physiol 1987; 253 (6 Pt 2): F1197-205. [ Links ]
3. Fernandez LA, Twickler J, Mead A. Neovascularization produced by angiotensin II. J Lab Clin Med 1985; 105: 141. [ Links ]
4. Danielson LA, Conrad KP. Acute blockade of nitric oxide synthase inhibits renal vasodilation and hyperfiltration during pregnancy in chronically instrumented conscious rats. J Clin Invest 1995; 96: 482-90. [ Links ]
5. Martin R, Alcira Nesse, Arrizurieta de Muchnik E. Urinary kallikrein excretion, renal kallikrein content and renal plasma flow in the rat. Medicina (B Aires) 1979; 39: 467-71. [ Links ]
6. Kovatz S, Arber I, Korzets Z, et al: Urinary kallikrein in normal pregnancy, pregnancy with hypertension, and toxemia. Nephron 1985; 40: 48-51. [ Links ]
7. Salas S, Roblero JS, Croxatto HR, Valdes G. Urinary kallikrein activity during rat pregnancy. Arch Biol Med Exp 1987; 20: 305-9. [ Links ]
8. Zoja C, Benigni A, Verroust P, Ronco P, Bertani T, Remuzzi G. Indomethacin reduce proteinuria in passive Heymann nephritis in rats. Kidney Int 1987; 31: 1335-43. [ Links ]
9. Hutchison F, Webster SK, Jaffa AA. Altered renal kallikrein and renin gene expression in nephritic rats and modulation by converting enzyme inhibition. J Clin Invest 1993; 92: 1073-9. [ Links ]
10. Imamura A, Mackenzie HS, Ploth DW. Effect of chronic administration of losartan on renal function and development of hypertension in 2-kidney, 1 clip hypertensive rats. Clin Res 1992; 40: 315. [ Links ]
11. Takemoto M, Egashira K, Usui M, et al. Important role of tissue angiotensin converting enzyme activity in the pathogenesis of coronary vascular and myocardial structural changes induced by long-term blockade of nitric oxide synthesis in rats. J Clin Invest 1997; 99: 278-87. [ Links ]
12. Oddo EM, Negri AL, Santos RS, Martín RS, Arrizurieta E. Chronic indomethacin administration and relation with the renal Kallikrein Kinin System during rat pregnancy. Medicina (B Aires) 1993; 53: 326-32. [ Links ]
13. McGiff JC: Interactions of prostaglandins with the kallikrein-kinin and renin-angiotensin systems. Clin Sci 1980; 59: 105s-16s. [ Links ]
14. Minuz P, Covi G, Paluani F, et al. Altered excretion of prostaglandin and thromboxane metabolites in pregnancy induced hypertension. Hypertension 1988; 11: 550-6. [ Links ]
15. Lahera V, Salom MG, Fiksen-Olsen MJ, Romero JC. Mediatory role of endothelium-derived nitric oxide in renal vasodilatory and excretory effects of bradykinin. Am J Hypertension 1991; 260-2. [ Links ]
16. Tolins JP, Raij L. Effects of amino acid infusion on renal hemodynamics: Rol of endothelium-derived relaxing factor. Hypertension 1991; 17: 1045-51. [ Links ]
17. Baylis C, Mitruka B, Deng A. Chronic blockade of nitric oxide synthesis in the rat produces systemic hypertension and glomerular damage. J Clin Invest 1992; 90: 278-81. [ Links ]
18. Yallampalli C, Garfield RE. Inhibition of nitric oxide synthesis in rats during pregnancy produces signs similar to those of preeclampsia. Am J Obstet Gynecol 1993; 169:1316-20. [ Links ]
19. Salas SP, Vuletin JF, Giacaman A, Rosso P, Vio CP. Long-term nitric oxide synthase inhibition in rat pregnancy reduces renal kallikrein. Hipertension 1999, 34: 865-71. [ Links ]
20. Miura S, Matsuo Y, Saku K. Transactivation of KDR/Flk-1 by the B2 receptor induces tube formation in human coronary endotelial cells. Hipertension 2003; 41: 1118-23. [ Links ]
21. Thuringer D, Maulon L, Frelin C. Rapid transactivation of the vascular endothelial growth factor receptor KDR/Flk-1 by the bradykinin B2 receptor contributes to endothelial nitric-oxide synthase activation in cardiac capillary endothelial cells. J Biol Chem 2002; 277: 2028-32. [ Links ]
22. Sealey JE, Atlas SA, Larga JH, Oza NB, Ryan JW. Human urinary kallikrein converts inactive to active renin and is a possible physiological activator of renin. Nature 1978; 275: 144-5. [ Links ]
23. Paller MS. Mechanism of decreased pressor responsiveness to Ang II, NE and Vasopressin in pregnant rats. Am J Physiol 1984; 247 (Heart Cir Physiol 16): H100-8. [ Links ]
24. Suzuki S, Franco-Saenz R, Tan SY, Mulrow PJ. Direct action of rat urinary kallikrein in rat kidney to release renin. J Clin Invest 1980; 66: 757-62. [ Links ]
25. Meneton P, Loffing J, Warnock DG. Sodium and potassium handling by the aldosterone-sensitive distal nephron: the pivotal role of the distal and connecting tubule. Am J Physiol Renal Physiol 2004; 287: F593-601. [ Links ]
26. Baylis C, Collins RC. Angiotensin HH inhibition on blood pressure and renal hemodynamics in pregnant rat. Am J Physiol 1986; 250: F308-14. [ Links ]
Recibido: 3-5-2011
Aceptado: 29-7-2011














