Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Medicina (Buenos Aires)
Print version ISSN 0025-7680
Medicina (B. Aires) vol.71 no.5 Ciudad Autónoma de Buenos Aires Oct. 2011
ARTÍCULO ORIGINAL
Nefropatía por contraste en el síndrome coronario agudo
Mariana Carnevalini, Mariano Giorgi, Silvina Waldman, Nicolás Caturla, Rodrigo Ovejero, Estela Falconi, Lucas San Miguel, Christian Caroli, Eduardo Magariños, Hernán Cohen Arazi
Departamento de Cardiología y Cirugía Cardiovascular, FLENI, Buenos Aires
Dirección postal: Dra. Mariana Carnevalini, FLENI, Montañeses 2325, 1428 Buenos Aires, Argentina
Fax: (54-11) 5777-3200 (2635) e-mail: mcarnevalini@gmail.com
Resumen
La nefropatía inducida por contraste (NIC) es una de las causas más frecuentes de insuficiencia renal en pacientes internados. En el síndrome coronario agudo (SCA), la presencia de NIC aumenta la morbimortalidad. Las medidas de profilaxis y los factores de riesgo intervinientes de NIC en SCA no han sido determinados con exactitud. El objetivo de este estudio fue evaluar la incidencia de NIC y los factores asociados a su desarrollo en pacientes ingresados en unidad coronaria con requerimiento de cinecoronariografía (CCG). Se realizó un estudio de cohorte retrospectivo. Se incluyeron pacientes consecutivos cursando SCA estudiados con CCG dentro de las 72 horas de su admisión. Se definió NIC al aumento del 25% del valor de creatinina a las 48 h sobre el nivel basal de ingreso. El período de inclusión fue entre el 1° de enero de 2004 hasta el 30 de junio de 2010. Se analizaron 125 casos. La incidencia de NIC fue del 10.4% (n = 13). En el análisis multivariado, los factores asociados independientemente a su desarrollo fueron la edad [OR 1.05 (IC 95% 1.004 - 1.11) p = 0.034], la angioplastia a múltiple vaso [OR 2.2 (IC 95% 1.07 - 4.8), p = 0.03] y el volumen de contraste utilizado [OR 1.007 (IC 95% 1.001 - 1.01), p = 0.014].
Palabras clave: Insuficiencia renal aguda; Nefropatía; Medios de contraste; Creatinina
Abstract
Contrast induced nephropathy in acute coronary syndrome. Contrast induced nephropathy (CIN) is one of the most frequent causes of acute renal failure in hospitalized patients. It is associated with an increase in morbidity and mortality in patients hospitalized for acute coronary syndrome (ACS) undergoing percutaneous coronary intervention (PCI). Risk factors and prevention strategies are not well defined. The aim of this study was to assess the incidence and clinical risk factors associated to the development of contrast induced nephropathy in patients hospitalized for ACS. In a retrospective cohort we analyzed consecutive patients hospitalized for ACS undergoing urgent PCI within 72 hours from the admission. CIN was defined as a 25% increase of creatinine levels from baseline at 48 hours from the PCI. The inclusion period was from January 1°, 2004 to June 30, 2010. A total of 125 patients were analyzed, and CIN occurred in 13 (10.4%) patients. An independent association was found between age (OR 1.05; 95% CI 1.004 to 1.11; p = 0.034), multiple vessel angioplasty (OR 2.2; 95% IC 1.07 to 4.8; p = 0.03) and the volume of contrast infused (OR 1.007; 95% CI 1.001 to 1.01; p = 0.014) with the development of CIN.
Key words: Acute kidney injury; Nephropathy; Constrast media; Creatinine
La nefropatía inducida por contraste (NIC) es una de las causas más frecuentes de insuficiencia renal en pacientes internados. La incidencia de NIC varía de acuerdo a la definición utilizada, oscilando entre un 7% al 15% en pacientes con enfermedad crónica que se estudian con cinecoronariografía (CCG) de manera programada1. Se trata de una entidad multicausal y los factores de riesgo asociados a su desarrollo no se han definido con exactitud2, 3.
Es una complicación que aumenta el riesgo de muerte y representa un factor de mal pronóstico a corto y largo plazo. Se encuentra asociada a prolongación de la estadía hospitalaria, aumento de la incidencia de infarto de miocardio, requerimiento de revascularización a un año y complicaciones vasculares1, 2, 4, 5.
Los pacientes con síndrome coronario agudo (SCA) (con o sin supradesnivel del ST) que requieren estudio de urgencia con CCG, comprenden una población de mayor riesgo para el desarrollo de NIC4, 5.
Se han evaluado distintas estrategias farmacológicas y no farmacológicas para prevenir la NIC con resultados controvertidos6-11. La mayoría de ellas fueron descriptas en pacientes con enfermedad coronaria crónica en quienes se realizaron procedimientos de manera programada, o estudios con contraste intravenoso o intraarterial con diferentes indicaciones clínicas7-9. Sin embargo, existe menos información en pacientes cursando un cuadro agudo que requieren la realización de CCG dentro de las primeras horas posteriores al ingreso.
El objetivo de este estudio fue evaluar la incidencia de NIC y los factores asociados a su desarrollo en pacientes internados en unidad coronaria con requerimiento de CCG durante las primeras 72 horas desde su ingreso.
Materiales y métodos
Se realizó un estudio de cohorte retrospectivo de pacientes admitidos a unidad coronaria con diagnóstico de síndrome coronario agudo (definido según las guías de práctica clínica vigentes de AHA/ACC)12, a los que se les realizó, según criterio médico, CCG durante las primeras 72 h de internación. Se incluyeron en el análisis los pacientes que presentaban datos de laboratorio basal (de ingreso) y dosaje de creatinina plasmática a las 48 h de realizada la CCG. El período evaluado fue entre el 1° de enero de 2004 y el 30 de junio de 2010 (período en el que se cuenta con los datos necesarios para incluir a los pacientes).
El criterio de utilización de las medidas de prevención de NIC fue de acuerdo a la decisión de los médicos intervinientes.
Se definió NIC al incremento en el valor de creatinina plasmática igual o mayor al 25% a las 48 h de la realización de la CCG respecto de la medición basal (obtenida al ingreso a Unidad Coronaria), en ausencia de otra etiología conocida1, 2, 13.
Se consideró tratamiento previo a la medicación que recibía el paciente en el momento anterior a la realización de la CCG.
Se definió el motivo de ingreso de acuerdo a lo asentado en la historia clínica utilizando la nomenclatura de las guías internacionales12, 14, 15.
Los valores de CK MB se consideraron elevados de acuerdo al valor de referencia del laboratorio local (> 25 mg/dl).
La función ventricular se valoró mediante la descripción ecocardiográfica, dividiéndose en normal, deterioro leve, moderado o severo, correspondiente a una fracción de eyección del ventrículo izquierdo (Fey VI) mayor a 55%, entre 45-54%, 30-44% y menor al 30%, respectivamente.
Las lesiones coronarias fueron consideradas severas cuando el tronco de la coronaria izquierda (TCI) presentaba obstrucción de la luz ≥ 50% o las coronarias nativas o by pass coronarios obstrucción ≥ al 70%16.
Para el estudio se registraron las características demográficas, antecedentes cardiovasculares y no cardiovasculares y medicación previa (Tabla 1). Se evaluó en el tiempo desde el ingreso hasta el momento del estudio angiográfico, el uso de medidas de profilaxis (n-acetil-cisteína/ hidratación parenteral, y el volumen y tipo de contraste utilizado (contraste iónico de alta osmolalidad, 1551 mOsmol/kg, o contraste no iónico de baja osmolalidad, 792 mOsmol/kg).
TABLA 1.Características de la población

IRC: insuficiencia renal crónica; IAM: infarto agudo de miocardio; CRM: cirugía de revascularización miocárdica; AAS: acido acetil-salicílico; IECA: inhibidor de la enzima convertidora de angiotensina; ARA II: antagonistas de receptor de angiotensina; FSVI: función sistólica ventricular izquierda. DS: Desvío estándar.
La identidad de los sujetos se preservó utilizando un código de tres números para cada caso.
Los datos se obtuvieron de una base de datos ad hoc. Las variables categóricas se expresan como valor absoluto y porcentajes y las continuas como media o mediana (según el tipo de distribución) y sus correspondientes desvíos estándar o rangos intercuartilos. Se compararon las características de los grupos con y sin NIC utilizando los test de chi cuadrado, de la t de Student_o U de Mann y Withney según correspondiera. El análisis de regresión se inició con un modelo de regresión simple para obtener los coeficientes crudos. Luego se seleccionaron las variables a incluir en un modelo múltiple con un criterio estricto debido al n pequeño; solo se incluyeron las variables que presentaran un valor de p < 0.06 en el análisis univariado. El modelo final se realizó en forma manual, y se consideró asociación estadísticamente significativa a las variables con p < 0.05 o que se comportaron como confundidores (se definió confundidor cuando la variación de la magnitud del coeficiente fue mayor al 20% en el modelo multivariable). Se utilizó el paquete informático STATA versión 9.0.
Resultados
Se seleccionaron 156 casos durante ese período. Se excluyeron 31 pacientes por no presentar el laboratorio control a las 48 h. Se incluyeron en el análisis los 125 casos que cumplían los criterios de inclusión. En la Tabla 1 se detallan las características de la población global. La edad promedio fue 64.9 ± 12 años, el 86% eran hombres, 3 pacientes (2.4%) presentaban insuficiencia renal crónica (IRC) definida por creatinina plasmática ≥ 2 mg/dl (media 2.2 ± 0.2 mg/dl), ninguno con requerimiento de diálisis. El valor de creatinina en los pacientes con SCA con insuficiencia cardíaca aguda (ICA) fue de 1.4 ± 0.28 mg/dl. En el 86% se había medido la troponina al ingreso (50% de ellas > 0.1 UI) y en 103 (82%) se disponía de resultados de CKMB (37% elevada según valores de referencia). El 27% mostraba deterioro significativo (moderado o grave) de la función sistólica del ventrículo izquierdo (FSVI).
La mediana y rango intercuartilo (RIC) de tiempo ingreso hasta la realización de la CCG fue 22 (4-48) h. En 81 pacientes (64.8%) se indicó la angiografía en el contexto de angina inestable y en 12 (9.6%) pacientes por ICA en contexto de SCA con evidencia de isquemia miocárdica por ECG o elevación enzimática. El resto de las indicaciones fueron: infarto agudo de miocardio (31 p, 24.8%) y en un paciente (0.8%) miocarditis (Tabla 2).
TABLA 2.Características relacionadas al procedimiento

N-AC: N-Acetilcisteina; CCG: Cinecoronariografía; VTG: Ventricu-lograma; TCI: Tronco de coronaria izquierda. RIC: Rango intercuartilo.
El 47% recibió n-acetilcisteína previo al estudio, con una dosis de 1200 (RIC 25-75%: 600-1200) mg y el 69% hidratación endovenosa previa al procedimiento, con solución de ClNa 0.9%, mediana 1000 (500 - 2000) ml. Se utilizó contraste iónico en el 83.2% de los casos con una media ±DS de 287 ml ± 117.4. El 73% recibió NAC post procedimiento (dosis promedio 1200 mg) pero solamente el 36% tuvo hidratación endovenosa durante 48 h luego de la angiografía.
La CCG reveló lesión grave de un vaso coronario en 33 pacientes (26.4%), de dos vasos en 36 (28.8%), de tres vasos en 18 (14.4%) y de cuatro vasos en seis (4.8%). Treinta y dos pacientes (25.6%) no presentaron lesiones coronarias graves. Se realizó angioplastia coronaria transluminal percutánea (PTCA) a un vaso en 58 pacientes (46.4%), a dos vasos en 18 pacientes (14.4%) y a tres vasos en dos pacientes (1.6%) durante el mismo procedimiento. En 47 pacientes (37.6%) no se realizó PTCA por decisión de los médicos tratantes.
Durante el estudio angiográfico se realizó ventriculograma (VTG) a 100 pacientes (80%), aortograma a nueve (7.2%) y angiografía de arterias renales a nueve (7.2%).
La incidencia de NIC fue del 10.4% (n = 13). Los pacientes que desarrollaron NIC eran en su mayoría hombres (108 ptes (86%)), con edad promedio de 71 ± 8.6 años, significativamente mayores que los que no presentaron NIC (p = 0.02) (Tabla 3). No se encontraron diferencias en cuanto a los factores de riesgo y antecedentes cardiovasculares (Tabla 3). Tampoco hubo diferencias respecto del tratamiento previo ni del laboratorio de ingreso. (Tabla 3). Dos de los pacientes que ingresaron por SCA con insuficiencia cardíaca y seis de los 33 pacientes con deterioro significativo de la FSVI presentaron NIC.
TABLA 3.Características de ambos grupos

NIC: nefropatía por contraste; IRC: insuficiencia renal crónica; IAM: infarto agudo de miocardio; CRM: cirugía de revascularización miocárdica; AAS: ácido acetilsalicílico; IECA: inhibidor de la enzima convertidore de angiotensina; ARA II: antagonistas de receptor de angiotensina II; Hto: hematocrito; N-AC: n-acetilcisteína; CCG: cinecoronariografía; VTG: ventriculograma; FSVI: función sistólica ventricular izquierda.
El tiempo promedio desde el ingreso hasta la realización de la CCG fue similar entre los que desarrollaron NIC (23 (5-142) horas) y los que no tuvieron NIC (22 (3-48) horas), p = 0.54.
La hidratación previa a la CCG se realizó con 1000 ml de ClNa al 0.9% (500-2000 ml) en los que evolucionaron con NIC vs. 1250 (500-1750) ml entre los que no tuvieron NIC, p = 0.93.
Tampoco se observaron diferencias en la dosis de NAC luego de la infusión de contraste en los pacientes con y sin NIC (1200 (900-1200) mg vs. 1800 (1200-2400) mg, respectivamente, p = 0.08).
En el grupo que desarrolló NIC se realizó más frecuentemente PTCA a múltiples vasos (p = 0.009) y recibió un mayor volumen de contraste iónico (380 ± 78 ml vs. 277 ± 116 ml respectivamente; p 0.0036) (Tabla 3).
Las variables que se asociaron significativamente al desarrollo de CIN fueron: edad (OR 1.05 (1.004-1.11), p = 0.034), la realización de PTCA a múltiples vasos (OR 2.2 (1.07 - 4.8), p = 0.03) y el volumen de contraste iónico utilizado (OR 1.007 (1.001 - 1.01), p = 0.014 (Tabla 4). El tiempo a la realización de la CCG se asoció al riesgo de NIC como variable contínua (OR 1.008 (1-1.01), p = 0.05); analizado en cuartilos el grupo de pacientes del cuartilo superior (CCG ≥ 48 h desde el ingreso) no mostró menor riesgo de desarrollar NIC (OR 0.999 (0.99 - 1.03), p = 0.056).
TABLA 4.Análisis univariado

IC: insuficiencia cardíaca; I/E: ingreso/estudio; IECA: inhibidor de la enzima convertidore de angiotensina; ARA II: antagonistas de receptor de angiotensina II; Hto: hematocrito; N-AC: n-acetilcisteíina; VTG: ventriculograma.
Por curva ROC se determinó que el mejor punto de corte del volumen de contraste que se asoció a NIC fue > 400 ml para el contraste iónico (S 60%, E 72%) y 300 ml para el contraste no iónico (S 50%, E 60%). La utilización de altas dosis de contraste aumentó el riesgo de NIC con RR 3.8 (1.02 - 11.1), p = 0.035).
A pesar del bajo número de pacientes, se intentó evaluar cuáles fueron las variables independientemente asociadas a NIC mediante un modelo de regresión logística multivariable.
Se observó que la edad (OR 1.13 (1.03 - 1.24), p = 0.01), la dosis elevada de contraste (OR 8.5 (1.25 - 58), p = 0.028) y la PTCA a múltiples vasos durante el mismo procedimiento (OR 3.6 (1 - 13.2), p = 0.05) se asociaron independientemente a NIC (Tabla 5). La utilización de NAC antes de la CCG no se asoció a menor incidencia de NIC (OR 0.37 (0.001 - 1.1), p = 0.06).
TABLA 5.Análisis multivariado
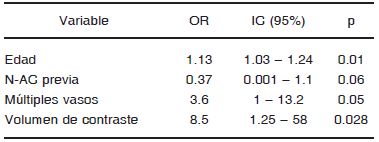
N-AC: n-acetilcisteina
Discusión
En el síndrome coronario agudo, insuficiencia cardíaca y shock cardiogénico el riesgo de NIC es elevado, con una incidencia que alcanza el 28%, aun en pacientes sin disfunción renal previa2-5. En este grupo de pacientes el requerimiento de hemodiálisis oscila entre 1.8 a 5.5%6.
En nuestro estudio, de un total de 125 pacientes internados por SCA con o sin ICA, estudiados con CCG, la incidencia de NIC fue de 10,4%, ninguno de ellos con requerimiento de diálisis. Si bien la población en estudio y las dosis de contraste son similares a la descriptas en estudios previos de pacientes con SCA, el hallazgo de una menor incidencia de NIC se deba probablemente a que se trató de pacientes con menos comorbilidades (menor prevalencia de diabetes y de insuficiencia renal previa) y con cuadros clínicos de menor gravedad4-6, 17.
La fisiopatología del desarrollo de NIC es multifactorial. Se encontraría relacionada no sólo al daño nefrotóxico directo del contraste y la generación de radicales libres de oxigeno e isquemia medular sino también al estado de inestabilidad hemodinámica del paciente con SCA, a la disfunción miocárdica, a mediadores inflamatorios, a la presencia de complicaciones hemorrágicas y a efectos secundarios de fármacos que alteran los mecanismos de autorregulación renal5, 7, 10.
Se han descripto como factores de riesgo asociados a NIC a la edad avanzada, diabetes (DBT), la presencia de anemia, las alteraciones hemodinámicas secundarias al procedimiento, insuficiencia renal previa, el volumen de contraste utilizado y la insuficiencia cardíaca17-20. En nuestro estudio, los factores asociados de manera independiente al desarrollo de NIC fueron la edad, el número de vasos tratados y el volumen de contraste utilizado, muy relacionados entre sí.
Las estrategias evaluadas para prevenir el desarrollo de NIC incluyen la utilización de N-acetilcisteína, bicarbonato de sodio, hidratación con solución salina isotónica, dopamina y el control sobre el volumen de contraste utilizado1 6, 8, 10, 17, 21.
Las bases de la acción nefroprotectora de la NAC no son completamente conocidas pero se postula que disminuye el fallo renal debido a su acción vasodilatadora por aumento de la expresión de óxido nítrico sintetasa y a que actúa como agente neutralizante de radicales libres 5, 7, 10, 22-26.
En el año 2000, el trabajo de Tepel y col. mostró una reducción significativa en la incidencia de nefropatía por contraste en pacientes de alto riesgo renal sometidos a tomografía axial con contraste endovenoso tratados con NAC27. Desde ese momento se han publicado numerosos estudios controlados y al azar, algunos de los cuales mostraron resultados favorables con NAC6, 7, 19 pero otros no lograron confirmarlos9, 28, 29. Las diferencias en el material de contraste, en la definición de NIC, las diferencias poblacionales, co-intervenciones, dosis de NAC y vías de administración, así como las características del procedimiento (electivo/urgencia) contribuyen a la heterogeneidad de los datos 30-41.
En nuestro estudio, el volumen de contraste se asoció de manera significativa al desarrollo de NIC. El tipo de contraste utilizado también ha sido evaluado por su posible asociación con NIC. Los materiales de contraste se clasifican en agentes iónicos de alta osmolalidad (1500-1800 mosm/kg) y los no iónicos de baja osmolalidad (600-850 mosm/kg, iohexol)42, 43. Estos últimos han demostrado marcados beneficios respecto a los primeros en pacientes con insuficiencia renal moderada (creatinina entre 1.4 - 2.4 mg/dl) y diabetes, pero no así en el grupo de muy bajo riesgo44.
De todas maneras, estos agentes de baja osmolalidad son hiperosmolales respecto al plasma45. La diuresis osmótica inducida por los medios de baja osmolalidad puede aumentar el aporte distal de sodio, incrementando el trabajo a nivel medular e induciendo hipoxia, o puede generar depleción de volumen, con la consecuente activación de hormonas vasorreguladoras que alteren la hemodinamia renal, especialmente si estos mecanismos vasorreguladores están alterados basalmente (DBT o IRC, por ejemplo)10, 46-48.
En nuestro estudio, la angioplastia a múltiple vaso se asoció al desarrollo de NIC. Esto podría corresponder a la mayor duración del estudio generando vasoconstricción renal prolongada e hipoxia celular secundaria al contraste, que en el contexto clínico de inestabilidad hemodinámica potenciaría el desarrollo de NIC. Por otra parte, en estos pacientes la enfermedad de múltiple vaso podría implicar la presencia de enfermedad macro y microvascular a nivel renal, generando mayor vulnerabilidad a los medios de contraste.
El tratamiento actual del SCA implica, cuando el caso lo requiere, la realización de CCG precoz 49, 50. En estos casos el tiempo al estudio con CCG no puede predeterminarse y esto constituye una limitante para la administración de medidas preventivas. Actualmente, la mejor estrategia para prevenir NIC continúa siendo una adecuada hidratación51, preferentemente con solución salina por vía intravenosa a 1 ml/kg/hora durante 3-12 horas antes del procedimiento, y continuando por 6-24 horas en los pacientes con riesgo47. Sin embargo, en algunos pacientes con SCA su estado de inestabilidad cardiovascular no permite la administración de hidratación EV en las dosis descriptas, y es en estos pacientes en quienes el control sobre el volumen de contraste administrado continúa siendo una de las estrategias recomendadas28.
Limitaciones
La principal limitación del estudio es que se trata de un análisis retrospectivo. Debe considerarse la realización de estudios de mayores dimensiones, especialmente en SCA, para evaluar la utilidad de medidas de profilaxis de bajo costo y favorable perfil de riesgo como NAC.
Conflictos de interés: los autores no presentan conflictos de interés con respecto al presente estudio.
1. McCullough PA. Contrast-induced acute renal injury. J Am Coll Cardiol 2008; 51:1419-28. [ Links ]
2. Senoo T, Motohiro M, Kamihatam H, et al. Contrast-induced nephropathy in patients undergoing emergency percutaneous coronary intervention for acute coronary syndrome. Am J Cardiol 2010; 105: 624-8. [ Links ]
3. De Agustín JA, Carda R, Manzano M, et al. Creatinine clearance and contrast nephropathy in patients with normal creatinine levels. Rev Esp Cardiol 2007; 60: 772-6. [ Links ]
4. Marenzi G, Lauri G, Assanelli E, et al. Contrast induced nephropathy in patients undergoing primary angioplasty for acute myocardial infarction. J Am Coll Cardiology 2004; 44: 1780-5. [ Links ]
5. Marenzi G, Assanelli E, Campodonico J, et al. Contrast volume during primary percutaneous coronary intervention and subsequent contrast induced nephropathy and mortality. Ann Intern Med 2009; 150: 170-7. [ Links ]
6. Recio-Mayoral A, Chaparro A, Prado B, et al. The reno-protective effect of hydration with sodium bicarbonate plus N-Acetylcysteine in patients undergoing emergency percutaneous coronary intervention. The Reno Study. J Am Coll Cardiol 2007; 49: 1283-8. [ Links ]
7. Jay K, Hing CW, Chan TM, et al. Acetylcysteine for prevention of acute deterioration of renal function following elective coronary angiography and intervention: a randomized controlled trial. JAMA 2003; 289: 553-8. [ Links ]
8. Maioli M, Toso A, Leoncini M, et al. Sodium bicarbonate versus saline for the prevention of contrast-induced nephropathy in patients with renal dysfunction undergoing coronary angiography or intervention. J Am Coll Cardiol 2008; 52: 599-604. [ Links ]
9. Goldenberg I, Shechterb M, Matetzkya S, et al. Oral acetylcysteine as an adjunct to saline hydration for the prevention of contrast-induced nephropathy following coronary angiography. A randomized controlled trial and review of the current literature. European Heart Journal 2004; 25: 212-8. [ Links ]
10. Barrett BJ, Parfrey PS. Preventing nephropathy induced by contrast medium. N Engl J Med 2006; 354: 379-86. [ Links ]
11. Toso A, Maioli M, Leoncini M. Usefulness of atorvastatin (80 mg) in prevention of contrast-induced nephropathy in patients with chronic renal disease. Am J Cardiol 2010; 105: 288-92. [ Links ]
12. Anderson JL, Adams CD, Antman EM, et al. ACC/AHA 2007 Guidelines for the management of patients with unstable angina/non-ST-elevation myocardial infarction. A report of the American College of Cardiology/American Heart Association Task Force on practice guidelines (writing committee to revise the 2002 guidelines for the management of patients with unstable angina/non-ST-elevation myocardial infarction). Circulation 2007; 116; e148-e304. [ Links ]
13. Solomon R, Deray G, on behalf of The Consensus Panel for CIN. How to prevent contrast-induced nephropathy and manage risk patients: Practical recommendations. Kidney International 2006; 69, S51-S53. [ Links ]
14. Antman EM, Anbe DT, Armstrong PW, et al. ACC/AHA guidelines for the management of patients with ST-elevation myocardial infarction: a report of the American College of Cardiology/American Heart Association Task Force on practice guidelines (committee to revise the 1999 guidelines for the management of patients with acute myocardial Infarction). Circulation 2004; 110; e82-e293. [ Links ]
15. Jessup M, Abraham WT, Casey DE, et al. Writing on behalf of the 2005 guideline update for the diagnosis and management of chronic heart failure in the adult writing committee. 2009 focused update ACC/AHA guidelines for the diagnosis and management of heart failure in adults. A report of the American College of Cardiology Foundation/American Heart Association Task Force on practice guidelines. Circulation 2009; 119; 1977-2016. [ Links ]
16. Eagle KA, Guyton RA, Davidoff R, et al. for the American College of Cardiology, American Heart Association Task Force on Practice Guidelines, American Society for Thoracic Surgery, the Society of Thoracic Surgeons. ACC/AHA 2004 guideline update for coronary artery bypass graft surgery: summary article: a report of the American College of Cardiology/ American Heart Association task force on practice guidelines (committee to update the 1999 guidelines for coronary artery bypass graft surgery). Circulation 2004; 110: 1168-76. [ Links ]
17. Bouzas-Mosquera A, Vázquez-Rodríguez JM, Calviño-Santos R, et al. Contrast-induced nephropathy and acute renal failure following urgent cardiac catheterization: incidence, risk factors, and prognosis. Rev Esp Cardiol 2007; 60: 1026-34. [ Links ]
18. Mehran R, Aymong E, Nikolsky E. A simple intervention. Development and initial validation. J Am Coll Cardiol 2004; 44: 1393-9, [ Links ]
19. Chen SL, Zhang J, Yei F, et al. Clinical outcomes of contrast-induced nephropathy in patients undergoing percutaneous coronary intervention: A prospective, multicenter, randomized study to analyze the effect of hydration and acetylcysteine. International Journal of Cardiology 2008; 126: 407-13. [ Links ]
20. Nicolsky E, Mehran R, Turcot D, et al. Impact of chronic kidney disease on prognosis of patients with diabetes mellitus treated with percutaneous coronary intervention. Am J Cardiol 2004; 94: 300-5. [ Links ]
21. Diez T, Bagilet D, Ramos M, Jolly H, et al. Estudio de dos métodos para evitar la nefropatía asociada a contraste radiológico. Medicina (B Aires) 1999; 59: 55-8. [ Links ]
22. DiMari J, Megyesi J, Udvarhelyi N, et al. N-acetyl cysteine ameliorates ischemic renal failure. Am J Physiol 1997; 272 (3 Pt 2): F292-8. [ Links ]
23. Hou SH, Bushinsky DA, Wish JB, Cohen JJ, Harrington JT. Hospital acquired renal insufficiency: a prospective study. Am J Med 1983; 74: 243-8. [ Links ]
24. Rudnick MR, Goldfarb S, Wexler L, et al. Nephrotoxicity of ionic and nonionic contrast media in 1196 patients: a randomized trial: the Iohexol Cooperative Study. Kidney Int 1995; 47: 254-61. [ Links ]
25. Rihal CS, Textor SC, Grill DE, et al. Incidence and prognostic importance of acute renal failure after percutaneous coronary intervention. Circulation 2002; 105: 2259-64. [ Links ]
26. Tepel M, Van der Giet M, Schwarzfeld C, et al. Prevention of radiographic-contrast-agent-induced reductions in renal function by acetylcysteine. N Engl J Med 2000; 20; 343: 180-4. [ Links ]
27. Briguori C, Airoldi F, D´Andrea D, et al. Renal Insufficiency following contrast media administration trial (REMEDIAL) A randomized comparison of 3 preventive strategies. Circulation 2007; 115: 1211-7. [ Links ]
28. Thiele H, Hildebrand L, Schirdewahn C, et al. Impact of high-dose N-Acetylcysteine versus placebo on contrast-induced nephropathy and myocardial reperfusion injury in unselected patients with ST-Segment elevation myocardial infarction undergoing primary percutaneous coronary intervention. The LIPSIA-N-ACC (prospective, single-blind, placebo-controlled, randomized Leipzig immediate percutaneouss coronary intervention acute myocardial infarction N-ACC) Trial. J Am Coll Cardiol 2010; 55: 2201-9. [ Links ]
29. Bagshaw SM, Ghali WA. Acetylcysteine for prevention of contrast-induced nephropathy after intravascular angiography: A systematic review and meta-analysis. BMC Medicine 2004; 2: 38. [ Links ]
30. Brown JR, Block CA, Malenka DJ, et al. Sodium bicarbonate plus N-acetylcysteine prophylaxis: a meta-analysis. JACC Cardiovasc Interv 2009; 2: 1116-24. [ Links ]
31. Gonzales DA, Norsworthy KJ, Kern SJ, et al. A meta-analysis of N-acetylcysteine in contrast-induced nephrotoxicity: unsupervised clustering to resolve heterogeneity. BMC Med 2007; 14: 5: 32. [ Links ]
32. Trivedi H, Daram S, Szabo A, et al. High-dose N-acetylcysteine for the prevention of contrast induced nephropathy. Am J Med 2009; 122: 874 e9-15. [ Links ]
33. Zagler A, Azadpour M, Mercado C, et al. N-acetylcysteine and contrast-induced nephropathy: a meta-analysis of 13 randomized trials. Am Heart J 2006; 151: 140-5. [ Links ]
34. Liu R, Nair D, Ix J, et al. N-acetylcysteine for the prevention of contrast-induced nephropathy. A systematic review and meta-analysis. J Gen Intern Med 2005 Feb; 20: 193-200. [ Links ]
35. Duong MH, MacKenzie TA, Malenka DJ. N-acetylcysteine prophylaxis significantly reduces the risk of radiocontrast-induced nephropathy: comprehensive meta-analysis. Catheter Cardiovasc Interv 2005; 64(4): 471-9. [ Links ]
36. Nallamothu BK, Shojania KG, Saint S, et al. Is acetylcysteine effective in preventing contrast-related nephropathy? A meta-analysis. Am J Med 2004; 117: 938-47. [ Links ]
37. Misra D, Leibowitz K, Gowda RM, et al. Role of N-acetylcysteine in prevention of contrast-induced nephropathy after cardiovascular procedures: a meta-analysis. Clin Cardiol 2004; 27: 607-10. [ Links ]
38. Pannu N, Manns B, Lee H, Tonelli M. Systematic review of the impact of N-acetylcysteine on contrast nephropathy. Kidney Int 2004; 65: 1366-74. [ Links ]
39. Kshirsagar AV, Poole C, Mottl A, et al. N-acetylcysteine for the prevention of radiocontrast induced nephropathy: a meta-analysis of prospective controlled trials. J Am Soc Nephrol 2004; 15: 761-9. [ Links ]
40. Isenbarger DW, Kent SM, O'Malley PG. Meta-analysis of randomized clinical trials on the usefulness of acetylcysteine for prevention of contrast nephropathy. Am J Cardiol 2003; 92: 1454-8. [ Links ]
41. Morcos SK. Contrast media-induced nephrotoxicity-questions and answers. Br J Radiol 1998; 71: 357-65. [ Links ]
42. Lindholt JS. Radiocontrast induced nephropathy. Eur J Vasc Endovasc Surg 2003; 25: 296-304. [ Links ]
43. Barrett BJ, Carlisle EJ. Metaanalysis of the relative nephrotoxicity of high- and low-osmolality iodinated contrast media. Radiology 1993; 188: 171. [ Links ]
44. McCullough PA, Bertrand ME, et al. A Meta-Analysis of the renal safety of isosmolar Iodixanol compared with low-osmolar contrast media. J Am Coll Cardiol 2006; 48: 692-9. [ Links ]
45. Solomon R, Dumouchel W. Contrast media and nephropathy: findings from systematic analysis and Food and Drug Administration reports of adverse effects. Invest Radiol 2006;41: 651-60. [ Links ]
46. Tumlin J, Stacul F, Adam A, et al. Pathophysiology of contrast-induced nephropathy. Am J Cardiol 2006; 98: 14K-20K. [ Links ]
47. Stacul F, Adam A, Becker CR, et al. Strategies to reduce the risk of contrast-induced nephropathy. Am J Cardiol 2006; 98: 59-77. [ Links ]
48. Maeder M, Klein M, Fehr T, et al. Contrast nephropathy: review focusing on prevention. J Am Coll Cardiol 2004; 44: 1763-71. [ Links ]
49. Neumann FJ, Kastrati A, Pogatsa-Murray G, et al. Evaluation of prolonged antithrombotic pretreatment ("cooling-off" strategy) before intervention in patients with unstable coronary syndromes: a randomized controlled trial. JAMA 2003; 290: 1593-9. [ Links ]
50. Mehta SR, Granger CB, Boden WE, et al. Early versus delayed invasive intervention in acute coronary syndromes. N Engl J Med 2009; 360: 2165-75. [ Links ]
51. Negri AL. Estudio de dos métodos para evitar la nefropatía asociada a contraste radiológico. Carta al comité de redacción. Medicina (B Aires)1999; 59: 776. [ Links ]
Recibido: 27-5-2011
Aceptado: 12-9-2011














