Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Medicina (Buenos Aires)
Print version ISSN 0025-7680
Medicina (B. Aires) vol.71 no.6 Ciudad Autónoma de Buenos Aires Nov./Dec. 2011
ARTÍCULO ORIGINAL
Linfomas plasmoblásticos del tracto gastrointestinal en pacientes con sida
Alejandro Avilés-Salas1,5, Roberto Herrera-Goepfert1, Diana Aguilar-León2, Myrna Candelaria-Hernández3, Erasmo Martínez-Cordero4, Marcelo Corti6
1Departamento de Patología, Instituto Nacional de Cancerología, México,
2Departamento de Patología, Instituto Nacional de Ciencias Médicas y Nutrición, México,
3Departamento de Hematología, Instituto Nacional de Cancerología, México,
4Instituto Nacional de Enfermedades Respiratorias, México,
5Facultad de Medicina, Universidad Nacional Autónoma de México,
6Hospital de Enfermedades Infecciosas Francisco Javier Muñiz, Buenos Aires, Argentina
Dirección postal: Dr. Alejandro Avilés Salas, Departamento de Patología, Instituto Nacional de Cancerología, Av. San Fernando 22, Sección XVI, Tlalpan. CP 14080, México, D.F.
Fax: (52-55) 56 28 04 21 e-mail: alejandroaviles2001@yahoo.com
Resumen
Los pacientes con infección por el virus de inmunodeficiencia humana (HIV) tienen 200 veces más riesgo de desarrollar un linfoma no Hodgkin (LNH) con respecto a la población general. El linfoma plasmoblástico (LP) representa menos del 3% de todos los LNH asociados con el HIV. El objetivo de este estudio es informar las características clínico-patológicas de 5 pacientes con enfermedad HIV/sida y LP del tracto gastrointestinal. Se revisaron de forma retrospectiva los casos de LP del tracto gastrointestinal diagnosticados en el Instituto Nacional de Cancerología de la Ciudad de México en el periodo comprendido entre los años 2000 al 2009. Se analizaron las características clínico-patológicas y se realizaron cortes de bloques de tejidos embebidos en parafina para reacciones de inmunohistoquímica. La presencia del virus de Epstein Barr (VEB) se examinó por reacción en cadena de la polimerasa (PCR) in situ. De los cinco pacientes, cuatro fueron hombres y una mujer, con una mediana de edad de 29 años. Tres tumores se localizaron en la región anorrectal, uno en colon ascendente y el restante en el estómago. Histológicamente, todos los tumores se caracterizaron por una proliferación difusa de células grandes de aspecto plasmoblástico. Las células neoplásicas fueron CD 138/MUM-1 positivas y CD 20 / PAX-5 negativas. En cuatro pacientes se detectó el genoma del VEB en las células neoplásicas mediante PCR in situ. La mediana de seguimiento fue 18 meses; tres pacientes estaban vivos con enfermedad y dos sobreviven sin evidencias de la neoplasia. El diagnóstico precoz de LP como una entidad clínico-patológica es importante para establecer el tratamiento correcto y mejorar el pronóstico de estos pacientes.
Palabras clave: Linfoma plasmoblástico; HIV; Tracto gastrointestinal; VEB
Abstract
Plasmablastic lymphoma of the gastrointestinal tract in AIDS patients. The risk of developing non-Hodgkin lymphoma (NHL) is 200 times higher in HIV-positive patients than otherwise healthy persons. Plasmablastic lymphoma (PL) represents < 3% of all NHL associated with HIV infection. The aim of this study was to review the clinical-pathologic features of PL of the gastrointestinal tract in 5 patients with HIV/aids disease. We performed a retrospective study of PL of the gastrointestinal tract diagnosed at the National Institute of Cancer at Mexico City, from 2000 to 2009. Clinical and pathological information was obtained and immunohistochemical studies were performed in paraffin-embedded tissue sections. The presence of Epstein-Barr Virus (EBV) was examined by in situ polymerase chain reaction (PCR). Four male and 1 female were included with a median of age of 29 years. Three tumors involved the ano-rectal area, one tumor the ascendant colon and one tumor the stomach. All tumors were histologically characterized by a monotonous proliferation of large lymphoid cell with plasmablastic features. Tumor cells were CD 138 / MUM-1positive and CD 20 / PAX-5 negative in all cases. EVB genome was detected by in situ PCR in 4 cases. The median of follow-up was 18 months, and revealed that three patients are alive with neoplasm disease and two patients are still alive with no evidence of the neoplasm. Recognition of this entity by pathologists and clinicians is important in order to establish the correct diagnosis and the early treatment of these patients.
Key words: Plasmablastic lymphoma; HIV; Gastrointestinal tract; Epstein-Barr virus
Los linfomas afectan entre el 5% y el 10% de los pacientes infectados por el virus de la inmunodeficiencia humana (HIV), siendo la segunda neoplasia en frecuencia en esta población, después del sarcoma de Kaposi (SK). El riesgo de desarrollar un linfoma no Hodgkin (LNH) es 200 veces mayor en pacientes HIV positivos en comparación con la población general1. Los linfomas observados son predominantemente de estirpe B, incluyendo: linfoma difuso de células grandes (LDCG), linfoma de Burkitt (LB), linfoma primario de serosas (LPS) y linfoma plasmoblástico (LP)2.
El virus de Epstein Barr (VEB) se ha relacionado con la patogenia del LDCG y del LP3; por otro lado, el virus herpes tipo 8 asociado a sarcoma de Kaposi (VHSK) se ha asociado con el desarrollo del SK, del LPS, del LP y de la enfermedad de Castleman difusa de células plasmáticas (ECDCP)4, 5.
El LP representa aproximadamente el 2.6% de todos los LNH asociados con la infección por HIV 6 y tiene una fuerte predilección por la cavidad oral; sin embargo, también se han diagnosticado casos en otras localizaciones incluyendo: estómago, pulmón, ganglios linfáticos, región anorrectal y senos paranasales7-13. El objetivo de este estudio es describir las características clínico-patológicas de 5 pacientes con enfermedad HIV/sida y LP del tracto gastrointestinal.
Materiales y métodos
Se realizó un estudio retrospectivo, descriptivo y observacional. Se revisó el archivo de patología quirúrgica del Instituto Nacional de Cancerología de México en el período comprendido de enero del 2000 a diciembre del 2009. Se incluyeron aquellos casos que contaron con material para el diagnóstico histopatológico: laminillas teñidas con técnica de hematoxilina-eosina (HE) y bloques de parafina, además de la información clínica. Los linfomas se diagnosticaron de acuerdo a la última clasificación de la OMS14. Los pacientes se estadificaron en base a los criterios de Lugano. En todos ellos se determinó el nivel del recuento de linfocitos T CD4+ y los valores de la lacticodeshidrogenasa (LDH) al momento del diagnóstico de la neoplasia.
En todos los casos se seleccionó un bloque de tejido fijado en formol amortiguado al 10% y embebido en parafina. Se realizaron cortes de 2 μm y se colocaron en laminillas cargas. Todas las pruebas se corrieron en el equipo automatizado Benchmark ULTRA, utilizando anticuerpos contra: CD20 (L26; 1:300 Dako), CD3 (Policlonal; 1:80 Dako), CD56 (BC56C04; 1:50 Biocare), CD138 (MI15; 1:200 Dako), MUM-1(MUM-1p; 1:200 Dako), PAX-5 (Cell marque), kappa (A8B5; 1:500 Dako), lambda (N10/2; 1:2000 Dako) y LMP-1 (CS1-4; 1:50 Dako), con el sistema de detección ultraView Universal DAB.
La detección del genoma del VEB se efectuó utilizando la técnica de reacción en cadena de la polimerasa (PCR) in situ. En todos los casos se realizaron cortes de 2 μm y se colocaron en laminillas cargadas, posteriormente se desparafinaron por 18 horas a 65 °C, y de forma secuencial se hidrataron pasando por xileno, etanol absoluto, 75%, 50%, 25% y agua. Las células se permeabilizaron con HCl 0.02 M y se incubaron a temperatura ambiente por 10 min. Las proteínas fueron agotadas por la incubación con 1 mg/l proteinasa K (Gibco, Paisley, UK) durante 30 min a 37 °C. La proteinasa fue inactivada por ebullición en horno de microondas por 15 min, e inmediatamente se colocaron las laminillas en ácido acético al 20% por 15 s para inactivar la fosfatasa alcalina endógena. La PCR se realizó mediante incubación de las secciones con buffer de reacción 1X (GibcoBRL) 1.5 U de Taq polimerasa, 2 mmol/l de MgCl2 40 mmol/l, dNTPs, 0.2 mmol dUTP marcado con digoxigenina (Boehringer Mannheim Lewes UK) y 60 pg de cada uno de los iniciadores de secuencia de EBV. Las secuencias de los iniciadores utilizadas fueron 5´ TTGACGTCATGCCAAGGCA 3' sentido y 5´AGCAGTGGCCAGCTCATATG 3´ antisentido. Las laminillas se cerraron y se colocaron en el termociclador (Hybaid Ashford, UK). La amplificación comprendió desnaturalización a 95 °C por 1 min, alineamiento a 60 °C por 1 min y extensión a 72 °C por 1 min por 35 ciclos. Los productos de PCR se detectaron con anticuerpos contra digoxigenina conjugados a fosfatasa alcalina 1:500 (Boehringer Mannheim). El cromógeno fue 5-bromo-indol 4-cloro-3-3 indol toluidina fosfato y nitroazul de tetrazolio 1:50 (Boehringer Mannheim). Los cortes fueron contrastados con Fast Red para evitar cualquier interferencia con la señal azul generada por el ADN del VEB. Cada caso se corrió con su propio control negativo, además se incluyeron controles positivos y negativos.
Resultados
Se incluyeron en la evaluación cinco pacientes con diagnóstico de LP del tracto gastrointestinal, cuatro hombres y una mujer, con una mediana de edad al momento del diagnóstico de la neoplasia de 29 años (intervalo de 24 a 37 años). Todos los pacientes fueron HIV positivos; tres habían adquirido la infección a través de relaciones homosexuales no protegidas, uno por relaciones bisexuales y la restante a partir de relaciones heterosexuales. En tres pacientes el diagnóstico de infección por HIV se había realizado en un lapso de 12 meses previos al diagnóstico del linfoma. Solo un paciente había recibido terapia antirretroviral de gran actividad (TARGA) previa al diagnóstico de la neoplasia. La carga viral solo se determinó en tres pacientes con una mediana de 403 000 copias (rango 58 000 a 600 000 copias); la mediana de linfocitos T CD4+ al momento del diagnóstico del LP fue de 194 células/μl (rango 111 a 400 células/μl). Los síntomas referidos con mayor frecuencia estuvieron en relación con la localización del tumor e incluyeron: tumor anorrectal (3), proctorragia (2), aumento de perímetro abdominal (2), plenitud posprandial (1), náuseas (1), vómitos (1), pérdida de peso (1) y fiebre (1). Tres tumores se localizaron en la región anorrectal, uno en colon ascendente y uno más en estómago (Tabla 1). A todos los pacientes se les practicó hemograma completo, química sanguínea, tomografía axial computarizada (TAC) de cerebro, tórax, abdomen y pelvis y biopsia de médula ósea. El 60% de los pacientes tuvieron niveles de LDH por encima del valor de referencia, con una mediana de 242 UI/l (rango 132 a 428 UI/l). El 80% de los pacientes tuvieron cifras de β2mG por encima del valor de referencia, con una mediana de 4.1 mg/l (rango 2.5-6.7 mg/l). De acuerdo con los criterios de estadificación de Lugano, tres pacientes se encontraban en estadio IV, un paciente en estadio III y uno más en estadio II de la neoplasia. Respecto al tratamiento, a un paciente con tumor localizado en la región anorrectal se le practicó resección anterior baja y posteriormente quimioterapia con EPOCH (etopósido, doxorrubicina, vincristina, ciclofosfamida y prednisona); actualmente se encuentra vivo sin vestigios de enfermedad neoplásica luego de 28 meses de seguimiento. El resto de los pacientes recibieron como primera línea quimioterapia con CHOP (ciclofosfamida, doxorrubicina, vincristina y prednisona). En la paciente con el tumor localizado en colon ascendente se comprobó infiltración a sistema nervioso central, por lo cual se administró metotrexate (MTX) intratecal; así mismo, la PET-CT mostró actividad tumoral en abdomen, que se manejó con radioterapia con una dosis total de 36 Gy, encontrándose actualmente viva sin enfermedad neoplásica luego de 50 meses de seguimiento. La mediana de seguimiento de los pacientes fue de 18 meses (rango 2 a 50 meses). Al momento del estudio, el 60% de los pacientes se encontraban vivos con enfermedad neoplásica residual, y 40% se encontraban vivos sin vestigios de la neoplasia (Tabla 2).
TABLA 1.- Características demográficas y de laboratorio de pacientes con linfomas plasmoblásticos (LP) del tracto gastrointestinal

M: masculino; F: femenino; ND: no determinado; TARGA: Terapia antirretroviral de gran actividad
TABLA 2.- Características clínico-patológicas de pacientes con LP del tracto gastrointestinal
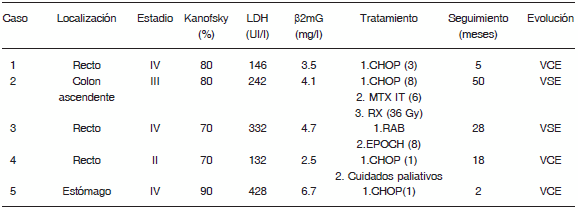
LDH: valor de referencia 119-213 UI/L; β2mG: valor de referencia 1.4-2.5 mg/lL; CHOP: ciclofosfamida, doxorrubicina, vincristina, prednisona; EPOCH: etopósido, doxorrubicina, vincristina, ciclofosfamida, prednisona; MTX IT: metotrexate intratecal; RX: radioterapia; RAB: resección anterior baja; VCE: vivo con enfermedad; VSE: vivo sin enfermedad.
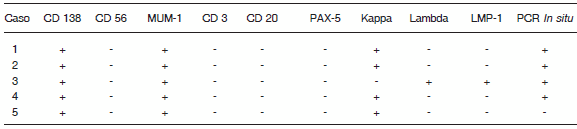
En el estudio histopatológico todas las muestras de biopsias mostraron una neoplasia maligna con crecimiento difuso que infiltraba y en ocasiones ulceraba la mucosa adyacente, con patrón en “cielo estrellado” (Fig. 1). En todos los casos las células neoplásicas eran grandes, de aspecto plasmoblástico (Fig. 2) y positivas para CD 138 (Fig. 3) y MUM-1, y negativas para CD 20 y PAX-5. El 80% de los casos mostró expresión de cadenas ligeras kappa y solamente uno resultó positivo para la proteína latente de membrana 1 (LMP-1). Los hallazgos de la inmunohistoquímica se resumen en la Tabla 3.
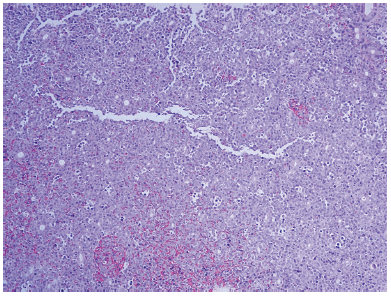
Fig. 1.- Neoplasia con patrón de crecimiento difuso, constituida por células grandes alternando con abundantes macrófagos con restos celulares en su citoplasma “patrón en cielo estrellado” (hematoxilina-eosina, 200X)

Fig. 2.- Las células neoplásicas son grandes, el núcleo es excéntrico, tienen nucléolo prominente y abundante citoplasma de aspecto plasmoblástico (hematoxilina-eosina, 200X)

Fig. 3.- Las células neoplásicas expresan intensamente CD 138 (técnica de inmunohistoquímica, 400X)
TABLA 3.- Resultado de la inmunohistoquímica y PCR in situ
Mediante técnica de PCR in situ se detectó el genoma del VEB en 80% de los casos, expresada a través de una reacción nuclear finamente granular en las células neoplásicas (Fig. 4).
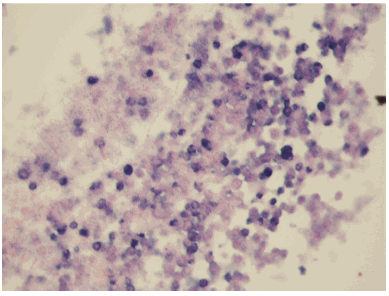
Fig. 4.- Los núcleos de las células neoplásicas son positivos (técnica de PCR in situ)
Discusión
A partir de 1981, con la emergencia del sida se ha observado una estrecha asociación entre la infección por HIV y el mayor riesgo de desarrollar diferentes neoplasias, las cuales incluyen: SK, LNH, neoplasia intraepitelial del canal anal y cáncer de cuello uterino15, 16.
En los últimos años, con la difusión del uso de la TARGA se ha registrado una reducción importante en la morbilidad y mortalidad por infecciones oportunistas relacionadas con el sida; sin embargo, no se ha observado un efecto importante en la incidencia de LNH1, 16.
Los virus juegan un papel importante en la patogénesis de los linfomas asociados al HIV, así como en alteraciones en c-myc, p53 y Bcl-617. La infección por el VEB es común en el LDCG, LB y LP18. Por otro lado, el VHSK se ha implicado en la patogénesis del LP, el LPS y la ECDCP19. Cofactores adicionales, tales como hormonas, predisposición genética y/o coinfección con otros agentes infecciosos al parecer son necesarios dentro del proceso patogénico de estas neoplasias.
Los pacientes con infección por HIV y LNH se presentan habitualmente con enfermedad avanzada y/o extraganglionar al momento del diagnóstico y síntomas B en aproximadamente 80% de los casos. En nuestra serie, el 80% de los pacientes se diagnosticaron en estadios avanzados; 3 en estadio IV y una en estadio III de la neoplasia. El sitio más común de compromiso extraganglionar es el tracto gastrointestinal20, particularmente el intestino delgado21, el estómago, el recto12 y el ano. Corti et al., informaron una serie de 48 casos de linfomas asociados con la enfermedad debida al HIV, de los cuales 14 correspondieron a LP; once fueron hombres y tres mujeres con una mediana de 37 años y enfermedad neoplásica avanzada. La mayoría de los casos fueron de cavidad oral y tres se localizaron en la región anal22. En la serie que se presenta, todos los pacientes excepto una fueron hombres jóvenes con estadios avanzados de la enfermedad neoplásica y el 60% de estos tumores se localizó en la región anorrectal.
Las células del LP se caracterizan por tener citoplasma basófilo, núcleo excéntrico y nucléolo central prominente. Tienen crecimiento cohesivo, son relativamente uniformes y con frecuencia muestran un patrón en “cielo estrellado”23. Colomo et al. describieron dos subgrupos de LP; el primero, con compromiso de la mucosa oral, constituido por una población monomorfa de inmunoblastos. La gran mayoría de los pacientes eran VIH+ / VEB+, aproximadamente la mitad se presentaron en la cavidad oral y sólo el 13% en ganglios linfáticos. El segundo subgrupo con diferenciación plasmocítica, compuesto por inmunoblastos, plasmoblastos pero con diferenciación a células plasmáticas maduras, sólo 33% de los pacientes fueron HIV+, el VEB fue detectado en 64% de los casos y 44% presentaron compromiso de ganglios linfáticos24. Por definición, estos tumores son CD 138, antígeno de membrana epitelial (EMA) e Ig citoplásmica positivos y CD 20 negativos. La detección de VEB por inmunohistoquímica utilizando LMP-1 es muy baja; por el contrario, al utilizar hibridación in situ con EBER el porcentaje aumenta hasta el 76%3, 8, 22, 24. En los casos estudiados sólo uno fue positivo por inmunohistoquímica para LMP-1; sin embargo, cuando se analizó la asociación del VEB utilizando la técnica de PCR in situ el 80% de los casos resultaron positivos, en forma similar a lo observado cuando se utiliza hibridación in situ con EBER.
El diagnóstico diferencial debe incluir al LDCG variante morfológica inmunoblástica, LPS, LB con diferenciación plasmocitoide y mieloma poco diferenciado18; sin embargo, es importante tener en cuenta otros diagnósticos como carcinoma poco diferenciado y melanoma3.
En general, los linfomas asociados con la infección por HIV tienen un comportamiento biológico agresivo y rápidamente fatal1, 3, 22, 25-27; sin embargo, el diagnóstico temprano y el tratamiento adecuado para ambas condiciones han mejorado significativamente el pronóstico de estos pacientes28. En forma similar a lo que ocurre con otros linfomas agresivos, los LP deben tratarse con esquemas de quimioterapia más TARGA. En los casos incluidos en esta serie, la terapia antirretroviral indicada por el Centro Nacional para la Prevención y Control del HIV/sida en México, incluye regímenes con Efavirenz 600 mg., 1 tableta cada 24 horas por la noche, más Truvada (emtricitabina 200 mg / tenofovir 300 mg) 1 tableta cada 24 horas, o como esquema alternativo Kaletra (lopinavir 200 mg / ritonavir 100 mg) 2 tabletas cada 12 horas, más Truvada (emtricitabina 200 mg / tenofovir 300 mg) 1 tableta cada 24 horas. Desafortunadamente, al momento del diagnóstico solo un paciente recibía TARGA, lo que representa un factor de mal pronóstico.
Por otro lado, aun cuando la gran mayoría de nuestros casos se trataron con CHOP, existen otros esquemas de quimioterapia utilizados en estos pacientes tales como: EPOCH, CODOX-M/IVAC (ciclofosfamida, vincristina, doxorrubicina, metotrexate, ifosfamida, etopósido y citarabina), ACVBP (doxorrubicina, ciclofosfamida, vindesina, bleomicina y prednisona) e hiper-CVAD (ciclofosfamida, metotrexate, citarabina, vincristina, doxorrubicina y dexametasona)27, 28. Con la finalidad de reducir la toxicidad hematológica se ha propuesto el esquema de EPOCH a dosis ajustada, utilizando: etopósido (50 mg/m2/día), doxorrubicina (10 mg/m2/día), vincristina (0.4 mg/m2/día) en infusión continua, y prednisona (60 mg/m2/día) vía oral; así como ciclofosfamida, ajustando la dosis en relación con el recuento de linfocitos T CD4+; con recuentos mayores de 100 células/μl la dosis es de 375 mg/m2/día y con menos de 100 células/μl la dosis se reduce a 187 mg/m2/día, el primer ciclo. Posteriormente, la dosis de ciclofosfamida se ajusta por arriba o por debajo de 187 mg/m2 en relación con el conteo absoluto de neutrófilos, con una dosis máxima de 750 mg/m2, 29.
Finalmente, factores que han sido asociados con mal pronóstico en esta población incluyen: edad > 35 años, recuentos de linfocitos CD4+ < 100 células/μl al momento del diagnóstico, pobre estado funcional, infiltración de la médula ósea, LDH sérica elevada, estadio III o IV y mala respuesta a la TARGA1, 13. En la práctica clínica, la identificación del LP como una entidad clínico-patológica es importante para el diagnóstico temprano y tratamiento correcto de estos pacientes; así como el desarrollo de estudios que incluyan un mayor número de pacientes para comprender mejor la patogénesis de esta neoplasia.
Conflictos de interés: Los autores no tienen conflictos de interés para declarar.
1. Cornejo-Juárez P, Volkow-Fernández P, Avilés-Salas A, Calderón-Flores E. AIDS and non-Hodgkin´s lymphoma. Experience at an oncological center in Mexico. Rev Invest Clin 2008; 60: 375-81. [ Links ]
2. Folk GS, Abbondanzo SL, Childers EL, Foss RD. Plasmablastic lymphoma: a clinicopathologic correlation. Ann Diagn Pathol 2006; 10: 8-12. [ Links ]
3. Rafaniello Raviele P, Pruneri G, Maiorano E. Plasmablastic lymphoma: a review. Oral Dis 2009; 15: 38-45. [ Links ]
4. Deloose ST, Smit LA, Pals FT, Kersten MJ, van Noesel CJ, Pals ST. High incidence of Kaposi sarcoma-associated herpesvirus infection in HIV-related solid immunoblastic/plasmablastic diffuse large B-cell lymphoma. Leukemia 2005; 19: 851-5. [ Links ]
5. Parravicini C, Chandran B, Corbellino M, et al. Differential viral protein expression in Kaposi´s sarcoma-associated herpesvirus-infected diseases. Kaposi´s sarcoma, primary effusion lymphoma, and multicentric Castleman´s disease. Am J Pathol 2000; 156: 743-9. [ Links ]
6. Carbone A. AIDS-relate non-Hodgkin´s lymphomas: from pathology and molecular pathogenesis to treatment. Hum Pathol 2002; 33: 392-404. [ Links ]
7. Borrero JJ, Pujol E, Pérez S, Merino D, Montano A, Rodríguez FJ. Plasmablastic lymphoma of the oral cavity and jaws. AIDS 2002; 16: 1979-80. [ Links ]
8. Delecluse HJ, Anagnostopoulos I, Dallenbach F, et al. Plasmablastic lymphomas of the oral cavity: a new entity associated with the human immunodeficiency virus infection. Blood 1997; 89: 1413-20. [ Links ]
9. Chetty R, Hlatswayo N, Muc R, Sabaratnam R, Gatter K. Plasmablastic lymphoma in HIV+ patients: an expanding spectrum. Histopathology 2003; 42: 605-9. [ Links ]
10. Pruneri G, Graziadei G, Ermellino L, Baldini L, Neri A, Buffa R. Plasmablastic lymphoma of the stomach. A case report. Haematologica 1998; 83: 87-9. [ Links ]
11. Lin Y, Rodrigues GD, Turner JF, Vasef MA. Plasmablastic lymphoma of the lung: report of a unique case and review of the literature. Arch Pathol Lab Med 2001; 125: 282-5. [ Links ]
12. Rajagopal AS, Copson E, Addis B, Shinkfield M, Mead G. Plasmablastic lymphoma: a case of rectal disease with spinal cord compression. Leuk & Lymphoma 2006; 47: 2670-3. [ Links ]
13. Lim JH, Lee MH, Lee MJ, et al. Plasmablastic lymphoma in the anal canal. Cancer Res Treat 2009; 41: 182-5. [ Links ]
14. World Health Organization. Classification of Tumours of Haematopoietic and Lymphoid Tissues. International Agency for Research on Cancer: Lyon 2008. [ Links ]
15. Cesarman E, Knowles DM. Kaposi´s sarcoma-associated herpesvirus: a lymphotropic human herpesvirus associated with Kaposi´s sarcoma, primary effusion lymphoma, and multicentric Castleman´s disease. Semin Diagn Pathol 1997; 14: 54-66. [ Links ]
16. Powles T, Matthews G, Bower M. AIDS related systemic non-Hodgkin´s lymphoma. Sex Transm Infect 2000; 76: 335-41. [ Links ]
17. Carbone A. Emerging pathways in the development of AIDS-related lymphomas. Lancet Oncol 2003; 4: 22-9. [ Links ]
18. Dong HY, Scadden DT, de Leval L, Tang Z, Isaacson PG, Harris NL. Plasmablastic lymphoma in VIH - positive patients: an aggressive Epstein-Barr virus - associated extramedullary plasmacytic neoplasm. Am J Surg Pathol 2005; 29: 1633-41. [ Links ]
19. Oksenhendler E, Boulanger E, Galicier L, et al. High incidence of Kaposi sarcoma-associated herpesvirus-related non-Hodgkin lymphoma in patients with HIV infection and multicentric Castleman disease. Blood 2002; 99: 2331-6. [ Links ]
20. Corti M, Villafañe Fioti MF, Lewi D, Schtirbu R, Narbaitz M, de Dios Soler M. Linfomas del tubo digestivo y glándulas anexas en pacientes con SIDA. Acta Gastroenterol Latinoam 2006; 36: 190-6. [ Links ]
21. Cha JM, Lee J, Joo KJ, et al. A case report with plasmablastic lymphoma of the jejunum. J Korean Med 2010; 25: 496-500. [ Links ]
22. Corti M, de Dios Soler M, Bare P, et al. Linfomas asociados con la infección por el virus de la inmunodeficiencia humana; subtipos histológicos y asociación con los virus de Epstein Barr y Herpes-8. Medicina (B Aires) 2010; 70: 151-8. [ Links ]
23. Gujral S, Shet TM, Kane SV. Morphological spectrum of AIDS-related plasmablastic lymphomas. Indian J Pathol Microbiol 2008; 51: 121-4. [ Links ]
24. Colomo L, Loong F, Rives S, et al. Diffuse large B-cell lymphomas with plasmablastic differentiation represent a heterogeneous group of disease entities. Am J Surg Pathol 2004; 28: 736-47. [ Links ]
25. Carbone A, Gloghini A, Vaccher E, et al. Kaposi´s sarcoma - associated herpesvirus/human herpesvirus type 8 - positive solid lymphomas: a tissue - based variant of primary effusion lymphoma. J Mol Diagn 2005; 7: 17-27. [ Links ]
26. Castillo J, Pantanowitz L, Dezube BJ. HIV-associated plasmablastic lymphoma: lessons learned from 112 published cases. Am J Hematol 2008; 83: 804-9. [ Links ]
27. Castillo J, Winer ES, Stachurski D, et al. Prognostic factors in chemotherapy-treated patients with HIV-associated plasmablastic lymphoma. Oncologist 2010; 15: 293-9. [ Links ]
28. Riedel DJ, Gonzalez-Cuyar LF, Zhao XF, Redfield RR, Gilliam BL. Plasmablastic lymphoma of the oral cavity: a rapidly progressive lymphoma associated with HIV infection. Lancet Infect Dis 2008; 8: 261-7. [ Links ]
29. Little RF, Pittaluga S, Grant N, et al. Highly effective treatment of acquired immunodeficiency syndrome-related lymphoma with dose-adjusted EPOCH: impact of antiretroviral therapy suspensión and tumor biology. Blood 2003; 101: 4653-9. [ Links ]
Recibido: 19-5-2011
Aceptado: 26-10-2011














