Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Medicina (Buenos Aires)
Print version ISSN 0025-7680
Medicina (B. Aires) vol.71 no.6 Ciudad Autónoma de Buenos Aires Nov./Dec. 2011
ARTÍCULO ESPECIAL
Aumento de los depósitos de hierro y su relación con la enfermedad cardiovascular
Tomás Meroño1, Patricia Sorroche2, Fernando D. Brites1
1Laboratorio de Lípidos y Lipoproteínas, Departamento de Bioquímica Clínica, INFIBIOC, Facultad de Farmacia y Bioquímica, Universidad de Buenos Aires, CONICET,
2Hospital Italiano de Buenos Aires
Dirección postal: Dr. Tomás Meroño, Departamento de Bioquímica Clínica, Facultad de Farmacia y Bioquímica, Universidad de Buenos Aires (UBA), Junín 956, 1113, Buenos Aires, Argentina
Fax: (54-11) 5950-8691 e-mail: tomasmero@yahoo.com.ar
Resumen
En los últimos años, se ha avanzado considerablemente en el control de varios de los denominados factores de riesgo aterogénico tradicionales, a pesar de lo cual la incidencia de la enfermedad cardiovascular (ECV) continúa siendo elevada. Entre las diversas condiciones asociadas a ECV, podría ubicarse también a la sobrecarga de hierro. Su estudio ha cobrado relevancia desde que se planteó la “hipótesis del hierro”, la cual postula que bajos niveles de hierro ejercerían un efecto protector del sistema cardiovascular. No obstante, hasta el presente, los resultados de los estudios diseñados para probar esta hipótesis han sido controversiales. Por otro lado, se lograron numerosos avances en el conocimiento del metabolismo del hierro a partir del descubrimiento de la hormona reguladora hepcidina. Los estudios sobre las funciones fisiológicas de esta hormona permitieron elaborar nuevas hipótesis que explican los resultados de los estudios clínicos anteriormente concebidos como contradictorios. El objetivo de la presente actualización es exponer, a la luz de los últimos avances sobre la regulación del metabolismo del hierro y su vinculación con la inflamación, el estado actual del conocimiento sobre el posible rol del exceso de hierro como factor de riesgo de ECV.
Palabras clave: Hierro; Enfermedad cardiovascular; Aterosclerosis; Sobrecarga de hierro; Hemocromatosis hereditaria
Abstract
Increased iron store and its relationship with cardiovascular disease. In the last years, great advance has been achieved in the control of several of the classic atherogenic risk factors; nonetheless, the incidence of cardiovascular disease (CVD) still remains high. Among the disorders which are associated with CVD, increased iron stores have been described as one of them. Its study gained relevance since the “iron hypothesis”, which postulates that low iron levels exert a protective effect on cardiovascular system, was elaborated. In spite of the numerous studies carried out to test this hypothesis, the results have been controversial. On the other hand, much knowledge regarding iron metabolism has been gained since the description of the regulatory hormone, hepcidin. The studies on hepcidin physiologic functions allowed the elaboration of new hypothesis that could explain the results formerly conceived as inconsistent. The aim of the present review is to describe, in light of the newest advances in iron metabolism regulation and its association with inflammation, the current state of knowledge regarding the possible role of iron overload as a risk factor of CVD.
Key words: Iron; Cardiovascular disease; Aterosclerosis; Iron overload; Hereditary hemochromatosis
En la actualidad, la enfermedad cardiovascular (ECV) es una de las principales causas de muerte en EE.UU. y en Europa occidental1. A pesar de los avances alcanzados en los últimos años en el control de varios de los denominados factores de riesgo aterogénico tradicionales, la incidencia de dicha enfermedad continúa aún siendo elevada. Por tal motivo, sobre la base de un mayor entendimiento de la fisiopatología de la ECV, se han estado estudiando otros factores de riesgo, llamados emergentes, y biomarcadores de ECV como la proteína C reactiva (PCR), las interleuquinas (IL) 1 y 6, la lipoproteína de baja densidad (LDL) oxidada, las moléculas de adhesión endotelial (VCAM-1, ICAM-1 y selectina E), la enzima fosfolipasa A2 asociada a lipoproteínas (Lp-PLA2), el fibrinógeno, la homocisteína, etc. Asimismo, cabe destacar que en diversas condiciones fisiológicas y patológicas, como la menopausia, la obesidad central, el síndrome metabólico, la diabetes, la acromegalia, el síndrome de Cushing, la esteatosis hepática no alcohólica, entre otras, frecuentemente existen modificaciones de los niveles de los factores de riesgo y biomarcadores antes mencionados. Entre estos desórdenes, podría ubicarse también a la sobrecarga de hierro, cuya relación con la ECV ha comenzado a ser abordada recientemente.
El conocimiento de la etiopatogenia de la sobrecarga de hierro ha avanzado considerablemente desde el descubrimiento de la hormona reguladora hepcidina2. Esta hormona secretada por el hígado es un péptido de 20 a 25 aminoácidos en su forma activa, y posee la capacidad de inhibir la absorción duodenal de hierro y el eflujo de hierro desde los macrófagos hacia la circulación3. De esta manera, la hepcidina regula los niveles del hierro en circulación, donde es transportado por la transferrina y utilizado principalmente para la síntesis de hemoglobina o es almacenado como ferritina (Fig. 1). El aumento de la expresión de hepcidina ocurre en respuesta al exceso de hierro y a la inflamación, mientras que su disminución se asocia a deficiencia de hierro, hipoxia y estimulación de la eritropoyesis4.
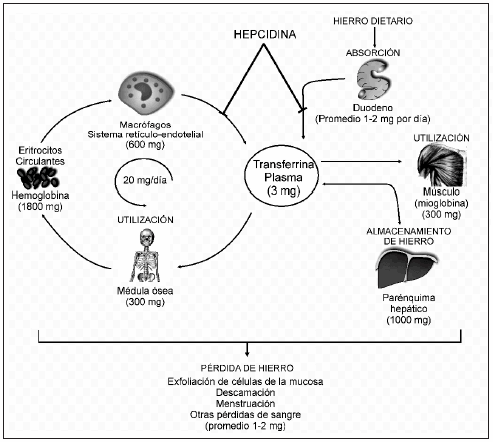
Fig. 1.- Distribución de hierro en adultos. El hierro absorbido en duodeno pasa a circulación donde se une a la transferrina. Este hierro puede ser utilizado para la síntesis de mioglobina y hemoglobina o su almacenamiento. El hierro de los eritrocitos se encuentra en continuo reciclaje siendo los macrófagos del sistema retículo endotelial los encargados de fagocitar los eritrocitos senescentes, obtener el hierro de la hemoglobina y almacenarlo o mediar su reutilización acorde a la concentración de hepcidina plasmática. Modificado de Andrews NC. New Eng J Med 1999; 341:1986-95.
La comprensión de los mecanismos de acción de esta hormona permitió elaborar nuevas hipótesis, explicando las controversias que existen en los estudios sobre el rol de los depósitos de hierro en la fisiopatología de la ECV. El objetivo de la presente revisión es resumir los resultados de los estudios de mayor relevancia, los cuales podrían ser agrupados en: a) la depleción de hierro como factor protector contra la ECV, b) el exceso de hierro como factor de riesgo de ECV, c) estudios en pacientes con sobrecarga de hierro y efecto de las mutaciones predisponentes, y d) el hierro retenido en los macrófagos como factor de riesgo de ECV, y presentar el estado actual del conocimiento sobre la hipótesis que plantea al exceso de hierro como factor de riesgo de ECV.
Depleción de hierro como factor protector frente a la ECV. Hipótesis del hierro
Hace aproximadamente 30 años, Sullivan5 postuló la hipótesis del hierro. Esta fue formulada pretendiendo explicar la diferencia en la incidencia de ECV entre hombres y mujeres posmenopáusicas, en comparación a mujeres en edad fértil, en función de las diferencias existentes en los niveles de hierro entre ambos grupos. Según este planteo, las mujeres en edad fértil estarían protegidas debido a que presentan menor hierro de depósito a causa del sangrado menstrual. Si bien en la actualidad se sabe que existen múltiples factores independientes del metabolismo del hierro que podrían explicar la diferencia en el riesgo de ECV, la relación entre disminución de hierro por donación de sangre y menor riesgo de padecer ECV ha sido avalada por distintos estudios6,7. Mientras que Salonen y col.6 comunicaron que los dadores de sangre presentaban una reducción del riesgo de infarto agudo de miocardio (IAM) del 88% respecto a los no dadores, Meyers y col.7 observaron una reducción del riesgo de eventos cardiovasculares del 40% al comparar dadores de sangre frecuentes (una donación por año) contra dadores casuales (una donación cada 3 años). Sin embargo, el tema es controvertido, ya que Ascherio y col.8 no observaron menor riesgo de IAM en dadores frecuentes de sangre (RR = 1.2; IC 95%, 0.8-1.2, p > 0.05). Paralelamente, estudios de marcadores de la función vascular llevados a cabo en dadores de sangre en comparación con no dadores, resultaron también controvertidos9, 10. Es probable que estas diferencias sean resultado de las limitaciones intrínsecas del diseño de estos estudios, debido a que tanto en el grupo de donantes como en el de no donantes los niveles de hierro de depósito (evaluados a través de la ferritina) pueden ser muy variables. En efecto, la donación de sangre no garantiza una efectiva depleción de los niveles de hierro, la cual sería necesaria para que se manifestase el efecto protector. Por lo tanto, para comprobar si la depleción de hierro, evitando la anemia por deficiencia, ejercía protección frente a la ECV, se implementó un protocolo de reducción de los niveles de hierro en aproximadamente 1300 pacientes en prevención secundaria, cuyos resultados fueron publicados recientemente11. En el citado estudio, si bien no se observaron diferencias significativas en el punto final compuesto por muerte, IAM-no fatal o stroke entre los pacientes asignados al tratamiento (HR = 0.88; IC 95%, 0.72-1.07; p = 0.20) y los controles, se evidenció una interacción significativa entre el tratamiento y la edad11.
Por lo tanto, hasta el momento la relación entre bajos niveles de hierro (equiparables con los de mujeres en edad fértil) y menor incidencia de ECV no ha sido fehacientemente comprobada. Las diferencias en los resultados obtenidos podrían deberse a que solo sea evidente un efecto protector en grupos específicos de individuos y no en la población general. En coherencia con esta limitación, es destacable la interacción entre la reducción de hierro y la edad en el estudio de Zacharski y col.11.
Exceso de hierro como factor de riesgo de ECV
En paralelo a los primeros estudios destinados a confrontar la hipótesis planteada por Sullivan5, se analizó la relación directa entre el riesgo de ECV y el aumento de la concentración de ferritina. Si bien inicialmente en una población finlandesa de hombres se observó que individuos con concentración de ferritina mayor o igual a 200 ng/ml presentaban dos veces mayor riesgo de IAM que individuos con menores concentraciones12, no todos los estudios posteriores confirmaron este hallazgo13-15. Mientras que por un lado Knuiman y col.13 y Friedrich y col.15, al estudiar prospectivamente más de 1500 sujetos, no evidenciaron una asociación positiva entre el aumento de ferritina y el riesgo de ECV, otros autores observaron un aumento del riesgo de aterosclerosis carotídea16,17, enfermedad arterial periférica18 y estenosis coronaria19 en relación al aumento de los depósitos de hierro. Un aspecto importante en los citados estudios radica en que en la mayoría de los que se observó una relación entre el aumento de la ferritina sérica y el riesgo de ECV el resultado fue significativo solo en individuos de sexo masculino. En particular, Wolff y col.16 informaron un aumento del riesgo de aterosclerosis por incremento de desvío estándar de ferritina significativo en hombres (1.33, IC 95%, 1.08-1.44; p < 0.01), pero no en mujeres (1.29; IC 95% 0.98-1.75; p > 0.05). De modo similar, Haidari y col.19 observaron que los hombres del mayor cuartilo de ferritina presentaban mayor riesgo de ECV que los del menor cuartilo (OR = 1.62; IC 95%, 1.1 -2.42; p < 0.001), mientras que en el grupo de mujeres no hubo incremento alguno. Es así que hasta el momento el rol del aumento de los depósitos de hierro como factor de riesgo de ECV es todavía discutido. Posiblemente y en coherencia con los estudios sobre la depleción, la asociación entre el exceso de hierro y el riesgo de ECV dependa de la interacción con factores como la edad y el sexo.
Sin embargo, otros estudios reportaron correlaciones entre la concentración de ferritina y bioindicadores de inflamación, disfunción endotelial y aterosclerosis. En particular, la concentración de ferritina se asoció positivamente con la concentración de oxisteroles, LDL oxidadas, PCR, IL-6, y moléculas de adhesión celular20-24. Más aún, se ha propuesto a la elevación de la concentración sérica de ferritina como un componente del síndrome de resistencia insulínica y como factor de riesgo para alteraciones en el metabolismo de los hidratos de carbono25-27. De hecho, estudios poblacionales describieron correlaciones positivas entre la ferritina y los niveles de glucosa en ayunas o el área bajo la curva de la prueba oral de tolerancia a la glucosa28. Si bien diversas explicaciones se han propuesto relacionando al exceso de hierro con la resistencia a la insulina, el mecanismo fisiopatológico aún no se encuentra completamente descrito.
En conclusión, pese a que los estudios clínicos no han podido definir al aumento de la concentración de ferritina como un factor de riesgo de ECV, existe abundante bibliografía que relaciona al exceso de hierro con la resistencia a la insulina y con bioindicadores de inflamación, disfunción endotelial y aterosclerosis; no pudiéndose descartar un mayor riesgo en individuos de sexo masculino o con concentraciones de ferritina excesivamente elevadas.
Estudios en pacientes con sobrecarga de hierro y efecto de las mutaciones predisponentes
La sobrecarga de hierro se caracteriza por un aumento sostenido de los niveles de hierro en los depósitos, el cual eventualmente daña órganos como el hígado, el páncreas y el corazón29. Su etiología puede ser primaria o secundaria. Las primarias son afecciones de origen genético, mientras que las secundarias se encuentran asociadas a hemoglobinopatías, patologías inflamatorias y alteraciones metabólicas como la esteatosis hepática no alcohólica29, 30, entre otras. En la presente revisión, nos referiremos en particular a la hemocromatosis hereditaria (HH), por ser la enfermedad más frecuente de etiología primaria asociada a sobrecarga de hierro.
La HH ocurre como consecuencia de mutaciones en el gen HFE, el cual modula el aumento de la expresión de hepcidina en los hepatocitos en respuesta al exceso de hierro plasmático31. Actualmente, se han descrito diversas mutaciones en el gen HFE que conducen a HH. Sin embargo, las de mayor frecuencia son las que llevan a un producto génico truncado caracterizado por reemplazo de la cisteína 282 por un residuo de tirosina (C282Y) y de la histidina 63 por un residuo de aspartato (H63D). La sobrecarga de hierro asociada a esta patología es entonces consecuencia de un incremento en la absorción duodenal de hierro debido a la baja capacidad de aumentar la expresión de hepcidina.
Respecto al estudio de si las mutaciones para HH influían en la incidencia de eventos cardiovasculares, sólo la mutación H63D se encontró asociada a riesgo de stroke32-36. En particular, Ellervik y col.33 comunicaron que los pacientes homocigotas para la mutación H63D presentaban entre 2 y 3 veces mayor riesgo de stroke isquémico. De modo similar, Njajou y col.34 destacaron un aumento significativo del riesgo de stroke en los portadores de mutaciones para HH en un contexto de hipertensión o tabaquismo. No obstante, un metaanálisis reciente que abarcó aproximadamente a 54 000 pacientes, no encontró asociación entre las mutaciones del gen HFE y el riesgo cardiovascular37. Es de notar que este resultado podría deberse a que las mutaciones que conducen a HH son factores predisponentes, pero por sí solos no llevan a sobrecarga de hierro. Más aún, el efecto de las mutaciones en mujeres en edad fértil se ve atenuado, debido a que en éstas, la acumulación de hierro presenta una evolución diferente por el sangrado menstrual. Por lo tanto, los niveles de ferritina en cohortes de pacientes con mutaciones en el gen HFE son muy variables y no representan un contraste adecuado a la hipótesis de si los niveles aumentados de hierro constituyen un factor de riesgo para ECV o no.
Dado esta limitación, se estudió la función vascular y los biomarcadores de aterosclerosis en grupos de pacientes con sobrecarga franca de hierro en comparación con controles. En estos estudios, todos los pacientes presentaban valores aumentados de ferritina, saturación de transferrina y/o siderosis hepática detectada por biopsia. Gaenzer y col.38 demostraron que los pacientes masculinos presentaban un deterioro de la función endotelial en comparación con controles pareados por sexo, el cual revirtió luego del tratamiento por flebotomía. Asimismo, en un estudio reciente realizado en nuestro laboratorio39, observamos que pacientes con sobrecarga de hierro presentaban no solo resistencia a la insulina, sino también un perfil lipoproteico aterogénico y aumento de la concentración de LDL oxidada y de la actividad de Lp-PLA2, la cual constituye un marcador de inflamación e injuria vascular40. El principal hallazgo de este estudio fue que un 40% de la variabilidad de la actividad de Lp-PLA2 era atribuible únicamente a la ferritina en un modelo ajustado por variables confundentes. A su vez, la actividad de esta enzima se halló correlacionada con la concentración de LDL oxidada, la cual presenta en su superficie los fosfolípidos oxidados que son hidrolizados por la Lp-PLA2 (Fig. 2). Adicionalmente, y en apoyo a los estudios que indican un mayor riesgo de ECV asociado a la mutación H63D, la presencia de este alelo en la población estudiada se asoció significativamente a concentraciones de colesterol total mayor a 200 mg/dl y de colesterol-LDL por encima de 160 mg/dl.
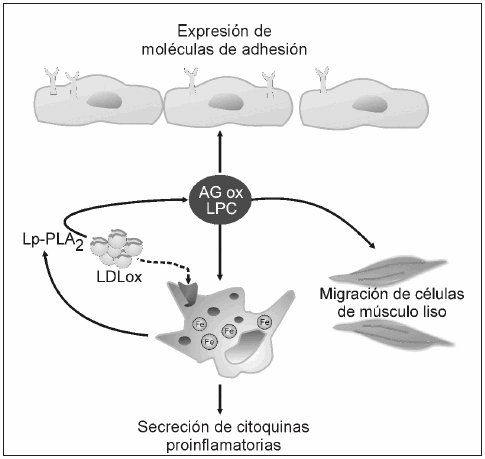
Fig. 2.- Acciones proaterogénicas de la Lp-PLA2. Las células inflamatorias, en particular macrófagos, secretan la enzima, la cual se une a la LDL oxidada e hidroliza los fosfolípidos oxidados de su superficie, liberando al medio ácidos grasos oxidados y lisofosfatidilcolina que estimulan la secreción de citoquinas proinflamatorias, la migración de células de músculo liso y la expresión de moléculas de adhesión. Resultados de nuestros estudios sugieren que la concentración de hierro del macrófago sería uno de los factores que estimularía la secreción de esta enzima. Lp-PLA2, fosfolipasa A2 asociada a lipoproteínas; LDLox, lipoproteína de baja densidad oxidada; AGox, ácidos grasos oxidados; LPC, lisofosfatidilcolina. Modificado de Münzel y col. Eur Heart J 2009; 30:2829-31.
Por lo tanto, se puede concluir que, si bien no se ha logrado demostrar un efecto de las mutaciones para HH sobre el riesgo de ECV, los pacientes con sobrecarga franca de hierro poseen alteraciones en la función vascular y en marcadores de inflamación y factores de riesgo de aterosclerosis, lo cual apoya la relación entre la concentración de ferritina y el riesgo de ECV en individuos con niveles de ferritina considerablemente elevados.
El hierro retenido en los macrófagos como factor de riesgo de ECV
La falta de asociación entre las mutaciones para HH y el riesgo de ECV, llevó al cuestionamiento de si éstas ejercen un efecto protector, y si el mayor riesgo cardiovascular sería solo atribuible al exceso de hierro retenido en los macrófagos, ya sea por aumento de hepcidina o de los niveles de hierro41. Si bien el punto respecto a las mutaciones para HH parece contradecir la hipótesis del hierro, más bien la complementa. De hecho, los bajos niveles de hepcidina presentes en pacientes con HH podrían explicar la falta de asociación entre estas mutaciones y el riesgo de ECV41.
En apoyo a este postulado, diversos estudios evidenciaron la presencia de hierro en placas ateroscleróticas, más específicamente en macrófagos y células espumosas42-44, tipos celulares con un rol clave en la progresión de las lesiones ateromatosas45. Más aún, la concentración de hierro en las lesiones ateroscleróticas correlacionó con los niveles de colesterol de las placas42, con marcadores de oxidación de proteínas y de lípidos, con la severidad de las lesiones y con los niveles plasmáticos de ferritina43, 44.
A su vez, la acumulación de hierro en los macrófagos podría ser responsable de la manifestación de un fenotipo proaterogénico con mayor capacidad de incorporar colesterol a través del receptor scavenger-1 y de secretar moléculas proinflamatorias como la Lp-PLA239,46. Más aún, es conocido que los macrófagos, frente a una sobrecarga celular de hierro secretan mayor cantidad de hierro y ferritina47, hecho que podría favorecer el aumento de la concentración de prooxidantes en la placa de ateroma, facilitando así el daño oxidativo y promoviendo la progresión de la enfermedad48.
En coherencia con este planteo, recientemente se han publicado dos estudios que involucran al aumento de hepcidina con el mayor riesgo de enfermedad aterosclerótica. Valenti y col.49 describieron los efectos proinflamatorios y proaterogénicos de la hepcidina in vitro e in vivo. En cultivos de monocitos derivados de pacientes sin mutaciones para HH, la hepcidina indujo la expresión de la proteína quimiotáctica de monocitos-1 (MCP-1) y de IL-6. A su vez, en un grupo de 130 pacientes con síndrome metabólico la concentración sérica de hepcidina correlacionó con la concentración de MCP-1 la cual junto con la concentración de ferritina resultaron predictores independientes de la presencia de placas carotídeas49. Asimismo, en otro estudio limitado a pacientes con esteatosis hepática no alcohólica, el mismo grupo de trabajo describió una asociación significativa entre la concentración de hepcidina y la presencia de placas carotídeas en los pacientes con concentraciones elevadas de ferritina y sin mutaciones en el gen HFE50.
Perspectivas
Pese a que muchos estudios abordaron la hipótesis del hierro según su planteo original o acorde a variantes derivadas de la misma, los resultados fueron controvertidos en todos los casos. Si bien existen amplias evidencias de que el hierro juega un rol en relación a la ECV, gran parte de la controversia se puede deber a diferencias en las poblaciones estudiadas y en el indicador sérico utilizado para evaluar el hierro corporal. El entendimiento de la relación entre los reguladores del metabolismo del hierro y su relación con la inflamación proveen evidencias sobre el posible rol del exceso de hierro como factor de riesgo de ECV. En este aspecto, el rol del hierro retenido en los macrófagos como factor de riesgo de ECV parece ser prometedor. De este modo, el aumento de la concentración de hepcidina podría condicionar el riesgo cardiovascular asociado al aumento de ferritina, por lo que la determinación de hepcidina podría resolver parte de la controversia existente en los estudios clínicos realizados hasta el momento. Serían necesarios estudios prospectivos en los que se evalúe la concentración de hepcidina y ferritina, y la implementación de protocolos controlados de reducción de hierro en pacientes de alto riesgo, para poder esclarecer la relación entre el aumento de los depósitos de hierro y la ECV.
Agradecimientos: El estudio fue financiado por subsidios otorgados por la Universidad de Buenos Aires (UBACyT 01/2017), la Fundación Alberto J Roemmers y el Consejo Nacional de Investigaciones Científicas y Técnicas (CONICET) (PIP 0931). Tomás Meroño es becario del CONICET. Los autores agradecen a la Dra. Margarita Angerosa por su colaboración.
Conflictos de Interés: Los autores declaran no poseer conflictos de interés.
1. Roger VL, Go AS, Lloyd-Jones DM, et al. Heart disease and stroke statistics--2011 update: a report from the American Heart Association. Circulation 2011; 123: e18-e209. [ Links ]
2. Park CH, Valore EV, Waring AJ, Ganz T. Hepcidin, a urinary antimicrobial peptide synthesized in the liver. J Biol Chem 2001; 276: 7806-10. [ Links ]
3. Ganz T. Hepcidin, a key regulator of iron metabolism and mediator of anemia of inflammation. Blood 2003; 102: 783-8. [ Links ]
4. Fleming MD. The regulation of hepcidin and its effects on systemic and cellular iron metabolism. Hematology Am Soc Hematol Educ Program 2008: 151-8. [ Links ]
5. Sullivan JL. Iron and the sex difference in heart disease risk. Lancet 1981; 1: 1293-4. [ Links ]
6. Salonen JT, Tuomainen TP, Salonen R, Lakka TA, Nyyssonen K. Donation of blood is associated with reduced risk of myocardial infarction. The Kuopio Ischaemic Heart Disease Risk Factor Study. Am J Epidemiol 1998; 148: 445-51. [ Links ]
7. Meyers DG, Jensen KC, Menitove JE. A historical cohort study of the effect of lowering body iron through blood donation on incident cardiac events. Transfusion 2002; 42: 1135-9. [ Links ]
8. Ascherio A, Rimm EB, Giovannucci E, Willett WC, Stampfer MJ. Blood donations and risk of coronary heart disease in men. Circulation 2001; 103: 52-7. [ Links ]
9. Zheng H, Cable R, Spencer B, Votto N, Katz SD. Iron stores and vascular function in voluntary blood donors. Arterioscler Thromb Vasc Biol 2005; 25: 1577-83. [ Links ]
10. Engberink MF, Geleijnse JM, Durga J, et al. Blood donation, body iron status and carotid intima-media thickness. Atherosclerosis 2008; 196: 856-62. [ Links ]
11. Zacharski LR, Chow BK, Howes PS, et al. Reduction of iron stores and cardiovascular outcomes in patients with peripheral arterial disease: a randomized controlled trial. Jama 2007; 297: 603-10. [ Links ]
12. Salonen JT, Nyyssonen K, Korpela H, et al. High stored iron levels are associated with excess risk of myocardial infarction in eastern Finnish men. Circulation 1992; 86: 803-11. [ Links ]
13. Knuiman MW, Divitini ML, Olynyk JK, Cullen DJ, Bartholomew HC. Serum ferritin and cardiovascular disease: a 17-year follow-up study in Busselton, Western Australia. Am J Epidemiol 2003; 158: 144-9. [ Links ]
14. Danesh J, Appleby P. Coronary heart disease and iron status: meta-analyses of prospective studies. Circulation 1999; 99: 852-4. [ Links ]
15. Friedrich N, Milman N, Volzke H, Linneberg A, Jorgensen T. Is serum ferritin within the reference range a risk predictor of cardiovascular disease? A population-based, long-term study comprising 2874 subjects. Br J Nutr 2009; 102: 594-600. [ Links ]
16. Wolff B, Volzke H, Ludemann J, et al. Association between high serum ferritin levels and carotid atherosclerosis in the study of health in Pomerania (SHIP). Stroke 2004; 35: 453-7. [ Links ]
17. Kiechl S, Willeit J, Egger G, Poewe W, Oberhollenzer F. Body iron stores and the risk of carotid atherosclerosis: prospective results from the Bruneck study. Circulation 1997; 96: 3300-7. [ Links ]
18. Menke A, Fernandez-Real JM, Muntner P, Guallar E. The association of biomarkers of iron status with peripheral arterial disease in US adults. BMC Cardiovasc Disord 2009; 9: 34. [ Links ]
19. Haidari M, Javadi E, Sanati A, Hajilooi M, Ghanbili J. Association of increased ferritin with premature coronary stenosis in men. Clin Chem 2001; 47: 1666-72. [ Links ]
20. Ikeda Y, Suehiro T, Yamanaka S, et al. Association between serum ferritin and circulating oxidized low-density lipoprotein levels in patients with type 2 diabetes. Endocr J 2006; 53: 665-70. [ Links ]
21. Depalma RG, Hayes VW, Chow BK, et al. Ferritin levels, inflammatory biomarkers, and mortality in peripheral arterial disease: a substudy of the Iron (Fe) and Atherosclerosis Study (FeAST) Trial. J Vasc Surg 2010; 51: 1498-503. [ Links ]
22. van Tits LJ, Jacobs EM, Swinkels DW, et al. Non-transferrin-bound iron is associated with plasma level of soluble intercellular adhesion molecule-1 but not with in vivo low-density lipoprotein oxidation. Atherosclerosis 2007; 194: 272-8. [ Links ]
23. Tuomainen TP, Diczfalusy U, Kaikkonen J, Nyyssonen K, Salonen JT. Serum ferritin concentration is associated with plasma levels of cholesterol oxidation products in man. Free Radic Biol Med 2003; 35: 922-8. [ Links ]
24. Brouwers A, Langlois M, Delanghe J, et al. Oxidized low-density lipoprotein, iron stores, and haptoglobin polymorphism. Atherosclerosis 2004; 176: 189-95. [ Links ]
25. Brudevold R, Hole T, Hammerstrom J. Hyperferritinemia is associated with insulin resistance and fatty liver in patients without iron overload. PLoS One 2008; 3: e3547. [ Links ]
26. Gillum RF. Association of serum ferritin and indices of body fat distribution and obesity in Mexican American men--the Third National Health and Nutrition Examination Survey. Int J Obes Relat Metab Disord 2001; 25: 639-45. [ Links ]
27. Fernandez-Real JM, Ricart-Engel W, Arroyo E, et al. Serum ferritin as a component of the insulin resistance syndrome. Diabetes Care 1998; 21: 62-8. [ Links ]
28. Tuomainen TP, Nyyssonen K, Salonen R, et al. Body iron stores are associated with serum insulin and blood glucose concentrations. Population study in 1,013 eastern Finnish men. Diabetes Care 1997; 20: 426-8. [ Links ]
29. Piperno A. Classification and diagnosis of iron overload. Haematologica 1998; 83: 447-55. [ Links ]
30. Riva A, Trombini P, Mariani R, et al. Revaluation of clinical and histological criteria for diagnosis of dysmetabolic iron overload syndrome. World J Gastroenterol 2008; 14: 4745-52. [ Links ]
31. Pietrangelo A. Hereditary hemochromatosis--a new look at an old disease. N Engl J Med 2004; 350: 2383-97. [ Links ]
32. Dunn T, Blankenship D, Beal N, et al. HFE mutations in heart disease. Heart Vessels 2008; 23: 348-55. [ Links ]
33. Ellervik C, Tybjaerg-Hansen A, Appleyard M, et al. Hereditary hemochromatosis genotypes and risk of ischemic stroke. Neurology 2007; 68: 1025-31. [ Links ]
34. Njajou OT, Hollander M, Koudstaal PJ, et al. Mutations in the hemochromatosis gene (HFE) and stroke. Stroke 2002; 33: 2363-6. [ Links ]
35. Ellervik C, Tybjaerg-Hansen A, Grande P, Appleyard M, Nordestgaard BG. Hereditary hemochromatosis and risk of ischemic heart disease: a prospective study and a case-control study. Circulation 2005; 112: 185-93. [ Links ]
36. Pankow JS, Boerwinkle E, Adams PC, et al. HFE C282Y homozygotes have reduced low-density lipoprotein cholesterol: the Atherosclerosis Risk in Communities (ARIC) Study. Transl Res 2008; 152: 3-10. [ Links ]
37. van der AD, Rovers MM, Grobbee DE, et al. Mutations in the HFE gene and cardiovascular disease risk: an individual patient data meta-analysis of 53 880 subjects. Circ Cardiovasc Genet 2008; 1: 43-50. [ Links ]
38. Gaenzer H, Marschang P, Sturm W, et al. Association between increased iron stores and impaired endothelial function in patients with hereditary hemochromatosis. J Am Coll Cardiol 2002; 40: 2189-94. [ Links ]
39. Merono T, Rosso LG, Sorroche P, et al. High risk of cardiovascular disease in iron overload patients. Eur J Clin Invest 2010. [ Links ]
40. Davidson MH, Corson MA, Alberts MJ, et al. Consensus panel recommendation for incorporating lipoprotein-associated phospholipase A2 testing into cardiovascular disease risk assessment guidelines. Am J Cardiol 2008; 101: 51F-57F. [ Links ]
41. Sullivan JL. Do hemochromatosis mutations protect against iron-mediated atherogenesis? Circ Cardiovasc Genet 2009; 2: 652-7. [ Links ]
42. Stadler N, Lindner RA, Davies MJ. Direct detection and quantification of transition metal ions in human atherosclerotic plaques: evidence for the presence of elevated levels of iron and copper. Arterioscler Thromb Vasc Biol 2004; 24: 949-54. [ Links ]
43. Lapenna D, Pierdomenico SD, Ciofani G, et al. Association of body iron stores with low molecular weight iron and oxidant damage of human atherosclerotic plaques. Free Radic Biol Med 2007; 42: 492-8. [ Links ]
44. Stanley N, Stadler N, Woods AA, Bannon PG, Davies MJ. Concentrations of iron correlate with the extent of protein, but not lipid, oxidation in advanced human atherosclerotic lesions. Free Radic Biol Med 2006; 40: 1636-43. [ Links ]
45. Stocker R, Keaney JF, Jr. Role of oxidative modifications in atherosclerosis. Physiol Rev 2004; 84: 1381-478. [ Links ]
46. Kraml PJ, Klein RL, Huang Y, Nareika A, Lopes-Virella MF. Iron loading increases cholesterol accumulation and macrophage scavenger receptor I expression in THP-1 mononuclear phagocytes. Metabolism 2005; 54: 453-9. [ Links ]
47. Yuan XM, Li W, Baird SK, Carlsson M, Melefors O. Secretion of ferritin by iron-laden macrophages and influence of lipoproteins. Free Radic Res 2004; 38: 1133-42. [ Links ]
48. Li W, Ostblom M, Xu LH, et al. Cytocidal effects of atheromatous plaque components: the death zone revisited. Faseb J 2006; 20: 2281-90. [ Links ]
49. Valenti L, Dongiovanni P, Motta BM, et al. Serum Hepcidin and Macrophage Iron Correlate With MCP-1 Release and Vascular Damage in Patients With Metabolic Syndrome Alterations. Arterioscler Thromb Vasc Biol 2011; 31: 683-90. [ Links ]
50. Valenti L, Swinkels DW, Burdick L, et al. Serum ferritin levels are associated with vascular damage in patients with nonalcoholic fatty liver disease. Nutr Metab Cardiovasc Dis 2011. [ Links ]
Recibido: 20-5-2011
Aceptado: 27-9-2011














