Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Medicina (Buenos Aires)
versión impresa ISSN 0025-7680
Medicina (B. Aires) vol.72 no.1 Ciudad Autónoma de Buenos Aires ene./feb. 2012
ARTÍCULO ESPECIAL
Amiodarona y disfunción tiroidea
Leonardo F. L. Rizzo, Oscar D. Bruno
Estudios Metabólicos y Endocrinos, Buenos Aires
Dirección postal: Dr. Leonardo F.L. Rizzo, Estudios Metabólicos y Endocrinos, Laprida 1898, PB "H", 1425 Buenos Aires, Argentina
Fax (54-11) 4805-0631 e-mail: elbylen@yahoo.com.ar
Resumen
La amiodarona es un análogo estructural de la hormona tiroidea, y algunas de sus propiedades antiarrítmicas como así también su toxicidad son atribuibles a su interacción con los receptores nucleares de las hormonas tiroideas. Por ser muy lipofílica, la amiodarona se concentra en muchos tejidos y se elimina, por consecuencia, muy lentamente. Se emplea preferentemente para el tratamiento de arritmias graves tales como fibrilación y taquicardia ventriculares. Otras indicaciones incluyen la fibrilación auricular y el aleteo, la insuficiencia cardíaca congestiva grave, la prevención de la fibrilación auricular recurrente y situaciones de emergencia médica como la prevención de muerte súbita cardiaca1. Nuestro objetivo es proporcionar un enfoque actualizado sobre la amiodarona y su influencia sobre la fisiología tiroidea y discutir y analizar en profundidad sus potenciales efectos adversos como el hipotiroidismo y la tirotoxicosis.
Palabras clave: Amiodarona; Tiroides; Hipotiroidismo; Tirotoxicosis
Abstract
Amiodarone and thyroid dysfunction. Amiodarone is a structural analogue of thyroid hormone, and some of its anti-arrhythmic actions and toxicity are attributable to its interaction with nuclear receptors of thyroid hormones. Being highly lipophilic, amiodarone is concentrated in many tissues and is eliminated, consequently, very slowly. It is preferably employed to manage life-threatening arrhythmias, including ventricular fibrillation and unstable ventricular tachycardia. Other indications include atrial fibrillation and flutter, severe congestive heart failure, prevention of atrial fibrillation recurrence, and even in emergency medical situations to prevent sudden cardiac death. The aim of this review is to provide an updated approach on amiodarone and its influence on thyroid physiology and to discuss and analyze in depth its potential and not infrequent thyroidal adverse effects such as hypothyroidism and thyrotoxicosis.
Key words: Amiodarone; Thyroid; Hypothyroidism; Thyrotoxicosis
Historia
La amiodarona fue desarrollada como antianginoso en 1962 por Charlier, Deltour, Tondeur y Binon en el laboratorio farmacéutico Labaz, en Bruselas, Bélgica2. Sus propiedades antiarrítmicas fueron determinadas en animales en 1969 y al año siguiente, Van Schepdael y Solvay corroboraron dicha acción antiarrítmica en seres humanos, administrándola por vía endovenosa2. Pero fueron los resultados terapéuticos en pacientes con arritmias supraventriculares y ventriculares, descriptos por Rosenbaum y col. en 1976 en la Argentina, los que atrajeron la mayor atención e interés por esta droga2, 3.
Acción farmacológica
De acuerdo a la clasificación de Vaughan Williams (Tabla 1) la amiodarona es un fármaco antiarrítmico clase III que actúa inhibiendo la actividad Na+-K+ ATPasa a nivel miocárdico, retardando la fase 3 de la despolarización e incrementando la duración del potencial de acción y del período refractario efectivo. Además, bloquea los canales de sodio disminuyendo la velocidad de conducción (efecto clase I), reduce el número de receptores beta-adrenérgicos con el resultante efecto antiadrenérgico (efecto clase II) y suprime los potenciales de acción mediados por las fibras cálcicas (efecto clase IV)4, 5. Es una droga anfifílica con una parte hidrofílica (amina terciaria) y otra lipofílica (anillo benzofurano y anillo bencénico diyodinado), que posee una semejanza estructural con las hormonas tiroideas, comportándose incluso como un verdadero análogo de las mismas en tejidos como el hígado y la hipófisis. Existe una semejanza estructural entre la amiodarona, su principal metabolito -desetilamiodarona (DEA)- y las hormonas tiroideas (Fig. 1).
TABLA 1.- Clasificación de Antiarrítmicos de Vaughan-Williams4

*Muchas de estas drogas poseen acciones antiarrítmicas correspondientes a más de una clase
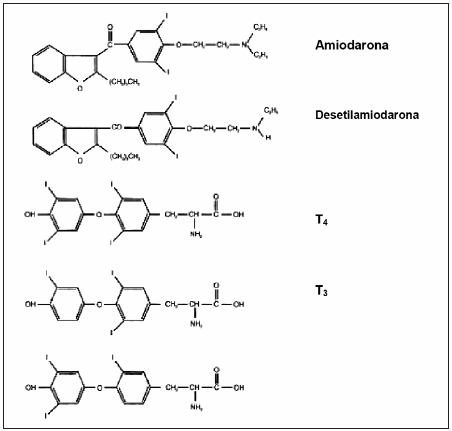
Fig. 1.- Estructura química de la amiodarona, desetilamiodarona, y hormonas tiroideas.
La amiodarona tiene un alto contenido en yodo (37% de su peso molecular)6, aportando alrededor de 75 mg del halógeno por cada comprimido de 200 mg7, 8. Administrada en una dosis de 200 a 600 mg/día, la amiodarona libera durante su metabolismo hepático aproximadamente unos 7 a 21 mg de yodo inorgánico a la circulación sistémica9, 10. Considerando que la ingesta diaria recomendada de yodo es de 150 a 200 μg, el tratamiento con amiodarona aporta diariamente un exceso de yodo 50 a 100 veces superior. Una vez ingerida, se absorbe en forma lenta y errática, variando en un 22-80%, alcanzándose el mayor porcentaje cuando se la administra junto a las comidas11. Su biodisponibilidad es de alrededor de un 40%, y posee un amplio volumen de distribución de aproximadamente 60 l/kg peso corporal y una extensa acumulación tisular, factores que explican su larga vida media biológica11. Las concentraciones máximas se alcanzan en tejido adiposo, hígado, pulmón y tiroides donde la amiodarona alcanza una concentración de 14 μg/g, y la DEA de 64 μg/g7.
Se metaboliza extensamente en hígado, transformándose por N-desalquilación a DEA; por deyodinación a monoyodoamiodarona, desdiyodoamiodarona y desdiyododesetilamiodarona; y por conjugación a metabolitos glucuro y arilsulfoconjugados que se excretan por la bilis7.
La vida media de eliminación es de alrededor de 40 días para la amiodarona y de 57 días para la DEA11. Se elimina por vía digestiva en un 65 al 75% y en menor proporción por sudor, saliva, lágrimas y semen. Al ser una droga anfifílica, la amiodarona se acumula en los lisosomas uniéndose a los fosfolípidos intralisosomales. Estos complejos resultantes no pueden ser digeridos por las fosfolipasas y forman cuerpos de inclusión multilamelares en los lisosomas de varios órganos (pulmones, hígado, corazón, piel, córneas y nervios periféricos), lo que se traducirá en una variedad de efectos adversos7.
Precisamente, la prevalencia de efectos adversos inducidos por la amiodarona es de alrededor del 15% en el primer año, aumentando al 50% con el uso prolongado. En cerca del 20 al 50% de los casos, el tratamiento deberá interrumpirse debido a los efectos indeseables del fármaco12. En la Tabla 2 se detallan los efectos adversos inducidos por la amiodarona9, 12.
TABLA 2.- Efectos adversos inducidos por la amiodarona9, 12

Acciones de la amiodarona sobre la tiroides
Pueden subdividirse en dos grandes grupos o categorías:
Acciones inducidas o propias del yodo
Las alteraciones provocadas sobre la síntesis de las hormonas tiroideas (HT) y la autorregulación tiroidea debido a la sobrecarga de yodo promovida por la amiodarona pueden inducir hipotiroidismo o tirotoxicosis. El primero se debe a la inhibición de la síntesis de HT producto del exceso de yodo intratiroideo lo que se conoce como efecto Wolff-Chaikoff13, el cual es habitualmente temporario en sujetos normales, produciéndose un fenómeno de "escape" en aproximadamente dos semanas. En sujetos eutiroideos el transporte activo de yoduro dentro de las células tiroideas se restaura en alrededor de 2 días, aun en presencia de una concentración plasmática elevada de yodo. Esto se debe a la capacidad de autorregulación que posee la tiroides ante diferentes cambios en la oferta de yodo. Aquellos pacientes que tienen una patología tiroidea subyacente (tiroiditis autoinmune o bocio) no pueden manejar una sobrecarga de yodo (escape al efecto Wolff-Chaikoff). Esto llevará a un aumento sostenido en los niveles séricos de TSH, lo que podrá ocasionar un agrandamiento de la glándula. La tirotoxicosis inducida por amiodarona surge también por una falla en los mecanismos de autorregulación tiroidea, lo que lleva a distintos grados de autonomía glandular, fenómeno conocido como efecto Jod Basedow (ver luego). Este efecto suele ocurrir típicamente en áreas con déficit de yodo y en pacientes con enfermedad tiroidea autoinmune o nodular subyacente11, 14.
Acciones inducidas o propias de la amiodarona
En este contexto consideramos de utilidad hacer un breve repaso del metabolismo deyodinativo de las HT. La deyodinación sucesiva es la principal vía metabólica de las HT, dando metabolitos activos e inactivos15, 16. La deyodinación inicial de la T4 puede ocurrir en el anillo distal produciendo T3 (3, 3´, 5 T3), o en el anillo proximal formándose así T3 reversa (3,3´, 5´T3). Menos del 20% de la T3 total es producida en la tiroides; el 80% restante surge de la monodeyodinación de la T4 en los tejidos periféricos15. Tanto la T3 como la T3 reversa son posteriormente deyodinadas a diyodotironinas (T2) y luego a monoyodotironinas (T1), metabolitos estos sin significancia biológica15, 16.
Este metabolismo deyodinativo de las HT se lleva a cabo a través de las isoenzimas deyodinasas (DI, DII, DIII) que son selenoproteínas pertenecientes a la superfamilia tioredoxina15, 16. La amiodarona inhibe francamente la actividad de las enzimas deyodinasas, La inhibición de la actividad DI en tejidos periféricos lleva a un descenso en las concentraciones séricas de T3 del 30% y a un incremento en los niveles de T4 del 20 al 40% y de T3 reversa del 20%8. Por su parte, la inhibición de la actividad DII a nivel pituitario es responsable del aumento de los niveles séricos de TSH17. Tanto la amiodarona como la DEA son inhibidores no competitivos de la DII, siendo la acción de la DEA mucho más potente18. Además de la acción sobre las deyodinasas, la amiodarona disminuye el transporte intracelular de T4 y la unión de la T3 a sus receptores nucleares. En la Tabla 3 se resumen estas acciones de la amiodarona sobre la tiroides.
TABLA 3.- Acciones de la amiodarona sobre la tiroides

Como resultado de la acción descripta sobre las enzimas deyodinasas, los pacientes tratados con amiodarona sufren variaciones en los niveles séricos de HT y de TSH8-10, 14. Estos cambios reflejados en los análisis de laboratorio deben diferenciarse de una verdadera disfunción del eje tiroideo que pueda además producirse durante el tratamiento. Es importante señalar que la amiodarona no tiene efecto sobre las proteínas transportadoras de HT. En la Tabla 4 se muestran las alteraciones de laboratorio del eje tiroideo inducidas por la amiodarona de acuerdo al tiempo de tratamiento14. Tanto la amiodarona como la DEA tienen una acción citotóxica directa sobre la célula folicular tiroidea, que luego describiremos en más detalle.
TABLA 4.- Pruebas de función tiroidea en sujetos eutiroideos tratados con amiodarona

* Pueden alternar períodos de TSH discretamente aumentadas o disminuidas
Otras acciones extra-tiroideas
La amiodarona se comporta también como un antagonista de las hormonas tiroideas sobre otros tejidos. Así, la hipercolesterolemia inducida por la amiodarona es el resultado de una condición hipotiroidea-símil en el hígado, dado que la amiodarona disminuiría la expresión genética del receptor LDL, normalmente regulado por la T314.
A nivel miocárdico, el uso crónico de amiodarona induce cambios electrofisiológicos semejantes a los que se observan en el hipotiroidismo18, que revierten con la administración concomitante de levotiroxina. La DEA actúa como un inhibidor competitivo de la unión de la T3 con su receptor α-1 (T3R-α1), y como un inhibidor no competitivo de su unión con el receptor ß-1 (T3R-ß1)19.
Amiodarona y disfunción tiroidea
La disfunción tiroidea se describe en alrededor del 15 al 20% de los pacientes tratados con amiodarona9. La prevalencia de tiroideopatías inducidas por la amiodarona varía en gran parte de acuerdo al grado de suficiencia o déficit ambiental de yodo. Un estudio ya clásico de Martino y col. evaluó la prevalencia de tiroideopatías inducidas por amiodarona comparando áreas deficientes en yodo (Lucca y Pisa en la región de Toscana, en Italia) versus un área suficiente en yodo (Worcester, Massachusetts, Estados Unidos). La prevalencia de tirotoxicosis inducida por amiodarona (TIA) fue mayor en el área con déficit de yodo -10% vs. 2%-, mientras que la de hipotiroidismo inducido por amiodarona (HIA) fue notablemente superior en el área suficiente en yodo -22% vs. 10%20. Estos hallazgos fueron luego confirmados en un número de estudios prospectivos con un seguimiento de hasta 4.5 años de tratamiento con amiodarona. La TIA se observó en 1.7% en áreas con ingesta alta de yodo y en un 11.9% en áreas con déficit de yodo, mientras que el HIA se observó en el 13.2% y el 6.4%, respectivamente7.
Por lo expuesto, es altamente recomendable establecer ciertas pautas antes de prescribir la amiodarona, debido a sus potenciales efectos adversos sobre el eje tiroideo. Las mismas comprenden: realizar una semiología tiroidea adecuada, medir un perfil hormonal (TSH, T4, T3) y anticuerpos antitiroideos y hacer una ecografía de tiroides. En pacientes añosos puede ser dificultosa la palpación adecuada de la tiroides, ya sea por la presencia de cifosis o por una localización glandular más profunda en el tórax. Además, en esta población es frecuente (> 50%) la presencia por ecografía de nódulos tiroideos, entre ellos bocios subesternales que usualmente pueden pasar inadvertidos. En estos casos es muy útil la tomografía de cuello y tórax sin contraste, dado que el material de contraste yodado puede desencadenar un hipertiroidismo en presencia de un bocio multinodular21 (Fig. 2). Otra opción es la resonancia nuclear magnética. La centellografía con radioyodo puede definir áreas de autonomía funcional e identificar en casos de duda una masa subesternal como tejido tiroideo; aunque muchos bocios subesternales captan pobremente el radioyodo21. Una vez descartada una disfunción tiroidea y/o la presencia de bocio nodular, de iniciarse tratamiento con amiodarona será necesario realizar un control hormonal a los 3 meses y luego cada 6 meses con TSH, T4 y T314, 22, 23.

Fig. 2.- Tomografía computada de cuello y tórax sin contraste que muestra un bocio subesternal con reducción de la luz traqueal (flecha) en un paciente que desarrolló una tirotoxicosis inducida por amiodarona.
En pacientes tratados con amiodarona que reciben también warfarina pueden ocurrir cambios inducidos por la amiodarona que pueden alterar la respuesta terapéutica al anticoagulante. La amiodarona inhibe el metabolismo de esta droga, potenciando el efecto anticoagulante. Esto requiere a menudo una reducción de alrededor de un 25% de la dosis de warfarina, con un monitoreo estrecho del tiempo de protrombina12. Estas interacciones son de cuidado, ya que pueden persistir hasta tres meses después de la interrupción de la amiodarona, debido a su larga vida media de eliminación. En todo paciente bajo tratamiento con amiodarona y warfarina que permaneció estable en el tiempo, y que inesperadamente presenta cambios en el R.I.N (Rango Internacional Normalizado), es dable sospechar y descartar la presencia de disfunción tiroidea7, 24. Así, el efecto de la warfarina estará potenciado en la tirotoxicosis inducida por amiodarona (aumento del R.I.N y mayor riesgo de hemorragias) y estará atenuado en el hipotiroidismo inducido por la amiodarona (disminución del R.I.N con riesgo de formación de coágulos).
Hipotiroidismo inducido por amiodarona (HIA)
El HIA aparece generalmente dentro de los primeros meses de tratamiento (6 a 18 meses), aunque puede observarse más tardíamente de iniciado el mismo22. Es más frecuente en mujeres, ancianos, en sujetos con autoinmunidad pre-existente y, como ya se mencionó, en áreas con ingesta suficiente de yodo. Se observa en cerca del 5 al 25% de los pacientes tratados6, 22, 25, y generalmente es secundario a la presencia de una menor reserva tiroidea, debido a una tiroiditis autoinmune subyacente, tratamiento previo con 131I o cirugía tiroidea6, 9 o a la presencia de ciertas enfermedades crónicas predisponentes, como la talasemia mayor26. El mecanismo se debe a la acción antitiroidea persistente del yodo y a la acción antagonista, particularmente de la DEA, sobre los receptores de la T3. Las manifestaciones clínicas no difieren a las observadas en el hipotiroidismo primario. El HIA puede, si es prolongado o severo, inducir la aparición de arritmias ventriculares como torsades de pointes11. Con menos frecuencia, el HIA se ha asociado con insuficiencia renal aguda, la cual revierte con el tratamiento con levotiroxina y la suspensión de la amiodarona27. Es interesante señalar que el HIA no parecería depender de las dosis administradas de amiodarona. Las concentraciones séricas de amiodarona y sus dosis acumulativas no difieren entre los pacientes que permanecen eutiroideos de quienes desarrollan hipotiroidismo en el transcurso del tratamiento con amiodarona22, 28. El HIA no remite espontáneamente si se continúa el tratamiento con amiodarona. Por otro lado, en pacientes con función tiroidea previa normal, la interrupción del fármaco promueve una recuperación de la función tiroidea a los 2 a 4 meses en el 60% de los casos; aunque en el 40% restante puede persistir durante 5 a 8 meses más. No se ha observado aparición de anticuerpos antitiroideos de novo durante el tratamiento con amiodarona28.
Algunos autores proponen la administración de perclorato de potasio por vía oral, 1000 mg/día durante un mes, con el fin de reducir el pool intratiroideo de yodo mediante el bloqueo del ingreso de yoduros, para acortar el intervalo entre la interrupción de la amiodarona y la restauración del eutiroidismo. La mayoría de los pacientes alcanzan el eutiroidismo en 2 a 3 semanas7. En nuestro medio no empleamos habitualmente perclorato de potasio en estas circunstancias.
Por el contrario, en pacientes con disfunción tiroidea previa, el hipotiroidismo persistirá aún después de interrumpida la amiodarona, requiriendo tratamiento crónico con LT49, 10, 28. En consecuencia, el tratamiento del hipotiroidismo inducido por amiodarona se hará en base a28:
Presencia de enfermedad tiroidea subyacente:
El tratamiento con amiodarona puede continuarse y se agregará terapia de reemplazo con LT4. Muy probablemente, el reemplazo deberá continuarse más allá de la suspensión de la amiodarona
Ausencia de enfermedad tiroidea subyacente:
También aquí podrá continuarse la amiodarona, agregando reemplazo con T4. Si se suspende la amiodarona (por falta de respuesta terapéutica y/o presencia de otros efectos adversos), se puede reducir progresivamente la dosis de T4 y realizar control periódico de la función tiroidea, ya que el hipotiroidismo revierte espontáneamente en la mayoría de los casos.
En cualquiera de las circunstancias mencionadas, de implementar tratamiento con hormona tiroidea, se recomienda tener un contacto periódico con el cardiólogo, ser prudente y cauteloso con la dosificación de LT4 (emplear dosis bajas y crecientes a intervalos cada 4 o más semanas de acuerdo a la tolerancia y control cardiológico) y admitir niveles de TSH más altos que en otros casos de hipotiroidismo. Es importante señalar que no siempre es necesario o aconsejable tratar el hipotiroidismo inducido por amiodarona. La decisión de tratarlo, o no, dependerá del grado del hipotiroidismo, la edad del paciente y en particular de su condición cardíaca subyacente28, 29.
Tirotoxicosis inducida por amiodarona (TIA)
La TIA es más frecuente en el sexo masculino (M:F = 3:1) y en áreas con déficit de yodo7, 22, con una incidencia informada en diferentes series que varía entre el 5 y el 10%6, 11. Algunas publicaciones sugieren que la incidencia en áreas con suficiencia yódica parecería ir en aumento30. La aparición de TIA durante el tratamiento con amiodarona es menos predecible que el HIA. La TIA es una entidad grave con una morbi-mortalidad que alcanza al 20% en presencia de disfunción grave del ventrículo izquierdo (vide infra)31.
Se describen usualmente dos tipos de tirotoxicosis inducidas por amiodarona: tipo 1 y tipo 214, 28, 32, 33. A la tipo 1 se la puede a su vez subclasificar en dos subtipos (1a y 1b) de acuerdo a la alteración tiroidea subyacente:
Tipo 1a- por sobrecarga de yodo en pacientes con bocio multinodular tóxico.
Tipo 1b- por sobrecarga de yodo en la enfermedad de Graves latente.
Tipo 2 - por inducción de una tiroiditis química.
Sin embargo, en muchos casos pueden presentarse formas mixtas o indefinidas33 que podrían ser clasificadas como tipo 3.
El mecanismo fisiopatológico en la TIA tipo 1 es un aumento de la síntesis de hormonas tiroideas, inducido por el exceso de yodo en presencia de autonomía de la glándula tiroidea (efecto Jod Basedow)33.
Con respecto al tipo 2, el mecanismo es un daño citotóxico inducido directamente por la amiodarona y la DEA34 lo que resulta en una liberación de yodotironinas a la circulación33. La microscopia electrónica muestra, como características del daño celular, inclusiones lisosomales e inclusiones de glucógeno y un cuadro morfológico de hiperfunción tirocítica35, 36. Esto estaría a su vez avalado por el hallazgo de que la amiodarona estimula la producción de interleukina 6 en cultivos de tirocitos humanos, ejerciendo sobre ellos efectos citotóxicos directos37.
Las formas mixtas de TIA contemplan ambos mecanismos fisiopatológicos y son las formas más difíciles de controlar terapéuticamente.
Muchos pacientes con TIA se encuentran asintomáticos7, debido a que las manifestaciones clínicas de la tirotoxicosis suelen a menudo estar enmascaradas o minimizadas por la acción beta bloqueante de la amiodarona, por su inhibición sobre la conversión de T4 a T3 y posiblemente por la acción antagonista de su principal metabolito (DEA) sobre los receptores de T3. Sumado a esto, se debe considerar que la amiodarona normalmente se prescribe en sujetos mayores de 60 años7, 31, quienes de por sí expresan los signos y síntomas de hipertiroidismo de manera más solapada que el adulto joven33, 38.
Los signos y síntomas de presentación más característicos de la TIA incluyen la aparición o reaparición de arritmias, la exacerbación de una cardiopatía isquémica, la insuficiencia cardíaca congestiva, o bien, pérdida de peso inexplicable. En la serie de Conen y col39 las características clínicas más salientes en pacientes con TIA fueron:

El comienzo de la TIA es usualmente rápido e impredecible, y puede incluso aparecer 6-9 meses luego de interrumpir la amiodarona, debido a su gran depósito tisular y su larga vida media39. Es muy importante tener presente que los pacientes con TIA tienen un riesgo tres veces mayor de sufrir un evento cardiovascular mayor (taquicardia ventricular, infarto agudo de miocardio, accidente cerebrovascular, insuficiencia cardíaca y muerte de causa cardiovascular) que los sujetos eutiroideos tratados con amiodarona40. Además, una disfunción severa del ventrículo izquierdo (fracción de eyección menor al 50% por ecocardiografía) en pacientes con TIA sería un factor de riesgo de mortalidad. En estos casos se plantea no interrumpir la amiodarona para evitar exacerbar el impacto de la tirotoxicosis a nivel cardíaco31, 41. Esto se explica dado que la amiodarona promueve, a nivel miocárdico, bradicardia, prolongación del potencial de acción y disminución del consumo de oxígeno. De hecho, la amiodarona reduce la expresión genética de la ATPasa de calcio del retículo sarcoplásmico (SERCA2a) y modifica la expresión genética de las cadenas pesadas de miosina, reduce la de la αMHC e incrementa la de la βMHC7. Esto genera un estado de "hipotiroidismo" a nivel cardíaco semejante a lo que se observa en el hipotiroidismo sistémico7, 11, 18. De esta forma, la amiodarona protegería paradojalmente al corazón, pese a la presencia de tirotoxicosis.
En todo paciente anciano con pérdida de peso inexplicable se debe siempre descartar la presencia de tirotoxicosis de cualquier etiología, y en este contexto interrogar si el paciente está bajo tratamiento con amiodarona. Muchas veces la orientación diagnóstica se simplifica cuando el paciente es derivado directamente por el cardiólogo. Es importante realizar una buena semiología de cuello y tener presente las pautas de seguimiento recomendadas para pacientes bajo tratamiento con amiodarona14, 24 (Tabla 5). La determinación sérica de TSH es la prueba más sensible para detectar hipertiroidismo en pacientes tratados con amiodarona. La presencia de TSH baja con T4 libre alta y T3 elevada o normal certifican el diagnóstico. Pueden ocurrir casos de T4 toxicosis. La medición de anticuerpos anti-peroxidasa y anti-receptor de TSH (TRAb) ayudará a establecer la presencia de enfermedad de Graves.
TABLA 5.- Pautas de seguimiento recomendadas en pacientes bajo tratamiento con amiodarona

Diferencias entre los distintos tipos de TIA:
La tipo 1 tiende a ocurrir más tempranamente y con una menor dosis acumulativa de amiodarona que la del tipo 2. La interleukina 6 fue sugerida inicialmente como un buen discriminador bioquímico entre ambos tipos (más elevada en la tipo 2)42, 43; aunque estudios posteriores no confirmaron su validez diagnóstica44. La curva de captación de radioyodo a las 24 horas en ambos tipos de TIA es usualmente indetectable o baja. Como excepción, en áreas con déficit de yodo y en casos esporádicos como luego veremos, la captación de radioyodo en la tipo 1 puede estar normal o incluso alta (> 10%) a pesar del exceso de yodo45. En la tipo 2 la curva de captación será invariablemente < 1% debido a la tiroiditis destructiva. El ecodoppler color46, 47 y el centellograma con Tc99m-sesta MIBI48 parecieran ser herramientas prometedoras en el diagnóstico diferencial de la TIA. En pacientes con tipo 1 el ecodoppler color muestra un flujo vascular normal o aumentado (patrón 1 a 3), mientras que en la tipo 2 hay ausencia de vascularidad (patrón 0)46, 47. El centellograma con Tc99m-sesta MIBI muestra una captación difusa del radioisótopo, sugestiva de hiperfunción tisular en pacientes con TIA tipo 1 y ausencia de captación en pacientes con TIA tipo 248. En resumen, ninguno de los métodos disponibles discrimina con certeza entre ambos tipos de TIA, siendo necesaria una combinación de métodos diagnósticos para lograr, aunque no siempre, diferenciar un tipo de otro. En la Tabla 6 se detallan las características diferenciales entre los distintos tipos de TIA.
TABLA 6.- Características diferenciales entre los distintos tipos de tirotoxicosis inducida por amiodarona33, 46, 47,48

1Casi siempre baja en áreas con suficiencia de yodo.
2Casi siempre normal o alta en áreas con deficiencia de yodo.
El tratamiento de la TIA enmarca un verdadero desafío para el médico. Suele ser de difícil manejo y es importante establecer un contacto permanente con el cardiólogo de cabecera y consensuar la conducta terapéutica a seguir. Algunos casos pueden ser leves (incluso con hipertiroidismo subclínico) pero otros pueden ser graves y, como ya vimos, con elevada morbi-mortalidad. En un 20% de los casos puede haber resolución espontánea de la TIA, en particular en la tipo 247.
Cualquiera sea la circunstancia, si la condición cardíaca del paciente lo permite y siempre y cuando el cardiólogo tratante lo considere posible, sería conveniente suspender la amiodarona reemplazándola por otro antiarrítmico49. Esto es especialmente recomendable en pacientes con TIA tipo 17. De todas maneras, hay que tener en cuenta que más allá de su interrupción, la resolución de la tirotoxicosis puede llevar meses (6 a 9 meses) en ausencia de otro tratamiento, debido a la larga vida media de la amiodarona9, 14. Como ya fuera dicho, la amiodarona y su metabolito tienen acciones a nivel cardíaco que pueden, paradojalmente, servir de cierta protección frente a la tirotoxicosis14.
En el tipo 1, se utilizan los antitiroideos en la forma convencional, aunque la respuesta puede ser lenta y puede ser necesaria una dosis de metimazol superior a la habitual9, 10. Esto se debe a que las altas concentraciones intratiroideas de yoduro en pacientes tratados con amiodarona reducen la efectividad de los antitiroideos. Sin embargo, Osman y col.50 han sugerido que la continuidad de la amiodarona no afectaría la respuesta terapéutica a los antitiroideos, proponiendo a los mismos como tratamiento de primera elección. Recordemos que el mecanismo de acción de los antitiroideos comprende en parte competir con el yodo por los residuos tirosilos de la tiroglobulina, lo cual reduce la disponibilidad de yoduro libre para la síntesis hormonal. Por este motivo, puede en ocasiones requerirse dosis de 40 a 60 mg diarios para controlar la tirotoxicosis14, aunque en las formas leves puede lograrse un buen control con dosis bajas de metimazol. En casos más severos puede asociarse perclorato de potasio en dosis de 1000 mg/día, dividida en dos tomas, durante aproximadamente 15 a 45 días7, 9, 10, 51. El perclorato bloquea la entrada de yoduro reduciendo el pool intratiroideo del mismo, aumentando de esta forma la eficacia terapéutica de los antitiroideos52, 53. Si la dosis de perclorato no supera los 1000 mg/día y el tratamiento no se prolonga por más de 30 a 45 días, es poco probable que aparezcan reacciones adversas severas, como anemia aplásica52, 53. El uso terapéutico del perclorato está muy difundido en Europa pero no está disponible en EEUU ni en muchos otros países. Desde los reportes iniciales en los años 60' de anemia aplásica, no se han descripto nuevos casos desde su reintroducción al campo terapéutico54. Tras la interrupción del perclorato, el metimazol será mantenido durante varios meses si el paciente continúa bajo tratamiento con amiodarona. Se ha sugerido también el uso de carbonato de litio asociado a antitiroideos, con el objeto de reducir la liberación glandular de hormonas tiroideas (dosis de 900 a 1350 mg/día durante 4 a 6 semanas)9, 55. La normalización de la función tiroidea (T3 y T4 normales, yodurias menores a 250 μg/día), al suspenderse la amiodarona, puede demandar 6 a 18 meses. De acuerdo a la evolución, si la amiodarona no puede interrumpirse y fracasa el tratamiento médico, en particular en presencia de bocio difuso o nodular, podrá considerarse la tiroidectomía casi total, aunque el riesgo quirúrgico puede estar aumentado por la cardiopatía de base7, 9, 44. La tiroidectomía es un tratamiento altamente efectivo para la TIA, aunque la experiencia es aún relativamente limitada, con pocos casos descriptos en la literatura y con una incidencia de morbilidad y mortalidad peri-operatorias relativamente elevadas. Las indicaciones más apropiadas del tratamiento quirúrgico de la TIA que han sido propuestas son56-61:
- Imposibilidad de suspender la amiodarona
- Descompensación cardíaca
- Falta de respuesta al tratamiento de la tirotoxicosis
- Intolerancia y/o reacciones adversas al tratamiento con antitiroideos
- El grado de severidad de la condición cardíaca y tiroidea del paciente
La tiroidectomía bajo anestesia local en pacientes cardíacos críticos con tirotoxicosis inducida por amiodarona puede ser una alternativa muy útil62. Los resultados obtenidos son alentadores con buena tolerancia al procedimiento y sin complicaciones62. En circunstancias muy especiales, tales como la imposibilidad de controlar la arritmia con otros antiarrítmicos o si la cirugía está contraindicada, podrá recurrirse al 131I para el control definitivo de la tirotoxicosis11, 63. Esto puede obtenerse si la captación del radioyodo es suficientemente alta (> 10%); aunque generalmente los pacientes con TIA suelen tener una captación de radioyodo bloqueada11, 63. Hemos tenido la propia experiencia en casos aislados, como también se relata en la literatura64, del uso de radioyodo en casos esporádicos de TIA, incluso con captaciones < 10% y administrando una dosis de alrededor de 800 MBq (20 mCi) de 131I. En aquellos casos en que pueda suspenderse la amiodarona, la radioablación es una opción terapéutica definitiva muy eficaz para prevenir la recurrencia de TIA en pacientes que requieran la reintroducción de la amiodarona en taquiarritmias resistentes a otros tratamientos63, 65. También se ha propuesto más recientemente la administración de TSH recombinante humana en dos dosis de 0,1 mg por vía intramuscular, con el objetivo de incrementar la captación y efectividad terapéutica del radioyodo66, 67. Sin embargo, este esquema debe aplicarse con suma cautela porque, a pesar de la poca experiencia disponible, puede producirse un agravamiento de la tirotoxicosis y de la condición cardiaca subyacente67.
Con respecto a la TIA tipo 2, se obtiene generalmente una buena respuesta con glucocorticoides en dosis iniciales de prednisona de 0.5-0.7 mg/kg peso/día durante 2 a 3 meses33. Si la amiodarona es interrumpida, en muchos casos se recupera el eutiroidismo entre los 3 a 5 meses de la suspensión. Con la normalización de la función tiroidea es importante realizar un control periódico por la posible progresión al hipotiroidismo. La suspensión de la amiodarona en estos casos puede no ser necesaria. Se ha descripto remisión y mantenimiento del eutiroidismo luego del tratamiento con glucocorticoides pese a la continuación de la amiodarona22, 50. Algunos autores han propuesto también una combinación de antitiroideos y glucocorticoides68 o de antitiroideos con ácido iopanoico para el manejo de la TIA tipo 269. Sin embargo, Bogazzi y col. observaron una mayor eficacia terapéutica con los glucocorticoides en comparación, tanto con el ácido iopanoico70 (no se comercializa más en Argentina) como con las tionamidas71. También se ha propuesto el uso de radioyodo en ciertos casos de TIA tipo 272.
¿Cómo manejar aquellas formas mixtas o situaciones de diagnóstico incierto? Una propuesta es iniciar metimazol 40 mg/día asociado a prednisona 40 mg/día. Realizar control hormonal en aproximadamente dos semanas. Un descenso en los niveles séricos de T3, sugiere una TIA tipo 2; por lo que se podrá disminuir el metimazol hasta suspenderlo. Una respuesta parcial o insuficiente sugiere una TIA tipo 1. En este caso se suspenden los glucocorticoides y, dependiendo de la evolución, se agregará perclorato o se optará por un tratamiento definitivo73.
Se ha intentado establecer algoritmos diagnósticos y terapéuticos a través de distintos cuestionarios implementados por sociedades científicas de Europa, Norteamérica y Latinoamérica. Las conclusiones de dichas propuestas y preferencias en el tratamiento de la TIA se resumen en la Tabla 7 74-76. En síntesis, no se dispone de estudios clínicos randomizados controlados que avalen un algoritmo terapéutico. La propuesta de Han y col.73 en pacientes con diagnóstico incierto del tipo de TIA nos parece aceptable y de fácil ejecución.
TABLA 7.- Preferencias en el tratamiento de la TIA de acuerdo a distintas encuestas realizadas en Norte América, Europa y Latinoamérica74-76

El futuro nos depara la posibilidad de reemplazar a la amiodarona por análogos efectivos no yodados como la dronedarona. Este fármaco contiene un grupo metano sulfonilo (Fig. 3) que disminuye la lipofilicidad acortando la vida media y disminuyendo la acumulación tisular7, 73. La dronedarona comparte los efectos antiarrítmicos de la amiodarona. Es un antagonista selectivo TRα1 pero a diferencia de la amiodarona no inhibe la unión de la T3 a TRβ1. Puede inducir entonces una condición de hipotiroidismo-símil a nivel cardíaco como la amiodarona7. Comparada con placebo, la dronedarona fue más efectiva en controlar la fibrilación auricular como así también en disminuir la incidencia de sus complicaciones77, 78. La incidencia de hipo e hipertiroidismo en pacientes tratados con dronedarona no fue hasta ahora mayor al grupo tratado con placebo77, 78. La dronedarona ha sido aprobada por la FDA (Food and Drug Administration, EE.UU.) para el tratamiento de la fibrilación auricular y el aleteo auricular en julio de 2009. En un estudio aleatorizado, doble ciego, se evaluó la efectividad terapéutica de la dronedarona vs. amiodarona en 504 pacientes con fibrilación auricular por un período de seis meses. Se evaluó la función tiroidea en todos los pacientes pre-tratamiento. Si bien la amiodarona fue más efectiva (menor recurrencia de fibrilación auricular), la dronedarona mostró un mejor perfil de seguridad con menores complicaciones tiroideas y neurológicas y ausencia de interacciones farmacológicas con los anticoagulantes orales. La incidencia de TIA en sujetos basalmente eutiroideos, fue del 6% en los tratados con amiodarona y del 1% en los que recibieron dronedarona79. Así, la dronedarona (aún no en venta en la Argentina) sería la mejor opción para aquellos pacientes con arritmias graves que tengan un riesgo mayor de desarrollar disfunción tiroidea inducida por amiodarona11.

Fig. 3.- Estructura química de la dronedarona
Conclusiones y recomendaciones
La amiodarona es una droga altamente eficaz para el control de arritmias cardíacas severas pero presenta una gran variedad de reacciones adversas. La disfunción tiroidea se observa en el 15-20% de los pacientes tratados. El hipotiroidismo inducido por amiodarona es más frecuente y generalmente de fácil control. La tirotoxicosis inducida por amiodarona representa un verdadero desafío para el médico tratante debido a las dificultades diagnósticas y terapéuticas que usualmente ofrece. Por tanto, es importante descartar patología tiroidea antes de indicar amiodarona y efectuar en los sujetos eutiroideos un estrecho monitoreo semestral una vez iniciado el tratamiento. La introducción de la dronedarona ofrece una buena alternativa terapéutica en aquellos pacientes con mayor riesgo de desarrollar disfunción tiroidea inducida por amiodarona.
Conflictos de interés: El Dr. Leonardo F. L. Rizzo es Director Médico de Química Montpellier S.A.
1. Ryan LE, Braverman LE, Cooper DS, Ladenson PW, Kloos RT. Can amiodarone be restarted after amiodarone-induced thyrotoxicosis? Thyroid 2004; 14: 149-53. [ Links ]
2. Singh BN. Amiodarone: historical development and pharmacologic profile. Am Heart J 1983; 106: 788-97. [ Links ]
3. Rosenbaum MB, Chiale PA, Halpern MS, et al. Clinical efficacy of amiodarone as an antiarrhythmic agent. Am J Cardiol 1976; 38: 934-44. [ Links ]
4. Vaughan Williams EM. Classifying antiarrhytmic actions: by facts or speculation J Clin Pharmacol 1992; 32: 964-77. [ Links ]
5. Nattel S, Talajic M, Fermini B, Roy D. Amiodarone: Pharmacology, clinical actions, and relationships between them. J Cardiovasc Electrophysiol 1992; 3: 266-80. [ Links ]
6. Harjai KJ, Licata AA. Effects of amiodarone on thyroid function. Ann Intern Med 1997; 126: 63-73. [ Links ]
7. Eskes SA, Wiersinga WM. Amiodarone and thyroid. Best Pract Res Clin Endocrinol Metab 2009; 23: 735-51. [ Links ]
8. Figge HL, Figge J. The effects of amiodarone on thyroid hormone function: A review of the physiology and clinical manifestations. J Clin Pharmacol 1990; 30: 588-95. [ Links ]
9. Martino E, Bartalena L, Bogazzi F, Braverman LE. The effects of amiodarone on the thyroid. Endocr Rev 2001; 22: 240-54. [ Links ]
10. Bogazzi F, Bartalena L, Gasperi M, Braverman LE, Martino E. The various effects of amiodarone on thyroid function. Thyroid 2001; 11: 511-19. [ Links ]
11. Conen-Lehman J, Dahl P, Danzi S, Klein I. Effects of amiodarone therapy on thyroid function. Nat Rev Endocrinol 2010; 6: 34-41. [ Links ]
12. Van Erven L, Schalij MJ. Amiodarone: an effective antiarrhythmic drug with unusual side effects. Heart 2010; 96: 1593-600. [ Links ]
13. Wolf J, Chaikoff IL. The temporary nature of the inhibitory action of excess iodide on organic iodine synthesis in the normal thyroid. Endocrinology 1949; 45: 504-13. [ Links ]
14. Newman CM, Price A, Davies DW, Gray TA, Weetman AP. Amiodarone and the thyroid: a practical guide to the management of thyroid dysfunction induced by amiodarone therapy. Heart 1998; 79: 121-7. [ Links ]
15. St Germain DL, Galton VA, Hernández A. Defining the roles of the iodothyronine deiodinases: Current concepts and challenges. Endocrinology 2009; 150: 1097-107. [ Links ]
16. Bianco AC, Kim BW. Deiodinases: implications of the local control of thyroid hormone action. J Clin Invest 2006; 116: 2571-9. [ Links ]
17. Rosene ML, Wittmann G, Arrojo e Drigo R, et al. Inhibition of the type 2 iodothyronine deiodinase underlies the elevated plasma TSH associated with amiodarone treatment. Endocrinology 2010; 151: 5961-70. [ Links ]
18. Loh KC. Amiodarone-induced thyroid disorders: a clinical review. Postgrad Med J 2000; 76: 133-40. [ Links ]
19. Van Beeren HC, Bakker O, Wiersinga WM. Structure-function relationship of the inhibition of the 3,5,3' -triiodothyronine binding to the alpha 1- and beta 1-thyroid hormone receptor by amiodarone analogs. Endocrinology 1996; 137: 2807-14. [ Links ]
20. Martino E, Safran M, Aghini-Lombardi F, et al.. Environmental iodine intake and thyroid dysfunction during chronic amiodarone therapy. Ann Intern Med 1984; 101: 28-34. [ Links ]
21. Rizzo L, Niepomniszcze H. Tirotoxicosis: definición, etiología, clínica, enfoque diagnóstico. In: Gauna A, Sánchez A, Novelli JL eds. Hipertiroidismo. Rosario: UNR Editora, 2008, p 65-78. [ Links ]
22. Trip MD, Wiersinga WM, Plomp TA. Incidence, predictability and pathogenesis of amiodarone-induced thyrotoxicosis and hypothyroidism. Am J Med 1991; 91: 507-11. [ Links ]
23. Pazin-Filho A, de Jesus AMX, Magalhaes PKR, et al. How frequently should a patient taking amiodarone be screened for thyroid dysfunction? Braz J Med Biol Res 2009; 42: 744-9. [ Links ]
24. Kurnik D, Loebstein R, Farfel Z, et al. Complex drug-drug-disease interactions between amiodarone, warfarin, and the thyroid gland. Medicine 2004; 83: 107-13. [ Links ]
25. Batcher EL, Tang XC, Singh BN, et al. Thyroid function abnormalities during amiodarone therapy for persistent atrial fibrillation. Am J Med 2007; 120: 880-5. [ Links ]
26. Mariotti S, Loviselli A, Murenu S, et al. High prevalence of thyroid dysfunction in adult patients with beta-thalassemia major submitted to amiodarone treatment. J Endocrinol Invest 1999; 22: 55-63. [ Links ]
27. Luciani R, Falcone C, Principe F, Punzo G, Mené P. Acute renal failure due to amiodarone-induced hypothyroidism. Clin Nephrol 2009; 72: 79-80. [ Links ]
28. Basaria S, Cooper DS. Amiodarone and the thyroid. Am J Med 2005; 118: 706-14. [ Links ]
29. Rizzo L. Hipotiroidismo inducido por fármacos. In: Niepomniszcze H, Novelli JL eds. Hipotiroidismo. Rosario: UNR Editora, 2009, p 215-23. [ Links ]
30. Bogazzi F, Bartalena L, Dell'Unto E, et al. Proportion of type 1 and type 2 amiodarone-induced thyrotoxicosis has changed over a 27-year period in Italy. Clin Endocrinol (Oxf) 2007; 67: 533-7. [ Links ]
31. O'Sullivan AJ, Lewis M, Diamond T. Amiodarone-induced thyrotoxicosis: left ventricular dysfunction is associated with increased mortality. Eur J Endocrinol 2006; 154: 533-6. [ Links ]
32. Daniels GH. Amiodarone-induced thyrotoxicosis. J Clin Endocrinol Metab 2001; 86: 3-8. [ Links ]
33. Bogazzi F, Bartalena L, Martino E. Approach to the patient with amiodarone-induced thyrotoxicosis. J Clin Endocrinol Metab 2010; 95: 2529-35. [ Links ]
34. Chiovato L, Martino E, Tonacchera M, et al. Studies on the in vitro cytotoxic effect of amiodarone. Endocrinology 1994; 134: 2277-82. [ Links ]
35. Cappiello E, Boldorini R, Tosoni A, Piraneo S, Bernasconi R, Raggi U. Ultrastructural evidence of thyroid damage in amiodarone-induced thyrotoxicosis. J Endocrinol Invest 1995; 18: 862-8. [ Links ]
36. Brennan MD, Erickson DZ, Carney JA, Bahn RS. Nongoitrous amiodarone-associated thyrotoxicosis: evidence of follicular disruption in vitro and in vivo. Thyroid 1995; 5: 177-83. [ Links ]
37. Nakajima K, Yamazaki K, Yamada E, et al. Amiodarone stimulates interleukin-6 production in cultured human thyocytes, exerting cytotoxic effects on thyroid follicles in suspension culture. Thyroid 2001; 11: 101-9. [ Links ]
38. Trivalle C, Doucet J, Chassagne P, et al. Differences in the signs and symptoms of hyperthyroidism in older and younger patients. J Am Geriatr Soc 1996; 44: 50-3. [ Links ]
39. Conen D, Melly L, Kaufmann C, et al. Amiodarone-induced thyrotoxicosis: clinical course and predictors of outcome. J Am Coll Cardiol 2007; 49: 2350-5. [ Links ]
40. Kurt IH, Yigit T, Karademir BM. Atrial fibrillation due to late amiodarone-induced thyrotoxicosis. Clin Drug Investig 2008; 28: 527-31. [ Links ]
41. Yiu KH, Jim MH, Siu CW, et al. Amiodarone-induced thyrotoxicosis is a predictor of adverse cardiovascular outcome. J Clin Endocrinol Metab 2009; 94: 109-14. [ Links ]
42. Bartalena L, Grasso L, Brogioni S, Aghini-Lombardi F, Braverman LE, Martino E. Serum interleukin-6 in amiodarone-induced thyrotoxicosis. J Clin Endocrinol Metab 1994; 78: 423-7. [ Links ]
43. Bartalena L, Brogioni S, Grasso L, et al. Interleukin-6: A marker of thyroid-destructive processes? J Clin Endocrinol Metab 1994; 79: 1424-7. [ Links ]
44. Erdogan MF, Güleç S, Tutar E, Baskal N, Erdogan G. A stepwise approach to the treatment of amiodarone-induced thyrotoxicosis. Thyroid 2003; 13: 205-9. [ Links ]
45. Martino E, Aghini-Lombardi F, Lippi F, et al. Twenty-four hour radioactive iodine uptake in 35 patients with amiodarone associated thyrotoxicosis. J Nucl Med 1985; 26: 1402-7. [ Links ]
46. Bogazzi F, Bartalena L, Brogioni S, et al. Color flow Doppler sonography rapidly differentiates type I and II amiodarone-induced thyrotoxicosis. Thyroid 1997; 4: 541-5. [ Links ]
47. Eaton SE, Euinton HA, Newman CM, Weetman AP, Bennet WM. Color-flow Doppler sonography may help to distinguish between iodine-induced and thyroiditis-induced hyperthyroidism in patients treated with amiodarone. Clin Endocrinol (Oxf) 2002; 56: 33-8. [ Links ]
48. Piga M, Cocco MC, Serra A, Boi F, Loy M, Mariotti S. The usefulness of 99mTc-sestaMIBI thyroid scan in the differential diagnosis and management of amiodarone-induced thyrotoxicosis. Eur J Endocrinol 2008; 159: 423-9. [ Links ]
49. Bartalena L, Brogioni S, Grasso L, Bogazzi F, Burelli A, Martino E. Treatment of amiodarone-induced thyrotoxicosis, a difficult challenge: Results of a prospective study. J Clin Endocrinol Metab 1996; 81: 2930-3. [ Links ]
50. Osman F, Franklyn JA, Sheppard MC, Gammage MD. Successful treatment of amiodarone-induced thyrotoxicosis. Circulation 2002; 105: 1275-7. [ Links ]
51. Franklyn JA, Sheppard MA. Amiodarone and thyroid dysfunction. Trends Endocrinol. Metabol 1993; 4: 128-31. [ Links ]
52. Wolff J. Perchlorate and the thyroid gland. Pharmacol Rev 1998; 50: 89-105. [ Links ]
53. Martino E, Aghini-Lombardi F, Mariotti S, et al. Treatment of amiodarone associated thyrotoxicosis by simultaneous administration of potassium perchlorate and methimazole. J Endocrinol Invest 1986; 9: 201-7. [ Links ]
54. Barbesino G. Drugs affecting thyroid function. Thyroid 2010; 20: 763-70. [ Links ]
55. Dickstein G, Schechner C, Adawi F, Kaplan J, Baron E, Ish-Shalom S. Lithium treatment in amiodarone-induced thyrotoxicosis. Am J Med 1997; 102: 454-8. [ Links ]
56. Houghton SG, Farley DR, Brennan MD, van Heerden JA, Thompson GB, Grant CS. Surgical management of amiodarone-associated thyrotoxicosis: Mayo Clinic experience. World J Surg 2004; 28:1083-7. [ Links ]
57. Gough J, Gough IR. Total thyroidectomy for amiodarone-associated thyrotoxicosis in patients with severe cardiac disease. World J Surg 2006; 30: 1957-61. [ Links ]
58. Pratap R, Qayyum A, Ahmad N, Jani P. Surgical management of amiodarone-induced thyrotoxicosis in a patient with Eisenmenger's syndrome: literature review and case report. J Laryngol Otol 2009; 123: 1276-9. [ Links ]
59. Franzese CB, Fan CY, Stack BC Jr. Surgical management of amiodarone-induced thyrotoxicosis. Otolaryngol Head Neck Surg 2003; 129: 565-70. [ Links ]
60. Sato K, Omi Y, Kodama H, et al. Differential diagnosis and appropriate treatment of four thyrotoxic patients with Graves' disease required to take amiodarone due to life-threatening arrhythmia. Inter Med 2008; 47: 757-62. [ Links ]
61. Mehta AN, Vallera RD, Tate CR, Sager RA, Welch BJ. Total thyroidectomy for medically refractory amiodarone-induced thyrotoxicosis. Proc (Bayl Univ Med Cent) 2008; 21: 382-5. [ Links ]
62. Williams M, Lo Gerfo P. Thyroidectomy using local anesthesia in critically ill patients with amiodarone-induced thyrotoxicosis: A review and description of the technique. Thyroid 2002; 12: 523-5. [ Links ]
63. Padmanabhan H. Amiodarone and thyroid dysfunction. South Med J 2010; 103: 922-30. [ Links ]
64. Czarnywojtek A, Czepcynski R, Ruchala M, et al. Radioiodine therapy in patients with amiodarone-induced thyrotoxicosis (AIT). Neuro Endocrinol Lett 2009; 30: 209-14. [ Links ]
65. Hermida JS, Jarry G, Tcheng E, et al. Radioiodine ablation of the thyroid to allow the reintroduction of amiodarone treatment in patients with a prior history of amiodarone-induced thyrotoxicosis. Am J Med 2004; 116: 345-8. [ Links ]
66. Albino CC, Paz-Filho G, Graf H. Recombinant human TSH as an adjuvant to radioiodine for the treatment of type 1 amiodarone-induced thyrotoxicosis (AIT). Clin Endocrinol (Oxf) 2009; 70: 810-1. [ Links ]
67. Bogazzi F, Tomisti L, Ceccarelli C, Martino E. Recombinant human TSH as an adjuvant to radioiodine for the treatment of type 1 amiodarone-induced thyrotoxicosis: a cautionary note. Clin Endocrinol (Oxf) 2010; 72: 133-4. [ Links ]
68. Broussole C, Ducottet X, Martin C, et al. Rapid effectiveness of prednisone and thionamides combined therapy in severe amiodarone iodine induced thyrotoxicosis. Comparison of two groups of patients with apparently normal thyroid glands. J Endocrinol Invest 1989; 12: 37-42. [ Links ]
69. Chopra IJ, Baber K. Use of oral cholecystographic agents in the treatment of amiodarone-induced hyperthyroidism. J Clin Endocrinol Metab 2001; 86: 4707-10. [ Links ]
70. Bogazzi F, Bartalena L, Cosci C, et al. Treatment of type II amiodarone-induced thyrotoxicosis by either iopanoic acid or glucocorticoids: A prospective, randomized study. J Clin Endocrinol Metab 2003; 88: 1999-2002. [ Links ]
71. Bogazzi F, Tomisti L, Rossi G, et al. Glucocorticoids are preferable to thionamides as first-line treatment for amiodarone-induced thyrotoxicosis due to destructive thyroiditis: a matched retrospective cohort study. J Clin Endocrinol Metab 2009; 94: 3757-62. [ Links ]
72. Gursoy A, Tutuncu NB, Gencoglu A, Anil C, Demirer AN, Demirag NG. Radioactive iodine in the treatment of type-2 amiodarone-induced thyrotoxicosis. J Natl Med Assoc 2008; 100: 716-9. [ Links ]
73. Han TS, Williams GR, Vanderpump MP. Benzofuran derivatives and the thyroid. Clin Endocrinol (Oxf) 2009; 70: 2-13. [ Links ]
74. Diehl LA, Romaldini JH, Graf H, et al. Management of amiodarone-induced thyrotoxicosis in Latin America: an electronic survey. Clin Endocrinol (Oxf) 2006; 65: 433-8. [ Links ]
75. Bartalena L, Wiersinga WM, Tanda ML, et al. Diagnosis and management of amiodarone-induced thyrotoxicosis in Europe: results of an international survey among members of the European Thyroid Association. Clin Endocrinol (Oxf) 2004; 61: 494-502. [ Links ]
76. Tanda ML, Piantanida E, Lai A, et al. Diagnosis and management of amiodarone-induced thyrotoxicosis: similarities and differences between North American and European thyroidologists. Clin Endocrinol (Oxf) 2008; 69: 812-8. [ Links ]
77. Singh BN, Connolly SJ, Crijns HJ, et al. Dronedarone for maintenance of sinus rhythm in atrial fibrillation or flutter. N Engl J Med 2007; 357: 987-99. [ Links ]
78. Hohnloser SH, Crijns HJ, van Eickels M, et al. Effect of dronedarone on cardiovascular events in atrial fibrillation. N Engl J Med 2009; 360: 668-78. [ Links ]
79. Le Heuzy JI, De Ferrari GM, Radzik D, Santini M, Zhu J, Davy JM. A short-term randomized, double-blind, parallel-group study to evaluate the efficacy and safety of dronedarone versus amiodarone in patients with persistent atrial fibrillation: The DIONYSOS Study. J Cardiovasc Electrophysiol 2010; 21: 597-605. [ Links ]
Recibido: 1-9-2011
Aceptado: 24-10-2011














