Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Medicina (Buenos Aires)
versión impresa ISSN 0025-7680
Medicina (B. Aires) vol.72 no.2 Ciudad Autónoma de Buenos Aires mar./abr. 2012
ARTÍCULO ESPECIAL
El litio y su relación con la acuaporina-2 y el canal de sodio ENaC
Luciano Galizia, Gabriela I. Marino, Basilio A. Kotsias
Laboratorio de Canales Iónicos, Instituto de Investigaciones Médicas Alfredo Lanari, Universidad de Buenos Aires, IDIM-CONICET
Dirección postal: Dr. Luciano Galizia, Laboratorio de Canales Iónicos, Instituto de Investigaciones Médicas Alfredo Lanari, Combatientes de Malvinas 3150, 1427 Buenos Aires, Argentina
e-mail: lgalizia@gmail.com
Resumen
Desde hace más de cuarenta años que el litio es usado para el tratamiento de la enfermedad bipolar; recientes estudios sugieren también su utilidad en el trastorno cognitivo mínimo tipo amnésico. El litio es filtrado en el glomérulo y un 65-75% del mismo es reabsorbido en el túbulo contorneado proximal y en el asa ascendente de Henle por el transportador Na+, K+, 2Cl- y vía paracelular. Una pequeña fracción del litio entra en las células principales del túbulo colector por medio del canal epitelial de sodio sensible al amiloride (ENaC) localizado en la membrana apical de la célula. Luego de 10- 20 años de tratamiento con litio los enfermos pueden desarrollar poliuria, acidosis tubular e insuficiencia renal crónica que puede terminar en una forma de diabetes que no responde a la arginina vasopresina llamada diabetes insípida nefrogénica. Se cree que estas fallas renales son consecuencias de una reducción en el número de moléculas de acuaporina 2 en la membrana apical. Las causas para esto son complejas. El litio es un poderoso inhibidor de la isoforma beta de la enzima glicógeno sintetasa quinasa y esto está asociado a una menor actividad de la adenilato ciclasa que lleva a una disminución en la concentración intracelular de cAMP. Esto finalmente interferiría con la síntesis de nuevas moléculas de acuaporina 2 y con el tráfico de ellas desde la zona subapical de la célula hacia la membrana celular, causando la disminución en la reabsorción de agua en la parte distal del nefrón.
Palabras clave: Litio; Canal epitelial de sodio; Acuaporina 2; Diabetes insípida nefrogénica
Abstract
Lithium and its relation with the epithelial sodium channel and aquaporin-2. For more than 40 years lithium has been used to treat bipolar disorder and recent trials suggest a potential efficacy also in the treatment of the amnestic mild cognitive impairment. Lithium is filtered by the glomerulus and 65% - 75% of the filtered amount is reabsorbed along the proximal tubule and in the thick ascending limb of Henle's loop by the Na+, K+, 2Cl- transporter and via paracellular. A small fraction of lithium is reabsorbed in the collecting duct's principal cells through the epithelial Na channel (ENaC) located on the apical side of the cells. Polyuria, renal tubular acidosis and chronic renal failure are the most frequent adverse effects of lithium after 10-20 years of treatment and these alterations can reach to a vasopressin nonresponding form of diabetes insipidus entity called nephrogenic diabetes insipidus. It is believed that the molecular mechanisms of these renal changes are related to a reduction in the number of aquaporin-2 inserted in the apical membrane of the cells. The causes of this are complex. Lithium is a powerful inhibitor of the enzyme glycogen synthase kinase 3β and this is associated with a lower activity of adenylate cyclase with a reduction in the cAMP levels inside of the cells. The latter may interfere with the synthesis of aquaporin-2 and also with the traffic of these molecules from the subapical site to membrane promoting the impairment of water reabsorption in the distal part of the kidney.
Key words: Lithium; Epithelial sodium channel; Aquaporin 2; Nephrogenic diabetes insipidus
En 1949 se publicó el artículo de John Cade1 sobre el uso del litio para el tratamiento de la enfermedad maníaco depresiva o enfermedad bipolar; su introducción al arsenal terapéutico junto con la clorpromazina revolucionó la psiquiatría del siglo XX. Con el litio está relacionado este artículo, en particular con sus efectos tóxicos sobre el riñón que se manifiestan luego de 10-20 años de tratamiento. Nos referiremos además a la participación del canal de sodio sensible al amiloride (ENaC) y a la acuaporina 2 en el desarrollo de la anormal función renal. Entre el 20 y el 40% de los pacientes tratados con litio sufren poliuria, acidosis tubular e insuficiencia renal crónica, y la incapacidad de concentrar la orina puede desembocar en un cuadro conocido como diabetes insípida nefrogénica2. En la anatomía patológica el daño renal se evidencia como una fibrosis intersticial, glomeruloesclerosis focal y segmentada y quistes. De ahí la importancia del control periódico de la litemia y del filtrado glomerular, dado el estrecho rango terapéutico del litio2, 3.
El litio genera un particular interés debido a su naturaleza: un elemento químico simple, un metal alcalino similar al sodio marcado por su cercanía en la tabla periódica. La concentración de litio basal en sangre proviene del mineral presente en alimentos como lácteos, huevos, azúcar, papas, limones y agua mineral entre otros. La litemia basal es de unos pocos μM/l y la concentración terapéutica para el tratamiento de la enfermedad bipolar es de 1 mM/l4.
El empleo del litio en la enfermedad maníaco depresiva se debió a la conjunción del azar, una asociación de ideas y a poner a prueba las mismas, por el médico australiano John F.J. Cade (1912-1980), Senior Medical Officer, Victoria Department of Mental Hygiene. En el trabajo publicado en The Medical Journal of Australia describe sus inicios en esta investigación mientras estaba interesado en los efectos tóxicos de la urea inyectada en el peritoneo de cobayos, en particular sobre las convulsiones y agravamiento general que conducía a la muerte de los animales. El principal problema para los experimentos era la baja solubilidad del ácido úrico, y Cade encontró que la sal de litio era la más soluble: el azar. Los cobayos inyectados con una mezcla de urea saturada con urato de litio sufrían menos y permanecían vivos. Era claro que el Li+ tenía un efecto protector en los animales. La asociación de ideas fue rápida: utilizó carbonato de litio junto con urea y el resultado fue que los animales no convulsionaban y permanecían en un estado letárgico aunque concientes. En sus palabras:
"It appeared worth while in view of these results to try lithium salts in the treatment of two distinct disorders- firstly mania, in view of their sedative effect; secondly epilepsy, in view of their anti-convulsivant action. With the latter, this paper is not concerned."
El trabajo lista los primeros 10 enfermos tratados con litio, sus efectos beneficiosos y la continuidad de los síntomas si el tratamiento se interrumpía por los efectos adversos de la droga. El éxito no fue inmediato, debido en parte a que el psicoanálisis gozaba de gran prestigio en las grandes capitales del mundo, y recién después de varios años se extendió su uso luego de la confirmación de los resultados en un trabajo doble ciego publicado por Schou en 19545. Hasta aquí la breve reseña histórica.
El Li+ es filtrado en el glomérulo renal, un 70% reabsorbido en el túbulo contorneado proximal y un 20% en el asa de Henle ascendente6, 7. Los mecanismos utilizados son el del transportador Na+, K+, 2Cl- y la vía paracelular. El resto, una pequeña fracción, es transportado en la porción distal del nefrón por medio del canal de sodio sensible al amiloride (ENaC). De esta forma se incorpora a la célula principal, blanco para sus efectos tóxicos renales. Cuando la filtración glomerular está disminuida (insuficiencia renal crónica, hipovolemia, antiinflamatorios no esteroideos) la concentración de litio aumenta y la toxicidad se manifiesta por una disminución en la capacidad de concentrar orina e hipercalcemia.
Entrada del litio a la célula principal
El ENaC es un canal catiónico con gran selectividad sobre el Na+ respecto al K+ aunque es muy permeable al Li+. Se expresa en numerosos tejidos epiteliales y en la placenta. El amiloride, utilizado como diurético, es un potente bloqueante del canal. La Fig. 1 muestra un registro de este canal en células BeWo, derivadas de trofoblasto humano, incubadas con aldosterona; en presencia de 8 Br- cAMP generan corrientes de sodio que son sensibles al amiloride. Se grafican las curvas que asocian la corriente iónica con el voltaje aplicado y en las que se nota que las corrientes son mayores cuando el Li+ es el principal catión extracelular que cuando lo es el Na+, siendo la relación de permeabilidades del Li+ respecto a la del Na+ igual a 1.30, similar a la obtenida en otros tipos celulares8 (Fig. 1).

Fig. 1.- Registro de corriente obtenido en células BeWo derivadas del trofoblasto humano. Las células fueron incubadas en 100 nM de aldosterona por 12 horas y sometidas a pulsos desde +60 hasta -140 mV. Las corrientes fueron normalizadas por la capacitancia de la célula para eliminar el tamaño de las células como fuente de error y expresadas en picoamperes/picofaradios. Los registros se tomaron primero en condiciones control con una solución externa conteniendo Na+ como principal catión, luego del agregado de 8 Br-AMP (un análogo permeable del cAMP que expone los canales ENaC en la membrana celular) y luego del reemplazo del Na+ extracelular por Li+. Es evidente que el agregado del 8Br-cAMP permite la generación de corrientes mucho mayores que en condiciones control y que el reemplazo del Li+ por el Na+ extracelular aumentan aún más las corrientes medidas.
En condiciones normales, la Na-K ATPasa de la membrana basal en los epitelios exporta al medio extracelular el Na+ que entra por el ENaC, pero como la ATPasa tiene muy poca afinidad por el Li+ su concentración no es regulada. Existen datos que señalan al intercambiador Na-H presente en la membrana basolateral como el medio de expulsión del Li+ 9.
Los datos obtenidos con ratones knock out con el gen del ENaC abolido han reforzado la idea que el ENaC es clave para el desarrollo de los efectos tóxicos del litio ya que esos animales tratados con litio no desarrollan la poliuria y disminución en la concentración de orina presentes en los ratones normales10, 11.
Como se comentó, las células principales son el blanco del litio y la desregulación de la acuaporina-2 es un efecto demostrable clave para el desarrollo de la enfermedad renal. Es así que se observa una disminución en la expresión de la acuaporina-2 en diversos tipos celulares. La acuaporina-2 es una proteína regulada por la arginina vasopresina (AVp, ADH). En ausencia de la hormona, la acuaporina-2 se concentra en vesículas en la región subapical de las células principales y se inserta en la membrana apical cuando es estimulada, permitiendo la alta permeabilidad al agua, paso clave para concentrar la orina y por lo tanto en la regulación del agua corporal12. De aquí se entienden las consecuencias cuando la acuaporina no se expresa, como ocurre con la intoxicación por litio.
Acuaporina-2
La acuaporina-2 es una proteína de membrana constituida por cuatro monómeros con 6 dominios transmembrana cada uno, conformando un paso para el agua. La proteína está sometida a cambios post transduccionales por fosforilaciones, ubiquitinaciones y glicosilaciones entre otros procesos que modifican su función, expresión y ubicación en la célula12. En el túbulo colector del riñón su incorporación a la membrana apical desde las vesículas subapicales es estimulada por la hormona arginina vasopresina a través de un mecanismo dependiente de cAMP. La participación de la acuaporina-2 en el proceso de reabsorción de agua debido a la exposición de la membrana apical a disminuciones en la osmolaridad luminal, implica elevados flujos de agua y rápidos cambios de volumen en estas células. En respuesta al hinchamiento osmótico, se ponen en marcha en las células mecanismos de regulación de volumen para los cuales es importante la presencia de la acuaporina-2 en la membrana13-15 (Fig. 2).

Fig. 2.- Participación de la acuaporina-2 en la regulación de volumen celular en un modelo de túbulo colector cortical. En presencia de una solución hipotónica la célula se hincha por el ingreso de agua y luego va recuperando su volumen inicial con la salida de osmolitos por diversos sistemas de transporte que inducen la salida de agua, en un proceso conocido como disminución regulatoria de volumen. Esta regulación está ausente en las células que no expresan acuaporina-2 (menor movimiento de agua y osmolitos, flechas más delgadas) que en presencia de acuaporina-2 (adaptado de Galizia y col.14).
Litio y acuaporina 2
En 1995 Marplet y col.16 describieron la disminución en la expresión de acuaporina-2 en el tejido renal de rata por el tratamiento con litio. El litio es un poderoso inhibidor no competitivo de la isoforma β de la enzima glicógeno sintetasa quinasa (GSQβ). Un trabajo reciente de Kortenoeven et al.17 demuestra que el Li+ disminuye la cantidad de proteína sintetizada y de mRNA de la acuaporina-2 en coincidencia con una reducida expresión de la enzima GSQβ, y esto sería el paso clave para los efectos tóxicos del Li+ sobre el riñón. La inhibición de la enzima lleva a una poliuria y a los cambios proliferativos en el tejido renal que se observan con la intoxicación por litio. Si bien el litio aumenta los niveles de COX-2, los valores de prostaglandinas no cambian, por lo que su efecto sobre la acuaporina-2 es independiente de los valores de enzimas inflamatorias. Rao y col.18 sugieren que la disminución en la expresión de la GSQβ provocaría una baja en los niveles de cAMP en respuesta a la arginina vasopresina, llevando a una disminución total o parcial de la acuaporina-2. Una reducción en el tráfico de moléculas hacia la membrana celular sería otro de los mecanismos por el cual el Li+ disminuye la presencia de acuaporina-2 en las membranas apicales con la consiguiente poliuria al no poder concentrarse la orina. La Fig. 3 es un esquema del mecanismo propuesto para la disminución en la reabsorción de agua en el riñón por efectos del Li+. Podemos resumir entonces que el Li+ ejerce su efecto tóxico en el segmento renal donde existe la acuaporina-2 regulada por la arginina vasopresina. El amiloride, por su capacidad de bloquear el ENaC, podría contrarrestar los efectos tóxicos del Li+ aunque todavía no se ha probado en terapéutica humana.
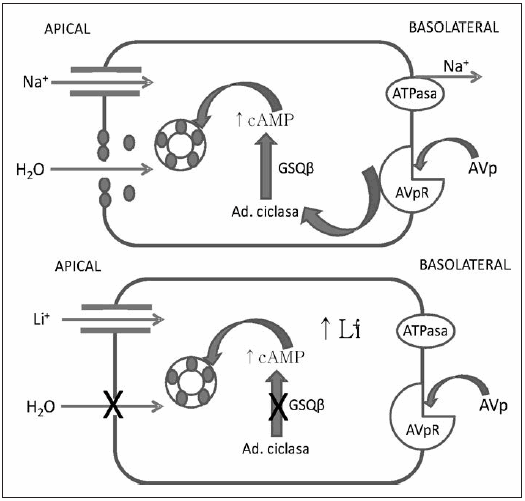
Fig. 3.- Esquema general de una célula principal en condiciones de ausencia (panel superior) y presencia de litio (inferior) y el efecto de la arginina vasopresina sobre la AQP2 (después de Rao y col.18). En condiciones normales (panel superior) la isoforma ββ de la enzima glicógeno sintetasa quinasa (GSQβ) resulta un mediador fundamental en la activación de la adenilato ciclasa. Este paso es necesario para la señalización vía AMP cíclico del tráfico de la acuaporina-2 a la membrana luego de la activación del receptor de arginina vasopresina y garantiza la apropiada reabsorción de agua. En presencia de Li+ (panel inferior) la formación de AMP cíclico se ve reducida, ya que la inhibición de la GSQβ se traduce en un bloqueo de la adenilato ciclasa. De esta manera, aun en presencia de arginina vasopresina, el tráfico de la acuaporina 2 a la membrana no se efectúa y se bloquea la reabsorción de agua.
Además de su utilización en la enfermedad maníaco depresiva, el litio está siendo utilizado en el trastorno cognitivo mínimo tipo amnésico (amnestic mild cognitive impairment), un cuadro que puede desembocar en la enfermedad de Alzheimer19. Por otro lado, Ohgami y col.20 demostraron una relación negativa entre la tasa de suicidios y la concentración de Li+ en el agua potable, sugiriendo que aun muy bajos niveles de Li+ ejercen un efecto protector sobre esta entidad (Nota: no hay datos de esto en el agua corriente de Buenos Aires, fuente AYSA). Las explicaciones para estos efectos escapan al propósito de este trabajo, son complejos y conocidos en forma parcial, involucran el bloqueo del receptor para N-metil-D aspartato e inhibición de la enzima GSK21. De esta forma el litio, a más de 60 años de su descubrimiento como terapéutica en la enfermedad bipolar continúa siendo estudiado por su potencial en otras entidades y, al igual que la aspirina, podría convertirse en un "ión mágico".
Conflictos de intereses: Ninguno. Este trabajo fue financiado por subsidios de la Agencia de Promoción Científica, Consejo Nacional de Investigaciones Científicas y Técnicas y Universidad de Buenos Aires.
1. Cade JFK. Lithium salts in the treatment of psychotic excitement. Med J Austral 1949; 2: 349-52. [ Links ]
2. Trepiccione F, Christensen BM. Lithium-induced nephrogenic diabetes insipidus: new clinical and experimental findings. J Nephrol 2010; 23 (Suppl) 16: S43-8. [ Links ]
3. Jefferson JW. A clinician's guide to monitoring kidney function in lithium-treated patients. J Clin Psychiatry 2010; 71: 1153-7. [ Links ]
4. de Roos NM, de Vries JHM, Katan MB. Serum lithium as a compliance marker for food and supplement intake. Am J Clin Nutrition 2001; 73: 75-9. [ Links ]
5. Schou M. The early european lithium studies. Aust N Z J Psychiatry 1999; 33 (Suppl): S39-47. [ Links ]
6. Unwin RJ, Walter SJ, Shirley DG. Lithium reabsorption in perfused loops of Henle: effects of perfusion rate and bumetanide. Am J Physiol 1994; 266: F806-12. [ Links ]
7. Atherton JC, Doyle A, Gee A, et al. Lithium clearance: modification by the loop of Henle in man. J Physiol 1991; 437: 377-91. [ Links ]
8. del Mónaco S, Assef Y, Kotsias BA. Epithelial sodium channel (ENaC) in a human trophoblast cell line (BeWo). J Membr Biol; 2008: 223: 127-39. [ Links ]
9. Zerbini G, Maestroni A, Mangili R, Pozza G. Amiloride-insensitive Na+-H+ exchange: a candidate mediator of erythrocyte Na+-Li+ countertransport. J Am Soc Nephrol 1998; 9: 2203-11. [ Links ]
10. Christensen BM, Zuber AM, Loffing J, et al. AlphaENaC-mediated lithium absorption promotes nephrogenic diabetes insipidus. J Am Soc Nephrol 2011; 22: 253-61. [ Links ]
11. Grünfeld JP, Rossier BC. Lithium nephrotoxicity revisited. Nat Rev Nephrol 2009; 5: 270-6. [ Links ]
12. Moeller HB, Olesen ET, Fenton RA. Regulation of the water channel aquaporin-2 by posttranslational modification. Am J Physiol Renal Physiol 2011; 300: F1062-73. [ Links ]
13. Ford P, Rivarola V, Chara O, et al. Volume regulation in cortical collecting duct cells: role of AQP2, Biology Cell 2005; 97: 687-97. [ Links ]
14. Galizia L, Pizzoni A, Fernandez J, Rivarola V, Capurro C, Ford P. Functional interaction between AQP2 and TRPV4 in renal cells. J Cell Biochem 2012; 113: 580-9. [ Links ]
15. Galizia L, Flamenco MP, Rivarola V, Capurro C, Ford P. Role of AQP2 in activation of calcium entry by hypotonicity: implications in cell volume regulation. Am J Physiol Renal Physiol 2008; 294: F582-90. [ Links ]
16. Marples D, Christensen S, Christensen EI, Ottosen PD, Nielsen S. Lithium-induced downregulation of aquaporin-2 water channel expression in rat kidney medulla. J Clin Invest 1995; 95: 1838-45. [ Links ]
17. Kortenoeven ML, Schweer H, Cox R, Wetzels JF, Deen PM. Lithium reduces aquaporin-2 transcription independent of prostaglandins. Am J Physiol Cell Physiol 2011; 302: C131-40. [ Links ]
18. Rao R, Patel S, Hao C, Woodgett J, Harris R. GSK3beta mediates renal response to vasopressin by modulating adenylate cyclase activity. J Am Soc Nephrol 2010; 21: 428-37. [ Links ]
19. Forlenza OV, Diniz BS, Radanovic M, Santos FS, Talib LL, Gattaz WF. Disease-modifying properties of long-term lithium treatment for amnestic mild cognitive impairment: randomised controlled trial. Br J Psychiatry 2011; 198: 351-6. [ Links ]
20. Ohgami H, Terao T, Shiotsuki I, Ishii N, Iwata N. Lithium levels in drinking water and risk of suicide. Br J Psychiatry 2009; 194: 464-5. [ Links ]
21. Chiu CT, Chuang DM. Molecular actions and therapeutic potential of lithium in preclinical and clinical studies of CNS disorders. Pharmacol Ther 2010; 128: 281-304. [ Links ]
Recibido: 6-12-2011
Aceptado: 18-1-2012














