Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Medicina (Buenos Aires)
Print version ISSN 0025-7680
Medicina (B. Aires) vol.72 no.4 Ciudad Autónoma de Buenos Aires Aug. 2012
ARTÍCULO ORIGINAL
Obesidad y factores de riesgo del síndrome metabólico en jóvenes con diabetes tipo 1
Mariana Prieto1, Andrea G. Krochik1, Eduardo Chaler2, Mercedes Maceiras2, Anabel Villalba3, Silvina Valdez3, Gloria Cerrone4, Mariana Telechea4, Carmen Mazza1
1Servicio de Nutrición, Hospital de Pediatría SAMIC J. P. Garrahan,
2Laboratorio de Bioquímica, Hospital de Pediatría SAMIC J. P. Garrahan,
3Cátedra de Inmunología, IDEHU, Facultad de Farmacia y Bioquímica, Universidad de Buenos Aires,
4Servicio de Genética, Hospital de Clínicas José de San Martín, Universidad de Buenos Aires
Dirección postal: Dra. Mariana Prieto, Servicio de Nutrición, Hospital de Pediatría SAMIC J. P. Garrahan, Combate de los Pozos 1881, 1245 Buenos Aires, Argentina
Fax: (54-11) 4308-4300 e-mail: prietomar@gmail.com
Resumen
Los cambios en la forma de presentación de la diabetes mellitus tipo 1(DM T1) en la infancia y adolescencia asociados a la obesidad, determinaron una superposición entre los dos tipos de diabetes, con mayor heterogeneidad en su presentación clínica. Con el objetivo de caracterizar el tipo de diabetes mellitus (DM), comienzo de la diabetes, independientemente de las clasificaciones disponibles y evaluar el impacto de la obesidad en la forma de presentación, se estudiaron cincuenta niños diabéticos agrupados según su condición nutricional. Se evaluó la reserva de insulina pancreática por medición de péptido C basal, índice glucemia/péptido C y en respuesta a comida mixta (MMTT), se determinó el genotipo HLA-DQB1 y los anticuerpos GADA, ICA 512, IAA y se evaluó la presencia de factores de riesgo para enfermedad metabólica como obesidad, hipertensión, diabetes y dislipidemia en el grupo familiar. El 38% de la población presentó sobrepeso/obesidad (SP/OB). Un 82% tuvo anticuerpos positivos GADA, ICA 512, IAA sin diferencia significativa entre ambos grupos, el 100% fue positivo para genotipo HLA-DQB1 de riesgo. El 84% de los familiares presentó factores de riesgo positivo para síndrome metabólico. Se dividió a la población en dos grupos (sobrepeso/obesidad vs. normopeso.) No hubo diferencias en los valores de péptido C en ayunas o en el índice glucemia/péptido C entre los dos grupos El péptido C en el MMTT mostró mayor área bajo la curva (1.77 ng/ml vs. 5.5 ng/ml, p = 0.0007) y valores más altos a los 60 y 120 minutos (p: 0.02 y 0.03) en el grupo con SP/OB. En conclusión, los pacientes con diabetes tipo 1A con SP/OB tienen mayor capacidad de respuesta pancreática medida por péptido C, sugiriendo que el estado nutricional podría actuar como acelerador del comienzo clínico de la enfermedad.
Palabras clave: Diabetes en la infancia; Obesidad; Reserva pancreática
Abstract
Obesity and risk factors for metabolic syndrome in young people with type 1 diabetes. Changes in the clinical presentation of diabetes mellitus in childhood and adolescence associated with obesity have resulted in an overlap of the two most common types of diabetes with a greater clinical heterogeneity. In order to characterize the type of diabetes at onset and assess the effect of obesity, 50 children with diabetes were studied. The patients were divided into two groups according to their nutritional status at diagnosis (overweight/obese vs. normal weight). Insulin reserve was evaluated by measuring basal C-peptide and stimulated C-peptide in response to a mixed meal (MMTT) as well as HLA-DQB1 genotype, antibodies, and family history of risk factors for metabolic disease. Of all 50 patients, 38% was overweight /obese, 84% had a positive family history of metabolic syndrome, 82% had positive antibodies, and 100% were positive for the high-risk HLA-DQB1 genotype. No significant differences were found in fasting C-peptide or glycemic index/C-peptide levels between the two groups. In the overweight/obese group C-peptide response to MMTT showed higher levels at 60 and 120 minutes (p = 0.02 and 0.03) and the area under the curve for C-peptide was also higher (1.77 ng / ml vs. 5.5 ng/ml, p = 0.0007) than in the normal-weight group. In conclusion, overweight/obese patients with type 1A diabetes had a greater pancreatic reserve, suggesting that nutritional status may accelerate disease onset.
Key words: Diabetes in children; Obesity; Beta-cell reserve
Los procesos etiológicos involucrados en el desarrollo de la diabetes mellitus (DM) son variados y no totalmente conocidos, permitiendo agrupar a gran parte de los casos dentro de dos categorías etiopatogénicas: la DMT1, con deficiencia absoluta de secreción insulínica, en la mayoría de los casos originada por un proceso autoinmune, denominándose en ese caso la DM tipo 1A (DMT1A), o sin proceso autoinmune demostrado, denominándose 1B (DMT1B) y en segundo lugar, la diabetes tipo 2 (DMT2), en la que se combinan la resistencia periférica a la insulina y una respuesta secretoria compensatoria insuficiente.
Si bien hasta hace algunos años la mayor parte de los niños con diabetes eran incluidos en el primer grupo, el mejor conocimiento de los mecanismos etiopatogénicos subyacentes y los cambios ocurridos con la epidemia de obesidad extendida a la población infanto-juvenil, han permitido observar que la DM en la población pediátrica al igual que en los adultos, también está constituida por un grupo heterogéneo desde el punto de vista clínico y etiológico1. Algunas evidencias al respecto son las siguientes: 1) existen grandes diferencias en la prevalencia de las formas mayores de diabetes entre diferentes gruposétnicos habiéndose comunicado en Texas (EE.UU.) en hispánicos2, en afroamericanos3 y en orientales4 (Japón) que la destrucción de células beta puede presentarse con insulinopenia aguda y rápida progresión a cetosis, sin evidencias de auto inmunidad; 2) se observan grandes variaciones fenotípicas con un amplio rango en el que los extremos están constituidos por las formas de presentación clásicas: delgados, con tendencia a la cetosis e insulino depencia y OB, con menor tendencia a la cetosis y mayor insulino-resistencia; 3) existe un incremento concomitante de la incidencia de DMT1 y DMT2 a edades cada vez menores, acorde con el aumento de la incidencia de OB en niños y 4) numerosos estudios epidemiológicos encuentran que la genética no permite distinguir entre las dos formas de DM1.
Estas evidencias sugieren que, clasificar a los niños desde el punto de vista etiopatogénico, en DM tipo 1A, 1B y tipo 2 de acuerdo a la presentación clínica al inicio, en algunos casos no es posible. Aun cuando los pacientes se presenten con igual clínica, y teniendo en cuenta que el tipo 1-A o autoinmune parece ser el más frecuente, deben ser consideradas otras formas de DM, incluso con mecanismos etiopatogénicos yuxtapuestos.
Para el diagnóstico de DM 1A, tres anticuerpos son los de mayor utilidad: los anticuerpos contra la decarboxilasa del ácido glutámico (GADA), presentes en el 70 a 80% de los pacientes con reciente diagnóstico, los anticuerpos anti ICA512 o IA-2, una proteína transmembrana de la familia de la tirosin-fosfatasa, presentes en el 60 a 70% de los pacientes recientemente diagnosticados y los anticuerpos anti auto-insulina (IAA), cuya prevalencia varía de acuerdo a la edad de comienzo de la enfermedad, siendo más frecuentes entre los menores de 10 años. Alrededor de un 90% presentan uno o más de estos anticuerpos. El porcentaje de positividad depende de varios factores como la edad de los sujetos, la duración de la enfermedad y el origen étnico.
Si bien la diabetes es una enfermedad poligénica, los genes del HLA clase II contribuyen en un 50% al riesgo genético de la misma5, encontrándose en el 95% de los pacientes con diabetes tipo 1A los haplotipos DQA1 *0301 DQB1 *0302 combinados con DQA1 *0501 DQB1 *0201. En esta forma de diabetes, la tasa de destrucción de células beta es variable, rápida en algunos individuos con tendencia a la cetoacidosis y lenta en otros. Algunas líneas de evidencia sugieren que la autoinmunidad no es la única causa de destrucción de células beta, en este sentido la Asociación Americana de Diabetes(ADA) y la Organización Mundial de la Salud (OMS) proponen otro subtipo en la clasificación de DM tipo 1: la 1B o idiopática, en la que no se conoce la etiología. En este grupo de pacientes, en su mayoría hispánicos2, afroamericanos3 (en EE.UU.) o asiáticos 4, no hay evidencias de autoinmunidad aunque sí insulinopenia y predisposición a la cetosis, en forma indistinguible de la tipo 1.A.
Por otra parte, el aumento de OB a niveles epidémicos, determina la aparición de DMT2 en niños y adolescentes, con igual mecanismo etiopatogénico que en los adultos: resistencia a la insulina seguida de claudicación secundaria de la célula beta. Esta forma que en adultos suele ser oligosintomática y sin tendencia a la cetosis, en su presentación pediátrica, puede asociarse hasta en un 20% de los casos con cetosis y cetoacidosis, con necesidad de tratamiento insulínico.
La superposición de DMT1 y DMT2 sumadas al aumento de la incidencia de OB, ha originado, algunas teorías explicativas, entre las que se destaca la"Hipótesis del acelerador", propuesta por Wilkin7, que sugiere que la ganancia excesiva de peso, causante de insulino-resistencia, al aumentar la demanda de la célula beta, induciría apoptosis de la misma con liberación de autoantígenos que aceleran el daño auto-inmune en personas genéticamente predispuestas.
Considerando la evidencia de heterogeneidad en la patogénesis de la diabetes en niños con tratamiento insulínico, definir los diferentes subtipos etiológicos en el momento del inicio es de vital importancia para determinar conductas terapéuticas y/o preventivas, medir riesgos y establecer pronósticos.
El propósito del presente trabajo fue caracterizar el tipo de DM en el momento del diagnóstico y evaluar el rol de la OB junto con los factores de riesgo metabólico en jóvenes DBMT1.
Materiales y métodos
El presente es un estudio prospectivo, comparativo, entre pacientes con reciente diagnostico clínico de DM T1 (de acuerdo a ADA) que fueron clasificados de acuerdo a su IMC en un subgrupo con SP/OB y otro con normopeso.
Fueron estudiados consecutivamente todos los niños, con diagnóstico de DM que comenzaron tratamiento insulínico entre junio del 2005 y junio del 2006, atendidos en el Servicio de Nutrición del Hospital J .P Garrahan.
Los criterios de inclusión fueron: diagnóstico DMIT1 de acuerdo a la ADA, requerimiento de insulina desde el principio de la enfermedad, haber aceptado participar en el estudio por parte de los padres o tutores del paciente, con firma del consentimiento informado.
Fueron excluidos los que no requirieron insulina , o bien aquellos con diabetes secundaria a otras enfermedades o a drogas.
Se realizó una evaluación clínica que incluyó el registro de los antecedentes personales y familiares, antecedentes de la enfermedad, examen físico y estudios de laboratorio. En todos, se recabó información mediante un cuestionario realizado al adulto a cargo, sobre los antecedentes de la historia perinatal, curva ponderal y antecedentes patológicos personales y familiares, con especial énfasis en enfermedades auto-inmunes y aquellas que forman parte de la constelación del síndrome metabólico: OB, dislipidemia, hipertensión y DMT2.
Con el paciente compensado, sin cetoacidosis y normo hidratado se realizó el examen físico completo que incluyó a la estadificación puberal de acuerdo al estadio de Tanner, presión arterial y signos clínicos de insulino-resistencia tales como la presencia de acantosis nigricans. Se los pesó y se midió su talla, perímetro de cintura, de cadera y espesor de pliegues cutáneos: tricipital y subescapular. Se calculó índice de masa corporal según la fórmula peso/talla2 (IMC) y el desvío estándar (DE). Se consideraron los valores de peso/edad, talla/edad e IMC/edad y se expresaron como score Z de DS, según sexo y edad utilizando tablas de referencia del CDC8. Los pacientes con índice de masa corporal mayor o igual al percentilo 85 fueron clasificados como SP y aquellos con IMC igual o superior al percentilo 95 se clasificaron como OB. Se calculó la masa grasa utilizando la siguiente fórmula9-11: (0.23 x pliegue subescapular)+ (0.18 x peso) + (0.13 x pliegue tricipital)-3.
Dentro de los 10 primeros días de tratamiento insulínico se extrajo sangre en ayunas para llevar a cabo los estudios inmunológicos, la tipificación de HLA y el dosaje de péptido C.
Los anticuerpos estudiados fueron:
a) Anti decarboxilasa del ácido glutámico (GADA): realizado por inmunoprecipitación según el método descrito por Grubin12 con modificaciones. La (35S) GAD65 obtenida se utilizó para la formación de inmunocomplejos con los autoanticuerpos específicos presentes en los sueros. La formación de los inmunocomplejos, aislados con Proteína A-Sepharose, se determinó por centelleo líquido. Los resultados se expresaron como GAD index utilizando como patrón un suero estándar internacional con GAD index = 1. Se procesaron simultáneamente 30 sueros normales para calcular el cutoff como la media más 3 DE.
b) Anticuerpos anti auto- insulina (IAA): realizados por test de unión de radio ligando (RBA), según el método descrito por Kurtz13. Los resultados se expresaron como porcentajes de unión especifica de insulina: B % (incubados con el trazador exclusivamente)-B% (incubados con el trazador y un exceso de insulina fría). La reproducibilidad se estimó a diferentes niveles de B%.
c) Anticuerpos anti ICA 512 (ICA 512): obtenidos a través de un ensayo de inmunoprecipitación semejante al de GADA. Se utilizó como trazador ICA512 sintetizada in vitro, la que se hizo reaccionar con los anticuerpos específicos presentes en los sueros. La formación de inmunocomplejos, aislados con proteína A-Sepharose, se determinó por centelleo líquido14. Los controles de calidad externos para los anticuerpos mencionados se efectuaron a través de los respectivos Proficiency Programs del University of Florida Collage of Medicine (Chairman: Dr. Noel K. Maclaren), EE.UU.
Se realizó tipificación del Genotipo HLA DQB1 por Sequence- Specific Oligonucleotide Typing (PCR-SSO), con hibridización de un panel de SSO probes (sondas) de las secuencias apropiadas HLA, amplificadas por reacción en cadena de polimerasa, previa extracción del ADN, según el protocolo de Ready Amp (Promega) y amplificación de un segmento de 259 pb mediante un par de primers apropiados (Immunogenetics) utilizando un ciclador térmico Perkin Elmer 480. El test seleccionado para la etapa de revelado fue el reverse blot, (Immunogenetics), con resolución de los 23 alelos DQB1conocidos hasta la fecha. Se utilizó la última nomenclatura del Comité para Factores del Sistema HLA de la OMS.
Se valoró la reserva pancreática de insulina mediante el dosaje de péptido C15-16 con el método de radioinmunoensayo (DSL) y se calculó la relación glucemia basal (mg/dl) /péptido C (ng/l). La extracción de sangre se realizó entre las 7 y las 10 de la mañana con el paciente normohidratado, con ayuno de 8 horas. En un subgrupo de 29 pacientes aleatorizados se realizó la determinación bajo estímulo con la prueba Mixed Meal Tolerante Test (MMTT) siguiendo el protocolo internacional estandarizado Trial Net Improving Metabolic Assesment in type 1 Diabetes16-19. La secreción de péptido C fue estimulada con el preparado estandarizado Boost HP. La dosis administrada por vía oral fue de 6 ml por kg de peso corporal, con una dosis máxima de 360 ml, ingerida en un tiempo máximo de 5 minutos. Debían tener niveles de glucemia en un rango entre 70 y 200 mg%. Las muestras de sangre se tomaron en los tiempos 0,15, 30, 60, 90 y 120 minutos. Los valores de péptido C y glucemia se expresaron en forma absoluta en ng/l y mg % respectivamente y como índices glucemia /péptido C, y como área bajo la curva de glucemia y de péptido C.
Los resultados se expresaron como medias y sus DE. Las diferencias se analizaron con test de Chi cuadrado para las variables cualitativas y test de Student y de Mann Whitney para las variables cuantitativas. Las asociaciones de las variables de riesgo con las medidas antropométricas se analizaron con correlación de Spearman. Se consideró una p menor o igual a 0.05 como significativa. Se trabajó con un intervalo de confianza de 95%.
Resultados
Durante el período de estudio 2005-2006 se diagnosticaron y comenzaron tratamiento insulínico 50 niños y adolescentes que se han incluidos en el análisis. Veinticuatro fueron mujeres (48%) y veintiséis varones. La edad media al comienzo de la enfermedad fue de 10.5 años con un rango de 0.7 a 18.3 años y una mediana de 11.0 años. Presentaron antecedentes personales de riesgo para enfermedad cardiometabólica 20 pacientes (40.8%), 19 (38%) SP u OB al inicio de la diabetes o inmediatamente antes de la aparición de los síntomas atribuibles a la DM y 1 paciente (2.2%) dislipidemia, mientras 4 pacientes (8.3%) tenían enfermedad autoinmune pre-existente al comienzo de la DM (8.3%).
En relación a la forma de comienzo, todos refirieron el antecedente de pérdida de peso con poliuria y polidipsia en el mes previo al diagnóstico. Veintiuno (42%) presentaron cetoacidosis como comienzo de su DBT, no encontrándose diferencias en la forma de presentación entre los pacientes con SP/ OB y aquellos con peso normal. Presentaron antecedentes familiares para componentes del síndrome metabólico 42 pacientes (84%), 31 con antecedentes familiares de OB (62%) 17 con dislipidemia (34%), 24 con hipertensión arterial (49%), y 23 con DMT2 (46%). El antecedente de enfermedad autoinmune se registró en 17 familias (36.2%).
El score Z medio para peso/edad fue de 0.07 ± 1.18, el score Z medio para talla/edad fue de 0.01 ± 1.15 y el score Z medio IMC fue 0.22 ±1.08. Cumplían criterios diagnósticos de SP u OB al momento del inicio de la diabetes 10 niños (20%). El 42.7 % se encontraba en estadio de Tanner prepuberal.
Los resultados de los estudios inmunológicos mostraron que 41 (82%) presentaron al menos un anticuerpo positivo, lo que confirma el diagnóstico de DMT1A de este grupo. El 46% fue positivo para GADA, el 48% para ICA512 y un 28% para IAA. Solamente 9 (18%) presentaron los tres anticuerpos negativos.
La genotipificación del locus HLA-DQB1 se realizó en 49 pacientes. Todos presentaron genotipo de riesgo: 19 fueron homocigotas (3.7 %) y el resto heterocigotas (61%).
Los valores de péptido C tendieron a ser más elevados en los niños pospuberales en comparación con los prepúberes, aunque no significativamente (3.0 ± 0.32 ng/dl vs. 2.3 ng/dl ± 0.9 ng/dl). Para evaluar el rol de la OB, fueron separados en dos grupos según presentaran SB y/o OB o normopeso. Los antecedentes familiares relacionados con componentes del síndrome metabólico en ambos grupos mostraron diferencias significativas en la frecuencia de OB familiar y DBMT2 (p = 0.05), ambas más altas en la población de DM con SB u OB (Tabla 1). No se encontraron diferencias significativas en el valor de péptido C o el índice glucemia/péptido C, ni en el perfil genético o en la frecuencia de anticuerpos entre los grupos (Tabla 1). En el subgrupo en el que se realizó la medición de péptido C bajo prueba de estímulo (MMTT), se observaron valores más elevados durante la prueba en el grupo con SP/OB, esta diferencia alcanzó significación estadística en los 60 y 120 minutos (p: 0.02 y 0.03 respectivamente) (Fig. 1). Con los valores de péptido C durante la prueba se calculó el área bajo la curva que mostró un valor acumulado de péptido C de 1.77 ng/ml en los pacientes DM normopeso vs. 5.5 ng/ml en los del grupo con SB u OB (p = 0.0007) (Fig. 2).
TABLA 1.- Evaluación de factores de riesgo metabólico en pacientes diabéticos agrupados según su estado nutricional
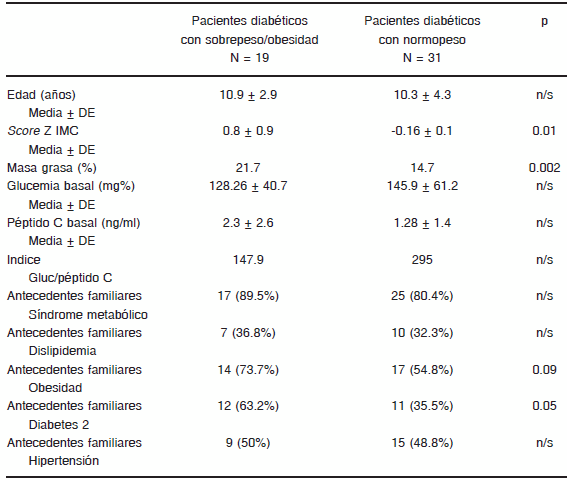
Score Z de índice de masa corporal (IMC), porcentaje de masa grasa, glucemia en ayunas, péptido C en ayunas e índice Glucemia/Péptido C. grupos. DBT SP/OB: diabéticos con sobrepeso u obesidad. DBT normo peso. Antecedentes familiares de riesgo metabólico.
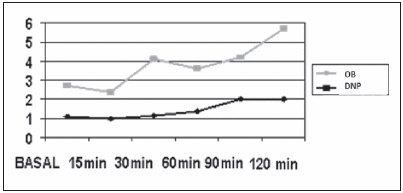
Fig. 1.- Valores de péptido C durante MMTT en 21 pacientes diabéticos normo peso (negro) y con sobrepeso/obesidad (gris) DNP: diabéticos normopeso. OB: diabéticos sobrepeso/obesidad.
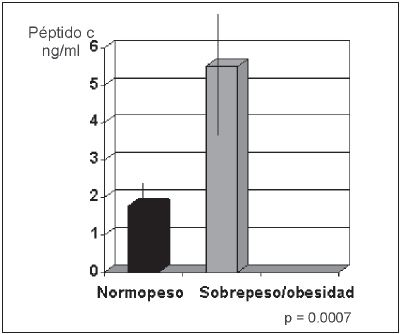
Fig.2.- Dosaje de péptido C en ng/ml expresado como área bajo la curva durante MMTT en 21 pacientes diabéticos.
Discusión
La clasificación de los diferentes tipos de DM se encuentra en debate, postulándose el concepto de heterogeneidad en las formas de presentación clásicas. El presente estudio aporta información en relación al tipo de DM de acuerdo a la etiopatogenia en 50 niños y adolescentes que presentaron síntomas clásicos de DBMT1. El 83% tuvo por lo menos un anticuerpo positivo lo que permite clasificarlos como DBMT1, y todos ellos presentan genotipo de riesgo DQB1. La prevalencia de autoinmunidad hallada en el análisis es algo menor a la registrada en un estudio previo de nuestro grupo en el que la forma autoinmune constituyó el 89% de los casos20, sin embargo, esta diferencia no puede atribuirse a otras formas de DM como la DBTMT2. Desde el punto de vista clínico, no se encontraron diferencias en la forma de presentación entre los pacientes con o sin autoinmunidad medida por anticuerpos, ni en la frecuencia de cetoacidosis , ni en los requerimientos de insulina, ni en los antecedentes familiares o presencia de OB en el momento del diagnóstico. En relación al hallazgo del antecedente de la presencia de uno o más factores de riesgo de síndrome metabólico en los niños (40.8%) y sus familias (84%) llama la atención la elevada frecuencia encontrada, datos parciales de diferentes poblaciones refieren la presencia de un factor en el 20 a 25% de las poblaciones estudiadas. En EE.UU., uno de los más importantes estudios poblacionales en el que se evaluó el riesgo cardiovascular, el San Antonio Heart Study 21, encuentra al 64% de la población con al menos un factor de riesgo para enfermedad cardiovascular, cifra menor a la referida como antecedente en padres y abuelos en nuestra población. Entre estos antecedentes, la OB fue el factor de riesgo más frecuente (62%) tanto en la familia como en los pacientes. Un reciente estudio que analiza la prevalencia de OB en una población de niños argentinos sanos de 10 a 19 años, encuentra una frecuencia de SP y OB de 26.2%, marcadamente inferior a lo hallado en nuestra población, lo que sugiere una asociación positiva entre OB y DM en niños y adolescentes22. Estudios recientes3, 7, 23, 24 postulan que la heterogeneidad en la forma de presentación clínica puede estar condicionada por una probable superposición en los mecanismos etiopatogénicos de ambas formas de DM: DBMTI y DMT22, 7, 24, 25 que solo diferirían en la velocidad de la pérdida de reserva de células beta. La excesiva ganancia de peso podría ser un factor de riesgo también para DMT1. En este sentido, la hipótesis del acelerador de Wilkin y la hipótesis de la sobrecarga de la célula beta de Dahlquist proponen varios factores ambientales como desencadenantes del daño de célula beta entre los que se encuentran el aumento de peso, el crecimiento acelerado, la resistencia a la insulina secundaria a la OB y situaciones de estrés físico o fisiológico además de la autoinmunidad y los factores genéticos7, 26. La sumatoria de estos desencadenantes o "aceleradores" explicarían el aumento en la incidencia de la DMT1 y comienzo a edades más tempranas. La teoría de que la excesiva ganancia de peso puede ser un factor de riesgo para DM T1 sugiere que la adiposidad, causante de insulino-resistencia, aumentaría la demanda de las células beta, induciendo apoptosis con liberación de autoantígenos, lo que aceleraría el daño auto-inmune en personas genéticamente predispuestas. Algunos estudios epidemiológicos en niños y adolescentes con reciente aparición de la diabetes han encontrado diferentes y más de un mecanismo patogénico para la misma, sugiriendo que varios factores de riesgo actuando sinérgicamente y a través de una variedad de mecanismos patogénicos puede llevar al daño de la célula beta3-7, 23,24. En nuestro estudio incluimos la medición de péptido C al inicio de la enfermedad para evaluar la capacidad secretoria de la célula beta en dos condiciones: en una muestra basal en todos los pacientes, al presentar compensación metabólica, que ha demostrado en numerosos estudios alto valor predictivo para distinguir entre las distintas formas de DM15 y en un subgrupo, la medición de péptido C bajo estimulo de comida mixta (MMTT)16-18.
Los pacientes con SP /OB al inicio de la enfermedad o inmediatamente previo a la misma, presentaron valores significativamente mayores en el dosaje de péptido C en respuesta al estimulo durante el MMTT a los 60 y los 120 minutos y en el área bajo la curva, lo que sugeriría una mayor reserva secretora y por consiguiente, comienzo más temprano en relación a la pérdida de masa de células beta. En concordancia con nuestro hallazgo, Kivirige y Betts demuestran en los niños con más peso un comienzo más temprano de la DM23, 24.
Al inicio de la DM y durante su primer año, se describe una similitud importante en el dosaje de insulina y péptido C entre los pacientes DMT1, DMT2 y Moddy, asociada a la fase de recuperación parcial en la DM autoinmune (remisión) y la disminución de la glucotoxicidad/lipotoxicidad que perjudica la secreción insulínica en ambos tipos de DM. Este hecho, sumado a la insulino-resistencia generada por la OB que aumenta el nivel de péptido C residual en el comienzo de la diabetes de los adolescentes con diabetes tipo 1, explicaría el amplio rango en el que pueden desarrollarse los signos y síntomas en los niños y adolescentes, independientemente de la caída secretoria de la célula beta.
No encontramos diferencias en la prevalencia de anticuerpos en ambos grupos, por lo que asumimos que el compromiso inmune fue igual entre los niños con peso normal y con OB. Los pacientes con SP /OB presentaron una mayor frecuencia de antecedentes familiares para DMT2 coincidentemente con publicaciones que describen superposición en los antecedentes entre ambos tipos de DM27, 28. Nuestros resultados concuerdan con los estudios que demuestran una mayor prevalencia de antecedentes de DMT2 y síndrome metabólico en familiares de 1º y 2° grado de DMT1. En estos pacientes se describe una historia familiar de DMT2 tres veces más frecuente comparados con población sana28. En esta hipótesis de heterogeneidad de la etiopatogenia de la DM, también se ha demostrado mayor prevalencia de haplotipos de riesgo de diabetes tipo 1en familias con miembros DMT2, sugiriendo la superposición genética mediada por el locus HLA en estas formas de DM29. Concluimos que a pesar de las diferencias clínicas presentadas por la población estudiada, con alta prevalencia de OB y DMT2, el perfil de anticuerpos y el genotipo es característico de DBMT1A. La secreción de la célula beta expresada en secreción de péptido C en respuesta a un estímulo, mostró valores más elevados en los pacientes con SP y mayor porcentaje de grasa corporal, que podría estar implicando una asociación de resistencia a la insulina y daño autoinmune como productores del déficit de secreción, en población genéticamente predispuesta a DM autoinmune. Los datos en conjunto sugieren la existencia de un alto porcentaje de pacientes DMT1en los que el impacto de la epidemia de OB, adelantaría el comienzo de su enfermedad por el "rol acelerador" de la misma.
Agradecimientos: El presente proyecto fue realizado en el marco de una Beca Ramón Carrillo-Arturo Oñativia, CONAPRIS. Ministerio de Salud de la Nación, año 2005. Queremos agradecer a los pacientes y sus familias y a las enfermeras del Servicio de Nutrición del Hospital J. P. Garrahan, por su inestimable colaboración.
Conflictos de interés: no hay conflictos de intereses que declarar.
1. Expert Committee on the Diagnosis and Classification of Diabetes Mellitus. Report of the expert committee on the diagnosis and classification of diabetes mellitus. Diabetes Care 2003; 26: S5-20. [ Links ]
2. Piñero-Piloña A, Litonjua P, Aviles-Santa L, Raskin P. Idiopathic type 1 diabetes in Dallas, Texas: a 5 year experience. Diabetes Care 2001; 24: 1014-8. [ Links ]
3. Libman IM, Pietropaolo M, Arslanian SA, LaPorte RE, Becker DJ. Changing prevalence of overweight children and adolescents at onset of insulin-treated diabetes. Diabetes Care 2003; 26: 1871-5. [ Links ]
4. Imagawa A, Hanafusa T, Miyagawa J, Matsuzawa Y. A novel subtype of type 1 diabetes mellitus characterized by a rapid onset and an absence of diabetes-related antibodies. Osaka IDDM Study Group. N Engl J Med 2000; 342: 301-7. [ Links ]
5. Notkins A, Lenmark A. Autoimmune type 1 diabetes resolved and unresolved issues. J Clin Invest 2001; 108: 1247-52. [ Links ]
6. Araujo M, Ozuna B, Krochik G, Martinengo L, et al. Prevalencia de enfermedad celiaca en diabetes tipo 1. Medicina Infantil 2001; VIII: 18-22. [ Links ]
7. Wilkin TJ. The accelerator hypothesis: weight gain as the missing link between Type I and Type II diabetes. Diabetologia 2001; 44: 914-22. [ Links ]
8. Ogden CL, Kuczmarski RJ, Flegal KM, et al. Centers for Disease Control and Prevention 2002 growth charts for the United States; improvements to the 1977 National Center for Health Statistics version. Pediatrics 2002; 109: 45-60. [ Links ]
9. Goran MI, Driscoll P, Johnson R, Nagy TR, Hunter G. Cross-calibration of body- composition techniques against dual-energy X-ray absorptiometry in young children. Am J Clin Nut 1996; 63: 299-305. [ Links ]
10. Dezenberg CV, Nagy TR, Gower BA, Johnson R, Goran MI. Predicting body composition from anthropometry in pre-adolescent children. Int J Obes Relat Metab Disord 1999; 23: 253-9. [ Links ]
11. Slaughter MH, Lohman TG, Boileau RA, et al. Skinfold equations for estimation of body fatness in children and youth. Hum Biol 1988; 60:709-23. [ Links ]
12. Grubin CE, Daniels T, Toivola B, et al. A novel radioligand binding assay to determine diagnostic accuracy of isoform-specific glutamic acid decarboxylase antibodies in childhood IDDM. Diabetologia 1994; 37: 344-50. [ Links ]
13. Kurtz A, DiSilvio L, Bosi E. The determination of detection limits for insulin antibody assays. Diabetologia 1998; 31: 395-9. [ Links ]
14. Verge CF, Gianani R, Kawasaky E, et al. Prediction of type I diabetes in first-degree relatives using a combination of insulin, GAD and ICA512 bdc/IA-2 autoantibodies. Diabetes 1996; 45: 926-33. [ Links ]
15. Berger B, Stenström G, Sundkvist G. Random C-peptide in classification of diabetes. Scand J Clin Lab Invest 2000; 60: 687-93. [ Links ]
16. Palmer JP, Fleming GA, Greenbaum CJ, et al. C-peptide is the appropriate outcome measure for type 1 diabetes clinical trials to preserve beta-cell function; report of an ADA workshop, 21-22 October 2001. Diabetes 2004; 53: 250-64. [ Links ]
17. Singhal P,Caumo A, Carey PE, Cobelli C, Taylor R. Regulation of endogenous glucose production after a mixed meal in type 2 diabetes. Am J Physiol Endocrinol Metab 2002; 283: E275-83. [ Links ]
18. Greenbaum CJ, Harrison LC: Immunology of Diabetes Society. Guidelines for intervention trials in subjects with newly diagnosed type 1 diabetes. Diabetes 2003; 52: 1059-65. [ Links ]
19. Tsai EB, Sherry NA, Palmer JP, Harold KC. The rise and fall of insulin secretion in type 1 diabetes mellitus. Diabetologia 2006; 49: 261-70. [ Links ]
20. Krochik AG, Mazza CS, Valdez SN, et al. Immunologic and genetic markers in insulin-dependent diabetes mellitus (Type 1) in an Argentine population. Medicina (B Aires) 2001; 61: 279-83. [ Links ]
21. Zavaroni I, Bonora E, Pagliara M, et al. Risk factors for coronary artery disease in healthy persons with hyperinsulinemia and normal glucose tolerance. N Engl J Med 1989; 320: 702-6. [ Links ]
22. Kovalskys I, Bay L, Rausch Herscovici C, Berner E. Prevalencia de obesidad en una población de 10 a 19 años en la consulta pediátrica. Arch Argent Pediatr 2003; 101: 441-7. [ Links ]
23. Kibirige M, Metcalf B, Renuka R, Wilkin TJ. Testing the accelerator hypothesis: the relationship between body mass and age at diagnosis of type 1 diabetes. Diabetes Care 2003; 26: 2865-70. [ Links ]
24. Betts P, Mulligan J, Wards P, Smith B, Wilkin T. Increasing body weight predicts the earlier onset of insulin-dependant diabetes in childhood: testing the "accelerator hypothesis" (2). Diabet Med 2005; 22: 144-51. [ Links ]
25. Knerr I, Wolf J, Reinehr T, et al.The "accelerator hypothesis": relationship between weight, height, body mass index and age at diagnosis in a large cohort of 9.248 German and Austrian children with type 1 diabetes mellitus. Diabetologia 2005; 48: 2501-4. [ Links ]
26. Dahlquist G. Can we slow the rising incidence of childhood-onset autoimmune diabetes? The overload hypothesis. Diabetologia 2006. 49: 20-4. [ Links ]
27. Dahlquist G, Blom L, Tuvemo T, Nyström L, SandströmA, Walls S. The Swedish childhood diabetes study: results from a nine year cases register and a one year case-referent study indicating that type 1 (insulin-dependent) diabetes mellitus is associated with both type 2 (non-insulin- dependent) diabetes mellitus and autoimmune disorders. Diabetologia. 1989; 32: 2-6. [ Links ]
28. Nielsen LB, Mortensen HB, Chiarelli F,et al. Impact of IDDM2 on disease pathogenesis and progression in children with newly diagnosed type 1 diabetes: reduce insulin antibody titres and preserved beta cell function. Diabetologia 2006; 49: 71-4. [ Links ]
30. Li H, Lindholm E, Almgren P, et al. Possible human leukocyte antigen-mediated genetic interaction between type 1 and type 2 Diabetes. J Clin Endocrinol Metab 2001; 86: 574-82. [ Links ]
Recibido: 1-9-2011
Aceptado: 1-6-2012














