Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Medicina (Buenos Aires)
Print version ISSN 0025-7680
Medicina (B. Aires) vol.72 no.4 supl.1 Ciudad Autónoma de Buenos Aires Aug. 2012
SUPLEMENTO
Recomendaciones para la prevención, diagnóstico y tratamiento de LA EPOC en la Argentina
Juan Carlos Figueroa Casas1, Eduardo Schiavi2, Juan Antonio Mazzei3, Ana María López4, Edgardo Rhodius5, Julián Ciruzzi6, Martín Sívori7 y Grupo Recomendaciones de EPOC8 Asociación Argentina de Medicina Respiratoria
1Facultad de Ciencias Médicas, Universidad Nacional de Rosario, Santa Fe,
2Hospital de Rehabilitación respiratoria María Ferrer, Buenos Aires,
3Departamento de Medicina, Hospital de Clínicas José de San Martín, Universidad de Buenos Aires,
4Hospital Privado de Córdoba, Córdoba,
5Hospital Alemán, Buenos Aires,
6Hospital Provincial Dr. Eduardo Castro Rendón, Neuquén,
7Hospital Ramos Mejía, Buenos Aires
Dirección postal: Dr. Juan C. Figueroa Casas, Azcuénaga 8383, 2000 Rosario, Santa Fe, Argentina
Fax (54-341) 4510708 e-mail: jcfigueroa@arnet.com.ar
8Grupo Recomendaciones de EPOC:
Definición y Epidemiología (coordinador Eduardo Schiavi): Daniel Colodenco, Carlos Elías, Luis J. Nannini, Salvador Pace, Ramón Rojas, Luis Wehbe, Gustavo Zabert
Diagnóstico (coordinador Juan C. Figueroa Casas): Jorge Ávila, Ricardo del Olmo, Luis Fajre, Ricardo Gené, Eduardo Giugno, Luis Larrateguy, Orlando López Jové, Guillermo Menga, Ricardo Re, Carlos Parpaglione, Daniel Pérez Chada, Santiago Rossi
Tratamiento farmacológico y no farmacológico (coordinador Edgardo Rhodius): Bartolomé Lungo, Daniel Buljuvasich, Susana Nahabedian, Daniel Carlés, Martín Sívori, Raúl Lisanti, Alejandro Salvado, Rogelio Pendino, Iván Guevara, Sergio Monteiro
Exacerbación (coordinador Ana María López): Álvaro Alonso, Ana Diez, Oscar Caberlotto, Hugo Esteva, Stella Fabio, Mariano Mazzei, José Menéndez, Alejandro Raimondi, María Elisa Uribe
Situaciones Especiales (coordinador Juan Antonio Mazzei): Eduardo Abbate, Analía Barro, Jorge Cáneva, René Walter Chavez, Carlos Gustavo Di Bartolo, Beatriz Gil, Ernesto J. Prieto Brandstaetter, César Salomone
Comunicación (coordinador Julián Ciruzzi): Gustavo Douglas, Pedro Grynblat, Artemio García, Daniel Pascansky, Vicente Llanes, Marcelino de Vega
Resumen
La enfermedad pulmonar obstructiva crónica (EPOC) está aumentando marcadamente su morbimortalidad, costos e indicadores epidemiológicos. Por ello la Asociación Argentina de Medicina Respiratoria (AAMR) convocó a un grupo de especialistas para actualizar conocimientos básicos y efectuar recomendaciones para su diagnóstico, prevención y tratamiento. Se revisan definición, avances en fisiopatología, presentación clínica, diagnóstico por imágenes y evaluación funcional. Se enfatiza su diagnóstico temprano mediante exploración funcional -esencialmente espirometría- y la prevención a través de la cesación del tabaquismo. Se describen estrategias para dejar de fumar, tratamiento farmacológico y no farmacológico. La administración de broncodilatadores, preferentemente de acción prolongada, es la primera opción de tratamiento farmacológico. Los corticoides inhalados se indican en combinación con los broncodilatadores en pacientes con obstrucción al flujo aéreo persistente asociada con exacerbaciones frecuentes, si bien se requieren estudios que confirmen su relación costo/beneficio. La vacuna antigripal es recomendada en todos los pacientes. Con respecto a las intervenciones no farmacológicas, la cirugía del enfisema solo se recomienda en circunstancias especiales. La rehabilitación respiratoria es una herramienta útil en pacientes con limitación en la actividad física habitual. La oxígenoterapia crónica domiciliaria mejora la supervivencia en pacientes con hipoxemia crónica grave. La ventilación no invasiva domiciliaria fuera de las exacerbaciones, tiene indicaciones en pacientes seleccionados. Las exacerbaciones agudas deben tratarse con broncodilatadores, oxígeno, corticoides, antibióticos y, bajo ciertas circunstancias, asistencia respiratoria mecánica tanto no invasiva como invasiva. El papel de la educación pública, del paciente y su familia, es considerada esencial en la prevención y tratamiento.
Palabras clave: Recomendaciones; EPOC; Enfisema; Guías; Consenso; Prevención; Diagnóstico; Tratamiento
Abstract
Guidelines for COPD prevention, diagnosis and treatment in Argentina. Since morbidity, mortality and socioeconomic costs from Chronic Obstructive Pulmonary Disease (COPD) are widely increasing, a group of respiratory medicine specialists was summoned by the AAMR to update basic knowledge on COPD and to issue recommendations for its prevention, diagnosis and treatment. The authors review the definition of COPD together with current knowledge on pathophysiology. Clinical presentation, functional evaluation and imaging are summarized. Early diagnosis through pulmonary function tests -mainly spirometry- and the role of smoking cessation are stressed. Smoking cessation strategies are described as well as pharmacological and non-pharmacological treatment. Long acting bronchodilators are considered the first pharmacological option for treatment due to its effectiveness and patient compliance. Inhaled corticosteroids are indicated in combination with long-acting bronchodilators in patients who present persistent airway obstruction associated with frequent exacerbations since they reduce their number although further studies are needed to confirm their cost/benefit. Annual influenza vaccination is recommended in all patients. In the non-pharmacological section, surgery for emphysema is suggested in very specific cases. Respiratory rehabilitation is a useful tool for patients with daily activities limitation. Long-term oxygen therapy at home improves survival in patients with severe chronic hypoxemia. Non-invasive home ventilation in chronic patients has limited indications in specific subgroups. Acute exacerbations should be aggressively treated with bronchodilators, oxygen, antibiotics, corticosteroids and eventually mechanical ventilation, as invasive as not invasive respiratory support. The importance of public education as well as of individual patients and their families is deemed essential in the prevention and treatment of the disease.
Key words: Recommendations; Guidelines; Consensus; COPD; Emphysema; Prevention; Diagnosis; Treatment
En 1994 y 2003 un grupo de médicos neumonólogos actualizó los conocimientos básicos sobre la enfermedad pulmonar obstructiva crónica (EPOC) basados en la evidencia científica conocida hasta ese momento1-2. Debido al notable avance ocurrido en los diferentes campos de investigación de esta enfermedad y teniendo en cuenta su creciente impacto sanitario, un conjunto de especialistas convocado por la Asociación Argentina de Medicina Respiratoria, ha creído conveniente efectuar una actualización y generar recomendaciones para su diagnóstico, prevención y tratamiento cuyo propósito esencial es transferir lo investigado y demostrado a la práctica habitual.
Metodología
Este documento va dirigido a especialistas en medicina respiratoria, internistas, médicos generales y otro personal de salud con el fin de sintetizar y hacer asequibles la innumerable cantidad de aportes de la investigación a la comprensión de esta enfermedad ocurridos en los últimos años. Los contenidos fueron elaborados por grupos coordinados y luego homogeneizados por un Comité Ejecutivo. Se tuvo como objetivo resumir en un texto, con la mayor brevedad posible, los conocimientos que sustentan recomendaciones aplicables en la medicina cotidiana. Se ha procurado jerarquizar su importancia clasificando las mismas de acuerdo a niveles de evidencia recientemente publicados y aceptados por una mayoría de asociaciones médicas3. Éstos se basan en la combinación de dos cualidades: I) Fortaleza de cada recomendación (fuerte o débil, según el grado en que sus beneficios superan los riesgos, molestias y costos que conllevan, y representadas por los números 1 o 2 respectivamente). II) Calidad de los estudios que la sustentan (alta, moderada o baja -identificada por las letras A, B o C- según sean estudios aleatorizados y controlados hasta meramente observacionales3. Esta calificación de la evidencia se hace constar a lo largo del texto sólo cuando existió convicción, a criterio de los autores, acerca de su fortaleza y calidad luego de la revisión de las referencias citadas (Tabla 1).
TABLA 1.- Estadificación del nivel y calidad de las Guías Clínicas3

* Fortaleza: Calificada como Fuerte -categoría en la cual los beneficios de una intervención claramente superan (o no) los riesgos, molestias y costos e identificada como 1- o Débil cuando existe equilibrio o incertidumbre al comparar beneficios y perjuicios e identificada como 2. ** Calidad: Definida según la metodología que la sustenta como Alta (Estudios aleatorizados y controlados consistentes o estudios observacionales (excepcionalmente), Moderada (Estudios aleatorizados y controlados con algunas limitaciones o estudios observacionales (excepcionalmente) o Baja (estudios aleatorizados y controlados con múltiples limitaciones o estudios observacionales)
Definición
La enfermedad pulmonar obstructiva crónica (EPOC) es una enfermedad fuertemente ligada al tabaquismo, que causa inflamación de la vía aérea (bronquitis y bronquiolitis crónica), destrucción alveolar (enfisema) y se asocia con repercusión sistémica. Es prevenible, tratable, lentamente progresiva y cursa con episodios puntuales de empeoramiento (exacerbaciones). Clínicamente se presenta con tos, expectoración y disnea de esfuerzo. Funcionalmente se caracteriza por un defecto ventilatorio obstructivo con respuesta parcial tanto a broncodilatadores como a corticoides orales4-7. Significativos efectos extrapulmonares y comorbilidades pueden presentarse y acentuar su gravedad.
La obstrucción se define espirométricamente por una relación entre el volumen espiratorio forzado en el primer segundo (FEV1) y la capacidad vital forzada (FVC) (relación FEV1/FVC) < 0.7, luego de la administración de un broncodilatador adrenérgico de acción corta4, 8. Una respuesta broncodilatadora como la que caracteriza al asma no descarta el diagnóstico de EPOC. En algunos casos ambas enfermedades pueden coexistir.
No hay una prueba diagnóstica única y concluyente. El criterio clínico basado en los antecedentes (exposición a factores de riesgo, historia de otras patologías), síntomas, examen físico y la espirometría son los elementos apropiados para el diagnóstico final.
Historia natural y etiología
La enfermedad se manifiesta habitualmente después de los 40 años de edad. El tabaquismo es la causa más importante y 20 cigarrillos diarios por un período de 10 años es la dosis patogénica mínima probable. Se ha señalado que sólo un 15 a 20% de los fumadores desarrollan EPOC clínico. Sin embargo, existe una estrecha asociación entre la magnitud del tabaquismo y la velocidad de declinación anual del FEV1 (entre 25 y 100 ml/año) agregándose además la susceptibilidad individual como un factor significativo9-12. Es probable que la proporción de fumadores con obstrucción de la vía aérea aumente con la edad hasta comprometer a casi la mitad de los sujetos fumadores13, 14. Si bien el abandono del tabaquismo no se acompaña de una reversión de la enfermedad, dejar de fumar siempre es conveniente porque retarda el comienzo de la discapacidad y preserva la función pulmonar remanente. El abandono definitivo del tabaquismo equipara la velocidad de declinación del FEV1 a la de los no fumadores9-12.
Tanto los pacientes como los médicos tienen dificultades para reconocer la enfermedad en sus estadios iniciales. Los pacientes se adaptan a las dificultades que la pérdida de función pulmonar les ocasiona e interpretan los síntomas como propios del tabaquismo.
La mortalidad en EPOC está en relación con la magnitud de la exposición (edad de comienzo del tabaquismo, el consumo de cigarrillos en paquetes-año y su persistencia en el tiempo)12, 15. Otros factores independientes que pueden contribuir al desarrollo de EPOC son:
1. Exposición ocupacional a inhalantes industriales, polvo de cereales, etc.16-18
2. Exposición domiciliaria a humo de combustión de biomasa (leña, carbón)19
3. Polución ambiental y tabaquismo pasivo
4. Deficiencia de a1-antitripsina y otras alteraciones genéticas
5. Infecciones respiratorias recurrentes en la infancia
6. Antecedentes de tuberculosis
7. Asma e hiperreactividad bronquial previa
8. Serología positiva para HIV, hepatitis C
Patogenia y fisiopatología
Toda persona que fuma desarrolla un cierto grado de inflamación en su sistema respiratorio, pero esta respuesta inflamatoria se halla notablemente amplificada en aquellos que desarrollarán EPOC (20-50% de los que fuman)10, 14, 20, 21. El humo del cigarrillo altera la inmunidad innata compuesta por el aparato mucociliar, el epitelio de la vía aérea (barrera mecánica), células inflamatorias, moléculas proinflamatorias y otros componentes. Este sistema inmunitario es más inespecífico que el adquirido pero es de rápida respuesta a agentes dañinos que llegan a la vía aérea. Cada uno de sus componentes resulta alterado por el humo del tabaco que lesiona el epitelio, y aumenta la activación y migración de neutrófilos, macrófagos y linfocitos CD4 y CD822, 23. Estas células inflamatorias, especialmente los macrófagos y neutrófilos, son capaces de liberar proteasas y desbordar la capacidad neutralizadora de las antiproteasas24. También generan estrés oxidativo la cual es otra forma de daño inflamatorio consistente en la liberación de especies activas de oxígeno (como radicales libres) que superan la capacidad antioxidante tisular. Ambos procesos producen daño tisular que amplifica el proceso inflamatorio inespecífico.
Cuando el tabaquismo continúa durante un tiempo considerable, también se ve involucrado el sistema inmune adaptativo que es más especifico y exquisito, pero más lento en responder. El resultado de esta activación se traduce en la presencia de linfocitos T (CD4, CD8), y B y de gran cantidad de sustancias inflamatorias como citoquinas y factores de crecimiento que provocan el consiguiente daño bronquial y parenquimatoso25-26. Las alteraciones de la vía aérea periférica (bronquiolar) provocan engrosamiento de la pared y reducción de la luz que generan obstrucción al flujo aéreo. Se explica entonces la correlación entre el daño inflamatorio bronquial (en mayor medida de bronquios pequeños y bronquiolos) y el deterioro de la función pulmonar. La pérdida importante de la arquitectura bronquial a causa de este proceso inflamatorio crónico, se conoce como remodelación de la vía aérea27-29. En las vías aéreas centrales ocurre hiperplasia y metaplasia de células caliciformes que junto con la hipertrofia de glándulas bronquiales explica la producción aumentada de moco en la bronquitis crónica. A este nivel también ocurre hipertrofia del músculo liso bronquial30, 31. En las vías aéreas periféricas, además de la metaplasia de células caliciformes, se observa bronquiolitis y metaplasia escamosa, lo que se traduce en pérdida de la función ciliar32, 33. En el parénquima pulmonar se produce destrucción de los tabiques alveolares, lesión característica del enfisema pulmonar. Estas lesiones se distribuyen en forma variable, y la destrucción del esqueleto conectivo provoca la pérdida de presión de retroceso elástico que contribuye a la disminución del flujo aéreo. La destrucción de los anclajes alveolares en la pared bronquiolar favorece el colapso de los mismos durante la espiración y es el tercer componente de la obstrucción al flujo aéreo. La coalescencia de los alvéolos entre sí como consecuencia de la destrucción de sus paredes puede producir zonas de destrucción más grandes, conocidas como bullas (espacios enfisematosos de más de un centímetro)34, 35.
A los factores estructurales se agregan factores funcionales. En los pacientes con EPOC se observa un franco aumento del tono colinérgico mediado por nervios vagales postganglionares, que en personas sanas es poco relevante36. Esta activación es causante de un incremento del tono broncoconstrictor en vías aéreas cartilaginosas y constituye el componente reversible más importante de la obstrucción de la vía aérea. Recientemente se han vinculado los efectos del sistema colinérgico con el control de los mecanismos inflamatorios abriendo nuevas vías posibles de intervención37. Estos cambios, no siempre cesan al dejar de fumar, aun cuando suele verse un enlentecimiento de su progresión38, 39.
La obstrucción, mayormente a nivel de la pequeña vía aérea (diámetro menor a 2 mm) y la pérdida de retroceso elástico, explican el deterioro del flujo aéreo en EPOC40, 41. La pérdida de retroceso elástico es también la causa principal de la hiperinsuflación pulmonar que tienen muchos pacientes y que se expresa en el aumento de la capacidad pulmonar total (TLC). Debido a la dificultad espiratoria, más aire permanece en el espacio alveolar al final de la espiración. Esta alteración se conoce como "atrapamiento aéreo" y provoca un aumento del volumen residual (RV), de la capacidad residual funcional (FRC) y aumenta la relación entre el volumen residual y la capacidad pulmonar total (relación RV/TLC). Este "atrapamiento aéreo" puede aumentar si disminuye el tiempo espiratorio o aumenta el volumen minuto ventilatorio (hiperinsuflación dinámica). Esto se puede observar durante el aumento de la actividad física y causa su limitación42.
Finalmente, desde el comienzo de la enfermedad ocurre compromiso del lecho vascular pulmonar. Lo que comienza con engrosamiento de la pared y daño endotelial subclínico, puede continuar con hipertrofia del músculo liso e infiltración de células inflamatorias, para terminar en remodelación del lecho vascular por depósito de colágeno y, con ello, grados variables de hipertensión pulmonar43.
Clasificación
La clasificación de la EPOC se basa en las alteraciones de la espirometría. La iniciativa GOLD (Global Initiative for Chronic Obstructive Lung Disease) define la presencia de obstrucción de la vía aérea cuando la relación FEV1/FVC es menor a 0.7 postbroncodilatador, y reconoce 4 estadios de gravedad (leve, moderado, grave y muy grave) en función del compromiso del FEV1 postbroncodilatador (Tabla 2)4. La presencia o ausencia de síntomas respiratorios (tos, expectoración o disnea) no modifica los estadios ni influye en la clasificación de gravedad.
TABLA 2.- Clasificación de la EPOC (valores post-broncodilatador)4

El empleo de un valor fijo de relación FEV1/FVC para confirmar el diagnóstico de EPOC tiene la ventaja de ser simple, de fácil acceso y aplicación práctica, pero sobrestima la prevalencia de EPOC en mayores de 50 años, y la subestima en adultos jóvenes8, 44-47. La utilización del límite inferior de lo normal (LIN) por debajo del quinto percentilo ha sido propuesta como alternativa contando con mayor sensibilidad y especificidad48-50. En personas mayores de 50 años, puede hallarse una relación FEV1/FVC menor a 0.7 que se encuentre por encima del límite inferior de lo normal (falsos positivos); viceversa, en sujetos jóvenes una relación superior a 0.7 puede hallarse por debajo del límite normal (falsos negativos). No obstante, hasta tanto se disponga en forma generalizada de las ecuaciones que permitan el rápido cálculo del LIN se recomienda utilizar el límite de FEV1/FVC < 0.7 dada su mayor simplicidad y accesibilidad a la fecha. Existen ahora ecuaciones de referencia post-broncodilatadores51. Con todo, la principal limitación de este enfoque es la pobre correlación del FEV1 con diversas variables que reflejan el impacto de la enfermedad tales como mortalidad, síntomas, tolerancia al ejercicio, compromiso sistémico y otros. Por estas razones, algunos autores han sugerido emplear índices multidimensionales para caracterizar la enfermedad. El índice BODE combina el FEV1, el índice de masa corporal, la distancia caminada en la prueba de caminata de 6 minutos y el grado de disnea evaluada con una escala objetiva52. Es probable que este índice u otros similares se empleen en forma generalizada como complemento de la clasificación GOLD. Siendo la EPOC una enfermedad heterogénea algunos estudios en curso (ECLIPSE, SPIROMICS) buscan identificar características clínicas, radiológicas y biomarcadores que permitan individualizar subgrupos con características comunes (fenotipos) 53, 54. El hallazgo de fenotipos diferentes permitirá conocer mejor la historia natural, el pronóstico de la enfermedad y ofrecer tratamientos más específicos. Uno de los fenotipos identificados recientemente es el de exacerbador frecuente (2 o más exacerbaciones por año) y puede estar presente ya en las formas leves de la enfermedad55. En el futuro otras características clínicas, de imágenes o biomarcadores van a permitir subclasificar la EPOC y personalizar el tratamiento en forma más precisa que en la actual.
Epidemiología
Las dificultades en la descripción epidemiológica de la EPOC se sustentan en las limitaciones metodológicas para definirla y en que, a pesar de constituir una enfermedad crónica con gran impacto sobre la calidad de vida y sobre los costos de atención directos e indirectos, no existen a la fecha registros sistemáticos de la misma56-61.
Prevalencia
Para superar las mencionadas limitaciones se han realizado recientemente varios estudios multicéntricos diseñados con metodología similar (PLATINO, BOLD, PREPOCOL) 62-64. A pesar de ello, estos estudios han evidenciado amplias diferencias en prevalencia entre los distintos sitios explorados. Estas variaciones en la prevalencia enfatizan la necesidad de unificar los criterios diagnósticos de manera que se pueda establecer la magnitud real del problema y así poder explorar explicaciones alternativas. La multiplicidad de factores causales (tabaco, polución ambiental, tuberculosis, exposición laboral, etc.) o determinantes (género, raza, condición socioeconómica, altitud, etc.) es una de las razones importantes que impiden una predicción ajustada del problema. En nuestro país no hay registros de prevalencia de EPOC con metodología estandarizada. Algunos datos preliminares sugieren una elevada prevalencia de síntomas respiratorios obstructivos en adultos que deberá ser corroborado con estudios más completos65. Estos datos sumados a la magnitud y evolución del consumo de tabaco y el aumento de mortalidad sugieren que el problema reclama prontas acciones de salud.
Morbilidad
No hay indicadores disponibles de morbilidad, tales como consultas programadas y de emergencia, internaciones y consumo de fármacos.
Mortalidad
Es el indicador más confiable para el seguimiento del problema dado que a pesar de las limitaciones de los reportes constituyen registros sistemáticos anuales. Las tasas de mortalidad ajustadas por sexo y edad para mayores de 45 años son el mejor indicador para la vigilancia epidemiológica a pesar que evidencia la situación de las décadas previas.
A diferencia de lo que sucede con las enfermedades cardiovasculares, la mortalidad por EPOC en el mundo continúa en ascenso y se prevé que para el 2020 será la tercera causa de muerte en el mundo. Un informe de nuestro país del año 2004 destacó la tendencia en ascenso de la tasa de muertes por EPOC entre 1980 y 199866. Los cambios en la codificación del CIE-9 al CIE- 10 (ICD-9 códigos 490-496 y ICD-10 códigos J42-46), hacen necesario realizar nuevos estudios que permitan actualizar el seguimiento de este indicador.
Otros indicadores
Dado que la EPOC es una enfermedad prevalente, discapacitante y de alto requerimiento de recursos, otros indicadores que reflejen el consumo de medicamentos, los costos (directos e indirectos), los años de vida ganados ajustados por su calidad (QALYs) o años de incapacidad o mortalidad prematura (DALYs), y el impacto social en los pacientes que padecen EPOC podrán ser de utilidad en el futuro67, 68.
Diagnóstico de EPOC
Varios estudios han demostrado que una gran proporción de pacientes con EPOC permanecen sin diagnosticar incluso hasta etapas avanzadas de la enfermedad. Este subdiagnóstico causa que no se adopten medidas como consejo antitabaco y un tratamiento y seguimiento adecuados de la enfermedad.
El diagnóstico debe ser considerado en pacientes mayores de 40 años con factores de riesgo, en general tabaquismo, riesgo ocupacional o inhalación de humos de leña en ambientes cerrados y quienes presentan algunos de los siguientes síntomas:
- Disnea
- Tos crónica
- Producción de secreciones
El diagnóstico requiere ineludiblemente de la espirometría (FEV1/FVC post broncodilatador < 0.7, o debajo del límite inferior de lo normal) (ver más adelante "Evaluación funcional")4. La espirometría debe ser realizada en todas las personas expuestas al cigarrillo y/o polución ambiental o laboral que presenten síntomas, particularmente disnea, para diagnosticar la obstrucción de la vía aérea69.
Estudios de laboratorio
Hemograma: útil para la detección de anemia o poliglobulia70. La presencia de leucocitosis puede ser evidencia de inflamación sistémica, aún en periodo estable71.
Determinación de gases en sangre arterial: Indicada en la prescripción de oxígenoterapia domiciliaria y en EPOC moderada o severa con saturación < a 92% en reposo a nivel del mar o con evidencias de insuficiencia cardiaca derecha4-5, 70, 72, 73.
Alfa1 antitripsina (ATT): su deficiencia es un trastorno genético que puede ocasionar EPOC, principalmente enfisema precoz, en la tercera y cuarta década de vida. En todo paciente con EPOC debe determinarse una vez en su vida la concentración de ATT; en aquellos con concentraciones bajas se debe determinar su fenotipo72, 74, 75.
Cultivo de esputo: Puede ser de utilidad para caracterizar el germen patógeno colonizante en los pacientes que presenten esputo mucopurulento el cual sugiere la presencia de inflamación activa76.
Estudios radiológicos
El par radiográfico de tórax (posteroanterior y perfil) forma parte de la evaluación inicial en un paciente con disnea. Debido a su baja sensibilidad y especificidad, las radiografías de tórax se utilizan principalmente para apoyar el diagnóstico de EPOC y no como elemento de juicio principal.
Los siguientes son signos radiográficos sugestivos de EPOC:
- Aumento del espacio retroesternal
- Aplanamiento o inversión de ambos hemidiafragmas
- Horizontalización de los arcos costales
- Disminución de la vascularización pulmonar (sugiere la presencia de enfisema)
Si bien la tomografía computada constituye la mejor herramienta para estudiar la gravedad del enfisema in vivo, su rol en el diagnóstico primario de EPOC es limitado77-79. Debe ser utilizada cuando se contempla la posibilidad de una intervención quirúrgica, como la bullectomía o la reducción de volumen pulmonar, casos en los cuales la indicación depende de la distribución de las áreas enfisematosas80.
Evaluación funcional
La espirometría es el indicador más confiable y difundido de la obstrucción al flujo aéreo siendo parte ineludible en su diagnóstico,4, 5, 62, 70, 72. Además, establece el grado de severidad de la obstrucción y es un predictor pronóstico en EPOC y forma parte de los indicadores multidimensionales de severidad52, 81-83.
La realización de la espirometría debe indicarse:
- En los sujetos sintomáticos mayores de 40 años expuestos a factores de riesgo (1A)69
- Para establecer el diagnóstico en la evaluación inicial del paciente con EPOC (1A)4, 5, 70, 72
- Anualmente para seguimiento de la enfermedad72
La medición del flujo espiratorio pico, de gran utilidad en pacientes con asma, no tiene valor en los portadores de EPOC, debido a que subestima la obstrucción en estadios iniciales, y no varía significativamente para reflejar los cambios funcionales a lo largo de la evolución de la enfermedad84.
La oximetría de pulso (SpO2) en reposo es de especial valor en la detección de hipoxemia arterial y está indicada en los pacientes con FEV1 menor al 50% de su valor teórico70. Es orientadora antes de solicitar la medición de los gases en sangre arterial.
Otras pruebas funcionales respiratorias de uso no rutinario pueden ser útiles y deben ser aplicadas en situaciones especiales.
La evaluación del factor de transferencia de monóxido de carbono (TLCO) es de utilidad para evaluar la presencia de enfisema en un paciente con EPOC. La pérdida de superficie alveolar y densidad capilar en el enfisema causan una disminución del TLCO y de la constante de remoción del CO del gas alveolar (KCO). Una buena correlación ha sido hallada entre la TLCO y KCO con mediciones anatómicas del área de superficie alveolar por unidad de volumen en lóbulos subsiguientemente resecados85. También es de utilidad para:
- Evaluación preoperatoria de cirugía de resección pulmonar86, 87
- Asesorar la incapacidad laboral
- Contribuir al diagnóstico diferencial con asma
- Investigar síntomas que parecen desproporcionados en base a otras evaluaciones5.
Los volúmenes pulmonares estáticos evalúan el grado de atrapamiento aéreo e hiperinsuflación87. La disminución de la capacidad inspiratoria (IC) refleja estas alteraciones y es factor causal de la disnea de esfuerzo y la intolerancia al ejercicio42. Su determinación tiene valor pronóstico, particularmente el índice IC/capacidad pulmonar total (IC/TLC), el cual también puede ser útil en la evaluación de la respuesta al tratamiento88. La determinación de los volúmenes pulmonares está también indicada en el estudio de un proceso restrictivo asociado89.
La medición de las presiones máximas en la vía aérea (PiMax-PeMax) está indicada cuando se sospeche debilidad de los músculos respiratorios, (PiMax y PeMax reducidas, por ejemplo en desnutrición, miopatía esteroidea, sospecha de inflamación sistémica, esclerosis lateral amiotrófica, etc), y en caso de disnea desproporcionada en relación a los valores espirométricos90. En el caso de la hiperinsuflación, la Pemax es normal y está asociada a Pimax baja90.
La prueba de caminata de los seis minutos (PC6M) es de suma importancia en la evaluación de la capacidad de ejercicio, y tiene por sí sola valor pronóstico42, 91, 92. Es sencilla de ejecutar, reproducible, y es también de valor para evaluar la eficacia de diversas intervenciones terapéuticas. El shuttle test, prueba de caminata de carga progresiva, tiene alta correlación con el consumo de oxígeno pico siendo de especial utilidad donde no existen de equipos apropiados para esta medición93.
La prueba de ejercicio cardiopulmonar está indicada en pacientes de alto riesgo para la evaluación preoperatoria de cirugía de resección pulmonar y en la evaluación de patología cardiovascular asociada82, 89.
Otros estudios
La polisomnografía u otros estudios de sueño tienen lugar cuando se sospecha la coexistencia de síndrome de apnea/hipopnea del sueño (ver más adelante Sueño y EPOC).
El electrocardiograma puede sugerir la presencia de hipertensión pulmonar aunque su sensibilidad es baja. Es de utilidad para detectar otras alteraciones (arritmias, isquemia miocárdica, hipertrofia ventricular izquierda, etc.)1, 2. El ecocardiograma y el ecocardiograma Doppler son importantes si se sospecha hipertensión pulmonar u otras alteraciones cardiacas.
Diagnóstico diferencial
Los síntomas de EPOC no son específicos; otras enfermedades pueden presentar síntomas similares con un patrón de tipo obstructivo en la espirometría. Las más frecuentes son:
- Asma
- Bronquiectasias
- Fibrosis quística
- Bronquiolitis obliterante
- Tuberculosis
- Insuficiencia cardíaca
Efectos sistémicos de la EPOC
Pueden ser definidos como las alteraciones bioquímicas o estructurales ocurridas en órganos o sistemas no broncopulmonares vinculados a características de la enfermedad primaria. Se entiende por manifestaciones sistémicas a las consecuencias de la enfermedad como resultado de su acción causal directa mientras que las co-morbilidades comprenden aquellas condiciones que ocurren frecuentemente asociadas con EPOC quizás como resultado de factores de riesgo comunes. No obstante, no existe acuerdo sobre una clara diferenciación entre ambas y son consideradas en conjunto como efectos sistémicos de la EPOC71, 94-98.
La respuesta inflamatoria que ocurre en los pulmones de los fumadores es más acentuada en aquellos que padecen EPOC y puede ser también hallada en la circulación sistémica71. No es claramente conocido si el origen de las manifestaciones extrapulmonares es debido al "derrame" del proceso inflamatorio pulmonar -activación de células inflamatorias circulantes (neutrófilos, monocitos, linfocitos) y aumento de las concentraciones sanguíneas de Proteína C reactiva, fibrinógeno, interleuquinas (IL-1, IL-6, IL-8), factor de necrosis tumoral (TNFa)- hacia la circulación sistémica o a otras causas como el humo del cigarrillo, la hiperinflación pulmonar, la inactividad, la hipoxia tisular o inflamación en otros órganos como hígado médula ósea o músculos 71, 94-99.
El desarrollo de efectos sistémicos transforma esta afección en una enfermedad multicomponente6. Estas condiciones deben ser reconocidas como parte del diagnóstico dado que los pacientes mueren más probablemente a causa de las mismas que de la propia EPOC y afectan marcadamente su pronóstico95. La presencia de efectos sistémicos es más frecuente en pacientes con EPOC que en controles (3.8% vs. 1.8%)96. Si bien su frecuencia es mayor en los pacientes con severa obstrucción al flujo aéreo pueden verse también en estadios leves o moderados. Las condiciones descriptas son muy variadas (Tabla 3).
TABLA 3.- Manifestaciones extrapulmonares de la EPOC

La pérdida de masa muscular es quizás la manifestación sistémica más notable. Su reducción limita la capacidad de ejercicio de estos pacientes siendo, además, un factor pronóstico. La masa muscular remanente es, además, disfuncional99.
Hay evidencias epidemiológicas del aumento de la enfermedad cardiovascular en la EPOC siendo una de las principales causas de muerte100, 101. La gravedad de la obstrucción es considerada por algunos autores como un "factor EPOC" de riesgo cardiovascular102. El puntaje de injuria miocárdica e infarto se ha correlacionado positivamente con el nivel de Proteína C Reactiva y la gravedad de la EPOC. Una mayor rigidez y engrosamiento de las paredes arteriales secundaria a la acción de mediadores inflamatorios sustentaría estas complicaciones103, 104.
La anemia también ocurre con cierta frecuencia en pacientes con EPOC. Los niveles inadecuados de hemoglobina pueden agravar la hipoxia tisular105, 106.
La osteoporosis con fracturas subsiguientes y la depresión ocurren también con llamativa frecuencia en la EPOC habiéndose atribuido a inflamación sistémica, persistente, de bajo grado107-110.
El riesgo de desarrollar diabetes aumenta 1.8 veces en mujeres con EPOC en comparación con quienes no la padecen111. Otras alteraciones endocrinológicas han sido propuestas recientemente112.
También la presencia de desórdenes autoinmunes ha sido evidenciada en la EPOC y sus manifestaciones extrapulmonares113. Los pacientes con EPOC tienen una probabilidad 3 a 4 veces mayor de desarrollar cáncer de pulmón que los fumadores con función pulmonar normal114.
Recientemente se ha detectado una mayor incidencia de microalbuminuria (MAB) en pacientes con EPOC (24%) que en un grupo control de fumadores sin EPOC (6%). Se ha sugerido que la MAB podría ser un biomarcador simple y accesible para detectar disfunción del epitelio arterial con riesgo cardiovascular aumentado especulándose que que las lesiones vasculares pueden ser secundarias a hipoxemia o a mediadores inflamatorios115.
Se ha postulado que el tratamiento antiinflamatorio de ciertas manifestaciones sistémicas (estatinas, inhibidores enzima convertidora), podría ser beneficioso en la evolución de la EPOC98.
Sueño y EPOC
Los trastornos del sueño se presentan en forma frecuente o muy frecuente en más del 40% de los pacientes con EPOC, siendo la queja más común luego de la disnea y la tos116. Hasta el 50% de los pacientes refieren insomnio, pesadillas y somnolencia diurna, con una prevalencia superior a la de la población general117-120.
Durante el sueño especialmente en los periodos de movimientos oculares rápidos (REM), estos pacientes presentan desaturaciones de oxígeno y aumentos de la presión parcial de CO2 121. Estas desaturaciones son más frecuentes en pacientes hipercápnicos y pueden ser mayores que las que se producen durante el ejercicio máximo. La desaturación arterial predispone a arritmias cardíacas, hipertensión pulmonar y mayor mortalidad durante las exacerbaciones agudas. El mejor predictor de la desaturación nocturna es la PaO2 diurna, por lo cual pacientes con PaO2 > 55 mm Hg no requerirían estudios de oximetría nocturna122-123. Algunos medicamentos mejoran la SpO2 nocturna incluyendo teofilina y anticolinérgicos inhalados124-126. Deben evitarse los hipnóticos en los pacientes con EPOC grave2, 127.
La evaluación clínica de todos los pacientes con EPOC debe incluir preguntas sobre calidad del sueño y debe interrogarse sobre la presencia de respiración irregular, ronquidos, apneas observadas por terceros, excesiva somnolencia diurna, para evaluar la posible coexistencia con el Síndrome de Apnea e Hipoapneas Obstructivas del Sueño (SAHOS). Ante la sospecha de apneas del sueño se debe realizar polisomnografia nocturna con oximetría ya que la oximetría nocturna en forma aislada no permite el diagnóstico diferencial (1A)128-130.
En caso de coexistir EPOC y SAHOS el tratamiento con presión positiva continua en la vía aérea (CPAP) es una opción terapéutica . Se indica CPAP cuando las apneas durante el sueño son la principal causa de los síntomas131, 132 (1C). En ocasiones el uso de CPAP no corrige la hipoxemia por lo que es necesario administrar oxígeno suplementario junto al tratamiento con presión positiva continua133.
Sexualidad en la EPOC
Una alta proporción de los pacientes con EPOC en diversos estadios tienen algún grado de disfunción sexual (falta de deseo o impotencia) que puede alcanzar el 75%133, 134. El 94 % de las parejas han mostrado también algún grado de insatisfacción sexual134. Debe tenerse en cuenta que ciertas comorbilidades y medicaciones pueden alterar la respuesta sexual. La disnea, la fatiga y la hipoxemia pueden producir inhibición del deseo. La limitación de la actividad física en los pacientes con EPOC también altera la función sexual por disfunción eréctil134. La comunicación cercana entre el médico tratante y el paciente es de suma importancia para establecer la estrategia terapéutica. El objetivo es minimizar el gasto de energía logrando la realización satisfactoria de esta actividad. Si el uso del oxígeno está indicado durante la deambulación, también debe ser indicado durante las relaciones sexuales. Lo mismo en el caso de la ventilación mecánica no invasiva (1C)135. El uso del sildenafil como parte del tratamiento de la disfunción sexual en los pacientes con EPOC puede ser efectivo (2C)136.
Evaluación preoperatoria
La EPOC es un factor de riesgo para la cirugía86, 137. Algunas de las cirugías electivas a las que pueden ser sometidos estos pacientes incluyen: 1) cirugías generales, 2) cirugías de resección pulmonar (especialmente por cáncer), 3) cirugías para el tratamiento de la EPOC (reducción de volumen, bullectomía, trasplante pulmonar).
En todos los casos se debe valorar, y eventualmente corregir antes del procedimiento, la condición cardiovascular, el estado nutricional, los gases en sangre, cuyas alteraciones podrían contraindicar la cirugía electiva. Está indicada la realización de una espirometria en el preoperatorio de cirugía abdominal superior, de aneurisma de aorta abdominal, cuello, neurocirugía y en cirugías prolongadas (más de 3 horas) 138-140.
En las cirugías generales la probabilidad de complicaciones aumenta con: la localización de la intervención, siendo mayor en la cirugía cardíaca, pleural, pulmonar y del abdomen superior, y con la duración de la intervención (≥ de 210 min) y la gravedad de la obstrucción al flujo aéreo. Se prefieren las anestesias loco-regionales a las generales.
Para las resecciones pulmonares la operabilidad y el riesgo deben establecerse sobre la base de pruebas funcionales basadas en la estimación de los valores esperados luego de la resección. El cálculo del FEV1 postoperatorio se realiza utilizando una fórmula de predicción137: FEV1 post-neumonectomía = FEV1 pre-operatorio x (1 - y/z), donde y es el número de segmentos pulmonares obstruídos a resecar (se refiere a atelectasia por obstrucción endobronquial, y no por otro tipo de obstrucción), y z es el número total de segmentos pulmonares funcionantes. Se han propuesto algoritmos para la evaluación de la cirugía de resección pulmonar (Fig. 1)89.

Fig. 1.- Algoritmo para la evaluación pre quirúrgica de la resección pulmonar(modificado de 89)
FEV1 Volumen espiratorio formado en el primer segundo post-broncodilatador
TLCO Capacidad de difusión de monóxido de carbono
FEV1 %ppo FEV1 predicho post-operatorio en porcentaje del valor teórico
TLCO %ppo TLCO predicho post-operatorio en porcentaje del valor teórico
PECP: Prueba de ejercicio cardiopulmonar con medición del consumo de oxígeno
*Acorde a situación clínica y personal
Si no estuviera disponible la realización de una prueba de ejercicio cardiopulmonar se deben tener en cuenta otras modalidades de ejercicio: subir escaleras o PC6M. Si el paciente puede subir 5 pisos de escaleras sin interrumpir por disnea puede ser considerado para neumonectomía y si puede subir 3 pisos de escalera para lobectomía89, 141. También se ha sugerido que la distancia recorrida durante PC6M podría predecir el riesgo posoperatorio89.
La bullectomía, la cirugía de reducción de volumen pulmonar y el trasplante son tratadas en el capítulo sobre Tratamiento quirúrgico.
Tratamiento del paciente con EPOC estable
Los objetivos del tratamiento de la EPOC han sido acordados internacionalmente en la iniciativa GOLD (Tabla 4)4. El plan de tratamiento debe considerar los beneficios y riesgos individuales, como también los costos directos e indirectos para la sociedad.
TABLA 4.- Objetivos del tratamiento de la EPOC4

Prevención de la progresión de la enfermedad
La suspensión del consumo de tabaco es la medida más eficaz para evitar la progresión de la EPOC (1A)9, 142-144. En EPOC leve y moderada hay leve mejoría de la función pulmonar al cesar de fumar, en comparación con los que continúan fumando (1A)9, 142-144.
Hay evidencias no concluyentes (2A) que sugieren que pacientes con EPOC con moderada obstrucción al flujo aéreo podrían atenuar su progresión con el uso de BD de acción prolongada aunque aún debe ser comprobado en estudios prospectivos destinados a tal fin145-147.
Cesación tabáquica
Se recomienda:
- Interrogar a todo paciente sobre su condición de fumador (1A)148-150
- Motivar en cada visita médica a todo paciente con EPOC para dejar de fumar (1A)148-150
- Implementar la estrategia de las 5A para cesación tabáquica (1A) (Tabla 5)151-152
- Intervención cognitivo conductual a cargo de profesionales entrenados153
- Tratamiento farmacológico
TABLA 5.- Estrategias de las cinco A para dejar de fumar 152, 153

En la actualidad hay numerosos tratamientos farmacológicos eficaces que aumentan considerablemente las tasas de éxito (1A) (Tabla 6)149-158. Deben valorarse en todos los pacientes motivados salvo contraindicaciones previas, fumadores de poca intensidad (menos de 10 cigarrillos/día), embarazadas y adolescentes149. Las drogas de primera línea como terapia de reemplazo nicotínico, el antidepresivo bupropión y más recientemente el agonista parcial del receptor nicotínico vareniclina ha mostrado aumento en la tasa de éxito reduciendo el síndrome de abstinencia157, 158. La combinación de drogas puede ser más efectiva en lograr la abstinencia que el sólo uso de monoterapia159, 160. El uso de estos fármacos debe asociarse a intervenciones cognitivo conductuales que incluyen técnicas motivacionales, técnicas especificas de abandono del tabaco y técnicas especificas de prevención y manejo de las recaídas (1C)153, 161, 162.
TABLA 6.- Drogas de reemplazo nicotínico disponibles en la Argentina

Exposición laboral y ambiental
Una proporción significativa de pacientes con EPOC en algunos países de América Latina, especialmente mujeres, no está relacionada con el hábito de fumar y sí con la exposición a combustibles sólidos dentro del hogar16-19, 62, 163-166. Reducir la contaminación laboral, la exposición al aire ambiental contaminado (polución, humo de tabaco ambiental, etc.) y evitar la utilización de combustibles sólidos para calefacción y cocinar deben ser metas claras a nivel mundial involucrando medidas de legislación adecuada. La educación de la comunidad, personal de salud, entidades gubernamentales y organizaciones no gubernamentales son pilares de la solución19 ,62, 163-166.
Tratamiento farmacológico
Las drogas disponibles en nuestro país, en su forma farmacéutica y dosis, están enunciadas en la Tabla 7.
TABLA 7.- Fármacos disponibles en forma de aerosol presurizado, polvo seco o solución para nebulizador y dosis habituales

No ha sido demostrada la acción de los fármacos existentes para modificar la declinación de la función pulmonar a largo plazo4, 5, 70, 72, 101, 142, 145-147, 167-171. Si bien la reducción del FEV1 refleja la severidad de la obstrucción al flujo aéreo, éste no es el único criterio por el cual el tratamiento farmacológico es prescripto172. Debe tenerse en cuenta especialmente que los mayores de 50 años, asintomáticos, con relación FEV1/FVC menor a 0.7, pueden encontrarse dentro de límites normales para su edad sin requerir tratamiento. Otros factores, como la presencia y evolución de la disnea y otros síntomas, número y severidad de las exacerbaciones y alteraciones del índice de masa corporal, deben ser utilizados en la elección de la terapéutica. Tratamientos adicionales están siendo evaluados ante la presencia de efectos sistémicos98.
a) Broncodilatadores:
Son los fármacos centrales para el manejo sintomático de la EPOC estable4, 173-175.
En la práctica clínica se utilizan tres tipos de broncodilatadores:
- ß2 agonistas de acción corta y prolongada
- Anticolinérgicos de acción corta y prolongada
- Metilxantinas
- Tratamiento combinado
1.- ß2 agonistas (BDß2) de acción corta y prolongada
La efectividad terapéutica de los BDß2 no solamente debe ser valorada por la función pulmonar, sino también por otras medidas como la mejoría de los síntomas, la actividad diaria y la tolerancia al ejercicio físico (1A)172- 174, 176-180.
Los BDß2 de acción corta y prolongada pueden incrementar la tolerancia al ejercicio y calidad de vida sin modificar el FEV1 176-182. Los BDß2 de acción corta se utilizan como medicación de "rescate" (1A). Para el tratamiento regular de la EPOC sintomática se indican los broncodilatadores de acción prolongada (1A)178-184. Los beta 2 agonistas de acción prolongada se usan desde 1990 en pacientes con EPOC, mejorando la disnea, la función pulmonar,la calidad de vida, reduciendo también las exacerbaciones de la enfermedad185.
En nuestro país se encuentran disponibles BDß2 de acción corta (salbutamol, fenoterol, terbutalina), de acción prolongada (salmeterol y formoterol) y los también llamados de acción ultraprolongada (indacaterol). Todos tienen una potencia broncodilatadora similar, pero la duración de efecto de los tres primeros es cercana a las 4-6 horas, mientras que el salmeterol y formoterol poseen un acción de 12 horas y el indacaterol 24 horas. El formoterol comienza a actuar en 1 a 3 minutos por lo que puede utilizarse como medicación de rescate, mientras el salmeterol inicia su acción farmacológica dentro de los 30 minutos lo cual debe advertirse al paciente183.
Preferentemente se usan aerosoles presurizados o dispositivos de polvo seco en pacientes con EPOC186. Las aerocámaras, espaciadores y aerocámara valvulada se recomiendan para pacientes que usan incorrectamente los aerosoles187. El uso de nebulizaciones debe dejarse para aquellos pacientes que no puedan usar los métodos anteriores adecuadamente (imposibilidad de coordinar el disparo con la inspiración)188.
Debe asegurarse una correcta técnica inhalatoria y corregirse la misma en cada visita189:
a. El médico debe demostrar personalmente todos los pasos a seguir para realizar una técnica inhalatoria correcta con los diferentes dispositivos.
b. El paciente debe practicar enfrente del médico de manera tal de poder corregir los errores.
c. El paciente debe ser evaluado periódicamente, corrigiendo cuando sea necesario.
d. El paciente debe ser estimulado por el profesional para practicar una maniobra inhalatoria adecuada.
2.- Anticolinérgicos (antimuscarínicos) de acción corta y prolongada
Los anticolinérgicos de acción corta como el ipratropio tiene un efecto broncodilatador más prolongado que los BDß2 de acción corta, pudiendo durar hasta 8 horas175. En la actualidad se utilizan habitualmente como rescate 4.
El tiotropio tiene una duración de acción de 24 horas190. Este fármaco mejora la calidad de vida, la tolerancia al ejercicio físico, reduce las exacerbaciones de la enfermedad y las hospitalizaciones, disminuye los costos en salud y aumenta la efectividad de la rehabilitación respiratoria (1A)145, 147, 191-198. Un estudio multicéntrico llevado a cabo durante 4 años en pacientes con EPOC moderada y grave demostró que el tiotropio mantiene la mejoría obtenida en la función pulmonar, prolonga el tiempo hasta la primera exacerbación y reduce significativamente su número, disminuye la probabilidad de internaciones por exacerbación y mejora la calidad de vida, habiéndose hallado recientemente en otro estudio superioridad sobre el salmeterol en su acción preventiva145, 199. Dicho estudio reafirma el perfil de seguridad de tiotropio al reducir la morbilidad respiratoria y cardíaca. Un estudio sugiere disminución en la progresión de la obstrucción al flujo aéreo en los pacientes en estadío II de la clasificación GOLD lo que debe aún probarse en estudios prospectivos longitudinales específicamente dirigidos a este grupo147.
3.- Metilxantinas
La teofilina tiene un modesto efecto sobre el FEV1 y mejora la PaO2. Sin embargo, dada su potencial toxicidad no es droga de primera elección como los broncodilatadores inhalatorios200. Todos los estudios que han demostrado la eficacia de la teofilina en EPOC han sido realizados con preparados de acción lenta201, 202. La teofilina en pacientes añosos debe ser utilizada con precaución debido a diferencias en la farmacocinética en relación a pacientes más jóvenes, la presencia de comorbilidades y el uso de otras medicaciones que puedan modificar su metabolismo. En este contexto, la dosis de teofilina debe disminuirse cuando se prescriben antibióticos macrólidos o fluoroquinolonas. La teofilina en baja dosis (100 a 250 mg dos veces por día) restablecería la actividad antiinflamatoria de los corticoides y se ha hallado reducción en el número de exacerbaciones en comparación con placebo (1B)203-205. La dosis inicial de teofilina es de 10 mg por Kg de peso (a partir de 300 mg). En pacientes obesos, el cálculo de la dosis adecuada debe realizarse usando el peso ideal. Preferentemente debe medirse los niveles de la droga pico en sangre a fin de evitar efectos colaterales, obteniendo la muestra entre las 3 y 7 horas después de una dosis matinal de una preparación de 12 horas y 8 a 12 horas después de una dosis de 24 horas de acción farmacológica. En general, los pacientes con EPOC, pueden ser adecuadamente tratados con niveles sanguíneos entre 8 y 12 ug/ml, efectuando controles cada 6 a 12 meses4.
4.- Tratamiento combinado
Cuando el paciente tratado con monoterapia continúa sintomático, deben usarse combinaciones de diferentes clases de BD. Sus diferentes mecanismos y duración de acción pueden aumentar el grado de broncodilatación y disminuir los efectos colaterales.
La combinación de BDß2 y anticolinérgicos de acción corta es más efectiva en la respuesta del FEV1 y en forma más sostenida que uno de ellos por separado, evitando el fenómeno de tolerancia en un período de tres meses (1A)206-209. También el uso combinado de tiotropio más formoterol una o dos veces diarias ha demostrado ser eficaz en mejorar la obstrucción al flujo aéreo, reducir la hiperinsuflación en reposo y disminuir el uso de broncodilatadores de acción corta como rescate teniendo un efecto aditivo a lo largo del intervalo de 24 h (1B)210-212. Otro estudio sugiere que el uso de salmeterol combinado con tiotropio también es más efectivo que el uso de estas drogas por separado213. Estudios utilizando combinaciones de BDB2 agonistas de acción prolongada con teofilina han demostrado una reducción en el número de exacerbaciones y/ó disminución de los síntomas y menor uso de BDß2 de acción corta a demanda en pacientes en estadio GOLD III y IV que presentan exacerbaciones frecuentes (2B)214-216.
b) Corticoides
No se recomienda el tratamiento a largo plazo con corticoides orales en la enfermedad estable dados sus importantes efectos colaterales (1A)4.
Estudios a corto plazo han mostrado resultados inconsistentes entre el efecto de los corticoides inhalados y el proceso inflamatorio en la EPOC217-220. En estudios a largo plazo, en pacientes con EPOC grave, los corticoides inhalados no han demostrado cambios significativos en la caída anual del FEV1 167-168, 170, 221-225. En este subgrupo de pacientes, los corticoides inhalados reducen la frecuencia de las exacerbaciones mejorando el estado general de salud, y combinados con BDß2 de acción prolongada son más efectivos que sus componentes individuales211, 223, 226-231. Su acción preventiva no estaría relacionada con el nivel de función pulmonar basal según se desprende de un reciente meta-análisis232. La mortalidad de los pacientes tratados con salmeterol o fluticasona sola fue similar con respecto al placebo en un metanálisis233. Los efectos adversos de los corticoides inhalados incluyen candidiasis oral, disfonía, equimosis cutáneas, osteopenia y cataratas. Se ha hallado una mayor incidencia de neumonías en pacientes tratados con fluticasona versus placebo en diversos estudios aunque sin incremento de mortalidad218, 231, 234-235.
c) Tratamiento combinado con BD y corticoides inhalados
Enfoque según gravedad de la enfermedad:
Estudios utilizando combinaciones de BDß2 agonistas de acción prolongada con corticoides inhalados han demostrado una reducción en el número de exacerbaciones y/ó disminución de los síntomas y menor uso de BDß2 de acción corta a demanda en pacientes en estadio GOLD III y IV que presentan exacerbaciones frecuentes (1A)184, 186-192, 214-216, 226, 236-239. La combinación de tiotropio con salmeterol y fluticasona mejoró la función pulmonar, calidad de vida y número de hospitalizaciones aunque no redujo la frecuencia de exacerbaciones severas240. Una evidencia reciente sugiere que el uso de la terapia triple combinando budesonide y formoterol más anticolinérgicos (tiotropio) beneficia a los pacientes con EPOC grave mejorando la función pulmonar, el estado de salud, la actividad diaria, y disminuyendo los síntomas matutinos y exacerbaciones graves en mayor grado que con el solo uso de tiotropio (2B)241, 242.
En resumen, el enfoque del tratamiento mediante la utilización de BD y corticoides inhalados debe ajustarse a la gravedad de la obstrucción y a la persistencia de los síntomas. Los pacientes con obstrucción leve al flujo aéreo (GOLD I), asintomáticos, no requieren tratamiento broncodilatador(1A) . Cuando los síntomas son solo ocasionales deben recibir BD de acción corta como rescate. En aquéllos con EPOC leve/moderada (GOLD I/II), particularmente con FEV1 < 60% del teórico normal, que presentan disnea, tos o expectoración crónicas, debe indicarse un tratamiento en forma regular con un broncodilatador de acción prolongada (1B)243. En pacientes con obstrucción grave(GOLD III) y síntomas el tratamiento combinado de inicio (tiotropio/BDß2 de acción prolongada) es la opción más adecuada. Los corticoides inhalados deben agregarse sólo en caso de exacerbaciones frecuentes, aunque una adecuada valoración entre su costo y su riesgo-beneficio aún requieren mayor evaluación172, 222, 226, 232, 241, 242. En la Figura 2 se propone un algoritmo tentativo de tratamiento farmacológico que resume esta secuencia y al cual se suma la rehabilitación respiratoria.

Fig. 2.- Algoritmo para el tratamiento farmacológico de la EPOC incluyendo rehabilitación respiratoria BD: Broncodilatadores AP: Acción prolongada AC: Anticolinérgicos ß2: Beta-adrenérgicos CI: Corticoides inhalados
d) Tratamientos farmacológicos adicionales
A continuación, se detallan otros tratamientos farmacológicos:
1) Vacunas
Se recomienda la vacunación anual anti-infuenza con virus inactivados (vivos o muertos) dado que reduce el riesgo de morbimortalidad en situación de epidemia en los pacientes con EPOC (1A)244, 245. Cada año la Organización Mundial de la Salud, sugiere la fórmula para el hemisferio sur para ser administrada en el otoño246, 247. La vacuna antineumocócica se recomienda en aquellos pacientes con EPOC mayores de 65 años una vez en la vida, y en menores de 65 años con un refuerzo a los 5 años de la primer dosis, habiéndose hallado una reducción de la incidencia de neumonía aguda de la comunidad en pacientes con EPOC menores a 65 años con FEV1<40% del valor teórico normal (1B)248-250.
2) Antivirales
Zanamivir y oseltamivir, inhibidores de la neuraminidasa de los virus de influenza A y B, son recomendados por vía inhalada y oral respectivamente en pacientes adultos que presenten síntomas compatibles con gripe y dentro de las 48 horas del inicio de los síntomas251.
3) Terapia sustitutiva con AAT
Su impacto en la disminución de la velocidad de declinación del FEV1, ha sido variable, habiéndose demostrado una significativa reducción (13.4 ml/año) en los pacientes con FEV1 30-65% del valor teórico normal, mientras que en aquellos con FEV1 < 30% o > 65%, esta tendencia no alcanzó a ser significativa252-255. Ello ha llevado a indicar el tratamiento sustitutivo con AAT en los pacientes jóvenes, con FEV1 entre 35 y 60% del valor teórico, con enfisema y deficiencia severa de AAT (PiZZ, PiZnulo y nulo/nulo) (niveles menores a 11uM/ml) si bien ello debe ser evaluado en cada caso en particular (1B)75. Un estudio, no aleatorizado, demostró impacto reductor del tratamiento sustitutivo en la mortalidad253. Este hallazgo, unido a una significativa caída en el coeficiente de transferencia de CO (KCO) y pérdida de densidad tomográfica observado en los pacientes con obstrucción muy grave (FEV1 < 30%), ha sugerido progresión de la lesión parenquimatosa y evidencia suficiente como para recomendar también el tratamiento en este estadio avanzado de la enfermedad (1C)256, 257.
4) Antibióticos profilácticos
Estudios recientes han demostrado beneficios en la reducción de la frecuencia de exacerbaciones con la utilización de macrólidos en forma profiláctica a dosis bajas dos a tres veces por semana258, 259. Sin embargo, estos resultados no son uniformes y aún se requiere determinar su verdadero papel en el tratamiento de la EPOC antes de indicar su recomendación rutinaria260. Sus propiedades antiinflamatorias se deberían a una menor acumulación de neutrófilos por reducción en la expresión de citoquinas pro-inflamatorias (IL8), y a la producción de moléculas de adhesión. En la EPOC, es también importante su efecto antipseudomonas258.
5) Mucolíticos - Antioxidantes
Se han encontrado resultados controvertidos acerca de su uso regular en pacientes con EPOC261, 262. Aunque algunas revisiones sistemáticas han hallado resultados favorables en la reducción del número de exacerbaciones, en un estudio aleatorizado controlado con placebo no se ha demostrado mejoría en la declinación del FEV1, aunque un subgrupo que no recibió corticoides inhalados evidenció significativa reducción de dichos episodios y mejoría en la calidad de vida263-266. Su uso debe ser considerado en aquellos pacientes con marcada broncorrea (2B) y continuarse sólo si se observa mejoría70.
6) Inmunorreguladores
Si bien algunos estudios relativamente pequeños o no controlados han demostrado beneficios con marcada reducción de las exacerbaciones utilizando un inmunoestimulante detoxificado proveniente de ocho bacterias se considera que la evidencia existente (2B) es aún insuficiente como para recomendar su uso habitual267-270.
7) Antitusígenos
No se recomienda su uso dado el rol protectivo de la tos (1A), salvo en casos de constituirse en un síntoma incoercible69, 70, 271.
8) Narcóticos
Los opioides orales y parenterales son útiles para tratar la disnea inmanejable en el paciente con EPOC terminal272. No hay datos sobre la morfina nebulizada. Se debe realizar una evaluación riesgo-beneficio dado el perfil de seguridad de estas drogas 273-278.
9) Otros
El uso de diuréticos puede considerarse cuando los pacientes presentan edema por corazón pulmonar crónico70. La digoxina no está indicada a menos que exista fibrilación auricular crónica o insuficiencia ventricular izquierda. Los inhibidores de la enzima convertidora de la angiotensina (ECA) reducen la hipertensión pulmonar y podrían neutralizar el efecto proinflamatorio de la angiotensina II, y aún reducir la hiperinflación en pacientes con EPOC279, 280. Además, se utilizan a menudo en el tratamiento de comorbilidades frecuentes en la EPOC (hipertensión arterial, diabetes), razones por las cuales un ensayo clínico prospectivo con respecto a sus posibles beneficios merece emprenderse. La utilización de beta bloqueantes ha sido tradicionalmente contraindicada en la EPOC por temor a causar broncoespasmo281. Sin embargo, recientes observaciones en sugieren que su administración es bien tolerada y que pueden reducir el número de exacerbaciones y la mortalidad (2C)282-285. No obstante, el tema es controvertido y aun cuando existen bases experimentales para su uso éste debe ser estrechamente vigilado286.
Una revisión sistemática de nueve trabajos referido a la acción de las estatinas sobre diversas variables en EPOC (número de exacerbaciones, número de intubaciones relacionadas a la enfermedad, función pulmonar- FEV1/FVC-, capacidad al ejercicio físico, mortalidad por EPOC y todas las causas de enfermedad) mostró algunos beneficios en las mismas. Sin embargo, varios de estos estudios tenían limitaciones metodológicas ya que eran retrospectivos, y heterogéneas las poblaciones estudiadas287. Se requieren estudios prospectivos, aleatorios y controlados con placebo, que aporten evidencia sobre esta interesante posibilidad.
Roflumilast, un inhibidor de la fosfodiesterasa 4, ha producido cierto beneficio en la función pulmonar (FEV1) y el número de exacerbaciones en el subgrupo de pacientes con EPOC que presentan agudizaciones frecuentes y tos y expectoración crónicas en dos ensayos clínicos aleatorizados (2B), aunque los efectos colaterales podrían limitar su uso288, 289.
Oxígenoterapia crónica domiciliaria (OCD)
El tratamiento con OCD aumenta la supervivencia de los pacientes con EPOC grave e insuficiencia respiratoria (1A)239, 290, 291.
A) Indicaciones4-6, 72, 73, 292
1) Criterios generales para su indicación:
- Presión parcial arterial de oxígeno (PaO2) <55 mmHg, respirando aire a nivel del mar o
- PaO2 entre 55 y 60 mm Hg que se acompaña de poliglobulia, insuficiencia cardíaca derecha y/o hipertensión pulmonar, en el paciente estable (1A).
El objetivo es mantener una PaO2>60 mm Hg o SpO2>90%. Si se inicia luego de una exacerbación reevaluar en 1 a 3 meses.
2) Oxígenoterapia durante el ejercicio:
La oxígenoterapia durante el ejercicio disminuye la disnea y mejora la tolerancia a la carga de trabajo submáxima mejorando la confianza y la autonomía del paciente293-299. Los pacientes con EPOC pueden estar hipoxémicos en reposo o presentar caída de la PaO2 con el ejercicio. La oxígenoterapia durante el mismo es administrada a ambos grupos si bien faltan conclusiones a largo plazo sobre su utilidad y su costo-beneficio es controvertido73, 297, 300. La titulación del flujo de O2 requerido durante el ejercicio debe llevarse a cabo mientras el paciente realiza un nivel de esfuerzo habitual a fin de mantener una SpO2 superior a 90%73.
Los pacientes que cumplen los criterios de OCD y tienen limitación al esfuerzo por disnea deben utilizar equipos portátiles de oxígenoterapia que faciliten la deambulación, puesto que reduce el síntoma y disminuye la hiperinsuflación dinámica, aumentando la tolerancia al ejercicio y su autonomía (2B)292. En quienes no presentan criterios de OCD puede considerarse la oxígenoterapia durante el ejercicio sólo si se comprueba de manera objetiva la mejoría de síntomas y la tolerancia al esfuerzo (2C)73.
3) Oxígenoterapia durante el sueño:
Cuando el paciente cumple criterios de OCD el aumento nocturno del flujo de oxígeno evita desaturaciones frecuentes y prolongadas (1B)301. Si no se cumplen criterios de OCD puede considerarse sólo si durante el sueño el paciente presenta más del 30% del tiempo de sueño una SpO2<90% o hipertensión pulmonar, insuficiencia cardíaca derecha o poliglobulia (2C), no estando demostrado que mejore la supervivencia302, 303.
4) Oxígenoterapia en vuelo:
Los vuelos aerocomerciales se desarrollan entre 11 000 y 12 000 m. (ambiente incompatible para la vida). Por esta razón los aviones presurizan su cabina a una altura equivalente a los 2400 metros (8000 pies) en donde la fracción inspirada de oxígeno es equivalente a 15%73,304-308. No es necesario el suministro de O2 suplementario durante el vuelo si la SpO2 del paciente en reposo, respirando aire y a nivel del mar es >95%, o PaO2 > 70 mm Hg. Se deben evaluar los pacientes cuya SpO2 está entre 92 y 95%, o PaO2 < 70 mm Hg y tienen factores de riesgo. En aquéllos en que la PaO2 predicha durante el vuelo sea menor de 50 mm Hg, se indicará usar O2 suplementario73,308. Pueden utilizarse diferentes estrategias para evaluar su necesidad73, 308-311. Las más recomendables son las ecuaciones de predicción como el nomograma de Gong y la prueba de simulación hipóxica312-314. Esta evaluación debe ser realizada por el especialista. Si se considera O2 suplementario debe administrarse a 2 l/min, o 2 l/min sobre el valor previo si ya se utilizaba273.
Si la EPOC es grave, la situación clínica debe ser estable para autorizar el vuelo ya que en estas circunstancias se experimenta una caída de la PaO2 de 25 mm Hg o mayor. Se recomienda tener especial cuidado si existen comorbilidades como anemia e insuficiencia cardiaca. Una reciente publicación reseña el estado de la oxígenoterapia en vuelo en la Argentina311.
B) Recomendaciones
- Los valores de gases en sangre son necesarios para establecer la indicación de oxígenoterapia e informar sobre el estado ácido base.
- Para el seguimiento y titulación, en lugar de gases en sangre se puede utilizar la SpO2.
- El efecto de la administración depende de la duración: los beneficios de 18 horas por día son mayores vs. 12 horas diarias (1A). No se recomienda menos de 12 h290, 291 (1A). Debe insistirse en el cumplimiento dado que la adhesión es a menudo deficitaria315.
- La OCD no disminuye la mortalidad en pacientes con moderada hipoxemia (PaO2>60 mm Hg)316.
- La indicación de oxígenoterapia, al igual que todo medicamento, debe incluir una orden médica, donde conste: equipo con el cual se suministra el O2 (tubo, concentrador, reservorio con mochila, otros), cantidad de horas diarias de uso, el flujo indicado (en reposo, durante el ejercicio y sueño), la forma de administración ("bigotera", máscara, otros).
- La fuente de suministro más utilizada cuando el paciente no realiza actividades fuera del hogar es el concentrador de O2. En caso de realizar actividad fuera del hogar se requiere un equipo portátil, ya sea un concentrador (Evergo portable oxygen concentrator) o bien una "mochila" recargable desde un reservorio de O2 líquido.
- El objetivo del tratamiento es mantener la SpO2>90% (PaO2>60 mm Hg), en reposo, ejercicio y sueño, lo cual preserva la función de los órganos vitales.
- La educación del paciente sobre los efectos de la utilización puede mejorar su cumplimiento.
- Es posible el uso simultáneo de ventilación no invasiva (VNI) en casos seleccionados317, 318.
- El uso de humidificación no está justificada cuando el flujo es inferior a 4 l/min319.
Rehabilitación respiratoria
La rehabilitación respiratoria (RR) es un tratamiento dirigido a las personas con EPOC con síntomas persistentes y a sus familiares, generalmente realizadas por un equipo multidisciplinario de especialistas, con el objetivo de mejorar y mantener el máximo grado de independencia y funcionamiento en su comunidad4, 320-325. Los objetivos principales de un programa de RR son reducir los síntomas, mejorar la calidad de vida e incrementar la participación física y emocional en las actividades de la vida diaria4, 323. En la Tabla 8 se detallan los beneficios de la RR y en la Tabla 9 la metodología a emplear.
TABLA 8.- Beneficios de la rehabilitación respiratoria
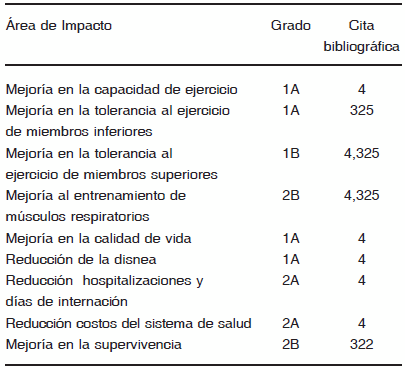
TABLA 9.- Metodología en rehabilitación respiratoria

Estrategias específicas para incrementar los beneficios del entrenamiento
1. Oxígeno suplementario: En quienes presentan desaturación durante el ejercicio (1C)320, 322, 324-326.
2. VNI: En pacientes seleccionados con EPOC grave y muy grave, y en aquéllos con respuestas sub-óptimas al ejercicio, la utilización de la VNI permitiría alcanzar mayor intensidad de entrenamiento y disminuir la sobrecarga de los músculos respiratorios (2B)320, 322-323. También puede estar indicada en el subgrupo de pacientes que presentan hipercapnia crónica (2B)327, 328.
3. Electroestimulación neuromuscular (NMES): La NMES es la estimulación eléctrica de los músculos periféricos que produce una contracción pasiva. La NMES puede ser una terapia adjunta para los pacientes con EPOC grave que estén en cama o con extrema debilidad de músculos periféricos (2C)320, 323.
4. Entrenamiento de músculos respiratorios: Se sugiere, bajo la modalidad de carga elástica umbral inspiratoria, indicarlo sólo a pacientes que no tienen posibilidad de entrenar otros grupos musculares, o aquéllos con PiMax inferior a -60 cm H2O y PeMax normal, asociado a entrenamiento de otros grupos musculares (1C)323.
5. Entrenamiento de fuerza: Se recomienda como complemento del entrenamiento aeróbico adicionar el entrenamiento de fuerza en los miembros superiores e inferiores (1B)323.
La RR debe ser llevada a cabo por un equipo multidisciplinario con dedicación y experiencia en su ejecución. Su indicación debe formularse en pacientes con enfermedad moderada a muy grave cuyos síntomas no responden al tratamiento con broncodilatadores (Fig. 2).
Educación
La educación es un componente fundamental dentro del tratamiento de la EPOC que debe integrarse con la rehabilitación329, 330. La educación mejora la respuesta del paciente ante la enfermedad, el automanejo, el uso correcto de dispositivos y el concepto de adherencia para continuar la actividad física post-rehabilitación. Un programa de automanejo de las exacerbaciones condujo a una significativa reducción de las hospitalizaciones por esta causa (17.3%) en comparación con quienes siguieron el cuidado usual (36.3%)331. Una revisión sistemática demostró una disminución en el uso de recursos hospitalarios con la implementación de programas de automanejo integrados con un modelo de cuidado crónico (1B)332.
Nutrición
Un adecuado régimen nutricional debe implementarse en los pacientes que han perdido peso complementado por un adecuado régimen de ejercicio y rehabilitación333-336.
Tratamiento quirúrgico del enfisema
Aquellos pacientes que continúan sintomáticos por disnea y limitación al ejercicio luego de un máximo y óptimo tratamiento médico, son candidatos a ser evaluados para alguna de las opciones quirúrgicas. Las disponibles son tres: bullectomía, cirugía de reducción volumétrica y trasplante pulmonar.
Bullectomía: Se realiza en pacientes seleccionados para liberar el parénquima desplazado por una bulla hiperinsuflada. Es efectiva en reducir la disnea y aumentar la distancia recorrida en la PC6M4, 337. Las bullas de más de 1/3 de hemitórax con evidencia de compresión parenquimatosa y función pulmonar conservada se benefician con el tratamiento quirúrgico (1A)338. Una cuidadosa evaluación funcional y clínica debe llevarse a cabo en quienes presenten evidencia tomográfica de enfisema en aquellos sectores pulmonares remanentes destinados a expandirse luego de la bullectomía.
Cirugía de reducción volumétrica: La cirugía de reducción de volumen pulmonar debe considerarse sólo en pacientes seleccionados con enfisema heterogéneo a predominio de lóbulos superiores, con baja capacidad de ejercicio y FEV1 y TLCO > 20%, habiéndose obtenido mejoría en la calidad de vida, tolerancia al esfuerzo y aumento de la supervivencia (1A)80, 339. En los pacientes con enfisema homogéneo y FEV1 o TLCO < de 20% esta cirugía no debe ser indicada dada su alta mortalidad y escasos beneficios (1A)80, 339.
Trasplante pulmonar: El trasplante pulmonar debe ser considerado en pacientes menores de 65 años, con clase funcional III-IV y esperanza de vida menor a 2 años. El trasplante ha demostrado mejorar la calidad de vida y la capacidad de ejercicio en pacientes altamente seleccionados340. Debido a los prolongados tiempos de espera, la recomendación actual es que aquellos pacientes con índice de BODE de 5 o más sean referidos para evaluación pretrasplante. Se aconseja trasplantar a aquellos con un BODE de 7 puntos o más con alguna de las siguientes características341:
- Hospitalización por exacerbación con hipercapnia PaCO2 > 50 mm Hg
- Hipertensión pulmonar o cor pulmonale a pesar del tratamiento con oxígeno.
- FEV1< 20% con TLCO < 20% o enfisema homogéneo. La decisión de someter a un paciente a estas indicaciones quirúrgicas debe ser formulada por equipos con experiencia en centros quirúrgicos capacitados.
Dada la alta morbilidad de la cirugía de reducción de volumen y del trasplante pulmonar otros procedimientos sustitutivos se han intentado. La colocación de válvulas por vía endoscópica con el fin de reducir el volumen pulmonar se encuentra en pleno desarrollo aún cuando los beneficios obtenidos son modestos con aumento de efectos indeseados como infecciones y hemoptisis342, 343. Ello impide recomendar su uso a la fecha.
Evaluación de los resultados del tratamiento
Las pruebas de función pulmonar (FEV1, FVC, TLCO, RV, TLC, PC6M) constituyen parámetros objetivos esenciales para evaluar los resultados de las intervenciones médico-quirúrgicas en los pacientes con EPOC. El tratamiento debe ser evaluado teniendo en cuenta -además de la función pulmonar- la mejoría en los síntomas (disnea, tolerancia al ejercicio), en la calidad de vida y la frecuencia de exacerbaciones. En la Tabla 10, propuesta por P. Jones, se incluyen preguntas útiles para evaluar individualmente el resultado del tratamiento344. Diversos cuestionarios que evalúan la calidad de vida han sido propuestos, algunos de ellos específicos para EPOC (CAT, CRQ, SGRQ)345-347. Éstos tienen utilidad para apreciar los cambios ocurridos como resultado de intervenciones en grupos numerosos de pacientes en fase estable.
TABLA 10.- Evaluación de la respuesta al tratamiento344

La respuesta positiva a 4 o más de estas preguntas indica una mejoría significativa en el cuestionario respiratorio de calidad de vida de Saint George
Manejo de la EPOC en estadios avanzados
En los pacientes en estadio GOLD IV o con un índice BODE de 6 puntos o más, y exacerbaciones frecuentes o que requieran hospitalización y/o presenten hipertensión arterial pulmonar, se deben contemplar en particular medidas terapéuticas para mejorar la calidad de vida y, si es posible, la sobrevida. Es preciso contar con la participación del enfermo y sus familiares. El paciente debe estar preferentemente en situación clínica estable o aún en la fase de recuperación de un episodio agudo, disponer de aceptable capacidad cognitiva y de información adecuada sobre sus futuros problemas y las diferentes alternativas existentes. Se requiere considerar todas las dimensiones necesarias, intentando favorecer la autonomía del paciente y su mejor calidad de vida348- 351. Las medidas a tener en cuenta incluyen: evaluación y soporte nutricional, RR, OCD; asistencia respiratoria mecánica domiciliaria no invasiva o invasiva; cirugía de reducción volumétrica pulmonar y/o trasplante pulmonar.
Aspectos médicos y bioéticos en situaciones terminales
Es necesario considerar los deberes del equipo de salud, los derechos del paciente y el diálogo profundo con el paciente y la familia. Las decisiones del equipo médico en lo que hace a la abstención o retiro de los medios de soporte vital, deben ser discutidas y compartidas por el grupo asistencial y en caso de dudas o desacuerdos, resultará pertinente la consulta con el Comité de Ética de la institución349, 352.
Indicaciones de derivación al especialista
Las indicaciones de derivación al especialista del paciente con EPOC son listadas en la Tabla 11 353.
TABLA 11.- Indicaciones de derivación al especialista

Valoración del deterioro e incapacidad
La incapacidad es definida por la Organización Mundial de Salud como la restricción o falta de capacidad para realizar cualquier actividad dentro del rango "normal" para un ser humano354. Para evaluar objetivamente la incapacidad de causa respiratoria se realizan los siguientes estudios: 1. Espirometría; 2. TLCO; 3. Gases en sangre arterial; 4. Prueba de ejercicio cardio-pulmonar. La Sociedad Americana de Tórax y la Asociación Médica Americana han propuesto útiles clasificaciones de deterioro e incapacidad (Tabla 12)355, 356.
TABLA 12.- Clasificación de incapacidad respiratoria (Asociación Médica Americana)355-356 modificada*
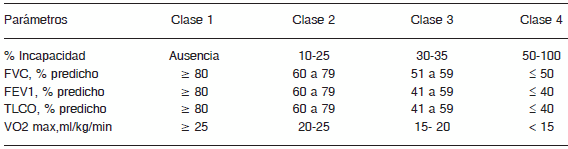
*La relación FEV1/FVC debe ser siempre menor de 70% en las clases 2, 3 y 4, mientras que la clase I es igual o mayor del 70%
Exacerbación de la EPOC (E-EPOC)
La definición de E-EPOC ha sido motivo de múltiples discusiones entre expertos. Desde el año 2000 se ha adoptado la siguiente definición de E-EPOC: "Un empeoramiento sostenido de la condición del paciente, más allá de la situación estable y de las fluctuaciones diarias, que es aguda en su comienzo y necesita un cambio en la medicación regular de la EPOC"357, 358. Este deterioro debe diferir de las variaciones diarias. Sus manifestaciones clínicas (incremento de la disnea, tos, volumen y purulencia del esputo) son consecuencia del aumento de la inflamación de la vía aérea habitualmente desencadenada por un agente infeccioso (viral, bacteriano o mixto) o polución ambiental359, 360. La E-EPOC produce además inflamación sistémica361-363. El neumotórax, la tromboembolia venosa, la insuficiencia cardiaca, el derrame pleural y la neumonía producen síntomas similares a una E-EPOC, siendo necesario descartarlos. El papel de las bacterias en la E-EPOC es difícil de precisar por la frecuente colonización de la vía aérea. Algunos pacientes EPOC tienen colonización persistente con Haemophilus influenzae, lo que afecta la frecuencia y gravedad de las exacerbaciones364.
Impacto en el paciente y la sociedad
La E-EPOC está asociada a significativa morbi-mortalidad y costos en salud. En el paciente provoca una reducción del FEV1 y de la PC6M. La repetición de los episodios agudos causa pérdida acumulativa en la función pulmonar y en la calidad de vida de los sujetos. Estos cambios se estabilizan durante la recuperación, pero si en el período de convalecencia se produce otra exacerbación, el deterioro se hace progresivo365. Causan considerable impacto económico debido al ausentismo laboral y al costo de las internaciones cuyo número se ha incrementado en los últimos años366-367. La mortalidad hospitalaria es del 10%, incrementándose al 25% en los pacientes internados en áreas de cuidado crítico367. Su reiteración es índice pronóstico de mayor mortalidad368-370.
Gravedad de la E-EPOC
Existen exacerbaciones limitadas, frecuentemente manejadas por los propios pacientes en su domicilio sin consulta profesional incrementando el uso de BD de rescate. Éstas son consideradas leves. Los episodios que requieren tratamiento con corticoides y/o antibióticos indicados por un médico son considerados de severidad moderada. Cuando el cuadro requiere hospitalización la exacerbación es considerada severa.
Clasificación según necesidad de tratamiento hospitalario
Basándose en la necesidad de usar diferentes niveles de complejidad de atención médica, la Sociedad Americana de Tórax y la Sociedad Europea Respiratoria realizaron la siguiente clasificación: Nivel 1: tratamiento ambulatorio. Nivel 2: tratamiento hospitalario. Nivel 3: falla respiratoria y tratamiento en UTI5. La Tabla 13 resume los diferentes tópicos de evaluación, nivel de complejidad requerido para el tratamiento de la E-EPOC y los exámenes complementarios a solicitar4-5. La decisión de hospitalización se basa en la severidad de los síntomas (disnea, cianosis, nivel de conciencia, edemas), presencia y gravedad de comorbilidades, gravedad de la EPOC, capacidad del paciente y entorno para manejarse adecuadamente en su domicilio.
TABLA 13.- Historia clínica, examen físico y procedimientos diagnósticos según niveles de complejidad del tratamiento 5 modificada
#: Las comorbilidades predictoras de mal pronóstico son la insuficiencia cardíaca, enfermedad coronaria, diabetes mellitus, falla renal o hepática.
¶: análisis de sangre incluyen hemograma, ionograma, función renal y hepática,
+: Dosaje de drogas en sangre: considerarlo si el paciente usa teofilina, warfarina, carbamazepina o digoxina.
Tratamiento ambulatorio de las E-EPOC
Broncodilatadores: Se debe incrementar la dosis y/o frecuencia del tratamiento broncodilatador de acción corta preexistente, de preferencia con un ß2 agonista. Si no se ha utilizado antes, puede agregarse un anticolinérgico de acción corta206-209.
Glucocorticoides: los glucocorticoides sistémicos son beneficiosos porque acortan la recuperación, ayudan a restaurar la función pulmonar (FEV1) y corrigen más rápidamente la hipoxemia (1A)367, 371-377. Se recomienda usar glucocorticoides sistémicos en pacientes con FEV1 menor de 50% en situación estable; la dosis recomendada es de 30-40 mg de prednisolona por día, durante 7 días4, 367, 376, 378.
Antibióticos: deben utilizarse cuando hay purulencia en el esputo, aumento de la disnea y del volumen de esputo (1A)367, 379. Los agentes infecciosos pueden ser virales o bacterianos. Las bacterias predominantes en las vías aéreas inferiores son H. influenzae, Streptococcus pneumoniae y Moraxella catarrhalis y están presentes en un 30% de los casos. Los virus Influenza A o B, Parainfluenza, Rhynovirus, Coronavirus y Syncicial Respiratorio están asociados a las exacerbaciones aproximadamente en el 25% de los casos5, 247, 371. La asociación de bacterias y virus, también son causantes de las exacerbaciones en un 25%371.Otros patógenos son Mycoplasma pneumoniae y Chlamidia pneumoniae, pero no se conoce su verdadera prevalencia4. En EPOC muy severa hay mayor frecuencia de infecciones por bacilos Gram negativos, especialmente enterobacterias y pseudomonas. La elección del antibiótico debe basarse según su uso previo y la sensibilidad local de los citados gérmenes367, 371, 380-381. La Pseudomonas aeruginosa se aísla con mayor frecuencia en pacientes con exacerbaciones que requirieron hospitalización, o que tienen un FEV1 <50% del teórico382, 383. La moxifloxacina y la levofloxacina se recomiendan para el tratamiento de las E-EPOC leves y moderadas a severas, sin factores de riesgo para P. aeruginosa382.
Hay una marcada correlación entre la gravedad de la obstrucción con el tipo de patógeno infectante384, 385. La purulencia del esputo es uno de los factores más importantes asociados con la presencia de infecciones bacterianas72, 379, 386. Los antibióticos son ampliamente recomendados en la exacerbaciones con esputo purulento (1A)4-5, 70, 247, 292, 382. El tratamiento precoz de las E-EPOC con la terapéutica actualmente disponible (broncodilatadores, corticoides sistémicos y antibióticos), acorta el tiempo de recuperación y reduce la morbimortalidad asociadas378. Para reducir el riesgo de resistencia bacteriana, son aconsejables períodos de tratamiento más cortos en las exacerbaciones leves a moderadas que resultan tan efectivos como el tratamiento prolongado convencional (1B)387.
Tratamiento hospitalario de las E-EPOC
El riesgo de mortalidad a causa de una exacerbación se relaciona estrechamente con el desarrollo de acidosis respiratoria, la presencia de comorbilidades importantes y la necesidad de soporte ventilatorio. Si el paciente es tratado en el servicio de urgencias o internado en una sala general, se debe realizar el mismo manejo que en el paciente ambulatorio, con el agregado de: 1. Evaluar/implementar ventilación mecánica no invasiva. 2. Monitorear el balance de fluidos, electrolitos y la nutrición. 3. Indicar heparina subcutánea. 4. Identificar y tratar las enfermedades asociadas.
Los enfermos que presentan disnea a los pequeños movimientos y/o en reposo, confusión, letargia, coma, inestabilidad hemodinámica con necesidad de uso de vasopresores, hipoxemia y/o hipercapnia graves y persistentes o cuando empeoran a pesar de oxígeno suplementario y ventilación mecánica no invasiva deben hospitalizarse en unidades de terapia intensiva. Los antibióticos son tratamiento vital en E-EPOC severas en insuficiencia respiratoria380. Se recomienda el cultivo de esputo o aspirado tráqueobronquial para conocer el patógeno infectante y su antibiograma, especialmente en pacientes hospitalizados y en aquellos con potencial riesgo de infección con gérmenes multirresistentes y uso de antibióticos en el mes previo247, 382, 383.
Oxígenoterapia controlada: Una vez iniciada la administración de oxígeno, deben verificarse los gases en sangre arterial a los 30-60 minutos para asegurarse que la oxigenación es satisfactoria (PaO2≥60 mm Hg), sin retención de anhídrido carbónico o acidosis. La frecuencia respiratoria y el volumen corriente modifican la FIO2. Las máscaras tipo Venturi son seguras, especialmente en pacientes con hipercapnia y permiten suministrar una FIO2 entre 24 y 50%5, 388. El oxígeno administrado por cánula nasal, en un rango de 1 a 5 l/min, alcanza una FIO2 entre 24 y 40%, siendo útil emplear la siguiente fórmula: Estimación de FIO2 = 20 + (4 x flujo de O2 en litros). El paciente puede requerir oxígeno al ser dado de alta por un período variable.
Broncodilatadores: los BDß2 de acción corta inhalados, administrados por nebulización o aerosol con aerocámara son los broncodilatadores preferidos para el tratamiento de la E-EPOC.
Glucocorticoides: en el tratamiento hospitalario de la E-EPOC, está demostrada la efectividad de los corticoides sistémicos por vía oral o intravenosa (1A)367, 371-377. No se ha comprobado mayor eficacia si el tratamiento es más prolongado y se pueden incrementar los riesgos de efectos secundarios.
Estimulantes Respiratorios: no se recomienda su uso.
Kinesioterapia respiratoria: puede ser beneficiosa cuando el volumen de esputo es superior a 25 ml diarios o hay atelectasia lobar4.
Criterios y consideraciones para el alta: a) No requerir tratamiento con agonistas ß2 con un intervalo superior a cada 4 h. b) Estabilidad clínica y gasométrica por 24 h. c) Capacidad de alimentación oral y de dormir sin despertarse frecuentemente por disnea. d) Capacidad de caminar en su habitación si era previamente ambulatorio. e) Garantizar la provisión de oxígeno domiciliario. f) Enfatizar medidas de prevención: cesación tabáquica y vacunación. g) Verificar la técnica inhalatoria.
Asistencia ventilatoria: los pacientes con E-EPOC grave que no responden inicialmente al tratamiento conservador con oxígeno y broncodilatadores son candidatos a recibir asistencia ventilatoria no invasiva y, en caso de contraindicación o su fracaso, ventilación invasiva.
Ventilación No Invasiva (VNI): La VNI es el tratamiento recomendado en la insuficiencia respiratoria aguda (IRA) hipercápnica con determinados parámetros clínicos y de intercambio gaseoso4, 388-391. Estudios controlados y randomizados demuestran su eficacia, ya que reduce la necesidad de intubación traqueal, la morbi-mortalidad asociada a la misma y los días de internación (1A)392-394. Su implementación requiere de un equipo entrenado. Se recomienda realizarla en áreas de cuidados críticos o intermedios. No obstante, puede ser llevada a cabo en salas de emergencia o de internación general de acuerdo con la severidad de la insuficiencia respiratoria aguda y el adiestramiento del personal72, 390, 394. Las contraindicaciones figuran en la Tabla 14. La VNI está especialmente indicada en el enfermo que presenta una PaCO2 > 45 mm Hg, pH < 7.35, PaO2/FiO2 < 200, frecuencia respiratoria > 25 rpm y uso de músculos accesorios, sin contraindicaciones para la misma (1A)388, 390, 395, 396. Se incluye un algoritmo de toma de decisiones en Figura 3 72. Inicialmente conviene usar una máscara oro-nasal, facial o escafandra, la cual puede reemplazarse a posteriori por una nasal para mayor confort387, 391, 394-395.
TABLA 14.- Contraindicaciones para VNI


*Contraindicaciones relativas en pacientes con EPOC
Fig. 3.- Algoritmo de aplicación de VNI en Insuficiencia Respiratoria Aguda Hipercápnica en EPOC72.
El modo ventilatorio con eficacia ya demostrada es el que se aplica con equipos portátiles (BiPAP) que proveen al paciente dos niveles de presión positiva: inspiratoria (IPAP) entre 10 a 15 cm H2O y espiratoria (EPAP) entre 4 a 8 cm H2O, con una FIO2 que garantice una saturación arterial de O2 > 90%. También pueden emplearse respiradores convencionales que permitan aplicar presión de soporte y presión positiva de fin de espiración (PEEP), además de otros modos de ventilación asistida72, 388, 394-396. El monitoreo de la VNI se realiza vigilando el estado de conciencia, frecuencia cardiaca y respiratoria, tensión arterial y uso de músculos accesorios. También incluye controlar pH y gases arteriales basales, luego de una hora de uso y posteriores. El fracaso de la VNI se define clínica y gasométricamente (aumento de la PaCO2 > 6 mm Hg con caída del pH > 0.04)391, 396-398.
Ventilación Invasiva (VI): Cuando la VNI fracasa o existen contraindicaciones para su uso, hay indicación de intubación traqueal e inicio de la ARMi. Para decidir la intubación traqueal se deben considerar el estado de salud previo, la expectativa de vida, la reversibilidad de la causa que ocasionó la insuficiencia respiratoria aguda y los deseos del paciente399, 400. La ventilación invasiva permite mantener la función respiratoria y revertir la hipoxia mientras se trata la enfermedad causal. Al realizarla, debe evitarse la "sobredistensión" regional y manejar adecuadamente la auto-PEEP (presión positiva de fin de espiración).
Se recomienda utilizar volúmenes corrientes bajos (5-7 ml/kg) y un tiempo espiratorio prolongado (frecuencia 12 - 15/min, flujos inspiratorios altos y baja relación I/E) a fin de evitar el atrapamiento aéreo, disminuir la hiperinflación dinámica y la injuria por sobredistensión399. La baja ventilación minuto puede conllevar hipercapnia, conocida como hipercapnia permisiva; no obstante, valores de pH entre 7.0-7.1, parecen no tener efectos clínicos indeseables. Si el paciente realiza esfuerzos respiratorios significativos a pesar de las medidas efectuadas, es conveniente la aplicación de PEEP extrínseca a fin de reducir el umbral necesario para "disparar" el respirador y disminuir el trabajo respiratorio399, 400.
Desvinculación de la VI en pacientes con EPOC: Es necesario evaluar diariamente si el enfermo está en condiciones de iniciar la prueba de respiración espontánea (PRE) para una desvinculación precoz de la ARMi. La PRE requiere cuidadoso monitoreo. Se puede realizar con niveles bajos de presión soporte o con tubo en "T". Si la prueba es exitosa, se recomienda no demorar la extubación401. En los pacientes con reiterados fracasos de PRE pero con criterios de extubación, puede utilizarse la VNI para facilitar la desvinculación de la ARMi (1B)402.
Difusión e incorporación de las recomendaciones a la práctica diaria
La difusión e incorporación de las recomendaciones o guías clínicas a la práctica diaria tiene por fin alcanzar un efecto benéfico tanto en los resultados clínicos individuales como en los indicadores epidemiológicos de esta frecuente e invalidante enfermedad. Con este propósito se considera de importancia implementar las siguientes acciones: comunicación con especialistas de otras sociedades médicas; difusión en congresos, simposios y jornadas; divulgación del conocimiento de la enfermedad y su prevención en el público en general; creación de un foro intersocietario; actualización anual de rápida publicación; evaluación de su impacto en la salud de la población.
Agradecimientos: La Asociación Argentina de Medicina Respiratoria tuvo a su cargo la coordinación de la ejecución de estas Recomendaciones.
Conflictos de interés: Los autores del presente trabajo declaran que no hubo participación de ningún patrocinador en el diseño, colección de la información, análisis e interpretación de la información, preparación del manuscrito y en la decisión de envío para la publicación.
El laboratorio Boehringer Ingelheim S.A. solventó los gastos correspondientes a las reuniones de los autores, realizadas en hoteles de la ciudad de Buenos Aires y gran Buenos Aires.
Juan Carlos Figueroa Casas declara haber recibido becas para viajes de asistencia a congresos médicos de Boehringer Ingelheim, AstraZéneca, GlaxoSmithKline y Teva Tuteur, y honorarios por ensayos clínicos de Novartis, Pfizer Argentina, Boehringer Ingelheim, AstraZéneca, GlaxoSmithKline, Johnson & Johnson, Bayer, Bristol Myers Squib y Genexion y honorarios por conferencias de Investi y Boehringer Ingelheim.
Eduardo Schiavi declara honorarios por conferencias y elaboración de material informativo para médicos de Boehringer Ingelheim y AstraZeneca; becas para viajes de asistencia a congresos médicos de Boehringer Ingelheim; honorarios por realización de ensayos de investigación clínica de Boehringer Ingelheim; honorarios como miembro del comité consultor de la empresa Nycomed.
Juan A. Mazzei ha recibido becas para viajes y reuniones relacionadas con la EPOC de GlaxoSmithKline, Boehringer Ingelheim y Takeda.
Ana María López declara honorarios por conferencias y elaboración de material informativo para médicos de Boehringer Ingelheim y AstraZeneca, becas para viajes de asistencia a congresos médicos de Boehringer Ingelheim y Astra Zéneca, honorarios por realización de ensayos de investigación clínica de Boehringer Ingelheim, Astra Zéneca, Schering Plough y Novartis.
Edgardo Rhodius declara no tener conflicto de intereses.
Martín Sívori declara honorarios por conferencias y consultor de Boehringer Ingelheim; becas para viajes de asistencia a congresos médicos de Boehringer Ingelheim; honorarios por realización de ensayos de investigación clínica de Boehringer Ingelheim, GlaxoSmithKline y AstraZeneca.
Julián Ciruzzi declara becas otorgadas por Boehringer Ingelheim, AstraZeneca y GlaxoSmithKline para viajes de asistencia a congresos médicos, honorarios por realización de ensayos de investigación clínica de GlaxoSmithKline y honorarios como consultor de la empresa Air Lìquide en área Capacitaciòn.
1. Figueroa Casas JC, Abbate E, Martelli N, et al. Enfermedad pulmonar obstructiva crónica. Consenso Argentino. Medicina (B Aires) 1994; 54: 671-96. [ Links ]
2. Gene R, Giugno E, Abbate E, et al. Nuevo Consenso Argentino de EPOC. Medicina (B Aires) 2003; 63: 419-46. [ Links ]
3. Guyatt G, Gutterman D, Baumann MH, et al. Grading strength of recommendations and quality of evidence in clinical guidelines: Report from an American College of Chest Physicians task force. Chest 2006; 129: 174-81. [ Links ]
4. Global Strategy for Diagnosis, Management, and Prevention of COPD (GOLD Guidelines) Updated 2010. En: http://goldcopd.com/GuidelinesResources, consultado el 28 de septiembre 2011. [ Links ]
5. Celli BR, MacNee W, and committee members. ATS/ ERS TASK FORCE. Standards for the diagnosis and treatment of patients with COPD: a summary of the ATS/ERS position paper. Eur Respir J 2004; 23: 932-46. [ Links ]
6. Russi EW, Leuenberger P, Brändli O, et al. Management of chronic obstructive pulmonary disease: the Swiss guidelines. Swiss Med Wkly 2002; 132: 67-78. [ Links ]
7. McKenzie DK, Frith PA, Burdon JGW, Town GI. The COPDX Plan: Australian and New Zealand Guidelines for the management of Chronic Obstructive Pulmonary Disease 2003. MJA 2003; 178: S1-S40. [ Links ]
8. Pellegrino R, Viegi G, Brusasco V, et al. Interpretative strategies for lung function tests. Eur Respir J 2005; 26: 948-68. [ Links ]
9. Anthonisen NR, Connett JE, Murray RP. Smoking and lung function of Lung Health Study participants after 11 years. Am J Respir Crit Care Med 2002; 166: 675-9. [ Links ]
10. Fletcher C, Peto R. The natural history of chronic airflow obstruction. BMJ 1977; 1: 1645-8. [ Links ]
11. Burrows B, Knudson RJ, Cline MG, Lebowitz MD. Quantitative relationships between cigarette smoking and ventilatory function. Am Rev Respir Dis 1977; 115:195-205. [ Links ]
12. Doll R, Peto R, Boreham J, Sutherland I. Mortality in relation to smoking: 50 years' observations on male British doctors. BMJ 2004; 328: 1519-27. [ Links ]
13. Kohansal R, Martínez C, Agustí A, Buist AS, Mannino DV, Soriano JB. The natural history of chronic airflow obstruction revisited. An analysis of the Framingham offspring cohort. Am Rev Respir Crit Care Med 2009; 180:3-10. [ Links ]
14. Løkke A, Lange P, Scharling H, et al. Developing COPD: a 25 year follow up study of the general population. Thorax 2006; 61: 935- 9. [ Links ]
15. Hersh CP, DeMeo DL, Al-Ansari E, et al. Predictors of survival in severe, early onset COPD. Chest 2004; 126: 1443-51. [ Links ]
16. Balmes J, Becklake M, Blanc P, et al. American Thoracic Society statement: occupational contribution to the burden of airway disease. Am J Respir Crit Care Med 2003; 167: 787-97. [ Links ]
17. Trupin L, Earnest G, San Pedro M, et al. The occupational burden of chronic obstructive pulmonary disease. Eur Respir J 2003; 22: 462-9. [ Links ]
18. Harber P, Tashkin D, Simmons M, et al. Effect of Occupational Exposures on Decline of Lung Function in Early Chronic Obstructive Pulmonary Disease. Am J Respir Crit Care Med 2007; 176: 994-1000. [ Links ]
19. Hu G, Zhou Y, Tian J, et al. Risk of COPD from exposure to biomass smoke: a metaanalysis. Chest 2010; 138: 20-31. [ Links ]
20. Pelkonen M, Notkola I-L, Nisssinen A, et al. Thirty-year cumulative incidence of chronic bronchitis and COPD and chronic bronchitis in relation to 30-year pulmonary function and 40-year mortality: a follow-up in middle-aged rural men. Chest 2006; 130: 1129-37. [ Links ]
21. Lundback B, Lindberg A, Lindstrom M, et al. Not 15 but 50% of smokers develop COPD? Report from the Obstructive Lung Disease in Northern Sweden Studies. Respir Med 2003; 97: 115-22. [ Links ]
22. Curtis JL, Freeman CM, Hogg JC. The Immunopathogenesis of Chronic Obstructive Pulmonary Disease: Insights from Recent Research. Proc Am Thorac Soc 2007; 4: 512-21. [ Links ]
23. Cosio MG, Majo J, Cosio MG. Inflammation of the airways and lung parenchyma in COPD: role of T cells. Chest 2002; 121: 160S-5S. [ Links ]
24. Lungarella G, Cavarra E, Lucatelli M, Martorana PA. The dual role of neutrophil elastase in lung destruction and repair. Internat J Biochem & Cell Biol 2008; 40: 1287-96. [ Links ]
25. Demedts IK, Bracke KR, Van Pottelberge G, et al. Accumulation of dendritic cells and increased CCL20 levels in the airways of patients with chronic obstructive pulmonary disease. Am J Respir Crit Care Med 2007; 175: 998-1005. [ Links ]
26. Vijayanand P, Seumois G, Pickard C, et al. Invariant Natural Killer T Cells in Asthma and Chronic Obstructive Pulmonary Disease. N Engl J Med 2007; 356: 1410-22. [ Links ]
27. Voelkel N, Taraseviciene-Stewart L. Emphysema: an autoimmune disease? Proc Am Thorac Soc 2005; 2: 23-5. [ Links ]
28. Chung KF. Cytokines in chronic obstructive pulmonary disease. Eur Respir J 2001; 34: 50S-9S. [ Links ]
29. Di Stefano A, Capelli A, Lusuardi M, et al. Severity of airflow limitation is associated with severity of airway inflammation in smokers. Am J Respir Crit Care Med 1998; 158: 1277-85. [ Links ]
30. Rabe KF, Beghe B, Luppi F, Fabbri LM. Update in Chronic Obstructive Pulmonary Disease 2006. Am J Respir Crit Care Med 2007; 175: 1222-32. [ Links ]
31. MacNee W. Pathogenesis of Chronic Obstructive Pulmonary Disease. Clin Chest Med 2007; 28: 479-513. [ Links ]
32. Hogg JC, Macklem PT, Thurlbeck WM. Site and nature of airway obstruction in chronic obstructive lung disease. N Engl J Med 1968; 278: 1355-60. [ Links ]
33. Hogg JC, Chu F, Utokaparch S, et al. The nature of small-airway obstruction in chronic obstructive pulmonary disease. N Engl J Med 2004; 350: 2645-53. [ Links ]
34. Saetta M, Turato G, Maestrelli P, et al. Cellular and structural bases of chronic obstructive pulmonary disease. Am J Respir Crit Care Med 2001; 163: 1304-9. [ Links ]
35. Grumelli S, Corry DB, Song LZ, et al. An immune basis for lung parenchymal destruction in chronic obstructive pulmonary disease and emphysema. PLoS Med 2004; 1: 75-83. [ Links ]
36. Gross NJ, Co E, Skorodin MS. Cholinergic bronchomotor tone in COPD. Estimates of its amount in comparison with that in normal smokers. Chest 1989; 96: 984-7. [ Links ]
37. Tracey KJ. Physiology and immunology of the cholinergic anti-inflammatory pathway. J Clin Invest 2007; 117: 289-96. [ Links ]
38. Willemse BW, ten Hacken NH, Rutgers B, Lesman-Leegte IG, Postma DS, Timnes W. Effect of 1-year smoking cessation on airway inflammation in COPD and asymptomatic smokers. Eur Respir J 2005; 26: 835-45. [ Links ]
39. Willemse BW, Postma DS, Timens W, et al. The impact of smoking cessation on respiratory symptoms, lung function, airway hyperresponsiveness and inflammation. Eur Respir J 2004; 23: 464-76. [ Links ]
40. Cosio M, Ghezzo H, Hogg JC, et al. The relations between structural changes in small airways and pulmonary-function tests. N Engl J Med 1978; 298: 1277-81. [ Links ]
41. Jeffery PK. Comparison of the structural and inflammatory features of COPD and asthma. Giles F. Filley Lecture. Chest 2000; 117: 251S-60S. [ Links ]
42. O'Donnell DE, Revill SM, Webb KA. Dynamic hyperinflation and exercise intolerance in chronic obstructive pulmonary disease. Am J Respir Crit Care Med 2001; 164: 770-7. [ Links ]
43. Peinado VI, Barbera JA, Abate P, et al. Inflammatory reaction in pulmonary muscular arteries of patients with mild chronic obstructive pulmonary disease. Am J Respir Crit Care Med 1999; 159: 1605-11. [ Links ]
44. Hardie JA, Buist AS, Vollmer WM, et al. Risk of over-diagnosis of COPD in asymptomatic elderly never-smokers. Eur Respir J 2002; 20: 1117-22. [ Links ]
45. Celli BR, Halbert RJ, Isonaka S, Schau B. Population impact of different definitions of airway obstruction. Eur Respir J 2003; 22: 268-73. [ Links ]
46. Shirtcliffe P, Weatherhall M, Marsh S, et al. COPD prevalence in a random population survey: a matter of definition. Eur Resp J 2007; 30: 232-9. [ Links ]
47. Cerveri I, Corsico AG, Accordini S, et al. Underestimation of airflow obstruction among young adults using FEV1/FVC<70% as a fixed cut-off: a longitudinal evaluation of clinical and functional outcomes. Thorax 2008; 63: 1040-5. [ Links ]
48. Pellegrino R, Brusasco V, Viegi G, et al. Definition of COPD: Based on evidence or opinion? Eur Resp J 2008; 31: 681-90. [ Links ]
49. Vollmer W, Gislason P, Burney P, et al. Comparison of spirometry criteria for the diagnosis of COPD: results from the BOLD study. Eur Resp J 2009; 34: 588-97. [ Links ]
50. Quanjer PH. En: http://www.spirxpert.com/controversies/controversy.html , consultado el 02/01/2011. [ Links ]
51. Pérez-Padilla R, Torre Bouscoulet L, Vázquez-García JC, et al. Valores de referencia para la espirometría después de la inhalación de 200 ug de salbutamol. Arch Bronconeumol 2007; 43: 530-4. [ Links ]
52. Celli BR, Cote CG, Marin JM, et al. The body mass index, airflow obstruction, dyspnea, and exercise capacity index in Chronic Obstructive Pulmonary Disease. N Eng J Med 2004; 350: 1005-12. [ Links ]
53. Vestbo J, Anderson W, Coxson HO, et al. Evaluation of COPD Longitudinally to Identify Predictive Surrogate End-points (ECLIPSE). Eur Respir J 2008; 31: 869-73. [ Links ]
54. Punturieri A, Croxton T, Weinmann G,Kiley J. Chronic Obstructive Pulmonary Disease: a view from the NHLBI. Am J Respir Crit Care Med 2008; 178: 441-3. [ Links ]
55. Hurst JR, Vestbo J, Anzueto A, et al. Susceptibility to exacerbation in chronic obstructive pulmonary disease. N Eng J Med 2010; 363: 1128-38. [ Links ]
56. Murray CJL, Lopez AD. Evidence-based health policy- lessons from the Global Burden of Disease Study. Science 1996; 274: 740-3. [ Links ]
57. Murray CJL, Lopez AD, eds. The global burden of disease: a comprehensive assessment of mortality and disability from diseases, injuries and risk factors in 1990 and projected to 2020. Cambridge, MA: Harvard University Press; 1996. [ Links ]
58. Lopez AD, Mathers CD, Ezzati M, et al. Global burden of disease and risk factors. Washington, DC: The World Bank, 2006. [ Links ]
59. Tirimanna PR, van Schayck P, den Otter JJ, et al. Prevalence of asthma and COPD in general practice in 1992: Has it changed since 1977? Br J Gen Pract 1996; 46: 277-8. [ Links ]
60. Halbert RJ, Natoli JL, Gano A, et al. Global burden of COPD: systematic review and meta-analysis. Eur Respir J 2006; 528: 523-32. [ Links ]
61. Halbert RJ, Isonaka S, George D, et al. Interpreting COPD prevalence estimates: what is the true burden of disease? Chest 2003; 123: 1684-92. [ Links ]
62. Menezes AMB, Perez-Padilla R, Jardim JB, et al. Chronic obstructive pulmonary disease in five Latin American cities (the PLATINO study): a prevalence study. Lancet 2005; 366: 1875-81. [ Links ]
63. Buist AS, McBurnie MA, Vollmer WM, et al. International variation in the prevalence of COPD (the BOLD study): a population-based prevalence study. Lancet 2007; 370: 741-50. [ Links ]
64. Caballero A, Torres-Duque CA, Jaramillo C, et al. Prevalence of chronic obstructive pulmonary disease in five Columbian cities situated at low, medium and high altitude (PREPOCOL study). Chest 2008; 133: 343-9. [ Links ]
65. Gomez RM, Zabert GE, Jossen RA, Croce JD, and Adult Wheezing Study Group. Adult wheezing prevalence in Argentina: Preliminary Report ATS 2007. [ Links ]
66. Sívori M, Sáenz C, Riva Posse C. Mortalidad por Asma y Enfermedad Pulmonar Obstructiva Crónica en Argentina (1980-1998). Medicina B Aires 2001; 61: 513-21. [ Links ]
67. National Institute for Health and Clinical Excellence-Measuring effectiveness and cost effectiveness: the QALY. En: http://www.nice.org.uk/newsroom/features/measuringeffectivenessandcosteffectivenesstheqaly.jsp , consultado el 10/12/10. [ Links ]
68. WHO. The Global Burden of disease concept. En: http://www.who.int/quantifying_ehimpacts/publications/en/9241546204chap3.pdf , consultado el 14/12/2010. [ Links ]
69. Qaseem A, Snow V, Shekelle P, et al. Diagnosis and Management of Stable Chronic Obstructive Pulmonary Disease: A Clinical Practice Guideline from American College of Physicians. Ann Intern Med 2007; 147: 633-8. [ Links ]
70. National Institute for Clinical Excellence (NICE). National clinical guideline on management of chronic obstructive pulmonary disease in adults in primary and secondary care Thorax 2004; 59 (Suppl I): 1-232. [ Links ]
71. Gan WQ, Man SF, Senthiselvan A, Sin DD. Association between chronic obstructive pulmonary disease and systemic inflammation: a systematic review and a meta-analysis. Thorax 2004; 59: 574-80. [ Links ]
72. Peces-Barba G, Barberà JA, Agustí A, et al. Guía clínica SEPAR-ALAT de diagnóstico y tratamiento de la Enfermedad Pulmonar Obstructiva Crónica. Arch Bronconeumol 2008; 44: 271-81. [ Links ]
73. Rhodius E., Caneva J., Sivori M. Consenso Argentino de Oxigenoterapia Domiciliaria. Medicina (B Aires) 1998; 58: 85-94. [ Links ]
74. Barker A., Brantlyu M., Campbell E., et al. Alpha 1 antitrypsin deficiency: Memorandum from a WHO meeting. Bulletin WHO 1997; 75: 397-415. [ Links ]
75. ATS/ERS Statement: Standards for the diagnosis and management of individuals with alpha 1 antitrypsin deficiency. Am J Respir Crit Care Med 2003; 168: 820-2. [ Links ]
76. Stockley RA, Bayley D, Hill SL, et al Assessment of airway neutrophils by sputum colour: correlation with airways inflammation. Thorax 2001; 56: 366-72. [ Links ]
77. Klein JS, Gamsu G, Webb WR, et al. High-resolution CT diagnosis of emphysema in symptomatic patients with normal chest radiograph and isolated low diffusing capacity. Radiology 1992; 182: 817-21. [ Links ]
78. Arakawa H, Webb WR. Air trapping on expiratory high - resolution CT scans in the absence of inspiratory scan abnormalities: correlation with pulmonary function tests and differential diagnosis. Am J Roentgenol 1998; 170: 1349-53. [ Links ]
79. Muller NL, Coxson H. Imaging the lung in patients with chronic obstructive pulmonary disease. Thorax 2002; 57: 982-5. [ Links ]
80. Fishman A., Martinez F, Naunheim K et al. A Randomized Trial Comparing Lung-Volume Reduction Surgery with Medical Therapy for Severe Emphysema. New Engl J Med 2003; 348: 2059-73. [ Links ]
81. Miller MR, Hankinson J, Brusasco V, et al. Standardisation of spirometry. Eur Respir J 2005; 26: 319-38. [ Links ]
82. Anthonisen NR, Wright EC, Hodgkin JE. Prognosis in chronic obstructive pulmonary disease. Am Rev Respir Dis 1986; 133: 14-20. [ Links ]
83. Burrows B. The course and prognosis of different types of chronic airflow limitation in a general population sample from Arizona: comparison with the Chicago "COPD" series. Am Rev Respir Dis 1989; 140: S92-S94. [ Links ]
84. Nolan D, White P, Pearson MG. FEV1 and PEF in COPD management. Thorax 1999; 54: 468-9. [ Links ]
85. Hughes J, Pride N. In defence of the carbón monoxide transfer coefficient KCO (TL/VA). Eur Respir J 2001; 17: 168-74. [ Links ]
86. Bolliger CT, Perruchoud AP. Functional evaluation of the lung resection candidate. Eur Respir J 1998;1: 198-212. [ Links ]
87. Wanger J, Clausen JL, Coates A, et al. Standardisation of the measurement of lung volumes. Eur Respir J 2005; 26: 511-22. [ Links ]
88. Casanova C, Cote C, de Torres JP, et al. Inspiratory-tototal lung capacity ratio predicts mortality in patients with chronic obstructive pulmonary disease. Am J Respir Crit Care Med 2005; 171: 591-7. [ Links ]
89. Colice GL, Shafazand S, Griffin JP, et al. Physiologic Evaluation of the Patient With Lung Cancer Being Considered for Resectional Surgery. ACCP Evidenced-Based Clinical Practice Guidelines (2nd Ed.) Chest 2007; 132: S161-S177. [ Links ]
90. Celli BR. Clinical and Physiologic Evaluation of Respiratory Muscle Function. Clin Chest Med 1989; 10: 199-21. [ Links ]
91. Butland R, Pang J, Gross E, et al. Two, six and twelve minutes walking-tests in respiratory disease. Br Med J 1982; 284: 1607-8. [ Links ]
92. Ambrosino N. Field tests in pulmonary diseases. Thorax 1999; 54: 191-3. [ Links ]
93. Sívori M, Sáenz C. Prueba de caminata de carga progresiva (Shuttle test) en enfermedad pulmonar obstructiva grave. Medicina (B Aires) 2010; 70: 305-10. [ Links ]
94. Sin DD, Anthonisen NR, Soriano JB, Agusti AG. Mortality in COPD: role of comorbidities. Eur Respir J 2006; 28: 1245-57. [ Links ]
95. Decramer M, Rennard S, Troosters T, et al. COPD as a lung disease with systemic consequences-clinical impact, mechanisms, and potential for early intervention. J COPD 2008; 5: 235-56. [ Links ]
96. Agustí A. Systemic effects of chronic obstructive pulmonary disease: what we know and what we don't know (but should). Proc Am Thorac Soc 2007; 4: 522-5. [ Links ]
97. Agusti A, Soriano JB. COPD as a systemic disease. J COPD 2008; 5: 133-8. [ Links ]
98. Barnes PJ, Celli BR. Systemic manifestations and comorbidities of COPD. Eur Respir J 2009; 33: 1165-85. [ Links ]
99. American Thoracic Society European Respiratory Society. Skeletal muscle dysfunction in chronic obstructive pulmonary disease. Am J Resp Crit Care Med 1999; 159: 2S-40. [ Links ]
100. Anthonisen NR, Conte JE, Enright PL, Manfreda J. Hospitalizations and mortality in the Lung Health Study. Am J Resp Crit Care Med 2002; 166: 333-9. [ Links ]
101. Calverley PM, Anderson JA, Celli B, et al. Salmeterol and fluticasone propionate and survival in chronic obstructive pulmonary idease. N Engl J.Med 2007; 356: 775-89. [ Links ]
102. Maclay JD, McAllister A, Mac Nee W. Cardiovascular risk in chronic obstructive pulmonary disease. Respirology 2007; 12: 634-41. [ Links ]
103. Iwamoto H, Yokoyama A, Kitahara Y, et al. Airflow limitation in smokers is associated with subclinical atherosclerosis. Am J Respir Crit Care Med 2009; 179: 35-40. [ Links ]
104. Maclay JD, McAllister DA, Mills NL, et al. Vascular dysfunction in chronic obstructive pulmonary disease. Am J Respir Crit Care Med 2009; 180: 513-20. [ Links ]
105. Similowski T, Agusti A, MacNee W, Schonhofer B. The potential impact of anaemia of chronic disease in COPD. Eur Respir J 2006; 27: 390-6. [ Links ]
106. Cote C, Zilberberg MD, Mody SH, et al. Haemoglobin level and its clinical impact in a cohort of patients with COPD. Eur Respir J 2007; 29: 923-9. [ Links ]
107. Antonelli Incalzi R, Corsonello A, Pedone C, et al. Depression and drug utilization in an elderly population. Ther Clin Risk Manag 2005; 1: 55-60. [ Links ]
108. Chatila WM, Thomashow BM, Minai OA, et al. Comorbidities in chronic obstructive pulmonary disease. Proc Am Thorac Soc 2008; 5: 549-55. [ Links ]
109. Sin DD, Man JP, Man SF. The risk of osteoporosis in Caucasian men and women with obstructive airway disease. Am J Med 2003; 114: 10-4. [ Links ]
110. Bolton CE, Ionescu AA, Shiels KM, et al. Associated loss of fat-free mass and bone mineral density in chronic obstructive pulmonary disease. Am J Respir Crit Care Med 2004; 170: 1286-93. [ Links ]
111. Rana JS, Mittleman MA, Sheikh J, et al Chronic obstructive pulmonary disease, asthma, and risk of diabetes type 2 in women. Diabetes Care 2004; 27: 2478-84. [ Links ]
112. Laghi F, Adiguzel N, Tobin MJ. Endocrinological derangements in COPD. Eur Respir J 2009; 34: 975-96. [ Links ]
113. Cosio MG, Saetta M, Agusti A. Immunologic Aspects of Chronic Obstructive Pulmonary Disease. N Engl J Med 2009; 360: 2445-54. [ Links ]
114. Wasswa Quintu-Kintu S, Gan WQ, Man SF, et al. Relationship between reduced forced expiratory volume in one second and the risk of lung cancer: a systematic review and metanalysis. Thorax 2005; 60: 570-5. [ Links ]
115. Casanova C, de Torres JP, Navarro J, et al. Microalbuminuria and hypoxemia in patients with chronic obstructive pulmonary disease. Am J Resp Crit Care Med 2010; 182: 1004-10. [ Links ]
116. Kinsman RA, Yaroush RA, Fernandez E, Dirks JF, Schocket M, Fukuhara J. Symptoms and experiences in chronic ronchitis and emphysema. Chest 1983; 83: 755-76. [ Links ]
117. Tirlapur VG, Mir MA. Nocturnal hypoxemia and associated electrocardiographic changes in patients with chronic obstructive airways disease. N Engl J Med 1982; 306: 125-30. [ Links ]
118. Fletcher EC, Luckett RA, Miller T, et al. Pulmonary vascular hemodynamics in chronic lung disease patients with and without oxyhemoglobin desaturation during sleep. Chest 1989; 95: 757-64. [ Links ]
119. McNicholas WT, Fitzgerald MX. Nocturnal death among patients with chronic bronchitis and emphysema. Br Med J (Clin Res Ed) 1984; 289: 878. [ Links ]
120. Klink M, Quan SF. Prevalence of reported sleep disturbances in a general adult population and their relationship to obstructive airways diseases. Chest 1987; 91: 540-6. [ Links ]
121. Douglas NJ, Calverley PM, Leggett RJ, et al. Transient hypoxaemia during sleep in chronic bronchitis and emphysema. Lancet 1979; 1: 1-4. [ Links ]
122. Mulloy E, McNicholas WT. Ventilation and gas exchange during sleep and exercise in severe COPD. Chest 1996; 109: 387-94. [ Links ]
123. Krachman S, Minai OA, Scharf SM. Sleep abnormalities and treatment in emphysema. Proc Am Thorac Soc 2008; 5: 536-42. [ Links ]
124. Mulloy E, McNicholas WT. Theophylline improves gas exchange during rest, exercise, and sleep in severe chronic obstructive pulmonary disease. Am Rev Respir Dis 1993; 148: 1030-6. [ Links ]
125. Martin RJ, Bartelson BL, Smith P, et al. Effect of ipratropium bromide treatment on oxygen saturation and sleep quality in COPD. Chest 1999; 115: 1338-45. [ Links ]
126. McNicholas WT, Calverley PM, Lee A, Edwards JC. Long-acting inhaled anticholinergic therapy improves sleeping oxygen saturation in COPD. Eur Respir J 2004; 23: 825-31. [ Links ]
127. Jolly E, Aguirre L, Jorge E, et al. Acute effect of lorazepam on respiratory muscles in stable patients with chronic obstructrive pulmonary disease. Medicina (B Aires) 1996; 54: 472-8. [ Links ]
128. Hudgel DW, Martin RJ, Capehart M, et al. Contribution of hypoventilation to sleep oxygen desaturation in chronic obstructive pulmonary disease. J Appl Physiol 1983; 55: 669-77. [ Links ]
129. Becker HF, Piper AJ, Flynn WE, et al. Breathing during sleep in patients with nocturnal desaturation. Am J Respir Crit Care Med 1999; 159: 112-8. [ Links ]
130. Connaughton JJ, Catterall JR, Elton RA, et al. Do sleep studies contribute to the management of patients with severe chronic obstructive pulmonary disease? Am Rev Respir Dis 1988; 138: 341-4. [ Links ]
131. Sampol G, Sagales MT, Roca A, et al. Nasal continuous positive airway pressure with supplemental oxygen in coexistent sleep apnoea-hypopnoea syndrome and severe chronic obstructive pulmonary disease. Eur Respir J 1996; 9: 111-6.132. [ Links ]
132. de Miguel J, Cabello J, Sanchez-Alarcos JM, et al. Long-term effects of treatment with nasal continuous positive airway pressure on lung function in patients with overlap syndrome. Sleep Breath 2002; 6: 3-10. [ Links ]
133. Sampol G, Sagales MT, Roca A, de la Calzada MD, Bofill JM, Morell F. Nasal continuous positive airway pressure with supplemental oxygen in coexistent sleep apnoea-hypopnoea syndrome and severe chronic obstructive pulmonary disease. Eur Respir J 1996;9: 111-6. [ Links ]
134. Ibáñez M, Aguilar J, Maderal M, et al. Sexuality in chronic respiratory failure: coincidences and divergentes between patient and primary caregiver. Respir Med 2001; 95: 975-9. [ Links ]
135. Köseoglu N, Köseoglu H, Ceylan E, et al. Erectile dysfunction prevalence and sexual function status in patients with chronic obstructive pulmonary disease. J Urol 2005; 174: 249-52. [ Links ]
136. Charam N. Does sildenafil also improve breathing? Chest 2001; 120: 305-6. [ Links ]
137. Bolliger CT. Evaluation of operability before lung resection. Curr Opin Pulm Med 2003; 9: 321-6. [ Links ]
138. Brooks-Brunn JA. Predictors of postoperative pulmonary complications following abdominal surgery. Chest 1997; 111: 564-71. [ Links ]
139. Arozullah AM, Daley J, Henderson WG, Khuri SF. Multifactorial risk index for predicting postoperative respiratory failure in men after major noncardiac surgery. The National Veterans Administration Surgical Quality Improvement Program. Ann Surg. 2000; 232: 242-53. [ Links ]
140. McAlister FA, Khan NA, Straus SE, Papaioakim M, Fisher BW, Majumdar SR, Gajic O, Daniel M, Tomlinson G. Accuracy of the preoperative assessment in predicting pulmonary risk after nonthoracic surgery. Am J Respir Crit Care Med 2003; 167: 741-4. [ Links ]
141. Bolton JWR, Weiman DS, Haynes JL, et al. Stair climbing as an indicator of pulmonary function. Chest 1987; 92: 783-7. [ Links ]
142. Anthonisen NR, Connet JE, Kiley JP, et al. Effects of smoking intervention and the use of an inhaled anticholinergic bronchodilator on the rate of decline of FEV1. JAMA 1994; 272: 1497-505. [ Links ]
143. Tashkin D, Kamer R, Bailey W, et al. Smoking cessation in patients with chronic obstructive pulmonary disease, double-blind placebo controlled, randomized trial. Lancet 2001; 357: 1571-5. [ Links ]
144. Scanlon P, Connet J.E, Waller LA, et al. Smoking cessation and lung function in mild-to-moderate Chronic Obstructive Pulmonary Disease. The Lung Health Study. Am J Respir Crit Care Med 2000; 161: 381-90. [ Links ]
145. Tashkin DP, Celli B, Senn S, et al. UPLIFT Study Investigators. A 4-year trial of tiotropium in chronic obstructive pulmonary disease. N Engl J Med 2008; 359: 1543-54. [ Links ]
146. Jenkins CR, Jones PW, Calverley PM, et al. Efficacy of salmeterol/fluticasone propionate by GOLD stage of chronic obstructive pulmonary disease: analysis from the randomised, placebo-controlled TORCH study. Respir Res 2009; 10: 59-65. [ Links ]
147. Decramer M, Celli B, Kesten S, et al. Effect of tiotropium on outcomes in patients with moderate chronic obstructive pulmonary disease (UPLIFT): a prespecified subgroup analysis of a randomised controlled trial. Lancet 2009; 374: 1171-8. [ Links ]
148. Lancaster T, Stead LF. 2006 Physician advice for smoking cessation. Cochrane Database of Systematic Reviews. Cochrane Database Syst Rev 2004;3: CD000146. [ Links ]
149. Guía nacional de tratamiento de la adicción al tabaco. Buenos Aires: Ministerio de Salud y Ambiente de la Nación, 2005. [ Links ]
150. Britton J, Knoox A. Helping people to stop smoking the new smoking cessation guideline. Thorax 1999; 54: 1-2. [ Links ]
151. Fiore, MC, Bailey WC, Cohen SJ, et al. A clinical practice guideline for treating tobacco use and dependence. A US Public Health Service Report. JAMA 2000; 283: 3244-54. [ Links ]
152. American Medical Association. Guideline for a diagnosis and tratment of nicotine dependence: How to help pacients to stop smoking. Washington D.C: American Medical Association, 1994. [ Links ]
153. Lancaster T, Stead L, Sigal C, Sowden A. Effectiveness of interventions to help people to stop smoking: findings from the Cochrane Library. BMJ 2000; 321: 355-8. [ Links ]
154. Silagy C, Lancaster T, Stead L, et al. Nicotine replacement therapy for smoking cessation. Cochrane Database Syst Rev. 2004;CD000146. [ Links ]
155. Jorenby DE, Leischow SJ, Nides MA, et al. A controlled trial of sustained-release bupropion, a nicotine patch, or both for smoking-cessation. N Engl J Med 1999; 340: 685-91. [ Links ]
156. Cahill K, Stead L, Lancaster T. Nicotine receptor partial agonists for smoking cessation. Cochrane Database Syst Rev 2007; CD006103. [ Links ]
157. Jorenby DE, Hays JT, Rigotti N, et al. Efficacy of varenicline, an alpha4 beta2 nicotine acetylcholine receptor partial agonist, vs placebo or sustained release bupropion for smoking cessation randomized controlled trial. JAMA 2006; 296: 53-63. [ Links ]
158. Nides M, Oncken C, Gonzales D, et al. Smoking cessation with varenicline selective alpha4beta2 nicotinic receptor partial agonist result from 7 week, randomized placebo - and bupropion-controlled trial with 1 year follow up. Arch Inter Med 2006; 166: 1561-8. [ Links ]
159. Ebbert JO, Croghan IT, Sood A, et al. Varenicline and bupropion sustained-release combination therapy for smoking cessation. Nicotine Tob Res 2009; 11: 234-9. [ Links ]
160. Shah SD, Wilken LA, Winkler SR, Lin SJ. Systematic review and meta-analysis of combination therapy for smoking cessation. J Am Pharm Assoc 2008; 48: 659-65. [ Links ]
161. Becoña E. Tratamiento psicológico del tabaquismo. Adicciones 2004; 16: 227-65. [ Links ]
162. Nerín I, Novella P, Crucelaegui A, et al. Factores predictores de éxito a los 6 meses en fumadores tratados en una unidad de tabaquismo. Arch Bronconeumol 2004; 40: 558-62. [ Links ]
163. Juneman A, Legarreta G. Inhalación de humo de leña: una causa relevante pero poco reconocida de Enfermedad Pulmonar Obstructiva Crónica. Rev Arg Med Respir 2007; 2: 51-7. [ Links ]
164. Smith KR, Mehta S, Maeusezahl-feuz. Indoor air pollution from house hold use of solid fuels. In: Ezzati M.; López A.D.; Rodgers A.; Murray C.J.L. Comparative quantification of health risks. Global and regional burden of disease atribuible to selected mayor risk factors. Geneva: WHO. 2004; 2: 1435-93. [ Links ]
165. Ko FW, Tam W, Wong TW, et al. Temporal relationship between air pollutants and hospital admissions for chronic obstructive pulmonary disease in Hong Kong. Thorax 2007; 62: 780-5. [ Links ]
166. Liu S, Zhou Y, Wang X, et al. Biomass fuels are the probable risk factor for chronic obstructive pulmonary disease in rural South China. Thorax 2007; 62: 889-97. [ Links ]
167. Vestbo J, Sorensen T, Lange P, et al. Long-term effect of inhaled budesonide in mild and moderate chronic obstructive pulmonary disease: a randomised controled trial. Lancet 1999; 353: 1819-23. [ Links ]
168. Altose MD, Redline S, Deitz CD, Quinlan KJ. The Lung Health Study Research Group. Effect of inhaled triamcinolone on the decline in pulmonary function in chronic obstructive pulmonary disease. N Engl J Med 2000; 343: 1902-9. [ Links ]
169. Highland KB, Strange C, Heffner JE. Long-term effects of inhaled corticosteroids on FEV1 in patients with chronic obstructive pulmonary disease. A meta-analysis. Ann Intern Med 2003; 138: 969-73. [ Links ]
170. Soriano JB, Sin DD, Zhang X, et al. A pooled analysis of FEV1 decline in COPD patients randomized to inhaled corticosteroids or placebo. Chest 2007; 131: 682-9. [ Links ]
171. Sutherland ER, Allmers H, Ayas N, et al. Inhaled corticosteroids reduce the progression of airflow limitation in chronic obstructive pulmonary disease: a meta-analysis. Thorax 2003; 58: 937-41. [ Links ]
172. Celli B.Update on Management of COPD. Chest 2008; 133;1451-62. [ Links ]
173. Albert P, Calverley P.M.A. Drugs (including oxygen) in severe COPD. Eur Respir J 2008; 31: 1114-24. [ Links ]
174. Vathenen AS, Britton JR, Ebden P, et al. High-dose inhaled albuterol in severe chronic airflow limitation. Am Rev Respir Dis 1988; 138: 850-5. [ Links ]
175. Gross NJ, Petty TL, Friedman M, et al. Dose response to ipratropium as a nebulized solution in patients with chronic obstructive pulmonary disease. A three -center study. Am Rev Respir Dis 1989; 139: 1188-91. [ Links ]
176. Jones PW, Bosh TK. Quality of life changes in COPD patients treated with salmeterol. Am J Respir Crit Care Med 1997; 155: 1283-9. [ Links ]
177. Man WD, Mustfa N, Nikoletou D, et al. Effect of salmeterol on respiratory muscle activity during exercise in poorly reversible COPD. Thorax 2004; 59: 471-6. [ Links ]
178. Cazzola M, Matera MG, Santangelo G, et al. Salmeterol and formoterol in partially reversible severe chronic obstructive pulmonary disease: a dose response study. Respir Med 1995; 89: 357-62. [ Links ]
179. Boyd G, Morice AH, Pounsford JC, et al. An evaluation of salmeterol in the treatment of chronic obstructive pulmonary disease (COPD). Eur Respir J 1997; 10: 815-21. [ Links ]
180. Mahler DA, Donohue JF, Barbee RA, et al. Efficacy of salmeterol xinafoate in the treatment of COPD. Chest 1999; 115: 957-65. [ Links ]
181. Albers R, Ayres J, Backer V, et al. Formoterol in patients with chronic obstructive pulmonary disease: a randomized, controlled, 3-month trial. Eur Respir J 2002; 19: 936-43. [ Links ]
182. Dahl R, Chung KF, Buhl R, et al. Efficacy of a new once-daily long-acting inhaled ß2-agonist indacaterol vs twice-daily formoterol in COPD. Thorax 2010; 65: 473-9. [ Links ]
183. Stam J, Souren M, Zweers P. The onset of action of formoterol, a new beta-2 adrenoceptor agonist. Int J Clin Pharmacol Ther Toxicol 1993; 31: 23-6. [ Links ]
184. Rodrigo G., Nannini LJ., Rodríguez-Roisin R. Safety of long-acting ß-agonists in stable COPD. Chest 2008; 133: 1079-87. [ Links ]
185. Wang J, Nie B, Xiong W,Xu Y. Effect of long-acting agonist on the frecuency of COPD exacerbation: a metanalysis. J Clin Pharm Ther 2011; Jul 11 (Epub ahead of print). [ Links ]
186. Rau J. Practical Problems with aerosol therapy in COPD. Respir Care 2006; 51: 158-72. [ Links ]
187. Berry R, Shinto R, Wong F, et al. Nebulizer vs spacer for bronchodilator delivery. Chest 1989; 96: 1241-6. [ Links ]
188. Dolovich MB, Ahrens RC, Hess DR, et al. Device selectionand outcomes of aerosol therapy: evidence-based guidelines: American College of Chest Physicians/American College of Asthma, Allergy, and Immunology. Chest 2005; 127: 335-71. [ Links ]
189. NAEP. National Asthma Education Program. Teach your patients about asthma. A clinician's guide. National Institutes of Health, Bethesda, 1992, Pub. # 92-2737. [ Links ]
190. Disse B, Speck GA, Rominger KL, et al. Tiotropium (Spiriva): mechanistical considerations and clinical profile in obstructive lung disease. Life Sci 1999; 64: 457-64. [ Links ]
191. Vincken W, van Noord JA, Greefhorst AP, et al. Improved health outcomes in patients with COPD during 1 year treatment with tiotropium. Eur Respir J 2002; 19: 209-16. [ Links ]
192. Casaburi R, Mahler DA, Jones PW, et al. A long-term evaluation of once-daily inhaled tiotropium in chronic obstructive pulmonary disease. Eur Respir J 2002; 19: 217-24. [ Links ]
193. O`Donnell DE, Flüge T, Gerken F, et al. Effects of tiotropium on lung hyperinflation, dyspnoea and exercise tolerance in COPD. Eur Respir J 2004; 23: 825-31. [ Links ]
194. Celli B, Decramer M, Kesten S, et al. Mortality in the 4-year trial of tiotropium (UPLIFT) in patients with chronic obstructive pulmonary disease. Am J Respir Crit Care Med 2009; 180: 948-55. [ Links ]
195. Casaburi R, Kukafka D, Cooper CB, et al. Improvement in exercise tolerance with the combination of tiotropium and pulmonary rehabilitation in patients with COPD. Chest 2005; 127: 809-17. [ Links ]
196. Dusser D, Bravo ML, Iacono P. The effect of tiotropium on exacerbations and airflow in patients with COPD. Eur Respir J 2006; 27: 547-55. [ Links ]
197. Brusasco V, Hodder R, Miravitlles M, et al. Health outcomes following treatment for six month with once daily tiotropium compared with twice daily salmeterol in patients with COPD. Thorax 2003; 58: 399-404. [ Links ]
198. Niewoehner D, Rice K, Cote C, et al. Prevention of exacerbations of chronic obstructive pulmonary disease with tiotropium, a once-daily inhaled anticholinergic bronchodilator. Ann Intern Med 2005; 143: 317-26. [ Links ]
199. Vogelmeier C, Hederer B, Glaab B, et al .Tiotropium versus salmeterol for the Prevention of Exacerbations of COPD. N Engl J Med 2011; 354: 1093-103. [ Links ]
200. Ram FS, Jones PW, Castro AA, et al. Oral theophylline for chronic obstructive pulmonary disease (Cochrane Review). Cochrane Database Syst Rev 2002; 4: CD003902. [ Links ]
201. Zhou Y, Wang X, Zeng X, et al. Positive benefits of theophylline in a randomized, double-blind, parallel-group, placebo-controlled study of low-dose, slow-release theophylline in the treatment of COPD for 1 year. Respirology 2006; 11: 603-10. [ Links ]
202. McKay SE, Howie CA, Thomson AH, et al. Value of theophylline treatment in patients handicapped by chronic obstructive lung disease. Thorax 1993; 48: 227-32. [ Links ]
203. Ford PA, Durham AL, Russell REK, et al. Treatment effects of low-dose theophylline combined with an inhaled corticosteroid in COPD. Chest 2010 137: 1338-44. [ Links ]
204. To Y, Ito K, Kizawa Y, et al. Targeting phosphoinositide- 3-kinase-d with theophylline reverses corticosteroid insensitivity in COPD. Am J Respir Crit Care Med 2010; 182: 897-904. [ Links ]
205. Zhou Y, Wang X, Zeng X, et al. Positive benefits of theophylline in a randomized, double-blind, parallel-group, placebo-controlled study of low-dose, slow-release theophylline in the treatment of COPD for 1 year. Respirology 2006; 11: 603-10. [ Links ]
206. Man WD, Mustfa N, Nikoletou D, Kaul S. In chronic obstructive pulmonary disease, a combination of ipratropium and albuterol is more effective than either agent alone. An 85-day multicenter trial. COMBIVENT Inhalation Aerosol Study Group. Chest 1994; 105: 1411-9. [ Links ]
207. Ikeda A, Nishimura K, Koyama H, Izumi T. Bronchodilating effects of combined therapy with clinical dosages of ipratropium bromide and salbutamol for stable COPD: comparison with ipratropium bromide alone. Chest 1995; 107: 401-5. [ Links ]
208. COMBIVENT Inhalation Solution Study Group. Routine nebulized ipratropium and albuterol together are better than either alone in COPD. Chest 1997; 112: 1514-21. [ Links ]
209. Gross N, Tashkin D, Miller R, Oren J, Coleman W, Linberg S. Inhalation by nebulization of albuterol-ipratropium combination is superior to either agent alone in the treatment of chronic obstructive pulmonary disease. Respiration 1998: 65: 354-62. [ Links ]
210. van Noord J, Aumann J, Janssens E, et al. Effects of tiotropium with and without formoterol on airflow obstruction and resting hyperinflation in patients with COPD. Chest 2006; 129: 509-17. [ Links ]
211. van Noord JA, Aumann JL, Janssens E, et al. Comparison of tiotropium once daily, formoterol twice daily and both combined once daily in patients with COPD. Eur Respir J 2005; 26: 214-22. [ Links ]
212. Tashkin DP, Cooper CB. The role of long-acting bronchodilators in the management of stable COPD. Chest 2004; 125: 249-59. [ Links ]
213. Cazzola M, Centanni S, Santus P, et al. The functional impact of adding salmeterol and tiotropium in patients with stable COPD. Respir Med 2004; 98: 1214-21. [ Links ]
214. Rossi A, Kristufek P, Levine BE, et al. Comparison of the efficacy, tolerability, and safety of formoterol dry powder and oral, slow-release theophylline in the treatment of COPD. Chest 2002; 21: 1058-69. [ Links ]
215. Cazzola M, Gabriella Matera M. The additive effect of theophylline on a combination of formoterol and tiotropium in stable COPD: a pilot study. Respir Med 2007; 101: 957-62. [ Links ]
216. Zuwallack RL, Mahler DA, Reilly D, et al. Salmeterol plus theophylline combination therapy in the treatment of COPD. Chest 2001; 119: 1661-70. [ Links ]
217. Keatings J, Jatakanon A, Worsdell YM, Barnes PJ. Effects of inhaled and oral glucocorticoids on inflammatory indices in asthma and COPD. Am J Respir Crit Care Med 1997; 155: 542-8. [ Links ]
218. Culpitt S., Maziak W, Loukidis S, et al. Effect of high dose inhaled steroid on cells, cytokines, and proteases in induced sputum in chronic obstructive pulmonary disease. Am J Respir Crit Care Med 1999; 160: 1635-9. [ Links ]
219. Hattotuwa K, Gizycki MJ, Ansari TW, et al. The effects of inhaled fluticasone on airway inflammation in chronic obstructive pulmonary disease: a double-blind, placebo-controlled biopsy study. Am J Respir Crit Care Med 2002; 165: 1592-6. [ Links ]
220. Gizycki MJ, Hattotuwa HL, Barnes N, Jeffery PK. Effects of fluticasone propionate on inflammatory cells in COPD: an ultrastructural examination of endobronchial biopsy tissue. Thorax 2002; 57: 799-803. [ Links ]
221. Kiri VA, Pride NB, Soriano JB, Vestbo J. Inhaled corticosteroids in chronic obstructive pulmonary disease: results from two observational designs free of immortal time bias. Am J Respir Crit Care Med 2005; 172: 460-4. [ Links ]
222. Pauwels RA, Lofdahl CG, Laitinen LA, et al. Long-term treatment with inhaled budesonide in persons with mild chronic obstructive pulmonary disease who continue smoking. European Respiratory Society Study on COPD. N Engl J Med 1999; 340: 1948-53. [ Links ]
223. Burge PS, Calverley PM, Jones PW, et al. Randomised, double blind, placebo controlled study of fluticasone propionate in patients with moderate to severe chronic obstructive pulmonary disease: the ISOLDE trial. BMJ 2000; 320: 1297-303. [ Links ]
224. Paggiaro PL, Dahle R, Bakran I, et al. Multicentre randomised placebo-controlled trial of inhaled fluticasone propionate in patients with chronic obstructive pulmonary disease. Lancet 1998; 351: 773-80. [ Links ]
225. Alsaeedi J, Sin DD, Finlay A, McAlister F. The effects of inhaled corticosteroids in chronic obstructive pulmonary disease: a systematic review of randomized placebo-controlled trials. Am J Med 2002; 113: 59-65. [ Links ]
226. Szafranski W, Cukier A, Ramirez A, et al. Efficacy and safety of budesonide/formoterol in the management of chronic obstructive pulmonary disease. Eur Respir J 2003; 21: 74-81. [ Links ]
227. Barnes NC, Yu-Sheng Qiu, Pavord ID, et al. Antiinflammatory effects of salmeterol/fluticasone propionate in chronic obstructive lung disease. Am J Respir Crit Care Med 2006; 173: 736-43. [ Links ]
228. Hanania N A, Darken P, Horstman D, et al. The efficacy and safety of fluticasone propionate (250 µg)/salmeterol (50 µg) combined in the diskus inhaler for the treatment of COPD. Chest 2003; 124: 834-43. [ Links ]
229. Bourbeau J, Christodoulopoulos P, Maltais F, et al. Effect of salmeterol/fluticasone propionate on airway inflammation in COPD: a randomised controlled trial. Thorax 2007; 62: 938-43. [ Links ]
230. Nannini L, Cates CJ, Lasserson TJ, Poole P. Combined corticosteroid and long-acting beta-agonist in one inhaler versus placebo for chronic obstructive pulmonary disease (Cochrane Review). The Cochrane Library, Issue 3, 2004. [ Links ]
231. Kardos P, Wencker M, Glaab T, Vogelmeier C. Impact of salmeterol/fluticasone propionate versus salmeterol on exacerbations in severe chronic obstructive pulmonary disease. Am J Respir Crit Care Med 2007; 175: 144-9. [ Links ]
232. Aggarwal R, Aggarwal ANS, Gupta D, Jindal SK. Inhaled corticosteroids vs placebo for preventing COPD exacerbations: a systematic review and meta-regression of randomized controlled trials. Chest 2010; 137: 318-25. [ Links ]
233. Sin DD, Wu L, Anderson JA, et al. Inhaled corticosteroids and mortality in chronic obstructive pulmonary disease. Thorax 2005; 60: 992-7. [ Links ]
234. Williams AJ, Baghat MS, Stableforth DE, et al. Dysphonia caused by inhaled steroids: recognition of a characteristic laryngeal abnormality. Thorax 1983; 38: 813-21. [ Links ]
235. Toogood JH, Jennings B, Baskerville J, et al. Dosing regimen of budesonide and occurrence of oropharyngeal complications. Eur J Respir Dis 1984; 65: 35-44. [ Links ]
236. Calverley PM, Boonsawat W, Cseke Z, et al. Maintenance therapy with budesonide and formoterol in chronic obstructive pulmonary disease. Eur Respir J 2003; 22: 912-9. [ Links ]
237. Wouters EF, Postma DS, Fokkens B, et al. Withdrawal of fluticasone propionate from combined salmeterol/fluticasone treatment in patients with COPD causes immediate and sustained disease deterioration: a randomised controlled trial. Thorax 2005; 60: 480-7. [ Links ]
238. Calverley PM, Anderson JA, Celli B, et al. Salmeterol and fluticasone propionate and survival in chronic obstructive pulmonary disease. N Engl J Med 2007; 356: 775-89. [ Links ]
239. Wilt TJ, Niewoehner D, MacDonald R, Kane RL. Management of stable chronic obstructive pulmonary disease: a systematic review for a clinical practice guideline. Ann Inter Med 2007; 147: 639-53. [ Links ]
240. Aaron SD, Vandemheen KL, Fergusson D et al. Tiotropium in combination with placebo, salmeterol or fluticasone- salmeterol for treatment of chronic obstructive pulmoanry disease: a randomized trial. Ann Intern Med 2007; 146: 545-55. [ Links ]
241. Welte T, Miravitlles M, Hernandez P, et al. Efficacy and tolerability of budesonide/formoterol added to tiotropium in patients with chronic obstructive pulmonary disease. Am J Respir Crit Care Med 2009; 180: 741-50. [ Links ]
242. Welte T. Optimising treatment for COPD - new strategies for combination therapy. Int J Clin Pract 2009; 63: 1136-49. [ Links ]
243. Qaseem A, Wilt T, Weinberger S, et al. Diagnosis and management of stable chronic obstructive pulmonary disease: a clinical practice guideline update from the American College of Physicians, American College of Chest Physicians, American Thoracic Society, and European Respiratory Society. Ann Int Med 2011; 155: 179-91. [ Links ]
244. Nichol KL., Margolis KL., Wuorenma J., Von Sternberg T. The efficacy and cost effectiveness of vaccination against influenza among elderly persons living in the community. N Engl J Med 1994; 331: 778-84. [ Links ]
245. Wongsurakiat P, Lertakyamanee J, Maranetra KN, et al. Economic evaluation of influenza vaccination in Thai chronic obstructive pulmonary disease patients. J Med Assoc Thai 2003; 86: 497-508. [ Links ]
246. Poole PJ, Chacko E, Wood-Baker RWB, Cates CJ. Influenza vaccine for patients with chronic obstructive pulmonary disease.(Cochrane Review). The Cochrane Library.Oxford: Update Software 2003; Issue 3. [ Links ]
247. Woodhead M, Blasi F, Ewig S, et al. Guidelines for the management of adult lower respiratory tract infections. Eur Respir J 2005; 26: 1138-80. [ Links ]
248. Jackson LA, Neuzil KM, Yu O, et al. Effectiveness of pneumococcal polysaccharide vaccine in older adults. N Eng J Med 2003; 348: 1747-55. [ Links ]
249. Centers for Disease Control and Prevention. Updated recommendations for prevention of invasive pneumococcal disease among adults using the 23-valent pneumococcal polysaccharide vaccine (PPSV23). MMWR 2010; 59: 1102-6. [ Links ]
250. Alfageme I, Vazquez R, Reyes N, et al. Clinical efficacy of anti-pneumococcal vaccination in patients with COPD. Thorax 2006; 61: 189-95. [ Links ]
251. National Institute for Clinical Excellence. Guidance on the use of zanamivir, amantadine and oseltamivir for the treatment of influenza. London: National Institute for Clinical Excellence. NICE technology appraisal guidance- No.58. 2003. [ Links ]
252. Dirksen A, Dijkman JH, Madsen F, et al. A randomized clinical trial of alpha1-antitrypsin augmentation therapy. Am J Respir Crit Care Med 1999; 160: 1468-72. [ Links ]
253. The Alpha 1-Antitrypsin Deficiency Registry Study Group. Survival and FEV1 decline in individuals with severe deficiency of alpha 1-an titrypsin. Am J Respir Crit Care Med 1998; 158: 49-59. [ Links ]
254. Chapman KR, Stockley RA, Dawkins C, et al. Augmentation therapy for alpha 1 antitrypsin deficiency: a meta-analysis. COPD 2009; 6: 177-84. [ Links ]
255. Tonelli AR, Rouhani F, Pam NL, et al. Alpha-1-antitrypsin augmentation therapy in deficient individuals enrolled in the Alpha1 Foundation DNA and Tissue Bank. International Journal of COPD 2009; 4: 443-52. [ Links ]
256. Dawkins PA, Dawkins CL, Wood AM, et al. Rate of progression of lung function impairment in a1-antitrypsin deficiency. Eur Respir J 2009; 33: 1335-41. [ Links ]
257. Soriano JB, Miravitlles M. Your racing horses will help you to quit: a lesson for COPD and a1-antitrypsin deficiency research. Eur Resp J 2009; 33: 1244-6. [ Links ]
258. Crosbie PA, Woodhead MA. Long term macrolide theraphy in chronic inflammatory airway diseases. Eur Respir J 2009; 33: 171-81. [ Links ]
259. Wilkinson TM, Seemungal TA, Sapsford R, et al. Effect of Long-term Erythromycin in COPD Trial (ELECT): exacerbations and inflammation. Thorax 2007; 62(Suppl. 3): A15. [ Links ]
260. Seemungal TAR, Wilkinson T, Hurst JR, et al. Long term erythromycin therapy is associated with decreased chronic obstructive pulmonary disease exacerbations. Am J Respir Crit Care Med 2008; 178: 1139-47. [ Links ]
261. Guyatt GH, Towsend M, Kazim F, Newhouse MT. A controlled trial of ambroxol in chronic bronchitis. Chest 1987; 92: 618-29. [ Links ]
262. Petty TL. The National Mucolytic Study: results of a randomized double blind placebo controlled study of iodinated glycerol in chronic obstructive bronchitis. Chest 1990; 97: 75-83. [ Links ]
263. Poole PJ, Black PN. Mucolytic agents for chronic bronchitis or chronic obstructive pulmonary disease. (Cochrane Review). The Cochrane Library.Oxford: Update Software 2003;Issue 3. [ Links ]
264. Decramer M, Janssens W. Mucoactive therapy in COPD. Eur Respir Rev 2010; 19: 134-40. [ Links ]
265. Stey C, Steurer J, Bachmann S, et al. The effect of oral N-acetylcysteine in chronic bronchitis: A quantitative systematic review. Eur Respir J 2000; 16: 253-62. [ Links ]
266. Decramer M, Rutten-van Mölken M, Dekhuijzen PN, et al. Effects of N-acetylcysteine on outcomes in COPD (Bronchus Trial): a randomized placebo-controlled trial. Lancet 2005; 365: 1552-60. [ Links ]
267. Collet JP, Shapiro P, Ernst P, et al. Effects of an immunostimulating agent on acute exacerbations and hospitalizations in patients with COPD. Am J Respir Crit Care Med 1997; 156: 1719-24. [ Links ]
268. Li J, Zheng JP, Yuan JP, et al. Protective effect of a bacterial extract against acute exacerbation in patients with chronic bronchitis accompanied by COPD. Chin Med J 2004; 117: 828-34. [ Links ]
269. Anthonisen NR. OMV-8BV for COPD. Am J Respir Crit Care Med 1997; 156: 1713-4. [ Links ]
270. Soler M, Mutterlein R, Cozma G. Double-blind study of OM-85 in patients with chronic bronchitis or mild chronic obstructive pulmonary disease. Respiration 2007; 74: 26-32. [ Links ]
271. Irwin RS, Boulet LP, Cloutier MM, et al. Managing cough as a defense mechanism and as a symptom: a consensus panel report of the American College of Chest Physicians. Chest 1998; 114: 133S-181S. [ Links ]
272. Jennings AL, Davies AN, Higgins JPT, Broadley K. Opioids for the palliation of breathlessness in terminal illness. Cochrane Database Syst Rev 2001;4: CD002066. [ Links ]
273. Jennings AL, Davies AN, Higgins JP, et al. A systematic review of the use of opioids in the management of dyspnea. Thorax 2002; 57: 939-44. [ Links ]
274. Eiser N, Denman WT, West C, Luce P. Oral diamorphine: lack of effect on dyspnea and exercise tolerance in the pink puffer syndrome. Eur Respir J 1191; 4: 926-31. [ Links ]
275. Young IH, Daviskas E, Keena VA. Effect of low dose nebulised morphine on exercise endurance in patients with chronic lung disease. Thorax 1989; 44: 387-90. [ Links ]
276. Woodcock AA, Gross ER, Gellert A, Shah S, Johnson M, Geddes DM. Effects of dydrocodeine, alcohol, and caffeine on breathlessness and exercise tolerance in patients with chronic obstructive lung disease and normal blood gases. N Engl J Med 1981; 305: 1611-6. [ Links ]
277. Rice KL, Kronenber RS, Niewoehner DE. Effects of chronic administration of codeine and promethazine on breathlessness and exercise tolerance in patients with chronic airflow obstruction. Br J Dis Chest 1987; 81: 287-92. [ Links ]
278. Poole PJ, Veale AG, Black PN. The effect of sustained-release morphine on breathlessness and quality of life in severe COPD. Am J Respir Crit Care Med 1998; 157: 1877-80. [ Links ]
279. Dandona P, Dhindsa S, Ghamim H, Chaudhuri A. Angiotensin II and inflammation: the effect of angiotensin-converting enzyme inhibition snf sngiotensin II receptors blockade. J Hum Hypertens 2007; 2: 20-7. [ Links ]
280. Andreas S, Hermann-Lingen C, Raupach T, et al. Angiotensin II blockers in obstructive pulmonary disease: a randomized controlled trial. Eur Resp J 2006; 27: 972-9. [ Links ]
281. Komajda M, Follath F, Swedberg K, et al. The study group of diagnosis of the working group on heart failure of the European Society of Cardiology. A survey among the quality of care among patients with heart failure in Europe. Eur Heart J 2003; 24: 464-74. [ Links ]
282. Salpeter SR, Ormiston TM, Salpeter EE, et al. Cardioselective beta-blockers for chronic obstructive pulmonary disease: a meta-analysis. Respir Med 2003; 97: 1094-101. [ Links ]
283. Ashrafian H, Violaris AG. Beta-blocker therapy of cardiovascular diseases in patients with bronchial asthma or COPD: the pro viewpoint. Prim Care Respir J 2005; 14: 236-41. [ Links ]
284. Van Gestel YR, Hoeks SE, Sin DD, et al. Impact of selective beta-blockers on mortality in patients with chronic obstructive pulmonary disease and atherosclerosis. Am J Resp Crit Care Med 2008; 178: 695-700. [ Links ]
285. Rutten FH, Zuithoff N, Hak E, Grobee DE, Hoes AW. Beta blockers may reduce mortality and risk of exacerbations in patients with chronic obstructive pulmonary disease. Arch Intern Med 2010; 170: 880-7. [ Links ]
286. Sin DD, Man SFP. A curious case of ß-blockers in chronic obstructive pulmonary disease. Arch Intern Med 2010; 170: 849-50. [ Links ]
287. Janda S, Park K, Fitzgerald M, et al. Statins in COPD. A systematic review. Chest 2009; 136: 734-43. [ Links ]
288. Calverley PMA, Rabe KF, Goehring UM, et al. Roflumilast in symptomatic chronic obstructive pulmonary disease: two randomised clinical trials. Lancet 2009; 374: 685-94. [ Links ]
289. Fabbri LM, Calverley PMA, Izquierdo-Alonso JL, et al. Roflumilast in moderate-to severe chronic obstructive pulmonary disease treated with long acting bronchodilators: two randomised trials. Lancet 2009; 374: 695-703. [ Links ]
290. Report of the Medical Research Council Working Party. Long term domiciliary oxygen therapy in chronic hypoxic cor pulmonale complicating chronic bronchitis and emphysema. Lancet 1981; 1: 681-6. [ Links ]
291. Kvale PA, Cugell DW, Anthonisen NR, et al. Continuous or nocturnal oxygen therapy in hypoxemic chronic obstructive lung disease. Ann Intern Med 1980; 93: 391-8. [ Links ]
292. O'Donnell DE, Aaron S, Bourbeau J, et al. Canadian Thoracic Society recommendations for management of chronic obstructive pulmonary disease - 2007 update. Can Respir J 2007; 14 (Suppl. B): 5B-32B. [ Links ]
293. Somfay A, Porszasz J, Lee SM, Casaburi R. Dose-response effect of oxygen on hypertension and exercise endurance in non hypoxaemic COPD patients. Eur Respir J 2001; 18: 77-84. [ Links ]
294. Liker ES, Karnick A, Lerner L. Portable oxygen in chronic obstructive lung disease with hypoxemia and cor pulmonale. Chest 1975; 68: 236-41. [ Links ]
295. Rooyackers JM, Dekhuijzen PN, Van Herwaarden CL, Folgering HT. Training with supplemental oxygen in patients with COPD and hypoxaemia at peak exercise. Eur Respir J 1997; 10: 1278-84. [ Links ]
296. Ambrosino N, Strambi S. New strategies to improve exercise tolerance in chronic obstructive pulmonary disease. Eur Respir J 2004; 24: 313-22. [ Links ]
297. Lacasse Y, Lecours R, Pelletier C, et al. Randomised trial of ambulatory oxygen-dependent COPD. Eur Respir J 2005; 25: 1032-8. [ Links ]
298. Eaton T, Gonett JE, Young P, et al. Ambulatory oxygen improves quality of life of COPD patients: a randomized controlled study. Eur Respir J 2002; 20: 306-12. [ Links ]
299. Tarpy SP, Celli BR. Long-term oxygen therapy. N Engl J Med 1995; 333: 710-4. [ Links ]
300. Ram FSF, Wedzicha JA. Ambulatory oxygen for chronic obstructive pulmonary disease (Review). The Cochrane Library 2009 (Issue 4): 1-24. [ Links ]
301. Plywaczewski R, Sliwinski P, Nowinski A, et al. Incidence of nocturnal desaturation while breathing oxygen in COPD patients undergoing long-term oxygen therapy. Chest 2000; 117: 679-83. [ Links ]
302. Fletcher EC, Luckett RA, Goodnight-White S, et al. A double-blind trial of nocturnal supplemental oxygen for sleep desaturation in patients with chronic obstructive pulmonary disease and daytime PaO2 above 60 mm Hg. Am Rev Respir Dis 1992; 145: 1070-6. [ Links ]
303. Chaouat A, Wetzenblum E, Kessler R, et al. A randomized trial of nocturnal oxygen therapy in chronic obstructive pulmonary disease patients. Eur Respir J 1999; 14: 997-9. [ Links ]
304. Apte NM, Karnad DR. Altitude hypoxaemia and the arterial-to-alveolar oxygen ratio. Ann Intern Med 1990; 112: 547-8. [ Links ]
305. Gale GE, Torre-Bueno JR, Moon RE, et al. Ventilation-perfusion inequality in normal humans during exercise at sea level and simulated altitude. J Appl Physiol 1985; 58: 978-88. [ Links ]
306. West JB, Wagner PD. Predicted gas exchange on the summit of Mt. Everest. Respir Physiol 1980; 42: 1-16. [ Links ]
307. Ward MP. High altitude medicine and physiology. Ed. Ward MP, Milledge JS, West JB.London: Arnold; 2000.434p. [ Links ]
308. BTS Statement. Management passengers with respiratory disease planning air travel. British Thoracic recommendations. Thorax 2002; 57: 289-304. [ Links ]
309. Cakel RK, Partridge MR. Assessing the rise of hypoxia in flight: the need for more rational guidelines. Eur Resp J 2000; 15: 128-30. [ Links ]
310. García Rio F, Borderías Calu L, Casanova Macario C, et al. Normativa SEPAR. Patología respiratoria y vuelos en avión. Arch Bronconeumonol 2007; 43: 101-25. [ Links ]
311. Martinez Fraga A., Sivori M., Alonso M, Saenz C. Situación de la oxigenoterapia en vuelos nacionales e internacionales en Argentina. Medicina (B Aires) 2008; 68: 433-6. [ Links ]
312. Gong H. Jr. Air travel and oxygen therapy in cardiopulmonary patients. Chest 1992; 101: 1104-13. [ Links ]
313. Muhm MJ. Predicted arterial oxygenation at commercial aircraft cabin altitudes. Aviat Space Environ Med 2004; 75: 905-12. [ Links ]
314. Robson A, Hartung T, Innes J. Laboratory assessment of fitness to fly in patients with lung disease: a practical approach. Eur Respir J 2000; 16: 214-9. [ Links ]
315. Cullen DL. Long term oxygen therapy adherence and COPD: What we don't know. Chron Respir Dis 2006; 3: 217-22. [ Links ]
316. Górecka D, Gorzelak K, Sliwinski P, et al. Effect of long-term oxygen therapy on survival in patients with chronic obstructive pulmonary disease with moderate hypoxemia. Thorax 1997; 52: 674-9. [ Links ]
317. Kolodziej MA, Jensen L, Rowe B, Sin D. Systematic review of noninvasive positive pressure ventilation in severe stable COPD. Eur Respir J 2007; 30: 293-306. [ Links ]
318. Clini EM., Ambrosino N. Nonpharmacological treatment and relief of symptoms in COPD. Eur Respir J 2008; 32: 218-28. [ Links ]
319. Petty TL, Stanford RE, Neff TA. Continuous oxygen therapy in chronic airway obstruction: observations on possible oxygen toxicity and survival. Ann Intern Med 1971; 75: 361-7. [ Links ]
320. ATS/ERS. Statement on Pulmonary Rehabilitation. Am J Crit Care Med 2006; 173: 1390-413. [ Links ]
321. Ringbaek TJ, Broendum E, Hemmingsen L, et al. Rehabilitation of patients with chronic obstructive pulmonary disease: exercise twice a week is not sufficient. Respir Med 2000; 94: 150-4. [ Links ]
322. Troosters T, Casabury R, Gosselink R, Decramer M. Pulmonary Rehabilitation in Chronic Obstructive Pulmonary Disease. Am J Respir Crit Care Med 2005; 172: 19-38. [ Links ]
323. Sivori M, Benzo R, Rhodius E, et al. Consenso Argentino de Rehabilitación Respiratoria. Medicina( B Aires) 2004; 64: 357-67. [ Links ]
324. Bradley JM, Lasserson T, Elborn S, et al. A systematic review of randomized controlled trials examining the short-term benefit of ambulatory oxygen in COPD. Chest 2007; 131: 278-85. [ Links ]
325. Ries A, Bauldoff G, Carlin B, et al. Pulmonary Rehabilitation: Joint ACCP/AACVPR Evidence-Based Clinical Practice Guidelines. Chest 2007; 131: 4S-42S. [ Links ]
326. Bradley JM, O´Neill B. Short-term ambulatory oxygen for chronic obstructive pulmonary disease. Cochrane Database Syst Rev 005;19: CD004356. [ Links ]
327. Clini E, Sturani C, Rossi A et al. The Italian multicentre study on non invasive ventilation in chronic obstructive pulmonary disease patients. Eur Respir J 2002; 20: 529-38. [ Links ]
328. Consensus conference report: Clinical indication for non invasive positive pressure ventilation in chronic respiratory failure due to restrictive lung disease, COPD, and nocturnal hypoventilation. Chest 1999; 116; 521-34. [ Links ]
329. Bourbeau J. The role of collaborative self-management in pulmonary rehabilitation. Semin Respir Crit Care Med 2009; 30: 700-7. [ Links ]
330. Hernandez P, Balter M, Bourbeau J, Hodder R. Living with chronic obstructive pulmonary disease: a survey of patients' knowledge and attitudes. Respir Med 2009; 103: 1004-12. [ Links ]
331. Sedeno MF, Nault D, Hamd DH, Bourbeau J. A self-management education program including an action plan for acute COPD exacerbations. COPD 2009; 6: 352-8. [ Links ]
332. Adams SG, Smith PK, Allan PF, Anzueto A, Pugh JA, Cornell JE. Systematic review of the chronic care model in chronic obstructive pulmonary disease prevention and management. Arch Intern Med 2007; 167: 551-61. [ Links ]
333. Whittaker JS, Ryan CF, Buckley PA, Road JD. The effect of re-feeding on peripheral and respiratory muscle function in malnourished chronic obstructive pulmonary disease patients. Am Rev Respir Dis 1990; 142: 283-8. [ Links ]
334. Rogers RM, Donahoe M, Constantino J. Physiologic effects of oral supplementation feeding in malnourished patients with chronic obstructive pulmonary disease. A randomized control study. Am Rev Respir Dis 1992; 146: 1511-7. [ Links ]
335. Steiner MC, BartonRL, Singh SK, Morgan MD. Nutritional enhancement of exercise performance in chronic obstructive pulmonary disease patients: a randomized trial. Thorax 2003; 58: 745-51. [ Links ]
336. Rogers RM, Donahoe M, Constantino J. Physiologic effects of oral supplementation feeding in malnourished patiens with chronic obstructive pulmonary disease. A randomized control study. Am Rev Respir Dis 1992; 146: 1511-7. [ Links ]
337. Martinez F, Chang A. Surgical therapy for chronic obstructive pulmonary disease. Semin Respir Crit Care Med 2005; 26: 167-91. [ Links ]
338. Snider GL. Reduction pneumoplasty for giant bullous emphysema. Implications for surgical treatment of nonbullous emphysema. Chest 1996; 109: 540-8. [ Links ]
339. Naunheim KS, Wood DE, Mohenifar Z, et al. Long-term follow-up of patients receiving lung-volume-reduction surgery versus medical therapy for severe emphysema by the National Emphysema Treatment Trial Research Group. Ann Thorac Surg 2006; 82: 431- 43. [ Links ]
340. Orens JB, Estenne M, Arcasoy S, et al. International guidelines for the selection of lung transplant candidates: 2006 Update-a consensus report from the Pulmonary Scientific Council of the International Society for Heart and Lung Transplantation. J Heart Lung Transplant 2006; 25: 745-55. [ Links ]
341. Varela A, Álvarez Kindelan A, Román A, et al. Grupo de trabajo de la SEPAR. Normativa SEPAR. Trasplante pulmonar. Arch Bronconeumol 2001; 37:307-15. [ Links ]
342. Venuta F, Rendina EA, De Giacomo T, et al. Bronchoscopic procedures for emphysema treatment. Eur J Cardiothorac Surg 2006; 29: 281-7. [ Links ]
343. Sciurba FC, Ernst A, Herth FJ, et al. A randomized study of endobronchial valves for advanced emphysema. N Engl J Med 2010; 363: 1233-44. [ Links ]
344. Jones PW. Quality of life measurement for patients with diseases of the airways. Thorax 1991; 46: 676-82. [ Links ]
345. Jones W, Harding G, Berry P, et al. COPD Development and first validation of the COPD Assessment Test. Eur Respir J 2009; 34: 648-54. [ Links ]
346. Guell R, Casan P, Sangenis M, Morante F, Belda J, Guyatt GH. Quality of life in patients with chronic respiratory disease: the Spanish version of the chronic respiratory questionnaire (CRQ). Eur Respir J 1998; 11: 55-60. [ Links ]
347. Jones PW, Quirk FH, Baveystock CM. The St George's Respiratory Questionnaire. Respir Med 1991; 85 Suppl B: 25-31. [ Links ]
348. Lynn J, Goldstein NE. Advance care planning for fatal chronic illness: avoiding common place errors and unwarranted suffering. Ann Intern Med 2003; 138: 812-8. [ Links ]
349. Código de Ética para el equipo de Salud de la Asociación Médica Argentina. Buenos Aires, Argentina, 2002. [ Links ]
350. Guía de Cuidados Paliativos. SECPAL (Sociedad Española de Cuidados Paliativos) http://www.secpal.com/guiacp/guiacp.pdf. Consultado 12 de diciembre de 2009. [ Links ]
351. Legislación Nacional. Dictámenes de mayoría y minoría sobre el Proyecto de Ley de Régimen de los derechos de los enfermos terminales. Comisiones de Acción Social y Salud Pública, de Legislación General y de Legislación Penal. Sala de las Comisiones, 9 de octubre de 1996. En: http://www.muerte.bioetica.org/legis/leyproy.htm; consultado el 12/12/2009. [ Links ]
352. Tripodoro V. Cuidados paliativos: El final de la vida en pacientes respiratorios crónicos. Rev Arg Med Respir 2004; 4:48-53 [ Links ]
353. Alvarez-Sala JL, Cimas E, Masa JF, et al. Grupo de Trabajo de la Sociedad Española de Neumología y Cirugía Torácica (SEPAR) y de la Sociedad Española de Medicina de Familia y Comunitaria (semFYC). Recomendaciones para la atención al paciente con enfermedad pulmonar obstructiva crónica. Arch Bronconeumol 2001; 37: 269-78. [ Links ]
354. World Health Organization. International Classification of Impairments, Disabilities and Handicaps. Geneva: World Health Organization,1980. [ Links ]
355. Guidelines for the evaluation of impairment/disability in patients with asthma. American Thoracic Society. Medical Section of the American Lung Association. Am Rev Respir Dis 1993; 147: 1056-61. [ Links ]
356. American Medical Association. Guides to the evaluation of permanent impairment, 4th ed, Chicago: American Medical Association, 1993. [ Links ]
357. Rodriguez Roisin R. Toward a consensus definition for COPD exacerbations. Chest 2000; 117: 398S-401S. [ Links ]
358. Niewoehner DE, Lokhnygina Y, Rice K, et al. Risk indexes for exacerbations and hospitalizations due to COPD. Chest 2007; 131: 20-8. [ Links ]
359. Bhowmik A, Seemungal TA, Sapsford RJ, Wedzicha JA. Relation of sputum inflammatory markers to symptoms and lung function changes in COPD exacerbations. Thorax 2000; 55: 114-20. [ Links ]
360. Crooks SW, Bayley DL, Hill SL, Stockley RA. Bronchial inflammation in acute bacterial exacerbations of chronic bronchitis: the role of leukotriene B4. Eur Respir J 2000; 15: 274-80. [ Links ]
361. Seemungal TAR, Harper-Owen R, Bhowmik A, et al. Respiratory viruses, symptoms and inflammatory markers in acute exacerbations and stable chronic obstructive pulmonary disease. Am J Respir Crit Care Med 2001; 164: 1618-23. [ Links ]
362. Hurst JR, Perera WR, Wilkinson TM. Systemic and upper and lower airway inflammation at exacerbation of chronic obstructive pulmonary disease. Am J Respir Crit Care Med 2006; 173: 71-8. [ Links ]
363. Drost EM, Skwarski KM, Sauleda J, et al. Oxidative stress and airway inflammation in severe exacerbations of COPD.Thorax 2005; 60: 293-300. [ Links ]
364. Murphy TF, Brauer AL, Schiffmacher AT, et al. Persistent colonization by Haemophilus influenzae in chronic obstructive pulmonary disease. Am J Respir Crit Care Med 2004; 170: 266-72. [ Links ]
365. Spencer S, Jones PW for the GLOBE Study Group. Time course of recovery of health status following an infective exacerbation of chronic bronchitis. Thorax 2003; 58: 589-93. [ Links ]
366. Currie GP, Wedzicha JA. Acute exacerbations. BMJ 2006; 333;87-9. [ Links ]
367. Bradley SG, Wen QG, Don DS. Contemporary Management of Acute Exacerbations of COPD. Chest 2008; 133:756-66. [ Links ]
368. Connors AF Jr, Dawson NV, Thomas C, et al. Outcomes following acute exacerbation of severe chronic obstructive lung disease. The SUPPORT investigators (Study to understand prognoses and preferences for outcomes and risks of treatments). Am J Respir Crit Care Med 1996; 154: 959-67. [ Links ]
369. Gunen H, Hacievliyagil S, Kosar F, et al. Factors affecting survival of hospitalised patients with COPD. Eur Respir J 2005; 26: 234-41. [ Links ]
370. Soler-Cataluña JJ, Martínez-García A, Román-Sánchez P, et al. Severe acute exacerbations and mortality in patients with chronic obstructive pulmonary disease. Thorax 2005; 60: 925-31. [ Links ]
371. Celli B, Barnes P. Exacerbations of chronic obstructive pulmonary disease. Eur Respir J 2007; 29: 1224-38. [ Links ]
372. Aaron SD, Vandemheen KL, Hebert P, et al. Outpatient oral prednisone after emergency treatment of chronic obstructive pulmonary disease. N Engl J Med 2003; 348: 2618-25. [ Links ]
373. Bullard MJ, Liaw SJ, Tsai YH, et al. Early corticosteroid use in acute exacerbations of chronic airflow obstruction. Am J Emerg Med 1996; 14: 139-43. [ Links ]
374. Davies L, Angus RM, Calverley PM. Oral corticosteroids in patients admitted to hospital with exacerbations of chronic obstructive pulmonary disease: a prospective randomized controlled trial. Lancet 1999; 354: 456-60. [ Links ]
375. Maltais F, Ostinelli J, Bourbeau J, et al. Comparison of nebulized budesonide and oral prednisolone with placebo in the treatment of acute exacerbations of chronic obstructive pulmonary disease: a randomized controlled trial. Am J Respir Crit Care Med 2002; 165: 698-703. [ Links ]
376. Niewoehner DE, Erbland ML, Deupree RH, et al. Effect of systemic glucocorticoids on exacerbations of chronic obstructive pulmonary disease: department of Veterans Affairs Cooperative Study Group. N Engl J Med 1999; 340: 1941-7. [ Links ]
377. Thompson WH, Nielson CP, Carvalho P, et al. Controlled trial of oral prednisone in outpatients with acute COPD exacerbation. Am J Respir Crit Care Med 1996; 154: 407-12. [ Links ]
378. Wilkinson TM, Donaldson GC, Hurst JR, et al. Early therapy improves outcomes of exacerbations of chronic obstructive pulmonary disease. Am J Respir Crit Care Med 2004; 169: 1298-303. [ Links ]
379. Stockley RA, O´Brien C, Pye A, Hill SL. Relationship of sputum color to nature and outpatient management of acute exacerbations of COPD. Chest 2000; 117: 1638-45. [ Links ]
380. Nouira S, Marghli S, Belghith M, et al. Once daily oral ofloxacin in chronic obstructive pulmonary disease exacerbation requiring mechanical ventilation: a randomised placebocontrolled trial. Lancet 2001; 358: 2020-25. [ Links ]
381. Ram FS, Rodriguez-Roisin R, Granados-Navarrete A, et al. Antibiotics for exacerbations of chronic obstructive pulmonary disease. Cochrane Database Syst Rev 2006; CD004403. [ Links ]
382. Torres A. COPD guidelines in relation to infections: a critical analysis. Breathe 2009; 5: 317-21. [ Links ]
383. Soler N, Torres A, Ewig S, et al. Bronchial microbial patterns in severe exacerbations of chronic obstructive pulmonary disease (COPD) requiring mechanical ventilation. Am J Respir Crit Care Med 1998; 157: 1498-505. [ Links ]
384. Miratvilles M, Espinosa C, Fernández Laso E, et al. Relationship between bacterial flora in sputum and exacerbations in patients with acute exacerbations of COPD. Chest 1999; 116: 40-6. [ Links ]
385. García Vidal C, Almagro P, Romani V, et al. Pseudomonas aeruginosa in patients hospitalized for COPD exacerbation: a prospective study. Eur Respir J 2009; 34: 1072-8 . [ Links ]
386. Soler N, Agustí C, Angrill J, et al. Bronchoscopic validation of the significance of sputum purulence in severe exacerbations of chronic obstructive pulmonary disease. Thorax 2007; 62: 29-35. [ Links ]
387. El Moussaoui R, Roede BM, Speelman P, et al. Short-course antibiotic treatment in acute exacerbations of chronic bronchitis and COPD: a meta-analysis of double-blind studies. Thorax 2008; 63: 415-22. [ Links ]
388. BTS guidelines. Non-invasive ventilation in acute respiratory failure. Thorax 2002; 57: 192-211. [ Links ]
389. Brochard L, Mancebo J, Elliott MW. Noninvasive ventilation for acute respiratory failure. Eur Respir J 2002; 19: 712-21. [ Links ]
390. Diez AR, Abbona H, Ferrero G, et al. Argentine consensus of non-invasive ventilation. Medicina (B Aires) 2005; 65: 437-57. [ Links ]
391. Confalonieri M, Garuti G, Cattaruzza MS, et al. Italian noninvasive positive pressure ventilation (NPPV) study group. A chart of failure risk for noninvasive ventilation in patients with COPD exacerbation. Eur Respir J 2005; 25: 348-55. [ Links ]
392. Bott J, Carroll MP, Conway JH, et al. Randomised controlled trial of nasal ventilation in acute ventilatory failure due to chronic obstructive airways disease. Lancet 1993; 341: 1555-7. [ Links ]
393. Plant PK, Owen JL, Elliott MW. Non-invasive ventilation in acute exacerbations of chronic obstructive pulmonary disease: long term survival and predictors of in-hospital outcome. Thorax 2001; 56: 708-12. [ Links ]
394. Ram FS, Picot J, Lightowler J, Wedzicha JA. Non-invasive positive pressure ventilation for treatment of respiratory failure due to exacerbations of chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 2004; CD004104. [ Links ]
395. Garpestad E, Brennan J, Hill NS. Noninvasive ventilation for critical care. Chest 2007; 132: 711-20. [ Links ]
396. American Thoracic Society, European Respiratory Society, European Society of Intensive Care Medicine and Société de Réanimation de Langue Française. International Consensus Conferences in Intensive Care Medicine: Non invasive positive pressure ventilation in acute respiratory failure. Am J Respir Crit Care Med 2001; 163: 283-91. [ Links ]
397. Brochard L, Isabey D, Piquet J, et al. Reversal of acute exacerbations of chronic obstructive lung disease by inspiratory assistance with a face mask. N Engl J Med 1990; 323: 1523-30. [ Links ]
398. MacIntyre NR, Cook DJ, Ely EW Jr, et al. Evidence-based guidelines for weaning and discontinuing ventilatory support: a collective task force facilitated by the American College of Chest Physicians; the American Association for Respiratory Care; and the American College of Critical Care Medicine. Chest 2001; 120: 375S-95S. [ Links ]
399. MacIntyre N, Huang YC. Acute exacerbations and respiratory failure in chronic obstructive pulmonary disease. Proc Am Thor Soc 2008; 5: 530-5. [ Links ]
400. Sociedad Argentina de Terapia Intensiva. Enfermedad pulmonar obstructiva crónica. Capítulo 14. Terapia Intensiva 4ta. Edición, Buenos Aires: Editorial Médica Panamericana, 2007. [ Links ]
401. Boles JM, Bion J, Connors A, et al. Weaning from mechanical ventilation. Eur Respir J 2007; 29: 1033-56. [ Links ]
402. Burns KE, Adhikari NK, Meade MO. A meta-analysis of noninvasive weaning to facilitate liberation from mechanical ventilation. Can J Anaesth 2006; 53: 305-15. [ Links ]














