Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Medicina (Buenos Aires)
Print version ISSN 0025-7680
Medicina (B. Aires) vol.72 no.5 Ciudad Autónoma de Buenos Aires Oct. 2012
ARTÍCULO ESPECIAL
Asma de difícil control en niños y adolescentes. Estrategias diagnóstico-terapéuticas
Hugo Neffen1, Santiago Vidaurreta2, Ana Balanzat3, Mónica Silvia De Gennaro4, Verónica Giubergia5, Jorge F. Maspero6, Ricardo J. Saranz7, Alejandro M. Teper8
1Hospital de Niños Orlando Alassia, Santa Fe,
2Hospital Universitario CEMIC, Buenos Aires,
3Hospital de Clínicas José de San Martín, Buenos Aires,
4Fundación CIDEA, Buenos Aires,
5Hospital Garrahan, Buenos Aires,
6Fundación CIDEA, Hospital Alemán, Buenos Aires,
7Clínica Universitaria Reina Fabiola, Facultad de Medicina, Universidad Católica de Córdoba, Córdoba,
8Centro Respiratorio Dr. Alberto Álvarez, Hospital de Niños Ricardo Gutiérrez, Buenos Aires
Dirección postal: Dr. Hugo Neffen, Irigoyen Freyre 2670, 3000 Santa Fe, Argentina
Fax: (54-342) 4560773 e-mail: hugoneffen@arnet.com.ar
Resumen
El asma es una de las enfermedades crónicas más frecuentes en los niños. Si bien la mayoría de los niños con asma responden a bajas dosis de corticoides inhalados y/o antagonistas del receptor de leucotrienos, algunos de ellos permanecen sintomáticos independientemente de cualquier esfuerzo terapéutico, presentando una elevada morbilidad e inclusive mortalidad. Aunque la mayoría de los pacientes controlan los síntomas de forma adecuada, existe un grupo importante que presenta síntomas graves de la enfermedad difíciles de controlar (ADC). El objetivo de la presente revisión es discutir los aspectos clínicos, diagnósticos y terapéuticos del ACD en los menores de 18 años y su implicancia en la práctica clínica diaria.
Palabras clave: Asma; Niños; Diagnóstico; Tratamiento
Abstract
Poorly controlled asthma: diagnosis and therapeutics in children and adolescents. Asthma is one of the most common chronic diseases in children. While most children with asthma respond to low doses of inhaled corticosteroids and /or leukotriene receptor antagonists, some of them remain symptomatic regardless of any therapeutic effort, showing a high morbidity and even mortality. While most of the patients control symptoms adequately, there is a large group with severe symptoms of the disease and difficult to control. The aim of this review is to discuss the clinical aspects, diagnosis and treatment of poorly controlled asthma in children and adolescents and its implications in daily clinical practice.
Key words: Asthma; Children; Diagnosis; Therapeutics therapeutics
El asma es una de las enfermedades crónicas más frecuentes en los niños. Si bien la mayoría responden a bajas dosis de corticoides inhalados y/o antagonistas del receptor de leucotrienos, algunos niños permanecen sintomáticos independientemente de cualquier esfuerzo terapéutico presentando una elevada morbilidad e incluso mortalidad1.
Aproximadamente trescientos millones de personas de todas las edades sufren de asma y hay 250 000 muertes prematuras debido al asma por año a nivel mundial2.
El estudio ISAAC (International Study of Asthma and Allergies in Childhood) documentó, entre 1996 y 2003, un aumento en la prevalencia mundial del asma, siendo en los adolescentes del 0.06% y del 0.13% entre escolares de 6 y 7 años de edad3. El patrón de aumento fue distinto en diferentes partes del mundo. En América Latina los valores observados fueron de 0.14% por año entre los adolescentes y de 0,21% por año entre los escolares de menor edad.
Como se mencionó previamente, gran parte de los pacientes controlan los síntomas de forma adecuada; de todos modos existe un grupo importante que presenta síntomas graves de la enfermedad y su control es difícil. Respecto a este punto, el estudio AIRLA (Asthma Insights and Reality in Latin America) realizado en 2004 determinó que el 5 al 15% de los pacientes con asma estudiados sufrían síntomas graves, el 23% debía ser hospitalizado, el 52% atendido en salas de emergencias y el 59% necesitaba una visita no programada a la consulta del médico tratante. En dicho estudio se observó que solo el 2.5% de los niños con asma bronquial alcanzaban los objetivos de control determinados por GINA (Global Initiative for Asthma) mostrando de esta forma la frecuencia de pacientes que no controlan los síntomas de la enfermedad a pesar del tratamiento4.
Considerando lo precedente, el objetivo de la presente revisión es discutir los aspectos clínicos, diagnósticos y terapéuticos del asma de difícil control (ADC) en los menores de 18 años, con el fin de aportar a la comunidad médica los aspectos básicos de esta condición y consecuentemente mejorar el abordaje terapéutico de los pacientes afectados.
Asma de difícil control (ADC)
Definición
Recientemente, expertos de la OMS5 acordaron la definición de asma grave como "asma no controlado que puede implicar riesgo de frecuentes y graves exacerbaciones (incluso con riesgo fatal) y/o reacciones adversas a la medicación utilizada con morbilidad crónica que incluye afectación de la función pulmonar o reducción del desarrollo pulmonar".
Dentro de esta definición de asma grave a la vez se pueden considerar tres categorías que engloban el concepto de ADC (Fig. 1):
Asma grave por tratamiento inadecuado: "asma que no es tratada en forma apropiada por fallas en su diagnóstico y tratamiento médico o porque no es posible el acceso a la medicación necesaria para su óptimo control".
Asma grave difícil de tratar: "asma que no tiene respuesta aparente al tratamiento, pero que, cuando el manejo es optimizado, se obtiene el control adecuado de la enfermedad".
En esta categoría, el pobre control es secundario a un inadecuado diagnóstico de condiciones co-mórbidas, pobre adherencia al tratamiento, deficiencias técnicas en el uso de los dispositivos inhalatorios y aerocámaras y factores ambientales y psicosociales.
Asma grave resistente al tratamiento: "asma que permanece en categoría de grave a pesar del uso de las más altas dosis de medicamentos disponibles (incluso esteroides orales) o que solo puede controlarse con el máximo nivel de terapia para el asma con un riesgo inaceptable de efectos adversos". También denominada "asma refractaria al tratamiento" o "asma cortico-resistente" representa la categoría que engloba con mayor fidelidad el concepto de ADC. Se sugiere que todo niño con asma que no puede ser controlado con medicación convencional según las pautas dictadas por las guías clínicas vigentes para la edad correspondiente, debiera calificarse como "asma grave problemática" y ser derivado al especialista. Luego, la evaluación del mismo permitirá sub-categorizarla según las definiciones expresadas más arriba.
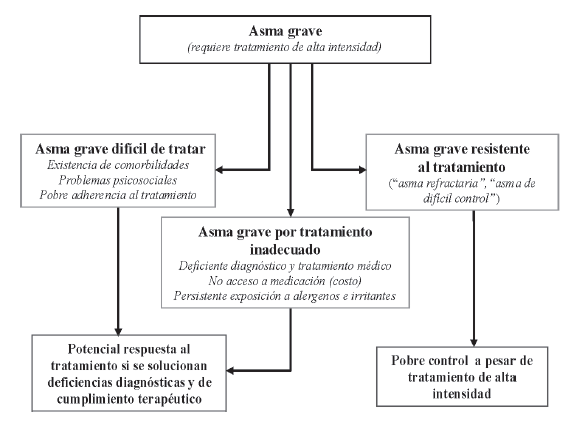
Fig. 1.- Espectro clínico del asma grave en pediatría
ADC: edad y características clínicas
Edad
La edad del niño que padece asma es condicionante de diferencias de expresión fenotípicas, desencadenantes, de evolución natural, limitaciones diagnósticas y de la intervención terapéutica que no deben soslayarse.
Lactante (0 a 2 años) y pre-escolar (3 a 5 años): Las dificultades diagnósticas de asma en esta edad se potencian por el conocimiento parcial de los mecanismos etiopatogénicos y la mayor posibilidad de diagnósticos diferenciales. Se agregan limitaciones para la determinación objetiva de la obstrucción bronquial, su reversibilidad y para el estudio de marcadores de la inflamación y el fenotipo clínico (episódico viral o con desencadenantes múltiples) o evolutivo (transitorio, de comienzo tardío o persistentes)6. Es sabido que las infecciones virales, especialmente por rinovirus, son causa frecuente de exacerbaciones. Estudios recientes demuestran que el mismo se halla frecuentemente en niños pequeños internados y ambulatorios7.
Escolar (6 a 12 años): Presenta como características fenotípicas distintivas que los síntomas a menudo son precipitados por el ejercicio, la sensibilización alérgica se torna más relevante y la valoración de la función pulmonar y el estudio de la inflamación de la vía aérea son más factibles8. El manejo y cumplimiento terapéutico es altamente dependiente de padres o cuidadores.
Adolescente (12 a 17 años): La expresión clínica puede ser variable, más frecuente en el sexo femenino, con tendencia a subestimar los síntomas. Los factores psicológicos son fuertes agravantes, lo que puede contribuir a dificultar el tratamiento, su cumplimiento y por ende, el control del asma9.
ADC: Fenotipos anátomo-patológicos
La heterogeneidad en los patrones inflamatorios y su respuesta terapéutica es una característica relevante en niños y adultos con ADC.
Los eosinófilos no son siempre las células predominantes. Un incremento en el número de neutrófilos, con o sin eosinofilia o formas paucigranulocíticas se ha encontrado en esputo de niños con asma grave y persistente y relacionada con formas más graves y refractarias de obstrucción crónica de la vía aérea10, 11.
Con fines prácticos, teniendo en consideración la refractariedad en la respuesta a esteroides destacan los siguientes fenotipos anátomo-patológicos de ADC
Asma de difícil control resistente a los corticoides con inflamación eosinofílica.
Niños que presentan inflamación endobronquial predominantemente eosinofílica pero que permanecen sintomáticos aun con dosis elevadas de esteroides inhalatorios12.
Asma de difícil control resistente a los corticoides con inflamación neutrofílica.
En este fenotipo, los biomarcadores de inflamación eosinofílica están ausentes y existe predominio de neutrófilos en esputo inducido o biopsia endobronquial. Está frecuentemente asociado al sexo femenino, obesidad, reflujo gastroesofágico y ausencia de atopia, con asma grave refractaria a esteroides.
ADC: Estrategias diagnósticas
Muchas enfermedades pueden simular asma de difícil control y otras condiciones pueden exacerbarla; por consiguiente, se impone un abordaje diagnóstico amplio. Por este motivo, para garantizar un diagnóstico correcto se deben evaluar diferentes aspectos del paciente y de su evolución para confirmar la presencia de asma y descartar otras enfermedades13.
Confirmación del diagnóstico de asma/Exclusión de otros diagnósticos
Es necesario analizar cuidadosamente los criterios de diagnóstico empleados y realizar en cada caso las pruebas oportunas que permitan descartar otras patologías. En la definición propuesta de ADC, la magnitud de tratamiento requerido, la persistencia de síntomas y la limitación del flujo aéreo son parámetros importantes para realizar el diagnóstico correctamente. Konradsen y Hedlin proponen criterios mayores y menores de diagnóstico, incrementando el poder diagnóstico de la condición al utilizarlos de forma apropiada14 (Tabla 1).
TABLA 1.- Criterios para la identificación de niños con asma grave

*Criterios menores observados dentro de los últimos 12 meses;
LABA (Long acting beta agonists): Beta agonistas de acción larga; LTRA: Antagonistas de receptores de leucotrienos.
Exclusión de otros diagnósticos
Como parte del diagnóstico correcto de asma se deben excluir otras patologías con síntomas similares que puedan enmascarar o solaparse con el asma. Debe recordarse que la solicitud de estudios complementarios deberá estar siempre basada en una historia clínica y un examen físico minuciosos. Se sugiere efectuar radiografía de tórax, test del sudor y tomografía computarizada de alta resolución cuando se sospechen lesiones asociadas (bronquiectasias, malformaciones congénitas y compromiso intersticial pulmonar). También se excluirá tuberculosis efectuando prueba tuberculínica y cultivos para micobacterias. Según las características del paciente podrá considerarse biopsia y medición de óxido nítrico nasal para descartar disquinesia ciliar primaria15.
En pacientes con antecedentes de infecciones recurrentes se descartarán inmunodeficiencias congénitas o adquiridas. Se sugiere evaluar las inmunoglobulinas G (eventualmente con subclases), M, A y E. Se podrá incluir la evaluación de la respuesta a antígenos comunes y serología para HIV.
Evaluación complementaria
Función pulmonar
La evaluación de la función pulmonar es mandatoria en pacientes con sospecha de asma grave. La falla en demostrar obstrucción bronquial reversible debe orientar a otros diagnósticos. Se evaluará la limitación al flujo aéreo mediante espirometría con prueba broncodilatadora. En la actualidad, ya se están efectuando espirometrías en niños de 3 a 5 años.
La reducción de la función pulmonar es esperable en niños con diagnóstico de asma grave. Sin embargo, a diferencia de lo que sucede en adultos, los niños con asma grave pueden tener una función pulmonar menos comprometida. La espirometría puede ser normal cuando están asintomáticos. Debido a que el VEF1 puede no mostrar cambios, se aconseja la evaluación de los flujos medios luego de la administración de broncodilatadores (FEF25-75%, FEF50% o VEF1/capacidad vital forzada) que reflejan más sensiblemente la obstrucción bronquial.
La evaluación de la respuesta broncodilatadora puede ser utilizada como una herramienta más en el diagnóstico para definir limitación persistente de la vía aérea. La evaluación de los volúmenes pulmonares con pletismografía y la capacidad de difusión del monóxido de carbono se indican para descartar otros diagnósticos.
Hiperreactividad bronquial: pruebas de broncoprovocación
Las pruebas de broncoprovocación, especialmente la evaluación de la limitación del flujo aéreo desencadenada por ejercicio (si las condiciones del paciente lo permiten), deben ser parte de la evaluación en asma grave. Estos estudios orientan hacia un correcto diagnóstico ya que el incremento de la hiperreactividad bronquial en el asma grave es particularmente relevante.
Se pueden utilizar métodos indirectos (bajo estricto control médico) como la broncoprovocación por ejercicio, aire frio o manitol inhalados, o directos con metacolina inhalada.
Estado atópico
La evaluación del estado atópico está indicada en pacientes con asma grave. El método inicial recomendado para evaluar sensibilización a alergenos son los test cutáneos por el método del Prick. Ante resultados discordantes, se impone la realización de los test de diagnóstico in vitro como RAST (Radioallergosorbent test) para determinación de IgE específica.
Enfermedad de la vía aérea superior
Siempre debe evaluarse la enfermedad de vías aéreas superiores en los niños con asma de difícil control. El interrogatorio dirigido a los síntomas cardinales de la rinitis y la rinoscopia anterior debe ser parte de la rutina exploratoria. Si la sintomatología indica la sospecha de sinusopatías, también deben solicitarse tomografías de senos paranasales para evaluar compromiso sinusal. La interconsulta con otorrinolaringólogo se impone ante dudas diagnósticas o la sospecha de otras enfermedades asociadas, como la poliposis nasal.
Tomografía de tórax
La tomografía no es un estudio de rutina para el diagnóstico de pacientes con asma grave y debe ser solicitada cuando existan dudas acerca del diagnóstico o deba descartarse una lesión concomitante (por ejemplo, bronquiectasias) 16.
Marcadores de inflamación
Los diferentes marcadores de inflamación aún no han sido implementados formalmente para definir asma grave. Sin embargo, aportan datos que son de utilidad para un correcto diagnóstico. Entre ellos se incluyen:
Fracción espirada de Óxido Nítrico (FeNO)
Evalúa indirectamente la magnitud de la inflamación eosinofílica de la vía aérea. Es muy útil en un paciente sin tratamiento con corticoides inhalados ya que, al igual que el esputo inducido, tiene un alto valor predictivo negativo. Una FeNO elevada orienta al diagnóstico de asma aunque no lo confirma. En niños bajo tratamiento con corticoides, una FeNO alta orienta hacia una mala adherencia al tratamiento, aun cuando se hayan prescripto dosis adecuadas de esteroides inhalados.
Esputo inducido
Este estudio evalúa directamente la inflamación de la vía aérea. Las muestras se obtienen luego de una nebulización con solución salina hipertónica. Se han descripto cuatro patrones inflamatorios: eosinofílico, neutrofílico, mixto o paucicelular según la cantidad de células observadas. En niños, especialmente en pre-escolares, la dificultad en la obtención del material y la falta de reproducibilidad del estudio limita su utilidad clínica, tanto para el diagnóstico como para el seguimiento de pacientes con asma grave.
Aire espirado
El análisis del aire espirado evalúa biomarcadores que guardan correlación con la inflamación. Se ha descripto que el 8-isoprostano es elevado en niños con asma grave. Estos biomarcadores no han sido aún validados en este grupo etario.
Endoscopia respiratoria
Se sugiere efectuar una endoscopía cuando el diagnóstico de asma grave es dudoso o para descartar anomalías estructurales de la vía aérea.
Evaluación de la respuesta a corticoides
La evaluación de la respuesta a los corticoides permite confirmar el diagnóstico de asma grave y medir la capacidad de respuesta del paciente a este tratamiento. Se sugiere administrar 1 mg/kg/día de prednisolona (dosis máxima 60 mg/día) durante 2 semanas y evaluar antes y después la calidad de vida mediante cuestionarios validados (ACT, ACQ)17, 18, la función pulmonar y los marcadores de la inflamación. Una respuesta completa a los corticoides es considerada si se observa mejoría en el cuestionario de calidad de vida, uso de broncodilatadores menos de tres veces por semana, normalización o aumento de más del 20% del VEF1 pre-broncodilatador y, si se pudo evaluar inflamación, celularidad en el esputo inducido y FeNO normales. La falta de respuesta en estos parámetros deberá considerarse respuesta negativa a los corticoides19.
DC: Comorbilidades
A diferencia de lo que ocurre en los adultos, existe poca evidencia disponible sobre el impacto que producen las comorbilidades en el asma de difícil control en edad pediátrica. Sin embargo, deben tenerse en cuenta cuando los síntomas respiratorios persisten a pesar de un tratamiento adecuado. Además siempre deben evaluarse la técnica de administración de la medicación y el cumplimiento del tratamiento de acuerdo a las indicaciones médicas20.
Atopía
El riesgo de tener asma grave aumenta con los niveles altos de Inmunoglobulina E (IgE) y con la existencia de sensibilidades múltiples. Paralelamente, existen asmas graves con IgE dentro de rangos normales y se necesitan más estudio para determinar con precisión los diversos factores de riesgo que contribuyen al desarrollo de asmas graves21.
Los casos de asma fatal se asocian frecuentemente con alergia severa a alimentos, principalmente maní, pero también con la exposición a aeroalergenos como caspa de animales y hongos22. También existen evidencias que los altos niveles de alergeno de gato, perro y ácaros del polvo doméstico podrían empeorar el asma aun en pacientes no sensibilizados23, 24.
Con relación a la utilidad de la implementación de medidas de evitación de ácaros del polvo doméstico, hongos, mascotas hogareñas, la literatura es controversial25-28. Sin embargo, la exposición a pequeñas cantidades de alergeno podría facilitar la aparición de resistencia a esteroides por un mecanismo dependiente de la interleukina (IL)2 e IL429. Por otro lado, la combinación de infección viral en pacientes con sensibilización a alergenos y altos niveles de exposición son predictivos de la exacerbación del asma. Hay suficiente evidencia para recomendar medidas de evitación de aeroalergenos cuando sea posible en niños sensibilizados con asma grave30.
Rinitis alérgica y rinosinusitis
La prevalencia de la rinitis alérgica en los niños con asma es mayor que en la población general, alcanzando en algunos estudios a cifras entre el 60 y el 80%. En los niños que sufren asma particularmente grave, esta prevalencia es muy manifiesta pues la gran mayoría de ellos también padece rinitis empeorando la evolución del asma31. A tal punto esto es así que los niños con ambas enfermedades tienen mayor utilización de recursos de salud, más visitas a emergencias y más internaciones con incremento de los costos32. La frecuente coexistencia de ambas condiciones se debe a que existen entre ellas similitudes anatómicas, fisiológicas e inmunopatológicas. El uso de corticoides intranasales en niños con rinitis alérgica demostró mejorar los síntomas como prurito nasal, estornudos, rinorrea y congestión. Es razonable concluir que el tratamiento de la rinitis concomitante con el asma mejore estos síntomas. Sin embargo, no hay suficiente evidencia para concluir que tratar la rinitis mejora el control del asma33.
Alergia alimentaria
El asma y la alergia alimentaria son enfermedades que pueden coexistir. Sin embargo, el asma como única manifestación de alergia alimentaria es rara. La incidencia de reacciones respiratorias inducidas por alimentos se estimó entre el 2 y el 8% de los niños y los adultos con asma34.
Se demostró que los pacientes con asma tienen reacciones contra alergenos alimentarios más severas que los pacientes sin asma (33% versus 21%; p < 0.0001)35, incluso reacciones fatales o casi fatales36.
Obesidad
En los últimos años, la obesidad se ha convertido en un serio problema del área de la salud pública. Las posibles causas de ello podrían ser una disminución de la actividad física, un incremento del estilo de vida sedentaria, el aumento en el tamaño de las porciones de los alimentos y el consumo de comidas hipercalóricas37.
El efecto que produce la obesidad en el asma incluye una reducción en el volumen pulmonar y corriente que promueven un estrechamiento de la vía aérea, un bajo grado permanente de inflamación, cambios hormonales, dislipemias, reflujo gastroesofágico, apneas del sueño e hipertensión arterial.
Varios estudios muestran mayores tasas de asma en niños con sobrepeso que en aquellos que no lo tienen. El índice de masa corporal (IMC) elevado a la edad de 1 y 2 años se asoció con una mayor prevalencia de síntomas de asma a los 3 años (OR 1.40 (95%CI, 1.12-1.73); p = 0.003) y el IMC elevado a los 3-5 años se asoció significativamente con una mayor prevalencia de síntomas de asma a los 6 años (OR1.36 (95%CI, 1.03-1.79); p = 0.03)38.
Reflujo gastroesofágico
La prevalencia de reflujo gastroesofágico (RGE) en niños no ha sido suficientemente estudiada. Una revisión sistemática de la prevalencia de RGE en niños con asma demostró rangos entre el 19.3% y el 65%39.
A pesar de que el asma y el RGE en niños parecen estar asociados, aún no está bien establecida la relación causal. No se sabe ciertamente si el asma produce reflujo, si el reflujo produce asma o si no existe relación clínicamente relevante entre ellos.
Gustafsson demostró que ocurría disfunción esofágica más frecuentemente en pacientes asmáticos entre los 8 y los19 años de edad que en los controles (60% versus 14%; p: 0.01), y encontró reflujo ácido en el 50% de estos adolescentes asmáticos40, 41.
Disfunción de cuerdas vocales
Este síndrome se caracteriza por la aducción paradojal de las cuerdas vocales durante la inspiración. Se produce con mayor frecuencia en adolescentes y suele estar relacionado con trastornos emocionales y psicológicos42. Puede aparecer espontáneamente o asociado con el ejercicio. La prevalencia en niños es incierta y debería ser evaluada su comorbilidad en niños con asma grave.
Afecciones mentales
Se ha descripto que el 16.3% de los niños con asma tienen criterios de ansiedad o depresión según el Diagnostic and Statistical Manual of Mental Disorders (DSM)-IV, en los 12 meses previos a la evaluación comparado con 8.6% sin asma (p < 0.01). Estas afecciones pueden favorecer la sobreestimación o la subestimación de los síntomas y favorecer el mal control del asma. A los pacientes con desórdenes psicológicos también se les hace difícil seguir las indicaciones médicas.
Se ha observado que las afecciones psicológicas son frecuentes en niños y adultos que posteriormente han muerto por asma43, 44.
ADC: estrategias terapéuticas
Es escaso el número de publicaciones con referencia al tratamiento del ADC en niños y adolescentes; por ende, gran parte de las sugerencias de manejo y tratamiento propuestas en la mayoría de los consensos para este grupo etario son el resultado de la extrapolación de estudios realizados en poblaciones de adultos.
Debido a las dificultades existentes para establecer criterios de diagnóstico de asma de difícil control en lactantes y preescolares, sumado al hecho que la prescripción de la mayoría de los fármacos sugeridos para el tratamiento del asma grave no están autorizados por autoridades como la FDA o el ANMAT para este grupo de edad, las estrategias terapéuticas sugeridas en este capítulo se referirán exclusivamente a niños mayores de 5 años de edad.
Se estima que en un importante porcentaje de casos inicialmente clasificados como ADC puede reclasificarse el grado de gravedad mediante una optimización diagnóstica y terapéutica logrando controlar la enfermedad con un tratamiento convencional de máxima intensidad con corticoides (CTC) inhalados a altas dosis, broncodilatadores de acción prolongada y/o antileucotrienos como se sugiere para el cuarto escalón de la clasificación del GINA45 (Fig. 1) o nivel 4 o 5 del NAEPP46.
Para optimizar el tratamiento se requiere confirmar la correcta prescripción de los agentes terapéuticos, el cumplimiento real de las medicaciones impartidas en el hogar incluyendo el control regular del funcionamiento de los dispositivos utilizados para la administración de la medicación inhalatoria así como la observación directa y periódica de la técnica aplicada por los familiares al niño o realizada directamente por el paciente. Múltiples estudios47, 48 han mostrado que los errores de administración son causa muy frecuente de falla terapéutica sobrevalorando la gravedad de la enfermedad. Una reciente publicación enfatiza realizar visitas domiciliarias para evaluar in situ pautas de cumplimiento, funcionamiento familiar y de control ambiental49.
En este grupo de pacientes, la interrupción brusca y total de la medicación del verano es otro de los motivos que generan falta de control de la enfermedad, que se traduce en exacerbaciones potencialmente graves.
Hay acuerdo en que es necesario, previo a la utilización de terapéuticas costosas o alternativas, re-evaluar meticulosamente el diagnóstico, las comorbilidades y la calidad de los tratamientos previamente impartidos.
Sabiendo que el asma no controlada puede generar riesgo de exacerbaciones graves o muerte, y que pueden existir morbilidad crónica, afección del crecimiento, limitación de la función pulmonar y reacciones adversas a la medicación, es imperioso identificar estos pacientes para implementar un adecuado tratamiento y estricto seguimiento.
En el "asma grave resistente al tratamiento", cuando persisten la gravedad y las dificultades para lograr el control a pesar del uso de las más altas dosis de medicamentos disponibles, incluyendo el uso diario de esteroides orales, o que solo puede controlarse con el máximo nivel de terapia para el asma con un riesgo inaceptable de existencia de efectos adversos, se considerará la necesidad de definir con claridad el fenotipo y evaluar otras alternativas farmacológicas que se describirán posteriormente. De lo arriba expuesto surge que la primera necesidad antes de formular recomendaciones terapéuticas es cerciorarse que el paciente pertenezca al último grupo.
En la Tabla 2 se define cómo realizar la evaluación de la respuesta a los corticoides y se resume en función de cada parámetro o campo (clínico, funcional e inflamatorio) el tipo o nivel de respuesta requerida para determinar si el paciente responde o no a la medicación esteroidea. Si se normalizan los cuatro parámetros, se lo clasificará como "respondedor", si mejoran solo 1 o 2 campos será un "respondedor parcial" y si no se logra respuesta alguna en ninguno de los 4 campos, "no respondedor".
TABLA 2.- Cómo evaluar la respuesta a los esteroides en asma grave

FeNO (Fractional exhaled nitric oxide): Fracción espiratoria de óxido nítrico.
Una vez agotadas todas las instancias para maximizar la eficacia de la terapéutica, tratadas las co-morbilidades, evaluado e intervenido sobre factores alérgicos, psicosociales y ambientales con erradicación del tabaquismo activo o pasivo y verificada la correcta administración y cumplimiento de las indicaciones médicas, se podrá considerar el diagnóstico de ACD y se plantea el desafío de definir otras alternativas farmacológicas.
Para este grupo se han postulado una serie de intervenciones farmacológicas alternativas cuya eficacia y evidencias resumimos en la Tabla 3.
TABLA 3.- Fármacos utilizados para el manejo terapéutico del ADC y sus evidencias

Recientemente fue incluido en las pautas de tratamiento de GINA para pacientes con asma grave en el 5° escalón, como estrategia de manejo, la adición de glucocorticoides orales o de omalizumab. Es sabido que si bien la indicación de los corticoides orales puede ser efectiva, se asocia a graves efectos indeseables. La adición de omalizumab es la única intervención terapéutica que ha demostrado mejorar el control del asma alérgico grave que no respondió a un tratamiento combinado con corticoides inhalatorios a dosis elevadas, previo a la utilización de corticoides sistémicos o corticoides orales combinado con otros controladores.
La última versión del National Asthma Education and Prevention Program (NAEPP) plantea una estrategia diferente. Divide el abordaje del tratamiento en seis niveles y recomienda omalizumab como terapia adicional en el nivel 5 en pacientes con asma alérgica grave no controlada causada por alérgenos perennes. El programa indica corticoides orales, como terapia adicional, recién en el nivel 6.
El omalizumab es un anticuerpo monoclonal anti-IgE compuesto en un 95% por un soporte de IgG1 humana, se une a la IgE libre circulante evitando que ésta se una a los receptores de alta afinidad en los mastocitos, con lo cual previene su degranulación.
Se logra la disminución de las concentraciones de IgE de 90 a 99%. Asimismo, este fármaco disminuye la expresión de los receptores de IgE (FCεRI) en mastocitos y basófilos50.
Los mecanismos de acción para la producción de estos efectos clínicos son los siguientes: Reducción de los siguientes factores, la IgE circulante, la densidad de receptores de IgE (FcεRI), la activación de mastocitos y basófilos, reducción de la presentación de antígenos facilitada por IgE por las células dendríticas, de los mediadores pro-inflamatorios y de moléculas de adhesión como ICAM-1 y de la síntesis de IgE hacia niveles no atópicos51-55.
La mayoría de los estudios clínicos56, 57 se llevaron a cabo en pacientes con asma grave parcialmente controlada a pesar de un tratamiento preventivo basado en altas dosis de corticoides inhalados asociados o no a otros controladores (LABAS, antileucotrienos) agregándoseles, en forma aleatorizada y doble ciego, omalizumab o placebo
La eficacia clínica del omalizumab se demostró sobre la base de variables como reducción del número de exacerbaciones, hospitalizaciones y visitas no programadas, disminución en el uso de medicamentos de rescate y requerimiento de los corticoides orales y en el progresivo descenso de las dosis de corticoides inhalados necesarias para lograr mantener un adecuado control de la enfermedad. En los adultos, aproximadamente el 77% de los pacientes que recibieron omalizumab logró disminuir el consumo de los corticosteroides inhalados en al menos un 50%, mientras que el 41% prescindió de ellos por completo. Esta reducción es estadísticamente significativa en comparación con los que recibieron placebo58, 59. El impacto en la función pulmonar es variable, algunos estudios en adultos han demostrado cierta mejoría comparados con el grupo de control.
En pacientes con historia reciente de hospitalizaciones, ingresos en unidades de terapia intensiva o asistencia respiratoria mecánica, el omalizumab aportó una mejoría significativa en la frecuencia y gravedad de las exacerbaciones, pruebas de función pulmonar y calidad de vida60.
Otro cambio consistentemente favorable es el cuantificado en cuestionarios de calidad de vida tanto para el asma como para la rinitis56, 61.
En el estudio SOLAR62 se demostró que el tratamiento con omalizumab contribuyó significativamente a la mejoría clínica tanto de los síntomas del asma como de la rinitis alérgica.
Las únicas evidencias de intervención farmacológica en asma grave en gran número de niños y adolescentes se han llevado a cabo con omalizumab como tratamiento adicional a esteroides inhalados solos o asociados a otros controladores63-65, corroborando su eficacia y seguridad. Al igual que los estudios en adultos se registró en este grupo etario una disminución significativa del número de hospitalizaciones, exacerbaciones, visitas a la sala de emergencias y consultas no programadas, dosis de esteroides inhalatorios y mejor calidad de vida63, 66, 67. Una reciente publicación68 analiza la eficacia y seguridad del omalizumab aplicado por vía subcutánea versus placebo en participantes de 8 estudios clínicos que incluyen 3,429 niños y adultos con asma tratados con CTC inhalados. La frecuencia de eventos adversos serios fue similar para ambos grupos (3.8% para omalizumab vs. 5.3% para placebo).
Existen por su aplicación raros casos de anafilaxia observados, que sería causada por sensibilización. De todos modos se recomienda mantener a los pacientes bajo supervisión por un período de al menos 2 horas y que reciban instrucción sobre el uso de epinefrina para manejo de la anafilaxia.
Los criterios para seleccionar adecuadamente a los candidatos a recibir esta medicación se describen en la Tabla 4. Se debe tener en cuenta que se trata de una terapéutica de adición para mejorar el control del asma en niños mayores de 6 años de edad.
TABLA 4.- Criterios para la indicación de omalizumab

Omalizumab se administra por vía subcutánea; la dosis depende de las concentraciones de IgE total dosificada previo al inicio del tratamiento y del peso del paciente.
Desde noviembre del 2009 el ANMAT aprobó el uso del omalizumab para el tratamiento del asma alérgica moderada o grave en pacientes adultos y niños (de 6 años en adelante) cuyos síntomas no sean adecuadamente controlados con corticoides inhalados. Una dificultad en la aplicación de las guías para el manejo del asma en la práctica clínica es la disponibilidad y acceso a la medicación, especialmente en países en vías de desarrollo. Estudios de costo eficiencia69, 70 han demostrado que los costos generados por hospitalizaciones frecuentes, visitas a emergencia y ausentismo laboral se reducen sensiblemente mediante las estrategias farmacológicas y no farmacológicas que logren el control de la enfermedad. La participación de los Ministerios de Salud Pública y Seguridad Social resulta imprescindible para resolver esta situación.
En conclusión, el asma es una de las enfermedades crónicas más frecuentes en los niños. Dada su elevada prevalencia y su alta morbilidad, resulta de fundamental importancia implementar en su manejo todas las evidencias actuales con relación a su diagnóstico, la utilización de estudios complementarios, las herramientas para evaluar el control y el abordaje del tratamiento escalonado, incluyendo todas las alternativas terapéuticas disponibles.
Agradecimientos: A la Dra. Marina Romano por la colaboración en la redacción del manuscrito.
Conflictos de interés: Se contó con un subsidio de investigación otorgado por el Laboratorio Novartis Argentina para la elaboración del presente trabajo de revisión.
1. Sívori ML, Sáenz CB, Riva Posse C. Mortalilidad por asma y enfermedad pulmonar obstructiva crónica en Argentina en el período1980-1998. Medicina (B Aires) 2001; 61: 513-21. [ Links ]
2. Lang A, Carlsen KH, Haaland G, et al. Severe asthma in childhood: assessed in 10 year olds in a birth cohort study. Allergy 2008; 63: 1054-60. [ Links ]
3. Pearce N, Ait-Khaled N, Beasley R, et al. Worldwide trends in the prevalence of asthma symptoms: phase III of the International Study of Asthma and Allergies in Childhood (ISAAC). Thorax 2007; 62: 758-66. [ Links ]
4. Neffen H, Fritscher C, Schacht FC, et al. Asthma control in Latin America: the Asthma Insights and Reality in Latin America (AIRLA) survey. Rev Panam Salud Publica 2005; 17: 191-7. [ Links ]
5. Bousquet J, Mantzouranis E, Cruz AA, et al. Uniform definition of asthma severity, control, and exacerbations: document presented for the World Health Organization Consultation on Severe Asthma. J Allergy Clin Immunol 2010; 126: 926-38. [ Links ]
6. Brand PL, Baraldi E, Bisgaard H, et al. Definition, assessment and treatment of wheezing disorders in preschool children: an evidence-based approach. Eur Respir J 2008; 32: 1096-110. [ Links ]
7. Marcone DN, Ricarte C, Videla C, et al. Rinovirus. Frecuencia en niños con infección respiratoria aguda, no internados. Medicina (B Aires) 2012; 72: 28-32. [ Links ]
8. Taylor DR, Bateman ED, Boulet LP, et al. A new perspective on concepts of asthma severity and control. Eur Respir J 2008; 32: 545-54. [ Links ]
9. Barton CA, McKenzie DP, Walters EH, Abramson MJ. Interactions between psychosocial problems and management of asthma: who is at risk of dying? J Asthma 2005; 42: 249-56. [ Links ]
10. Fleming L, Wilson N, Regamey N, Bush A. Are inflammatory phenotypes in children with severe asthma stable? Eur Respir J 2007; 30: 483S. [ Links ]
11. Mauad T, Poon AH, Hamid Q. Pathology, inflammation and cytokines of severe asthma. Eur Respir Mon 2011; 51: 97-106. [ Links ]
12. Navarro Merino M, Andrés Martín A, Asensio de la Cruz O, García García ML, Liñán Cortes S, Villa Asensi JR. Guía de diagnóstico y tratamiento del asma de difícil control en niños. An Pediatr (Barc) 2009; 71: 548-67. [ Links ]
13. Bush A. Frey U and Teague W. Difficult-to-Treat Severe Asthma Edited by K.F. Chung, E.H. Bel, and S.E. Wenzel. European Respiratory Society Monograph. 2011; 51: 59-81. En: http://erm.ersjournals.com/content/ermdta/1/SEC8.abstract; consultado el 15/7/2012.
14. Konradsen JR, Nordlund B, Lidegran M, et al. Problematic severe asthma: a proposed approach to identifying children who are severely resistant to therapy. Pediatr Allergy Immunol 2011; 22: 9-18. [ Links ]
15. Lodrup Carlsen KC, Hedlin G, Bush A, et al. Assessment of problematic severe asthma in children. Eur Respir J 2011; 37: 432-40. [ Links ]
16. Saglani S, Papaioannou G, Khoo L, et al. Can HRCT be used as a marker of airway remodelling in children with difficult asthma? Respir Res 2006; 7: 46. [ Links ]
17. Liu AH, Zeiger R, Sorkness C, et al. Development and cross-sectional validation of the Childhood Asthma Control Test. J Allergy Clin Immunol 2007; 119: 817-25. [ Links ]
18. Juniper EF, O'Byrne PM, Guyatt GH, Ferrie PJ, King DR. Development and validation of a questionnaire to measure asthma control. Eur Respir J 1999; 14: 902-7. [ Links ]
19. Bossley CJ, Saglani S, Kavanagh C, et al. Corticosteroid responsiveness and clinical characteristics in childhood difficult asthma. Eur Respir J 2009; 34: 1052-9. [ Links ]
20. British Thoracic Society, Scottish Intercollegiate Guidelines Network, British Guideline on the Management of Asthma. Thorax 2008; 63: Suppl. 4, iv1-iv121. [ Links ]
21. Roncoroni AJ. Relación entre asma, atopía, IgE e hiperreactividad bronquial. Medicina (B Aires) 1998; 58: 243-6. [ Links ]
22. Denning DW, O'Driscoll BR, Hogaboam CM, Bowyer P, Niven RM. The link between fungi and severe asthma: a summary of the evidence. Eur Respir J 2006; 27: 615-26. [ Links ]
23. Langley SJ, Goldthorpe S, Craven M, Woodcock A, Custovic A. Relationship between exposure to domestic allergens and bronchial hyperresponsiveness in non-sensitised, atopic asthmatic subjects. Thorax 2005; 60: 17-21. [ Links ]
24. Chinn S, Heinrich J, Anto JM, et al. Bronchial responsiveness in atopic adults increases with exposure to cat allergen. Am J Respir Crit Care Med 2007; 176: 20-6. [ Links ]
25. Bush RK. Indoor allergens, environmental avoidance, and allergic respiratory disease. Allergy Asthma Proc 2008; 29: 575-9. [ Links ]
26. Gotzsche PC, Johansen HK. House dust mite control measures for asthma: systematic review. Allergy 2008; 63: 646-59. [ Links ]
27. de Vries MP, van den Bemt L, Aretz K, et al. House dust mite allergen avoidance and self-management in allergic patients with asthma: randomised controlled trial. Br J Gen Pract 2007; 57: 184-90. [ Links ]
28. van den Bemt L, de Vries MP, Cloosterman S, et al. Influence of house dust mite impermeable covers on health-related quality of life of adult patients with asthma: results of a randomized clinical trial. J Asthma 2007; 44: 843-8. [ Links ]
29. McKinley L, Alcorn JF, Peterson A, et al. TH17 cells mediate steroid-resistant airway inflammation and airway hyperresponsiveness in mice. J Immunol 2008; 181: 4089-97. [ Links ]
30. De Boeck K, Moens M, Van Der Aa N, Meersman A, Schuddinck L, Proesmans M. 'Difficult asthma': can symptoms be controlled in a structured environment? Pediatr Pulmonol 2009; 44: 743-8. [ Links ]
31. Hamouda S, Karila C, Connault T, Scheinmann P, de Blic J. Allergic rhinitis in children with asthma: a questionnaire-based study. Clin Exp Allergy 2008; 38: 761-6. [ Links ]
32. Kang HY, Park CS, Bang HR, Sazonov V, Kim CJ. Effect of allergic rhinitis on the use and cost of health services by children with asthma. Yonsei Med J 2008; 49: 521-9. [ Links ]
33. Taramarcaz P, Gibson PG. Intranasal corticosteroids for asthma control in people with coexisting asthma and rhinitis. Cochrane Database Syst Rev 2003; 4: CD003570. [ Links ]
34. James JM. Respiratory manifestations of food allergy. Pediatrics 2003; 111: 1625-30. [ Links ]
35. Sicherer SH, Furlong TJ, Munoz-Furlong A, Burks AW, Sampson HA. A voluntary registry for peanut and tree nut allergy: characteristics of the first 5149 registrants. J Allergy Clin Immunol 2001; 108: 128-32. [ Links ]
36. de Groot EP, Duiverman EJ, Brand PL. Comorbidities of asthma during childhood: possibly important, yet poorly studied. Eur Respir J 2010; 36: 671-8. [ Links ]
37. Kopel SJ, Klein RB. Childhood asthma and obesity. Med Health R I 2008; 91: 161-4. [ Links ]
38. Scholtens S, Wijga AH, Seidell JC, et al. Overweight and changes in weight status during childhood in relation to asthma symptoms at 8 years of age. J Allergy Clin Immunol 2009; 123:1312-8 e2. [ Links ]
39. Tolia V, Vandenplas Y. Systematic review: the extra-oesophageal symptoms of gastro-oesophageal reflux disease in children. Aliment Pharmacol Ther 2009; 29: 258-72. [ Links ]
40. Gustafsson PM, Kjellman NI, Tibbling L. Oesophageal function and symptoms in moderate and severe asthma. Acta Paediatr Scand 1986; 75: 729-36. [ Links ]
41. Gustafsson PM, Kjellman NI, Tibbling L. Bronchial asthma and acid reflux into the distal and proximal oesophagus. Arch Dis Child 1990; 65: 1255-8. [ Links ]
42. Kenn K, Balkissoon R. Vocal cord dysfunction: what do we know? Eur Respir J 2011; 37: 194-200. [ Links ]
43. Strunk RC, Mrazek DA, Fuhrmann GS, LaBrecque JF. Physiologic and psychological characteristics associated with deaths due to asthma in childhood. A case-controlled study. JAMA 1985; 254: 1193-8. [ Links ]
44. Bergstrom SE, Boman G, Eriksson L, et al. Asthma mortality among Swedish children and young adults, a 10-year study. Respir Med 2008; 102: 1335-41. [ Links ]
45. Global Initiative for Asthma. Global Strategy for Asthma Management and Prevention. Updated 2009. Gig Harbor WA. Medical Communications Resources, Inc., 2009. [ Links ]
46. National Asthma Education and Prevention Program. Expert Panel Report 3 (EPR-3): Guidelines for the Diagnosis and Management of Asthma - Summary Report 2007. J Allergy Clin Immunol 2007; 120:S94-S138. [ Links ]
47. Giraud V, Roche N. Misuse of corticosteroid metered-dose inhaler is associated with decreased asthma stability. Eur Respir J 2002; 19: 246-51. [ Links ]
48. Thompson J, Irvine T, Grathwohl K, Roth B. Misuse of metered-dose inhalers in hospitalized patients. Chest 1994; 105: 715-7. [ Links ]
49. Bracken M, Fleming L, Hall P, et al. The importance of nurse-led home visits in the assessment of children with problematic asthma. Arch Dis Child 2009; 94: 780-4. [ Links ]
50. Holgate ST, Djukanovic R, Casale T, Bousquet J. Anti-immunoglobulin E treatment with omalizumab in allergic diseases: an update on anti-inflammatory activity and clinical efficacy. Clin Exp Allergy 2005; 35: 408-16. [ Links ]
51. Chand HS, Schuyler M, Joste N, et al. Anti-IgE therapy results in decreased myeloid dendritic cells in asthmatic airways. J Allergy Clin Immunol 2010; 125: 1157-8 e5. [ Links ]
52. Oliver JM, Tarleton CA, Gilmartin L, et al. Reduced FcepsilonRI- mediated release of asthma-promoting cytokines and chemokines from human basophils during omalizumab therapy. Int Arch Allergy Immunol 2009; 151: 275-84. [ Links ]
53. Kraft S, Kinet JP. New developments in FcepsilonRI regulation, function and inhibition. Nat Rev Immunol 2007; 7: 365-78. [ Links ]
54. Gould HJ, Sutton BJ. IgE in allergy and asthma today. Nat Rev Immunol 2008; 8: 205-17. [ Links ]
55. Schroeder JT, Bieneman AP, Chichester KL, et al. Decreases in human dendritic cell-dependent T(H)2-like responses after acute in vivo IgE neutralization. J Allergy Clin Immunol 2010; 125: 896-901 e6. [ Links ]
56. Humbert M, Beasley R, Ayres J, et al. Benefits of omalizumab as add-on therapy in patients with severe persistent asthma who are inadequately controlled despite best available therapy (GINA 2002 step 4 treatment): INNOVATE. Allergy 2005; 60: 309-16. [ Links ]
57. Holgate ST, Chuchalin AG, Hebert J, et al. Efficacy and safety of a recombinant anti-immunoglobulin E antibody (omalizumab) in severe allergic asthma. Clin Exp Allergy 2004; 34: 632-8. [ Links ]
58. Walker S, Monteil M, Phelan K. et al. Anti-IgE for chronic asthma in adults and children. Cochrane Database Syst Rev 2006; Apr 19. (2): CD003559. [ Links ]
59. Bousquet J, Cabrera P, Berkman N, et al. The effect of treatment with omalizumab, an anti-IgE antibody, on asthma exacerbations and emergency medical visits in patients with severe persistent asthma. Allergy 2005; 60: 302-8. [ Links ]
60. Holgate S, Bousquet J, Wenzel S, Fox H, Liu J, Castellsague J. Efficacy of omalizumab, an anti-immunoglobulin E antibody, in patients with allergic asthma at high risk of serious asthma-related morbidity and mortality. Curr Med Res Opin 2001; 17: 233-40. [ Links ]
61. Busse W, Fox H, Surrey K, et al. Relevant improvements in asthma related quality of life in patients receiving omalizumab as add-on therapy. J Allergy Clin Immunol 2006; 117: S8. [ Links ]
62. Vignola AM, Humbert M, Bousquet J, et al. Efficacy and tolerability of anti-immunoglobulin E therapy with omalizumab in patients with concomitant allergic asthma and persistent allergic rhinitis: SOLAR. Allergy 2004; 59: 709-17. [ Links ]
63. Milgrom H, Berger W; Nayak A, et al. Treatment of Childhood Asthma With Anti Immunoglobulin E Antibody (Omalizumab) Pediatrics 2001; 108:2: e36-46. [ Links ]
64. Lanier B, Bridges T, Kulus M, Taylor AF, Berhane I, Vidaurre CF. Omalizumab for the treatment of exacerbations in children with inadequately controlled allergic (IgE-mediated) asthma. J Allergy Clin Immunol 2009; 124: 1210-6. [ Links ]
65. Kulus M, Hebert J, Garcia E, Fowler Taylor A, Fernandez Vidaurre C, Blogg M. Omalizumab in children with inadequately controlled severe allergic (IgE-mediated) asthma. Curr Med Res Opin 2010; 26: 1285-93. [ Links ]
66. Fried AJ, Oettgen HC. Anti-IgE in the treatment of allergic disorders in pediatrics. Curr Opin Pediatr 2010; 22: 758-64. [ Links ]
67. Ayres JG, Higgins B, Chilvers ER, Ayre G, Blogg M, Fox H. Efficacy and tolerability of anti-immunoglobulin E therapy with omalizumab in patients with poorly controlled (moderate-to-severe) allergic asthma. Allergy 2004; 59: 701-8. [ Links ]
68. Rodrigo GJ, Neffen H, Castro-Rodriguez JA. Efficacy and safety of subcutaneous omalizumab vs placebo as addon therapy to corticosteroids for children and adults with asthma: a systematic review. Chest 2011; 139: 28-35. [ Links ]
69. Sullivan SD, Weiss KB, Lynn H, et al. The cost-effectiveness of an inner-city asthma intervention for children. J Allergy Clin Immunol 2002; 110: 576-81. [ Links ]
70. Gold MR, Siegel JE, Russell LB, Weinstein MC, editors. Cost-effectiveness in health and medicine. New York: Oxford University Press, 1996. [ Links ]
Recibido: 9-1-2012
Aceptado: 30-7-2012
ARTÍCULO ESPECIAL
Organización y financiamiento del sistema de salud en la Argentina
Hugo E. Arce
Departamento de Salud Pública, Instituto Universitario de Ciencias de la Salud, Fundación Barceló, Buenos Aires
Dirección postal: Dr. Hugo Arce, Paraguay 631 6° B, 1057 Buenos Aires, Argentina
e-mail: arce@satlink.com
Resumen
El sistema de salud argentino se caracteriza por los siguientes rasgos: a) la organización federal del país, donde las provincias se encargan de administrar salud y educación; b) coexistencia de servicios públicos y privados, tanto ambulatorios como de internación; c) entidades fragmentadas de seguridad social, en su mayoría de origen extra-estatal. Se describen y se calculan los componentes del sistema; se analiza la distribución del poder de decisión entre la autoridad sanitaria nacional y las provinciales y se comparan con la organización de otros países. Se muestran datos estadísticos sobre distribución del gasto en salud y cobertura de servicios en la población. Asimismo se presentan flujos financieros entre las diversas fuentes de recursos, aseguradores, prestadores y los usuarios de cada sector.
Palabras clave: Sistema de salud; Economía de la salud; Modelos de organización sanitaria; Financiamiento de salud
Abstract
The Argentine Health System: Organization and financial features. The Argentine health system is defined by the following features: a) federal country organization; b) coexistence of public and private services with either outpatients or inpatients; c) fragmented entities of social security, most of these originated outside of the state organization. Components of the system are described and weighed; making decisions strength between national and provincial health authorities is analyzed and the Argentine system is compared with that of other countries. Statistical data on distribution of health expenditures and coverage of health services are presented as well as financial flow among diverse funding sources, insurers, providers and users of each sector.
Key words: Health system; Health economics; Health organizational models; Health financing
Los sistemas de salud provienen de dos modelos genéricos: a) los servicios nacionales de salud, en los que los recursos pertenecen al Estado y se financian mediante impuestos generales, y b) los de seguridad social, donde los recursos pueden ser estatales o privados y se financian mediante alícuotas del salario. Desde que fueron creados estos dos modelos prototípicos -la Seguridad Social (SeS) alemana en 1883 y el Servicio Nacional de Salud (SNS) británico en 1948- en todo el mundo se reprodujeron organizaciones sanitarias similares, con rasgos predominantes de uno u otro modelo, pero en general combinando formas mixtas de organización y financiamiento1. En los países de la Commonwealth, Japón y España predominó el modelo de SNS, mientras que en los países de Europa continental y América Latina predominó el modelo de SeS. Un tercer modelo posterior, el de Seguro Nacional de Salud (SegNS), se desarrolló en Canadá y Costa Rica en base a una administración regional, regulada por unúnico ente recaudador. En la actualidad, todas las estructuras sanitarias tienden a formas combinadas, tanto en sus fuentes de financiamiento como en la naturaleza de los prestadores de servicios de salud2.
En América Latina predominaron sistemas pluralistas en los que coexistieron diferentes componentes: a) subsistemas de servicios públicos financiados por el Estado; b) subsistemas de SeS de origen estatal, financiados mediante aportes salariales y dirigidos a trabajadores formales, cuyos prestadores fueron predominantemente privados, y c) subsistemas privados a través de entidades aseguradoras con o sin fines de lucro. Un rasgo determinante en los países latinoamericanos ha sido la permanencia de grandes sectores de la población en circuitos de economía no registrada, por lo que las coberturas de SeS no alcanzaron a estos sectores, a menudo las ¾ partes de los habitantes. Como excepción a este modelo, Chile implementó un SNS similar al británico en 1952, pero a partir de 1980 debió convivir con un subsistema privado de Instituciones de Salud Previsional (ISaPre's). Por otra parte, a diferencia del resto de los países, donde la SeS fue de origen estatal, en Uruguay y Argentina se originó a partir de organizaciones no estatales y fragmentadas, las mutuales de procedencia inmigratoria común.
Organización
El rasgo más relevante del Sistema de Salud de Argentina está determinado en primer lugar por la organización federal del país, de modo que las provincias retienen su autonomía para administrar los servicios de salud y educación. A esta condición estructural debe agregarse la pluralidad de iniciativas y jurisdicciones, así como su persistente fragmentación institucional, que acentúa la dispersión de los centros de decisión. Comparativamente, Brasil también tiene una organización federal y una pluralidad de recursos mayor que la Argentina, pero ha logrado concentrar en un único ente recaudador la administración de los fondos públicos y de la SeS, el Sistema Único de Salud (SUS)3. Por su parte Uruguay, cuya SeS es de origen extra-estatal y fragmentado, logró concentrar los fondos públicos y mutuales en un organismo estatal autárquico equivalente al SUS, denominado Fondo Nacional de Salud (FoNaSa). Algo similar ocurre con Chile, donde los usuarios de las ISaPre's, pese a que aportan a un seguro privado, deben mantener sus contribuciones y dependencia regulatoria de un ente similar al de Uruguay, también denominado FoNaSa4. En la Argentina, la creación de la Administración Nacional de la Seguridad Social (ANSeS) en 1991 logró concentrar la recaudación de todos los aportes y contribuciones de Obras Sociales, Jubilaciones y Subsidios Familiares, pero en lo relativo a Obras Sociales solo actúa como ente distribuidor, sin poder para establecer normas ni regulaciones.
En lo referente a las autoridades sanitarias y la administración de los recursos asistenciales, existe una distribución de facultades decisorias y de regulación entre la Nación y las provincias, cuyo equilibrio les impide concentrar atribuciones suficientes para planificar reformas trascendentes en la gestión global del sistema (Tabla 1)5.
TABLA 1.- Facultades decisorias de las jurisdicciones nacional y provinciales

SSS: Superintendencia de Servicios de Salud.
APE: Administración de Programas Especiales.
INSSJP: Instituto Nacional de Servicios Sociales para Jubilados y Pensionados.
PAMI: Programa de Asistencia Médica Integral del INSSJP.
ANLIS: Administración Nacional de Laboratorios de Investigación en Salud.
ANMAT: Administración Nacional de Medicamentos, Alimentos y Tecnología.
Dentro de los establecimientos públicos, salvo algunas excepciones como los hospitales Garrahan y Posadas, todos los hospitales son administrados por las 24 jurisdicciones provinciales. Existen no obstante otros hospitales dependientes del nivel nacional, pero se encuentran fuera de la cartera de Salud, como los de las Fuerzas Armadas y de Seguridad y los universitarios. Según el último catastro de 2000, el país cuenta con 3311 nosocomios con internación (153 065 camas en total), de los que 1271 son públicos y 2040 privados. Según su tamaño, los públicos promedian 64.4 camas por establecimiento y los privados 34.9, lo que permite suponer una gran cantidad de sanatorios de pequeñas dimensiones e infraestructura precaria. Además, se agregan 14 534 establecimientos ambulatorios, de los que 6 456 son públicos y proveen el 1er nivel de atención, y 8 078 privados, y cuentan con la mayor densidad de recursos tecnológicos de atención ambulatoria6. Pese a que la mayor cantidad de camas pertenece al subsector estatal, en términos de atención médica y facturación, los servicios privados concentran las 2/3 partes del movimiento económico.
La mayor fragmentación se observa en el campo de la SeS. En 2004 se contabilizaban 284 Obras Sociales (OS's) nacionales reguladas por la SSS, de las que 201 se encuadraban como sindicales, 25 de personal de dirección y 58 de otras categorías. Además existen otras OS's que, aunque también son nacionales, están fuera del alcance regulatorio de la SSS: las de las Fuerzas Armadas y de Seguridad, las del personal universitario y las de los Poderes Legislativo y Judicial. También en el nivel nacional debe incluirse a la mayor entidad del país, el PAMI. Por último, deben agregarse 24 OS's provinciales, reguladas por legislaciones locales que, junto con el PAMI, representan entre el 40 y el 70% de la población cubierta en los distintos escenarios provinciales. Este heterogéneo conjunto comparte sus pautas operativas con las entidades gremiales de prestadores -por ejemplo federaciones médicas, asociaciones de clínicas y sanatorios-, que actúan como intermediarias en el circuito administrativo de facturación y cobranzas entre las OS's y los prestadores individuales7.
La población de mayor poder adquisitivo es usuaria de Empresas de Medicina Prepaga (EMP's), ya sea por contratación directa o por tercerización de la cobertura a través de una OS. Este fenómeno se debe a que las OS's delegan la gestión de sus afiliados de más altos ingresos a una EMP, a fin de evitar su migración hacia otras OS's. Desde la sanción de la Ley 26 682 en 2011, la regulación de las EMP's quedó en la órbita de la SSS. La verdadera dimensión de la Medicina Prepaga es un tema controvertido, dado que no existen registros unificados de usuarios en poder de autoridades regulatorias. Además de las empresas más conocidas, existe un conjunto de entidades mutuales, pequeños planes de alcance vecinal, cooperativas, abonos de sanatorios privados o de empresas de emergencias, que duplican la cantidad de población que habitualmente se registra en este subsector. Asimismo debe tenerse en cuenta que una parte significativa de la población cuenta con doble cobertura, lo que complica aún más establecer su tamaño real8.
La población que carece de cobertura, ya sea porque no tiene capacidad contributiva o porque se desenvuelve en la economía informal, es usuaria de los servicios públicos a los que accede en forma gratuita, incluyendo medicamentos básicos. El alcance de los servicios estatales es amplio e incluso son accesibles en barriadas marginales de las ciudades. La principal dificultad se presenta en localidades aisladas, de baja densidad de población, donde debe resolverse prioritariamente el traslado a centros de mayor poder resolutivo. Fuera de los aspectos asistenciales, los organismos estatales administran un conjunto de programas preventivos, que no se limitan a los usuarios de servicios públicos sino que alcanzan a toda la población, como vacunaciones, planes materno-infantiles, prevención de endemias (Chagas, dengue, sida), saneamiento ambiental, educación sanitaria y otros.
Financiamiento
Las dimensiones económicas del Sistema deben explorarse en diferentes fuentes y estimaciones, debido precisamente a la diversidad de actores que conforman el Sector Salud. Una primera aproximación consiste en estimar el gasto global y la participación de cada subsector ejecutando esos recursos (Tabla 2)9. La inequidad del Sistema se refleja en la existencia de un componente importante de gasto de bolsillo del orden del 30%, donde las 2/3 partes corresponde a gastos de farmacia. Del total del gasto público, aproximadamente ¼ parte es ejecutada por la Nación y el resto por las provincias, pero dentro del Estado nacional se distribuye entre diferentes carteras, por lo que el Ministerio de Salud nacional ejecuta menos del 4% del gasto global del Sector.
TABLA 2.- Gasto en salud por jurisdicción en 2010 (en millones de pesos)9

(a) En millones de pesos por año. Paridad en 2010: US$ 1 = $ 3.81 a 3.99.
(b) Incluye Obras Sociales nacionales, provinciales y PAMI
Comparando el gasto de la Argentina con el de otros países latinoamericanos, se observa que tiene el mayor gasto en dólares de la Región (Tabla 3). Sin embargo, la mayor dimensión del gasto no se refleja en mejores resultados sanitarios, ya que al menos Chile, Uruguay y Costa Rica tienen mejores indicadores de morbimortalidad que la Argentina.
TABLA 3.- Gasto en salud por habitante en América Latina (en dólares)11

Un abordaje más profundo requiere considerar al Sistema como un mercado de bienes y servicios, donde diferentes actores gestionan la cobertura de salud a segmentos variables de la población, en base a un conjunto de fondos recaudados por diversas vías. Las estimaciones de este tipo son complejas, ya que deben recabar diferentes fuentes de datos para reconstruir el escenario general. Se presenta la distribución estimada en 2009, de una serie que tiene al menos 10 años de continuidad (Tabla 4). Puede observarse que más del 16% de la población cuenta con doble cobertura. Esta cifra es coincidente con datos de la SSS de 2003, cruzando padrones de beneficiarios de OS's nacionales y provinciales, que mostraban un 15% de afiliados a OS's provinciales con cobertura adicional de una OS nacional10. Por otro lado, el gasto de bolsillo aparece subestimado (21.5%) con respecto al consignado en la Tabla 2.
TABLA 4.- Dimensiones estimadas del mercado de salud en 2009 (en pesos)11
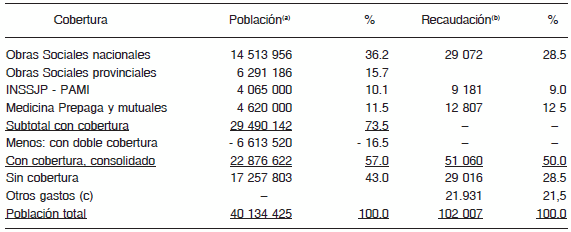
(a)En millones de habitantes, porcentajes agregados.
(b)En millones de pesos por año, porcentajes agregados. Paridad en 2009: US$ 1 = $ 3.46 a 3.80.
(c)Incluye gastos de bolsillo, gastos directos de las empresas y otros gastos indirectos de instituciones no lucrativas.
Por último, a fin de observar el comportamiento de los distintos componentes del Sistema en función de los recursos que disponen, puede estimarse el flujo financiero que circula dentro del Sector, teniendo en cuenta el origen de los fondos, qué tipo de entidad los administra y el destino de los gastos. En este análisis se calcula el gasto mensual de cada segmento de usuarios, según su cobertura y el destino de las erogaciones. De este modo surge una comparación de la magnitud del gasto en salud según el nivel de ingresos, y los subsidios cruzados que existen entre los diferentes subsectores: por ejemplo los programas preventivos de las autoridades sanitarias alcanzan a toda la población, tenga o no cobertura; los beneficiarios de OS's a menudo utilizan los servicios públicos sin declarar su cobertura (Tabla 5).
TABLA 5.- Estimación del flujo financiero mensual por usuario según servicios y cobertura en 2010 (en pesos)9

(a)Estimación del gasto mensual por usuario, según origen de los fondos y destino del gasto. (b)Estimación del gasto mensual en usuarios sin y con cobertura, según destino del gasto. OS: Obras Sociales.
En conclusión, el país realiza un gran esfuerzo global en materia de salud, pero sus resultados no se ven reflejados en indicadores de morbimortalidad que estén por debajo de los de otros países que tienen un gasto menor. La marcada fragmentación y dispersión de centros de decisión entre distintos actores ha determinado un equilibrio que impide abordar reformas estructurales de fondo. La autoridad sanitaria nacional no reúne poder suficiente para imponer innovaciones legislativas que deriven en cambios trascendentes; para hacerlo debe concitar consensos muy amplios, que escapan a su capacidad de influir sobre los poderes provinciales y los recursos que gestiona.
Conflictos de interés: No hay conflictos para declarar.
1. Arce H. El Sistema de Salud; de dónde viene y hacia dónde va. Buenos Aires: Editorial Prometeo, 2010, p 149-1. [ Links ]
2. Wagstaff A. Social Health Insurance Reexamined. Development Research Group, World Bank Policy Research Working Paper 4111, Washington D.C., January 2007. [ Links ]
3. Matta M, Leiva L. Sistemas de salud en el mundo. Buenos Aires: Editorial Dunken, 2008, Tomo I, p 61-103. [ Links ]
4. Sánchez Rodríguez H. (ed.). La Salud del Bicentenario, Chile 2011-2020. Santiago: Universidad Andrés Bello, 2011. [ Links ]
5. Arce H. El Sistema de Salud; de dónde viene y hacia dónde va. Buenos Aires: Editorial Prometeo, 2010, p 289-209. [ Links ]
6. Ministerio de Salud de la Nación: Catastro de Recursos de Salud. Buenos Aires: Editorial MSal, 2000. [ Links ]
7. Torres R. Mitos y realidades de las Obras Sociales. Buenos Aires: Editorial ISalud, 2004, p 137. [ Links ]
8. Arce H. La Medicina Prepaga en Argentina. Medicina y Sociedad, Vol. 31, N° 3, Buenos Aires, 2011. En: http://www.medicinaysociedad.org.ar/publicaciones/00_1SEP2011/01sep_2011.html; consultado el 20/9/2011. [ Links ]
9. Tobar F, Olaviaga S, Solano R. Retos postergados y nuevos desafíos del sistema de salud argentino. CIPPEC, Documento de Políticas Públicas N° 99, Buenos Aires, 2011. [ Links ]
10. Torres R. Mitos y realidades de las Obras Sociales. Buenos Aires: Editorial ISalud, 2004, p 161-8. [ Links ]
11. Key Market en base a datos de Ministerios de Economía y Salud, INDEC, ISalud, ACAMI, ADEMP, AFIP, COSSPRA y SSS. En: http://www.ieco.clarin.com/economia/salud-pais-gasta-paga_0_266973529.html; consultado el 23/5/2010. [ Links ]
Recibido: 12-6-2012
Aceptado: 11-7-2012
ARTÍCULO ESPECIAL
Hemorragia por dicumarínicos: Incidencia, factores de riesgo y comparación con los nuevos anticoagulantes orales
Jorge Korin
Consultorios Hematológicos, Buenos Aires
Dirección postal: Dr. Jorge Korin, Consultorios Hematológicos, Av. Córdoba 3515 8°, 1188 Buenos Aires, Argentina
Fax: (54-11) 4963-0120 e-mail: jkorin2009@hotmail.com
Resumen
La hemorragia es la complicación principal de los anticoagulantes orales, dicumarínicos o los nuevos agentes anti-Factor Xa y antitrombínicos. Se analizan los distintos factores de riesgo asociados a sangrado con los agentes clásicos y su vinculación probable con los nuevos fármacos. Se compara la incidencia de sangrado mayor en fibrilación auricular y en tromboembolismo venoso por ambos grupos de antitrombóticos. Además de las propiedades intrínsecas de los agentes clásicos y de los nuevos, serán las características de los pacientes y el correcto empleo terapéutico, los factores que impacten en la incidencia de sangrado en su uso diario, más allá de los datos publicados en los estudios clínicos.
Palabras clave: Hemorragia; Anticoagulantes orales; Factores de riesgo
Abstract
Bleeding during anti-vitamin K treatment. Incidence, risk factors and comparison with the new oral anticoagulants. Bleeding is the main complication of oral anticoagulants, anti-vitamin K or new drugs such as anti-factor Xa or anti-thrombin agents. Risk factors associated with bleeding during warfarin therapy are discussed. For the new drugs no published data is available yet. Comparative frequencies of major bleeding during anticoagulation in atrial fibrillation and venous thromboembolism are shown. Beyond the intrinsic properties of the classic and new agents, patients characteristics and co-morbidities and an appropriate management of the antithrombotic therapy will be the factors associated with bleeding incidence in real life.
Key words: Bleeding; Anti-vitamin K; Risk factors
El tratamiento anticoagulante con dicumarínicos tiene marcada eficacia en la prevención primaria y secundaria del tromboembolismo venoso (TEV), fibrilación auricular (FA) y varias cardiopatías embolizantes valvulares, endocárdicas, miocárdicas e isquémicas. La hemorragia es el efecto secundario principal de los dicumarínicos y constituye el mayor temor para pacientes y médicos.
Análisis de la frecuencia de hemorragia por anticoagulación
Hay amplia variación sobre la incidencia de sangrado en las publicaciones, que incluyen pacientes con diferentes afecciones o con una indicación única (FA o TEV). Los trabajos, aleatorizados u observacionales, tienen diseños diferentes, han sido conducidos con variables parámetros de calidad de atención médica cuyo subrogante aceptado (pero no necesariamente el más válido) es el llamado tiempo en rango terapéutico (TERT). En general, todos ellos tienen diferente definición de tres tipos de sangrado: mayor, no mayor clínicamente relevante y menor. Asimismo, en su gran mayoría, los pacientes más proclives a sangrar, como los muy añosos y con numerosas comorbilidades o antecedentes hemorrágicos, están poco representados respecto del mundo real.
En FA por ejemplo, la incidencia anual de sangrado mayor varía ampliamente entre 1.3 y 7.2% por año1. Un importante factor es la inclusión o no de los primeros 3 meses de tratamiento que constituyen un verdadero filtro de los pacientes más susceptibles al sangrado, que se manifiesta tempranamente en el curso de la anticoagulación2.
Otro elemento a considerar es la inclusión de un descenso fijo de hemoglobina (generalmente 2g/dl) como criterio de sangrado mayor, lo que suele incrementar la relevancia clínica de hemorragias que pueden ser poco importantes y que se tratan con infusiones que provocan hemodilución. En muy escasas ocasiones se describen los eventos de más relevancia como los que realmente amenazan la vida por su ubicación, o dejan daño permanente o requieren cirugía de urgencia o procedimientos endovasculares para cohibirlos. Es claro que el sangrado mayor tiene una composición heterogénea que va desde el juicio subjetivo de requerir transfusión a una hemorragia intracraneana fatal. Se estima que los anticoagulantes orales aumentan el riesgo de sangrado mayor en 0.3- 0.5% por año, y el de hemorragia intracraneana -causa principal de muerte y de discapacidad permanente por anticoagulación- en 0.2% anual, respecto de los controles. Según la complejidad clínica y las características etarias de la población que controla, un servicio especializado en anticoagulación (clínica de anticoagulación) tiene un promedio considerado aceptable de sangrado mayor anual de 1% (0.3-2.1) y de sangrado fatal de 0.1% anual3. El beneficio clínico neto surge de evaluar el riesgo embólico y hemorrágico antes de tomar la decisión de iniciar la anticoagulación. Con esa intención se han elaborado escalas numéricas de ambas situaciones, especialmente en pacientes con FA. Es necesario recalcar que el riesgo de hemorragia por anticoagulación en esta entidad es casi siempre 5 a 8 veces menor que el riesgo de embolia cerebral. En TEV, el riesgo de sangrado mayor suele ser al menos 10 veces menor que el de recurrencia en los primeros tres meses de tratamiento.
Factores de riesgo de hemorragia
El análisis de los factores asociados con variaciones en el riesgo hemorrágico en los pacientes tratados con dicumarínicos es útil para personalizar la indicación terapéutica. No han sido aún evaluadas las variables asociadas a sangrado por los nuevos agentes antitrombóticos en FA o en TEV. En una reciente revisión4 se mencionan como factores que aumentan el riesgo hemorrágico a) una duración permanente y la inclusión de los primeros 3 meses; b) la intensidad de la anticoagulación: una Razón Internacional Normatizada > 4.5; c) la calidad del control de anticoagulación: el seguimiento por internistas no especializados, el no emplear sistemas de auto-control ni programas de computación para asistir en la dosis del dicumarínico; d) las características genéticas de los pacientes: las variantes alélicas de citocromo CYP2C9*2 y 3, los haplotipos no A/no A de óxido-reductasa de vitamina K VKORC1 y la ausencia de mutación en propéptido de factor IX; e) las características no modificables de los pacientes: edad mayor a 75 y sexo femenino; f) las características psicosociales: la falta de información sobre el tratamiento, la falta de adherencia al mismo (prevención primaria, edad juvenil, ausencia de soporte familiar), dietas muy pobres en vitamina K, ataxia, caídas frecuentes, abuso de alcohol o psicotrópicos; g) las co-morbilidades, hemorragia gastrointestinal previa, hipertensión arterial no controlada, neoplasia activa, insuficiencia renal crónica, hepatopatía grave, angiopatía amiloide cerebral, cardiopatía isquémica o accidente cerebro-vascular concomitante; h) las medicaciones concomitantes: empleo de aspirina y/o clopidogrel, uso regular de anti-inflamatorios, potenciación por azólicos, sulfas o amiodarona. Los factores relacionados con las características de los pacientes son también probablemente relevantes para inducir mayor riesgo hemorrágico con las nuevas drogas orales ¿Son esos factores de igual potencia entre sí? No todos han sido reconocidos como válidos en las distintas series, algunos son inmodificables (edad, sexo) y otros no se conocen ni pueden preverse al inicio del tratamiento. Esto plantea que la evaluación del riesgo hemorrágico debe ser periódica y dinámica durante toda la duración del tratamiento. Los factores genéticos solo últimamente han sido considerados y no son de disponibilidad universal, tienen alto costo y no existe consenso sobre su utilidad para evitar sangrado mayor. Entre los factores más constantemente considerados están los antecedentes de sangrado y la edad (que probablemente es un subrogante de comorbilidades, mayor dificultad de comprensión de las precauciones a adoptar con el tratamiento, polimedicación, angiopatía amiloide cerebral y facilidad para el sangrado gastrointestinal por angiodisplasias, divertículos y neoplasias). En una reciente revisión, la insuficiencia renal y la presencia de cáncer fueron consideradas las comorbilidades más relevantes para producir sangrado5. La insuficiencia renal es de particular importancia por afectar la eliminación del dabigatrán y en menor magnitud, de rivaroxabán y apixabán. Es interesante que la presencia de neoplasia no ha sido considerada en el último y más promocionado score de sangrado en FA al que adhiere la Sociedad Europea de Cardiología (hipertensión sistólica, anormal función renal y/o hepática, apoplejía, sangrado previo, labilidad en la anticoagulación oral, edad > 65, abuso de drogas o alcohol: HAS-BLED).
El excesivo efecto antitrombótico (RIN> 3 o RIN 2-3 más antiagregación) es un factor reconocido para favorecer el sangrado. Sin embargo, el 20% de los sangrados mayores en una serie italiana de clínicas de anticoagulación ocurrieron con RIN < 2. Esto recalca la importancia de la existencia, a veces ignorada antes del inicio del tratamiento, de sitios de menor resistencia como los pólipos gastro-intestinales que se manifiestan clínicamente como sangrado con rangos bajos de anticoagulación6.
Valor de los scores predictivos de sangrado
En las últimas dos décadas, varios esquemas han tomado algunos de los parámetros asociados a mayor riesgo de sangrado y se han creado scores con los mismos7-15. No existen estudios prospectivos que evalúen el impacto del empleo de dichos scores en la decisión de anticoagular o en la efectiva reducción de la complicación hemorrágica. Una revisión crítica de todos estos sistemas predictivos de sangrado16, concluye que en FA tienen pobre performance predictiva y su incorporación a la clínica solo debería recomendarse cuando demuestren un impacto positivo en la toma de decisiones, si bien el score HAS-BLED tiene la ventaja de su mayor simplicidad17. La Tabla 1 muestra las diferencias de sangrado según puntuación de riesgo en HAS-BLED. Se debe remarcar que la mayoría de los pacientes incluidos en él son de bajo riesgo. En los pacientes con TEV, una puntuación baja en el score del Registro Informatizado de pacientes con enfermedad trombo-embólica (RIETE)14 parece de utilidad para identificar aquéllos con riesgo hemorrágico muy bajo. Sin embargo, esto requiere una validación prospectiva. Parámetros de importancia en el uso diario, como grado de adherencia a las indicaciones y calidad de la anticoagulación con dicumarínicos, no han sido considerados en ninguna de estas reglas de predicción de sangrado. La adherencia puede inferirse durante el interrogatorio inicial del paciente que va a recibir un tratamiento antitrombótico respecto a su actitud ante otras medicaciones crónicas que reciba. La calidad esperable del control requiere una auto-evaluación de cada clínica de anticoagulación o médico tratante para conocer cuán cerca se encuentra de las medias señaladas como aceptables en la literatura para TERT o eventos adversos en sus pacientes. Un sub-estudio de warfarina versus ximelagatrán en FA demuestra que el sangrado mayor bajo RIN 2-3 > 75% del tiempo es 1.58% anual, mientras que sube a 1.96% si el RIN fue adecuado durante el 60-75% del tiempo, y a 3.85% si solo se logró en < 60% del período de seguimiento18. En última instancia, el mayor beneficio clínico neto de los anticoagulantes se dará siempre en los pacientes con riesgo trombo-embólico más alto (score predictivo de embolia CHADS2 > 3 en FA, reemplazos valvulares mitrales, embolias pulmonares recientes, etc.) independientemente del riesgo hemorrágico.
TABLA 1.- Frecuencia de sangrado según nº de factores de riesgo en el score HASBLED

: Parámetros compartidos con el score CHADS2
¿Cumplirán las nuevas drogas antitrombóticas orales con la aspiración de provocar menos sangrado?
Pese a la notable efectividad demostrada por los dicumarínicos en FA y TEV, existe paradójicamente en la primera entidad una evidente subutilización, ya que los médicos consideran menos la eficacia y valoran en exceso el riesgo hemorrágico. Los dicumarínicos son drogas que requieren una especialización -de la que carecen muchos médicos de familia o cardiólogos- y un paciente colaborador o en su defecto un núcleo familiar o social contenedor. Tienen como mayor ventaja la experiencia de varias décadas (más de 70 años) y su bajo costo, y como desventajas su estrecha ventana terapéutica, la respuesta individual con marcadas diferencias entre los pacientes y la necesidad de controles de laboratorio frecuentes para ajuste de dosis, a lo que se suman las interacciones con dietas o medicamentos.
Los nuevos agentes antitrombóticos orales, inhibidores directos de trombina o de factor Xa han llegado a la arena terapéutica tratando de reemplazar o ser opciones válidas para considerar en las indicaciones previamente cubiertas por heparinas de bajo peso molecular o dicumarínicos. Tienen dosis fijas para promover con esta simplificación mayor adherencia, un efecto inmediato y predecible que evita las extracciones de sangre periódicas y el empleo simultáneo de heparinas de bajo peso molecular, y no poseen interacciones con alimentos. Sin embargo, también ellos producirán hemorragia por factores asociados al paciente. Si bien en los primeros ensayos en poblaciones seleccionadas han producido una tasa aceptable de complicaciones hemorrágicas, aún deberá verse en la práctica clínica diaria si contribuirán a que éstas sean menores que las observables con la terapéutica tradicional. El profesional que los indique deberá advertir a sus pacientes desde la primera consulta que, en términos de sangrado, se debe estar alerta permanentemente aunque no se cuente con el refuerzo mensual de ese mensaje durante el control de laboratorio y la consulta subsiguiente. Será imprescindible desde la indicación inicial una correcta información, de manera de lograr una motivación para cumplir un tratamiento que será menos supervisado que el tradicional, sin despreciar el riesgo de sangrado. Los aspectos de adherencia, detección pre-clínica de efecto inadecuado y alto costo, sumados a la ausencia de antídotos específicos, son cuestiones que en los próximos años deberán mejorar si se pretende un gradual reemplazo de los actuales gold standard en anticoagulación oral. Parámetros que resultan tradicionales al evaluar un paciente con hemorragia bajo dicumarínicos, como la intensidad de la terapéutica, deberán ser reemplazados por otros, como horario de la última toma del medicamento, posibilidad de cohibir localmente la hemorragia y conocimiento de las capacidades de depuración renal o hepática diferentes para cada droga antitrombótica nueva. Sería útil no desperdiciar la experiencia ganada en las clínicas de anticoagulación para incorporarlas a la supervisión del paciente tratado con los nuevos fármacos antitrombóticos. Las mismas contra-indicaciones para anticoagulación que están aceptadas para los dicumarínicos rigen para las nuevas drogas y se agrega para las de eliminación renal predominante (dabigatrán), la insuficiencia renal grave. La Tabla 2 recuerda sus características farmacológicas más relevantes.
TABLA 2.- Características farmacológicas de los nuevos agentes anticoagulantes orales

CYP 3A4: Haplotipo de citocromo. GpP: Glicoproteína P
A continuación se analizarán las evidencias clínicas en cuanto a sangrado en los estudios comparativos con warfarina, de las nuevas drogas en FA y TEV.
La Tabla 3 resume las características principales de los estudios en FA. Los estudios no son comparables entre sí, sobre todo por las distintas poblaciones de pacientes con FA, (el estudio con rivaroxabán incluyó enfermos con mayor riesgo embólico y hemorrágico) y por el diseño doble ciego exclusivo para los inhibidores de FXa. No obstante, puede apreciarse que sólo el apixabán ha demostrado una reducción de hemorragia mayor respecto de la warfarina y que los tres estudios muestran una reducción de la hemorragia intracraneana con las nuevas drogas. Aunque la frecuencia de ella no llega al 1% en estos estudios con alta selección de pacientes menos proclives a sangrar, en estudios de cohorte recientes22 es del 2.5% anual en añosos. ¿Por qué mecanismo las tres drogas producen menos efecto secundario de potenciales consecuencias catastróficas para los pacientes? Si bien es especulativo, esta observación se liga fisio-patológicamente a un posible efecto deletéreo de los dicumarínicos sobre la pared vascular arterial cerebral a través de la hipocarboxilación de proteínas K dependientes protectoras de las células musculares lisas ( Matrix Gla Protein (MGP) y Growth Arrest Specific Gene 6 (Gas-6), lo que facilitaría el sangrado26. Volviendo a la hemorragia intracraneana y las nuevas drogas, es necesario puntualizar que el dabigatrán solo la disminuye en forma estadísticamente significativa en los pacientes con score CHADS2 0 y 1 y como tendencia en los scores mayores. La edad > o < 75 años no es un factor para la disminución del riesgo de hemorragia intracraneana con dabigatrán. No obstante, en > 75 años se aprecia un incremento de la tendencia a sangrado mayor no intracraneano con esta droga23. Resaltando la importancia del CHADS2 como pronóstico de sangrado, la incidencia anual de hemorragia intracraneana en el estudio Randomized Evaluation of Long-Term Anticoagulation Therapy (RE-LY) con scores de CHADS2 de 3 o mayores fue de 4.28% para warfarina, 3.62% para dabigatrán 110 mg c/12 h y 4.64% para dabigatrán 150 mg c/12 h. No todos los sangrados mayores se comportan de igual manera en estos estudios. En el ya mencionado RE-LY, la incidencia de hemorragia gastrointestinal con dabigatrán fue mayor con dabigatrán 150 mg c/12 h que con warfarina, ya sea en consumidores de anti-vitaminas K (1.8% vs. 1.3%, p: 0.02) o en vírgenes de tratamiento (1.9% vs. 1.2%, p: 0.004). Quizás este dato se vincula al contenido de ácido tartárico y mayor dispepsia observada en los pacientes con dabigatrán en el estudio RE-LY.
TABLA 3.- Estudios de fase III completados con nuevos antitrombóticos orales en fibrilación auricular (FA).
Comparación de hemorragias con warfarina

TERT: Tiempo en rango terapéutico; CHADS2: Insuficiencia cardíaca congestiva, hipertensión arterial, edad, diabetes, apoplejía
En el estudio rivaroxabán versus warfarina en fibrilación auricular no valvular (ROCKET-AF), por otra parte, los componentes del sangrado mayor se comportan en forma asimétrica: existe mayor porcentaje de pacientes bajo rivaroxabán con descenso de Hb > 2 g/dl (2.77% vs. 2.26%, p: 0.02) y de necesidad transfusional > 2U (1.65% vs. 1.32%, p: 0.04) y por otra parte, menor sangrado en órgano crítico (0.82% vs. 1.18%, p: 0.007) y menor sangrado fatal (0.24% vs. 0.48%, p: 0.003). En el estudio apixabán versus warfarina en fibrilación auricular (ARISTOTLE), apixabán muestra menor sangrado intracraneano que warfarina como se señaló previamente, pero igual sangrado gastrointestinal (0.76% vs. 0.86% anual, p: ns). El sangrado mayor es menor que con warfarina (2.1 vs. 3.1% p: < 0.001). La conclusión sobre estos estudios es que el porcentaje de hemorragias mayores es bajo pero inevitable con cualquier agente, tradicional o nuevo, y no debe, especialmente en los pacientes con riesgo embólico elevado, disuadir del empleo de anticoagulación. Si el empleo en la clínica diaria confirma la disminución de hemorragia intracraneana con los nuevos agentes, éstos deberán ir reemplazando progresivamente a los dicumarínicos en FA. Para ello serán útiles estudios de fármaco-economía que confirmen una aceptable ganancia en calidad de vida pese a un costo directo mayor. En los estudios de profilaxis secundaria de TEV se observa equivalencia entre warfarina y las nuevas drogas, y puede concluirse que desde el punto de vista de disminuir la hemorragia no existen ventajas entre la terapéutica tradicional y los nuevos fármacos anticoagulantes, como muestra la Tabla 4.
TABLA 4.- Estudios de fase III completados con nuevos antitrombóticos orales en TEV.
Comparación de hemorragias con warfarina

TERT: Tiempo en rango terapéutico
¿Cumplirán los nuevos antitrombóticos con la expectativa de una anticoagulación más "amigable" que la clásica? ¿Continuarán los cardiólogos la tendencia perceptible con los dicumarínicos hacia la doble o triple terapia con antiagregantes cada vez más potentes? Esta asociación aumenta marcadamente el riesgo de hemorragia gastrointestinal grave27. Como comentario final y adaptando a este tema el comentario de Stuebe28 sobre la interfase entre la anécdota y la medicina basada en evidencia, puede concluirse que es indispensable que los médicos utilicen apropiadamente los nuevos antitrombóticos para no disminuir la eficacia ni favorecer el sangrado. La tarea del médico es interpretar lo que lee, conocer las conclusiones de los estudios y aplicarlos en la toma de decisiones. Este paradigma nos permite guiarnos por evidencias de nivel I como gold standard. En nuestra mente, sin embargo, la anécdota con resultados adversos (un sangrado cerebral en un paciente con uno de los nuevos agentes anticoagulantes a una dosis inapropiada por deterioro de la función renal, como ejemplo) es más convincente que el intervalo de confianza más estrecho, y crea recuerdos más poderosos que cualquier revisión de Cochrane. Los resultados de los estudios de mejor nivel pueden tardar décadas desde las páginas de las revistas de mayor impacto a la medicina diaria, pero la anécdota adversa puede transformar al instante nuestro patrón de práctica médica. Esto puede ser una debilidad intrínseca de la naturaleza humana pero es a la vez una de sus fuerzas atávicas (aprender de las malas experiencias personales).
Conflictos de interés: El autor no posee conflictos de interés.
1. Lip, GYH, Andreotti F, Fauchier L, et al. Bleeding risk assessment and management in atrial fibrillation patients: a position document from the European Heart Rhythm Association, endorsed by the European Society of Cardiology Working Group on Thrombosis. Europace 2011; 13: 723-46. [ Links ]
2. Garcia DA, Lopes RD, Hylek EM. New- onset atrial fibrillation and warfarin initiation; High risk periods and implications for new antithrombotic drugs. Thromb Haemost 2010; 104: 1099-105. [ Links ]
3. Fanikos J, Corranti GN, Shah R, et al. Major bleeding complications in a specialized anticoagulation service. Am J Cardiol 2005; 96: 595-8. [ Links ]
4. Palaretti G, Cosmi B. Bleeding with anticoagulation therapy. Who is at risk and how best to identify such patients. Thromb Haemost 2009; 102: 268-78. [ Links ]
5. Chen WT, White CM, Phung OJ, et al. Are the risk factors listed in warfarin prescribing information associated with anticoagulation-related bleeding? A systematic literature review. Int J Clin Pract 2011; 65: 719-21. [ Links ]
6. Palaretti G, Leali N, Coccheri S, et al. Bleeding complications of oral anticoagulant treatment: an inception-cohort, prospective- collaborative study (ISCOAT) Italian study on complications of oral anticoagulant therapy. Lancet 1996; 348: 423-8. [ Links ]
7. Landefeld CS, Goldman L. Major bleeding in outpatients treated with warfarin: incidence and prediction by factors known at the start of outpatient therapy. Am J Med 1989; 87: 144-52. [ Links ]
8. Beyth RJ, Quinn LM, Landefeld CS. Prospective evaluation of an index for predicting the risk of major bleeding in outpatients treated with warfarin. Am J Med 1998; 105: 91-9. [ Links ]
9. Kuijer PMM, Hutten BA, Prins MH, et al. Prediction of the risk of bleeding during anticoagulant treatment for venous thromboembolism. Arch Intern Med 1999; 159: 457-60. [ Links ]
10. Wells PS, Forgie MA, Simms M, et al. The outpatient bleeding risk index: validation of a tool for predicting predicting bleeding rates in patients treated for deep venous thrombosis and pulmonary embolism. Arch Intern Med 2003; 163: 917-20. [ Links ]
11. Aspinall SL, DeSanzo BE, Trilli LE, et al. Bleeding Risk Index in an anticoagulation clinic. Assessment by indication and implications for care. J Gen Intern Med 2005; 20: 1008-13. [ Links ]
12. Gage BF, Yan Y, Milligan PE, et al. Clinical classification schemes for predicting hemorrhage: Results from the National Registry of Atrial Fibrillation (NRAF). Am Heart J 2006; 151: 713-9. [ Links ]
13. Shireman TI, Mahnken JD, Howard PA, et al. Development of a contemporary bleeding risk model for elderly warfarin recipients. Chest 2006; 130: 1390-6. [ Links ]
14. Ruiz-Gimenez N, Suarez C, Gonzalez R, et al. Predictive variables for major bleeding events in patients presenting with documented acute venous thromboembolism. Findings from the RIETE Registry. Thromb Haemost 2008; 100: 26-31. [ Links ]
15. Pisters R, Lane DA, Nieuwlaat R, et al. A novel user-friendly score (HAS-BLED) to assess 1-year risk of major bleeding in patients with atrial fibrillation: the Euro Heart Survey. Chest 2010; 138: 1093-100. [ Links ]
16. Loewen P, Dahri K. Risk of bleeding with oral anticoagulants: an updated systematic review and performance analysis of clinical prediction rules. Ann Hematol 2011: 90: 1191-200. [ Links ]
17. Olesen JB, Lip GYH, Hansen PR, et al. Bleeding risk in real world patients with atrial fibrillation: comparison of two established bleeding prediction schemes in a nationwide cohort. J Thromb Haemost 2011; 9: 1460-7. [ Links ]
18. White HD, Gruber M, Feyzi J, et al. Comparison of outcomes among patients randomized to warfarin therapy according to anticoagulant control: results from the SPORTIF III and V. Arch Intern Med 2007; 167: 239-45. [ Links ]
19. Connelly SJ, Ezekowitz MD, Yusuf S, et al [for the RE-LY Steering Committee and Investigators]. Dabigatran versus warfarin in patients with atrial fibrillation. N Engl J Med 2009; 361: 1139-51. [ Links ]
20. Patel MR, Mahaffey KW, Garg J, et al [for the ROCKET AF Steering Committee and Investigators]. Rivaroxaban versus warfarin in nonvalvular atrial fibrillation. N Engl J Med 2011; 365: 883-91. [ Links ]
21. Granger CB, Alexander JH, McMurray JJV, et al. Apixaban versus warfarin in patients with atrial fibrillation. N Engl J Med 2011; 365: 981-92. [ Links ]
22. Hylek EM, Evans-Molina C, Shea C, et al. Major Hemorrhage and Tolerability of Warfarin in the First Year of Therapy Among Elderly Patients with Atrial Fibrillation. Circulation 2007; 115: 2689-96. [ Links ]
23. Eikelboom JW, Wallentin L, Connelly SJ, et al. Risk of bleeding with two doses of dabigatran compared with warfarin in older and younger patients with atrial fibrillation. An analysis of the Randomized Evaluation of Long Term Anticoagulant Therapy (RE-LY) Trial. Circulation 2011; 123: 2363-72. [ Links ]
24. Schulman S, Kearon C, Kakkar AK, et al. Dabigatran versus warfarin in the treatment of venous thromboembolism. N Engl J Med 2009; 361: 1-11. [ Links ]
25. The EINSTEIN investigators. Oral rivaroxaban for symptomatic venous thromboembolism. N Engl J Med 2010; 363: 2499-510. [ Links ]
26. Danziger J. Vitamin K-dependent proteins, warfarin and vascular calcification. Clin J Am Soc Nephrol 2008; 3: 1504-10. [ Links ]
27. Coleman CI, Sobieraj DM, Winkler S, et al. Effect of pharmacological therapies for stroke prevention on major gastrointestinal bleeding in patients with atrial fibrillation. Int J Clin Pract 2012; 66: 53-63. [ Links ]
28. Stuebe AM. Level IV-evidence. Adverse anecdote and clinical practice. N Engl J Med 2011; 365: 8-9. [ Links ]
Recibido: 8-3-2012
Aceptado: 4-7-2012
CASUÍSTICA
Encefalopatía hiperamoniémica y hepatocarcinoma fibrolamelar
Cintia Berger1, Pablo Dimant1, Laura Hermida1, Francisco Paulin1, Matías Pereyra2, Mariana Tejo2
1Servicio de Clínica Médica, Unidad 17, División A,
2Servicio de Anatomía Patológica, Hospital Juan A Fernández, Buenos Aires
Dirección postal: Dra. Laura Hermida, Servicio de Clínica, Hospital Juan A. Fernández, Cerviño 3356, 1425 Buenos Aires, Argentina
e-mail: laurahermida@fibertel.com.ar
Resumen
Presentamos el caso de una mujer de 22 años con hepatocarcinoma fibrolamelar agresivo, metastásico, de rápida evolución y con una rara forma de comienzo, como una encefalopatía hiperamoniémica. El hepatocarcinoma fibrolamelar es un tumor hepático raro, que se presenta en pacientes jóvenes, sin antecedentes de hepatopatía viral o cirrótica. Su etiología es desconocida, y tradicionalmente fue considerado como de mejor pronóstico que el carcinoma hepatocelular clásico.
Palabras clave: Encefalopatía hiperamoniémica; Hepatocarcinoma fibrolamelar
Abstract
Hyperammonemic encephalopathy and fibrolamellar hepatocellular carcinoma. We present the case of a young woman, 22 years old, with an aggressive form of fibrolamellar hepatocellular carcinoma. She began with the signs and symptoms of a hyperammonemic encephalopathy, an uncommon form of presentation. Fibrolamellar carcinoma is a rare liver tumor, which affects young patients without previous liver disease. Its etiology is unknown, and it has been considered as a tumor with a better prognosis than the classic hepatocellular carcinoma.
Key words: Hyperammonemic encephalopathy; Fibrolamellar carcinoma
El hepatocarcinoma es el tumor primario de hígado más frecuente. Es un tumor agresivo, con una supervivencia desde el diagnóstico de 6 a 20 meses. La variante fibrolamelar presenta mejor supervivencia. Se presenta como masa hepática voluminosa en adolescentes o adultos jóvenes. La cirrosis, los marcadores virales, el abuso de alcohol y la alfafetoptoteína no están habitualmente presentes. El hepatocarcinoma fibrolamelar tiene mal pronóstico si se presenta de inicio con metástasis, y plantea un diagnóstico diferencial para las encefalopatías hiperamoniémicas con lesión focal sólida hepática.
Caso clínico
Mujer de 22 años, que es derivada a Clínica Médica desde el Servicio de Ginecología de nuestro Hospital. Allí estaba internada por masa abdominal retro uterina, hígado palpable y ascitis. En el último año, luego de un parto normal, presenta progresiva pérdida de peso, constipación y vómitos ocasionales. Por acentuarse los síntomas en el último mes con distensión abdominal, consulta y se interna con sospecha de tumor de ovario. Durante la internación en el Servicio de Ginecología presenta a las 48 horas deterioro del sensorio, por lo que pasa a Clínica Médica.
Ingresa vigil, desorientada, con perseveraciones verbales. Hiporreflexia generalizada y flapping. Abdomen distendido, con hepatomegalia nodular de bordes irregulares y signos de ascitis. A las 72 horas se encuentra en coma, sin deficiencias motoras; movimientos óculo-encefálicos, reflejos corneanos, fotomotor y consensual, y reflejo nauseoso conservados.
Exámenes de laboratorio: TGP: 70 UI/l; TGO: 52 UI/l; fosfatasa alcalina: 95 UI/l, bilirrubina total: 0.2 mg%; CA 125: 434 U/ml (h 35); alfafetoproteina 34.2 UI/ml (h 7); gonadotrofina coriónica humana: negativa; CEA, CA19 9 normales. Amonio 254 (h 30); tiempo de protrombina (TP) 60%; APTT 29; Factor V 65%. Calcio, fósforo y magnesio normales. Serologías virales negativas. FAN, ASMA, LKM, AMA negativos. Anticuerpos anti Hu / Yo/ Ri / y Tr, negativos. Líquido ascítico hemorrágico, con citológico y cultivos del mismo, negativos.
TAC cerebro, RMN cerebro, LCR y fondo de ojo sin particularidades. EEG: ausencia de actividad alfa. Actividad theta bilateral de bajo voltaje; paroxismos delta irregulares, intermitentes y bifrontales. TAC tórax, abdomen y pelvis: adenomegalias mediastinales. Hepatomegalia heterogénea, con contornos polilobulados; calcificaciones en el domo. Áreas hipodensas con componente necrótico en la mayor parte del lóbulo derecho, compatibles con metástasis (Fig. 1). Ascitis. Masa pelviana polilobulada que desplaza útero vejiga y recto. Implantes peritoneales.

Fig. 1.- TAC de abdomen: hepatomegalia de bordes irregulares con múltiples imágenes nodulares.
Ecografía abdominal con eco Doppler venoso: trombosis de vena esplénica.
Punción aspiración de masa hepática: examen citológico compatible con carcinoma de células germinales o hepatocarcinoma. Inmunohistoquímica: hepatocarcinoma o tumor de seno endodérmico, variedad hepatoide.
Frente a la gravedad del cuadro, se decide comenzar quimioterapia (bleomicina, etopósido y cisplatino) para tumores germinales. La paciente recibe dos dosis de tratamiento y fallece.
Los datos pertinentes de la autopsia son: hígado de 3200 g. En la superficie, múltiples lesiones blanquecinas de bordes netos de 2.5 cm de diámetro mayor. Al corte, el lóbulo derecho presenta voluminosa formación tumoral blanco amarillenta de 22 x 18 x 8 cm, con áreas necróticas de aspecto nodular.
Microscopía: tumor hepático constituido por células de gran tamaño, con citoplasma eosinófilo y nucléolos prominentes, dispuestas en playas y trabéculas separadas por tejido fibroso de aspecto lamelar que se tiñe con las coloraciones para colágeno (Fig. 2 A). La inmunomarcación muestra Hep Par 1(Hepatocyte Paraffin 1): (+) (Fig. 2 B); alfafetoproteína (+) < 10%; AE1-AE3 (+); CK7 (+); Vim (-); S100 (-); HMB45 (-).

Fig. 2.- A. Tinción de tricrómico que evidencia las bandas laminares de tejido fibroso. B. Positividad citoplasmática para Hep-Par 1 que muestra el origen hepático de las células tumorales.
Se concluye con el diagnóstico de: hepatocarcinoma fibrolamelar con metástasis en mediastino, diafragma, epiplón, esófago, páncreas, vesícula, vejiga, ovarios, útero y recto.
Discusión
La presentación agresiva con metástasis múltiples y encefalopatía hiperamoniémica no suele ser la esperada para el hepatocarcinoma fibrolamelar. Sin embargo, presentamos un caso con necropsia que confirma dicho diagnóstico.
Al ingreso, la encefalopatía de la paciente planteó los siguientes diagnósticos diferenciales: causa estructural, metabólica o paraneoplásica. La RMN de cerebro con contraste y la punción lumbar descartaron la primera. La encefalopatía tipo Wernicke se excluyó por la falta de respuesta al tratamiento con altas dosis de tiamina. En cuanto a la encefalopatía paraneoplásica, nuestra enferma no presentaba la forma clásica, donde los síntomas son previos a la detección de una masa tumoral, o con tumores en etapas iniciales. Además, el LCR resultó normal; en la encefalopatía paraneoplásica suele ser inflamatorio. Por último, para descartar encefalopatía paraneoplásica, que puede coexistir con RMN de cerebro normal, se solicitaron anticuerpos anti Hu / Yo/ Ri / y Tr, que fueron negativos1.
Nos queda, finalmente, postular la hiperamoniemia como causa de la encefalopatía. En nuestro caso, la encefalopatía no es vinculable a hepatitis aguda con falla hepática, ni a hepatopatía en fase de cirrosis ya que se presenta con TGO y TGP con mínimo aumento, sin ictericia y con marcadores de función hepática sin insuficiencia (TP 60%; Factor V 65%). En la anatomía patológica no se encontró cirrosis. La presencia de trombosis de la esplénica en la ecografía con Doppler no es suficiente para justificar un shunt porto-sistémico, vena porta sin trombos en la autopsia. De tal modo, proponemos en este caso como mecanismo de la hiper-amoniemia al shunt intrahepático. Este se produce porque las células inflamatorias y sobre todo las neoplásicas, que ocupan buena parte del hígado con el tumor, resultan incompetentes para realizar el clearence de compuestos nitrogenados, con aumento del amonio. Luego de revisar la literatura, hemos encontrado solo un caso de hepatocarcinoma fibrolamelar causante de enfalopatía hiperamoniémica2.
El hepatocarcinoma fibrolamelar fue descripto por primera vez en 1958 por Edmonson como un subtipo del hepatocarcinoma3. Actualmente es considerado como una entidad distinta al hepatocarcinoma4. De etiología desconocida, afecta a jóvenes con hígado previamente sano, no relacionado a virus B y C, ni a hepatopatías cirróticas5, 6. En la inmunohistoquímica expresa marcadores de hepatocitos y células de los conductos biliares, siendo rara la de alfafetoproteína. En nuestro caso, la presencia en tejido de alfafetoproteína menor al 10%, justifica su leve aumento sérico (34.2 UI/ml). El carcinoma fibrolamelar puede aumentar el dosaje de vitamina B12 (no contamos con el mismo en la paciente). Dicha vitamina serviría como marcador de recidiva tumoral7, 8. El carcinoma fibrolamelar se asoció tradicionalmente a mejor pronóstico que el hepatocarcinoma debido a la edad, presentación en jóvenes y a la ausencia de cirrosis. Los pacientes que, como el nuestro, se presentan ya con metástasis, tienen un pronóstico sombrío, con supervivencias a cinco años < 15%9. La supervivencia media del carcinoma fibrolamelar es 12 -14 meses, comparada con 8-9 meses del hepatocarcinoma clásico10. En esta forma, con resección quirúrgica la supervivencia a 5 años es de 37 a 76%, al igual que con el transplante.
Nuestro caso muestra que el carcinoma fibrolamelar con metástasis tempranas tiene mal pronóstico y que, aunque la encefalopatía hiperamoniémica por shunt intrahepático es sumamente rara, debe recordarse como forma de presentación. En la revisión de la literatura encontramos solo un caso con idéntico comienzo clínico.
Conflictos de interés: No hay conflictos de interés que declarar.
1. Dalmau J, Rosenfeld MR, Paraneoplastic syndromes of the CNS. Lancet Neurol 2008; 7: 327-40. [ Links ]
2. Sethi S, Tageja N, Singh J, et al. Hyperammonemic encephalopathy: a rare presentation of fibrolamellar hepatocellular carcinoma. Am J Med Sci 2009; 338: 522-4. [ Links ]
3. Edmonson HA. Differencial diagnosis of tumors and tumor-like lesions of liver in infancy and childhood. Arch Dis Child 1956; 1: 168-86. [ Links ]
4. Hamilton SR, Aaltonen LA (ed). Tumors of the liver and intrahepatic bile ducts. In: Pathology and genetics of the digestive system. Lyon: IARC Press; 2000, p 159-72. [ Links ]
5. Stephen C, Ward, MD, Waxman S. Fibrolamellar Carcinoma: A review with focus on genetics and comparison to other malignant primary liver tumors. Semin Liver Dis 2011; 31: 61-70. [ Links ]
6. Craig JR, Peters RL, Edmonson HA, Omata M. Fibrolamellar carcinoma of the liver: a tumor of adolescents and young adults with distinctive clinic pathologic features. Cancer 1980; 46: 372-9. [ Links ]
7. Waxman S, Gilbert HS. A tumor-related vitamin B12 binding protein in adolescent hepatoma. N Engl J Med 1973; 289: 1053-6. [ Links ]
8. Waxman S, Liu CK, Schreiber C, Helson L.The clinical and physiological implications of hepatoma B12-binding proteins. Cancer Res 1977; 37: 1908-14. [ Links ]
9. Stipa F, Yoon SS, Liau KH, et al. Outcome of patients with fibrolamellar hepatocellular carcinoma. Cancer 2006; 106: 1331-8. [ Links ]
10. Epstein Be, Pajak TF, Haulk TL, Herpst JM, Order SE, Abrams RA. Metastatic nonresectable fibrolamellar hepatoma: prognostic features and natural history. Am J Clin Oncol 1999; 22: 22-8. [ Links ]
Recibido: 1-12-2011
Aceptado: 29-5-2012
CASUÍSTICA
Linfoma primario de hueso con afectación multicéntrica
Marcelo Graziadio1, Natalia Medina1, Marcelo Amato1, María del Carmen Ardaiz2, Santiago Ilutovich1, Marcelo Torino1
1Servicio de Clínica Médica,
2Servicio de Hematología, Hospital Ramos Mejía, Buenos Aires
Dirección postal: Dr. Marcelo Graziadio, Servicio de Clínica Médica, Hospital Ramos Mejía, Urquiza 609, 1221, Buenos Aires, Argentina
Fax: (54-11) 5371-3455 email: marcelograziadio@hotmail.com
Resumen
El linfoma primario de hueso es una enfermedad infrecuente, que tiene una presentación y evolución diferente a los linfomas de otras localizaciones. Se presenta un caso de linfoma primario de hueso de localización craneana y esternal de rápido crecimiento. En su evolución, realizada la exéresis de la lesión primaria de calota, presentó aparición de nuevas lesiones de rápido crecimiento a nivel craneano y fémur y progresión de lesión preesternal que, con anatomía patológica de linfoma no Hodgkin difuso de células grandes B, inició R-CHOPP (ciclofosfamida, doxorrubicina, vincristina, prednisona y rituximab) con rápida disminución de todas las lesiones sin evidencia de progresión al cabo de los seis ciclos.
Palabras clave: Linfoma primario de hueso; Linfoma; Tumor óseo
Abstract
Primary bone lymphoma with multicentric involvement. Primary bone lymphoma is a rare disease, which usually has a different presentation and evolution than lymphomas of other locations. We are presenting a case of primary bone lymphoma of rapid growth, in cranial and sternal locations. In its evolution, once the excision of the primary lesion of the skull was performed, the patient presented new lesions of rapid growth at the skull and femur level, and progression of pre-sternal lesion. With large B-cell diffuse non-Hodgkin lymphoma pathology, the patient initiated R-CHOPP (cyclophosphamide, doxorubicin, vincristine, prednisone and rituximab) with rapid reduction of all lesions without evidence of progression after the six cycles.
Key words: Primary bone lymphoma; Lymphoma; Bone tumor
El linfoma primario de hueso comprende menos del 2% de todos los linfomas1, 2. Suele tener una presentación clínica localizada, destacándose fundamentalmente el dolor óseo y el desarrollo de tumoraciones de partes blandas2. Presenta mejor pronóstico que los linfomas de otras localizaciones, evidenciado en los resultados de todas las series2. Si bien no se han desarrollado recomendaciones específicas para el tratamiento de esta entidad, la mayoría de los centros de referencia utilizan el mismo tratamiento que en los linfomas con otras localizaciones, siendo destacable su buena respuesta terapéutica. El objetivo de este trabajo es comunicar una variedad de linfoma poco habitual que además se presentó de manera atípica, demostrando buena respuesta a la quimioterapia instaurada.
Caso clínico
Mujer de 52 años, que en enero de 2011 presentó traumatismo encéfalo craneano leve. Tenía una tumoración en región frontoparietal derecha de crecimiento progresivo. En febrero 2011 presentó episodio de pérdida de conciencia, refiriendo el familiar movimientos anormales de la cabeza posterior, con lo que permaneció somnolienta por aproximadamente una hora. No refirió palpitaciones, sudoración ni relajación de esfínteres. Consultó a otro hospital donde se realizó TC de cráneo sin contraste negándose la paciente a la internación.
A las 24 horas consultó al Hospital Ramos Mejía por cefalea en hemicráneo derecho de intensidad 8/10, de característica opresiva, siendo evaluada por el Servicio de Neurocirugía solicitándose RMN de encéfalo que evidenció lesión tumoral expansiva a nivel frontotemporal derecho que destruyó la estructura ósea contigua, sobresaliendo sobre el plano óseo, que impresionó invadir desde el exterior; asimismo se evidenció edema perilesional (Fig. 1).

Fig. 1.- Centellograma de glándulas salivales con baja e irregular concentración del trazador; no se observan las glándulas submaxilares
El 25/2/2011 se internó en Clínica Médica para realización de exéresis de lesión, realizándose el mismo día TAC de tórax, abdomen y pelvis, observándose en extremo inferior del esternón, rodeándolo y por delante del corazón, tejido de densidad de partes blandas que realzó con contraste intravenoso, y que medía aproximadamente 55 x 11 mm (Fig. 2); con imagen lítica en proyección de trocánter de fémur izquierdo, imágenes líticas en calota y lesión osteolítica ilíaca izquierda.

Fig. 2.- TAC tórax: masa de partes blandas pre y retro esternal (febrero 2011, izquierda) que evidencia un franco crecimiento en la imagen control (abril 2011, derecha).
Como antecedentes personales refería anexo-histerectomía por miomatosis y lesión quística en cuadrante súpero externo de mama derecha cinco años antes de la consulta; la lesión, evaluada por punción-aspiración con aguja fina dio resultado benigno (informe verbal). Al ingreso: PA: 120/70 mm Hg, FC: 84 latidos/min, T: 36.1 °C, lúcida, sin signos de foco motor, sensitivo, ni signos meníngeos. Tumoración en cráneo, región frontoparietal derecha de 6 × 8 cm, una adenopatía submandibular derecha móvil de 1 × 1 cm y una tumoración en región pre esternal baja de 3 × 3 cm. El resto del examen físico no evidenciaba particularidades. El laboratorio del ingreso informaba hematocrito: 33%, Hb: 11 g%, plaquetas: 446 000/mm3, glóbulos blancos 11 900/mm3, eritrosedimentación 32 mm/h, urea 37 mg%, creatinina 0.67 mg%, Na 142 meq/l, K 4.3 meq/l, glucemia 86 mg%, calcio 9.7 mg%, fósforo 5.2 mg%.
El 28/02/2011 se realizó exéresis del tumor craneal con el diagnóstico presuntivo quirúrgico macroscópico de meningioma. Permaneció en unidad de Terapia Intensiva 24 h, regresando posteriormente a sala de Clínica Médica. Cursó postoperatorio sin complicaciones, otorgándose el alta el 9/3/2011.
El examen histopatológico informó fragmentos de tejido óseo y meníngeo infiltrados por una proliferación neoplásica atípica de disposición difusa y compacta constituida por células de núcleos grandes desiguales con citoplasma eosinófilo y numerosas mitosis. Acompañaban focos necróticos y algunas formas gigantes con núcleos polilobulados. Se efectuaron inmunomarcaciones para ACL (+++), CD3 (+ en elementos remanentes), CD20 (+++), MELAN A (-), desmina (-) y CK AE1-AE3 (-), CD30 destacó algunos elementos positivos. Diagnóstico histopatológico: linfoma no Hodgkin difuso de células grandes, inmunofenotipo B. Se reinternó el 12/03/2011 para estadificación y tratamiento. Al examen físico se constató nueva tumoración en región frontal derecha y en región occipitoparietal izquierda de 4x4 cm aproximadamente, otra en región parotídea derecha de 6x7 cm, una adenopatía retroauricular derecha (lesiones ausentes tres días antes) y progresión de lesión esternal, ya observada en la internación anterior (Fig. 2). Agregó dolor en región anterior de muslo izquierdo que aumentó con la movilización, y progresión de dolor esternal, con regular respuesta a la analgesia y requerimiento de morfina.
La serología para HIV fue negativa, beta 2 microglobulina: 2.6 mg/l y PAMO normal. Se realizó nueva TAC que evidenció progresión de las lesiones en cráneo, esternón y fémur izquierdo.
Con el resultado de la anatomía patológica inició tratamiento CHOPP-R. Una semana después del inicio de la quimioterapia se observó una franca reducción de todas las lesiones y la paciente fue dada de alta. Posteriormente continuó seguimiento ambulatorio por Hematología, sin evidenciarse recaída después de los seis ciclos de quimioterapia.
Discusión
El linfoma primario de hueso (LPH) es inusual, descripto por primera vez por Oberling en 1928. La primera serie de casos se publicó en 1939 por Jackson y Parker bajo la denominación de sarcoma de células reticulares primarias del hueso.
El LPH comprende entre el 3 y el 7% de todos los tumores óseos, menos del 2% de todos los linfomas y 3 a 5% de los linfomas extraganglionares1, 2. Este tumor suele presentarse alrededor de la quinta década de la vida, con leve predominio del sexo masculino (1:1 a 1:1.8)2, 4, 5.
Se presenta habitualmente con dolor óseo que no mejora con el reposo, pudiendo observarse, como ocurrió en nuestra paciente, masa palpable por extensión a tejidos blandos por contigüidad en hasta la mitad de los casos. Otros síntomas pueden incluir síntomas B (fiebre, pérdida de peso y sudoración nocturna; que tampoco presentó), fracturas patológicas (más común en la afectación del fémur), compresión medular (por afectación vertebral) y tumoraciones2, 6.
Los sitios más frecuentemente afectados son los huesos largos, en especial el fémur7, que en nuestra paciente se vio comprometido en forma secundaria, seguido por la pelvis y posteriormente el compromiso axial. El compromiso de múltiples huesos es inhabitual, desde la ausencia de lesiones múltiples en la mayoría de los informes, alcanzando el 25% en algunas series6, 8-10. El compromiso inicial en calota, como se observó en este caso, resulta excepcional, y más aún por haberse observado dicha presentación multicéntrica.
En concordancia con la distinción entre linfoma óseo primario de secundario, la mayoría de los pacientes se presentan con enfermedad con estadio limitado4.
Histopatológicamente, en todas las series el linfoma difuso de células grandes B es el causante del 68 al 85% de los casos1, 4, 5, 7, 11. Otros subtipos descriptos son el linfoma de Burkitt, leucemia/linfoma linfoblástico B1, folicular4, 11, de células B pequeñas11 y de células T4.
En relación a la supervivencia, se han descripto diferentes factores pronósticos, de los cuales el que tendría mayor peso es el estadio al momento de iniciar tratamiento4,10. Otros factores vinculados con mejor evolución son la edad menor a 40 años, el uso de tratamiento combinado, la ausencia de síntomas B, niveles de LDH normal y el género femenino4, 5, 12.
Dado lo infrecuente de esta forma no se han publicado consensos ni recomendaciones de tratamiento. En la mayoría de las series de casos publicadas se ha sugerido el uso de R-CHOPP con o sin el agregado de radioterapia. En nuestro caso se evidenció una muy buena respuesta a este esquema quimioterápico, observándose reducción de todas las lesiones (en calota, periesternal y fémur). El rituximab ha demostrado un gran impacto en la supervivencia en diversas series.
Un aspecto de reciente desarrollo es el dosaje del receptor sérico soluble de IL - 2. Esta determinación podría ocupar un lugar como marcador tumoral en pacientes con tumores óseos12, 13, siendo además de utilidad para la valoración de la respuesta al tratamiento y frente a la sospecha de recidiva.
Como estudio complementario, la tomografía por emisión de positrones (PET) posee una mayor sensibilidad que la TAC, fundamentalmente en ganglios en rango no adenomegálico, bazo y médula ósea. Moog y colaboradores identificaron una mejoría en la estadificación del 16% en enfermedades linfoproliferativas por PET en comparación con TAC. En nuestro caso de linfoma primario de hueso, la TAC fue suficiente para identificarlo dado el gran compromiso que presentaba14.
Los aspectos más destacables del caso presentado son lo inusual de la presentación multicéntrica, y la poco frecuente localización de la lesión primaria a nivel de la calota. Asimismo resultó notable la rápida progresión de las lesiones bajo comparación clínica y por TAC, como así también la notoria respuesta clínica con el tratamiento instaurado.
Conflictos de interés: Ninguno a declarar.
1. Maruyama D, Watanabe T, Beppu Y, et al. Primary bone lymphoma: a new and detailed characterization of 28 patients in a single-institution study. Jpn J Clin Oncol 2007; 37: 216-23. [ Links ]
2. LaCasce A, Freedman A, DeLaney T, Connor R. Primary lymphoma of bone. UptoDate. En: http://www.uptodate.com/contents/primary-lymphoma-of-bone; consultado 20/3/2012. [ Links ]
3. Kitsoulis P, Vlychou M, Papoudou-Bai A, et al. Primary lymphomas of bone. Anticancer Res 2006; 26: 325-37. [ Links ]
4. Ramadan KM, Shenkier T, Sehn LH, Gascoyne RD, Connors JM. A clinicopathological retrospective study of 131 patients with primary bone lymphoma: a population-based study of successively treated cohorts from the British Columbia Cancer Agency. Ann Oncol 2007; 18: 129-35. [ Links ]
5. Beal K, Allen L, Yahalom J. Primary bone lymphoma: treatment results and prognostic factors with long-term follow-up of 82 patients. Cancer 2006; 106: 2652-6. [ Links ]
6. Horsman JM, Thomas J, Hough R, Hancock BW. Primary bone lymphoma: a retrospective analysis. Int J Oncol 2006; 28: 1571-5. [ Links ]
7. Qureshi A, Ali A, Riaz N, Pervez S. Primary non-hodgkin's lymphoma of bone: experience of a decade. Indian J Pathol Microbiol 2010; 53: 267-70. [ Links ]
8. Heyning FH, Hogendoom PC, Kramer MH, et al. Primary non-Hodgkin's lymphoma of bone: a clinicopathological investigation of 60 cases. Leukemia 1999; 13: 2094-8. [ Links ]
9. Ford DR, Willson D, Sothi S, Grimer R, Spooner D. Primary bone lymphoma: treatment and outcome. Clin Oncol (R. Coll Radiol) 2007; 19: 50-5. [ Links ]
10. Ostrowky ML, Unni KK, Banks PM, et al. Malignant lymphoma of bone. Cancer 1986; 58: 2646-55. [ Links ]
11. Zinzani PL, Carrillo G, Ascani S, et al. Primary bone lymphoma: experience with 52 patients. Haematologica 2003; 88: 280-5. [ Links ]
12. Yabe H, Ueno H, Ochi K, Morioka H, Yabe H, Terai C. Possible clinical significance of serum soluble interleukin- 2 receptor level in primary bone lymphoma: two case reports. Case Rep Oncol 2011; 4: 125-31. [ Links ]
13. Akahane T, Shimizu T, Isobe K, Yoshimura Y, Kato H. Serum soluble interleukin-2 receptor levels in patients with malignant lymphoma of bone. J Orthop Sci 2009; 14: 248-52. [ Links ]
14. Even-Sapir, Lievshitz G, Perry C, Herishanu Y, Lerman H, Metser U. Fluorine-18 fluorodeoxyglucose PET/CT patterns of extranodal involvement in patients with Non- Hodgkin lymphoma and Hodgkin's disease. Radiol Clin North Am 2007; 45: 697-709. [ Links ]
Recibido: 25-11-2011
Aceptado: 21-6-2012
CASUÍSTICA
Tratamiento endovascular de una fuga paraprotésica mitral con dispositivo Amplatzer®
Alberto Sciegata1, José A. Álvarez1, Felipe Deketele2, José Alonso1, Jorge G. Allín1, Guillermo Migliaro1
1Servicio de Hemodinamia y Cardiología Intervencionista,
2Servicio de Cardiología, Hospital Alemán, Buenos Aires
Dirección postal: Dr. José A. Álvarez, Servicio de Hemodinamia y Cardiología Intervencionista, Hospital Alemán, Av. Pueyrredón 1640, 1118 Buenos Aires, Argentina
Fax: (54-11) 4309-6400 e-mail: jalvarez@hospitalaleman.com.ar
Resumen
El leak o fuga paraprotésica mitral se presenta entre el 5 y el 17% de los pacientes tratados con cirugía de reemplazo valvular. En general, los defectos son únicos, la mayoría se encuentran localizados en la región postero-medial del anillo valvular y solo la tercera parte produce reflujo de grado grave. El cierre percutáneo por vía endovascular es una alternativa terapéutica válida en pacientes con elevado riesgo para re-operación. La estrategia de abordaje depende de la localización, tamaño, morfología y relaciones adyacentes del o los defectos. El procedimiento debe ser realizado por profesionales con experiencia en el tratamiento de cardiopatías estructurales y en el manejo de estos dispositivos de cierre, y se considera imprescindible la utilización de un ecocardiograma transesofágico tridimensional. Se presenta el caso de un paciente con una fuga paraprotésica valvular mitral que fue cerrada con un dispositivo Amplatzer ® introducido en forma percutánea desde la vena femoral.
Palabras clave: Fuga paraprotésica; Cierre percutáneo; Amplatzer ®; Tratamiento endovascular; Válvula mitral
Abstract
Percutaneous closure of a mitral paraprosthetic leak with an Amplatzer® device. Mitral paraprosthetic leaks are present in 5 to 17% of patients who receive valve replacement surgery. Overall, the defects are single, most of them are located in the postero-medial region of the annulus, and only one third produce a severe reflux. Percutaneous closure by endovascular surgery is a valid therapeutic alternative in patients at high risk for re-operation. The approach depends on the location, size, morphology and relationships or neighboring defects. The procedure must be performed by professionals with experience in the treatment of structural heart disease and in the management of these closure devices. Guidance with three dimensional transesophageal echocardiography is considered essential. A case of a mitral paraprosthetic leak that was closed with an Amplatzer ® device introduced percutaneously from the femoral vein is here presented.
Key words: Paraprosthetic leak; Percutaneous closure; Amplatzer ®; Endovascular closure; Mitral valve
En los EE.UU. se realizan aproximadamente 9500 cirugías de reemplazo valvular mitral (RVM) por año (60% aisladas, 25% asociadas a cirugía de revascularización miocárdica y 15% asociadas a reemplazo valvular aórtico) con una mortalidad intrahospitalaria del 6%1. En nuestro país, el registro anual CONAREC XIV informó que en el período 2007-08 se realizaron 169 RVM en los principales centros cardioquirúrgicos de la Argentina, con una mortalidad intrahospitalaria del 10.65%2.
El leak o fuga paraprotésica mitral (FPPM) se presenta como un flujo retrógrado anormal entre la sutura de la prótesis y el anillo de la válvula nativa. Se trata de una complicación que se presenta entre el 5 y el 17% de los casos3, 4, aunque su incidencia varía considerablemente en las distintas series, dependiendo del tiempo al diagnóstico y del método utilizado para detectarlas. Chen y col. evidenciaron que la incidencia del FPPM era mayor utilizando ecocardiograma transesofágico (ETE) como herramienta diagnóstica en comparación con el ecocardiograma transtorácico (ETT) (16% vs. 9.8%)5. Ionescu y col., en el primer ensayo clínico que estudió de manera prospectiva la presentación de FPPM con ETE, encontraron, sobre 117 RVM, una incidencia del 33% cuando el estudio se realizaba precozmente (postquirúrgico inmediato), cifra que descendía al 15% al año6.
Entre los factores predisponentes más relevantes para la formación del FPPM se encuentran los relacionados a la técnica de sutura (ej. uso de pledgets, suturas continuas), al tipo de válvula utilizada (17% mecánicas vs. 7% biológicas, p 0.05), a las características anatómicas del anillo y a la presencia de infecciones post-quirúrgicas6, 7. Es de destacar que solo la tercera parte de las FPPM son de grado grave y que en el 73% de los casos son únicas. Los defectos se encuentran localizados, principalmente, en la región postero-medial del anillo valvular (76%).
La manifestación clínica habitual es la disnea, pero pueden presentarse también con anemia hemolítica y endocarditis infecciosa6-8.
A continuación se presenta el caso de un paciente con una FPPM de grado grave y reiteradas internaciones por insuficiencia cardíaca, a quien se le realizó el cierre percutáneo del defecto por vía endovascular con un dispositivo Amplatzer ® guiado por ETE tridimensional.
Caso clínico
Paciente de 74 años con cardiopatía coronaria e insuficiencia mitral grave que recibió cirugía de revascularización e implante de una válvula biológica mitral St. Jude N° 22. En el postoperatorio inmediato evolucionó con mediastinitis que requirió tratamiento prolongado con antibioticoterapia endovenosa y epiploplastia torácica reconstructiva.
Durante su evolución ambulatoria comenzó al sexto mes con disnea asociada a signos de sobrecarga hídrica, por lo que fue internado en varias oportunidades con respuesta parcial al tratamiento médico convencional. El ETT evidenció la presencia de una FPPM, con un jet de regurgitación hacia la aurícula izquierda de grado moderado. El ETE mostraba un normal funcionamiento de la válvula mitral protésica, con una solución de continuidad (leak o fuga) entre el anillo y el septum interauricular, en el cuadrante postero-medial, de 5.5 mm de diámetro. El paciente evolucionó desfavorablemente, con poca respuesta al tratamiento médico por lo que, ante el elevado riesgo para realizar una re-operación, se decidió el cierre percutáneo del defecto por vía endovascular con un dispositivo Amplatzer ® bajo guía de ETE tridimensional.
En la Sala de Cateterismos y bajo anestesia general se localizó el orificio paraprotésico bajo guía ecocardiográfica en el cuadrante postero-medial del anillo valvular (Fig. 1). Por punción de la vena femoral derecha y según técnica habitual, a través de una punción trans-septal se avanzó una vaina de Mullins hacia la aurícula izquierda y a continuación se realizó un abordaje retrógrado a través de la arteria femoral derecha posicionando un catéter diagnóstico Simmons I 5F (Cordis™) dentro del ventrículo izquierdo. Bajo asistencia fluoroscópica y de ETE tridimensional, con una guía hidrofílica de 0.035 pulgadas y 260 cm de longitud se atravesó el orificio paraprotésico en forma retrógrada hacia la aurícula izquierda posicionando el extremo de la guía en la vena pulmonar superior izquierda, se capturó este extremo con un lazo dedicado introducido por la vaina de Mullins y se retiró este extremo de la guía hacia la ingle fabricando de este modo un loop con una única guía desde la vena hacia la arteria femoral. A continuación se retiró la vaina y se avanzó desde la vena el sistema de liberación (vaina) del dispositivo (Amplatzer ® TorqVue Delivery System) cuyo extremo se posicionó en la aorta supravalvular retirando la guía 0.035"; en esta posición, se avanzó desde la vena y por la vaina un dispositivo para comunicación inter-ventricular (Amplatzer ® Muscular VSD occluder), y se comenzó la apertura retirando el sistema hasta que el dispositivo totalmente abierto quedó correctamente posicionado en ambas caras del defecto (Fig. 2). Se realizaron controles con angiografía en el ventrículo izquierdo y con ETE tridimensional observándose un leve reflujo paraprotésico. Luego se procedió a liberar el oclusor en la forma habitual.

Fig. 1.- Imagen ecocardiográfica tridimensional de la válvula protésica mitral (VPM) y el orificio paraprotésico (OP) responsable de la fuga.

Fig. 2.- Imagen ecocardiográfica tridimensional del dispositivo Amplatzer ® (vista superior) liberado.
El paciente evolucionó favorablemente, sin otros signos de insuficiencia cardiaca, y fue dado de alta a las 48 h de la intervención. Al tercer mes del procedimiento se encuentra con disnea en clase funcional I, sin signos de insuficiencia cardiaca, sin hemólisis y sin complicaciones relacionadas al procedimiento; el ETT muestra un correcto funcionamiento de la prótesis mitral y de la válvula aórtica y ausencia de reflujo paraprotésico.
Discusión
La mayoría de las FPPM que se presentan en la evolución de los RVM son leves o moderadas y los pacientes permanecen asintomáticos u oligo-sintomáticos. Sin embargo, Genomi y col., sobre la base de un registro retrospectivo de 96 pacientes con FPPM, evidenciaron una disminución significativa de la mortalidad a 1, 5 y 10 años (2% vs. 10% 1 año, 10% vs. 25% 5 años, 12% vs. 32% 10 años, p 0.03) y mejoría de la clase funcional en aquellos pacientes a quienes se les había decidido realizar un tratamiento quirúrgico de la fuga, en relación al grupo que continuó con el tratamiento médico habitual9.
El tratamiento clásico en FPPM sintomática o con anemia hemolítica que requiere de transfusiones es la cirugía, pero muchas veces se encuentra limitada en su aplicación por el alto riesgo que conlleva la re-operación de estos pacientes. En algunas series publicadas la mortalidad luego de una 1a, 2a y 3a re intervención asciende al 5%, 8% y 18.8%, respectivamente10.
El cierre percutáneo por vía endovascular se ha establecido en estos últimos años como una alternativa terapéutica válida para el tratamiento de fugas paraprotésicas mitrales o aórticas. En la literatura internacional existen informes de casos aislados y pequeñas series comunicando un éxito técnico global del 87-90% y escaso número de complicaciones graves relacionadas al procedimiento (2-3% de mortalidad intrahospitalaria)11, 12. Recientemente, Sorajja y col. publicaron la mayor serie de casos de cierre percutáneo de fugas con un seguimiento medio de 11 meses (126 pacientes, 78% mitrales y 22% aórticos). En los casos de cierre de FPPM, la principal indicación fue la insuficiencia cardíaca y en las 2/3 partes la válvula afectada era mecánica en pacientes con un riesgo quirúrgico calculado aproximado del 7% (euroscore). En el 82% de los casos se utilizó ETE intra-procedimiento, y se realizó con técnica anterógrada en el 78% de los casos, utilizándose dispositivos Amplatzer ® en todos ellos (62% Vascular Plug II y 8% de VSO occluder) con un éxito técnico del 92%. La mortalidad a 30 días fue del 2.4% y al año del 23%, con una tasa de embolización del dispositivo del 1.6%13.
En el caso que presentamos, el orificio paraprotésico mitral producía un reflujo de grado moderado, con clínica de insuficiencia cardíaca de difícil tratamiento; su antecedente de mediastinitis y su regular estado general aumentaban en grado significativo el riesgo en una eventual nueva cirugía, por lo que se decidió realizar el cierre por vía endovascular. El abordaje combinado por vía arterial y venosa se eligió teniendo en cuenta la localización del defecto y la dificultad para cruzarlo desde la aurícula.
Es importante tener en cuenta que para realizar este tipo de procedimientos se requiere de una participación multidisciplinaria con especialistas en intervencionismo endovascular y ecocardiografía, habituados al control y visualización de estos defectos y dispositivos de cierre, y de la tecnología para la obtención de imágenes ultrasónicas tridimensionales En este sentido, algunos autores sugieren que para realizar este tipo de procedimientos es imprescindible la guía con ETE tridimensional14, 15.
Las mayores limitaciones están relacionadas a la presencia de trombos intracavitarios y a las características anatómicas del orificio paraprotésico. Es importarte definir la cuantificación de la fuga, la localización circunferencial del defecto, forma, tamaño y relación con las diferentes estructuras adyacentes. La vía de abordaje anterógrada (vena), retrógrada (arteria) y el tipo de dispositivo dependerán de la correcta evaluación del o los defectos, para lo cual consideramos imprescindible obtener imágenes con ETE tridimensional, el que además será de gran ayuda durante el posicionamiento y liberación del dispositivo de cierre.
Es relevante también mencionar que todos los dispositivos utilizados actualmente para el cierre de estos defectos no fueron diseñados con este propósito (indicación "off-label"), por lo cual el empleo de nuevos dispositivos elaborados para este fin podrá ofrecer mejores resultados técnicos y clínicos con un menor riesgo de complicaciones.
Conflictos de interés: Los autores declaran no tener conflictos financieros ni personales que hayan influenciando la elaboración del presente manuscrito.
1. A Report from the STS National Database Committee and the Duke Clinical Research Institute. En: www.STS.org; consultado el 03/02/2012. [ Links ]
2. Lowenstein Haber D, Guardiani F, Pieroni P, et al. Realidad de la cirugía cardíaca en la República Argentina. Registro CONAREC XVI. Rev Argent Cardiol 2010; 78: 228-37. [ Links ]
3. Remadi JP, Bizouarn P, Baron O, et al. Mitral valve replacement with the St. Jude medical prosthesis: a 15-year follow-up. Ann Thorac Surg 1998; 66: 762-7. [ Links ]
4. Dávila-Román V, Waggoner A, Kennard E, et al. Prevalence and severity of paravalvular regurgitation in the artificial valve endocarditis reduction trial (AVERT) echocardiography study. J Am Coll Cardiol 2004; 44: 1467-72. [ Links ]
5. Chen YT, Kan MN, Chen JS, et al. Detection of prosthetic mitral valve leak: a comparative study using transesophageal echocardiography, transthoracic echocardiography, and auscultation. J Clin Ultrasound 1990; 18: 557-61. [ Links ]
6. Ionescu A, Fraser G, Butchart E. Prevalence and clinical significance of incidental paraprosthetic valvar regurgitation: a prospective study using transoesophageal echocardiography. Heart 2003; 89: 1316-21. [ Links ]
7. Hammermeister K, Sethi G, Henderson W, Grover F, Oprian C, Rahimtoola S. Outcomes 15 years after valve replacement with a mechanical versus a bioprosthetic valve: final report of the veterans affairs randomized trial. J Am Coll Cardiol 2000; 36: 1152-8. [ Links ]
8. Genoni M, Franzen D, Tavakoli R, et al. Does the morphology of mitral paravalvular leaks influence symptoms and hemolysis? J Heart Valve Dis 2001; 10: 426-30. [ Links ]
9. Genoni M, Franzen D, Vogt P, et al. Paravalvular leakage after mitral valve replacement: improved long-term survival with aggressive surgery? Eur J Cardiothorac Surg 2000; 17: 14-9. [ Links ]
10. Expósito V, García-Camarero T, Bernal J, et al. Reintervenciones múltiples sobre la válvula mitral: 30 años de experiencia. Rev Esp Cardiol 2009; 62: 929-32. [ Links ]
11. Alonso-Briales J, Muñoz-García A, Jiménez-Navarro M, et al. Utilización de los dispositivos Amplatzer para el cierre de fugas perivalvulares. Rev Esp Cardiol 2009; 62: 442-6. [ Links ]
12. Ruiz C, Roubin G, Cohen H, et al. Clinical outcomes in patients undergoing percutaneous closure of periprosthetic paravalvular leaks. J Am Coll Cardiol 2011; 58: 2210-7. [ Links ]
13. Sorajja P, Cabalka A, Hagler D, Rihal C. Long-term follow-up of percutaneous repair of paravalvular prosthetic regurgitation. J Am Coll Cardiol 2011; 58: 2218-24. [ Links ]
14. Bogunovic N, Faber L, Scholtz W, Mellwig K, Horstkotte D, Van Buuren F. Real-time three-dimensional transoesophageal echocardiography during percutaneous transcatheter occlusion of mitral periprosthetic paravalvular leak. Eur J Echocardiogr 2011; 12: E27. [ Links ]
15. Kim M, Casserly I, Garcia J, Klein A, Salcedo E, Carroll J. Percutaneous transcatheter closure of prosthetic mitral paravalvular leaks. Are we there yet? Am Coll Cardiol Intv 2009; 2: 81-90. [ Links ]
Recibido: 8-3-2012
Aceptado: 16-7-2012
CASUÍSTICA
Histoplasmosis diseminada, linfopenia, y síndrome de Sjögren
Horacio F. Rodrigo, Rodolfo N. Stavile, Sabino Deleo
Servicio de Clínica Médica, Sala D, Hospital Interzonal General de Agudos Gral. San Martín, La Plata, Buenos Aires
Dirección postal: Dr. Horacio F. Rodrigo, Calle 133 Nº 1461, 1900 La Plata, Buenos Aires, Argentina
Fax: (54-221) 483 3292 e-mail: hrodrigo@intramed.net
Resumen
El síndrome de Sjögren es una enfermedad autoinmune caracterizada por disminución de las secreciones de las glándulas exocrinas; puede presentar también diversas alteraciones hemáticas, entre ellas linfopenia. Presentamos el caso de un varón de 28 años que consultó por cefalea de un mes de evolución a la que se agregaron en las últimas 48 horas vómitos y fiebre. Presentaba lesiones en piel de tronco y cara; no tenía rigidez de nuca. Se demostró infección por Histoplasma capsulatum var. capsulatum en piel y líquido cefalorraquídeo, linfopenia, anticuerpos anti Ro-SSA positivos, baja concentración del trazador en centellograma de glándulas salivales e infiltración linfocitaria en glándulas salivales, lo que permitió confirmar al diagnóstico de síndrome de Sjögren. El tratamiento con anfotericina liposomal e itraconazol mejoró el cuadro clínico. Comunicamos este caso para referir que una infección oportunista, como la histoplasmosis diseminada, puede ser una forma poco común de presentación del síndrome de Sjögren.
Palabras clave: Histoplasmosis; Linfopenia; Síndrome de Sjögren
Abstract
Disseminated histoplasmosis, lymphopenia and Sjögren´s syndrome. Sjögren's syndrome is an autoimmune disease characterized by decreased exocrine gland secretions; patients may also present several hematological abnormalities, like lymphopenia. We describe the case of a 28 year old man who complained of headache a month of duration, with fever and vomiting in the last 48 hours. He also presented skin lesions on trunk and face, without neck stiffness. The diagnosis of duration infection was confirmed by culture from the skin biopsy and spinal fluid specimens; in addition, the presence of lymphopenia, positive anti Ro-SSA antibodies, poor concentration of the tracer in scintigraphy and lymphocytic infiltration in salivary glands confirmed the diagnosis of Sjögren's syndrome. The patient was successfully treated with liposomal amphotericin and itraconazole. We report this case to emphasize that opportunistic infections, such as disseminated histoplasmosis, may be an uncommon clinical presentation of Sjögren's syndrome.
Key words: Histoplasmosis; Lymphopenia; Sjögren's syndrome
El síndrome de Sjögren (SS) es una enfermedad autoinmune sistémica, en la que se produce una infiltración linfocítica que reemplaza el epitelio de glándulas exocrinas y provoca disminución de las secreciones, principalmente de las salivales y lagrimales. Es primario (SSp) cuando no existe enfermedad autoinmune previa y secundario cuando la hay. El SSp es más frecuente en mujeres y tiene una prevalencia de 0.5 a 1% de la población adulta en EE.UU. y algunos países europeos, siguiendo los criterios diagnósticos del Consenso Americano- Europeo1, 2; no existen datos de prevalencia en la Argentina. Dentro de sus manifestaciones hemáticas, la linfopenia no es un hallazgo raro3 y favorece la aparición de infecciones oportunistas como la histoplasmosis.
La histoplasmosis es una micosis sistémica que aparece principalmente en los inmuno-suprimidos; se puede manifestar de manera diseminada con amplia variedad de manifestaciones clínicas. El sistema nervioso central (SNC) es uno de los lugares afectados, principalmente como meningitis crónica4, 5.
Presentamos un paciente que realiza su primera consulta por un cuadro de síndrome meníngeo crónico; este cuadro es raramente la primera manifestación del SS.
Caso clínico
Varón de 28 años de edad sin antecedentes relevantes. Comienza alrededor de 30 días antes de la consulta, con cefalea holocraneana continua que lo despertaba por la noche, acompañada de equivalentes febriles y astenia. Dos semanas previas al ingreso a nuestro hospital consultó en otro establecimiento, donde se le indicó amoxicilina/ácido clavulánico por 10 días, con diagnóstico de sinusitis aguda. En las últimas 48 horas se intensificó la cefalea, acompañándose de vómitos y fiebre.
Trabajaba como empleado de limpieza en edificios donde habitan palomas y murciélagos. No refirió haber viajado.
El examen físico revela regular estado general, febril (38.5º C axilar); en la piel se observaba pequeña úlcera en mentón, pápulas eritematosas violáceas en tórax y abdomen. No presentó rigidez de nuca, ni signos focales del SNC. Los hallazgos destacados en el laboratorio fueron hematocrito 35%, hemoglobina 11.6 g/dl, leucocitos 5900 /mm3 (linfocitos 7%), eritrosedimentación 50 mm/1 h, TGO 71 UI/l y TGP 152 UI/l.
Las radiografía de tórax, ecografía abdominal y tomografía computarizada de encéfalo sin contraste, fueron normales. Se efectuó punción lumbar que reveló líquido claro, células: 15/ mm3 con franco predomino de linfocitos, hematíes 48/mm3, proteínas 0.99 g/l, glucorraquia 0.15 g/l.
Se plantearon diagnósticos diferenciales de meningoencefalitis con líquido cefalorraquídeo (LCR) claro, tales como bacteriana decapitada, tuberculosa, micótica, o viral. Se solicitaron estudios y se inició tratamiento empírico con ceftriaxona intravenosa 2 g c/12 h. A las 48 horas evolucionó sin fiebre y sin cefalea; los cultivos para bacterias y exámenes microscópicos para micobacterias y VDRL en LCR fueron negativos.
Por la linfopenia, se amplió la investigación de infecciones; las serologías para virus de: inmunodeficiencia humana, linfotrópico humano tipo 1, de las hepatitis A, B y C también fueron negativas, al igual que PCR para enterovirus, herpes tipo 1, varicela zoster, citomegalovirus y de Epstein Barr en LCR. La antigenemia y antigenorraquia para criptococo fueron también negativos.
Se tomaron biopsias de piel en una lesión del tronco y se solicitaron estudios inmunológicos.
Cumplió con 10 días de tratamiento con ceftriaxona y ante la buena evolución clínica se le otorgó el alta hospitalaria con seguimiento ambulatorio.
Posteriormente se recibieron los informes de micología: desarrollo de Histoplasma capsulatum var. capsulatum en la biopsia cutánea. En la anatomía patológica se observó presencia de granulomas crónicos no caseificantes.
Se reinterna afebril, con reaparición en los últimos 5 días de cefalea de intensidad moderada, continua, holocraneana, sin nauseas ni vómitos, y progresión de las lesiones cutáneas, con aparición de nuevas en cuero cabelludo. En ambos fondos de ojo se vieron múltiples lesiones blanco amarillentas.
Se realizó escarificación de la lesión de la cara: se observaron levaduras compatibles con Histoplasma capsulatum. En LCR se visualizó reacción de identidad frente a exoantígeno de Histoplasma capsulatum.
En la serología se detectan anticuerpos frente a exoantígenos de histoplasma en elevados títulos.
Se inició tratamiento con 300 mg/día de anfotericina liposomal.
En el examen hematológico persiste la linfopenia: 13% (637) de 4900/mm3 leucocitos; se midieron las poblaciones linfocitarias: CD3 14.9%, 95 células [valor de referencia (vr): 58-85%, 710 a 2300 células], CD4 7.8%, 50 células (vr: 32- 62%, 370 a 1540 células), CD8 5.2%, 33 células (vr: 12-45%, 183 a 1160 cel.). Relación CD4/CD8 1.5.
Se midieron proteínas totales: 74 g/l; albuminemia 37 g/l; proteinograma electroforético: albumina 50%, alfa1 1.2%, alfa2 6.3%, beta 11.1%, gamma 30.7%. La medición de inmunoglobulinas mostró IgG 2449 mg/dl (vr: 750 a 1600); IgA < 21 mg/dl (vr: 80 a 450); IgM 137.7 mg/dl (vr: 45 a 305).
Por persistencia de la linfopenia, se solicitaron estudios para enfermedades inmunológicas; el laboratorio reveló: anticuerpos antinucleares positivos 1/320 (patrón moteado fino denso) por inmunofluorescencia indirecta (IFI); anti Ro-SSA positivo a títulos elevados, por ELISA; factor reumatoideo por aglutinación, anti ADN por IFI, anti Sm, anti La-SSB, anti Scl70 por ELISA, negativos.
Pruebas de Schirmer, de Rosa de Bengala y de ruptura lagrimal: negativas para SS.
Se realizó centellograma de glándulas salivales con tecnecio 99: en la fase precoz se visualizaron las parótidas con sialectasias y concentración baja e irregular del trazador; las submaxilares no se visualizaron (Fig. 1).

Fig. 1.- Centellograma de glándulas salivales con baja e irregular concentración del trazador; no se observan las glándulas submaxilares
Biopsia de mucosa de labio: sialoadenitis crónica focal periductal con islotes linfocitarios (> 50 cada 4 mm2 de tejido glandular) y vasocongestión estromal sin evidencia de atrofia acinar, compatible con SS.
El diagnóstico de SS surge entonces de los anticuerpos anti RO-SSA positivos, el centellograma parotídeo y la biopsia de labio, de acuerdo con los criterios del Consenso Americano-Europeo2.
Evolucionó favorablemente, sin cefalea y con resolución de las lesiones cutáneas y las de ambos fondos de ojo. Cumplió 6 semanas de anfotericina liposomal y continuó tratamiento con itraconazol 200 mg/ 8 horas y cotrimoxazol 160/800 mg 3 veces/semana.
Concluimos entonces con el diagnóstico de histoplasmosis progresiva diseminada con compromiso meníngeo, como presentación de SS primario con grave linfopenia.
Discusión
La histoplasmosis es una micosis sistémica causada por el hongo dimorfo Histoplasma capsulatum, cuyo reservorio es el suelo en áreas donde hay gran cantidad de aves y murciélagos4. Presenta un amplio espectro de manifestaciones clínicas que van desde asintomáticas a formas diseminadas graves; estas últimas son resultado de una inmunidad celular deprimida5.
La infección se produce cuando los hongos se aspiran del ambiente, llegan a los pulmones y ahí germinan a levaduras. Los macrófagos las fagocitan y se diseminan a través de ellos. La inmunidad celular juega un rol preponderante en la recuperación. La falla en la capacidad destructora de los macrófagos parece ser una de las claves en el desarrollo de la enfermedad diseminada6. La mayoría de los enfermos son inmuno deprimidos. Ocasionalmente se observa en inmuno competentes, ya que el hongo se considera patógeno primario7. La alteración de la inmunidad celular, con disminución de los linfocitos CD4 por debajo de 200/mm3, es el principal factor de riesgo. Actualmente se ve con más frecuencia en los pacientes con síndrome de inmunodeficiencia adquirida (sida), pero también se la puede encontrar en pacientes que reciben corticosteroides o inmunosupresores, con neoplasias linfoproliferativas, linfocitopenia CD4 idiopática, diabetes, y en enfermedades autoinmunes como artritis reumatoidea, enfermedad de Crohn, lupus eritematoso sistémico, vasculitis primaria o como en nuestro caso SSp. La infección es más grave en pacientes con sida que en aquellos con otras inmunodeficiencias8, 9.
En áreas no endémicas el diagnóstico puede ser difícil si no se piensa en ella. Los principales síntomas son fiebre y síndrome de repercusión general (decaimiento, hiporexia, pérdida de peso).
La infección del SNC sucede en un 10% de las formas progresivas diseminadas y puede deberse tanto a una primoinfección como a una reactivación de una infección previa; puede presentarse como vasculitis e infartos isquémicos debido a invasión de las arterias intracraneales por el hongo, meningitis o hidrocefalia crónica, lesión granulomatosa ocupante de espacio en el parénquima cerebral (histoplasmoma) o embolismo cerebral secundaria a endocarditis. Las lesiones neurológicas más frecuentes son las meníngeas; los pacientes pueden presentar cefalea, fiebre, rigidez de nuca, crisis convulsivas y deterioro de la conciencia, configurando un cuadro de meningitis crónica4, teniendo en cuenta su tiempo de evolución de varias semanas. El diagnóstico de neurohistoplasmosis se establece mediante evidencia clínica de afectación del SNC y la positividad de alguno de los siguientes parámetros de laboratorio: a) anticuerpos de fijación de complemento positivos en el LCR; b) antígeno positivo en el LCR; c) aislamiento en cultivo del LCR o demostración histopatológica en tejido cerebral o meníngeo4, 10.
Este síndrome es una rara causa de meningitis aséptica recurrente11.
Las manifestaciones cutáneas afectan principalmente la cara, los miembros y el tronco, caracterizándose por el polimorfismo lesional: pápulas, nódulos, placas, pústulas ulceraciones, costras, lesiones umbilicadas símil molusco contagioso, lesiones acneiformes o herpetiformes, vegetaciones y seudofoliculitis, entre otras. De ellas se pueden tomar fácilmente muestras para análisis histopatológico y cultivos12.
Sin una explicación clara, las lesiones cutáneo mucosas se describen con más frecuencia en casos oriundos de America Latina12, 13.
Puede haber compromiso pulmonar, digestivo o de las glándulas adrenales; los casos graves se presentan con coagulopatía, insuficiencia hepática o renal8.
El SS puede tener dentro de sus manifestaciones hematológicas anemia, trombocitopenia, agranulocitosis, leucopenia, linfopenia, gammapatía monoclonal (más frecuente en los pacientes con hepatitis por virus C) y enfermedad linfoproliferativa, principalmente linfoma no Hodgkin de células B3. Tienen riesgo de muerte incrementado por linfoma maligno. La linfopenia, debida principalmente a la subpoblación CD4, no es un raro hallazgo del SSp ya que ha sido notificada en el 5% de los pacientes3; se observa con más frecuencia en los pacientes con anti Ro-SS-A positivos, y representa el grupo de mayor riesgo para el desarrollo de linfoma no Hodgkin14. En nuestro paciente también observamos disminución de todas las poblaciones linfocitarias T y déficit de Ig A, que se ha visto asociada a diversas enfermedades autoinmunes, entre ellas el SS.
Las manifestaciones sistémicas del SS se han descripto hasta en el 80% de los casos15.
Este caso clínico muestra que la histoplasmosis diseminada con compromiso meníngeo puede ser el cuadro inicial de enfermedades con deficiencia de la inmunidad, y que el SS raramente se manifiesta inicialmente por complicaciones infecciosas secundarias al déficit inmunitario. Esta entidad debería ser considerada en los diagnósticos diferenciales de las meningitis con LCR claro con trastornos inmunitarios.
Conflictos de interés: No existen conflictos de interés con respecto a este trabajo.
1. Moutsopoulos HM. Síndrome de Sjögren. En: Kasper DL, Braunwald E, Fauci AS, Hauser SL, Longo DL, Jameson JL eds. Principios de Medicina Interna. 16ª ed. Mexico: McGraw-Hill Interamericana, 2005, p 2190-3. [ Links ]
2. Vitali C, Bombardieri S, Jonsson R, et al. Classification criteria for Sjogren´s syndrome: a revised version of the European criteria proponed by the American-European Consensus Group. Ann Rheum Dis 2002; 61: 554-8. [ Links ]
3. Manganelli1 P, Fietta1 P, Quaini F. Hematologic manifestations of primary Sjögren's syndrome. Clin Exp Rheumatol 2006; 24: 438-48. [ Links ]
4. del Brutto, OH. Infecciones micóticas del sistema nervioso central. Rev Neurol 2000; 30: 447-59. [ Links ]
5. de Fernández MIG, Negroni R, Arechavala A. Absceso tibial causado por histoplasma capsulatum. Medicina (B Aires) 2001; 61: 191-2 [ Links ]
6. Wheat J, Kauffman C. Pathogenesis and clinical manifestations of disseminated histoplasmosis. En: UpToDate, Waltham, MA: Basow DS (Ed), 2011. [ Links ]
7. Torres-Rodríguez JM, Segura-Roca G, Coll J. Histoplasmosis en un varón inmunocompetente manifestada 45 años después de la infección. Rev Iberoam Micol 2009; 26: 244-6. [ Links ]
8. Duncan RA, von Reyn CF, Alliegro GM, Toossi Z, Sugar AM, Levitz SM. Idiopathic CD4 + T-lymphocytopenia: four patients with opportunistic infections and no evidence of HIV infection. N Engl J Med 1993; 328: 393-8. [ Links ]
9. Schulze-Koops H. Lymphopenia and autoinmune disease, Artritis Research & Therapy 2004; 6:178-80. [ Links ]
10. Kauffman, CA. Diagnosis of histoplasmosis in immunosuppressed patients. Current Opinion in Infectious Diseases 2008; 21: 421-5. [ Links ]
11. Vázquez F, Beguelin Y, Schutz N, Mayorga L. Colagenopatía y meningitis aséptica recurrente en una paciente de 88 años. Medicina (B Aires) 2004; 64: 54-6. [ Links ]
12. Peching G, Kumakawa Z, Galarza C. Histoplasmosis diseminada aguda: enfoque de manifestaciones cutáneas. Folia Dermatol Perú 2004; 15: 172-5. [ Links ]
13. Cunha VS, Zampese MS, Aquino VR, Cestari TF, Goldani LZ. Mucocutaneus manifestation of disseminated histoplasmosis in patients with acquired inmunodeficiency syndrome: particular aspects in a Latin-American population. Clin Exp Dermatol 2007; 32: 250-5. [ Links ]
14. Mandl T, Bredberg A, Jacobsson LT, Manthorpe R, Henriksson G: CD4+ T lymphocytopenia- A frequent finding in anti-SSA antibody seropositive patients with primary Sjögren's syndrome. J Rheumatol 2004; 31: 726-8. [ Links ]
15. Zazzetti F, Rivero MA, Duartes Noe DE, et al. Frequency of systemic manifestations in patients with primary Sjogren's syndrome in Argentina. Reumatol Clin 2010; 6: 299-302. [ Links ]
Recibido: 3-4-2012
Aceptado: 18-6-2012
EDITORIAL
Serendipity en investigación
Serendipity is the gift for discovery
by accident and sagacity, in pursuit
of something else1
HORACE WALPOLE, 1754
Allá lejos y hace tiempo, en una escuela del Canadá, la maestra contó una historia muy divertida relacionada con la palabra serendipity - una bella palabra, según ella. Esta es la historia. Hace varios siglos en Serendip -antiguo nombre de Ceilán y actual Sri Lanka- tres Príncipes, a instancia del Rey, iniciaron un peregrinaje por varios países para observar las maravillas del mundo. En una ocasión, se encontraron con un hombre que les preguntó si no habían visto su camello. Los tres dijeron no haber visto al animal pero sucesivamente le preguntaron si el camello perdido 1) no era tuerto, 2) si le faltaba un diente, 3) si era rengo, 4) si llevaba al costado una alforja con manteca, y 5) del otro lado con miel, 6) si no transportaba una mujer y 7) si ésta no estaba embarazada. A todo el camellero contestó que sí y convencido que le habían robado el animal los denunció y fueron presos. Ante la acusación explicaron que eran tres viajeros que recorrían el mundo y que nunca habían visto el camello y que solo quisieron gastar una broma al camellero basándose en algunas observaciones realizadas en su viaje. Mientras tanto, el camello apareció y los Príncipes fueron liberados con la condición de que explicarán cómo sabían tanto sin haber visto al animal. Contestaron que: 1) como era tuerto había comido el pasto del lado que era malo, y no del otro donde era bueno; 2) por faltarle un diente se le habían escapado de la boca pelotones de rumia visibles en la senda; 3) había huellas de tres pezuñas y de una pata arrastrada; 4) las hormigas que vieron en un largo trecho indicaban que allí había caído manteca; 5) otro tanto ocurría con las moscas atraídas por la miel; 6) habían deducido que llevaba una mujer porque cerca del sitio donde el camello se había arrodillado vieron la huella de un pie pequeño y restos de orina, y 7) que estaba embarazada porque para incorporarse después de orinar había apoyado sus manos en el polvo dejando las huellas. La maestra explicó que los tres Príncipes habían descubierto cosas sin proponérselo y que eso era la definición de serendipity.
Sigo preguntándome si no habría soñado este episodio…
Un siglo más tarde, durante un viaje a Nueva York, encontré en Barnes y Noble (por 5 dólares) un libro1 titulado Serendipity and the Three Princes, from the Peregrinaggio of 1557, que cuenta esta historia con lujo de detalles: no sólo me recordó el cuento de mi maestra sino que fue la inspiración que le llevó a Rodolfo Pasqualini -mi esposo- a escribir el Editorial titulado Houssay y el serendipismo2. En aquel entonces (1981), por falta de una traducción de serendipity, inventó serendipismo (serendip+ismo) pero hoy veo en Wikipedia que se tradujo como serendipia3. ¡Que no es una palabra bella!
Según ese libro1, Horace Walpole (1717-1797) escritor inglés de renombre, fue el que acuñó la palabra serendipity en 1754, al final de una carta a un amigo, a quien le relataba el cuento Los tres Príncipes de Serendip,que catalogaba como this silly Persian fairy tale. La acuñaba serendip+ity (¡a very expressive word!) y la definía como descubrir cosas sin proponérselo. Esta fábula persa había sido traducida en 1557 como el Peregrinaggio di tre giovani figluoli del re di Serendippo por Michele Tramezzino y siguieron más traducciones en francés y en inglés hasta que la palabra serendipity llegó a emplearse cada vez más1-3.
En ciencia, se habla corrientemente del "descubrimiento por serendipity". En cuanto a Houssay, Pasqualini en el trabajo arriba mencionado2 concluye:
"...los innumerables trabajos que realizó Houssay, desde el momento en que le interesaron por primera vez hasta finalizarlos, se cumplieron en tiempos breves o prolongados, mediante una manipulación simple o compleja, pero diseñada de antemano con criterio riguroso, sin desviaciones especulativas, no obstante la inteligencia, la lucidez y la sagacidad que los alentaba, pero invariablemente sin la intervención de accidentes afortunados. Y es que las virtudes científicas de Houssay eran tan estrictas en su aposición -como las piedras de Machu Picchu- que no dejaban resquicios para el serendipismo."
En una palabra, no hubo serendipity en la "investigación houssayana".
Por su lado, Héctor Alonso también se ocupó del tema en un artículo en Medicina (B Aires)5 y en su libro Palabras, Palabras6 donde dice:
"...Utilisima como puede ser en medicina esta sagacidad para los hallazgos afortunados que constituyen la serendipity, y aceptamos que debe ser acompañada de la sagacidad para interpretar y aprovechar los hechos que crea el azar, en última instancia debe aceptarse que la medicina clínica no puede basarse en la esperanza de un golpe de suerte bien explotado...".
Sin embargo, no son pocas las veces en que serendipity está presente. Primero, habría que contrarrestar dos tipos de descubrimiento o breakthrough, como se suele decir en inglés. Por un lado, el llamado Principio de Arquímedes: el matemático lo descubrió un día al introducirse en la bañadera y observar cómo su cuerpo desplazaba una masa de agua equivalente al volumen sumergido: salió desnudo a la calle gritando ¡Eureka! Había encontrado lo que buscaba. Contrariamente, cuando interviene serendipity, la sorpresa es aun mayor y la exclamación cambia por: Qué curioso, esto no estaba en mis miras. Ambos tipos de descubrimiento producen una alegría sui generis, a cual más.
Tomemos algunos ejemplos. Milstein y Köhler ganaron el Premio Nobel 1984 por su descubrimiento de los anticuerpos monoclonales7, una técnica que salió mejor de lo esperado y que estaba dentro de un proyecto de investigación dedicado a estudiar las mutaciones somáticas de los genes de inmunoglobulinas responsables de la diversidad de los anticuerpos: estos genes fueron identificados por Susumu Tonegawo quien a su vez mereció el Premio Nobel 1987. Vale decir que Milstein y Köhler inventaron una técnica por serendipity, la cual los desvió de su proyecto original y se convirtió rápidamente en un boom para la industria farmacéutica, sin que ellos percibieran un solo centavo.
Recientemente, Gabriel Stekolschik enumera en Exactamente8 una larga serie de experimentos cuyos resultados dependieron de "El azar y la sagacidad" concluyendo que "los campos en donde ha sido más fértil es el de las innovaciones, como el teflón, el velcro, el celofán, la anilina, el nylon, el rayón, el neoprene y el polietileno".
Por mi parte, a través de muchos años de investigación, son tres los casos de descubrimiento por serendipity que tuve el placer de experimentar y que cuento en mi autobiografía8.
El primero fue uno de los primeros experimentos que llevé a cabo en el laboratorio de Hans Selye en la Universidad de McGill en Canadá:
"Por ese entonces, trabajaba en forma intensa, de ocho de la mañana a siete de la tarde, siempre en distintos experimentos con ratas. Uno de esta larga serie lo recuerdo muy bien porque debía inyectar una hormona, desoxicorticosterona, en la vena yugular. La rata elegida era tan mansa que sólo bastó, sin necesidad de anestesiarla, con amarrarla a un bloque de corcho. Cuando terminé con el procedimiento y liberé la rata, para mi sorpresa la encontré profundamente dormida. Inmediatamente, busqué a Selye. Miró y dijo: 'Hágalo de nuevo'. Tomé una nueva rata y repetí el experimento, con idéntico resultado. Selye dijo: 'Acabamos de descubrir -sin querer- el efecto anestésico de una hormona, y no hay duda que se trata de un auténtico descubrimiento, a breakthrough'. Entonces, dispuso que un técnico repitiera el experimento con diferentes hormonas y así determinó que todas ellas tienen un efecto anestésico, dosis-dependiente según la hormona. Sin embargo, como mi tema de tesis era otro, no tuve nada que ver con la confirmación del hallazgo".
El segundo caso ocurrió muchos años después, trabajando en cáncer experimental. Así lo cuento:
"Con mis ratones yo luchaba para obtener sangre suficiente a través de la vena de la cola o, eventualmente, del seno retroocular, pero las cantidades eran siempre muy escasas. Se me ocurrió implantar tubos de vidrio debajo de la piel del ratón. Al inocularlo con un antígeno, el ratón produciría anticuerpos que supuestamente podrían recogerse del líquido acumulado en el cilindro de vidrio. Empleamos como antígeno células de una leucemia de un ratón de la cepa AKR y las inyectamos en ratones BALB que producirían anticuerpos anti-leucemia AKR. Tratándose de cepas diferentes (alogeneicas), según las leyes de trasplante, las células no se reproducirían. Realizamos el experimento. A los catorce días, intervalo determinado para obtener anticuerpos séricos, buscamos la jaula con los seis ratones y, para nuestra sorpresa, estos habían desarrollado un tumor alrededor del cilindro de vidrio. Nos miramos con Juan (mi ayudante) y grité: '¡Eureka!'. (y pensé, Qué Curioso - no tendría que haber aparecido un tumor), Habíamos hecho crecer un tumor donde no debía. Lo que ocurre es que el "modelo del cilindro de vidrio", como se lo denominó, crea un sitio inmunológico privilegiado-un microambiente inflamatorio- que permite el crecimiento de células tumorales alogenéicas. Este prototipo experimental nos ha dado muchas satisfacciones a lo largo de los años".
Va el tercer caso:
"El llamado 'modelo del cilindro de vidrio' nos proporcionó otro breakthrough o descubrimiento inesperado. Una vez implantado debajo de la piel, este cuerpo extraño se recubre muy pronto de una membrana de fibrosis, muy apropiada para estudiar el efecto anti-fibromatogénico de la progesterona que había sido observado años antes en el laboratorio de Lipschütz en Chile y que había impresionado a Alfredo Lanari cuando me había visitado allí en 1943. En consecuencia, alrededor de 1982, Lanari empleó la progesterona para tratar pacientes con fibromatosis agresiva y obtuvo buenos resultados. Con su hija Claudia que estaba terminando su Licenciatura de Biología, nos propusimos dilucidar el mecanismo involucrado, empleando el modelo del cilindro de vidrio. Se consiguió una disminución de la capa de fibrosis confirmando el efecto anti-fibromatogénico de la hormona, especialmente cuando los pellets de progesterona eran implantados cerca del cuerpo extraño. Además, la administración subcutánea continuada de la hormona disminuyó significativamente la incidencia de fibrosarcomas por cuerpo extraño. Pero, inesperadamente, todas las hembras tratadas con progesterona desarrollaron adenocarcinomas de mama. Es de hacer notar que este descubrimiento pudo lograrse por tener un bioterio propio y facilidad para mantener ratones durante largo tiempo: los primeros tumores de mama tenían una latencia de un año, más de la mitad de la vida del animal. Esta inducción de cáncer de mama por progesterona aun en ausencia del cilindro de vidrio -como se comprobó muy pronto- abrió una nueva línea de trabajo, totalmente inesperada ya que dentro de las hormonas, los considerados carcinogénicos son los estrógenos, en general inhibidos por la progesterona. Por serendipity, estábamos en presencia de un nuevo modelo experimental que Claudia Lanari ha desarrollado primero conmigo y luego en el Instituto de Biología y Medicina Experimental donde ya dirige un importante grupo de investigación".
Investigación básica implica descubrir algo nuevo, en general, dentro de un proyecto determinado, con planes bien trazados. Esto corresponde al grito de Arquímedes, EUREKA, pero esa misma palabra brota aun más fuerte con lo inesperado. Cuando, durante la marcha de los experimentos, salta un "descubrimiento por serendipity", completamente inesperado (unsought for), se lo debe aprovechar ya que abre un nuevo rumbo, a veces más interesante que el original.
Christiane Dosne Pasqualini
1. Remer TG (editor). SERENDIPITY and the Three Princes from the Peregrinaggio of 1557. Norman: University of Oklahoma Press, 1965. [ Links ]
2. Pasqualini RQ. Houssay y el serendipismo. Medicina (B Aires) 1981; 41: 827-30. [ Links ]
3. Serendipia. En: http://es.wikipedia.org/wiki/Serendipia; consultado 28/05/2012. [ Links ]
4. Serendipity. En: http://es.wikipedia.org/wiki/Serendipity; consultado 28/05/2012. [ Links ]
5. Alonso H. Serendipity en medicina clínica. Medicina (B Aires) 2001; 61: 369-72. [ Links ]
6. Alonso H. Palabras, palabras, palabras, sin figuras ni conversaciones. Rosario: Corpus Editorial, 2006, p 171-7. [ Links ]
7. Pasqualini CD. Entretelones del invento de los anticuerpos monoclonales. Medicina (B Aires) 2008; 68: 475-7. [ Links ]
8. Stekolschik G. El azar y la sagacidad. Exactamente 2012; 49: 10-3. [ Links ]
9. Pasqualini CD. Quise lo que hice. Autobiografía de una investigadora científica. Buenos Aires: Leviatán, 2007. [ Links ]
^rND^sPasqualini^nRQ^rND^sAlonso^nH^rND^sPasqualini^nCD^rND^sStekolschik^nG^rND^nGuillermo^sSemeniuk^rND^nGuillermo^sSemeniuk^rND^nGuillermo^sSemeniukEDITORIAL
Células madre. Vida más allá de la muerte
En el tercer milenio las células madre humanas parecen ofrecer tratamientos para múltiples enfermedades y ha nacido con ellas la llamada "medicina regenerativa". Muchos tejidos tienen una gran renovación y capacidad de reparación, tales como la piel, el músculo y, por supuesto, la médula ósea.
Si bien la utilización de células de cadáveres se efectuó ya en 1986, cuando un niño con leucemia recibió médula ósea de su padre extraída 40 minutos luego de su muerte, un artículo publicado en Nature Communication1 este año asombra. Un grupo de investigadores dirigidos por Fabrice Chrétien y Shahragim Tajbakhsh del Instituto Pasteur de Francia aislaron células madre de músculo humano y de ratones, hasta 17 días después de la muerte. Se conoce que hay marcadores en las células madre musculares, también denominadas satélites, que expresan la miogenina. Estas células tardan más tiempo en duplicarse que la de los tejidos frescos y esta capacidad está dada por adoptar un estado quiescente (dormant cells). Estas células consumen un 28% menos de oxígeno y tienen menores niveles de ATP. Inyectadas en ratones con músculos dañados pudieron repararlos. Hay una limitada disponibilidad de células madre, por lo que este método abre una extraordinaria posibilidad al poder usarse lo que se denominarían células madre "éticas". El 90% de las células obtenidas por el método descrito expresaban miogenina, factor de transición específico para la diferenciación muscular. Las biopsias obtenidas de músculos psoas e intercostales eran conservadas a 4 °C. Estos fenómenos nos llevan a preguntarnos cuánto puede vivir el ADN, y otros interrogantes surgen desde la biología, la ética y el derecho. Las células troncales adultas, y estas células obtenidas de tejidos post mortem, no parecen violar el principio ético-jurídico de "dignidad humana" y facilitarían la obtención ética de células madre (ver resolución INCUCAI 69/2009, por ejemplo). Excluido el aspecto ético del uso de células embrionarias, un punto crítico es el de la posibilidad de su contribución a la generación de tumores, de acuerdo a trabajos publicados este año en ScienceNow2 y Science3, que demostraron la existencia de células madre en modelos animales de tres cánceres humanos refractarios al tratamiento (intestino, cerebro y piel). Según algunos investigadores esto implicaría un cambio de paradigma en el tratamiento del cáncer. Por otro lado, se ha atribuido el fenómeno de la arterioesclerosis a células madre dormidas que, ante una injuria endotelial, se transdiferenciaron y formaron tejido óseo o cartilaginoso. Estas células que expresan marcadores Sox17, Sox 10 y S100 β, familias de genes que codifican reguladores transcripcionales para procesos de desarrollo, son clonables y tienen actividad de telomerasa, lo que les permite diferenciarse en células neurales, mesenquimatosas o de músculo liso o condrogénicas, siendo estas últimas las que producirían remodelación vascular, hiperplasia neointimal y enfermedad vascular4.
En el año 2005 escribí un editorial en la Revista de la Asociación Argentina de Medicina Respiratoria5 que titulé: Stem cells y reparación de lesiones pulmonares. Allí recordaba a Prometeo encadenado al Monte Cáucaso con su inmortalidad cedida por Quirón, que a su vez tenía una herida incurable. Prometeo regeneraba su hígado que era una y otra vez comido por un buitre. ¿Cómo sabían los griegos que el hígado era un órgano con capacidad de regeneración?
Las células madre pueden clasificarse en: embrionarias totipotenciales, embrionarias pluri- potenciales, multipotenciales y progenitoras unipotenciales.
La mayor parte de las células madre de un tejido sirven sólo para renovar ese tejido, pero en ocasiones pueden transformarse en pluripotenciales y renovar otros. Este fenómeno se denomina "plasticidad", que es la capacidad de alterar el fenotipo en respuesta a cambios del medio que las rodea. La transdiferenciación implica una reprogramación genética que puede, en forma directa o a través de múltiples pasos y con pérdida de la diferenciación (de-diferenciación) y luego re-diferenciación, ir a otro linaje celular. En editoriales de 2008 y 2011, la Dra. Pasqualini trató el tema de la reprogramación de fibroblastos de piel humana, que pudieron generar células madre pluripotenciales e inclusive generar luego tumores. Otro punto tratado por la misma autora fue el de la teoría de la "célula madre cancerogénica" 6, 7 abriéndose una amplia perspectiva para el tratamiento de diversos tumores al conocerse este posible mecanismo.
Como podemos apreciar, esta revolución en el estudio de las células madre (más de 31 000 citas en Google Académico y más de 81 millones en Google), requiere de una información certera para los médicos no especializados y para el público en general. No por pensar en Prometeo abramos nuevamente la caja de Pandora, aun sabiendo que en ella queda la esperanza.
Guillermo Semeniuk
e-mail: gsemeniuk@intramed.net
1. Latil M, Rocheteau P, Châtre L, et al. Skeletal muscle stem cells adopt a dormant cell state postmortem and retain regenerative capacity. Nat Commun 2012; Jun 12; 3: 903. En: http://www.nature.com/ncomms/journal/v3/n6/pdf/ncomms1890.pdf; consultado 3/8/12; Press release, I. Pasteur. En: http://www.pasteur.fr/ip/easysite/pasteur/en/press/press-releases/2012/postmortem-stem-cells; consultado 20/8/12. [ Links ]
2. Vogel G. Cancer Stem Cells Can Fuel Tumor Growth. En: http://www.wired.com/wiredscience/2012/08/cancer-stemcells/; consultado 3/8/12. [ Links ]
3. Schepers A G, Snippert H J, Stange D E, et al. Lineage Tracing Reveal Lgr5+ Stem Cell Activity in Mouse Intestinal Adenoma. Science, 2012; 337: 730-5. [ Links ]
4. Zhenyu Tang, Aijun Wang, Falei Yuan, et al. Differentiation of multipotent vascular stem cells contributes to vascular diseases. Nature Communications, June 2012. En: http://www.nature.com/ncomms/journal/v3/n6/full/ncomms1867.html; consultado 3/8/12. [ Links ]
5. Semeniuk GB. Stem cells en relación a la reparación de lesiones pulmonares. Revista Argentina de Medicina Respiratoria 2005; 1: 1-2. [ Links ]
6. Pasqualini CD. Reprogramación de fibroblastos humanos a células madre. Nuevo paradigma en medicina regenerativa. Medicina (B Aires) 2008; 68: 181-3. [ Links ]
7. Pasqualini CD. La guerra contra el cáncer. Medicina (B Aires) 2011; 71: 496-9. [ Links ]
^rND^sLatil^nM^rND^sRocheteau^nP^rND^sChâtre^nL^rND^sSchepers^nA G^rND^sSnippert^nH J^rND^sStange^nD E^rND^nZhenyu^sTang^rND^nAijun^sWang^rND^nFalei^sYuan^rND^sSemeniuk^nGB^rND^sPasqualini^nCD^rND^sPasqualini^nCD^rND^nGuillermo B.^sSemeniuk^rND^nGuillermo B.^sSemeniuk^rND^nGuillermo B^sSemeniukCOMENTARIO BIBLIOGRÁFICO
Libros para todos. Colecciones de Eudeba bajo la gestión de Boris Spivacow (1958-1966). Coordinado por Judith Gociol; 1ª Ed. Buenos Aires: Biblioteca Nacional, 2012, 304 pp
Un mega-emprendimiento universitario-cultural de fines de los años 50 con libros de calidad, originales y a precios accesibles. Eso fue la gestión de Boris Spivacow (1915-1994), gran editor y excelente administrador. La apnea del sueño que lo aquejó en sus últimos años no le impidió seguir soñando con la cultura. En una época donde se teme el fin del libro impreso en papel, este Libro para todos intenta rescatar lo editado por EUDEBA entre los años 1958 y 1966. El lema de Spivacow era "más libros para más". El libro no está muerto y, como dijera el recientemente fallecido Héctor Tizón (1929-2012) "sólo está muerto aquello que definitivamente hemos olvidado".
Como se menciona en el prólogo, escrito por Horacio L. González, "entre los distintos signos de la memoria se encuentran los libros que hemos leído, no sólo por su contenido, sino por su aspecto material". El libro que comentamos comenzó a gestarse en el año 2006, gracias a la coordinación de Judith Gociol y la recopilación de textos hecha por Cecilia Arthagnan. En esta recopilación se reviven las 120 colecciones y parte de los 6000 diferentes títulos publicados.
Catalogado como hombre experimentado, joven, interesante, matemático, pero con "el inconveniente de ser loco", Boris Spivacow fue nombrado Gerente General de EUDEBA por el entonces rector de la UBA, el filósofo Risieri Frondizi. Lo acompañaron en la gestión hombres a quienes tuve el privilegio de conocer, tan renombrados como el Ingeniero José Babini, el Dr. Alfredo Lanari y el dibujante Oscar "Negro" Díaz, entre otros. El Directorio se reunía todos los viernes, se registraba cuidadosamente en actas lo tratado y se aprobaba la serie de libros a editar. Esta extraordinaria actividad fue interrumpida en 1966 por la intervención a la Universidad y por los cambios políticos que todos conocemos. Retomada, fue nuevamente interrumpida en 1976 cuando se recibió una circular interna que decía: "Ruego a Ud. que los libros que se detallan a continuación deben de ser incluidos entre los detenidos (sic), etiquetados y empaquetados". La orden incluía además la suspensión de 15 títulos. La historia de la cultura es también la historia de la censura. EUDEBA había llegado a publicar un libro por día y a traducir obras directamente del griego (por ejemplo). Sigue siendo hoy un referente obligado de cualquier universidad que quiera poner el conocimiento al alcance de todos. Este libro no es sólo la recopilación de textos aquí comentados por actuales referentes culturales y científicos, sino también una historia de los procesos políticos y las distintas maneras de ver la relación de lo que debe y no debe hacerse en ciencia, investigación y tecnología.
En las distintas colecciones, tales como los Cuadernos, Series del Siglo y Medio, Ciencia Activa, Técnica e Investigación, Libros del Caminante y Serie de los Contemporáneos, para mencionar algunas, encontramos un amplio abanico de intereses y los más diversos temas. Entre los Cuadernos, recuerdo 'Las bases físicas y químicas de la herencia', de G.W. Beadle; 'Los grupos sanguíneos' de J.Moullec, revisado por G. Bomchil y 'El ABC de la química ácido-base' de H. Davenport. Entre los Manuales, uno muy utilizado por los que estudiábamos medicina fue la 'Introduccion a la bioestadística' de H. Bancroft. La fisiología estuvo representada por 'La maquinaria del cuerpo', de A. Carlson y V. Johnson, con revisión del querido y recordado Dr. A. Agrest. En Arte para todos, merece destacarse el 'Martín Fierro', con ilustraciones del Maestro Castagnino. En la serie Los contemporáneos, 'El túnel' de E. Sábato, los 'Poemas' de Marechal y muchos otros, cuya mención sería extensa y seguramente con injustas omisiones.
Como se dice en la contratapa, es una invitación a repensar el pasado y el presente mirando hacia el futuro. Recomiendo calurosa y emocionadamente la lectura de este libro, éste -como muchos otros- contribuirán a hacer mejores personas que seguramente llevarán a la construcción de un mundo mejor.
Guillermo B. Semeniuk
^rND^1A01^nJuan Ignacio^sRojas^rND^1A01^nLiliana^sPatrucco^rND^1A01^nEdgardo^sCristiano^rND^1A01^nJuan Ignacio^sRojas^rND^1A01^nLiliana^sPatrucco^rND^1A01^nEdgardo^sCristiano^rND^1A01^nJuan Ignacio^sRojas^rND^1A01^nLiliana^sPatrucco^rND^1A01^nEdgardo^sCristianoARTÍCULO ORIGINAL
Esclerosis múltiple en la Argentina. Revisión sistemática y meta-análisis
Juan Ignacio Rojas, Liliana Patrucco, Edgardo Cristiano
Servicio de Neurología, Clínica de Esclerosis Múltiple, Hospital Italiano de Buenos Aires, Buenos Aires
Dirección Postal: Dr. Juan Ignacio Rojas, Servicio de Neurología, Hospital Italiano de Buenos Aires, Juan D. Perón 4190, 1181 Buenos Aires, Argentina
Fax: (54-11) 4959-0322 e-mail: juan.rojas@hospitalitaliano.org.ar
Resumen
Escasos estudios describen la distribución de la esclerosis múltiple (EM) en América del Sur. El objetivo del presente trabajo fue realizar un análisis epidemiológico de la EM en la Argentina mediante una revisión sistemática de las publicaciones y meta-análisis. Se realizó una búsqueda sistemática en bases de datos electrónicas y listas de referencias sobre el tema. La misma se dirigió principalmente a estudios sobre aspectos epidemiológicos de la EM en la Argentina en los cuales fuese posible realizar una evaluación de su calidad. Se usó StatsDirect para el análisis. Se evaluaron 275 estudios de los que 15 fueron incluidos. La prevalencia, analizada en 4 estudios, fue de 17 casos cada 100 000 habitantes. La incidencia hospitalaria solo fue descrita en un estudio prospectivo de base hospitalaria, siendo de 1.76 casos/100 000 persona-año; 65.5% de los casos descriptos fueron recaídas y remisiones de EM, 21.5% EM secundaria progresiva, 10.6% EM primaria progresiva y 2.4 EM progresiva con recaídas. La relación mujer/hombre fue de 1.55 en el meta-análisis. Ningún estudio informó datos de mortalidad. Presentamos este estudio con el fin de conocer los aspectos epidemiológicos de la EM en la Argentina. Futuras investigaciones poblacionales contribuirán a incrementar los datos y profundizar el conocimiento sobre la misma.
Palabras clave: Esclerosis múltiple; Argentina; Epidemiología; Revisión sistemática; Meta-análisis
Abstract
Multiple sclerosis in Argentina. Systematic review and meta-analysis. The objective of the present study was to perform a systematic review and a meta-analysis in order to determine the epidemiological profile of multiple sclerosis (MS) in Argentina. A systematic search was performed in electronic databases and lists of references, focused on epidemiological studies of MS in Argentina. Data obtained were analyzed with the StatsDirect software. A total of 275 studies were retrieved of which 15 included. The prevalence was described in 4 studies, most of them reported a prevalence of 17 cases per 100 000 inhabitants. The incidence, prospectively described in one hospital based study, was 1.76 cases per 100 000 persons-years. In this study, 65.5% of cases were relapsing-remitting MS, 21.5% secondary progressive, 10.6% primary progressive and 2.4 progressive with relapsing MS. Female/male ratio was 1.55. This study provided information regarding the epidemiological feature of MS in Argentina. Future researches will contribute to increase the number of recorded cases, and the knowledge on the behavior of this disease in the country.
Key words: Multiple sclerosis; Argentina; Epidemiology; Systematic review; Meta-analysis
Los estudios poblacionales en esclerosis múltiple (EM) realizados con el objetivo de conocer mejor la distribución de la enfermedad comenzaron en 1929 cuando Sydney Allison describió 40 casos en Gales, determinando así una prevalencia de 13 por 100 000 habitantes en dicha zona1. En la actualidad, existen cientos de publicaciones describiendo la distribución poblacional de la enfermedad alrededor del mundo; sin embargo, gran parte de esta información proviene de países de Europa y América del Norte donde se estima que la distribución y la frecuencia podrían variar sustancialmente comparado con países de otras regiones del mundo2-5.
Existen a la fecha escasos estudios describiendo la distribución de la enfermedad en América del Sur, y aquellos que lo hacen se han enfocado principalmente sobre la frecuencia de la enfermedad en ciertas poblaciones sin prestar demasiada atención sobre otros aspectos epidemiológicos de la enfermedad tales como subtipos de EM, presentación inicial, curso clínico, mortalidad, etc.6.
Debido a que las características tanto clínicas como epidemiológicas de la EM diferirían de acuerdo a factores genéticos y ambientales, conocer las mismas específicamente en cada región, permitiría también conocer cómo se distribuye y afecta a una población determinada, y así distribuir de manera más eficiente los recursos utilizados para cuidar a la población afectada4, 6, 7.
Considerando lo precedente, el objetivo del presente trabajo fue realizar un análisis epidemiológico extenso a través de una revisión sistemática de las publicaciones de casos de EM en la Argentina, considerando tanto la frecuencia de la enfermedad como la forma clínica, tiempo de progresión y mortalidad, entre otras variables.
Materiales y métodos
Se realizó una búsqueda sistemática sin restricciones de idioma desde enero de 1980 a mayo de 2011 usando las siguientes bases de datos electrónicas: MEDLINE, EMBASE, LILACS, Cochrane CENTRAL. También se llevó a cabo una búsqueda en bases de datos electrónicas como Google y una búsqueda de información en listas de referencias para obtener información relevante. Otros sitios incluidos en la búsqueda fueron los informes ministeriales de la Argentina (Ministerio de Salud de Argentina, acceso Junio 2011), libro de resúmenes de congresos de la Sociedad Neurológica Argentina, publicaciones oficiales de las sociedades médicas en la Argentina (Sociedad Neurológica Argentina, Asociación Médica Argentina, Sociedad Argentina de Medicina). Finalmente, se consultó a los investigadores con experiencia en el tema para abarcar exhaustivamente la identificación de estudios potenciales. Los términos usados para la búsqueda incluyeron: multiple sclerosis and Argentina; multiple sclerosis and population*; multiple sclerosis and epidemiology; multiple sclerosis and prevalence; multiple sclerosis and incidence; multiple sclerosis and etiology* adaptados los mismos a cada base usada. Se siguieron los lineamientos recomendados en MOOSE y PRISMA para la presentación y publicación de revisiones sistemáticas y meta-análisis8, 9.
La selección de estudios se restringió a investigaciones y datos obtenidos en provincias, regiones y/o localidades de la Argentina con el objetivo de llevar a cabo lo propuesto en el estudio.
Las variables epidemiológicas de resultados incluidas en la búsqueda fueron: incidencia de EM, prevalencia de EM, edad de comienzo de la enfermedad, afectación por sexo, subtipo de EM, progresión de la discapacidad medida por tiempo medio hasta alcanzar un expanded disability status scale (EDSS) de 6 (asistencia unilateral para la deambulación), tiempo medio hasta la conversión a la fase secundaria progresiva y mortalidad. También se exploraron los datos de uso de recursos en salud tales como hospitalizaciones, días de hospitalización, uso de rehabilitación, ausentismo laboral y escolar, uso de tratamientos específicos para modificar el curso de la enfermedad y tratamientos sintomáticos.
Se evaluaron los títulos y los resúmenes de todas las referencias identificadas y seleccionaron los estudios potenciales. Posteriormente, se evaluaron los textos completos de dichos estudios para determinar la inclusión de los mismos. Cualquier discrepancia fue resuelta por consenso en ambas fases. Los datos fueron consignados en una planilla de extracción especialmente diseñada en Excel para este fin.
Se evaluó la calidad metodológica usada en los estudios incluidos en la revisión sistemática. El riesgo de sesgo de los estudios observacionales fue evaluada mediante STROBE (Strengthening the Reporting of Observational studies in Epidemiology). Los desacuerdos fueron resueltos mediante consenso.
La revisión sistemática se fundamentó principalmente en estudios de investigación sobre aspectos epidemiológicos de la EM en Argentina en los cuales fuese posible realizar una completa evaluación de la calidad del estudio incluido (lugar de realización, tipo de estudio, población de estudio, definición de EM, datos de frecuencia e intervalos de confianza de las medidas informadas). En el caso de no contar con esos datos se procedió a contactar a los investigadores para obtenerlos.
En un primer paso se analizaron los datos obtenidos de la revisión sistemática realizada. Se usaron los porcentajes para datos cualitativos y la media con su desvío estándar para datos cuantitativos. En su defecto, se usó la mediana dependiendo la distribución para datos cuantitativos. Se determinó la calidad metodológica de los estudios seleccionados. El cálculo de la prevalencia ponderada así como el meta-análisis de los datos se realizó con el programa StatsDirect (www.statsdirect.com). Para determinar el uso del modelo de efectos fijos o de efectos aleatorios usamos las pruebas de homogeneidad: la prueba Q de Cochran y la prueba de índice I2. Cuando la prueba Q de Cochran resultó significativa (p < 0.01), se usó el modelo de efectos aleatorios para el cálculo de la prevalencia ponderada. Además, un valor de 75% o mayor en la prueba I2 indica alta heterogeneidad, que indica el uso del modelo de efectos aleatorios. En el caso de heterogeneidad significativa se procedió a comunicar los resultados individuales de los estudios de manera descriptiva y el meta-análisis de los datos. Para el almacenamiento y análisis de los datos se utilizó el programa StatsDirect.
Resultados
Se evaluaron 275 estudios potenciales tras la búsqueda bibliográfica realizada de bases electrónicas y literatura gris. Luego de revisar título y resumen, 255 referencias fueron excluidas y se seleccionaron 20 estudios para su evaluación de texto completo, de los cuales 15 fueron incluidos para su evaluación (Fig. 1). Los estudios fueron en su mayoría epidemiológicos realizados en la provincia de Buenos Aires (Tabla 1, Fig. 2).

Fig. 1.- Diagrama de flujo de los estudios evaluados
TABLA 1.- Estudios incluidos

CABA: Ciudad autónoma de Buenos Aires; RR: Recaídas y Remisiones; PP: Primaria progresiva.

Fig. 2.- Distribución geográfica de los estudios identificados
De los 15 estudios incluidos, 4 fueron publicados en revistas médicas con revisión de pares y 11 fueron presentaciones en congresos10-25. De los 4 publicados, en 3 se evaluó la prevalencia de la enfermedad10, 12, 13 y en uno la incidencia hospitalaria11. De los estudios no publicados, uno evaluó la prevalencia de la enfermedad en la Provincia de Córdoba15, dos la historia natural de la enfermedad20, 21 y 8 fueron series de casos describiendo características clínicas de la EM17-19, 22-25. Los 4 estudios de prevalencia fueron de base poblacional, mientras que el estudio de incidencia fue de base hospitalaria con un seguimiento de 16 años (Tabla 1)10-13, 15.
Cuatro estudios informaron la prevalencia de la enfermedad, estimando 17.5 casos por 100 000 habitantes en la ciudad de Buenos Aires mediante el método de captura recaptura en el año 199710, 12 por 100 000 en la ciudad de Junín en la Provincia de Buenos Aires para el año 199112, de 17.2 por 100 000 habitantes para la región de la Patagonia (ciudad de Trelew, Neuquén, Río Gallegos y Ushuaia) para el año 200213 y de 80 por 100 000 habitantes para la ciudad de Oliva, provincia de Córdoba, para el año 200415. El meta-análisis de los datos mostró significativa heterogeneidad en los estudios incluidos (p < 0.001) por lo que se procedió a realizar un análisis descriptivo de los datos identificados y no meta-análisis de los mismos.
Dos estudios realizaron una estimación de la incidencia anual de la enfermedad11, 13, uno de ellos a través de una estimación indirecta obtenida por la prevalencia de base poblacional, realizado en la región de la Patagonia, que mostró una incidencia anual de de 1.4 casos por 100 000 habitantes13. El otro estudio evaluó la de la enfermedad de manera prospectiva sobre una población cerrada de individuos afiliados a un sistema de salud cerrado en la ciudad de Buenos Aires11. Ese estudio demostró una densidad de incidencia de 1.76/100 000 persona-año. Cuando este estudio estratificó la incidencia por sexo, se identificó una densidad de incidencia de 1.62 y de 1.86/100 000 persona-año para hombres y mujeres respectivamente11 (Tabla 2). Es importante puntualizar que este estudio de incidencia se registra en el orden de la consulta hospitalaria y no es poblacional, no permitiendo esta información la extrapolación de los hallazgos.
TABLA 2.- Prevalencia e incidencia informada en los estudios identificados

CABA = Ciudad Autónoma de Buenos Aires.
1incidencia hospitalaria
Ocho estudios comunicaron los subtipos de EM en la población evaluada16-19, 22-25. El meta-análisis de los datos comunicados mostró que del total de las EM evaluadas por los centros el 65.5% de los casos fueron recaídas y remisiones (RR), 21.5% secundaria progresiva (SP), 10.6% primaria progresiva (PP) y 2.4 progresiva con recaídas (PR) al considerar la totalidad de los pacientes con EM y los subtipos de EM evaluados (Tabla 3).
TABLA 3.- Meta-análisis según sub-tipo de enfermedad

EMRR = EM recaídas y remisiones
EMPP = EM primaria progresiva
EMSP = EM secundaria progresiva
EMPR = EM progresiva con recaídas
Siete estudios evaluaron13, 16, 18, 19, 22-24 la relación mujer/hombre de los casos identificados. El meta-análisis de los datos estableció una relación mujer/hombre de 1.55 de los casos (Tabla 3).
Un solo estudio evaluó la progresión de la discapacidad en el tiempo, tanto en pacientes con la forma RR como en la forma PP (tiempo medio en que los pacientes alcanzaban un EDSS de 6 y una fase SP sin estar los pacientes bajo tratamiento modificador del curso de la enfermedad)20,21. El tiempo medio en que los pacientes con la forma RR alcanzaban un EDSS de 6 fue de 14.6 + 2.1 años y en alcanzar la fase SP de 17.5 ± 8 años20. En pacientes con la forma PP, el tiempo medio de los pacientes en alcanzar un EDSS de 6 fue de 6.9 ± 1.8 años y en alcanzar un EDSS de 8 de 10 ± 1.2 años21. Ningún estudio informó datos de mortalidad de la enfermedad así como datos de uso de recursos.
Discusión
Este análisis tuvo como objetivo identificar los estudios realizados previamente en la Argentina considerando aspectos epidemiológicos en pacientes con EM. La prevalencia hallada en los estudios, en su mayoría fue de 17 casos por cada 100 000 habitantes aproximadamente (rango de 12 a 80 casos por 100 000 habitantes)6, 12, 13. La incidencia solo fue descrita en un estudio hospitalario de manera prospectiva, en el cual la misma fue de 1.76 casos/100 000 personas-año11. El subtipo de EM más frecuentemente identificado fue la forma RR en un 57.5% de los casos en el análisis global mientras que ningún estudio encontrado comunicó datos de usos de recursos ni de mortalidad.
La prevalencia de EM en los estudios realizados en la Argentina en su mayoría fue menor que en países desarrollados, siendo el riesgo en este país moderado, pero similar a lo publicado para países vecinos de Sudamérica4, 6. Sin embargo, es importante destacar que estas prevalencias informadas así como la incidencia podrían ser un estimador aproximado de las mismas pero no exacto, al considerar el escaso número de investigaciones realizadas así como la limitación poblacional que muchos de estos estudios poseen y que no pueden ser extrapoladas como la incidencia o prevalencia en Argentina de la EM.
La explicación sobre la diferencia antes comentada, respecto a la prevalencia e incidencia en EM entre países de Sudamérica y países desarrollados sigue siendo desconocida, postulándose que existirían factores principalmente de tipo ambiental que intervendrían para generar lesa diferencia en la frecuencia de la enfermedad entre países de distintos hemisferios26, 27. Los factores ambientales propuestos incluyen a la exposición solar y la suplementación con vitamina D en la dieta, que ha sido asociada con la posibilidad de desarrollar EM en diversos estudios alrededor del mundo26-28. Otro posible factor asociado podría estar dado por la llamada hipótesis higiénica26. Esta hipótesis propone que varias enfermedades autoinmunes e inmunológicas serían menos comunes en países en vías de desarrollo debido al hecho de que estas poblaciones estarían más expuestas a agentes infecciosos tales como micro-organismos y parásitos necesarios para balancear y regular la respuesta autoinmune26.
Respecto a la frecuencia de los subtipos de enfermedad, no existen diferencias importantes con las publicadas a nivel mundial29, 30, así como la razón mujer/hombre analizada de los estudios incluidos31. Solo dos estudios incluyeron datos retrospectivos respecto a la historia natural de la enfermedad tanto en la forma recaídas y remisiones como en la forma primaria progresiva20, 21. Si bien no hay diferencias con lo publicado en grandes estudios de historia natural realizados en países del hemisferio Norte32, 33, es imposible por los escasos datos realizar una comparación confiable entre ellos. Lamentablemente no se encontraron datos de mortalidad como tampoco datos de uso de recursos en esta población que permitan traer luz sobre estos aspectos tan importantes de la enfermedad en la Argentina.
El presente estudio provee información epidemiológica sobre las características de la EM en la Argentina. Si bien esclarece ciertos aspectos, son insuficientes para poder definir acabadamente las características de la misma. Consideramos que este estudio debiera ser el primer paso sobre el cuál debieran desarrollarse estudios a gran escala que no solo consideren la frecuencia de la enfermedad sino también aspectos tales como el uso de recursos generada por la misma y la morbimortalidad, para poder obtener así datos que permitan profundizar los conocimientos.
En conclusión, este estudio permite conocer algunos aspectos epidemiológicos de la EM tanto en su frecuencia como en aspectos clínico-evolutivos en nuestro país. Futuras investigaciones poblacionales contribuirán a incrementar los datos a este respecto y profundizar el conocimiento sobre el mismo con el fin de definir mejor la epidemiología de esta enfermedad en la Argentina.
Agradecimientos: Este trabajo fue financiado a través de un subsidio para la investigación otorgado por el Laboratorio Novartis.
Conflicto de interés: Los autores declaran que para la realización de la investigación se contó con un subsidio a la investigación otorgado por el Laboratorio Novartis. El subsidio, así como el otorgante, no tuvo ningún rol en el diseño del estudio, en la recolección, análisis e interpretación de los datos, en la redacción del manuscrito ni en la decisión de su publicación.
1. Allison, RS. Disseminated sclerosis in North Wales: an inquiry into its incidence, frequency, distribution and other etiological factors. Brain 1931; 53: 391-430. [ Links ]
2. Poser, CM. An Atlas of Multiple Sclerosis; In: Multiple sclerosis: epidemiology. 2nd ed. Nashville: Parthenon Publishing Group 1998, p 23-35. [ Links ]
3. Pugliatti M, Sotgiu S, Rosati G. The worldwide prevalence of multiple sclerosis. Clin Neurol Neurosurg 2002; 104: 182-91. [ Links ]
4. Rosati G. The prevalence of multiple sclerosis in the world: an update. Neurol Sci 2001; 22: 117-39. [ Links ]
5. Rosati G, Aiello I, Pirastru MI, et al. Epidemiology of multiple sclerosis in Northwestern Sardinia: further evidence for higher frequency in Sardinians compared to other Italians. Neuroepidemiology 1996; 15: 10-9. [ Links ]
6. Cristiano E, Patrucco L, Rojas JI. A systematic review of the epidemiology of multiple sclerosis in South America. Eur J Neurol 2008; 15: 1273-8. [ Links ]
7. Rosati G. Descriptive epidemiology of multiple sclerosis in Europe in the 1980s: a critical overview. Ann Neurol 1994; 36 Suppl 2: S164-74. [ Links ]
8. Stroup DF, Berlin JA, Morton SC, et al. Meta-analysis of observational studies in epidemiology: a proposal for reporting. Meta-analysis Of Observational Studies in Epidemiology (MOOSE) group. JAMA 2000; 283: 2008-12. [ Links ]
9. Moher D, Liberati A, Tetzlaff J, Altman D. Preferred reporting items for systematic reviews and meta-analyses: the PRISMA statement. PLoS Med 2009; 6: e1000097. [ Links ]
10. Cristiano E, Patrucco L, Rojas JI, et al. Prevalence of multiple sclerosis in Buenos Aires, Argentina using the capture-recapture method. Eur J Neurol 2009; 16:183-7. [ Links ]
11. Cristiano E, Patrucco L, Giunta D, Videla G, Soriano ER, Rojas JI. Incidence of multiple sclerosis in Buenos Aires: a 16-year health maintenance organization-based study. Eur J Neurol 2010; 17: 479-82. [ Links ]
12. Melcon MO, Vergara RH, Ceratto R. Prevalencia de Esclerosis Múltiple en Junín, Provincia de Buenos Aires, Argentina. Rev Neurol 1994; 19: 3-8. [ Links ]
13. Melcon M, Gold L, Carra A, et al. Argentine Patagonia: prevalence and clinical features of multiple sclerosis. Mult Scler 2008; 14: 656-62. [ Links ]
14. Cristiano E, Patrucco L, Garcea O, et al. Prevalence of multiple sclerosis in Argentina estimated by capture recapture method. J Neurol Sci 1999; 2: A438. [ Links ]
15. Piedrabuena R, Giobellina R, Alvarez D, V A. High prevalence of multiple sclerosis in the city of Oliva, Cordoba, Argentina. Arq Neuropsiquiatr 2004; 62: 13. [ Links ]
16. Cristiano E, Patrucco L, Carrá A, et al. Características clínico evolutivas de la esclerosis múltiple en Argentina. Estudio multicéntrico. Neurologia Argentina 1999; 24: 13. [ Links ]
17. Sandoval G, Fernández Liguori N, Cáceres F, Sica R, Garcea O. Características de inicio en la esclerosis múltiple en recaídas y remisiones. Neurologia Argentina 2000; 25: 36. [ Links ]
18. Sandoval G, Villa A, Vanotti S, Garcea M, Garcea O. Esclerosis Múltiple dos décadas de experiencia. Neurología Argentina 2004; 29: 16. [ Links ]
19. Saladino L, Fernández Liguori N. Características clínico demográficas de una población con esclerosis múltiple en un Hospital público de Capital Federal. Neurología Argentina 2006; 31: 46. [ Links ]
20. Rojas JI, Patrucco L, Riccio P, Cristiano E. Historia natural de la esclerosis múltiple: severidad de la enfermedad en una cohorte de Argentina. Neurologia Argentina 2008; 33: 7. [ Links ]
21. Rojas JI, Patrucco L, Cristiano E. Historia natural de la esclerois múltiple primaria progresiva en Buenos Aires. Neurologia Argentina 2009; 1: 15. [ Links ]
22. Vetere S, Muñiz R, Luisi AM, E. Esclerosis múltiple: análisis epidemiológico. Revista Neurológica 1998; 23: 3. [ Links ]
23. Bardeci C, Cristiano E, Torres D, Serra P. Esclerosis múltiple: Datos epidemiológicos en 150 pacientes. Revista Neurológica Argentina 1994; 19:26. [ Links ]
24. Caceres FS, Kremenchutzky MFL, Garcea O. Análisis de una población de pacientes con esclerosis múltiple. Revista Neurológica Argentina 1993; 21: 175. [ Links ]
25. Bardeci C, Patrucco L, Torres D, Cristiano E. Consultorio de esclerosis múltiple, cinco años de experiencia. Revista Neurológica Argentina 1993; 21: 215. [ Links ]
26. Ebers GC. Environmental factors and multiple sclerosis. Lancet Neurol 2008; 7: 268-78. [ Links ]
27. Lauer K. Environmental associations with the risk of multiple sclerosis: the contribution of ecological studies. Acta Neurol Scand Suppl 1995;161: 77-88. [ Links ]
28. Dolinoy DC, Jirtle RL. Environmental epigenomics in human health and disease. Environ Mol Mutagen 2008; 49: 4-8. [ Links ]
29. Kurtzke JF. MS epidemiology world wide. One view of current status. Acta Neurol Scand Suppl 1995; 161: 23-33. [ Links ]
30. Kurtzke JF. Epidemiology of multiple sclerosis. Does this really point toward an etiology? Lectio Doctoralis. Neurol Sci 2000; 21: 383-403. [ Links ]
31. Orton SM, Herrera BM, Yee IM, et al. Sex ratio of multiple sclerosis in Canada: a longitudinal study. Lancet Neurol 2006; 5: 932-6. [ Links ]
32. Kremenchutzky M, Rice GP, Baskerville J, Wingerchuk DM, Ebers GC. The natural history of multiple sclerosis: a geographically based study 9: observations on the progressive phase of the disease. Brain 2006; 129: 584-94. [ Links ]
33. Weinshenker BG. The natural history of multiple sclerosis. Neurol Clin 1995; 13:119-46. [ Links ]
Recibido: 6-12-2011
Aceptado: 16-7-2012
ARTÍCULO ORIGINAL
La investigación clínica en residencias de medicina interna de la Argentina. Facilitadores y barreras
Cristina M. Elizondo, Diego H. Giunta, Fernán González Bernardo de Quirós, Adriana R. Dawidowski, Silvana B. Figar, Gabriel D. Waisman
Servicio de Clínica Médica, Hospital Italiano de Buenos Aires
Dirección postal: Dra. Cristina M. Elizondo, Servicio de Clínica Médica, Hospital Italiano de Buenos Aires, Juan D. Perón 4190, 1181 Buenos Aires, Argentina
Fax: (54-11) 4958-4454 e-mail: cristina.elizondo@hiba.org.ar
Resumen
En el proceso de formación de los residentes de medicina interna, distintas organizaciones académicas y gubernamentales han recomendado incluir competencias específicas en investigación clínica. El estado actual de la investigación en este contexto no ha sido todavía relevado en nuestro país. El objetivo de este trabajo fue describir las actividades de investigación en las residencias de medicina interna como indicador de la adquisición de dichas competencias e identificar los facilitadores y barreras para la misma. Se realizó un estudio de corte transversal, se analizaron múltiples niveles para considerar las residencias como conglomerados. Se incluyeron 382 residentes de 24 residencias. Predominaron las mujeres, la mediana de edad fue 29 años. El 71% de los residentes informaron actividades de investigación. La mitad de ellos habían participado como autores de trabajos en congresos, solo el 9% había publicado su experiencia. Los factores predictores de desarrollar tareas de investigación fueron pertenecer a una residencia numerosa, OR 16.99 (IC 95%, 2.096-137.87), pertenecer al tercer año de residencia, OR 9.95 (IC 95%, 2.84-34.82), y haber realizado un curso de investigación, OR 2.78 (IC 95%, 1.10-7.04). Las variables que disminuyen la probabilidad de realizar investigación fueron la localización en el Gran Buenos Aires o Capital Federal, OR 0.25 (IC 95%, 0.0072-0.91), ser mujer, OR 0.34 (IC 95 0.14-0.79) y la carga asistencial, OR 0.97 (IC 95%, 0.95-0.99). Conocer los factores que influyen en la investigación contribuye a mejorar la formación de los residentes de medicina interna.
Palabras clave: Investigación clínica; Medicina Interna; Clínica médica; Conglomerado.
Abstract
Clinical research in internal medicine residencies in Argentina. Supporters and detractors. Several academic and government organizations have strongly recommended the inclusion of specific competences in clinical research. So far, the current state of research within this framework has not been modified in our country. The main goal of this study was to provide a thorough description of the research activities in medical residencies, which could be used as an indicator of the acquisition of such competences and to identify the supporters and detractors to achieve them. A cross section study was carried out and several levels were analyzed in order to consider residencies as a cluster; 382 residents from 24 different residencies were included. The study showed a preponderance of women. The average age was 29 years old. A 71% of the residents asserted doing research. Half of those residents have stated being authors of papers presented in congresses; only 9% have published their experience. Factors which predict the development of research assignments were: to belong to a large residency, OR 16.99 (IC 95%, 2.096-137.87), being in the 3rd year of the residency, OR 9.95 (IC 95%, 2.84- 34.82), completion of a research course, OR 2.78 (IC 95%, 1.10-7.04). Variables which reduce the chance to do research: location in Buenos Aires, OR 0.25 (IC 95%, 0.0072-0.91), being a woman, OR 0.34 (IC 95%, 0.14-0.79) and patients assistance workload, OR 0.97 (IC 95%, 0.95-0.99). We believe that the identification of factors which influence the possibility of doing research will lead to a improvement in the training of medical residents.
Key words: Clinical research; Internal medicine; Medical residency; Cluster
La adquisición de competencias específicas en investigación de los médicos residentes son consideradas un componente fundamental en la formación de un médico clínico, ya que estimulan el razonamiento clínico y la lectura crítica de la evidencia científica, y favorecen la transferencia teórico-práctica de los conocimientos científicos1, 2.
El consejo de acreditación de educación médica de postgrado de los EE.UU. (ACGME) recomienda que los médicos residentes realicen tareas de investigación clínica: desarrollo de un proyecto de investigación, escritura de artículos, participación en congresos de sociedades científicas, como parte de su participación académica3.
A pesar de esta recomendación, un estudio que evaluó la investigación en las residencias de clínica médica de EE.UU, mostró que la realidad actual no alcanza los objetivos propuestos en los programas de formación4.
En la Argentina, el Ministerio de Salud y Medio Ambiente, en su resolución 450/06, establece que al menos un 30% de la carga horaria de los residentes deberá dedicarse a actividades educativas, entendiéndose como tales docencia, investigación y estudio con supervisión docente5. No encontramos publicaciones que muestren cuál es el grado de cumplimiento de esta resolución.
Conocer las actividades de investigación llevadas a cabo en las residencias permitiría revisar e implementar mejoras en los programas de formación. En este estudio nos proponemos describir el estado actual de las actividades de investigación clínica en las residencias de medicina interna de la Argentina y detectar los factores que favorecen o dificultan su desarrollo.
Materiales y métodos
Se realizó un estudio de corte transversal en el período de junio 2007 a junio 2008 incluyendo residencias de medicina interna del ámbito público y privado. Se seleccionaron las residencias de forma aleatoria utilizando como marco de muestreo el censo de residencias de Medicina Interna llevado a cabo en el anterior período como parte del "Estudio Cuali-Cuantitativo de Residencias de Clínica Médica en Argentina"6. De cada residencia muestreada, se incluyeron todos sus residentes como un conglomerado (cluster). Para mantener la representatividad de las residencias seleccionadas se muestreó manteniendo la proporción por región del país y por tamaño de residencia (muestreo por estratos proporcional al tamaño). En este informe no se incluirán los resultados cualitativos del proyecto sobre la investigación clínica.
Las características de las residencias fueron recolectadas por medio de cuestionarios auto-administrados dirigidos al jefe de servicio y al responsable de la residencia, mientras que la información concerniente a tareas de investigación se preguntó en un cuestionario dirigido a los residentes de clínica médica. Los cuestionarios fueron controlados, modificados y validados en un estudio piloto en tres hospitales6.
Se clasificó como que realizaban investigación a los residentes que informaron participar en proyectos de investigación (incluyendo protocolos dependientes o independientes de la industria farmacéutica, descripción de casos, investigación básica o revisiones sistemáticas), o si habían publicado artículos científicos, o presentado estudios en congresos científicos. Se evaluaron la presencia de facilitadores (tiempo destinado exclusivamente para la investigación, motivación para investigar, capacitación en investigación o metodología) y barreras (falta de tiempo, de entrenamiento, de recurso económico, de asesoramiento, de especialistas en metodología, ausencia de tutores y falta de motivación) para el desarrollo de la investigación en la residencia.
Se clasificó a los residentes como pertenecientes o no a residencias de hospitales que generan publicaciones científicas. Para esto se realizó una búsqueda sistemática en las bases de datos de Pubmed y Lilacs de artículos publicados de hospitales con residencia de medicina interna en el país y que tuvieran al menos una publicación en los últimos cinco años. Se consideraron los cinco años previos al presente estudio para que en este período tanto los residentes del primero como del último año hubieran estado en la institución al momento de dicha publicación, aun cuando la investigación que diera origen a la misma hubiera comenzado años antes. Se evaluó esta variable como predictora de investigación durante la residencia.
Se definió residencia numerosa como aquella que tenía al menos 9 residentes; este es el número promedio que tuvieron las residencias en el censo de las residencias antes descripto.
El tamaño de la muestra fue calculado para la unidad de análisis residente, considerando la correlación dentro del conglomerado de 0.2 (la variabilidad intra-conglomerado es menor que la variabilidad entre conglomerados), se estimó un efecto de diseño por conglomerados de 1.5. El número de residentes a incluir fue estimado en 327 para una frecuencia esperada de residentes que cumplan los criterios de realizar investigación del 20%, con una precisión del 5% y un nivel de confianza de 95%. Para incluir la cantidad suficiente de residentes se muestrearon 24 residencias con la metodología antes descripta, manteniendo la representatividad nacional. Se utilizó el software EpiInfo 6.3.
Se imputó el 1.3% (102/7360) de los datos. La edad, el sueldo y el número de camas a cargo se imputaron considerando el promedio por año de residencia. Para imputar el promedio general de la carrera se consideró el promedio general de todos los residentes. Para el resto de los datos no imputados se aclara entre paréntesis el numerador y denominador.
Presentamos las variables categóricas como proporciones y los datos continuos con media y desvío estándar o mediana e intervalo intercuartil según la distribución observada. Para evaluar los factores predictivos de investigación considerando el agrupamiento en conglomerados de los residentes, se utilizó un modelo de regresión logística con efectos aleatorios (random effect model). Se utilizó el modelo en el análisis univariado y se construyó un modelo multivariado incluyendo las variables explicativas relevantes desde el punto de vista teórico y las significativas en el análisis univariado. Se presentan los Odds Ratios (OR) del modelo multivariado con su Intervalo de Confianza del 95% (IC95%) y el p-valor del test de Wald. Se seleccionó el mejor modelo con el test de razón de verosimilitud. Se utilizó para el análisis el software estadístico STATA 10. Se utilizó el software SPSS 17.0 para testear la bondad de ajuste del modelo estimado con el test Hosmer Lemeshow y el área bajo la curva COR (Característica Operativa del Receptor)7.
El protocolo del estudio fue evaluado y aprobado por el comité de ética independiente de protocolos de investigación del Hospital Italiano de Buenos Aires.
Resultados
Las 24 residencias seleccionadas participaron. De los 382 residentes integrantes de estas 24 residencias respondieron a la encuesta 230 (60%). La tasa de respuesta varió entre 100% y 16 % de los residentes. La mayor tasa de respuesta la tuvieron los residentes de primer año. Las residencias encuestadas correspondían en un 71% (17/24) al sector público y el resto al sector privado. Las características generales de los residentes se describen en la Tabla 1 y fueron descriptas con mayor detalle en el estudio descriptivo de las residencias a nivel nacional antes mencionado6.
TABLA 1.- Características de los 230 residentes incluidos

Todos los datos cuantitativos como mediana (intervalo intercuartil) salvo aclaración
Un 71% (162/230) de los residentes informaron realizar actividades de investigación durante la residencia (participación, presentación en congresos o publicaciones científicas). En el sector público 64% (109/168) y en el sector privado 85% (53/62), p 0.004.
Al evaluar una posible asociación entre la universidad en la que estudió el residente y el desarrollo de investigación durante su residencia se encontró una frecuencia de residentes investigadores similar a las frecuencias presentadas en la Tabla 1, y todas las universidades tuvieron al menos un residente que investigara.
El 51% (117/228) de los residentes refirió haber realizado tareas de investigación como investigador principal, secundario, o haber realizado funciones administrativas. En el análisis del rol que cumplió el residente, respondieron (pudiendo haber participado en más de una forma en diferentes investigaciones) el 32% (56/174) que fueron ayudantes, 22% (43/187) investigadores secundarios, 21% (40/190) investigadores principales y solo uno que realizó tareas administrativas.
El 56% (128/226) de los residentes refirió haber sido autores en trabajos científicos para congresos y el 45% (103/226) haber presentado trabajos en congresos o jornadas científicas. De estos, el 81% (84/103) expresó haber presentado al menos un trabajo en congresos nacionales, 34% (36/103) en congresos locales, 16% (17/103) en congresos provinciales y solo 4% (5/103) en congresos internacionales. Un 9% (18/194) de los residentes presentaron publicaciones científicas en revistas de revisión de pares.
En cuanto a los facilitadores de investigación citados por los residentes, un 21% (38/182) de éstos tuvieron tiempo de dedicación exclusiva para tareas de investigación durante la residencia. Se sintieron estimulados para investigar un 73% (145/199) de los residentes y un 47% (96/202) mencionó haber realizado un curso de metodología de la investigación o epidemiología durante su residencia.
La falta de tiempo fue considerada como la primera barrera para la realización de investigación durante la residencia (78.2%, 180/230); otras fueron: la falta de entrenamiento (46.9%, 108/230), falta de recursos económicos (43.9%, 101/230), falta de asesoramiento (35%, 81/230), falta de especialistas en metodología (25.2%, 58/230), falta de tutores (25.2%, 58/230) y falta de interés (12.6%, 29/230).
Los factores asociados a mayor probabilidad de investigación fueron: cursar el 2º. año de residencia (OR 1.50; IC 95%, 0.65 - 3.49), el tercero (OR 8.50; IC 95%, 2.60-27.78) o el cuarto (OR 6.11; IC 95%, 1.35-27.68). También se asoció haber hecho algún curso relacionado con metodología de la investigación (OR 2.97; IC 95%, 1.27-6.92), pertenecer a una residencia numerosa (más de 9 residentes) (OR 5.32; IC 95%, 0.84-33.71), y la edad en años (OR 1.16; IC 95%, 1.00-1.35). No se encontró asociación entre pertenecer o no a una residencia de una institución que publica y realizar investigación.
Los factores que se asociaron a menor probabilidad de investigación fueron: pertenecer a una residencia de Capital Federal o Gran Buenos Aires (OR 0.39; IC95%, 0.12-1.31), ser mujer (OR 0.43; IC95%, 0.20-0.91), pertenecer al sector público (OR 0.42; IC95%, 0.10-1.70) y las horas de trabajo mensuales (OR 0.97; IC95%, 0.94-0.99).
Las variables predictoras de investigación según el mejor modelo predictivo observado se muestran en la Tabla 2. Se testeó la bondad de ajuste del modelo predictivo estimando un valor de significancia de 0.647 para el test de Hosmer Lemeshow y un área bajo la curva de 0.82 (IC 95%, 0.76-0.87) con un nivel de significancia de p = 0.001.
TABLA 2.- Modelo predictivo para investigación

Beta estimado: es el estimador del modelo predictivo. LI IC 95%: límite inferior del intervalo de confianza 95% del beta estimado, LS IC 95%: límite superior del intervalo de confianza 95% del beta estimado.
EL OR ajustado para investigación fue de 16.99 (IC95%, 2.096-137.87) para pertenecer a una residencia grande, de 9.95 (IC95%, 2.84-34.82) para estar cursando el tercer año, de 2.8 (IC95%, 1.10-7.04) para haber realizado un curso de metodología, de 0.34 (IC95%, 0.14-0.79) para ser mujer, de 0.97 (IC95%, 0.95-0.99) por cada aumento en horas de trabajo semanal, de 0.26 (IC95%, 0.058-1.250) para pertenencia al sector público y 0.25 (IC95%, 0.0072-0.91) para pertenecer el área de Capital Federal y Gran Buenos Aires.
Discusión
Durante la investigación sobre residencias de clínica médica en el año 2008, se realizó el censo de las residencias de clínica médica en el país, datos que han sido publicados6.
Durante este estudio se evaluó el desarrollo de las actividades de investigación clínica en los residentes de medicina interna. En concordancia al Consejo de Acreditación de Educación Médica, Accreditation Council for Graduate Medical Education, que estipula una recomendación del tipo mandatoria, es decir que el 100% de las residencias deberán tener tareas de investigación en su programa para permanecer acreditadas3, 8, 9, todas las residencias que se incluyeron en el estudio realizaron alguna tarea de investigación. A pesar de esto, solo el 71% de los residentes realizó investigación durante su residencia. En lo que no hay acuerdo total es en cuáles son las estrategias para cumplimentar este requerimiento ni tampoco sobre los indicadores de su cumplimiento.
En un estudio que encuestó a directores de programas de residentes, los tipos de investigaciones realizadas fueron: informe de casos entre un 25% y 40% de las residencias, presentaciones en reuniones científicas locales o regionales entre un 20% y 25% e investigaciones derivadas de hipótesis un 20%. Las presentaciones nacionales y las publicaciones científicas en revistas con revisión por pares fueron las menos frecuentes, entre 5 y 10%4.
En nuestra experiencia, la presentación en congresos o reuniones científicas superó a la de Levine con un 56%4. La participación en investigaciones derivadas de hipótesis alcanzó un 51% y la publicación en revistas con revisión por pares fue muy similar a lo notificado internacionalmente, con un 9%.
En este estudio los facilitadores encontrados fueron: pertenecer a una residencia numerosa, estar en el tercer año de la residencia y haber realizado un curso de investigación. Los obstáculos detectados fueron: ser una residencia dentro de la Capital Federal o Gran Buenos Aires, pertenecer al sector público y ser mujer.
En el análisis de los factores que se asocian a investigar se encontró la asociación con estar en un año de residencia más avanzado. Probablemente los residentes de los años superiores hayan tenido una menor carga asistencial que los residentes más jóvenes, adquiriendo mayor experiencia en investigación. Así tal vez nuestro hallazgo pueda corresponder al momento de entrevista de los residentes, siendo que los residentes encuestados en primer año y que no realizaran investigación todavía, pudieran realizarla en los años siguientes.
Otro de los factores asociados a investigación fue la pertenencia a una residencia numerosa. Probablemente esta asociación se deba a diferentes características entre las que podrían estar el tamaño del hospital, con una mayor infraestructura académica y casuística.
Ninguno de estos dos factores fueron identificados con anterioridad en la literatura, probablemente debido a lo mandatorio de la recomendación de investigación en la residencia, que hace que aun en residencias menos numerosas y en todos los años de residencia sea realizada alguna actividad de este tipo.
Los factores identificados como facilitadores en otros estudios fueron: la inclusión en el programa de residencia de tareas específicas que debía realizar el residente para cumplimentar el requisito, el aporte financiero para la realización de la investigación y el tiempo con dedicación exclusiva para realizarla4. En nuestro estudio no se ha evaluado el contenido de los programas ni el aporte financiero para la investigación. Tampoco incluimos cómo es la participación de los médicos de planta como parte del entorno, aunque ellos pudieran ser los tutores o los asesores referidos por los residentes.
Con respecto al tiempo con dedicación exclusiva para investigar, pocas veces se formaliza un tiempo estipulado para que el residente realice su investigación, variando desde dos semanas a cuatro, o dejando este espacio para las rotaciones electivas. En el estudio de Levine antes citado, solo un 32% de los programas de residencias tienen estipulado ese tiempo protegido para que el residente desarrolle sus tareas de investigación4. Este tiempo suele ser insuficiente para realizar un proyecto de investigación; Hamann propone tomar al menos12 meses para la fase de preparación de un proyecto, entre 1 y 2 meses para la fase de investigación y luego 12 meses para la fase de síntesis10. En este punto muchos han coincidido y propusieron rotaciones electivas dentro de la residencia, demostrando que este tiempo protegido mejora las competencias adquiridas por los residentes11-15. En la experiencia cualitativa de este mismo estudio, los residentes informaron la falta de tiempo como uno de los determinantes más importantes16.
En nuestro estudio, las horas de trabajo asistencial de los residentes impresionan adecuadas a la recomendación nacional (50 horas semanales), y están por debajo de lo citado en el ámbito internacional (80 horas semanales). Aunque se observó que, a mayor número de horas de trabajo asistencial, los residentes presentaron menor dedicación a las tareas de investigación. Creemos que tal vez esto se deba a la falta de tiempo con dedicación exclusiva para la investigación, siendo este un factor que probablemente mejore la oportunidad de investigar9, 17.
La asociación encontrada entre investigación y realización de cursos de investigación podría ser un indicador de una mayor valoración de estas actividades como parte de la formación de residentes, además de brindar herramientas para la realización de aquellas. Desconocemos si este tipo de cursos fue buscado por los residentes como motivación personal o bien si fue una tarea obligatoria dentro de la residencia.
En cuanto a la enseñanza formal en métodos de investigación, según Levine los directores de programas consideran importante la formación específica en tareas de investigación. A pesar de esto, ellos mismos refieren que la enseñanza formal y exhaustiva en diseños de investigación se da solo en un 18% de las residencias, un 23% formación en bioestadística, un 21% en ética de la investigación y hasta un 63% en búsqueda de bibliografía4, 14.
Un posible sesgo a considerar en nuestro estudio es el auto-informe de tareas de investigación y publicaciones, siendo estos temas sensibles para los respondedores.
Si bien la tasa de respondedores fue del 60%, podríamos pensar en la ocurrencia de un sesgo de selección. Al analizar la tasa de respuesta por año de residencia se encontró que los no respondedores fueron en mayor proporción residentes de los años superiores y si hubiera un sesgo, este podría incurrir en subestimar la asociación.
Por otro lado, en las entrevistas en terreno realizadas durante la investigación cualitativa no pudimos detectar que los residentes no respondedores fueran diferentes en algo a los respondedores, siendo en su mayoría residentes que se encontraban en rotaciones externas del hospital al momento de la evaluación.
La definición de investigación considerada en este proyecto fue la más amplia para poder abarcar todo el espectro que incluye las diferentes tareas de la investigación clínica, en concordancia a las recomendaciones del Accreditation Council for Graduate Medical Education. Así mismo se consideró tarea de investigación a la participación ya sea como investigador principal, investigador secundario, ayudante o funciones administrativas.
Solo un residente realizó funciones administrativas. La colaboración como ayudante tal vez refiera al residente que solo colaboró en la recolección de los datos. El contacto con una implementación concreta de un estudio de investigación podría sensibilizarlo para la participación en una segunda investigación con otro rol. Por otro lado, aun con una participación menor en la investigación, el hecho de participar aporta la experiencia sobre el circuito y validez del dato, sistemas para evitar errores, llenado de formularios, administración de consentimientos, adoptar sistemáticas de trabajo, cumplir procedimientos estándar y entrenamiento en buenas prácticas clínicas, requisitos para desarrollarse como investigador.
Si bien investigar incluye la generación de una pregunta de investigación, la implementación y el informe, en el presente estudio no se hizo la discriminación entre investigación de la industria farmacéutica y la independiente. La distinción pudiera no ser necesaria si se considera que el residente aprende y mejora sus competencias con todas las tareas de investigación que haya desempeñado en el proyecto.
Esta distinción tampoco se suele encontrar en la bibliografía internacional, ya que la investigación realizada por los residentes que está puesta bajo evaluación es la realizada en el contexto de la residencia y, como tal, en un entorno académico.
Una de las fortalezas de la presente comunicación es el alcance nacional que tuvo nuestro trabajo. Con el muestreo utilizado pudimos lograr la representatividad de todas las residencias de medicina interna del país.
Otra fortaleza es el tipo de análisis utilizado, ya que al tomarlos en conglomerados contemplamos al residente en su contexto. Esta metodología de análisis, cada vez más frecuente en la bibliografía, fue creciendo en losúltimos años, sobre todo desde el 2009 donde se introduce el término multilevel analysis como término MeSH en PubMed. No hemos encontrado esta metodología de análisis en distintos informes sobre residentes.
El conocimiento de los facilitadores y de las barreras existentes para realizar investigación podría contribuir a revisar programas para implementar cambios en los procesos de formación de los especialistas en medicina interna de nuestro país. Estas estrategias, implementadas y sostenidas en el tiempo aumentarían la tasa de producción de conocimiento científico, favorecerían el pensamiento crítico de nuestros médicos y mejorarían, en consecuencia, el nivel de la atención médica de nuestro país15.
Agradecimientos: Agradecemos al Ministerio de Salud de la Nación, (Comisión Nacional Salud Investiga) por el auspicio de esta investigación en el marco de la Beca Oñativia Carrillo 2007 "Estado Actual de las residencias de Clínica Médica en Argentina - estudio cuali-cuantitativo del contexto formativo", al Dr. Luis Cámera y a la Sociedad Argentina de Medicina, a todos los referentes regionales y colaboradores del proyecto: Natalia Pereiro, Juan Blanco, Gonzalo Barrientos, Jorge Farías, Alejandro Cragno, Gustavo Ellena, Alejandra Gaydou, Armando Kremer, Susana Salomón, Marcelo Yorio.
Conflictos de intereses: Los autores declaran no tener conflictos financieros o personales que hayan influenciado inapropiadamente la realización del trabajo y sus resultados.
1. Borrell Bentz R. La educación médica de posgrado en Argentina: el desafío de una nueva práctica educativa. 1 ed. Buenos Aires: OPS/OMS, 2005. [ Links ]
2. Barousse AP. Certificación de profesionales médicos en la especialidad Clínica Médica. Medicina (B Aires) 2002; 62: 609-11. [ Links ]
3. Accreditation Council for Graduate Medical Education ACGME Program Requirements for Residency Education in Internal Medicine http://www.acgme.org/acWebsite/downloads/RRC_progReq/140_im_07012007.pdf.; consultado julio 2007. [ Links ]
4. Levine RB, Hebert RS, Wright SM. Resident research and scholarly activity in internal medicine residency training programs. J Gen Intern Med 2005; 20: 155-9. [ Links ]
5. García GMG. Residencias del equipo de salud. Sistema Nacional de Acreditación de Residencias del Equipo de Salud. Criterios básicos. Integrantes del sistema. Registros, Min. Salud y Medio Ambiente. Dirección Nacional del Boletín Oficial: Buenos Aires, 2006. [ Links ]
6. Elizondo CM, Giunta DH, González Bernaldo de Quirós F, et al. Residencias de medicina interna en Argentina, 2008. Medicina (B Aires) 2010; 70: 143-50. [ Links ]
7. Van der Steen JT, Ooms ME, Ader HJ, Ribbe MW, van der Wal G. Withholding antibiotic treatment in pneumonia patients with dementia: a quantitative observational study. Arch Intern Med 2002; 162: 1753-60. [ Links ]
8. Meyers FJ, Weinberger SE, Fitzgibbons JP, et al. Redesigning residency training in internal medicine: the consensus report of the Alliance for Academic Internal Medicine Education Redesign Task Force. Acad Med 2007; 82: 1211-9. [ Links ]
9. Fletcher KE, Underwood W 3rd, Davis SQ, et al. Effects of work hour reduction on residents' lives: a systematic review. JAMA, 2005; 294: 1088-100. [ Links ]
10. Hamann KL, Fancher TL, aint S, Henderson MC. Clinical research during internal medicine residency: a practical guide. Am J Med 2006; 119: 277-83. [ Links ]
11. Alguire PC, Anderson WA, Albrecht RR, Poland GA. Resident research in internal medicine training programs. Ann Intern Med 1996; 124: 321-8. [ Links ]
12. Vinci RJ, Bauchner H, Finkelstein J, et al. Research during pediatric residency training: outcome of a senior resident block rotation. Pediatrics 2009; 124: 1126-34. [ Links ]
13. Kanna B, Deng C, Erickson SN, et al. The research rotation: competency-based structured and novel approach to research training of internal medicine residents. BMC Med Educ 2006; 6: 52. [ Links ]
14. Rivera JA Levine RB, Wright SM. Completing a scholarly project during residency training. Perspectives of residents who have been successful. J Gen Intern Med 2005; 20: 366-9. [ Links ]
15. Fuentes NA, Giunta DH, Pazo V, et al. Proyecto institucional para la educación médica continua en investigación clinica. Medicina (B Aires) 2010; 70: 240-6. [ Links ]
16. Pereiro ND, Elizondo C, Giunta D, Figa S. Clinical Eepidemiologic Research in Internal Medicine Residencies in Argentina. Qualitative Study, in 29Th World Congress of Internal Medicine 2008: Buenos Aires. [ Links ]
17. González García GM. Residencias del equipo de salud. Sistema Nacional de Acreditación de Residencias del Equipo de Salud. Criterios básicos. Integrantes del sistema. Registros. En: http://www.femeba.org.ar/fundacion/, Min. Salud y M. Ambiente, Dirección Nacional del Boletín Oficial: Buenos Aires, 2006. [ Links ]
Recibido: 9-4-2012
Aceptado: 24-7-2012
ARTÍCULO ORIGINAL
Human papillomavirus risk factors for infection and genotype distribution in aboriginal women from Northern Argentina
Gerardo D. Deluca1, Jorge Basiletti2, Joaquín V. González2, Nicolás Díaz Vásquez3, Raúl H. Lucero3, María A. Picconi2
1Facultad de Medicina, Universidad Nacional del Nordeste, Corrientes;
2Servicio de Virus Oncogénicos, Laboratorio Nacional de Referencia de Virus Papiloma Humano, Instituto Nacional de Enfermedades Infecciosas Carlos G. Malbrán, Buenos Aires;
3Instituto de Medicina Regional, Universidad Nacional del Nordeste, Chaco, Argentina
Dirección postal: Dr. Gerardo Daniel Deluca, Roldán 1307, 3500 Resistencia, Chaco, Argentina
e-mail: delucagd@gmail.com
Abstract
The mortality rate for cervical cancer (CC) in Northern Argentina is three times higher than the average for the country (7.8 deaths/100 000 women). We determined the prevalence and genotype distribution of human papillomavirus (HPV) in 227 sexually active women of the native Pilagá community in Formosa, Argentina. We also conducted an HPV-16 variant analysis and studied several community factors that might play a role in viral entry and infection. Endo- and exocervical samples were tested for HPV DNA with MY09/11-PCR or with GP5+/6+-PCR. HPV was detected in 46.7% of the samples and 21 different types were found; the most frequent being HPV-16 (19.4%), -6 and -18 (5.3%), -58 (3.5%) and -31 and -33 (3.1%). In relation to HPV-16 variants, 68.2% were European and 31.8% Asian-American. Among the cofactors analyzed only disposal of human excreta to the open air (P=0.01) was significantly associated with HPV infection. Our prevalence estimates clearly show that Pilagá women are highly exposed to or infected with high risk HPV types and therefore are at a high risk of developing precancerous lesions and eventually CC at the population level.
Key words: Aboriginal women; Human papillomavirus infection; Viral sexually transmitted disease
Resumen
Virus papiloma humano (hpv) en mujeres de la etnia Pilagá del nordeste argentino: Factores de riesgo de infección y distribución de tipos virales. La tasa de mortalidad por cáncer cervical (CC) en la región norte de la Argentina es tres veces más alta que la media del país (7.8 muertes/100 000 mujeres). En el presente trabajo se determinó la prevalencia de infección por virus papiloma humano (VPH) y la distribución y frecuencia de los genotipos en 227 mujeres sexualmente activas de la etnia aborigen Pilagá (Formosa, Argentina). También se realizó un análisis de las variantes intratípicas de VPH-16 presentes en la comunidad y se analizaron diversos factores socioculturales que podrían tener algún rol destacado en la transmisión de la infección viral. Se estudiaron muestras de células endo-exocervicales mediante PCR basadas en los cebadores MY09/11 y GP5+/6+ con posterior restricción enzimática y/o hibridación dot-blot. La infección por VPH fue detectada en el 46.7% de las mujeres analizadas. Fueron identificados 21 genotipos, de los cuales los más frecuentes fueron HPV-16 (19.4%), -6 y -18 (5.3%), -58 (3.5%) y -31 y -33 (3.1%). Respecto al HPV-16, se encontraron 68.2% de variantes europeas y 31.8% de asiático-americanas. Entre los cofactores analizados, solo la disposición de excretas al aire libre estuvo significativamente asociada con la infección por VPH (P = 0.01). Los datos obtenidos reflejan que la comunidad Pilagá está altamente expuesta a las infecciones por genotipos de alto riesgo de VPH, lo cual puede estar asociado a una alta incidencia de lesiones cervicales preneoplásicas y neoplásicas.
Palabras clave: Mujeres aborígenes; Infección por virus pailoma humano; Enfermedad viral de transmisión sexual
Human papillomavirus (HPV) infection is known to cause cervical cancer (CC)1, 2. More than 120 HPV types have already been characterized, but only the high-risk (HR-HPV) types are considered as true human carcinogens3. Within this group, HPV-16 and -18 are the most prevalent viral types associated with CC, accounting for more than 65-70% of cases worldwide4, 5.
Argentina is characterized by the multi-ethnic composition of its population. This particular situation explains the existence of large disparities in both socio-economic development and cultural characteristics, including sexual behaviour among communities from different regions of the country. Understanding how these features relate to the acquisition of HPV infections is important in order to identify subgroups that are at higher risk for CC6. The annual mortality rate for CC in Argentina is 7.8/100 000 women, but this rate is three times higher in the North Eastern region of the country, where a wide spectrum of Indian and isolated white communities live in unfavourable conditions in terms of socioeconomics and health7.
The aim of our study was to estimate the HPV prevalence in the Pilagá Indians, a native community from Northern Argentina, and to carry out HPV typing, HPV- 16 variant analysis and the study of several community factors that might play a role in viral entry and infection.
Materials and Methods
A cross-sectional community-based study was conducted between March 2007 and March 2009 among 235 women aged 13 to 68 (mean age 30 years) of the Pilagá aboriginal ethnia. After excluding samples that were not suitable for cytological and virological analysis, 227 women were finally included in this study, representing 20% of the total sexually active women in the community.
A standardized questionnaire was used to interview the participants regarding their clinical history, sexual behavior, cultural habits and socio-economic and living conditions. Confidentiality was guaranteed for all participants to ensure as frank and complete answers as possible. After providing informed consent, all women were examined by a gynecologist.
The study was reviewed and approved by the Ethics Committee of the Instituto de Medicina Regional of Universidad Nacional del Nordeste (Argentina) in accordance with the Helsinki Declaration.
Exfoliated cervical cells were collected from all women by sampling the ecto- and endocervix using a wooden spatula for Papanicolau smears (PAP) and a cytobrush for HPV DNA detection. Cervical cells from the latter were eluted in sterile phosphate-buffered saline (PBS) contained in a tube, and then transported on ice to the laboratory. Upon arrival at the lab, and after checking the sample container's integrity, the cells of each sample were pelleted by centrifugation and kept frozen at -70 °C until processing.
DNA was obtained by treating pellets with 400-700 µl of homogenization solution (2% cetyltrimethylammonium bromide,1.4 M NaCl, 0.2% ß-mercaptoethanol, 20 mM EDTA, 100 mM Tris-HCl pH 7.5), extracting the DNA using chloroform:isoamyl alcohol (24:1), then precipitating with absolute ethanol and resuspending in 50-100 µl of sterile bidistilled water. All samples were checked to assess the quality and integrity of the DNA by amplifying a known region of the human ß-globin gene (268 bp). Samples that were negative for the ß-globin test were discarded.
PAP smears were processed and analyzed according to the 2001 Bethesda Classification System. The final diagnosis was based on the worst morphological picture.
HPV DNA detection and typing was conducted using the widely known MY09/11 polymerase chain reaction (PCR) (450 bp PCR product) followed by the restriction fragment-length polymorphisms (RFLP) technique, as previously described8, 9. Briefly, the products of MY09/11 PCR were first electrophoresed on a 2% agarose gel, stained with ethidium bromide and visualised under UV light. Then, the amplicons of positive samples were digested by seven restriction enzymes (BamHI, DdeI, HaeIII, HinfI, PstI, RsaI and Sau3AI) in individual microtubes. After that, the RFLP product of each sample was electrophoresed on a 3% agarose gel, stained with ethidium bromide, and photographed under UV light. Each restriction pattern was compared with published data to identify the genotype(s) involved.
HPV-positive samples that were difficult to analyze by PCR-RFLP either due to the presence of nonspecific amplimers or weak amplicon signals on agarose gels, were reanalyzed by PCR using GP5+/6+ primers followed by dot-blot hybridization with type-specific oligonucleotide probes as previously described10. Probes for HPV types 6, 11, 16, 18, 31, 33 and 45 were used. The bound probes were detected with streptavidin-horseradish peroxidase and enhanced chemiluminescent substrate (Amersham ECLT Systems). Samples that remained untyped were classified as undetermined HPV types (HPV-X).
To determine the genotype variants of the HPV-16-positive samples, a 364-bp segment (nucleotide positions 7478 to 7841) of the long control region (LCR) was analyzed by PCR-sequencing according to the method described by Ho et al11. The LCR sequencing reaction was performed using the Big Dye-terminator 3.1 chemistry, and DNA sequencing was conducted using the Applied Biosystems Division Automated 3100 DNA Analyzer.
All completed interviews were carefully reviewed by the researchers for completeness prior to entering data into computer files. Continuous variables were categorized, and the risk associated with HPV positivity was calculated for each category of a variable, adjusted by age. Univariate statistics were calculated for all variables, and multivariate logistic regression analysis was performed in order to identify the independent variables that influence the relative risk of HPV positivity (95% CI). The limit of statistical significance was set at p<0.05. Data were analyzed using the Epi-InfoTM 3.5.1 Statistical Program (Centers for Disease Control and Prevention, Atlanta, GA).
Results
Out of the 227 women included in the study, 36 (15.8%) had negative PAP smears for squamous intraepithelial lesion (SIL) or malignancy, 173 (76.2%) showed reactive cellular changes (RCC) (mainly due to inflammation), 16 (7%) low-grade SIL (LG-SIL), 1 (0.4%) high-grade SIL (HG-SIL), and 1 (0.4%) CC. HPV DNA was detected in 46.7% of the samples (106/227 women) with statistically significant differences in terms of positive results according to the cytological category; the prevalence of HPV was estimated as 27.8% in women with a normal PAP test, 46.2% in women with RCC, 87.5% in women with LG-SIL and 100% in women with HG-SIL and CC (P=0.01). Table 1 shows the results of the detection of HPV DNA and the distribution of the positive results according to the risk grade of the HPV and cytological category.
TABLE 1.- HPV infection stratified by grade of cervical status among sexually active women of the Pilagá community

aAccording to 2001 Bethesda System; bReactive cellular changes. Subcategory of negative for SIL or malignity; cLow-grade squamous intraepithelial lesion; dHigh-grade squamous intraepithelial lesion; eCervical cancer; fhigh-risk HPV type.
The socio-economic evaluation of the living conditions of the Pilagá community showed that the majority of the participants had completed elementary school education (76.8%), but only 27.5% had a formal or informal occupation at the time of the study; 98.3% had no sanitary latrines in their houses and only 5% had well water for drinking and cleaning. Two logistic regression models generated prevalence odds ratio estimates of HPV DNA detection associated with each socioeconomic, behavioural and sexual characteristic. One model was adjusted for age effects and one was further adjusted for all variables considered as possible confounders (data not shown). We were unable to evaluate the impact of tobacco or the use of oral contraceptives because only a small proportion of women referred to a smoking habit (3.1%) and less than 6% of the women had used oral contraceptives at some point in their life. There was no association between age, age at first intercourse, number of lifetime sexual partners, number of pregnancies, level of literacy, employment and the risk of HPV infection. However, we found a significant correlation between HPV-positive results and the disposal of human excreta to the open air (41/71 = 57.5%) instead of using sanitary latrines (64/156 = 41.7%; OR: 2.38, CI 95% = 1.19-4.75, P = 0.01).
The individual prevalence of the 21 detected HPV types is presented in Table 2. Overall, the most frequent HPV types were HPV-16 (19.4%), -6 and -18 (5.3%), -58 (3.5%) and -31 and -33 (3.1%). Multiple HPV infections were observed in 28 cases (12.3%), including 24 cases with two viral types and 4 cases with three different genotypes. Out of them, 25 multiple infections involved one or more high-risk HPV types.
TABLE 2.- Prevalence of 21 HPV types by cytological findings and overall among 227 Pilagá women, Northern Argentina
aSum of distribution percentages exceeds the total number of prevalence because, in the numerator, women with multiple infections are counted in each of the HPV types found. bIncludes HPV-types of unknown oncogenic risk (HPVs 62, 71, 84, 102). cHPVs that could not be typed. dHPV-types covered by licensed vaccines; the percentages displayed in this section can be taken as the effective coverage of vaccines only under the assumption of full cross-protection between HPVs 16/18 and 31/45, which remain to be determined.
In relation to HPV-16, 22 positive cervical samples were examined to determine the genomic variants of this viral type. Of these, 7 (31.8%) were Asian-American (AA) variants and 15 (68.2%) were European (E) (Table 3).
TABLE 3.- Nucleotide substitutions identified in the LCRa sequence of European and non-European variants compared to HPV-16 reference sequence

aLong Control Region. bEuropean. cAsian-American
Discussion
Only a few epidemiological studies have estimated HPV prevalence, HPV type distribution and the risk factors associated with HPV infection in South American Indian populations12-16. However, these communities constitute a substantial proportion of the population in certain regions of Latin America, as in Northern Argentina. Furthermore, the particular conditions of aboriginal communities in terms of migration, social exchange and specific sexual habits can have an important impact on public health, mostly due to interactions with the inhabitants of nearby regions. Despite the numerous logistical and cultural barriers that have hindered our work in the Pilagá population, we were able to recruit and study 20% of the sexually active women in this community.
The cervical cytology study showed that 92.1% of the women analyzed had a normal PAP test; however, a high proportion of this cytological category (82.8%) showed inflammatory changes, mainly due to bacterial and/or parasitic infection (data not shown). This situation is very common among aboriginal communities in Northern Argentina, and mainly reflects their almost non-existent access to healthcare6, 13, 14.
The worldwide prevalence of HPV infection ranges from 2 to 44% in the general population and, on the whole, developing countries seem to have higher rates4,17. A consistent worldwide meta-analysis on global HPV prevalence showed an infection rate of 10.4% for the world and 12.9% for Latin America, HPV-16 being the most common type in both normal and pathological populations17. In our study, the overall prevalence of HPV was very high (46.7%), similar to the values found in developing countries having serious problems in implementing and maintaining a sustainable gynecologic health policy18,19. It is also comparable with the results obtained by other authors for other indigenous populations of Northern Argentina (prevalence ranging from 52% to 60%)12, 13, but clearly exceeds the mean frequency for populations from the central and southern regions of the country and for Latin America4, 17, 20. There was no trend pattern between HPV prevalence and age. Indeed, HPV prevalence in this community was high in all age groups (around 30-60%), and the customary peak among young women, as well as the steady decrease among middle-aged women, described in a number of regions, was not observed in this population21, 22. Accordingly, a lack of a decrease of HPV with age was previously observed in regions with an overall high HPV prevalence23-25.
In relation to the genotypes found, the high-risk HPV types were present in 67% of all infected women, and HPV-16 clearly stood out among the 21 different types identified in this work, consistent with worldwide data and with previous studies on different populations in Argentina4, 17, 12, 13. In addition, the four HPV types most prevalent in Pilagá women (HPV-16, -18, -6, and -11) represented 70% of all infections detected and 32.6% of the total number of women analyzed. These are very important baseline data for estimating the theoretical impact of the HPV vaccine and for planning future postvaccination epidemiological surveillance.
The proportion of infections by multiple HPV types was within the expected range, most of them involving high-risk types (87.5%) and being more frequent in PAP smears with RCC and L-SIL+ than in normal ones. Other studies have shown a similar tendency26, and since the implication of HPV infection with multiple genotypes remains unclear for CC development, it is important to accumulate epidemiological information for further analysis27, 28.
Among the risk factors analyzed in the Pilagá community for HPV infection, the disposal of excreta in the open air was found to be significantly related to a positive HPV DNA result. Although it was surprising, it is a clear indicator of the living conditions of certain populations that can favour the spread of any infectious disease. The absence of an association between HPV positivity and other common risk factors described in other regions and populations (e.g. number of pregnancies, age at first intercourse, number of lifetime sexual partners, level of literacy) is not unexpected since the elevated HPV prevalence found in all age groups of this series tends to override the effect of such factors.
In relation to HPV-16 variants, the current epidemiological knowledge suggests that the non-European, and particularly the Asian-American variants (AA), are more closely related to CC development. In addition, more recent epidemiological evidence showed that among the European (E) branch, the non-prototypic variants (non- G1) could have a higher oncogenic potential29-31. We only found E and AA branches in the Pilagá women; the former predominated, accounting for 68.2% of the cases, but its prevalence was lower than in other indigenous groups of Brazil and Argentina32-34. Altogether, the proportion of non-prototypic, potentially oncogenic HPV-16 variants (i.e. non G1 E plus AA) was 54.5% in HPV-16-positive Pilagá women, providing an additional risk factor for CC development in this vulnerable community.
The prevalence estimates provided by this work clearly show that Pilagá women are highly exposed to or infected by HPV and therefore are at high risk of developing precancerous lesions and eventually CC at the population level. In this sense, it must be remembered that there is an estimated incidence of CC of 15.1/100 000 women/year (age standardized) in our study area. The Argentinean Health Ministry recently announced the implementation of vaccination strategies against diseases caused by HPV. This study provides valuable baseline knowledge about the prevalence and type distribution of HPV in Northern Argentina prior to the introduction of HPV vaccination.
1. Schiffman M, Castle PE, Jeronimo J, Rodriguez AC, Wacholder S. Human papillomavirus and cervical cancer. Lancet 2007; 370: 890-907. [ Links ]
2. IARC Working Group on the Evaluation of Carcinogenic Risks to Humans. Human papillomaviruses. IARC Monogr Eval Carcinog Risks Hum 2007; 90: 1-636. [ Links ]
3. Muñoz N, Bosch FX, de Sanjosé S, et al. Epidemiologic classification of human papillomavirus types associated with cervical cancer. N Engl J Med 2003; 348: 518-27. [ Links ]
4. Bruni L, Díaz M, Castellsagué X, Ferrer E, Bosch FX, de Sanjosé S. Cervical human papillomavirus prevalence in 5 continents: meta-analysis of 1 million women with normal cytological findings. J Infect Dis 2010; 202: 1789-99. [ Links ]
5. Clifford GM, Smith JS, Aguado T, Franceschi S. Comparison of HPV type distribution in high-grade cervical lesions and cervical cancer: a meta-analysis. Br J Cancer 2003; 89: 101-5. [ Links ]
6. Arrossi S, Ramos S, Paolino M, Sankaranarayanan R. Social inequality in Pap smear coverage: identifying under-users of cervical cancer screening in Argentina. Reprod Health Matters 2008; 16: 50-8. [ Links ]
7. Arrossi S. Proyecto para el mejoramiento del Programa Nacional de Prevención de Cáncer de Cuello Uterino en Argentina. Informe final: Diagnóstico de situación del Programa Nacional y Programas Provinciales. 1° ed. Buenos Aires: Organización Panamericana de la Salud, OPS; 2008. In: http://www.msal.gov.ar/cancer-cervico-uterino/pdf/info-equipos-salud/Diagnostico_Pub64_OPS.pdf (last accessed 14-11-2011). [ Links ]
8. Bernard HU, Chan SY, Manos MM, et al. Identification and assessment of known and novel human papillomaviruses by polymerase chain reaction amplification, restriction fragment length polymorphisms, nucleotide sequence, and phylogenetic algorithms. J Infect Dis 1994; 170: 1077-85. [ Links ]
9. Manos MM, Ting Y, Wright DK, Lewis AJ, Brocker TR, Wolinsky SM. The use of polymerase chain reaction amplification for the detection of genital human papillomavirus. Cancer Cells 1989; 7: 209-14. [ Links ]
10. de Roda Husman AM, Walboomers JM, van den Brule AJ, Meijer CJ, Snijders PJ. The use of general primers GP5 and GP6 elongated at their 3' ends with adjacent highly conserved sequences improves human papillomavirus detection by PCR. J Gen Virol 1995; 76 (Pt 4): 1057-62. [ Links ]
11. Ho L, Chan SY, Burk RD, et al. The genetic drift of human papillomavirus type 16 is a means of reconstructing prehistoric viral spread and the movement of ancient human populations. J Virol 1993; 67: 6413-23. [ Links ]
12. Picconi MA, Gronda J, Alonio LV, et al. Human Papilloma virus in Quechua women from Jujuy with high frequency of cervical cancer: viral types and HPV-16 variants. Medicina (B Aires) 2002; 62: 209-20. [ Links ]
13. Tonon SA, Picconi MA, Zinovich JB, et al. Human papillomavirus cervical infection in Guarani Indians from the rainforest of Misiones, Argentina. Int J Infect Dis 2004; 8: 13-9. [ Links ]
14. Soto-De Leon S, Camargo M, Sanchez R, et al. Distribution patterns of infection with multiple types of human papillomaviruses and their association with risk factors. PLoS One 2011; 6: e14705. [ Links ]
15. Brito EB, Silva ID, Stávale JN, Taromaru E, Menezess RC, Martins SJ. Amerindian women of the Brazilian Amazon and STD. Eur J Gynaecol Oncol 2006; 27: 279-81. [ Links ]
16. Kightlinger RS, Irvin WP, Archer KJ, et al. Cervical cancer and human papillomavirus in indigenous Guyanese women. Am J Obstet Gynecol 2010; 202: 626. e1-7. [ Links ]
17. de Sanjosé S, Díaz M, Castellsagué X, et al. Worldwide prevalence and genotype distribution of cervical human papillomavirus DNA in women with normal cytology: a meta-analysis. Lancet Infect Dis 2007; 7: 453-9. [ Links ]
18. Parkin DM, Almonte M, Bruni L, Clifford G, Curado MP, Piñeros M. Burden and trends of type-specific human papillomavirus infections and related diseases in the Latin America and Caribbean region. Vaccine 2008; 26: L1-15. [ Links ]
19. Almonte M, Albero G, Molano M, Carcamo C, García PJ, Pérez G. Risk factors for human papillomavirus exposure and co-factors for cervical cancer in Latin America and the Caribbean. Vaccine 2008; 26: L16-36. [ Links ]
20. Lippman SA, Sucupira MCA, Jones HE, et al. Prevalence, distribution and correlates of endocervical human papillomavirus types in Brazilian women. Int J STD AIDS 2010; 21: 105-9. [ Links ]
21. Franceschi S, Herrero R, Clifford GM, et al. Variations in the age-specific curves of human papillomavirus prevalence in women worldwide. Int J Cancer 2006; 119: 2677-84. [ Links ]
22. Smith JS, Melendy A, Rana RK, Pimenta JM. Age-specific prevalence of infection with human papillomavirus in females: a global review. J Adolesc Health 2008; 43: S5-25, S25. e1-41. [ Links ]
23. Franceschi S, Rajkumar R, Snijders PJF, et al. Papillomavirus infection in rural women in southern India. Br J Cancer 2005; 92: 601-6. [ Links ]
24. Muñoz N, Méndez F, Posso H, et al. Incidence, duration, and determinants of cervical human papillomavirus infection in a cohort of Colombian women with normal cytological results. J Infect Dis 2004; 190: 2077-87. [ Links ]
25. Tábora N, Bakkers JM, Quint WG, et al. Human papillomavirus infection in Honduran women with normal cytology. Cancer Causes Control 2009; 20: 1663-70. [ Links ]
26. Spinillo A, Dal Bello B, Gardella B, Roccio M, Dacco MD, Silini EM. Multiple human papillomavirus infection and high grade cervical intraepithelial neoplasia among women with cytological diagnosis of atypical squamous cells of undetermined significance or low grade squamous intraepithelial lesions. Gynecol Oncol 2009; 113: 115-9. [ Links ]
27. Trottier H, Mahmud S, Costa MC, et al. Human papillomavirus infections with multiple types and risk of cervical neoplasia. Cancer Epidemiol Biomarkers Prev 2006; 15: 1274-80. [ Links ]
28. Bello BD, Spinillo A, Alberizzi P, et al. Cervical infections by multiple human papillomavirus (HPV) genotypes: Prevalence and impact on the risk of precancerous epithelial lesions. J Med Virol 2009; 81: 703-12. [ Links ]
29. Sichero L, Ferreira S, Trottier H, et al. High grade cervical lesions are caused preferentially by non-European variants of HPVs 16 and 18. Int J Cancer 2007; 120: 1763-8. [ Links ]
30. Xi LF, Koutsky LA, Hildesheim A, et al. Risk for high-grade cervical intraepithelial neoplasia associated with variants of human papillomavirus types 16 and 18. Cancer Epidemiol Biomarkers Prev 2007; 16: 4-10. [ Links ]
31. Sichero L, Villa LL. Epidemiological and functional implications of molecular variants of human papillomavirus. Braz J Med Biol Res 2006; 39: 707-17. [ Links ]
32. Tonon SA, Basiletti J, Badano I, et al. Human papillomavirus type 16 molecular variants in Guarani Indian women from Misiones, Argentina. Int J Infect Dis 2007; 11: 76-81. [ Links ]
33. Picconi MA, Alonio LV, García Carrancá A, et al. Molecular variants of human papillomavirus (HPV) types 16 and 18 in adenocarcinomas of the cervix. Medicina (B Aires) 2000; 60: 889-94. [ Links ]
34. Alencar TR, Cerqueira DM, da Cruz MR, Wyant PS, Ramalho ED, Martins CR. New HPV-16 European and non-European variants in Central Brazil. Virus Genes 2007; 35: 1-4. [ Links ]
Recibido: 15-5-2012
Aceptado: 12-9-2012
ARTÍCULO ORIGINAL
Injertos cutáneos, hábito de fumar y diabetes mellitus tipo 2
Joaquín Pérez-Guisado1, Félix T. Fidalgo-Rodríguez1*, Kate L. Gaston2, Luis F. Rioja1, Steven J. Thomas2
1Servicio de Cirugía Plástica, Estética y Reparadora, Hospital Universitario Reina Sofía, Córdoba, España,
2UAB Burn Center, University of Alabama at Birmingham, Alabama, USA
*Fallecido en Córdoba (España) el 26-VIII-2012
Dirección postal: Dr. Joaquín Pérez-Guisado, Servicio de Cirugía Plástica, Estética y Reparadora, Hospital Universitario de Reina Sofía, Hospital Provincial, Av. Menéndez Pidal s/n 14004, Córdoba, España
Teléfono (00-34) 957212072 e-mail: pv1peguj@uco.es
Resumen
El tabaco y la hiperglucemia reducen significativamente el éxito de los injertos cutáneos. El estrés oxidativo y la disfunción endotelial son factores que se asocian tanto al tabaquismo como a la diabetes mellitus (DM) tipo 2. El objetivo de este estudio fue constatar si existe una asociación entre estos factores de riesgo y el descenso en el porcentaje de éxito de los injertos en pérdidas cutáneas de diversa etiología. Estudio bicéntrico, retrospectivo, de casos y controles, llevado a cabo de enero 2000 a diciembre 2009, en los centros hospitalarios de Reina Sofía (Córdoba, España) y Birmingham (Alabama, EE.UU.), con 2457 pacientes que cumplían los criterios de inclusión. El éxito del injerto p ara cada grupo fue analizado mediante chi-cuadrado. El intervalo de confianza fue del 95%. El hábito de fumar y la DM tipo 2 disminuyeron el porcentaje de éxito de los injertos comparados con sus grupos controles, siendo el efecto de la DM tipo 2 mayor que el del tabaco. Se observó un descenso altamente significativo del porcentaje de injertos prendidos, del 18% en el grupo de fumadores (de 86% a 68%), y del 25% en el grupo de los diabéticos (de 78% a 53%). El cálculo de OR demostró asociación entre los factores de riesgo estudiados y el menor éxito de los injertos cutáneos, siendo mayor para la DM tipo 2. En conclusión: la DM tipo 2 y el hábito de fumar son factores que influyen negativamente en el éxito de los injertos cutáneos.
Palabras clave: Fijación injerto; Hiperglucemia; Pérdida injerto; Diabetes mellitus tipo 2; Tabaquismo
Abstract
Skin graft, smoking and diabetes mellitus type 2. Smoking and hyperglycemia decrease the success of skin graft survival in specific circumstances. It is well known that smoking and diabetes mellitus (DM) type 2 increase the oxidative and impair the endothelial function. The objective of this retrospective study was to determine if smoking and DM type 2 are factors associated with lower skin graft survival, in different etiologies of the injury associated to the skin loss. It was a bicentric, retrospective, cross sectional case control study, carried out on 2457 medical patients who met the inclusion criteria. It was carried out over a 10 years period between January 2000-December 2009, at Reina Sofía University Hospital (Córdoba, Spain) and UAB Hospital at Birmingham (Alabama, USA). The percentage of successful graft for each group and its control were analyzed by Chi-square test. The confidence interval chosen for statistical differences was 95%. Smoking and DM type 2 decreased the percentage of skin graft survival when compared with their control groups. DM type 2 was associated with greater negative success on skin graft survival than smoking when compared with their control groups.. There was a statistically significant drop in skin graft of 18% in smoking group (range: 68-86%) and 25% in DM type 2 group (53-78%). The OR showed a clear association between the risk factors studied and the lower skin graft success, being stronger for DM type 2. In conclusion, DM type 2 and smoking are factors associated to lower skin graft take.
Key words: Graft fixation; Graft loss; Graft survival; Hyperglycemia; Diabetes mellitus type 2; Smoking
El tabaco y la diabetes mellitus (DM) tipo 2 son causas reconocidas de aumento de la mortalidad, mayor incidencia de enfermedad cardiovascular y cáncer1. Estudios recientes han demostrado su asociación con enfermedades como la arterioesclerosis2, el síndrome coronario agudo en pacientes jóvenes3, el cáncer de páncreas4 y la disfunción eréctil5.
El incremento de la inflamación, el estrés oxidativo y la disfunción endotelial son factores que se asocian tanto al tabaquismo como la DM tipo 21. Además, el tabaco por sí solo se considera un factor de riesgo independiente para el desarrollo y peor pronóstico de DM tipo 26, 7.
La supervivencia de los injertos cutáneos, en sus fases iniciales depende de un proceso de imbibición procedente del lecho, hasta que alrededor de los 4 o 5 días comienza a producirse el fenómeno de neovascularizacion8.
Con frecuencia nos encontramos en nuestra práctica diaria con pacientes fumadores y diabéticos en los que debemos practicar procedimientos reconstructores con diferentes grados de complejidad. Sabemos que el hábito de fumar influye negativamente en el éxito de los colgajos, tanto pediculados como libres. Del mismo modo, aceptamos que los pacientes diabéticos presentan problemas de cicatrización debido a alteraciones en la micro circulación periférica. Sin embargo, encontramos pocos datos en la bibliografía para documentar la influencia que estos factores ejercen sobre uno de los procedimientos reconstructores más usados como son los injertos cutáneos.
El hábito de fumar9 y la hiperglucemia10 han demostrado provocar un descenso en el éxito de los injertos cutáneos en dos situaciones concretas: la amputación del pulpejo de los dedos reparada mediante injerto cutáneo, y los injertos como tratamiento quirúrgico en los pacientes quemados. Para aclarar estos aspectos decidimos estudiar la relación existente entre el hábito de fumar y la diabetes mellitus tipo 2 con el éxito de los injertos cutáneos.
El objetivo de este estudio fue constatar si existe una asociación entre estos dos factores de riesgo y el descenso en el porcentaje de éxito de los injertos en forma genérica, independientemente de la localización y del tipo de lesión que llevan a este procedimiento quirúrgico.
Materiales y métodos
Se trata de un estudio bicéntrico, retrospectivo, de casos y controles, con un total de 2457 pacientes incluidos en el período de tiempo comprendido entre enero de 2000 y diciembre de 2009. El estudio fue realizado tomando los datos procedentes de 2 hospitales, uno español y otro de EE.UU. En el español se tomaron 894 pacientes, tratados en el servicio de Cirugía Plástica, Estética y Reparadora del Hospital Universitario Reina Sofía de Córdoba, y en el de EE.UU. 1563 pacientes del UAB Burn Center, University of Alabama, Birmingham.
Los criterios de inclusión fueron: lesión que necesite reconstrucción mediante injerto cutáneo, porcentaje de superficie corporal afectada inferior al 20%, edad superior a 18 años (debido a que el comité ético de la Universidad de Alabama no permitía la inclusión de pacientes de edades inferiores en este tipo de estudios), injertos de espesor parcial (ya sea obtenidos con dermátomo manual o automático) y no empleo de fibrina como herramienta para favorecer el éxito de los injertos.
Los criterios de exclusión fueron: zonas consideradas difíciles para la realización de injertos (perineo, axilas o pliegues inguinales y glúteos), pacientes que simultáneamente fueran fumadores y diabéticos tipo 2, así como aquellos que presentaran otros factores de riesgo asociados como alcoholismo crónico, pobre estado nutricional previo o heridas infectadas.
Con relación al grupo de diabéticos, consideramos para este estudio a diabéticos tipo 2 insulino-dependientes con una historia de al menos 10 años de evolución del tratamiento de la enfermedad. En cuanto al grupo de fumadores, se incluyeron sujetos que consumían al menos un paquete diario (20 cigarrillos al día) con una historia de consumo de al menos 10 años. Cada grupo de casos fue comparado con su correspondiente grupo de controles.
Para el brazo español del estudio, no fue necesaria la autorización por parte del Comité Ético del Hospital Universitario de Reina Sofía (Córdoba, España) ya que se trataba de un estudio retrospectivo que reunía todos los requerimientos necesarios para evitar esta obligación. No obstante, para el brazo americano, fue necesario presentar una solicitud de autorización de proyecto de investigación al Comité Ético del Hospital Universitario de Birmingham (Alabama, USA). El estudio fue autorizado asignándosele el protocolo número X100615005.
El anonimato de los pacientes fue preservado en todo momento en ambos brazos del estudio.
Se determinó que los grupos control fueran equivalentes a sus respectivos grupos de casos para las variables estudiadas (Tabla 1). Se utilizó el test Chi-cuadrado con la corrección de Yates para la comparación de variables cuyos resultados eran expresados en porcentajes (variables cualitativas), es decir, el sexo y el mecanismo lesional. De igual forma se utilizó la prueba t de Student para la comparación de variables cuyos resultados fueron expresados como medidas centrales y de dispersión (variables cuantitativas), es decir, la edad y la superficie corporal a injertar (SCAI).
TABLA 1.- Características de los pacientes incluidos en el presente estudio

Las diferencias estadísticas del porcentaje de éxito de los injertos de cada grupo y sus controles fueron analizadas mediante el test Chi-cuadrado con la corrección de Yates (Tabla 2). Como parámetro epidemiológico para medir la fuerza de la asociación entre los supuestos factores de riesgo (el tabaquismo y la diabetes tipo 2) y el fracaso de los injertos se utilizó el Odds Ratio (OR).
TABLA 2.- Porcentaje de éxito de los injertos

Para analizar estadísticamente los datos se utilizó el programa estadístico SPSS 12.0 (SPSS Inc., Chicago, IL, USA), expresándose los resultados como la media ± desvío estándar. El intervalo de confianza elegido fue del 95%.
Resultados
Como se puede ver en la Tabla 1, al realizar el test Chi-cuadrado y la t de Student, el grupo de fumadores y de diabéticos tipo 2 eran equivalentes a sus respectivos controles para todas las variables estudiadas que consideramos pudieran afectar a los resultados: edad, sexo, porcentaje de superficie corporal afectada a injertar (SCAI) y mecanismo lesional.
La edad media para el grupo de fumadores fue de 46 ± 8 años, y para los controles de 47 ± 10 años; para los diabéticos tipo 2 fue de 69 ± 11 años, y para los controles de 68 ± 14 años. En cuanto al sexo, en el grupo de fumadores había 555 hombres y 326 mujeres, y en el grupo control 595 hombres y 321 mujeres. En el grupo de diabéticos tipo 2 había 151 hombres y 133 mujeres y en los controles 164 hombres y 152 mujeres. Con relación al porcentaje de SCAI, en el grupo de fumadores y controles la SCAI media fue de 9.7 ± 4.5 y 9.2 ± 4.3 respectivamente. Para los diabéticos tipo 2 y controles fue 1.5 ± 0.4 y de 1.7 ± 0.6 respectivamente. Por último, con respecto a lesiones, en el grupo de fumadores había 537 (60.95%) quemados y en los controles 614 (62.91%). Para los diabéticos tipo 2 había 13 (18.84%) y en los controles 13 (13.00%) (Tabla 1).
Como no se encontraron diferencias significativas entre los datos de los pacientes de ambos centros, se analizaron conjuntamente para dotar al estudio de mayor potencia estadística.
En la Tabla 2 puede observarse el porcentaje de éxito de los injertos en cada grupo. En los fumadores hubo 599 injertos con éxito de 881 totales, y en los controles 839 de 976. Con relación a los diabéticos tipo 2, hubo 151 injertos con éxito de 284 y en los controles 246 de 316.
El test Chi cuadrado de la diferencia entre los grupos en estudio y los controles dio un p = 0.0000 y el OR 2.88 para el tabaquismo y 3.10 para la DM2, indicando asociación entre los factores de riesgo y el menor éxito de los injertos.
Discusión
El tabaco se ha relacionado con un descenso significativo en el éxito de los injertos cutáneos cuando siguen a la amputación del extremo distal de los dedos9. La hiperglucemia también se asocia a un mayor fracaso de los injertos cuando éstos se realizan en pacientes quemados10. Nuestros hallazgos sugieren que la DM tipo 2 se asocia con mayor descenso en el índice de éxito de los injertos cutáneos al compararla con el hábito tabáquico. En el grupo de diabéticos se observó un descenso del 25% en el porcentaje de éxito, mientras que en los fumadores fue del 18%. Si comparamos el éxito del injerto en el grupo de los fumadores con el de los diabéticos, vemos que el de los diabéticos es claramente inferior, observándose una diferencia del 15%: 68% vs. 53%. Sin embargo, estos resultados no son comparables y se deben considerar con prudencia, teniendo en cuenta que los pacientes diabéticos y sus controles tenían una edad media de 23 años superior al grupo de los fumadores y sus controles, y la edad podría actuar también negativamente disminuyendo el éxito de los injertos. No obstante, al anular el efecto de la edad, comparando el grupo de diabéticos con el de sus controles (ambos tienen la misma edad), vemos que la diabetes tiene por sí sola la capacidad de descender un 25% (78% a 53%) mientras que en el caso del tabaco la reducción fue del 18% (86% a 68%) en el éxito del injerto. Cuando se controla la variable edad, la diferencia entre el descenso en el éxito de los injertos provocado por la DM tipo 2 y el tabaco, sería del 7% (25% vs. 18%), mientras que cuando la comparación se realiza sin tener en cuenta esta variable la diferencia ascendía al 15% (68% vs. 53%). Se podría plantear la hipótesis que la diferencia existente del 8% (15%-7%) sería debida a la diferencia de edad entre ambos grupos (DM tipo 2 y fumadores) y el 7% restante al mayor efecto que ejercería la DM tipo 2 al compararla con el hábito tabáquico. Lo que sí está claro, es que independientemente de la edad, la DM tipo 2 tiene mayor efecto negativo que el tabaquismo sobre el éxito de los injertos cutáneos; esto viene avalado por una mayor fuerza de asociación representada por una OR más elevada (3.10 frente a 2.88).
Además de la diferencia de edad, la SCAI es mayor en el grupo de los pacientes fumadores y sus controles, debido a la naturaleza de los traumatismos causales. Las quemaduras son más comunes en las edades comprendidas entre los 38 ± 18 años11, y las probabilidades de tener una mayor superficie corporal afectada que requiera injertos como tratamiento es mayor debido al mecanismo lesional asociado a estas edades: la quemadura. Prueba de ello es que el 67% de los pacientes fumadores y sus controles eran pacientes quemados, mientras que en el grupo de los diabéticos y sus controles solo encontramos un 4% de pacientes con quemaduras como causa de la pérdida de sustancia que requirió el injerto cutáneo.
También debemos añadir que las heridas objeto de estudio estaban localizadas en áreas parecidas, tras descartar del estudio, como ya se dijo, las áreas anatómicas consideradas de mayor fracaso. Además, consideramos que el mismo tipo de herida sería tratado de forma similar por el mismo cirujano, independientemente de si el paciente fuera diabético, fumador o no tuviera ninguno de estos factores de riesgo, por lo que teóricamente su efecto no influiría en los resultados.
Vibe y Pless12 encontraron que en la población general el porcentaje de éxito de los injertos sin el empleo de fibrina era aproximadamente de 83%, porcentaje similar a los hallados en nuestros grupos control: grupo control de fumadores 86 ± 2.4% y grupo control de diabéticos 78 ± 4.2%.
Analizando nuestros resultados y comparándolos con los de Vibe y Pless pensamos que el habito de fumar y la diabetes tipo II, si se presentasen en un mismo paciente de forma simultánea, podrían provocar un efecto aditivo negativo en los injertos cutáneos, superior al que ejercería la DM tipo 2 o el tabaco por sí solos, aunque esto necesita ser demostrado.
En cuanto a los mecanismos que pudieran ser responsables de este menor resultado, si consideramos que en las fases iniciales de la supervivencia de los injertos cutáneos es fundamental la imbibición plasmática procedente del lecho y el fenómeno de neovascularizacion8, podríamos pensar que tanto el tabaquismo como la diabetes tipo 2 ejercerían su efecto negativo sobre estas fases iniciales a través del ya reconocido incremento de la inflamación, el estrés oxidativo y la disfunción endotelial que son capaces de provocar por sí mismos1.
Por todo lo anterior, ante un paciente con DM tipo 2 o con hábito tabáquico, debiéramos emplear todos los medios a nuestro alcance para favorecer la evolución favorable de los injertos, por tratarse de factores de riesgo.
En conclusión, la DM tipo 2 y el hábito tabáquico son factores asociados a un peor pronóstico de los injertos cutáneos.
Agradecimientos: Agradecemos la ayuda prestada por el Dr. Maclenan para el proceso de solicitud de autorización del proyecto de investigación al comité ético del Hospital Universitario de Birmingham (Alabama, EE.UU.).
Conflictos de interés: Los autores declaran no tener conflictos de interés.
1. Ding EL, Hu FB. Smoking and type 2 diabetes: under recognized risks and disease burden. JAMA 2007; 298: 2675-6. [ Links ]
2. Mathur RK. Role of diabetes, hypertension, and cigarette smoking on atherosclerosis. J Cardiovasc Dis Res 2010; 1: 64-8. [ Links ]
3. Alanbaei M, Zubaid M, Al-Mallah MH, et al. Impact of diabetes and smoking epidemic in the Middle East on the presentation with acute coronary syndrome in very young patients. Angiology 2012; 63: 48-54. [ Links ]
4. Matsubayashi H, Maeda A, Kanemoto H, et al. Risk factors of familial pancreatic cancer in Japan: current smoking and recent onset of diabetes. Pancreas 2011; 40: 974-8. [ Links ]
5. Zedan H, Hareadei AA, Abd-Elsayed AA, Abdel-Maguid EM. Cigarette smoking, hypertension and diabetes mellitus as risk factors for erectile dysfunction in upper Egypt. East Mediterr Health J 2010; 16: 281-5. [ Links ]
6. Cho NH, Chan JC, Jang HC, Lim S, Kim HL, Choi SH. Cigarette smoking is an independent risk factor for type 2 diabetes: a four-year community-based prospective study. Clin Endocrinol (Oxf) 2009; 71: 679-85. [ Links ]
7. Fagard RH, Nilsson PM. Smoking and diabetes-the double health hazard! Prim Care Diabetes 2009; 3: 205-9. [ Links ]
8. Currie LJ, Sharpe JR, Martin R. The use of fibrin glue in skin grafts and tissue-engineered skin replacements: a review. Plast Reconstr Surg 2001; 108: 1713-26. [ Links ]
9. Heistein JB, Cook PA. Factors affecting composite graft survival in digital tip amputations. Ann Plast Surg 2003; 50: 299-303. [ Links ]
10. Mowlavi A, Andrews K, Milner S, Herndon DN, Heggers JP. The effects of hyperglycemia on skin graft survival in the burn patient. Ann Plast Surg 2000; 45: 629-32. [ Links ]
11. Ramos G, Guastavino MP, Bolgiani A, Prezzavento G. Patiño 0, Benaim F. Hypoalbuminemia in burned patients: an outcome marker that could define evolution periods. Revist Argent Quemad 2000; 15: 23-9. [ Links ]
12. Vibe P, Pless J. A new method of skin graft adhesion. Scand J Plast Reconstr Surg 1983; 17: 263-4. [ Links ]
Recibido: 15-2-2012
Aceptado: 4-9-2012
IMÁGENES EN MEDICINA
Síndrome de Morgagni Stewart Morel
Mujer de 42 años de edad, ingresa por hiperglucemia y somnolencia. Examen físico: obesidad centrípeta (Fig. 1), hirsutismo. La radiografía de cráneo presenta hiperostosis frontal (Fig. 2).

Fig. 1

Fig. 2
El síndrome es hereditario, la trasmisión es autosómica dominante o ligada al sexo, prevalece en el sexo femenino (circa 90%). Sus características más importantes son hiperostosis en la cara interna del hueso frontal, obesidad, virilismo e hirsutismo. La osteopatía no es inflamatoria, es benigna y consiste usualmente en un engrosamiento de la lámina endocraneal del hueso frontal. Los síntomas asociados son trastornos mentales, fatiga, somnolencia, desórdenes visuales, vértigo, tinnitus, polifagia, polidipsia, poliuria, pérdida del olfato, intolerancia a la glucosa, diabetes y afectación de los II, V y VII pares craneales.
Ezequiel Baran
Servicio de Clínica Médica, Sanatorio IPENSA, La Plata, Buenos Aires
e-mail: ezebaran@gmail.com
AL MARGEN
Seda refrigerante
Durante cuatro días, sobre hojas de brezo o apoyos de plástico en los criaderos, el gusano de seda que ha estado comiendo hojas de mora o de roble sin parar, segrega por su boca 30 cm de baba por minuto, dos hilos de 5-10 µm de diámetro que entrelaza moviendo en forma de ocho su cabeza hasta formar una sola cuerda de hasta 3 km de longitud. El 75% de ese hilo está compuesto por una proteína, la fibroína, un biopolímero y el resto por una sustancia pegajosa que lo recubre, la sericina. Al cabo de 300 000 movimientos cefálicos, el capullo está terminado, el gusano se duerme para luego transformarse en una mariposa y continuar su ciclo. En los criaderos se sumergen los capullos en agua caliente para desprenderlos y reconocer el comienzo del ovillo. Con el entrelazamiento de 5-8 filamentos comienza la manufactura del hilo de la seda para convertirlo en un tejido único, tornasolado por la geometría de su hilo semejando un prisma1, 2. Pero el material que lo forma tiene otra función. La seda es un biomaterial de extremada resistencia, excelente biocompatibilidad, con la fibroína, una proteína muy estable por su estructura de lámina ß, que le confiere dureza y rigidez. Su procesamiento en formatos como films, geles y membranas fibrosas mantiene su estructura en soluciones en una interfase aire agua que la hacen de utilidad en la biomedicina. Los antibióticos y vacunas se transportan y conservan por la cadena de frío, que insume hasta el 80% del costo total de las campañas de vacunación. Su falla ocasiona hasta el 50% de las aplicaciones inefectivas de vacunas. Para los antibióticos se agregaría la amenaza de aumentar la resistencia a los mismos3. Kaplan y col. estudiaron la posibilidad de encontrar un vehículo para vacunas y antibióticos que los mantuviera protegidos de la temperatura ambiente4. Encontraron en la proteína de la seda una alternativa práctica para la conservación de sustancias sensibles. Disolvieron fibroína de seda del gusano Bombyx mori en una solución salina y la mezclaron con antibióticos y con vacunas (contra el sarampión, paperas y rubéola) para luego secarla y de esta manera formar films que atrapen en su interior a los compuestos de interés. Se demostró en varios estudios que los films transportados a temperatura ambiente y sin ningún equipamiento especial, mantenían su actividad por seis meses a 45 °C, tiempo en que los controles con soporte corriente habían perdido gran parte de su potencia. Aparentemente, el film de fibroína protege los compuestos de la degradación y desnaturalización inducidas por la temperatura debido a las microscópicas cavidades que presentan las láminas de la proteína, que atrapan a los compuestos de interés sin alterar su estructura tridimensional y evitan además la incorporación de agua, por estar alineados estos microbolsillos con moléculas hidrofóbicas. Esta nueva función de la fibroína, una proteína que es el corazón de la seda, podría revolucionar el transporte de vacunas y antibióticos. La seda subyuga a los seres humanos desde hace miles de años por su hermosura y sensación al tacto. Forma parte además de suturas y prótesis por su biocompatibilidad y resistencia. En la noche tormentosa de octubre de 1752, cuando Benjamin Franklin realizó su famoso experimento para comprobar si el rayo era un fenómeno eléctrico, utilizó un barrilete de seda5.

Basilio A. Kotsias
1. Pernot F. La ruta de la seda. Londres: Parragon, 2001. [ Links ]
2. Hyde N. Silk, the queen of textiles. National Geographic Magazine 1984; 65: 2-49. [ Links ]
3. Wang X, Zhang X, Castellot J, Herman I, Iafrati M, Kaplan DL. Controlled release from multilayer silk biomaterial coatings to modulate vascular cell responses. Biomaterials 2008; 29: 894-903. [ Links ]
4. Zhang J, Pritchard E, Hu X, et al. Stabilization of vaccines and antibiotics in silk and eliminating the cold chain. Proc Natl Acad Sci U S A 2012; 109: 11981-6. [ Links ]
5. Larrán de Vere A. Franklin. Biblioteca Billiken, Buenos Aires Editorial Atlántida, 1945. [ Links ]
^rND^sHyde^nN^rND^sWang^nX^rND^sZhang^nX^rND^sCastellot^nJ^rND^sHerman^nI^rND^sIafrati^nM^rND^sKaplan^nDL^rND^sZhang^nJ^rND^sPritchard^nE^rND^sHu^nX
Caveat lector
Notas para advertir, entretener y relacionar lo nuevo con lo viejo, sin un análisis detallado ni opinión formada. Son bienvenidos los comentarios a revmedbuenosaires@gmail.com o a Basilio A. Kotsias, kotsias@retina.ar
¿Son los alimentos orgánicos más nutritivos y seguros que los convencionales?
Un metaanálisis revisó las publicaciones de los pasados treinta años buscando diferencias entre los alimentos orgánicos y no orgánicos. No hubo diferencias en las reacciones alérgicas por tipo de alimento ni en la tasa de infección por bacterias del género Campylobacter y Salmonella, ni en la contaminación de alimentos con Escherichia coli. Una diferencia fue el mayor contenido de fósforo en los orgánicos. Fueron muy heterogéneos los datos en los niveles de contaminantes entre ambos tipos de alimentos. No hubo diferencias en los valores nutritivos aunque el consumo de alimentos orgánicos, de por sí mucho más caros que los convencionales, podría reducir la exposición a residuos de pesticidas y el de bacterias resistentes a los antibióticos que pueden estar presentes en el pollo y cerdo convencionales.
Smith-Spangler C, Brandeau ML, Hunter GE, et al. Are organic foods safer or healthier than conventional alternatives?: A systematic review. Ann Intern Med 2012; 157: 348-66.
Agua "baja en sodio"
La venta de agua mineral embotellada aumentó en forma fenomenal en todo el mundo y las razones invocadas son las características organolépticas, sanitarias y su contenido de sodio. Asociaciones médicas, ligas de consumidores y las empresas recomiendan el consumo de agua "baja en sodio" para sanos y enfermos, niños y mayores, y la industria aguatera responde con prontitud. El código alimentario argentino establece que las aguas bajas en sodio deben tener menos de 20 mg/l. El INTI analizó las aguas envasadas registrando un rango de 3-196 mg/l. Los de potasio entre 1 y 24 mg/l. El contenido de sodio del agua corriente de Buenos Aires es de 20-28 mg/l (Fuente: Laboratorio central AySA, 23 de octubre 2012). Los adultos sanos deben limitar la ingesta de sodio a no más de 2300 mg/día (5.7 g de sal), proveniente en su mayoría de la sal en los alimentos y de la agregada. De esto se deduce que el consumo de 2 litros del agua envasada con la menor concentración de sodio respecto al mismo volumen de agua corriente disminuiría en menos del 2 % la ingesta de sodio diario: (2300 + 6) / (2300 +48).
www.inti.gob.ar/productos/pdf/aguas_de_mesa2011.pdf (2011), www.fundacioncardiologica.org/alimsalud.htm
El consumo de tomates podría disminuir el riesgo del accidente cerebrovascular
En Finlandia se halló, en varones de 46- 65 años seguidos por 12 años, que los niveles de licopeno en sangre están asociados en forma inversa al riesgo de padecer un accidente cerebrovascular. El licopeno es un pigmento vegetal, soluble en grasas, que contribuye a la coloración rojiza de los tomates, sandías y en menor cantidad a otras frutas y verduras; es un poderoso antioxidante que no sintetiza el organismo.
Karppi J, Laukkanen JA, Sivenius J, Ronkainen K, Kurl S. Serum lycopene decreases the risk of stroke in men: A population-based follow-up study. Neurology 2012; 79: 1540-7.
Los accidentes cerebrovasculares ocurren a edades cada vez menores
Se analizó la frecuencia del primer accidente cerebrovascular en el estado de Kentucky, EE.UU., en tres períodos: 1993-94, 1999 y 2005. La media de la edad de los que sufrieron el accidente disminuyó de 71.2 años en 1993 a 69.2 en 2005, en tanto que el porcentaje de afectados menores de 55 años aumentó del 12.9% a 18.6% para iguales años. El aumento de los casos de diabetes, obesidad e hipercolesterolemia podría explicar estos datos al igual que el mejoramiento en los métodos diagnósticos.
Kissela BM, Khoury JC, Alwell K, et al. Temporal trends in stroke incidence in a large, biracial population. Neurology 2012, Oct 10. [Epub ahead of print].
SIAMESES

Los siameses Chang y Eng fueron célebres fenómenos del siglo XIX realizando una increíble labor de adaptación, primero entre sí y luego en una civilización ajena a ellos. Nacieron en 1811 en Tailandia, conocida entonces como Siam, de donde deriva el nombre coloquial con que se los conocía y como nos referimos a la anormalidad. En 1828 un comerciante británico que creía en las enormes posibilidades comerciales que ofrecían los hermanos obtuvo la autorización de su madre para trasladarlos al exterior. Examinados en el Colegio Real de Cirujanos de Londres, se comprobó que estaban unidos en la parte inferior del tórax (variedad thoracopagus) por medio de un grueso cordón de 20 cm de circunferencia, no muy largo pero muy flexible que les permitía una amplia libertad de movimientos y habilidades detalladas en las viñetas de la litografía de Currier & Ives que mostramos (http://ihm.nlm.nih.gov). Podían estar acostados, de pie o espalda contra espalda. Chang y Eng nunca regresaron a Siam; en Nueva York fueron contratados para el circo itinerante Barnum para una exposición que luego continuaron por cuenta propia durante 8 años. En 1839 se establecieron en Carolina del Norte, adquirieron propiedades, tierras y esclavos, adoptaron Bunker como apellido y se casaron en 1843 con dos hermanas. Durante esos años realizaron esporádicas presentaciones para recaudar dinero y conseguir, sin éxito, un cirujano que los separase. En el invierno de 1874, Chang contrajo una grave bronquitis y murió; el médico de la familia fue llamado de urgencia para intentar separarlos pero Eng murió antes de su llegada. La autopsia reveló que compartían el hígado, conservado en el museo Mütter de Medicina en Filadelfia. De los dos matrimonios nacieron 22 hijos, el último fallecido en 1951. No se conoce otro caso de siameses entre sus más de mil descendientes y 200 de ellos se reunieron el año pasado en Mt. Airy, Carolina del Norte, donde están enterrados los siameses, para conmemorar el bicentenario de sus nacimientos.
Los siameses son gemelos monocigóticos (idénticos); no se conoce la causa de la anomalía para que al final de la segunda semana del desarrollo embrionario los gemelos no se separen y permanezcan unidos. Se clasifican de acuerdo al sitio de unión y tres de cada cuatro casos lo están por el tórax (variedad thoracopagus) siendo la craniopagus la menos común y más compleja y difícil para su separación por las conexiones vasculares y nerviosas compartidas.
Un reciente estudio multicéntrico mundial estudió el mayor número de casos con una prevalencia de 1.47/100 000 nacimientos, máxima en Finlandia (3.2/100 000), mínima en el noreste de Italia (0.1/100 000). Es dos-tres veces más común en las mujeres, más frecuente -y creciente- en la etnia latinoamericana (distinguida de la etnia latina-europea) y las variedades parasítica y parapagus (unidos en forma lateral por la pelvis) son más altas en varones mientras que la thoracopagus predomina en las mujeres. Los investigadores no hallaron relación entre estos resultados y datos genéticos, demográficos o ambientales.
Robertson A. Epílogo a la historia de los hermanos siameses. Selecciones del Reader´s Digest, enero 1953, p 60-63. Mutchinick OM, Luna-Muñoz L, Amar E, et al. Conjoined twins: a worldwide collaborative epidemiological study of the International Clearinghouse for Birth Defects Surveillance and Research. Am J Med Genet C Semin Med Genet 2011; 157C:274-87. Jackson OA, Low DW, Larossa D. Conjoined twin separation: lessons learned. Plast Reconstr Surg 2012; 129: 956-63.
^rND^1A01^nAgustín^sDal Verme^rND^1A01^nEmiliano^sLópez^rND^1A01^nSebastián^sGrinspon^rND^1A01^nRocío^sFernández Pardal^rND^1A01^nMariano^sMengia^rND^1A01^nOctavio^sMazzocchi^rND^1A01^nAgustín^sDal Verme^rND^1A01^nEmiliano^sLópez^rND^1A01^nSebastián^sGrinspon^rND^1A01^nRocío^sFernández Pardal^rND^1A01^nMariano^sMengia^rND^1A01^nOctavio^sMazzocchi^rND^1A01^nAgustín^sDal Verme^rND^1A01^nEmiliano^sLópez^rND^1A01^nSebastián^sGrinspon^rND^1A01^nRocío^sFernández Pardal^rND^1A01^nMariano^sMengia^rND^1A01^nOctavio^sMazzocchiCASUÍSTICA
Infarto esplénico ¿Ergotismo inducido por ritonavir?
Agustín Dal Verme, Emiliano López, Sebastián Grinspon, Rocío Fernández Pardal, Mariano Mengia, Octavio Mazzocchi
Va Cátedra de Medicina, Hospital de Clínicas José de San Martín, Universidad de Buenos Aires
Dirección postal: Dr. Agustín Dal Verme. Dirección: El Parque 490, 1611 Don Torcuato, Provincia de Buenos Aires, Argentina
e- mail: agustindalverme@yahoo.com
Resumen
El ergotismo es una enfermedad conocida desde la antigüedad, que se caracteriza por isquemia y, en algunos casos, gangrena de las extremidades. Muchas drogas de uso corriente tienen la capacidad de interactuar con los ergotamínicos desarrollando ergotismo como efecto adverso. Un ejemplo de ello es el ritonavir, un inhibidor de la proteasa utilizado en pacientes con el virus de la inmunodeficiencia humana (HIV). Presentamos un caso de ergotismo en un varón de 39 años con infección por HIV en tratamiento con ritonavir que, después de ingerir 1 mg de tartrato de ergotamina, además de presentar manifestaciones clásicas de la enfermedad, desarrolló un infarto esplénico. Por lo tanto, consideramos importante advertir a los pacientes sobre la posible interacción farmacológica entre los ergotamínicos y otras drogas de uso frecuente y, en particular, el ritonavir en pacientes portadores de HIV.
Palabras clave: Ergotismo; HIV; Infarto esplénico; Ritonavir
Abstract
Splenic infarction. Ergotism induced by ritonavir? Ergotism is a clinical condition known since old times and whose main characteristics are ischemia and even limb gangrene. Some drugs have the capacity of interacting with small amounts of ergotamine or its derivatives producing ergotism as a side effect. This is the case of ritonavir, a widely used anti-HIV drug. Here we present a case of ergotism that developed in an HIV positive 39 year old male under treatment with ritonavir, after taking 1 mg of ergotamine tartrate. His clinical picture, apart from showing the basic manifestations of the disease, was associated with splenic infarction. For this reason, we consider important to advise patients about the potential pharmacological interaction between ergotamines and others common drugs and, in particular, ritonavir in HIV positive patients.
Key words: Ergotism; HIV; Splenic infarction; Ritonavir
El ergotismo es una enfermedad generada por la toxicidad de un grupo de alcaloides presentes en un hongo, el Claviceps purpurea o cornezuelo de centeno. La enfermedad se conoce desde la edad media como "el fuego de San Antonio", ya que los síntomas estaban asociados a dolores francamente urentes de las extremidades isquémicas1. En la actualidad, el ergotismo se asocia a los ergotamínicos, una familia de fármacos de consumo frecuente, principalmente como agentes antimigrañosos.
En los últimos años se han publicado al menos once trabajos con casos referidos al desarrollo de esta enfermedad en el contexto del consumo de ergotamínicos y la ingesta concomitante de inhibidores de la proteasa en pacientes portadores de HIV3-13. Excepto dos pacientes, uno en tratamiento con nelfinavir y otro en tratamiento con indinavir, todos recibían ritonavir dentro de su esquema de medicación antirretroviral. A continuación, se describe un caso clínico de ergotismo en un paciente en tratamiento con ritonavir que desarrolló, durante su evolución, un infarto esplénico.
Caso clínico
Varón de 39 años de edad con antecedentes de tabaquismo y adicción a cocaína endovenosa, la cual no consume desde 14 años atrás; infección por HIV, sin criterios de sida, en tratamiento con lamivudine, didanosina, lopinavir y ritonavir, y coinfección con virus de hepatitis C (HCV). Presentaba cirrosis hepática, con hipertensión portal, esplenomegalia y várices esofágicas. Refirió dos episodios de hemorragia digestiva alta con ligadura endoscópica de las várices esofágicas y profilaxis posterior con propanolol 120 mg/día.
Cinco días previos al ingreso, había presentado cefalea, náuseas y vómitos, por lo que ingirió un miligramo de tartrato de ergotamina. Se agregaron frialdad y parestesias de los cuatro miembros, asociadas a claudicación intermitente a los pocos metros de caminata y posteriormente dolor de los miembros inferiores en reposo. Evolucionó con fiebre y dolor abdominal difuso con predominio del hipocondrio izquierdo. En el examen físico se constató una frecuencia cardíaca de 80 lpm, presión arterial irregistrable, tanto en miembros superiores como inferiores, frecuencia respiratoria de 20 rpm y temperatura de 38° C (oral). Se encontraba lúcido, con ausencia de los pulsos radiales, humerales, poplíteos, tibiales y pedios. Pulso carotídeo presente y femoral disminuido. Presentó frialdad y palidez distal en miembros inferiores y un soplo sistólico en la región lateral posterior izquierda del cuello. Refirió dolor a la palpación en el cuadrante superior izquierdo del abdomen, sin reacción peritoneal, y se constató esplenomegalia. Su examen neurológico era normal.
Los datos de laboratorio fueron: hematocrito 29%, hemoglobina 8.7 g/dl, VCM 84 fl, glóbulos blancos 8 200/mm3, (neutrófilos 76%, linfocitos 8%), plaquetas 143 000/mm3, sodio 129 mEq/l, potasio 4.2 mEq/l; bilirrubina total 2.1 mg/dl, bilirrubina directa 1.1 mg/dl, GPT 96 UI/l, GOT 93 UI/l, FAL 260 UI/l, LDH 409 UI/l, GGT 91 UI/l, eritrosedimentación: 25 mm/h y colesterol total 88 mg%. Cocaína y metabolitos en orina no detectables. La radiografía de tórax mostró elevación del hemidiafragma izquierdo. En el electrocardiograma se constató ritmo sinusal y la ecografía abdominal evidenció aumento heterogéneo de la ecogenicidad hepática con aumento de su tamaño y esplenomegalia homogénea de 180 mm de longitud; sin líquido libre. La ecografía Doppler arterial de miembros inferiores mostró engrosamiento miointimal difuso, sin lesiones ateromatosas hemodinámicamente significativas y flujo de baja resistencia.
Persistió con dolor en el hipocondrio izquierdo y ausencia de pulsos. Se realizó entonces una tomografía computarizada de abdomen con contraste oral y endovenoso, donde se observó una hipodensidad por falta de realce con el material de contraste en el bazo que comprometía aproximadamente 2/3 del mismo, compatible con infarto esplénico (Fig. 1). La ecografía Doppler de arterias y venas abdominales no evidenció obstrucción de las mismas.

Fig. 1.- Tomografía axial computarizada: esplenomegalia conáreas de hipodensidad por falta de realce con material de contraste.
Se interpretó como ergotismo secundario al uso de tartrato de ergotamina, en un paciente con hepatopatía crónica e hipertensión portal, tratado con ritonavir y propanolol, complicado con un infarto esplénico. Se contraindicaron los ergotamínicos, se suspendió el propanolol y se inició nifedipina (20 mg cada 8 horas). Evolucionó 48-72 horas después, con franca mejoría de su sintomatología, reaparición de todos los pulsos periféricos y normalización de la presión arterial.
Discusión
La intoxicación por derivados de la ergotamina es una entidad de baja frecuencia que puede desarrollarse de forma aguda o crónica, siendo la primera la forma más común de presentación. Normalmente se manifiesta después de la ingesta de dosis más elevadas que las recomendadas (4-6 mg para un ataque; máximo 10 mg semanales cuando se administra por vía oral)2 pero también se ha descrito en pacientes que ingieren dosis mínimas. El desarrollo del ergotismo con dosis bajas ocurre cuando el consumo de ergotamina se asocia con el uso concomitante de drogas que inhiben el metabolismo hepático, principalmente el citocromo P 450, isoenzima CYP. Ejemplos de ello son la claritromicina y el ritonavir (Tabla 1).
TABLA 1.- Fármacos que interactúan con la ergotamina

Este último fármaco es un potente inhibidor de la proteasa de uso corriente en el tratamiento del HIV/sida y se caracteriza, no solo por inhibir la isoenzima CYP 3A4, sino también la CYP 2D6 y la 2C9/10 y es el único de este grupo con la capacidad de actuar sobre estas tres enzimas3. Esta interacción se ha asociado también a otros inhibidores de la proteasa como el indinavir4 y nelfinavir5.
El ergotismo inducido por ritonavir se produce tanto en hombres como en mujeres con dosis variables de ergotamina. Existen casos publicados con dosis de 1 a 2 mg3, 5-7. En el presente caso se ingirió 1 mg.
La claudicación intermitente, el dolor en reposo, la frialdad de miembros inferiores y/o superiores y la ausencia de pulsos son las manifestaciones clínicas más frecuentes3-8, 11-13. Se han descripto casos de compromiso cerebral únicamente, presentados con amaurosis, coma, afasia y signos focales motores y sensitivos8, 9.
El paciente desarrolló los síntomas clásicos de ergotismo. Posterior a la ingesta de ergotamina presentó, en forma progresiva, claudicación intermitente, dolor en reposo de los cuatro miembros y ausencia de pulsos. El infarto esplénico se manifestó con dolor en el hipocondrio izquierdo y fiebre. Creemos que el desarrollo del mismo se vio favorecido además del vasoespasmo, por la esplenomegalia secundaria a la hipertensión portal. Asociado a las interacciones farmacocinéticas descriptas entre los ergotamínicos y el ritonavir y la insuficiencia hepática, consideramos también, que pudo haber presentado una interacción farmacodinámica con el propanolol que, por su efecto bloqueante de los receptores beta 2 adrenérgicos, puede generar vasoespasmo como efecto colateral. Atribuimos el mecanismo final del infarto esplénico a la acción de los ergotamínicos, ya que si bien había otros factores predisponentes como la enfermedad hepática avanzada, y el uso de propanolol, el infarto ocurrió simultáneamente con el vasoespasmo generalizado, manifestado clínicamente por la ausencia de pulsos.
La presentación más común del infarto esplénico es el dolor abdominal, especialmente el localizado en el cuadrante superior izquierdo. Cabe destacar que aproximadamente un 18% de los pacientes no refieren este síntoma14, 15. Puede haber fiebre en un 30% de los casos. Los hallazgos habituales del examen físico son el dolor a la palpación del hipocondrio izquierdo y la esplenomegalia. Por orden de frecuencia, las causas más frecuentes de infarto esplénico son: la cardioembolia, generalmente asociada a la fibrilación auricular y el infarto agudo de miocardio, las enfermedades hematológicas, la endocarditis bacteriana, la enfermedad hepática avanzada, la mononucleosis y el cáncer de origen no hematológico. No encontramos ningún caso en la literatura médica donde el infarto esplénico se haya asociado a ergotismo, ya sea en presencia, o no, de fármacos con capacidad de alterar la farmacocinética de la ergotamina.
La ergotamina y sus derivados son drogas de uso frecuente, aun sin prescripción médica. Debido a que su toxicidad, como se mencionó, puede ocurrir con dosis mínimas, es fundamental considerar la posibilidad de interacciones medicamentosas con otros fármacos de uso común. Dado que el ritonavir, entre otros inhibidores de la proteasa, es una droga de uso habitual en pacientes portadores de HIV, se debe advertir a estos pacientes de los peligros asociados al uso concomitante de ergotamínicos.
Conflictos de interés: no existen conflictos de interés.
1. De Costa C. St Anthony´s fire and living ligatures: a short history of ergotamine. Lancet 2002; 359: 1768-70. [ Links ]
2. Ruano Calderón L, Zermeño Pohls F. Ergotismo. Presentación de un caso y revisión de la bibliografía. Revista de Neurología 2005; 40: 412-6. [ Links ]
3. Baldwin Z, Ceraldi C. Ergotism associated with HIV antiviral protease inhibitor therapy. J Vasc Surg 2003; 37: 676-8. [ Links ]
4. Rosenthal E, Sala F, Chichmanian R, et al. Ergotism related to concurrent administration of ergotamine tartrate and indinavir. JAMA 1999; 281: 987. [ Links ]
5. Mortier E, Pouchot J, Vinceneux P, Lalande M. Ergotism related to interaction between nelfinavir and ergotamine. Am J Med 2001; 110: 594. [ Links ]
6. Montero A, Giovannoni A, Tvrde, P. Leg ischemia in a patient receiving ritonavir and ergotamine. Ann Intern Med 1999; 130: 329. [ Links ]
7. Blanche P, Rigolet A, Gombert B, Ginsburg C, Salmon D, Sicard D. Ergotism related to a single dose of ergotamine tartrato in an AIDS patient treated with ritonavir. Postgrad Med J 1999; 75: 546-8. [ Links ]
8. Pardo Rey C, Yebra M, Borrallo M, Vega A, Ramos A, Montero M. Irreversible coma, ergotamine and ritonavir. Clin Infect Dis 2003; 37: 72-3. [ Links ]
9. Spiegel M, Schmidauer C, Kampfl A, Sarcletti M, Poewe W. Cerebral ergotism under treatment with ergotamine and ritonavir. Neurology 2001; 57: 743. [ Links ]
10. FrÖhlich G, Kaplan V, Amann-Vesti B. Holy fire in an HIV-positive man: a case of 21st-century Ergotism. CMAJ 2010; 182: 378-80. [ Links ]
11. Vila A, Mykietiuk A, Bonvehí P, Temporiti A, Urueña A, Herrera F. Clinical ergotism induced by ritonavir. Scand J Infect Dis 2001; 33: 788-9. [ Links ]
12. Caballero-Granado F, Viciana P, Cordero E, Gómez-Vera M, de Nozal M, López-Cortez L. Ergotism related to concurrent administration of ergotamine tartrate and ritonavir in an AIDS patient. Antimicrob Agents Chemother 1997; 45: 1207. [ Links ]
13. Liaudet L, Buclin T, Jaccard C, Eckert P. Severe ergotism associated with interaction between ritonavir and ergotamine. BMJ 1999; 318: 771. [ Links ]
14. Antopolsky M, Hiller N, Salameh S, Goldshtein B, Stalnikowicz R. Splenic infarction: 10 years of experience. Am J Emerg Med 2009; 27: 262-5. [ Links ]
15. Yaacov R, Pokroy R, Berlowitz D, Aharoni D, Hain D, Breuer G. Splenic infarction: an update on William Osler´s observations. Isr Med Assoc J 2010; 12: 362-5. [ Links ]
Recibido: 23-11-2011
Aceptado: 3-7-2012
CASUÍSTICA
Síndrome de Marfan con disección aórtica asociada a tromboembolismo venoso e hiperhomocisteinemia
Ramón N. Herrera1, Julio A. Miotti2, Aldo S. Pereyra3, María V. Lobo4, Mariela T. Ibarra5, Andrés F. Tomé Guzmán6
Residencia de Clínica Médica, Hospital Centro de Salud Zenón J. Santillán, San Miguel de Tucumán
Dirección postal: Dr. Ramón Nicasio Herrera, Marcos Paz 796, 4000 San Miguel de Tucumán, Argentina
e-mail: nicasioherrera@arnet.com.ar
Resumen
El síndrome de Marfan es un desorden genético infrecuente, cuyas manifestaciones clínicas afectan a los sistemas cardiovascular, ocular y músculo esquelético, la gravedad de las manifestaciones cardiovasculares son generalmente responsables de la mortalidad de estos pacientes. La enfermedad tromboembólica venosa está íntimamente relacionada con diversos factores de riesgo, congénitos, adquiridos, mixtos o desconocidos. La hiperhomocisteinemia es un factor de riesgo moderado para tromboembolismo venoso. Presentamos el caso de una mujer de 47 años de edad con síndrome de Marfan asociado a disección aórtica tipo A indolora, que simultáneamente padeció trombosis venosa de miembros inferior y superior izquierdos con embolia de pulmón. Al realizar el cribado de trombofilia se constató hiperhomocisteinemia. Con la terapéutica instituida evolucionó favorablemente.
Palabras clave: Síndrome de Marfan; Disección aórtica; Tromboembolismo venoso; Hiperhomocisteinemia
Abstract
Marfan syndrome associated with aortic dissection, venous thromboembolism and hyperhomocysteinemia. Marfan syndrome is an infrequent genetic disorder of connective tissue whose clinical manifestations mainly affect the cardiovascular, ocular and musculoskeletal systems. Serious cardiovascular manifestations are generally the cause of mortality of Marfan patients. Thromboembolic venous disease is intimately related to different risk factors: inherited, acquired, mixed or unknown; hyperhomocysteinemia is a moderate risk factor for venous thromboembolism. We present the case of a 47-year-old woman with Marfan syndrome associated to a painless type A aortic dissection, who simultaneously suffered venous thromboembolism of left upper and lower limbs with pulmonary embolism. Hyperhomocysteinemia was found through thrombofilia screening. The patient's condition has evolved favorably.
Key words: Marfan syndrome; Aortic dissection; Venous thromboembolism; Hyperhomocysteinemia
El síndrome de Marfan (SM) es un desorden genético del tejido conectivo con una prevalencia de 1/5 000-10 000, independiente de factores étnicos o geográficos. Es una afección de herencia autosómica dominante con penetrancia incompleta y expresividad variable, y cuyas manifestaciones clínicas son en general dependientes de la edad. Estas involucran principalmente a los sistemas ocular, músculo esquelético y cardiovascular, siendo las causas principales de muerte prematura la dilatación de la raíz aórtica y aorta ascendente, responsables de la incompetencia valvular, de la disección de la misma y la insuficiencia cardiaca producida por insuficiencia mitral o aórtica1.
El SM clásico o tipo 1 se caracteriza por presentar un defecto en las proteínas de la matriz extracelular, resultante de la mutación del gen FBN1 que codifica la proteína fibrilina, esencial para la formación de fibras elásticas1. Actualmente se postula que a nivel del cromosoma 3p25- 24.2 se expresa una potencial vía de desregulación del Factor de Crecimiento Transformante Beta (TGF-ß) que explicaría los cambios moleculares que pueden llegar a producir dilatación y aneurisma de aorta2.
El TGF-ß es secretado biológicamente inactivo desde su almacenamiento en la matriz extracelular como un complejo denominado gran complejo latente del TGF-ß (Complejo LLC). La desregulación de la señal de TGF-ß resulta en mutaciones en la fibrilina-1 - TGF-ßR1 o TGF-ßR2- produciendo una alteración en la respuesta genética del TGF-ß con cambios degenerativos en la pared de los vasos, que llevan a la formación de aneurisma o disección3.
La hiperhomocisteinemia constituye una alteración genética del metabolismo de la metionina, que se hereda en forma autosómica recesiva. Involucra siete trastornos bioquímicos clínicamente diferentes, siendo los más frecuentes el déficit de cistatioina ß-sintetasa y de la metiltetrahidrofolato reductasa (MTHFR). La hiperhomocisteinemia actualmente es considerada un factor de riesgo trombofílico moderado para la producción de tromboembolismo venoso4. Se ha comunicado que existe correlación entre los niveles séricos de homocisteina y la gravedad de las manifestaciones cardiovasculares en pacientes con SM5.
Caso clínico
Mujer de 47 años de edad, oriunda de zona periurbana, con antecedentes de hipertensión arterial (HA) de diez años de evolución en tratamiento discontinuo con enalapril. No refirió otros antecedentes personales ni hereditarios. Ingresó a nuestro servicio por insuficiencia cardiaca congestiva (ICC) y edema generalizado de miembro superior izquierdo (MSI). Relató que 30 días antes de la consulta presentó disnea de esfuerzo que progresó rápidamente a disnea de reposo. Simultáneamente manifestó aparición brusca de edema y dolor generalizado de MSI, extendiéndose posteriormente a hombro y región infraclavicular homónima con presencia de circulación colateral. Al examen físico presentó hábito marfanoide con tórax cifoescoliótico y aracnodactilia, disminución marcada de la agudeza visual, además de hiperlaxitud ligamentosa. Se destacaban en cuello baile arterial, acompañado de la presencia de tumoración localizada en región supraclavicular izquierda de 10 cm de diámetro, renitente, dolorosa, no pulsátil, que comprimía el tronco de la yugular izquierda produciendo ingurgitación sin latidos; pulso radial con frecuencia de 95 lpm regular con signo del martillo de agua, presión arterial de 140/60 mm Hg, se palpó choque de punta en el quinto espacio intercostal izquierdo por fuera de línea media clavicular, R1 y R2 normales, soplo holodiastólico aspirativo decreciente en foco aórtico, de intensidad 4/6. En foco mitral, se auscultó ritmo de galope por R3; frecuencia respiratoria de 24 /min, se auscultaron rales crepitantes bibasales; hepatomegalia dolorosa 4 cm por debajo del reborde costal; miembros inferiores edematizados. En miembro inferior derecho (MID) de localización infrapatelar con signo de Godet (+); en miembro inferior izquierdo (MII) aumento de volumen generalizado desde la raíz del mismo con signo de Godet (++), observándose también gruesos trayectos varicosos.
De los exámenes de laboratorio realizados, hemograma, orina completa, función hepática y renal, fueron normales; dímero D: (+) > 500 ng/dl; homocisteina: 24.1 µmol/l (VN = 5-15 µmol/l).
El examen oftalmológico mostró miopía y subluxación bilateral hacia arriba de cristalino.
En la radiografía de tórax se observó cardiomegalia con índice cardiotorácico > 0.55, botón aórtico prominente, hilios congestivos, redistribución de flujo y borramiento del seno costo frénico derecho.
El electrocardiograma mostraba ritmo sinusal, frecuencia cardiaca de 95 lpm, Eje: 0°, PR y QT normales, con signos de sobrecarga de volumen de ventrículo izquierdo.
Un ecodoppler de MSI informó trombosis venosa profunda (TVP) de la confluencia axilo-yugulo-subclavia izquierda y en MII: TVP de vena femoral superficial, poplítea y senos venosos gemelares. Trombosis venosa superficial (TVS) de safena interna.
Fig. 1.- El ecodoppler cardíaco transesofágico muestra la disección de la aorta con la presencia de trombos en el falso lumen.
El ecocardiograma transtorácico realizado informó FEY: 30%, diámetro de raíz aórtica de 59 mm, diámetro de la aurícula izquierda de 34 mm, raíz aórtica y aorta ascendente dilatadas. Cavidades derechas dilatadas con disfunción sistólica de ventrículo derecho, signos de hipertensión pulmonar (HTP) con presión de arteria pulmonar de 75 mm Hg. Hipoquinesia global de ventrículo izquierdo y deterioro de función sistólica.
Durante la realización del ecocardiograma transtorácico, sufrió un cuadro de descompensación hemodinámica presentando hipotensión arterial, taquicardia y taquipnea, se realizó gasometría arterial que presentó hipoxemia e hipocapnia, pH 7.36; PaO2 73 mm Hg; PaCO2 27 mm Hg; HCO3 23mEq/l; SatO2 87%; la gammagrafía de ventilación-perfusión identificó defecto de perfusión segmentario en el lóbulo inferior derecho y otros defectos subsegmentarios en el lóbulo superior del mismo lado, dichas imágenes se presentaban normoaireadas en la ventilación pulmonar, gammagrafía V/Q compatible con alta probabilidad de tromboembolismo pulmonar (TEP) procediéndose a la anticoagulación de la enferma con heparina de bajo peso molecular (nadroparina 90 UI/Kg/ cada 12 h) más acenocumarol.
Ya compensada, se procedió a realizar ecocardiograma trans-esofágico que mostró dilatación grave de raíz aórtica y aorta ascendente, insuficiencia aórtica grave y disección tipo A constatándose en el falso lumen presencia de trombos.
Se procedió a suspender la terapia anticoagulante y a colocar un filtro de Greenfield en vena cava inferior. Se continúo tratamiento con losartán, furosemida, espironolactona y ß-bloqueantes a dosis convencionales.
Para completar la evaluación, se solicitó angiorresonancia tóraco-abdominal que confirmó la disección tipo A, encontrando además en aorta abdominal, por encima de los vasos renales, dilatación aneurismática sacular de 29 mm de diámetro.
Se realizó posteriormente intervención quirúrgica, efectuándose reemplazo valvular y de aorta ascendente.
Evolucionó favorablemente, se la medicó con losartán, ß-bloqueantes, diuréticos y espironolactona y se reinició la anticoagulación con acenocumarol.
Finalmente, la hiperhomocisteimenia se medicó con ácido fólico y vitamina B12.
La trombosis de la confluente axilo-yugulo-subclavia izquierda y las trombosis superficiales y profundas de MII evolucionaron favorablemente con el tratamiento anticoagulante.
Discusión
En nuestro caso se realizó diagnóstico de síndrome de Marfan aplicando los nuevos criterios de Ghent6. Se constató disección aórtica tipo A crónica, con insuficiencia aórtica grave, sin poder precisar el inicio de la misma. Generalmente la disección aórtica cursa en la mayoría de los casos con sintomatología dolorosa típica, aunque en el 10% es indolora, sin conocerse con exactitud los mecanismos por los cuales existe ausencia de dolor7.
En los pacientes con SM el diámetro aórtico aumenta con la edad, disminuye su distensibilidad y aumenta su índice de rigidez y la velocidad pico flujo, lo que produce disrupción y separación de las fibras de elastina en las paredes de la aorta. Estos hallazgos apoyan la hipótesis de que las alteraciones de las propiedades elásticas preceden a la dilatación8.
Se ha sugerido que la disección aórtica en el síndrome de Marfan se asocia a la hiperhomocisteinemia, ya que la misma provoca la descomposición prematura de las fibras elásticas mediante el incremento de las actividades elastolíticas. En efecto, Giusti y col. sugieren que los pacientes con SM con los cambios vasculares más graves, tienen niveles significativamente más altos de homocisteina que los pacientes con cambios leves o controles normales. La elevación de la homocisteina plasmática en el SM puede indicar una mayor utilización de la misma para la síntesis de glicosaminoglicanos de la matriz extracelular de la aorta. Este depósito de matriz anormal puede afectar a la integridad de las láminas elásticas de la aorta5.
La hiperhomocisteinemia se considera actualmente un factor de riesgo trombofílico moderado para tromboembolismo venoso4. No se encuentran elucidadas las causas por las cuales es un factor de riesgo trombogénico, diversos autores coinciden en que la hiperhomocisteinemia es un factor citotóxico que daña el endotelio vascular. La administración de ácido fólico, vitamina B6 y B12 parecería disminuir la frecuencia de episodios tromboembólicos aunque no existen estudios prospectivos9.
En nuestra paciente llamó la atención el compromiso simultáneo de dos territorios venosos, el territorio de la confluencia axilo-yugulo-subclavia izquierda y del territorio femoral superficial y profundo de miembro inferior homónimo, asociado a embolia de pulmón que produjo compromiso hemodinámico grave.
Si bien existían otros factores de riesgo para tromboembolismo venoso, inmovilización prolongada, insuficiencia cardiaca congestiva, presencia de várices, la edad de la paciente y el compromiso simultáneo de dos territorios venosos obligó a realizar posteriormente un estudio de trombofilia.
No se midió vitamina B12. Se ha informado alta frecuencia de déficit de vitamina B12 en pacientes asintomáticos, asociada al polimorfismo homocigota C667T de la MTHFR que produce disfunción endotelial10.
No existe una correlación directa entre los niveles de homocisteina en plasma y la gravedad de las manifestaciones tromboembólicas4.
Luego de haber superado con éxito el tratamiento quirúrgico de la disección tipo A y aun teniendo colocado un filtro en vena cava inferior, se decidió anticoagulación permanente con acenocumarol.
Conflictos de interés: los autores no tienen conflictos de interés para declarar.
1. Faivre L, Collod-Beroud G, Loeys L, et al. Effect of mutation type and location on clinical outcome in 1,013 probands with Marfan syndrome or related phenotypes and FBN1 mutations: an international study. Am J Hum Genet 2007; 81: 454-66. [ Links ]
2. Bolineau C, Jondeau G, Mizuguchi T, et al. Molecular genetics of Marfan syndrome. Curr Opin Cardiol 2005; 20: 194-200. [ Links ]
3. Neptune E, Frinchmeyer PA, Arking DE, et al. Dysregulation of TFG-Beta activation contributes to pathogenesis in Marfan syndrome. Nat Genet 2003; 33: 407-11. [ Links ]
4. den Heijer M, Lewintong S, Clarke R. Homocysteine, MTHFR and risk of venous thrombosis: a meta-analysis of published epidemiological studies. J Thromb Haemost 2005; 3: 292-9. [ Links ]
5. Giusti B, Porciani M, Brunelli T, et al. Phenotypic variability of cardiovascular manifestations in Marfan syndrome, possible role of hyperhomocysteinemia and C677T MTHFR gene polymorphism. European Heart Journal 2003; 24: 2038-45. [ Links ]
6. Loeys B, Dietz H, Braverman A, et al. The revised Ghent nosology for the Marfan syndrome. J Med Genet 2010; 47: 476-85. [ Links ]
7. Hiroshi Matsuo: Clinical significance and impact of "painless acute aortic dissection". Official Journal of the Japanese Circulation Society 2011; 75: 47-8. [ Links ]
8. Jeremy, RW, Huang H, Hwa J, et al. Relation between age, arterial distensibility and aortic dilatation in the Marfan syndrome. Am J cardiol 1994; 74: 369-73. [ Links ]
9. Stanger O, Herman W, Pietrzik K, et al. Clinical use rational management of homocysteine, folic acid, and B vitamins in cardiovascular and thrombotic diseases. Z Kardiol 2004; 93: 439-53. [ Links ]
10. Zittan E, Preis M, Asmir I, et al. High frequency of vitamin B12 deficiency in asymptomatic individuals homocygous to MTHFR C677T mutation is associated whit endothelial dysfunction and homocysteinemia. Am J Physiol Heart Circ Physiol 2007; 293: 860-5. [ Links ]
Recibido: 9-1-2012
Aceptado: 25-6-2012
CASUÍSTICA
Hialohifomicosis cutánea en un paciente con leucemia linfoblástica
Alejandro Avilés-Salas1,5, Juan Álvarez-Reyes1, María de Lourdes Peña-Torres2, Myrna Candelaria-Hernández3, Teresa Vega-González4
1Departamento de Patología,
2Laboratorio de Patología Molecular e Inmunopatología,
3Departamento de Hematología,
4Departamento de Piel y Partes Blandas, Instituto Nacional de Cancerología,
5Facultad de Medicina, Universidad Nacional Autónoma de México, México
Dirección postal: Dr. Alejandro Avilés Salas, Departamento de Patología, Instituto Nacional de Cancerología, Av. San Fernando 22, Sección XVI, Tlalpan, CP 14080 México, D.F.
Fax: (52-55) 56 28 04 21 e-mail: alejandroaviles2001@yahoo.com
Resumen
Las infecciones fúngicas causadas por Aspergillus sp. y Candida sp. son causa importante de morbilidad y mortalidad en pacientes gravemente inmunodeficientes, especialmente en aquellos con neutropenia o receptores de trasplante de médula ósea o de órganos sólidos. Informamos sobre una hialohifomicosis cutánea en una mujer de 24 años de edad con leucemia linfoblástica.
Palabras clave: Hialohifomicosis cutánea; Aspergillus; Aspergilosis invasora; Leucemia linfoblástica
Abstract
Cutaneous hyalohyphomycosis in a patient with acute lymphoblastic leukemia. Invasive fungal infections most frequently caused by Aspergillus sp. and Candida sp. are significant causes of morbidity and mortality in severely immunocompromised patients, especially those who are neutropenic or who have undergone bone marrow or solid-organ transplant. We report a case of cutaneous hyalohyphomycosis in a 24-year-old female with acute lymphoblastic leukemia.
Key words: Cutaneous hyalohyphomycosis; Aspergillus; Invasive aspergillosis; Acute lymphoblastic leukemia
Las infecciones fúngicas invasoras son causa importante de morbilidad y mortalidad en pacientes hemato-oncológicos y pacientes trasplantados con precursores hematopoyéticos u órganos sólidos. En estos casos, el 80% al 90% de las infecciones fúngicas son debidas a Candida sp. y a Aspergillus sp., el resto son producidos por hongos causantes de infecciones emergentes tales como Fusarium sp., Scedosporium sp., Trichosporon sp., Rhodotorula sp., Alternaria sp., Bipolaris sp. y Curvularia sp.1, 2.
La aspergilosis es una infección causada por hongos miceliales, que provocan diferentes cuadros clínicos, desde una enfermedad broncopulmonar alérgica hasta una enfermedad invasora y diseminada3. La afección extrapulmonar habitualmente ocurre como resultado de un foco pulmonar; sin embargo, el compromiso cutáneo es extremadamente raro. La aspergilosis cutánea (AC) ha sido descrita como primaria o secundaria en pacientes inmunocomprometidos4, 5. Informamos un caso de hialohifomicosis cutánea en una paciente de 24 años de edad con diagnóstico de leucemia linfoblástica.
Caso clínico
Mujer de 24 años de edad que inició su padecimiento en el último trimestre del embarazo con astenia, disnea de moderados esfuerzos, hematuria y fiebre no cuantificada, motivo por el cual recibió tratamiento con antibióticos, sin mejoría. Los exámenes de laboratorio inicialmente mostraron hemoglobina: 9.5 g/dl, hematocrito: 27%, VCM: 89, leucocitos: 222 300/mm3, plaquetas: 32 000/mm3, LDH: 1 310 UI/l y creatinina: 1.5. La paciente recibió múltiples transfusiones y se decidió terminar el embarazo de 34.2 semanas con cesárea; así como referirla al Instituto Nacional de Cancerología para su valoración y manejo. A su ingreso, los estudios de laboratorio informaron: leucocitos 38 000/mm3, hemoglobina: 8.9 g/dl, hematocrito: 26.8%, plaquetas 14 000/mm3 y LDH: 462 UI/l. La impresión diagnóstica inicial fue de leucemia aguda y en el aspirado de médula ósea se observaron 96% de blastos linfoides con inmunofenotipo CD45: 90.9%, CD10: 90%, CD19: 76.9%, CD34: 45%, CD20: 22%, CD22: 44.4% y CD79a: 39.6% que concluyó el diagnóstico de leucemia aguda linfoide L2. Se realizó biopsia de médula ósea que corroboró el diagnóstico y se inició tratamiento con ciclofosfamida, metotrexate, citarabina, vincristina, doxorrubicina y dexametasona (Hiper-CVAD) a dosis convencionales. En abril del 2011 se documentó en el aspirado de médula ósea falla a la primera inducción con persistencia de blastos linfoides, así como neumonía basal izquierda con derrame pleural ipsilateral, por lo que se decidió manejo con Hiper-CVAD fase IB y anfotericina B a dosis de 1 mg/kg en infusión intravenosa. Posteriormente, la paciente desarrolló lesión verrugosa de base eritematosa de 1 cm de diámetro en la cara anterior del antebrazo izquierdo (Fig. 1), de la cual se tomó biopsia. En el estudio histológico se observó infiltración de la dermis y tejido subcutáneo por células de tamaño intermedio de núcleos hendidos, cromatina blástica, nucléolo poco aparente y citoplasma escaso. Se realizaron reacciones de inmunohistoquímica resultando positivas las células neoplásicas para CD10 y TdT (Fig. 2). En otros campos se identificó necrosis e infiltrado inflamatorio constituido por linfocitos, células plasmáticas e histiocitos epitelioides. En estas zonas había estructuras filamentosas con ramificación en ángulos de 45°, las que se tiñeron de rojo con PAS y de marrón oscuro con metenamina-plata de Grocott (Fig. 3), con lo cual se estableció el diagnóstico de piel infiltrada por leucemia aguda linfoide coexistente con hialohifomicosis cutánea. Finalmente, la paciente desarrollo falla orgánica múltiple y falleció.
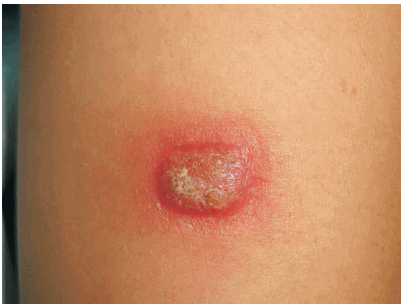
Fig. 1.- Lesión cutánea de aspecto verrugoso y base eritematosa en cara interna de antebrazo izquierdo.
Fig. 2.- Corte histológico de la piel que muestra dermis y tejido subcutáneo infiltrados por blastos linfoides. Las células neoplásicas fueron intensamente positivas para TdT (técnica de inmunohistoquímica, 400x).
Fig. 3.- Hongos filamentosos con hifas de tamaño variable y separados (tinción de metenamina-plata de Grocott 400x).
Discusión
El género Aspergillus comprende aproximadamente 180 especies, de las cuales 34 se han asociado con un espectro amplio de manifestaciones clínicas; la forma "alérgica" local sintomática se puede manifestar como asma, aspergilosis broncopulmonar alérgica y sinusitis alérgica. La enfermedad saprofítica local, también conocida como aspergilomas, son bolas de micelios que crecen en áreas de pulmón desvitalizadas de pacientes con enfermedad pulmonar cavitaria. Aspergillus es el género más frecuentemente identificado como agente responsable de enfermedad fúngica invasora en pacientes hemato-oncológicos y en pacientes receptores de trasplante de células precursoras hematopoyéticas y órganos sólidos; así como una de las principales causas de morbi-mortalidad en pacientes inmunocomprometidos1, 6, 7.
La incidencia de aspergilosis invasora (AI) varía de acuerdo a la población estudiada y al grado de exposición a las esporas, fluctuando entre 1.5% y 14%. La afección cutánea es rara y puede ocurrir como infección primaria o secundaria. La AC primaria es causada por inoculación directa en relación a trauma local, y clínicamente se caracteriza por pápulas, máculas violáceas, bulas hemorrágicas, úlceras con necrosis central y pústulas o abscesos subcutáneos. Su diagnóstico requiere de cultivo y estudio histopatológico de la lesión cutánea5, 8, 9.
En la forma secundaria hay varios factores que la predisponen, como neoplasias hematológicas, quimioterapia, trasplante de médula ósea y órganos sólidos, neutropenia (< 100 neutrófilos/mm3 durante más de tres semanas o < 500 neutrófilos/mm3 durante más de cinco semanas), enfermedad injerto contra huésped, tratamiento con esteroides y otros inmunosupresores, diabetes mellitus, tratamiento antimicrobiano prolongado, aumento de la concentración de conidios en el ambiente, infección por citomegalovirus, cirugía cardiovascular, quemaduras de más del 50% de la superficie corporal y estancia en unidades de cuidados intensivos3.
Se han informado casos aislados y series pequeñas de AC en pacientes con leucemia aguda linfoide10, 11. En el caso informado, la paciente desarrolló una lesión cutánea en la cara anterior del antebrazo, cuyo estudio histopatológico mostró la coexistencia de leucemia aguda linfoide como enfermedad de base y hialohifomicosis cutánea.
El diagnóstico de AI se basa en la combinación de factores de riesgo, signos y síntomas, cultivo, estudio histopatológico y detección de componentes del hongo como el antígeno galactomanano. El cultivo de Aspergillus se ha vuelto relevante, dada la emergencia de especies resistentes a antimicóticos, y de otros hongos causales de enfermedad invasora1, 2. La sensibilidad de los cultivos de expectoración alcanza solo 12% a 33%, con un valor predictivo positivo del 14% a 72%3, 12. La detección del antígeno galactomanano y la reacción en cadena de la polimerasa en muestras de expectoración o sangre ayudan al diagnóstico temprano3, 13. Consideramos que el caso informado puede corresponder a una AC, por ser la micosis que con mayor frecuencia produce el cuadro histopatológico antes mencionado en pacientes hematooncológicos; sin embargo, no podemos hacer esta afirmación ante la falta de confirmación con cultivo, por este motivo se emplea el término hialohifomicosis.
El manejo de la AI tiene tres aspectos fundamentales: revertir la condición predisponente, tratamiento médico y tratamiento quirúrgico. El tratamiento médico se basa principalmente en el uso de anfotericina B, itraconazol, voriconazol y equinocandinas. Se ha informado mayor efectividad del voriconazol que de la anfotericina B en el tratamiento de AI, con mejor supervivencia y menores efectos secundarios3; por otro lado, el itraconazol se ha usado satisfactoriamente como primera línea de tratamiento para la forma nodular de la AC primaria14. En pacientes con infección progresiva y resistente al tratamiento convencional se ha utilizado la caspofungina como agente de rescate3. El tratamiento quirúrgico solo es útil para resecar tejido necrótico o infectado.
La mortalidad de la AI oscila entre 45% y 94%; la enfermedad es fatal cuando existe compromiso del sistema nervioso central y/o cuando la neoplasia subyacente no está en remisión1, 2. En el caso informado, la paciente se manejó con anfotericina B; sin embargo el proceso neoplásico subyacente nunca remitió, lo cual contribuyó al desenlace fatal.
En conclusión, cualquier lesión cutánea en un paciente inmunocomprometido debe ser cuidadosamente examinada por la posibilidad de infecciones fúngicas, y de esta manera realizar un diagnóstico precoz y proporcionar el tratamiento oportuno. La AC debe tomarse en cuenta en el diagnóstico diferencial de una lesión cutánea de rápido crecimiento con un área central de necrosis en un paciente inmunocomprometido, ya que estas lesiones puede ser la primera manifestación de una enfermedad invasora.
Conflictos de interés: Los autores no tienen conflictos de interés para declarar.
1. Rabagliati R, Fuentes LG, Guzmán AM, et al. Enfermedad fúngica invasora en pacientes hemato-oncológicos y receptores de trasplante de precursores hematopoyéticos bajo la perspectiva de los criterios diagnósticos EORTC/MSG. Rev Chilena Infectol 2009; 26: 212-9. [ Links ]
2. Pagano L, Caira M, Candoni A, et al. Invasive aspergillosis in patients with acute myeloid leukemia: a SEIFEM-2008 registry study. Haematologica 2010; 95: 644-50. [ Links ]
3. Barnes PD, Marr KA. Aspergillosis: spectrum of disease, diagnosis, and treatment. Infect Dis Clin North Am 2006; 20: 545-61. [ Links ]
4. Galimberti R, Kowalczuk A, Hidalgo Parra I, Gonzalez Ramos G, Flores V. Cutaneous aspergillosis: a report of six cases. Br J Dermatol 1998; 139: 522-6. [ Links ]
5. Nakashima K, Yamada N, Yoshida Y, Yamamoto O. Primary cutaneous aspergillosis. Acta Derm Venereol 2010; 90: 519-20. [ Links ]
6. Nucci M, Anaissie E. Fungal infections in hematopoietic stem cell transplantation and solid-organ transplantation: focus on aspergillosis. Clin Chest Med 2009; 30: 295-306. [ Links ]
7. Martinez R, Castro G, Machado AA, Moya MJ. Primary aspergilloma and subacute invasive aspergillosis in two AIDS patients. Rev Inst Med Trop Sao Paulo 2009; 51: 49-52. [ Links ]
8. Zhang QQ, Li L, Zhu M, Zhang CY, Wang JJ. Primary cutaneous aspergillosis due to Aspergillus flavus: a case report. Chin Med J 2005; 118: 255-7. [ Links ]
9. Yuanjie Z, Jingxia D, Hai W, Jianghan C, Julin G. Primary cutaneous aspergillosis in a patient with cutaneous T-cell lymphoma. Mycoses 2008; 52: 462-4. [ Links ]
10. Abbasi S, Shenep JL, Hughes WT, Flynn PM. Aspergillosis in children with cancer: A 34-year experience. Clin Infect Dis 1999; 29: 1210-9. [ Links ]
11. Grossman ME, Fithian EC, Behrens C, Bissinger J, Fracaro M, Neu HC. Primay cutaneous aspergillosis in six leukemic children. J Am Acad Dermatol 1985; 12: 313-8. [ Links ]
12. Horvath JA, Dummer S. The use of respiratory-tract cultures in the diagnosis of invasive pulmonary aspergillosis. Am J Med 1996; 100: 171-8. [ Links ]
13. Wheat LJ. Approach to the diagnosis of invasive aspergillosis and candidiasis. Clin Chest Med 2009; 30: 367-77. [ Links ]
14. Tunccan ÖG, Aki SZ, Akyürek N, Sucak G, Senol E. Isolated cutaneous aspergillosis in an acute lymphoblastic leukemia patient after allogeneic stem cell transplantation. J Infect Dev Ctries 2011; 5: 406-9. [ Links ]
Recibido: 8-3-2012
Aceptado: 3-7-2012














