Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Medicina (Buenos Aires)
Print version ISSN 0025-7680
Medicina (B. Aires) vol.73 no.2 Ciudad Autónoma de Buenos Aires Apr. 2013
ARTÍCULO ORIGINAL
Reacciones adversas medicamentosas y errores de prescripción: morbi-mortalidad
Sebastián Chaio1, Javier Toibaro1, Pedro Valicenti1, Patricia Saidón2
1División B de Clínica Médica,
2Servicio de Neurología, Sección Epilepsia, Hospital General de Agudos José María Ramos Mejía, Buenos Aires
Dirección postal: Dr. Sebastián Chaio, Gral. José G. Artigas 4648, 1419 Buenos Aires, Argentina
e-mail: sebastianchaio@gmail.com
Resumen
La farmacovigilancia tiene por objeto la detección, evaluación, comprensión y prevención de cualquier problema relacionado a las drogas. La recolección de información relacionada a reacciones adversas medicamentosas (RAM) posterior a la aprobación y el manejo del riesgo basados en los datos observacionales son críticos para la salud pública.El objetivo primario fue evaluar la morbimortalidad de las reacciones adversas medicamentosas y describir los errores médicos de prescripción en un hospital público de la Ciudad de Buenos Aires. Se llevó a cabo un estudio prospectivo observacional. Se definió RAM como cualquier manifestación nociva, clínica y/o biológica imputable a un medicamento, que ocurra a las dosis habitualmente utilizadas en humanos para la profilaxis, diagnóstico o tratamiento de una enfermedad. La mortalidad global fue del 7% (21/310) y la atribuible a RAM observada fue del 1% (3/310). Se identificaron 149 RAMs en el 36% de los pacientes (111/310) y las RAM constituyeron el 11% (35/310) de los motivos de internación. Las RAM causan un número significativo de internaciones y son responsables de morbilidad evitable durante la internación. Ningún fármaco aislado causó más del 6% de las RAM, por lo que las estrategias para disminuirlas deben estar dirigidas a múltiples grupos farmacológicos.
Palabras clave: Reacciones adversas medicamentosas; Farmacovigilancia; Errores médicos de prescripción
Abstract
Adverse drug reactions and prescription errors: morbi-mortality. Pharmacovigilance aims to detect, assess, understand and prevent any possible drug-related problem. The record of information related to adverse drug reactions (ADRs) after drug approval and risk management based on observational data are crucial for public health. The main goal was to assess the ADRs morbimortality and to describe prescription medical errors in a public hospital in the city of Buenos Aires. A prospective observational study was undertaken. ADR was defined as any clinical and/or biological noxious manifestation imputable to a drug, which occurs at the usually used dose in humans for disease prophylaxis, diagnosis or treatment. Global mortality was 7% (21/310). The observed mortality due to ADR accounted for 1% (3/310). One hundred and forty nine ADRs in 36% of patients were identified (111/310), and 11% (35/310) of the hospital admissions were due to ADRs. ADRs cause a great number of admissions and are responsible for preventable morbidity during hospitalization. Neither drug alone caused more than 6% of the ADRs. For this reason, in order to diminish ADRs, strategies should be addressed to multiple drug groups.
Key words: Adverse drug reactions; Pharmacovigilance; Drug prescription errors
La farmacovigilancia tiene por objeto la detección, evaluación, comprensión y prevención de las reacciones adversas o cualquier problema relacionado con las drogas1. La Organización Mundial de la Salud (OMS) define como objetivos centrales de la farmacovigilancia la mejoría, el cuidado y la seguridad de los pacientes en relación al uso de medicamentos, la optimización de la salud pública en relación al uso de medicamentos, la contribución a la evaluación de riesgo-beneficio de las intervenciones con medicamentos y la promoción de la comprensión, educación y entrenamiento en farmacovigilancia2.
Dado que durante la comercialización de los medicamentos, la cantidad de personas expuestas es mayor y las características de las mismas podrían diferir de las estudiadas durante los ensayos clínicos (por ej.: comorbilidades o polifarmacia) la recolección de información posterior a la aprobación y el manejo del riesgo basados en los datos observacionales son críticos para la salud pública3, 4. Dicho concepto se ve acrecentado por el retiro del mercado, en las últimas décadas, de más de 130 productos farmacéuticos debido a problemas de seguridad, un tercio de ellos dentro de los 2 años de incorporados y la mitad dentro de los 5 años1.
Los estudios de meta-análisis mostraron una incidencia de reacciones adversas medicamentosas que varió entre 4.4% a 5.8% en EE.UU. y 5.2 a 8.2% en Australia5. Dos estudios de centros regionales de farmacovigilancia de Francia, en muestras representativas de departamentos médicos de hospitales públicos, mostraron una prevalencia de RAM entre 4.2 y 22.1%, acorde al tipo de hospital y departamento estudiado5, 6.
Nuestro estudio busca describir la morbi-mortalidad asociada al uso de medicamentos, la incidencia de las reacciones adversas medicamentosas (RAM), sus características, los fármacos asociados a las mismas y determinar la incidencia de errores de prescripción en pacientes internados en la División B del Servicio de Clínica Médica del Hospital Ramos Mejía, Buenos Aires, Argentina.
Materiales y métodos
Para evaluar la morbimortalidad de las reacciones adversas medicamentosas se realizó un estudio prospectivo, observacional, descriptivo, sobre una cohorte de pacientes internados en la División B de Clínica Médica del Hospital Ramos Mejía durante el período octubre 2009-agosto de 2011. El estudio fue aprobado por el comité de ética hospitalario.
Todos los pacientes internados que presentaran los criterios de selección y que voluntariamente aceptaran firmar el consentimiento informado (CI) eran entrevistados por el equipo médico.
Los criterios de elegibilidad fueron: pacientes que hayan sido internados en dicho período; que permanezcan internados al menos 24 horas y que (ellos o sus representantes legales) puedan comprender y aceptar voluntariamente firmar el CI.
El equipo médico estaba constituido por personal de la comisión de farmacovigilancia hospitalaria.
Se utilizaron tres instrumentos de recolección de datos:
1. Una planilla donde se registraban los datos del paciente: sexo (M/F) fecha de nacimiento, fecha de última menstruación (F), embarazo (F), fecha de internación, diagnóstico al momento de la internación, momento de presentación de la RAM (al ingreso, motivándolo o no, o durante la internación), co-morbilidades, medicación que consume al momento del ingreso (incluida la dosis, intervalo, antigüedad y motivo), datos de laboratorio al momento del ingreso y fecha de alta, diagnóstico y destino al alta.
2. Una segunda planilla donde se registraban los medicamentos recibidos durante la internación, consignándose el nombre genérico, la dosis, el intervalo, la vía de administración, la fecha de inicio y suspensión, el total de días recibido y el tipo de error de prescripción detectado.
3. Una tercera planilla para cada una de las RAM detectadas que contiene la descripción y diagnóstico del evento adverso, la toxicidad, criterios de seriedad, información de las drogas sospechosas (nombre, dosis, frecuencia, vía de administración, indicación de uso, fecha de inicio, fecha de suspensión, cantidad de días de exposición, tiempo para la resolución luego de la suspensión, tiempo para la reaparición luego de la reexposición, estado actual, relación de causalidad y datos del elaborador), el dato de laboratorio y los estudios realizados al paciente que tengan relación con el evento.
Se definió RAM como cualquier manifestación nociva, clínica y/o biológica imputable (de acuerdo a criterios clínicos establecidos de imputabilidad) a un medicamento, que ocurre a las dosis habitualmente utilizadas en el ser humano para la profilaxis, diagnóstico o tratamiento de una enfermedad (Criterios CIOMS e ICH E2A)7-9. Se estableció la causalidad considerando los siguientes criterios10: ocurrencia del evento en el tiempo esperado; ausencia de síntomas relacionados al evento previos a la exposición; evidencia de detención o mejoría con la suspensión (dechallenge); reaparición ante la re-exposición (rechallenge); consistencia del evento con la farmacocinética, la farmacodinamia o los efectos toxicológicos en estudios preclínicos; consistencia del evento con los datos de toxicidad del producto en el prospecto; consistencia del evento con los efectos conocidos de otros productos de la misma familia farmacológica; ausencia de explicación alternativa del evento en relación al desarrollo de la enfermedad o co-morbilidad y ausencia de explicación alternativa por medicamentos concomitantes.
Se describieron por separado los grupos de pacientes de acuerdo al momento en que la RAM fue detectada. Se determinaron así los siguientes grupos: a) RAM al ingreso que motiva la internación, b) RAM al ingreso pero no como motivo de internación, c) RAM durante la internación.
Se estableció la relación entre el evento y el fármaco de acuerdo a la siguiente escala de relación: a) ninguna: el evento se manifiesta con una secuencia temporal improbable en relación con la administración y del medicamento, y puede ser explicado de forma más plausible por la enfermedad concurrente, o por otros medicamentos o sustancias; b) posible: el evento se manifiesta con una secuencia temporal razonable en relación con la administración del medicamento, pero puede ser explicado también por la enfermedad concurrente, o por otros medicamentos o sustancias. La información respecto a la suspensión del medicamento puede faltar o no estar clara; c) probable: el evento se manifiesta con una secuencia temporal razonable en relación con la administración del medicamento, es improbable que se atribuya a la enfermedad concurrente, ni a otros medicamentos o sustancias, y que al retirar (dechallenge) el medicamento se presente una respuesta clínicamente razonable. No existe reexposición (rechallenge); d) definida: el evento se manifiesta con una secuencia temporal plausible en relación con la administración del medicamento y no puede ser explicado por la enfermedad concurrente, ni por otros medicamentos o sustancias. Mejora con la supresión del medicamento (dechallenge), procedimiento de reexposición (rechallenge) concluyente, si es necesario; e) condicional: la secuencia temporal es razonable y la reacción no se explicaría por el estado clínico del paciente, pero el cuadro presentado no es conocido como efecto indeseable del medicamento implicado.
Se consideraron serias a aquellas RAM que cumplen los siguientes criterios de la clasificación de CIOMS1: 1) Causan defecto congénito o daño permanente; 2) Causan la muerte del paciente; 3) Inician o prolongan la hospitalización; 4) Causan discapacidad o daño permanente; 5) Son una amenaza para la vida; 6) Requirieron intervención médica.
Se clasificaron las RAM de acuerdo a la gravedad y al mecanismo de acción.
De acuerdo a la gravedad (CTCAE v4.0311) en: Grado 1, leve: asintomático o síntomas leves, requiere solo del diagnóstico u observación clínica, sin indicación de intervención. Grado 2, moderada: está indicada la intervención pero ésta es minima, local o no invasiva y no afecta las capacidades habituales del paciente. Grado 3, grave: o médicamente significativa, pero no compromete la vida inmediatamente, prolonga o motiva la internación, compromete completamente o limita las capacidades habituales del paciente. Grado 4: compromete la vida, requiere de intervención urgente. Grado 5: el evento adverso causa la muerte del paciente.
De acuerdo al mecanismo de producción en tipo A (asociado al mecanismo de acción); tipo B (no relacionado con la dosis, inmunomediado o no); tipo C (asociado a tratamientos crónicos), tipo D (efecto diferido, como teratogénesis o carcinogénesis) y tipo E (secundario a interacción medicamentosa).
Se evaluaron los errores médicos de prescripción, definiéndose como aquellos que ocurren cuando, como resultado de una decisión de prescripción o un proceso de escritura de la prescripción, hay una significativa y no intencional reducción en la probabilidad de que el tratamiento sea el oportuno y efectivo, o existe un incremento en el riesgo de daño12. Se consideró error médico de prescripción a cada uno de los siguientes ítems13, 14: a) error en la dosis (menor o mayor a la dosis terapéutica), o falta de ajuste en caso de alteración de la función renal y/o hepática; b) falta de indicación de dosis; c) intervalo inter-dosis equivocado; d) dilución en solución o concentración incorrectas o no especificadas; e) velocidad de infusión incorrecta o no especificada; f) asociación no conveniente; g) duplicidad terapéutica; h) contraindicación de acuerdo al prospecto; i) uso de abreviaturas; j) nombre comercial; k) letra ilegible.
Una vez detectados los errores se realizaron las correcciones correspondientes, reescribiendo las indicaciones y avisando del error al médico encargado de la prescripción. Además, se dictaron clases destinadas a médicos y enfermeros haciendo hincapié en prescripción de antibióticos. Se agregaron tablas de dilución y velocidad de infusión de antibióticos en el sector enfermería, carpetas de indicaciones, y en el lugar físico en el cual se confeccionan las indicaciones.
Métodos estadísticos: se llevó a cabo estadística descriptiva para las variables continuas, se utilizaron medidas de tendencia central (media/mediana) y medidas de dispersión: rango, desvío estándar, rango intercuartilo (RIC), según correspondiera. Para las variables categóricas se utilizaron proporciones.
Resultados
Durante el período octubre 2009-agosto 2011 se evaluaron en forma completa 310 pacientes (65% mujeres). La edad media de la población fue de 57 años, de 56 años en el grupo de pacientes que presentaron RAM como motivo de internación, 54 años en los que presentaron RAM durante la internación y 59 años en aquellos que no presentaron RAM. Las comorbilidades más frecuentemente detectadas fueron el tabaquismo, hipertensión arterial y diabetes. En la Tabla 1 se presentan las características demográficas y las comorbilidades de la población general así como las características de la población que presentó RAM como motivo de internación, durante la internación y la de aquellos que no presentaron RAM.
TABLA 1.- Características demográficas y clínicas de los pacientes con o sin RAM durante la internación en clínica médica
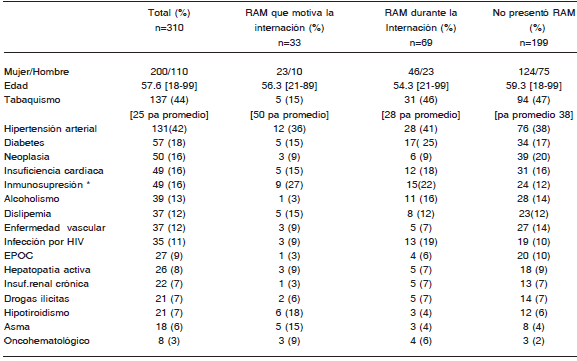
Número absoluto de comorbilidades presentes en los pacientes ingresados al estudio de acuerdo al total. N=310 pacientes. (El porcentaje total es mayor al 100% ya que varias comorbilidades coexisten en muchos pacientes).
* se consideró inmunosuprimido a aquel paciente con tratamiento inmunosupresor crónico o HIV con CD4 menor a 200. Abreviaturas: EPOC: enfermedad pulmonar obstructiva crónica; pa: paquetes-año (cigarillos por día/20 x años de tabaquismo); RAM= Reacción adversa medicamentosa; HIV: virus de la inmunodeficiencia humana.
La mediana de días de internación observada fue de 11 días (RIC: 7-21). Fue 8 días (RIC: 5.5-8.5) en el subgrupo de pacientes con RAM que motivaron la internación; 8 días (RIC: 5.25-21.75) en el grupo que presentaron una RAM al ingreso que no motivara la internación y 21 días (RIC: 11-31) en el grupo en el que las RAM se produjeron durante la internación. Los pacientes que no presentaron ninguna RAM tuvieron una mediana de internación de 10 días (RIC: 7-16).
Se identificaron 149 RAM, las cuales se presentaron en el 36% de los pacientes (111/310); el 32% (99/310) presentó una única RAM y el 4% (12/310) tuvo más de una RAM.
Cuando se analizó la distribución de las RAM de acuerdo al momento de su presentación, se detectaron 56 RAM al ingreso en 53 pacientes (3 presentaron 2 RAM al ingreso, solo una motivaba la internación), siendo el 11% de los motivos de internación (33/310); el 7% (23/310) presentó la RAM al ingreso, pero ésta no fue el motivo de internación y el 22% (69/310) presentó un total de 93 RAMs durante la internación.
En total, 221 medicamentos fueron responsables de las 149 RAM. Los antibióticos, drogas cardiovasculares e inmunosupresores fueron las familias de fármacos más asociados a la producción de RAM durante la internación. Los corticoides e inmunosupresores, antiinflamatorios no esteroideos (AINEs) y drogas cardiovasculares las familias de fármacos más asociados a RAM como motivo de internación. En las Tablas 2 y 3 se aprecia la distribución por grupos de fármacos y los tipos de RAM detectados de acuerdo al momento en el cual se presentaron las RAM. Los órganos más afectados por las RAM durante la internación fueron el aparato gastrointestinal, con predominio de colitis pseudomembranosa y diarrea, el metabolismo y medio interno y el aparato cardiovascular. Las RAM que causaron la internación afectaron más frecuentemente el aparato gastrointestinal, con predominio de hemorragia digestiva y el metabolismo y medio interno. En las Tablas 4 y 5 se aprecia la distribución de las RAM de acuerdo al órgano afectado, para las RAM ocurridas durante la internación y para las que causaron la misma, respectivamente.
TABLA 2.- Familias de drogas que más frecuentemente causaron RAM durante la internación

Se muestra además la incidencia de RAM por droga. Referencias: IBL = inhibidor de beta lactamasas; RAM = reacción adversa medicamentosa.
TABLA 3.- Familias de drogas que más frecuentemente causaron la internación por RAM

AINES: antiinflamatorios no esteroideos; RAM: reacción adversa medicamentosa
TABLA 4.- RAM ocurridas durante la internación agrupadas según los principales órganos afectados
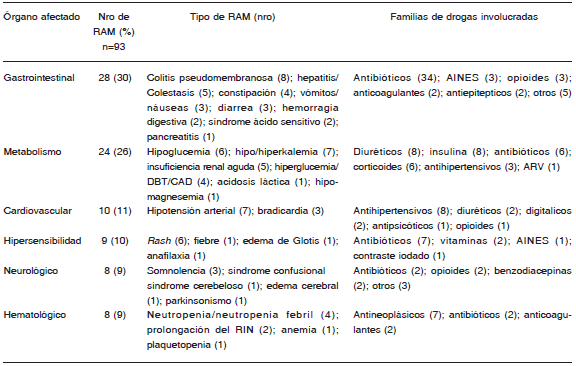
AINES: antiinflamatorios no esteroideos; DBT: diabetes; CAD: cetoacidosis diabética; ARV: antirretrovirales; RIN: rango internacional normatizado.
TABLA 5.- RAM que causaron la internación del paciente, según los principales órganos afectados

AINES: antiinflamatorios no esteroideos.
De acuerdo a la seriedad, el 42% de las RAM observadas (62/149) fueron serias y el 23% (14/62) presentaron más de un criterio de seriedad. La distribución de los criterios de seriedad fueron los siguientes: inicia o prolonga la hospitalización: 56% (35/62) y 24% (15/62) respectivamente, requirieron intervención 15% (9/62), amenaza de vida 15% (9/62), discapacidad 5% (3/62) y muerte 5% (3/62). Las familias de drogas que más se asociaron a prolongación de la internación fueron los antibióticos, con el 40% (6/15) y las drogas cardiovasculares, sumando 20 % (3/15). La droga aislada que más se asoció a la presencia de RAM seria durante la internación fue la insulina, con 2 casos de amenaza de vida y 4 en los que requirió de intervención médica.
La distribución de las RAM de acuerdo a la gravedad fue la siguiente: Grado 1: 31% (46/149), Grado 2: 27% (40/149), Grado 3: 23% (35/149), Grado 4: 15% (23/149) y Grado 5: 2% (3/149).
La distribución de las RAM de acuerdo al mecanismo de acción observado fue la siguiente: tipo A: 72% (107/149); tipo B: 26% (38/149); tipo C: 2% (3/149) y tipo D: 1% (1/149).
De acuerdo a la causalidad, la correlación fue la siguiente: 19% (29/149) fueron clasificados como definidas, 42% (63/149) como probables y 38% (57/149) como posibles.
La mortalidad global fue del 7% (21/310). Las principales causas de muerte fueron las neoplasias en estadios avanzados: 62% (13/21), seguidas por las infecciones, 24% (5/21). La mortalidad por RAM observada fue del 1% (3/310). Una de las muertes fue secundaria a RAM, una paciente con antecedentes de hepatitis por virus C que desarrolló falla hepática fulminante probablemente secundaria a lopinavir/ritonavir/tenofovir, las otras dos muertes fueron a causa de RAM en forma indirecta, y se discuten más adelante. Además, el 5.5% (17/310) de los pacientes debió ser derivado a unidad coronaria (UCO) o unidad de cuidados intensivos (UCI). De estos últimos, el 18% (3/17) fue derivado a causa de RAM y dos de ellos fallecieron; una paciente con shock séptico por infección urinaria, post quimioterapia con gemcitabine y otro con diarrea post-tratamiento con clindamicina y ciprofloxacina. El restante presentó insuficiencia cardíaca derecha secundaria a bajo volumen por diuréticos de asa.
Se detectaron 775 errores de prescripción, cuya distribución fue la siguiente: falta de especificación de dosis: 19% (148/775); dosis equivocada: 2% (18/775); intervalo inter dosis incorrecto: 0.6% (5/775); falta de especificación de la dilución: 18% (142/775); dilución incorrecta: 0.6% (5/775); falta de especificación de la velocidad de infusión: 23% (197/775); velocidad de infusión incorrecta: 1% (10/775); asociación no conveniente: 1% (11/775); duplicidad terapéutica: 0.5% (4/775); contraindicación: 0.5% (4/775); uso de abreviaturas: 5% (42/775); uso de nombre comercial: 21% (161/775). La distribución de errores de prescripción por familias de fármacos mostró que el porcentaje más elevado de errores de prescripción se produjo al prescribir antibióticos: 43% (337/775) debidos a fallas en la dilución y/o en la velocidad de infusión.
Un solo error de prescripción se asoció a la RAM, 0.1% (1/775), el que fue grado 4 y Tipo b. Se observó en una paciente en la que se indicó anfotericina B 25 mg en una hora, presentando como reacción relacionada a la infusión sudoración profusa, piloerección, broncoespasmo grave y fiebre durante 2 horas. No volvió a presentar el cuadro con un tiempo de infusión de 6 h.
Discusión
La frecuencia de RAM varía entre los diferentes estudios publicados, lo cual puede explicarse por la población estudiada (una de las limitaciones de nuestro estudio es que se llevó a cabo en un solo hospital), la definición de las RAM, la metodología para su detección, las comorbilidades de los pacientes y la gravedad de las reacciones, entre muchas otras. La mortalidad asociada a RAM fue aquí del 1%. Este mismo porcentaje fue encontrado por David Bates y col.15. Otros autores16, 17 encontraron porcentajes menores.
El 36% de los pacientes presentó al menos una RAM. En Latinoamérica, un estudio de Camargo y col.18, 19 (Brasil) mostró una incidencia de RAM del 43% en los pacientes internados y otro de Tribino y col.18 (Colombia) una incidencia del 25%. Ambos estudios fueron de diseño prospectivo, el segundo de ellos se basó en el informe espontáneo y en la revisión de historia clínica y no en la vigilancia intensiva. En una revisión sistemática de 38 artículos, el porcentaje de pacientes con RAM varió del 1.7 al 51.8%. Esta extensa variación podría relacionarse con los bajos porcentajes hallados en los estudios retrospectivos con informe espontáneo o búsqueda de las RAM por diagnóstico al momento del alta.
En nuestro estudio, las RAM como motivo de internación constituyeron el 11%, más elevado que lo observado en un meta-análisis publicado por Lazarou y col. donde se describen las RAM serias y dentro de las mismas las que motivaron la internación, con una incidencia del 4.7%17, 19, pero menor que el 19.7% hallado por Camargo y col.19 y dos estudios de Dormann y col., prospectivos, en hospitales universitarios, que mostraron una incidencia de RAM como motivo de internación del 15.2 y 11.8%18. Esta diferencia puede deberse al diseño prospectivo, con vigilancia continua basada en signos, síntomas y datos de laboratorio, y no solamente en notificación espontánea, lo cual permite una menor pérdida de RAM.
Al analizar la mediana de días de internación, menos afectada por los valores extremos en algunos pacientes, se observa un valor de 21 días para los pacientes que presentaron RAM durante la internación, (que duplica la mediana general de 10 días). Camargo y col. describen en su estudio que un tiempo de hospitalización mayor a 7 días podría ser un factor de riesgo independiente para el desarrollo de RAM19; esto podría relacionarse con los resultados obtenidos en nuestro estudio.
Los antibióticos, las drogas cardiovasculares (diuréticos y antihipertensivos en su mayoría), inmunosupresoras e hipoglucemiantes, fueron las familias de fármacos de mayor prevalencia en la producción de RAM durante la internación; esto puede ser consecuente con su uso elevado, siendo esto también concordante con los resultados hallados por Cano y col. en una revisión sistemática, con preponderancia de antibióticos (8-39%), antineoplásicos (30.7%) y drogas cardiovasculares (25.3%)17, y con otros estudios que evaluaron este punto15, 16,20. Coincidente asimismo con lo observado, ninguna droga aislada fue responsable de más del 6% de las RAM, por lo cual se deben diseñar estrategias dirigidas a múltiples grupos de drogas para tener un mayor impacto en la reducción de las RAM15. Existe un patrón de afectación diferente según el momento en que se produce la RAM. Así, los antibióticos son una causa importante de morbimortalidad durante la internación, pero no son una causa importante de hospitalización, los corticoides causan internación por enfermedades oportunistas y durante la internación desencadenan hiperglucemia o diabetes metacorticoidea, para enfatizar algunos ejemplos.
Las drogas que causaron más RAMs como motivo de internación fueron los inmunosupresores (corticoides a largo plazo la mayoría de ellos), los antiinflamatorios no esteroideos y las drogas cardiovasculares, consistente con el resultado de Camargo y col.19 con mayor representación de antiinflamatorios no esteroideos y corticoides principalmente.
Un 42% (62/149) de las RAM fueron clasificadas como serias (71% fueron tipo A); Bates15 encontró un porcentaje menor (30% de RAM serias, 43% tipo A). Otra vez, la diferencia podría deberse a que en ese estudio se realizó notificación espontánea y revisión de historias clínicas solamente. Lazarou y col. evaluaron la incidencia de RAM serias en pacientes hospitalizados en los EE.UU., con una incidencia global del 6.7% (IC 5.2-8.2%), 0.32% fatales, y 76% de RAM tipo A, siendo entre la cuarta y sexta causa de mortalidad21.
Nuestra incidencia de errores de prescripción en los 310 pacientes fue del 22% (775/3481). Se observó una sola RAM asociada a un error de prescripción, probablemente la baja relación entre los errores de prescripción y las RAM esté vinculada a las intervenciones que se llevaron a cabo una vez que fueron detectados los errores. En España, Otero López y col. comunicaron una incidencia de errores de prescripción en el 1.8% de los pacientes hospitalizados (motivando el 4.6% de las internaciones, siendo del 9.7% en los mayores de 65 años)22. En Brasil, un estudio de Borges Rosa y col. evaluó los errores de prescripción en medicamentos de alto riesgo, comunicando una incidencia del 44.5% con una tasa de omisión de la concentración del 49.8% 23. En EE.UU. la incidencia de error en un estudio fue del 10%17. Los errores más frecuentemente observados en nuestro estudio fueron concordantes con los comunicados por Borges Rosa y col. e Inocenti Miasso y col., como falta de especificación de la velocidad de infusión y falta de especificación de la dilución23, el uso de nombre comercial, falta de indicación de dosis o uso de abreviaturas24.
Las RAM constituyen un problema para la salud de la población, son un factor de morbimortalidad importante y causan un incremento en el monto total del gasto destinado a salud (internaciones, tratamientos, discapacidad y eventualmente costos judiciales), calculado en 3 000 euros por internación en España23 y de 473 millones de euros por pacientes hospitalizados anuales en Alemania25.
Pocos estudios han evaluado la incidencia y características de las RAM en América Latina; es imperioso realizar estudios prospectivos multicéntricos con criterios unificados a fin de obtener datos extrapolables y que incluyan las medidas a tomar e intervenciones destinadas a disminuir su frecuencia en un futuro próximo.
Agradecimientos: Este trabajo se realizó con el soporte financiero de las Becas de Investigación 2009 del Ministerio de Salud del Gobierno de la Ciudad de Buenos Aires.
Conflictos de interés: Los autores declaran no presentar conflictos de interés.
1. Management of safety information from clinical trials. Report of CIOMS working group VI. CIOMS 2005. En: www.cioms.ch/publications/blurbs/management_of_safety_information.htm [ Links ]
2. WHO medicines strategy: framework for action in essential drugs and medicines policy 2000-2003. WHO/EDM/2000. En: http://apps.who.int/medicinedocs/pdf/whozip16e/whozip16e.pdf; consultado el 2/3/2012. [ Links ]
3. The importance of pharmacovigilance, WHO, 2002. En: http://apps.who.int/medicinedocs/en/d/Js4893e/; consultado el 15/4/2012. [ Links ]
4. Gess HA, Stephenson W, Sacks ST, Gardner JS. Beyond pharmacoepidemiology: the larger role of epidemiology in drug development. J Clin Epidemiol 1989; 41: 995-6. [ Links ]
5. Haramburu F, Pouyanne P, Imbs JL, Blayac JP, Begaud B. Incidence and prevalence of adverse drug reactions. Presse Med 2000; 29: 111-4. [ Links ]
6. Pouyanne P, Haramburu F, Imbs JL, Bégaud B. Admissions to hospital caused by ADRs: cross sectional incidence study. BMJ 2000; 320: 1036. [ Links ]
7. Definition, criteria and standard form for international reporting of medically ADRs, Report of CIOMS I Working Group. CIOMS. Geneva, 1990. [ Links ]
8. Reporting adverse drug reactions: definitions of terms and criteria for their use. Edited by Z. Bankowski et al. Council of International Organizations of Medical Sciences, Geneva, 1999. [ Links ]
9. ICH guideline E2A. Clinical safety data management: Definition and standards for expedited reporting, Step 4 as of October 1994. En: http://www.ich.org/fileadmin/Public_Web_Site/ICH_Products/Guidelines/Efficacy/E2A/Step4/E2A_Guideline.pdf; consultado el 12/03/2009. [ Links ]
10. Safety monitoring of medicinal products: guidelines for setting up and running a pharmacovigilance centre (2000). World Health Organization, Upsala Monitoring Center. En: http://apps.who.int/medicinedocs/en/d/Jh2934e/15.html; consultado el 15/03/2009. [ Links ]
11. Common toxcicity criteria. En: http://evs.nci.nih.gov/ftp1/CTCAE/CTCAE_4.03_2010-06-14_QuickReference_8.5x11.pdf; consultado el 12/04/2011. [ Links ]
12. Dean B, Barber N, Schachter M. What is a prescribing error? Qual Health Care 2000; 9: 232-7. [ Links ]
13. Otero López MJ. Errores de medicación: estandarización de la terminología y clasificación. Farm Hosp 2003; 27: 137-49. [ Links ]
14. Institute for safe medical practices guidelines for standard order sets. En: http://www.ismp.org/tools/guidelines//standardOrderSets.pdf; consultado el 7/04/2011. [ Links ]
15. Bates DW, Cullen DJ, Nan Laird. Incidence of adverse drug events and potential adverse drug events. Implications from prevention. ADE prevention group study. JAMA 1995: 274; 29-34. [ Links ]
16. Davies EC, Green C, Taylor S. Adverse drug reactions in hospital in-Patients: a prospective analysis of 3695 patient-episodes. PLoS ONE 2009; 4: e4439. [ Links ]
17. Leape L, Brennan TA, Laird N, et al. The nature of adverse events in hospitalized patients. Results of the Harvard Medical Practice Study II. N Engl J Med 1991; 324:377-84. [ Links ]
18. Giordani Cano F, Rozenfeld S. Adverse drug events in hospitals: a systematic review. Cad. Saúde Pública 2009; 25 Sup 3: S360-72. [ Links ]
19. Camargo AL, Cardozo Ferreira MB, Heineck I. Adverse drug reactions; a cohort study in internal medicine units at a university hospital. Eur J Clin Pharmacol 2006; 62: 143-9. [ Links ]
20. Otero López MJ, Alonso-Hernández P. Acontecimientos adversos prevenibles causados por medicamentos en pacientes hospitalizados. Med Clin (Barc) 2006; 126: 81-7. [ Links ]
21. Lazarou J, Pomeranz B, Corey P. Incidence of adverse drug reactions in hospitalized patients. A meta-analysis of prospective studies. JAMA 1998; 279: 1200-5. [ Links ]
22. Otero López MJ. Nuevas iniciativas para mejorar la seguridad de la utilización de los medicamentos en los hospitales. Rev Esp Salud Pública 2004; 78:323-39. [ Links ]
23. Rosa MB, Perini E, Anacleto TA, Neiva HM, Bogutchi T. Erros na prescrição hospitalar de medicamentos potencialmente perigosos. Rev Saúde Pública 2009; 43: 490-8. [ Links ]
24. Miasso AI, Oliveira RC, Silva AE, et al. Prescription errors in brazilian hospitals: a multi-centre exploratory survey. Cad Saude Publica 2009; 25: 313-20. [ Links ]
25. Stark R, Jürgen J, Leidl R. Health care use and costs of adverse drug events emerging from outpatient treatment in Germany: A modeling approach. BMC Health Serv Res 2011; 11: 9. [ Links ]
Recibido: 23-V-2012
Aceptado: 22-XI-2012














