Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Medicina (Buenos Aires)
versión impresa ISSN 0025-7680
Medicina (B. Aires) vol.73 no.5 Ciudad Autónoma de Buenos Aires oct. 2013
COMUNICACIÓN BREVE
La redistribución dinámica mitocondria-núcleo de la inmunofilina FKBP51 es regulada por PKA para modular la expresión de genes durante el proceso de adipogénesis*
Judith Toneatto, Nancy L. Charó, Sebastián Susperreguy, Graciela Piwien-Pilipuk
Laboratorio de Arquitectura Nuclear, Instituto de Biología y Medicina Experimental (IByME), CONICET, Buenos Aires
Dirección postal: Dra. Graciela Piwien-Pilipuk, Laboratorio de Arquitectura Nuclear, Instituto de Biología y Medicina Experimental, Vuelta de Obligado 2490, 1428 Buenos Aires, Argentina
e-mail: gpiwien@conicet.gov.ar
* Premio León Cherny, Reunión Anual de la Sociedad Argentina de Investigación Clínica, Mar del Plata, noviembre de 2012
Resumen
Los glucocorticoides tienen un papel central en la adipogénesis, por su unión al receptor RG citoplasmático formando parte de un heterocomplejo también integrado por una inmunofilina (INM) de alto peso molecular, FKBP51 o FKBP52. Durante la diferenciación adipocítica los niveles de Hsp90, Hsp70 y p23 no se modifican, mientras la expresión de FKBP52 disminuye y la de FKBP51 aumenta progresivamente. FKBP51 sufre una dinámica redistribución mitocondria-núcleo al inicio del proceso de adipogénesis, concentrándose en la lámina nuclear coincidiendo temporalmente con su reorganización. A las 48 h la INM se concentra nuevamente en las mitocondrias. Esta dinámica redistribución mitocondria-núcleo es regulada por glucocorticoides principalmente, por la vía AMPc-PKA ya que la inhibición de PKA por PKI-miristoilado bloquea la traslocación de FKBP51 a núcleo inducida por 3-isobutil-1-metilxantina (IBMX). PKA-c se asocia con RG de manera ligando-dependiente potenciando su actividad transcripcional y ésta disminuye con IBMX, forskolina o dibutiril-AMPc que inducen la traslocación a núcleo de FKBP51 y, por lo tanto, PKA podría ejercer un papel dual en la regulación de dicho factor. En síntesis, la presencia de FKBP51 en el núcleo dependiente de la activación de PKA puede ser crítica para el control de RG y posiblemente para otros factores no pertenecientes a la familia de los receptores nucleares cuya función es regulada también por dicha vía de señalización, evento que tiene lugar en una etapa del proceso de diferenciación con alto nivel de remodelamiento de cromatina, pero donde la transcripción debe estar estrictamente controlada para la adquisición del fenotipo adipocítico.
Palabras clave: Adipogénesis; FKBP51; PKA
Abstract
The dynamic mitochondria-nuclear redistribution of FKBP51 during the process of adipocyte differentiation is regulated by PKA. Glucocorticoids play an important role in adipogenesis via the glucocorticoid receptor (GR) that forms a heterocomplex with Hsp90-Hsp70 and a high molecular weight immunophilin FKBP51 or FKBP52. We have found that FKBP51 level of expression progressively increases, FKBP52 decreases, whereas Hsp90, Hsp70, and p23 remain unchanged when 3T3-L1 preadipocytes differentiate. Interestingly, FKBP51 translocates from mitochondria to the nucleus at the onset of adipogenesis. FKBP51 transiently concentrates in the nuclear lamina, at a time that this nuclear compartment undergoes its reorganization. FKBP51 nuclear localization is transient, after 48 h it cycles back to mitochondria. We found that the dynamic FKBP51 mitochondrial-nuclear shuttling is regulated by glucocorticoids and mainly on cAMP-PKA signaling since PKA inhibition by myristoilated-PKI, abrogated FKBP51 nuclear translocation induced by 3-isobutyl-1-methylxanthine (IBMX). It has been reported that PKA interacts with GR in a ligand dependent manner potentiating its transcriptional capacity. GR transcriptional capacity is reduced when cells are incubated in the presence of IBMX, forskolin or dibutyryl-cAMP, compounds that induced nuclear translocation of FKBP51, therefore PKA may exert a dual role in the control of GR. In summary, the presence of FKBP51 in the nucleus may be critical for GR transcriptional control, and possibly for the control of other transcription factors that are not members of the nuclear receptor family but are regulated by PKA signaling pathway, when transcription has to be strictly controlled to succeed in the acquisition of the adipocyte phenotype.
Key words: Adipogenesis; FKBP51; PKA
Por mucho tiempo se le ha asignado al tejido adiposo la mera función de almacenamiento de triacilglicerol en períodos de exceso de energía y de su distribución durante tiempos de escasez. Sin embargo, durante las últimas dos décadas se ha demostrado que este tejido no solo cumple la función de reserva de energía sino que es también un activo órgano endocrino que secreta diversos factores denominados genéricamente adipocitoquinas (por ej. leptina, adiponectina, resistina, interleuquina-6, a1-glicoproteína, amiloide A sérico, entre otros) que actúan no solo en la regulación del balance energético, sino también modulando la respuesta inmune y la regulación vascular1. Debido a su importante rol en el control de la homeostasis metabólica, cuando el funcionamiento de este tejido se desregula influye negativamente en otros sistemas. Tal es el caso de la obesidad, en la cual la hipertrofia e hiperplasia del tejido adiposo, esto último como consecuencia del aumento de la adipogénesis, determinan la expansión de su masa que se acompaña de la incapacidad del mismo para funcionar apropiadamente, contribuyendo así a los problemas asociados a la obesidad tales como dislipemia, ateroesclerosis, trastornos cardiovasculares, diabetes de tipo 2 y aumento de riesgo a varios tipos de cáncer2-4. Por lo tanto, elucidar los mecanismos moleculares que regulan la adipogénesis es fundamental para profundizar el conocimiento de la fisiopatología de la obesidad. Además, conocer las moléculas que modulan la adipogénesis es relevante porque ellas constituyen potenciales blancos terapéuticos para el desarrollo de nuevas estrategias para el tratamiento de esta enfermedad.
Durante el proceso de diferenciación adipocítica tiene lugar una cascada de eventos génicos perfectamente coordinada y regulada por numerosas vías de señalización5, 6. Se encuentra ampliamente documentado que los glucocorticoides son importantes moduladores de la adipogénesis7. En el hipercortisolismo, tanto el endógeno (síndrome de Cushing) como el exógeno por tratamiento con glucocorticoides, se observa desarrollo de obesidad visceral central acompañada de un aumento involuntario de peso7. El cortisol producido por preadipocitos/adipocitos actúa de manera parácrina estimulando la adipogénesis, favoreciendo así la expansión del tejido adiposo y la concomitante aparición de los trastornos que acompañan a la obesidad7. Sin embargo, no solo los glucocorticoides juegan un importante rol en la adipogénesis sino también la aldosterona (ALDO), esteroide mineralocorticoide. Se ha demostrado que ZK91587, antagonista de ALDO, inhibe la diferenciación mediada por ALDO y no por DEXA8. Es por ello que el rol de ALDO ha cobrado recientemente importancia, no solo en adipogénesis sino también en el desarrollo del síndrome metabólico y obesidad. Los gluco- y mineralocorticoides ejercen su acción a través de la unión a sus receptores, los cuales son factores de transcripción integrantes de la familia de los receptores nucleares (RN) que se encuentran ubicados en el citoplasma. Para unir hormona y translocar a núcleo, tanto el receptor de glucocorticoides (RG) como el de mineralocorticoides (RM) deben formar parte de un heterocomplejo con Hsp90•Hsp70•p23 y una inmunofilina (INM) de alto peso molecular (Fig. 1)9, 10. El dímero de Hsp90 presente en el complejo forma un sitio aceptor que reconoce al dominio TPR (del inglés - TetratricoPeptide Repeat) de las INMs de alto peso molecular FKBP51 y FKBP52. Las INMs constituyen una familia de proteínas que reciben dicha denominación debido a su capacidad de unir a las drogas inmunosupresoras rapamicina, ciclosporina-A o FK506 (subfamilia FKBP, por FK506-Binding Protein). Las INMs asociadas a la inmunosupresión son las de bajo peso molecular, mientras que la función de las de alto peso molecular no está aún bien definida, más allá de lo profusamente descripto para los receptores nucleares. En el modelo de señalización, hasta hace pocos años se consideraba que la unión de la hormona a su receptor determinaba su liberación del heterocomplejo, facilitándose así su translocación a núcleo. Sin embargo, trabajos de los laboratorios del Dr. W. Pratt, de la Universidad de Michigan, y del Dr. M. D. Galigniana, de la Universidad de Buenos Aires, han aportado evidencias experimentales que demuestran que la unión de la hormona a RG o RM produce en el heterocomplejo un intercambio de INMs siendo FKBP51 reemplazada de su unión a Hsp90 por FKBP52, esta última con capacidad de interactuar con componentes de la maquinaria motora, facilitando así el movimiento retrógrado del heterocomplejo RG o RM •Hsp90•Hsp70•p23•FKBP52 a núcleo (Fig. 1)9-12. Además, la interacción de componentes del heterocomplejo con proteínas que conforman el poro nuclear facilitaría la translocación del RN a núcleo donde ejerce su acción regulatoria sobre la expresión de genes blanco10, 14.
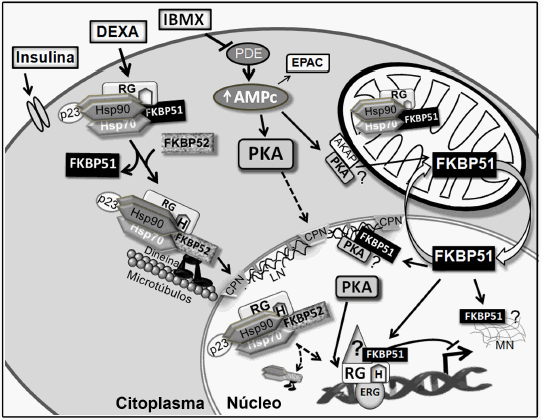
Fig. 1.– Esquema del modelo de acción de FKBP51 al inducirse el proceso de adipogénesis. FKBP51 se encuentra en mitocondria y en citoplasma, en parte formando el heterocomplejo con Hsp90•RG. El aumento de AMPc y activación de PKA mediado por IBMX, así como el estímulo de DEXA regulan la translocación de esta INM a núcleo donde puede interactuar con la matriz nuclear (MN), y con cromatina modulando la expresión de genes blanco tales como los regulados por RG. FKBP51 se concentra y co-localiza transitoriamente con PKA-c en la lámina nuclear (LN). PDE: fosfodiesterasa, CPN: Complejo del Poro Nuclear.
Debido a que los glucocorticoides son un estímulo hormonal importante en la inducción de la adipogénesis7, y nada se sabía acerca del rol de las INMs sobre el control de RG durante dicho proceso de diferenciación celular, estudiamos la función de FKBP51. Como se puede observar en la Fig. 2A, el nivel de expresión de RG mostró un comportamiento bifásico, disminuyendo transitoriamente entre el cuarto y sexto día de diferenciación. Este resultado concuerda con lo informado previamente para el ARNm de RG15. En el caso de Hsp90 (Fig. 2A), Hsp70, Cyp40 y p23 (datos no mostrados) no hubo modificaciones en sus respectivos niveles de expresión. Por el contrario, las INMs evidenciaron cambios opuestos, aumentando progresivamente el nivel de FKBP51 (Fig. 2A), lo que se correlaciona con aumento de su ARNm (Fig. 2B), y disminuyendo el nivel de expresión proteica de FKBP52 (Fig. 2A) sin cambios observables en los niveles de su ARNm (Fig. 2B), lo que sugiere un mecanismo de control no relacionado a la transcripción. Como control de la diferenciación de los preadipocitos se muestra el aumento progresivo del ARNm del marcador adiponectina (Fig. 2B).

Fig. 2.– El nivel de expresión de FKBP51 aumenta y su distribución subcelular se modifica durante el proceso de adipogénesis: A- WB con los niveles de expresión de FKBP51, FKBP52, RG y Hsp90 en los días indicados post-inducción de la diferenciación adipocítica de células 3T3-L1; B- Niveles de ARNm de los factores indicados, empleándose ß tubulina como control de carga; C-E- Imágenes de IFI obtenidas por microscopía confocal mostrando la distribución subcelular de FKBP51 en 3T3-L1 a diferentes tiempos de iniciada la diferenciación adipocítica. Las flechas en el panel D señalan a los nucléolos. Escala 5 mm; (F) Análisis mediante WB de los niveles de FKBP51 y Hsp-70 presentes en las fracciones mitocondrial (M) y nuclear (N) de preadipocitos 3T3-L1 antes y a las 24 h de inducida su diferenciación.
En preadipocitos 3T3-L1, FKBP51 se localiza mayoritariamente en las mitocondrias (Fig. 2C) co-localizando con MitoTracker, y otros marcadores mitocondriales como la proteína Tom20. Al gatillarse la adipogénesis, FKBP51 se concentra rápidamente en el núcleo (Fig. 2D). Se ha descripto recientemente que esta INM transloca a núcleo en respuesta al estrés oxidativo, concentrándose en el nucléolo16. En cambio, al inducirse la adipogénesis FKBP51 se excluye del nucléolo (ver flechas en Fig. 2D), sugiriendo diferentes funciones para esta INM en el núcleo según se trate de una situación de estrés o un proceso de diferenciación celular. La localización nuclear de FKBP51 es transitoria, a partir del cuarto día de adipogénesis se la detecta nuevamente en mitocondria. En el adipocito 3T3-L1, la INM se localiza en núcleo y mayoritariamente en mitocondria (Fig. 2E). Los resultados obtenidos por inmunofluorescencia indirecta (IFI) fueron corroborados mediante análisis por western blot (WB) de las fracciones citoplasmáticas y nucleares, así como del fraccionamiento mitocondria-núcleo que demuestra que no solo FKBP51 modifica su localización subcelular sino también, aunque en menor grado, Hsp70, chaperona también presente en mitocondria (Fig. 2F). Debemos remarcar que FKBP51 se resuelve en varias bandas siendo las de menor movilidad electroforética detectadas en la fracción nuclear. Estas bandas corresponden a formas fosforiladas de la INM, ya que el tratamiento con fosfatasa alcalina de la fracción nuclear resulta en la desaparición de las bandas de menor movilidad. Estos resultados sugieren que cambios en el estado de fosforilación de FKBP51 regularían su distribución subcelular.
Para inducir la diferenciación de los preadipocitos 3T3-L1, el medio de cultivo es suplementado con 520 μM isobutil-metilxantina (IBMX), 1 μM dexametasona (DEXA), 167 nM de insulina y 10% suero fetal bovino (SFB)6. Por lo tanto, para determinar el estímulo responsable de la redistribución de FKBP51, incubamos a los preadipocitos con los componentes del cocktail de diferenciación por separado, encontrando que IBMX y, en menor grado DEXA son los responsables de la relocalización nuclear de FKBP51. El evento es altamente dinámico, ya que si luego de incubar las células en presencia de IBMX a éste se lo elimina del medio, FKBP51 recupera su localización mitocondrial. IBMX es un inhibidor de la fosfodiesterasa, lo que causa aumento en los niveles de AMPc; por lo tanto estos resultados sugieren que la redistribución de FKBP51 estaría regulada por PKA. Para demostrar nuestra hipótesis, analizamos si la translocación nuclear de FKBP51 era inhibida por PKI-miristoilado, un péptido que se une específicamente a la subunidad catalítica de PKA inhibiendo su actividad. Efectivamente, cuando las células se incuban en presencia de IBMX y PKI-miristoilado, FKBP51 no transloca al núcleo. Además, IBMX promueve la localización nuclear de PKA-ca (subunidad catalítica a de la PKA) la que co-localiza con FKBP51 principalmente en la periferia nuclear, evento también inhibido por PKI. Como la inhibición farmacológica de una cascada de señal puede no ser absolutamente específica, interferimos la expresión de PKA-ca empleando si-ARN específico. Observamos que al interferir la expresión de PKA-ca, FKBP51 no relocaliza en el núcleo de células tratadas con IBMX, en coincidencia con los resultados obtenidos empleando PKI. Como ya lo indicamos en un SDS-PAGE, FKBP51 puede ser resuelta en hasta 3 bandas, las que corresponden a distinto grado de fosforilación de la INM. Si las células se incuban con IBMX en presencia de PKI o si se interfiere PKA-ca por si-ARN, la banda con menor migración electroforética desaparece, de manera similar al resultado obtenido cuando los lisados son incubados con fosfatasa alcalina. En su conjunto, estos resultados indican que la dinámica relocalización de mitocondria a núcleo de FKBP51 depende de la activación de PKA y que la INM sería sustrato de dicha quinasa. Conjuntamente con la translocación de mitocondria a núcleo de la INM, observamos que PKA-ca también va a núcleo al gatillarse la diferenciación de los preadipocitos 3T3-L1, evidenciándose marcada co-localización entre ambas proteínas en la periferia del núcleo, donde el anillo perinuclear de FKBP51 co-localiza con lamina B, constituyente de la lámina nuclear. Es importante remarcar que FKBP51 y PKA-ca presentan un patrón de fragmentación semejante al de lamina B, lo que se correlaciona con el proceso de reorganización de la lamina nuclear recientemente descripto17. La localización nuclear de PKA-ca es también transitoria, a partir del cuarto día de inducida la adipogénesis se la detecta nuevamente en mitocondria, para retornar parcialmente a núcleo cuando la célula se encuentra totalmente diferenciada. En base a todos estos resultados, hipotetizamos que FKBP51 podría tener un rol regulatorio de genes que responden a dicha señal.
Ha sido descripto que PKA fosforila y activa a RG18. Demostramos en este trabajo que la translocación nuclear de FKBP51, un modulador negativo de RG19, es regulada por PKA. Por lo tanto, postulamos que esta quinasa podría cumplir un rol dual en la regulación de RG; por un lado modulando positivamente la capacidad transcripcional de RG a través de su fosforilación y por otro restringiendo dicha actividad al aumentar la disponibilidad nuclear de FKBP51. En preadipocitos, RG se encuentra co-localizando con FKBP51 mayoritariamente en citoplasma y, en menor medida, en el núcleo. Luego de 24 h de inducirse la diferenciación, RG está principalmente en núcleo exhibiendo una alta co-localización con la INM. Por ensayos de inmunoprecipitación se corroboró la interacción entre ambas proteínas, observándose una mayor interacción durante el primer y segundo día de diferenciación. Para evaluar el efecto de la INM sobre la capacidad transcripcional de RG se realizaron ensayos de gen reportero. FKBP51 ejerce una acción inhibitoria sobre la capacidad transcripcional de RG. La capacidad transcripcional de RG también disminuye en presencia de concentraciones crecientes de IBMX, así como también forskolina o dibutiril AMPc, agentes que actúan en la vía AMPc-PKA. Se ha demostrado que AMPc actúa tanto a nivel de la vía clásica de PKA como la no clásica de EPAC. Nosotros encontramos que cuando se emplea 8-(4-clorofeniltio)-2´-O-metiladenosina-3',5'- monofosfato cíclico (Me-AMPc), un agonista de la vía EPAC [31], la actividad transcripcional de RG no se modifica. Estos resultados sugieren que la translocación de FKBP51 a núcleo inducida por IBMX, forskolina o dibutiril AMPc serían responsables de regular negativamente la capacidad transcripcional de RG, evento independiente de la vía "no clásica" de AMPc. Para obtener evidencia experimental de lo propuesto, 3T3-L1 se trataron con DEXA en ausencia o presencia de IBMX o Me-AMPc analizándose la localización de RG y FKBP51. Se comprobó que el tratamiento con DEXA e IBMX inducía una marcada co-localización nuclear de dichos factores, comparable a la observada durante los primeros días de inducida la adipogénesis. En cambio, el tratamiento con DEXA y Me-AMPc no causó aumento en la localización nuclear de FKBP51 mayor que el inducido por DEXA, ni afectó la capacidad transcripcional de GR en ensayos de gen de reporte.
En su conjunto, nuestros resultados muestran por primera vez que durante el proceso de adipogénesis FKBP51 sufre una dinámica redistribución entre mitocondria-núcleo regulada por AMPc-PKA y, en menor medida, por los glucocorticoides (Fig. 1). Verstraeten y col. han demostrado el reordenamiento de la lámina nuclear dado por la fragmentación y subsecuente pérdida de lamina A, C, B1 y emerina del borde nuclear en los estadios tempranos del proceso de diferenciación de los preadipocitos 3T3-L117. FKBP51 y PKA-ca se concentran transitoriamente en la lámina nuclear co-localizando con lámina B en un patrón fragmentado, pudiendo ser ello funcional a la ya descripta reorganización que dicho compartimento nuclear sufre al inicio de la diferenciación. Previamente se describió que PKA-c se asocia con RG de manera ligando dependiente, potenciando su actividad transcripcional18. Nosotros demostramos que la translocación nuclear de FKBP51 dependiente de PKA reduce la capacidad transcripcional de RG; por lo tanto, PKA ejercería un rol dual en la regulación de la expresión de sus genes blanco. Además, durante los primeros días del proceso de adipogénesis hay una marcada reorganización de cromatina e interacción de factores de transcripción -como RG-, en los promotores de genes que se transcriben más tardíamente20. Por lo tanto la presencia de FKBP51 en el núcleo en esa ventana temporal de la adipogénesis puede ser crítica para el control de RG y de otros factores no pertenecientes a la familia de los RNs, en una etapa del proceso de diferenciación con alto nivel de remodelamiento de cromatina, pero donde la transcripción debe mantenerse estrictamente controlada.
Nota: Todos los autores son miembros de la Carrera de Investigador y Becarios de CONICET (Consejo Nacional de Investigaciones Científicas y Técnicas).
Conflicto de intereses: Ninguno para declarar.
1. Rajala MW, Scherer PE. Minireview: The adipocyte--at the crossroads of energy homeostasis, inflammation, and atherosclerosis. Endocrinology 2003; 144: 3765-73. [ Links ]
2. Mathieu P, Poirier P, Pibarot P, Lemieux I, Després JP. Visceral obesity: the link among inflammation, hypertension, and cardiovascular disease. Hypertension 2009; 53: 577-84. [ Links ]
3. Hossain P, Kawar B, El Nahas M. Obesity and diabetes in the developing world -a growing challenge. N Engl J Med 2007; 356: 213-5. [ Links ]
4. van Kruijsdijk RC, van der Wall E, Visseren F L. Obesity and cancer: the role of dysfunctional adipose tissue. Cancer Epidemiol Biomarkers Prev 2009; 18: 2569-78. [ Links ]
5. Rosen E D, MacDougald O A. Adipocyte differentiation from the inside out. Nature Rev Mol Cell Biol 2006; 7: 885-96. [ Links ]
6. Susperreguy S, Prendes LP, Desbats MA, et al. Visualization by BiFC of different C/EBPbeta dimers and their interaction with HP1alpha reveals a differential subnuclear distribution of complexes in living cells. Exp Cell Res 2011; 317: 706-23. [ Links ]
7. Pasquali R, Vicennati V, Cacciari M, Pagotto U. The hypothalamic-pituitary-adrenal axis activity in obesity and the metabolic syndrome. Ann N Y Acad Sci 2006; 1083: 111-28. [ Links ]
8. Rondinone CM, Rodbard D, Baker ME. Aldosterone stimulated differentiation of mouse 3T3-L1 cells into adipocytes. Endocrinology 1993; 132: 2421-6. [ Links ]
9. Pratt WB, Toft DO. Steroid receptor interactions with heat shock protein and immunophilin chaperones. Endocr Rev 1997; 18: 306-60. [ Links ]
10. Galigniana MD. Steroid receptor coupling becomes nuclear. Chem Biol 2012; 19, 662-3. [ Links ]
11. Galigniana MD, Echeverria PC, Erlejman AG. Piwien-Pilipuk G. Role of molecular chaperones and TPR-domain proteins in the cytoplasmic transport of steroid receptors and their passage through the nuclear pore. Nucleus 2010; 1: 299-308. [ Links ]
12. Galigniana M D, Radanyi C, Renoir JM, Housley PR. Pratt WB. Evidence that the peptidylprolyl isomerase domain of the hsp90-binding immunophilin FKBP52 is involved in both dynein interaction and glucocorticoid receptor movement to the nucleus. J Biol Chem 2001; 276: 14884-9. [ Links ]
13. Galigniana MD, Erlejman AG, Monte M, Gomez-Sanchez C, Piwien-Pilipuk G. The hsp90-FKBP52 complex links the mineralocorticoid receptor to motor proteins and persists bound to the receptor in early nuclear events. Mol Cell Biol 2010; 30: 1285-98. [ Links ]
14. Echeverria PC, Mazaira G, Erlejman A, Gomez-Sanchez C, Piwien Pilipuk G. Galigniana MD. Nuclear import of the glucocorticoid receptor-hsp90 complex through the nuclear pore complex is mediated by its interaction with Nup62 and importin beta. Mol Cell Biol 2009; 29: 4788-97. [ Links ]
15. Fu M, Sun T, Bookout AL, et al. A Nuclear Receptor Atlas: 3T3-L1 adipogenesis. Mol Endocrinol 2005; 19: 2437-50. [ Links ]
16. Gallo LI, Lagadari M, Piwien-Pilipuk G, Galigniana MD. The 90-kDa Heat-shock Protein (Hsp90)-binding Immunophilin FKBP51 Is a mitochondrial protein that translocates to the nucleus to protect cells against oxidative stress. J Biol Chem 2011; 286: 30152-60. [ Links ]
17. Verstraeten VL, Renes J, Ramaekers FC, et al. Reorganization of the nuclear lamina and cytoskeleton in adipogenesis. Histochem Cell Biol 2011; 135: 251-61. [ Links ]
18. Doucas V, Shi Y, Miyamoto S, West A, Verma I, Evans RM. Cytoplasmic catalytic subunit of protein kinase A mediates cross-repression by NF-kappa B and the glucocorticoid receptor. Proc Natl Acad Sci USA 2000; 97: 11893-8. [ Links ]
19. Wochnik GM, Ruegg J, Abel GA, Schmidt U, Holsboer F, Rein T. FK506-binding proteins 51 and 52 differentially regulate dynein interaction and nuclear translocation of the glucocorticoid receptor in mammalian cells. J Biol Chem 2005; 280: 4609-16. [ Links ]
20. Siersbaek R, Nielsen R, John S, et al. Extensive chromatin remodelling and establishment of transcription factor 'hotspots' during early adipogenesis. Embo J 2011; 30: 1459-72. [ Links ]
Recibido: 22-V-2013
Aceptado: 24-VII-2013














