Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Medicina (Buenos Aires)
Print version ISSN 0025-7680
Medicina (B. Aires) vol.73 no.6 Ciudad Autónoma de Buenos Aires Dec. 2013
CASUÍSTICA
Dermatosis de origen alimentario al regreso de un viaje: gnathostomiasis
Tomás A. Orduna, Susana C. Lloveras, Sofía E. Echazarreta, Santiago L. Garro, Gustavo D. González, Claudia C. Falcone
Servicio de Patologías Regionales y Medicina Tropical (CEMPRA-MT), Hospital de Infecciosas F. J. Muñiz, Buenos Aires
Dirección postal: Dra. Susana C. Lloveras, CEMPRA-MT (Sala 9) Hospital F. J. Muñiz, Uspallata 2272, 1282 Buenos Aires, Argentina
Fax: (54-11) 4305-3161 e-mail: slloveras@intramed.net
Resumen
Se describe el caso de un paciente de 32 años de edad, residente en Buenos Aires, con manifestaciones dermatológicas compatibles con gnathostomiasis. Había realizado un viaje a Colombia en el mes previo a la aparición de la sintomatología. Allí consumió cebiche (pescado crudo marinado en jugo de limón) en reiteradas oportunidades. El cuadro clínico se presentó como paniculitis eritematosa y migratoria acompañada de eosinofilia sanguínea. Se le realizó biopsia cutánea de una lesión y el diagnóstico anatomopatológico fue "paniculitis eosinofílica". La tríada de paniculitis migratoria, eosinofilia sanguínea y el consumo de pescado crudo durante el viaje a Colombia fue sugestiva de gnathostomiasis por lo que se indicó tratamiento con ivermectina con buena evolución inicial y recaída posterior. Se realizó un nuevo tratamiento con la misma droga con buena evolución y sin recaídas durante tres años de seguimiento. La afección dermatológica es un motivo frecuente de consulta al regreso de un viaje, y representa la tercera causa de morbilidad en viajeros. Es muy importante el reconocimiento de las enfermedades que pueden tener manifestación cutánea, ya que muchas de ellas son potencialmente graves y pueden poner en riesgo la vida del paciente si no son oportunamente diagnosticadas y tratadas.
Palabras clave: Gnathostomiasis; Dermatosis; Larva migrante; Eosinofilia
Abstract
Foodborne dermatosis after traveling: gnathostomiasis. We describe a case of a 32-year-old man, resident in Buenos Aires, with dermatologic manifestations compatible with gnathostomiasis. The patient had traveled to Colombia in the month prior to the onset of symptoms. There, he repeatedly ate ceviche (raw fish marinated in lemon juice). He presented with an erythematous migratory panniculitis accompanied by eosinophilia. He underwent skin biopsy of a lesion and pathological diagnosis was "eosinophilic panniculitis". The triad of migratory panniculitis, eosinophilia and consume of raw fish during the trip to Colombia was suggestive of gnathostomiasis. Ivermectin treatment started out with good initial response but subsequent relapse. We performed a new treatment with the same drug with good results and no relapses during three years of follow up. The dermatological disease is common upon return from a trip, and is the third leading cause of morbidity in travelers. It is very important to recognize cutaneous manifestations of disease as many of them are potentially serious and may compromise the patient's life if not promptly diagnosed and treated.
Key words: Gnathostomiasis; Dermatoses; Migrant larvae; Eosinophilia
Las enfermedades dermatológicas son un motivo frecuente de consulta al regreso de un viaje y representan la tercera causa de morbilidad en viajeros1, 2. El espectro etiológico de las dermatosis es muy amplio, desde enfermedades infecciosas, exóticas o cosmopolitas, hasta aquellas relacionadas con causas ambientales como secundarias a exposición solar o congelamiento o bien por la exacerbación de enfermedades pre-existentes. Es necesario reconocer las lesiones cutáneas ya que pueden ser expresión de enfermedades potencialmente graves, como la gnathostomiasis, con riesgo de vida para el paciente y en ocasiones también para el equipo de salud, como las fiebres hemorrágicas virales de transmisión interhumana.La gnathostomiasis es una zoonosis parasitaria producida por larvas de nematodes del género Gnathostoma spp, transmitida por alimentos y común de observar en áreas tropicales y subtropicales donde se consumen peces de agua dulce crudos o mal cocidos3-5.
Es una enfermedad endémica en el sureste de Asia, especialmente Japón y Tailandia pero también en Camboya, Laos, Myanmar, Indonesia, Filipinas y Malasia. Se han reportado casos en China, Sri Lanka, India y, en África, Zambia y Botswana6, 7.
En las últimas décadas, es una enfermedad emergente en países de América Central y del Sur, particularmente en México, Guatemala, Perú y Ecuador4, 5, 8.
En nuestro país existe un solo caso reportado en la literatura con paniculitis migratoria en tórax, abdomen y miembro superior izquierdo9
Caso clínico
Varón de 32 años que consultó en febrero de 2009 por placa edematosa, pruriginosa, eritematosa y caliente en muslo derecho de 7 días de evolución. El cuadro clínico comenzó a fines de enero con la aparición de una primera placa eritematosa, caliente, acompañada de edema a nivel de pared abdominal que luego de 3-4 días desapareció; a la semana presentó otra lesión de iguales características en región inguinal con similar evolución. Sucesivamente aparecieron placas migratrices en muslo y tobillo derechos. Estuvo internado en una clínica privada donde recibió tratamiento con ceftriaxona más clindamicina por cuadro clínico compatible con celulitis, y fue dado de alta por haber evolucionado favorablemente. Durante la internación se le realizaron ecografía abdominal y eco- Doppler venoso de miembros inferiores que fueron normales. Ante la reaparición de sintomatología consultó en nuestro Servicio.
No tenía antecedentes personales significativos excepto que había realizado un viaje a varias ciudades de la costa caribeña de Colombia entre el 1 y el 20 de enero de ese año y consumido en reiteradas oportunidades pescado crudo ("cebiche").
Se realizó biopsia de la lesión a nivel de muslo derecho y los siguientes estudios complementarios: serología de HIV que resultó no reactiva, recuento de glóbulos blancos: 6400/mm3 (eosinófilos 11%), eritrosedimentación 8 mm, fondo de ojo normal. Ecografía de partes blandas: en la profundidad del tejido celular subcutáneo de la cara posteroexterna de la raíz de muslo derecho, formación nodular policíclica pre aponeurótica de 56 × 40 × 16 mm sin colecciones líquidas a ese nivel.
Con diagnóstico clínico compatible con gnathostomiasis, fue tratado con ivermectina (200 μg/kg/d durante 2 días) con buena evolución.
El informe anatomopatológico de la biopsia obtenida de lesión cutánea fue "paniculitis eosinofílica".
Un mes después presentó recidiva y recibió un segundo esquema de tratamiento con la misma droga. En los controles periódicos hasta abril de 2012 no presentó recaídas.
Discusión
El género Gnasthostoma pertenece al orden Spirurida y se caracteriza por necesitar uno o más hospederos intermediarios en su ciclo vital. El género tiene 13 especies, pero solo cuatro de ellas se han relacionado con casos humanos: G. spinigerum, que generalmente se encuentra en gatos salvajes y domésticos y perros en la India, China, Japón y otros países de Asia; G. hispidum, que se encuentra en los cerdos domésticos y silvestres en Europa, Asia y Australia; G. doloresi en jabalíes, y G. nipponicum en comadrejas en Japón5, 10.
El ciclo biológico del parásito involucra hospedadores definitivos, intermediarios y paraténicos (Fig.1). Entre los hospedadores definitivos se incluyen carnívoros mamíferos como gatos, tigres, leopardos, leones, perros, mapaches, zarigüeyas y cerdos. En estos hospederos, los parásitos adultos se alojan en masas hiperplásicas inflamatorias (pseudo tumores) en la pared del esófago o el estómago, donde copulan y las hembras realizan la postura de huevos que son eliminados por la materia fecal. Cuando los huevos fértiles son depositados en aguas de lagos o ríos y tienen condiciones de temperatura adecuada, se inicia un proceso de embriogénesis que da origen a larvas de primer estadio (L1), que luego se transforman en larvas de segundo estadio (L2), eclosionan de los huevos y se desplazan en el agua. Las larvas L2 son ingeridas por pequeños crustáceos de diferentes especies (copépodos); son los primeros hospederos intermediarios que son ingeridos por los segundos hospederos intermediarios que son peces de agua dulce y salada. En estos últimos hospedadores la larva se transforma en tercer estadio (L3) y se enquista en sus masas musculares. El ciclo se completa cuando un huésped definitivo ingiere carne de peces infectados, la larva completa su maduración a larva estadio cuatro (L4) y luego muda y se convierte en parásito adulto.
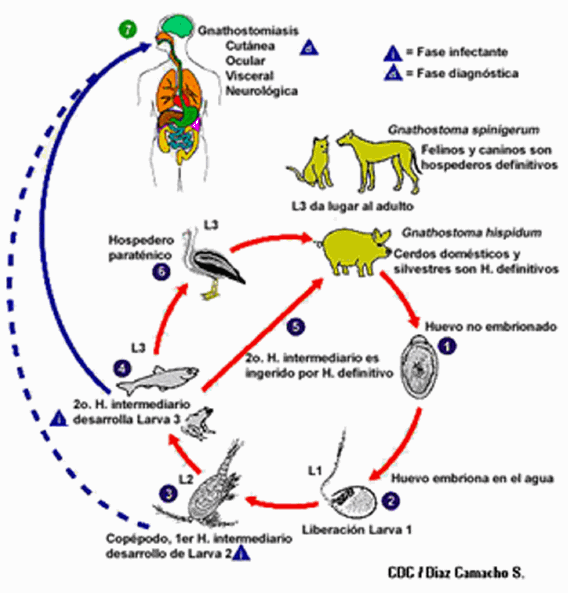
Fig. 1.- Ciclo biológico de Gnathostoma sp
Los seres humanos se convierten en huéspedes accidentales al adquirir la infección por la ingesta de pescado crudo o poco cocinado con larvas de tercer estadio enquistadas en la carne5, 6, 11.
Después de la ingestión, las larvas no pueden completar su desarrollo en los humanos, sino que migran a través de los tejidos.
Las manifestaciones clínicas pueden ser inmediatas o presentarse como un cuadro de larva migrans cutánea o visceral. La mayoría de las infecciones solo se manifiesta como enfermedad cutánea 3 a 4 semanas después de la ingestión de las larvas, pero el inicio de los síntomas puede retrasarse durante meses e incluso años5-7.
Después de la infección pueden presentarse síntomas gastrointestinales como náuseas, vómitos, dolor abdominal y también fiebre, urticaria o astenia, que pueden persistir durante 2-3 semanas. Se producen por el desenquistamiento larvario y la migración a través de la pared del estómago, intestino e hígado y coincide con una marcada eosinofilia que en algunos casos puede llegar al 50% del recuento total de glóbulos blancos5.
Las lesiones cutáneas se manifiestan como inflamaciones subcutáneas, migratorias y pruriginosas.
Los episodios de inflamación se hacen cada vez menos intensos y de menor duración, pero en los pacientes no tratados pueden persistir en forma intermitente durante un máximo de 10 a 12 años. Otras manifestaciones menos comunes de gnathostomiasis cutánea incluyen la aparición de un tracto serpiginoso, o una forma de microabscesos o nódulos que tienden a ocurrir cuando la larva migra en forma más superficial6, 12.
La gnathostomiasis visceral ocurre cuando las larvas migran e invaden otros tejidos como el sistema nervioso central, ojos, tracto gastrointestinal, genitourinario o pulmones13.
Las complicaciones más graves son debidas a la invasión del sistema nervioso central y se pueden manifestar como radiculomielitis, radiculomieloencefalitis, meningitis eosinofílica y hemorragia subaracnoidea14.
Los síntomas característicos son la aparición aguda de dolor radicular insoportable y cefalea (hemorragia subaracnoidea o meningitis eosinofílica), con la consiguiente parálisis de las extremidades y/o un par craneal. El cuadro clínico puede explicarse por el recorrido migratorio del parásito, que logra introducirse en la médula espinal a lo largo de las raíces nerviosas (craneal, cervical, torácica o lumbar), causando dolor radicular intenso que por lo general dura de 1 a 5 días5, 14.
La patogenicidad en el sistema nervioso central, como en otros tejidos, se debería a una lesión mecánica directa por la larva, como así también a la liberación de toxinas que causan daño tisular y que dan por resultado lesiones hemorrágicas que se pueden observar en el tejido cerebral o médula espinal post-mortem5, 14.
El diagnóstico de gnathostomiasis se debe sospechar por las manifestaciones cutáneas características, asociadas a eosinofilia y al antecedente epidemiológico de haber viajado a un área endémica y haber consumido alimentos con la forma larvaria (pescado crudo o poco cocido, ranas, etc.).
El diagnóstico definitivo se realiza por el aislamiento de la larva en las lesiones cutáneas, pero muchas veces se dificulta por tratarse de lesiones migratorias y, actualmente, con el advenimiento de la serología ya casi no se utiliza. Existen varias técnicas serológicas para el diagnóstico como inmunofluorescencia indirecta, hemaglutinación indirecta, ELISA. En algunos países se encuentra disponible la técnica de inmunoblot, altamente sensible y específica, que detecta la banda específica 24-kDa-L3 considerada diagnóstica de gnathostomiasis5.
Histológicamente puede observarse edema y hemorragias leves en el trayecto migratorio del parásito, y paniculitis con infiltrado de eosinófilos y neutrófilos9.
En nuestro país no contamos con disponibilidad de métodos serológicos para poder realizar el diagnóstico; por lo tanto, las manifestaciones clínicas características y los antecedentes epidemiológicos son muy importantes para sospechar la enfermedad. Los estudios histopatológicos pueden ser de utilidad, especialmente si se identifica la larva, aunque su ausencia, por su carácter migratorio, no descarta el diagnóstico.
En la localización en sistema nervioso central, el líquido cefalorraquídeo se caracteriza por presentar eosinofilia, aumento del nivel de proteínas y elevada presión de apertura. La resonancia nuclear magnética ha sido de utilidad para demostrar lesiones migratorias en médula espinal5.
En el diagnóstico diferencial de la gnasthostomiasis cutánea deben incluirse entre otros, loiasis, oncocercosis, miasis, dirofilariasis, larva migrante cutánea, esparganosis, celulitis eosinofilica, y en la localización en sistema nervioso debe considerarse Angiostrongylus cantonensis, que también puede producir una meningoencefalitis eosinofílica3, 4.
El tratamiento de esta parasitosis puede realizarse con albendazol, que en diferentes estudios demostró una tasa de curación mayor del 90% cuando se lo administró en dosis de 400 mg/800 mg/día, durante 21 días.
También se ha utilizado la ivermectina en una dosis única de 200 μg / kg por vía oral o durante dos días sucesivos, con una eficacia similar al albendazol15.
El tratamiento inicial puede fracasar y es necesario realizar un segundo esquema terapéutico, como lo requirió el paciente que se presenta. Se pueden utilizar tanto la ivermectina como el albendazol con iguales resultados para resolver el cuadro luego del fracaso inicial8, 15.
Se puede considerar que un paciente se ha curado cuando luego de 12 meses de seguimiento se encuentra asintomático, más aún si ha disminuido la eosinofilia y los títulos serológicos5.
La gnathostomiasis es actualmente una enfermedad emergente en diversos países del mundo, potencialmente grave y muy difícil de erradicar o controlar debido a un ciclo biológico muy complejo. Es necesario que los médicos puedan diagnosticarla precozmente y, además, que los viajeros realicen un asesoramiento adecuado antes de emprender un viaje para conocer las medidas de prevención al consumir alimentos.
Conflictos de interés: Los autores declaran no tener conflictos de interés.
1. Freedman DO, Weld LH, Kozarsky PE, et al. Spectrum of disease and relation to place of exposure among Ill returned travelers. N Engl J Med 2006; 354: 119-30. [ Links ]
2. Lederman ER, Weld LH, Elyazar IR, et al. Dermatologic conditions of the ill returned traveler: an analysis from the GeoSentinel Surveillance Network. Int J Infect Dis 2008, 12: 593-602. [ Links ]
3. Chopra S, Knight MA, Vega-Lopez F. Dermatological Problems. In: Gordon C. Cook MD and Alimuddin Zumla. Manson's Tropical Diseases 22 Edition. London: Saunders Elsevier; 2009, p 333-72. [ Links ]
4. Nash T. Visceral Larva Migrans and Other Unusual Helminth Infections. In: Gerald L. Mandell, John E. Bennett, Raphael Dolin. Mandell, Douglas, and Bennett's principles and practice of infectious diseases. 7th Edition. Philadelphia: Elsevier Inc; 2010, p 3620-3. [ Links ]
5. Herman JS, Chiodini PL. Gnathostomiasis, another emerging imported disease. Clin Microb Rev 2009; 22: 484-92. [ Links ]
6. Rusnak JM, Lucey DR. Clinical gnathostomiasis: case report and review of the English-language literature. Clin Infect Dis1993; 16: 33-50. [ Links ]
7. Herman JS, Wall E, Van Tulleken C, Godfrey-Faussett P, Bailey RL, Chiodini PL. Emergence of gnathostomiasis in Botswana in British tourists. Emerg Infect Dis 2009; 15: 594-7. [ Links ]
8. Chappuis F, Farinelli T, Loutan L. Ivermectin treatment of a traveler who returned from Peru with cutaneous gnathostomiasis. Clin Infect Dis 2001; 33: E17-19. [ Links ]
9. Kaminsky CA, De Kaminsky AR, Costantini SE, Abulafia J. Eosinophilic migratory nodular panniculitis (human gnathostomiasis). Med Cutan Ibero Lat Am 1989; 17: 158-62. [ Links ]
10. Gutierrez Y. Diagnostic pathology of parasitic infections with clinical correlations. 2nd ed. Oxford, UK: Oxford University Press; 2000. [ Links ]
11. Camacho SPD, Ramos MZ, Torrecillas EP, et al. Clinical manifestations and immunodiagnosis of gnathostomiasis in Culiacan, Mexico. Am J Trop Med Hyg 1998; 59: 908-15. [ Links ]
12. Vazquez Tsuji O, Campos Rivera T, Rondán Zárate A. Gnathostomiasis humana. Abordaje diagnóstico y tratamiento. Revista del Centro de Investigación. Universidad La Salle (México, DF) 2006; 7: 65-76. En: http://www.redalyc.org/articulo.oa?id=34202505; consultado 3/11/2012 [ Links ]
13. Bhattacharjee H, Das D, Medhi J. Intravitreal gnathostomiasis and review of literature. Retina 2007; 27: 67-73. [ Links ]
14. Boongird P, Phuapradit P, Siridej N, Chirachariyavej T, Chuahirun S, Vejjajiva A. Neurological manifestations of gnathostomiasis. J Neurol Sci 1977; 31: 279-91. [ Links ]
15. Nontasut P, Claesson BA, Dekumyoy P, Pakdee W, Chullawichit S. Double-dose ivermectin vs albendazole for the treatment of gnathostomiasis. Southeast Asian J Trop Med Public Health 2005; 36: 650-2. [ Links ]
Recibido:3-XII-2012
Aceptado:21-III-2013














