Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Medicina (Buenos Aires)
Print version ISSN 0025-7680
Medicina (B. Aires) vol.74 no.1 Ciudad Autónoma de Buenos Aires Jan./Feb. 2014
ARTÍCULO ORIGINAL
Geohelmintiasis en la Argentina. Una revisión sistemática
M. Eugenia Socías1,2, Anabel Fernández3, José F. Gil4, Alejandro J. Krolewiecki4
1Fundación Mundo Sano, Buenos Aires,
2Fundación Huésped, Buenos Aires,
3Programa REMEDIAR, Ministerio de Salud de la Nación,
4Instituto de Investigaciones en Enfermedades Tropicales, sede regional Orán, Universidad Nacional de Salta, Argentina
Dirección postal: Dra. M. Eugenia Socías, Fundación Mundo Sano, Paraguay 1535, 1016 Buenos Aires Argentina
e-mail: esocias@mundosano.org
Resumen
Con el objetivo de analizar la prevalencia y distribución de las geohelmintiasis en la Argentina e identificar las áreas de mayor riesgo, realizamos una revisión sistemática de los estudios poblacionales publicados entre 1980 y 2011, indexados en las bases MEDLINE/ PUBMED y/o LILACS. También se incluyeron los datos de prevalencia basal del Programa Nacional de Desparasitación Masiva (PNDM, 2005). Se identificaron 310 publicaciones, de las que solo 24 artículos con información sobre 26 relevamientos, realizados en 8 provincias y un total de 5495 individuos evaluados, cumplían los criterios de inclusión. La prevalencia de geohelmintiasis varió ampliamente: Ascaris lumbricoides 0-67%, uncinarias 0-90%, Trichuris trichiura 0-24.5%, Strongyloides stercoralis 0-83%. La prevalencia acumulada estimada de los 4 geohelmintos principales varió entre 0.8 y 88.6%. Los datos basales del PNDM con información de 1943 niños de 12 provincias confirman esta heterogeneidad con rangos de prevalencia acumulada entre 0 y 42.7%. Los estudios incluidos en esta revisión muestran que la distribución de geohelmintiasis en la Argentina es heterogénea, con focos de alta prevalencia (> 20%) en el noreste y noroeste del país, los que podrían beneficiarse de una estrategia de desparasitación masiva. En muchos casos esta alta prevalencia es debida a uncinarias y estrongiloidiosis, lo que debe tenerse en cuenta para definir las estrategias diagnósticas y terapéuticas para su control. Asimismo, se resalta la escasez o ausencia de datos, con información de menos de la mitad de las provincias y menos de 8000 individuos evaluados.
Palabras clave: Geohelmintos; Ascaris lumbricoides; Uncinarias; Trichuris trichiura; Strongyloides stercoralis; Argentina
Abstract
Soil transmitted helminthiasis in Argentina. A systematic review. A systematic review of surveys performed between 1980 and 2011 (published in MEDLINE/Pubmed and/or LILACS indexed journals, available in the baseline data from a Mass Deworming National Program (MDNP, 2005) was used to identify the prevalence, distribution and detection of risk areas for soil transmitted helminth infections (STH) in Argentina. We found 310 publications in the database using the pre-defined key-words (medical subject headings) for research purposes. Only 24 articles with 26 surveillance sites in 8 provinces and a total of 5495 surveyed individuals fulfilled the inclusion criteria. Frequency rates for STH had a wide range: Ascaris lumbricoides: 0-67%, hookworms: 0-90%, Trichuris trichiura: 0-24.6 and Strongyloides stercoralis: 0-83%. The estimated combined incidence varied from 0.8% to 88.6%. Baseline surveys from the MDNP reporting on 1943 children from 12 provinces confirmed the heterogeneity, with combined STH frequency rates ranging from 0 to 42.7%. Surveys included in this review showed that the distribution of STH in Argentina is not homogeneous, with areas of high incidence (> 20%) in the northeastern and northwestern provinces where mass deworming activities would be highly beneficial. In several surveys, the high overall incidence was mostly due to hookworms and S. stercoralis, a situation to be considered when selecting diagnostic and therapeutic control strategies. The scarcity or absence of data from various provinces and the availability of less than 8000 surveyed individuals should be considered.
Key words: Soil transmitted helminths; Ascaris lumbricoides; Hookworms; Trichuris trichiura; Strongyloides stercoralis; Argentina
Las parasitosis intestinales ocasionadas por geohelmintos son consideradas mundialmente como un problema de salud pública. Estas infecciones se encuentran entre las de mayor prevalencia en poblaciones empobrecidas en los países en desarrollo, siendo una importante causa de morbilidad y mortalidad1, 2. A pesar de su importancia a nivel educativo, económico y de salud pública, estas infecciones son ampliamente ignoradas, englobándolas dentro del grupo de las Enfermedades Tropicales Olvidadas3.
Los geohelmintos son parásitos intestinales que presentan como parte de sus ciclos vitales un pasaje por la tierra, el cual es obligado en el caso de Ascaris lumbricoides, Trichuris trichiura y las uncinarias, Necator americanus y Ancylostoma duodenale, pero no en el caso de Strongyloides stercoralis. Estas parasitosis no se transmiten de forma interpersonal sino a través de la contaminación del suelo, agua y comida contaminados con heces portadoras de huevos o larvas, o indirectamente por las malas condiciones higiénicas. Los huevos embrionados pueden ingresar al aparato digestivo a través de la vía oral por ingestión de tierra, alimentos o agua contaminada (A. lumbricoides, T. trichiura) o a través de larvas infectantes que penetren activamente la piel (uncinarias y S. stercoralis)4.
Estas parasitosis pueden infectar a personas de todas las edades, pero afectan principalmente a niños en edad pre-escolar y escolar y a mujeres embarazadas. Son una de las causas más importantes de retraso en el desarrollo físico e intelectual a nivel mundial. Varios estudios han señalado el profundo impacto que estas infecciones tienen sobre la performance escolar y la productividad económica futura5-7.
Si bien cada una de estas infecciones puede tener sus propias características, clínicamente se caracterizan por la inflamación crónica y una serie de síndromes asociados, mediados por la anemia y la desnutrición8. Generalmente, los efectos sobre la salud quedan enmascarados y hasta incluso son subestimados por ser, en su mayoría, de instalación lenta y de difícil diagnóstico dada la inespecifidad de sus síntomas o la carencia de laboratorios para el diagnóstico, por las cargas parasitarias bajas sin expresión clínica, o por las dificultades para la consulta médica oportuna por parte de las personas afectadas9-11.
Determinantes importantes de la transmisión de los geohelmintos son las características climáticas y las condiciones sanitarias, que hacen que las áreas de riesgo correspondan fundamentalmente a zonas con deficiente saneamiento ambiental y población pobre en conglomerados urbanos10, 12.
En las poblaciones endémicas la carga parasitaria no se distribuye uniformemente. Como regla, el 20% de la población en riesgo posee aproximadamente el 80% de la carga parasitaria13. Este tipo de distribución tiene consecuencias desde el punto de vista clínico y de salud pública, ya que la población afectada sufre el mayor impacto de la enfermedad y además constituye la principal fuente de contaminación ambiental. De hecho, existe evidencia de la tendencia a la agregación familiar de estas infecciones. La contribución relativa de factores genéticos o de factores comunes socioambientales es motivo de debate3, 14.
En función de lo expuesto, el control de las geohelmintiasis se basa en la combinación de tres grandes conjuntos de acciones: 1) tratamiento medicamentoso para reducir los niveles de infección y la morbilidad; 2) educación para la salud, para reducir la infección humana y la contaminación ambiental; y 3) saneamiento, para controlar la contaminación ambiental15.
El uso de antihelmínticos no se limita al tratamiento de infecciones sintomáticas, sino que también se utilizan en gran escala para la reducción de morbilidad en comunidades endémicas3. El objetivo de la desparasitación periódica, aun cuando la re-infección sea la regla, es mantener el nivel de infección por debajo del límite asociado a enfermedad. La frecuencia apropiada de la desparasitación masiva debe decidirse de acuerdo a factores epidemiológicos, socioeconómicos y ambientales locales16. La Organización Mundial de la Salud (OMS) recomienda el tratamiento bi o trianual de los niños en edad escolar (y otros grupos en riesgo) cuando la prevalencia de geohelmintiasis en una determinada área es = 50%, o anual cuando la prevalencia está entre 20 y 50%17.
Aproximadamente mil millones de personas en el mundo están infectadas con al menos una especie de geohelminto18, siendo el poliparasitismo frecuente. Se estima que el 30% de la población latinoamericana padece geohelmintiasis19. En la Argentina, la prevalencia es variable (9-38.7%)20, con una distribución heterogénea y dos áreas endémicas principales en el noreste y noroeste del país.
En un mapeo reciente de geohelmintiasis en niños de hasta 14 años en Latinoamérica realizado por la Organización Panamericana de la Salud21, para la Argentina se identificaron 19 estudios publicados entre 2000 y 2010, que informaron una prevalencia entre 0 y 88.9%. La mayoría corresponden a estudios de prevalencia puntual, que reflejan la heterogeneidad de la distribución de las geohelmintiasis en nuestro país. Asimismo, es importante destacar la falta de información sobre la intensidad de estas infecciones, la escasa información sobre prevalencia en niños preescolares (solo 2 estudios) y que el último estudio corresponde al año 2007. Todo esto resalta la necesidad de un mapeo actualizado que permita un mejor planeamiento y monitoreo de las actividades de desparasitación.
El objetivo del presente estudio fue obtener un mapeo de la situación de las geohelmintiasis en la Argentina con el fin de identificar áreas de mayor riesgo donde concentrar esfuerzos, y el mejor planeamiento y monitoreo de los programas de control de desparasitación y de otras actividades relacionadas como nutrición, educación y saneamiento. En particular, se buscó identificar aquellas áreas con prevalencias de geohelmintiasis mayores de 20%, para identificar áreas que podrían beneficiarse de la implementación de una estrategia de desparasitación masiva17.
Siguiendo la metodología PRISMA (Preferred reporting items for systematic reviews and metaanalyses)22, se realizó una búsqueda bibliográfica de estudios de prevalencia de geohelmintiasis en la Argentina entre los años 1980 y 2011.
Con el fin de asegurar la calidad de los estudios se incluyeron solo aquellos que estuviesen indexados en las bases de datos MEDLINE/PUBMED y/o LILACS.
La búsqueda en la base de datos de PUBMED se realizó utilizando las palabras clave (MeSH - medical subject headings): Helminthiasis [mh] OR Helminth* OR nematodes OR whipworm* OR Trichuriasis [mh] OR Trichuri* OR Ascariasis [mh] OR Ascariasis OR ascaris OR Ascaridida OR roundworm* OR nematode OR Hookworm Infections [mh] OR Hookworm OR Ancylostomiasis [mh] OR Necatoriasis [mh] OR Ancylosto* OR Necatoriasis OR necator [mh] OR Necator OR ancylostoma OR Strongyloid*.
La búsqueda en LILACS incluyó las siguientes palabras: "HELMINT$" or "UNCINARIA" or "TRICURIASIS" or "TRICHURI$" or "ASCARI$" or "ANCYLOSTOM$" or "NECATOR$" or "INTESTINAL DISEASES, PARASITIC" or "STRONGY$"
Ambas búsquedas se limitaron a estudios realizados en humanos en la Argentina y publicados entre los años 1980 y 2011, sin restricción de idioma, que informasen prevalencia de al menos uno de los geohelmintos de interés (Ascaris lumbricoides, Trichuris trichiura, uncinarias -Ancylostoma duodenale, Necator americanus- o Strongyloides stercoralis) en una población determinada, sin restricciones de edad.
Se excluyeron los estudios basados en informes de hospitales o clínicas a partir de la demanda espontánea de pacientes sintomáticos. Asimismo se excluyeron los estudios en donde no se informara el denominador sobre el cual se calculó la prevalencia.
En los trabajos en los que se reporta más de un estudio, cada uno de estos fue considerado por separado.
Al menos dos de los tres revisores (ES, AF y AK) evaluaron de manera independiente cada reporte y las discrepancias se resolvieron con una nueva revisión. A partir de ello, se identificaron los estudios elegibles de los cuales se extrajo la siguiente información, que fue incorporada en una hoja de cálculos: autores, año de publicación, lugar y año del estudio o año de publicación (cuando el primero no estuviese disponible), tamaño muestral, características de la población incluida en el estudio, número de muestras, y tipo de test parasitológico realizado detallando el número de individuos parasitados con cada especie de geohelminto. Debido a que los métodos parasitológicos de rutina no suelen distinguir entre ambas especies de uncinarias (A. duodenale, N. americanus), se las consideró de forma global. De existir el dato, también se incluyó el número de individuos parasitados con al menos uno de los cuatro geohelmintos tradicionales (A. lumbricoides, T.trichiura, A. duodenale, N. americanus).
Para disminuir la posibilidad de error en el ingreso de datos, la digitalización de los mismos se realizó por duplicado.
Debido a que en función de uno de los objetivos de este trabajo se espera determinar áreas que requerirían programas de desparasitación con intervención masiva según recomendaciones de la Organización Mundial de Salud17, y a que se observó que ninguno de los estudios incluidos en la revisión presentaba información sobre prevalencia acumulada de geohelmintos, este último dato se estimó siguiendo el modelo desarrollado por Silva y Hall23, utilizando las siguiente ecuación:
PHAT = [H + A + T - (HA) - (AT) - (HT) + (HAT)] ÷ 1.06
Donde PHAT es la prevalencia acumulada de geohelmintos, H es la prevalencia de uncinarias, A la prevalencia de A. lumbricoides, T la prevalencia de T. trichiura y 1.06 un factor utilizado para corregir la sobre-estimación que probablemente resulta de la asociación entre A. lumbricoides y T. trichiura. Para estos cálculos las prevalencias se expresaron como proporciones, pudiendo tomar valores entre 0 y 1.
Para el mapeo de los datos, cada una de las localidades fue geo-referenciada utilizando el software ArcView 3.1 (ESRI, Redlands, CA; EE.UU.). Las estimaciones puntuales de prevalencia de cada uno de los estudios fue categorizada en los siguientes rangos: < 1%, 1-20%, > 20%, 50% y > 50%. Estas categorías se definieron teniendo en cuenta los umbrales utilizados por la OMS para decidir las distintas estrategias de desparasitación17, de manera tal de permitir la comparación con otros trabajos. En los caso donde existiese más de un estudio por localidad a fines del mapeo, se calculó una prevalencia promedio.
Asimismo y para tratar de complementar la información, se decidió incluir también los resultados del mapeo realizado por el Ministerio de Salud de la Nación previo a la implementación del Programa Nacional de Desparasitación entre 2005 y 200724.
El objetivo de este Programa estaba orientado a disminuir en forma sostenida la prevalencia de geohelmintos en la población infantil de 2 a 14 años de áreas afectadas, reduciendo la contaminación del medio ambiente con materias fecales humanas portadoras de huevos o larvas de geohelmintos, especialmente en áreas marginales donde se asientan urbanizaciones que carecen de servicios sanitarios básicos. Su estrategia de intervención estuvo basada en dos ejes: a) el tratamiento medicamentoso masivo reiterado a poblaciones con elevadas tasas de infestación y exposición al riesgo y, b) la promoción de contenidos de educación sanitaria que mejoren la higiene, y medidas de saneamiento ambiental.
Para seleccionar qué departamentos se beneficiarían del tratamiento antihelmíntico masivo bianual con dosis única de mebendazol se realizó un muestreo inicial en áreas con potencial situación de riesgo. En base a los datos basales del PNDM ("Chau lombriz"), se utilizaron los de las jurisdicciones con la información requerida para esta revisión.
Resultados
La búsqueda inicial arrojó 310 artículos, de los cuales 281 fueron excluidos en la revisión inicial por no cumplir con los criterios de inclusión definidos para esta revisión. De los 29 artículos potencialmente elegibles, se excluyeron otros 5 por contar con información duplicada (4), o ausencia de denominador (1) (Fig. 1). Así, finalmente se incluyeron y evaluaron 24 artículos10, 25-47 que tenían información de 26 relevamientos diferentes, realizados en 8 provincias entre los años 199327, 43 y 201147. El número total de individuos evaluados fue de 5495 (Tabla 1).
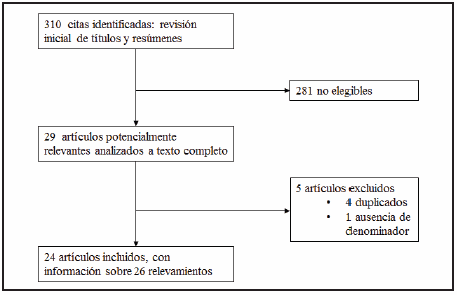
Fig. 1.- Diagrama de flujo de estudios incluidos
TABLA 1.- Características y prevalencia de geohelmintiasis en los estudios analizados para la revisión sistemática.

AL: Ascaris lumbricoides; UN: uncinarias; TT: Trichuris trichiura; SS: Strongyloides stercoralis; ...: sin datos; CABA: Ciudad Autónoma de Buenos Aires; Todos: todas las edades
En su mayor parte, los estudios incluidos correspondían a la provincia de Buenos Aires (n = 11), en particular al Partido de La Plata (n = 5), la provincia de Misiones (n = 4) y Salta (n = 4). En 12 relevamientos26, 27, 29-31, 35, 38, 42, 43, 45-47 se evaluaron niños, en uno36 adultos; en otros 1210, 25, 28, 32-34, 37, 40-41, 44, tanto niños como adolescentes y adultos, mientras que en un estudio no hay información sobre grupo etario evaluado39. El número de individuos evaluados varió entre 3643 y 52240. En la mayoría de los estudios se evaluó más de una muestra por individuo (n = 19) y se utilizó más de una técnica coproparasitológica (n = 22), con una marcada heterogeneidad en los métodos elegidos.
La prevalencia de cada geohelminto varió ampliamente, de acuerdo al tipo de población y área geográfica del estudio. Así, el rango de prevalencias de A. lumbricoides varió entre 0 y 67%; el de uncinarias (N. americanus y/o A. duodenale) entre 0 y 90%; el de T. trichiura entre 0 y 24.5%; y el de S. stercoralis entre 0 y 83%.
Ninguno de los estudios incluidos informa la prevalencia acumulada de los 4 geohelmintos principales (A. lumbricoides, N. americanus, A. duodenalis y T. trichiura), por lo que para estimar este valor se utilizó la fórmula que se detalla en la sección de Materiales y Métodos 23.
Como parte de la validación de este cálculo se realizó un análisis con los datos de prevalencia basal de un programa de desparasitación masiva realizado en Orán, Salta, durante 2010-201148. La prevalencia acumulada de geohelmintiasis observada en este estudio fue del 17.5%; siendo las prevalencias individuales las siguientes: A. lumbricoides: 8.6%, uncinarias: 9% y T. trichiura: 2.3%. Utilizando la fórmula desarrollada por Silva y Hall, la prevalencia acumulada predicha es de 17.7%, sin diferencias estadísticamente significativas con la observada.
Así, al igual que la prevalencia individual de cada geohelminto, el rango de la prevalencia acumulada varió ampliamente entre 0.8 y 88.6% (Tabla 1). Trece estudios tenían una prevalencia estimada de geohelmintiasis mayor al 20%, correspondiendo 5 estudios a prevalencias entre 20 y 50% y 8 a prevalencias mayores al 50% (Fig. 2). Es de destacar que todos los estudios incluidos en esta revisión, realizados en las provincias de Salta, Misiones y Santa Fe reportan valores de prevalencias de geohelmintiasis mayores al 20%, lo que justificaría la implementación en estas áreas de campañas de desparasitación masiva con una frecuencia por lo menos anual.

Fig. 2.- Prevalencia acumulada estimada de geohelmintiasis en la Argentina
En base a los datos basales del Programa Nacional de Desparasitación Masiva (PNDM)24, se incluyó información correspondiente a 1943 niños de 12 provincias (Tabla 2). Debido a que la cantidad de niños evaluados en cada localidad era poca, se decidió reportar la prevalencia agrupada por provincia, excepto cuando el tamaño muestral de la jurisdicción evaluada fuese mayor a 50 niños, como ocurre en algunos municipios de la Provincia de Buenos Aires.
TABLA 2.- Prevalencia basal del Programa Nacional de Desparasitación Masiva (2005-2007), N = 1943 niños de 12 provincias
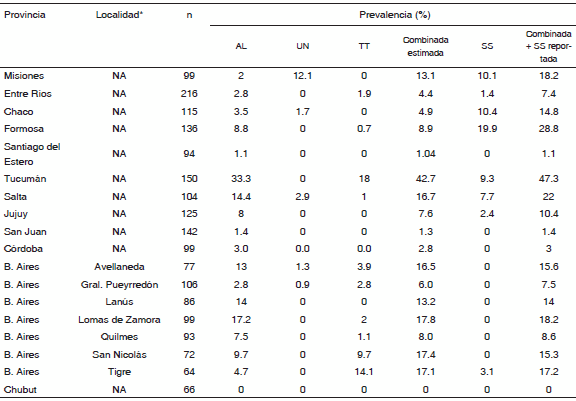
AL: Ascaris lumbricoides; UN: uncinarias; TT: Trichuris trichiura; SS: Strongyloides stercoralis; NA: no aplica
*Para aquellas provincias donde el número de niños evaluados por localidad fue menor a 50, se reporta la prevalencia agrupada por provincia
En todos los casos, la población estudiada fueron niños de entre 2 y 14 años y los valores de prevalencia reportados corresponden a la prevalencia acumulada de geohelmintos y S. stercoralis, los cuales alcanzaron valores que variaron entre 0 y 47%. Las provincias con valores mayores al 20% fueron Salta (22%), Formosa (28.8%) y Tucumán (47.3%). Es de destacar que los valores de las provincias de Salta y Formosa están altamente influenciados por la alta prevalencia de S. stercoralis (7.7% y 19.9%, respectivamente). Cuando se aplica la fórmula para estimar prevalencia acumulada de geohelmintos (excluyendo S. stercoralis), previamente explicada, la única provincia que persiste con valores mayores al 20% es Tucumán.
Discusión
Este estudio, diseñado como una revisión sistemática, resume y analiza toda la información publicada a partir del año 1980 respecto a la prevalencia y distribución de geohelmintiasis en la República Argentina, utilizando criterios de selección que restringen el cálculo de estas variables a relevamientos poblacionales. Hasta donde nosotros sabemos, esta es la primera revisión sistemática de geohelmintiasis en la Argentina que se publica, y sus resultados evidencian la escasez de datos y la existencia de grandes segmentos territoriales y poblacionales sin estudios de prevalencia.
La limitada información se engloba dentro de la situación existente en América Latina sobre las Enfermedades Tropicales Olvidadas, a las que las geohelmintiasis pertenecen49. La disparidad encontrada en la prevalencia de las distintas especies de geohelmintos es probablemente multifactorial, relacionada con la amplia variabilidad de condiciones socioeconómicas, sanitarias y ambientales presentes en el país. La Argentina forma parte de la región que, si bien no tiene los índices más altos de pobreza, sí presenta los más altos índices de desigualdad50.
Históricamente, las geohelmintiasis se han considerado endémicas en las zonas del norte del país, donde se encuentran las condiciones climáticas y socioambientales que favorecen la perpetuación de estas infecciones. Los hallazgos de esta revisión confirman esta situación, pero también muestran focos de alta prevalencia en el centro del país (Provincias de Buenos Aires y Santa Fe).
La distribución relativa de las distintas especies de geohelmintos muestra una baja prevalencia de T. trichiura, con focos de alta prevalencia solo en Tucumán (18%) y en los partidos de Tigre (14.1%) y San Nicolás (9.7%), ambos en el norte de la Provincia de Buenos Aires, de acuerdo al PNDP, en Salta (Tartagal, 15.8%) y Santa Fe (Santa Fe, 24.5%)26, 44. T. trichiura tiene una baja susceptibilidad a los 4 antihelmínticos listados por la Organización Mundial de la Salud (OMS) como drogas esenciales9, cuando se utilizan en monodosis, habiéndose obtenido una eficacia superior mediante el uso combinado de mebendazol o albendazol junto a ivermectina51. La infección por esta especie presenta manifestaciones sutiles de morbilidad tales como inapetencia y déficits en crecimiento y desarrollo cognitivo8.
Las tasas de prevalencia de A. lumbricoides en ningún caso superaron el 50%, y valores entre el 10 y 50% se distribuyeron en áreas del norte y centro del país.
En el caso de las uncinarias, los focos de alta prevalencia (> 20%) se limitaron al norte del país. Esto tiene importancia para elegir un benzimidazol para los tratamientos masivos. Varios estudios han llamado la atención sobre la falta de eficacia de mebendazol monodosis para el tratamiento de uncinarias52-53. Un meta-análisis reciente donde se evaluó la actividad de distintos antihelmínticos en monodosis frente a geohelmintos, encontró que para las infecciones por uncinarias, albendazol es la droga más efectiva con una tasa de cura de 72% (vs. solo 15% para mebendazol)9.
La identificación de Strongyloides stercoralis en diversas áreas del país con focos de alta prevalencia en Misiones, Chaco y Formosa en la región noreste y Salta en el noroeste, alerta acerca de la necesidad de un ajuste en las estrategias de diagnóstico y tratamiento para el control de las geohelmintiasis a través de programas de desparasitación. Esto se debe a la sensibilidad prácticamente nula para S. stercoralis (que se elimina en materia fecal en su estadio larvario) de técnicas parasitológicas basadas en el diagnóstico de huevos, como las de Mc Master, FLOTAC o la técnica de Kato-Katz recomendada por las guías de la OMS16. Este helminto es además resistente al mebendazol (medicamento que fuera utilizado en el Programa Nacional de Desparasitación cuyos datos aquí se resumen) y de muy baja susceptibilidad al albendazol, siendo la ivermectina o alternativamente el tiabendazol las medicaciones indicadas para su tratamiento.
Entre las limitaciones más significativas de este trabajo se encuentra el relativamente bajo número de individuos incluidos (8000) en los trabajos publicados y una selección de localidades con una representatividad desproporcionada respecto de su tamaño poblacional en el contexto del país, lo que impide extrapolar estos resultados a áreas no relevadas. Las zonas relevadas se relacionan con trabajos de campo de grupos académicos con entrenamiento en el diseño experimental y hábito de publicar sus resultados. Otra limitación es la carencia de datos de carga parasitaria obtenidos con técnicas que cuantifican huevos por gramo de materia fecal. Sin embargo, estas estimaciones son de importancia para la determinación del riesgo de morbilidad, impacto de intervenciones y epidemiología de estas infecciones13. Las mediciones de carga parasitaria han demostrado ser más representativas de la epidemiología y morbilidad de estas parasitosis que la prevalencia general poblacional, en trabajos con uncinarias y A. lumbricoides14, 54.
La situación actual de la Argentina con una población, según el censo del año 2010, de 40 millones de habitantes, de los cuales el 25.5% son menores de 15 años y presentando según datos del mismo censo un 17% de hogares sin agua de red y el 51% sin red cloacal, con una variabilidad interprovincial de entre el 2.1% al 83%, subrayan la necesidad de diseñar estrategias que apunten al relevamiento de las poblaciones en riesgo y la intervención y monitoreo de aquellos grupos en los que se constate la presencia de estas parasitosis; para su control y eventual eliminación. Las condiciones de vivienda e infraestructura demuestran también la posibilidad de intervenciones en áreas que complementan las desparasitaciones, tales como ampliación de la red cloacal y provisión de agua de red, las cuales han demostrado un impacto positivo en otras regiones55-56.
La utilización de un modelo para la estimación de la prevalencia combinada de geohelmintos (a excepción de S. stercoralis) demostró ser adecuada para el cálculo de este indicador, a través de su validación mediante una comprobación empírica con datos de estudios locales que cuentan con esta información. Es de destacar, sin embargo, que la mayoría de los trabajos analizados no reportan la tasa de prevalencia acumulada de geohelmintos, a pesar de ser este valor el criterio que utiliza la OMS para el abordaje de las desparasitaciones por campañas comunitarias17.
En conclusión, la Argentina se encuentra entre los países de Latinoamérica endémicos para geohelmintiasis, las cuales se distribuyen de manera heterogénea y con grados variables de prevalencia. La realización de relevamientos sistemáticos con datos discriminados al nivel municipal y con información de especies prevalentes y carga parasitaria, permitirán un mapeo más adecuado de la situación real de estas Enfermedades Tropicales Olvidadas, para una planificación ordenada y racional de las intervenciones, su monitoreo y medición de impacto.
Conflictos de interés: Ninguno para declarar.
1. Adedayo O, Nasiiro R. Intestinal parasitoses. J Natl Med Assoc 2004; 96: 93-6. [ Links ]
2. Montresor A, Crompton D, Hall A, Bundy D, Savioli L. Guidelines for the evaluation of soil-transmitted helminthiasis and schistosomiasis at community level. WHO/CDS/CPC/SIP/99.3 En: http://whqlibdoc.who.int/HQ/1998/WHO_CTD_SIP_98.1.pdf. Geneva: World Health Organization;1998. [ Links ]
3. Bethony J, Brooker S, Albonico M, et al. Soil-transmitted helminth infections: ascariasis, trichuriasis, and hookworm. Lancet 2006; 367: 1521-32. [ Links ]
4. Botero D, Restrepo M. Parasitosis Intestinales por Nematodos. Parasitosis Humanas. 3a ed. Medellín: Corporación para Investigaciones Biológicas; 1998: 89-134. [ Links ]
5. Baird S, Kremer M, Hicks JH, Miguel E. Worms at Work: Long-run Impacts of Child Health Gains, 2011.En: http://www.dewormtheworld.org/sites/default/files/pdf/Baird%20-%20Worms%20at%20Work.pdf [ Links ]
6. Bleakley H. Disease and development: evidence from hookworm eradication in American South. J European Econ Assoc 2003; 1: 376-86. [ Links ]
7. Miguel EA, Kremer M. Worms: identifying impacts on education and health in the presence of treatment externalities. Econometrica 2003; 72: 159-217. [ Links ]
8. Crompton DWT, Nesheim MC. Nutritional impact of intestinal helminthiasis during the human life cycle. Ann Rev Nutr 2002; 22: 35-59. [ Links ]
9. Keiser J, Utzinger J. Efficacy of current drugs against soil-transmitted helminth infections: systematic review and meta-analysis. JAMA 2008; 299: 1937-48. [ Links ]
10. Navone GT, Gamboa MI, Oyhenart EE, Orden AB. Intestinal parasitosis in Mbya-Guarani populations from Misiones Province, Argentina: epidemiological and nutritional aspects. Cad Saude Publica 2006; 22: 1089-100. [ Links ]
11. OPS/OMS. Helmintiasis intestinales. Manejo de las geohelmintiasis. Departamento de Parasitología y Micología, DIGESA/MSP,OPS/OMS; 2003. [ Links ]
12. Sorensen E, Ismail M, Amarasinghe DK, Hettiarachchi I, Dassenaieke TS. The effect of the availability of latrines on soil-transmitted nematode infections in the plantation sector in Sri Lanka. Am J Trop Med Hyg 1994; 51: 36-9. [ Links ]
13. Anderson RM. The population dynamics and epidemiology of intestinal nematode infections. Transactions of the Royal Society of Tropical Medicine and Hygiene 1986; 80: 686-96. [ Links ]
14. Pullan RL, Kabatereine NB, Quinnell RJ, Brooker S. Spatial and genetic epidemiology of hookworm in a rural community in Uganda. PLoS Negl Trop Dis 4: e713. [ Links ]
15. Nock IH, Aken'ova T, Galadima M. Deworming: adding public health education to the equation. Trends in parasitology 2006; 22: 7-8. [ Links ]
16. WHO. Controlling disease due to helminth infections. Geneva: World Health Organization; 2003. [ Links ]
17. WHO. Preventive Chemotherapy in Human Helminthiasis: Coordinated Use of Anthelminthic Drugs in Control Interventions. A Manual for Health Professionals and Programme Managers. Geneva: World Health Organization; 2006. [ Links ]
18. WHO. Deworming for health and development. Report of the third global meeting of the partners for parasite control. Geneva: World Health Organization; 2005. [ Links ]
19. OPS/OMS. Marco de referencia de un programa regional para el control de las geohelmintosis y esquistosomosis en América. Santo Domingo: OPS; 2-6 Junio 2003 2003. En: http://www1.paho.org/Spanish/AD/DPC/CD/psit-marco-ref.pdf [ Links ]
20. PAHO. Epidemiological Profiles for Neglected Diseases and Other Infections Related to Poverty in Latin America and the Caribbean. Pan American Health Organization; 2009. [ Links ]
21. Saboyá M, Catalá L, Ault S, Nicholls R. Prevalence and intensity of infection of Soil-transmitted Helminths in Latin America and the Caribbean Countries: Mapping at second administrative level 2000-2010. Washington D.C.: Pan American Health Organization; 2011. [ Links ]
22. Moher D, Liberati A, Tetzlaff J, Altman DG. Preferred reporting items for systematic reviews and meta-analyses: the PRISMA statement. PLoS Med 2009;6: e1000097. [ Links ]
23. de Silva N, Hall A. Using the prevalence of individual species of intestinal nematode worms to estimate the combined prevalence of any species. PLoS neglected tropical diseases 2010; 4: e655. [ Links ]
24. PROAPS - REMEDIAR. Geohelmintiosis en la República Argentina. Programa Nacional de Desparacitación Masiva. Ciudad de Buenos Aires: Ministerio de Salud de la Nación; 2007. [ Links ]
25. Basualdo JA, Cordoba MA, de Luca MM, et al. Intestinal parasitoses and environmental factors in a rural population of Argentina, 2002-2003. Rev Inst Med Trop Sao Paulo 2007; 49: 251-5. [ Links ]
26. Beltramino D, Lura MC, Carrera E. El tratamiento antihelmíntico selectivo frente al tratamiento masivo. Experiencia en dos comunidades hiperendémicas. Revista panamericana de salud publica / Pan American journal of public health 2003; 13: 10-8. [ Links ]
27. Borda CE, Rea MJ, Rosa JR, Maidana C. Intestinal parasitism in San Cayetano, Corrientes, Argentina. Bull Pan Am Health Organ 1996; 30: 227-33. [ Links ]
28. Chamorro M, Stein M. Estudio enteroparasitológico y su relación con variables epidemiológicas. Bol Inst Med Reg 1996; 17/19: 23-7. [ Links ]
29. Costamagna S, Torno Cafasso O, García S, Visciarelli E, Osorio J, Santamaria B. Enteroparasites in children living in rural areas at the Partido de Carmen de Patagones: province of Buenos. Parasitol día 1999; 23: 48-52. [ Links ]
30. Costamanga S, García S, Visciarelli E, Casas N. Epidemiology of the parasitosis in Bahía Blanca, province of Buenos Aires, Argentina 1994-1999. Parasitol latinoam 2002; 57: 103-10. [ Links ]
31. Gamboa MI, Basualdo JA, Kozubsky L, Costas E, Cueto Rua E, Lahitte HB. Prevalence of intestinal parasitosis within three population groups in La Plata, Argentina. Eur J Epidemiol 1998; 14: 55-61. [ Links ]
32. Gamboa MI, Kozubsky LE, Costas ME, et al. Associations between geohelminths and socioenvironmental conditions among different human populations in Argentina. Revista panamericana de salud publica/Pan American journal of public health 2009; 26: 1-8. [ Links ]
33. Guignard S, Arienti H, Freyre L, Lujan H, Rubinstein H. Prevalence of enteroparasites in a residence for children in the Cordoba Province, Argentina. Eur J Epidemiol 2000; 16: 287-93. [ Links ]
34. Krolewiecki AJ, Ramanathan R, Fink V, et al. Improved diagnosis of Strongyloides stercoralis using recombinant antigen-based serologies in a community-wide study in northern Argentina. Clin Vaccine Immunol 2010; 17: 1624-30. [ Links ]
35. Lura MC, Beltramino DM, de Carrera EF. Prevalencia de helmintiosis intestinales en escolares de la ciudad de Santa Fe. Medicina (B Aires) 2002; 62: 29-36. [ Links ]
36. Méndez OC, Szmulewicz G, Menghi C, Torres S, González G, Gatta C. Comparación de índices de infestaciones por enteroparásitos entre poblaciones HIV positivas y negativas. Medicina (B Aires) 1994; 54: 307-10. [ Links ]
37. Menghi CI, Iuvaro FR, Dellacasa MA, Gatta CL. Investigación de parásitos intestinales en una comunidad aborigen de la Provincia de Salta. Medicina (B Aires) 2007; 67: 705-8. [ Links ]
38. Milano AM, Oscherov EB, Palladino AC, Bar AR. Enteroparasitosis infantil en un área urbana del nordeste Argentino. Medicina (B Aires) 2007; 67: 238-42. [ Links ]
39. Navone G, Gamboa M, Kozubsky L, et al. Comparative study of parasitic forms recuperation using three different coproparasitoscopic methods. Parasitol latinoam 2005; 60: 178-81. [ Links ]
40. Pezzani BC, Minvielle MC, Ciarmela ML, Apezteguia MC, Basualdo JA. Participación comunitaria en el control de las parasitosis intestinales en una localidad rural de Argentina. Revista panamericana de salud publica / Pan American journal of public health 2009; 26: 471-7. [ Links ]
41. Pezzani BC, Minvielle MC, De Luca MM, Radman N, Iacoy P, Basualdo Farjat JA. Estudio de las infecciones por enteroparasitos en una comunidad periurbana de la provincia de Buenos Aires, Argentina. Bol Chil Parasitol 1996; 51: 42-5. [ Links ]
42. Soriano S, Silvia V, Manacorda A, et al. Intestinal parasitosis in relation to socioeconomic factors and habitat conditions in children of Neuquen, Patagonia, Argentina. Parasitol latinoam 2005; 60: 154-61. [ Links ]
43. Taranto NJ, Bonomi de Filippi H, Orione O. Prevalencia de la infeccion por Strongyloides stercoralis en la primera infancia. Orán, Salta, Argentina. Bol Chil Parasitol 1993; 48: 49-51. [ Links ]
44. Taranto NJ, Cajal SP, De Marzi MC, et al. Clinical status and parasitic infection in a Wichi Aboriginal community in Salta, Argentina. Transactions of the Royal Society of Tropical Medicine and Hygiene 2003; 97: 554-8. [ Links ]
45. Zonta M, Navone G, Oyhenart E. Intestinal parasites in preschool and school age children: current situation in urban, periurban and rural populations in Brandsen, Buenos Aires, Argentina. Parasitol Latinoam 2007; 62: 54-60. [ Links ]
46. Zonta ML, Oyhenart EE, Navone GT. Nutritional status, body composition, and intestinal parasitism among the Mbya-Guarani communities of Misiones, Argentina. Am J Hum Biol 2010; 22: 193-200. [ Links ]
47. Gamboa MI, Navone GT, Orden AB, Torres MF, Castro LE, Oyhenart EE. Socio-environmental conditions, intestinal parasitic infections and nutritional status in children from a suburban neighborhood of La Plata, Argentina. Acta Trop 2011. [ Links ]
48. Krolewiecki A, Socías E, Cajal S, et al. Mass drug administration for helminths with albendazole and ivermectin in an area endemic for Strongyloides stercoralis. Am J Trop Med Hyg 2011; 85: 475. [ Links ]
49. Ault SK, Nicholls RS, Saboya MI. The Pan American Health Organization's role and perspectives on the mapping and modeling of the neglected tropical diseases in Latin America and the Caribbean: an overview. Geospatial health 2012; 6: S7-S9. [ Links ]
50. Hotez PJ, Bottazzi ME, Franco-Paredes C, Ault SK, Periago MR. The neglected tropical diseases of Latin America and the Caribbean: a review of disease burden and distribution and a roadmap for control and elimination. PLoS neglected tropical diseases 2008; 2: e300. [ Links ]
51. Knopp S, Mohammed KA, Speich B, et al. Albendazole and mebendazole administered alone or in combination with ivermectin against Trichuris trichiura: a randomized controlled trial. Clin Infect Dis 2010; 51: 1420-8. [ Links ]
52. Albonico M, Bickle Q, Ramsan M, Montresor A, Savioli L, Taylor M. Efficacy of mebendazole and levamisole alone or in combination against intestinal nematode infections after repeated targeted mebendazole treatment in Zanzibar. Bull World Health Organ 2003; 81: 343-52. [ Links ]
53. Flohr C, Tuyen LN, Lewis S, et al. Low efficacy of mebendazole against hookworm in Vietnam: two randomized controlled trials. Am J Trop Med Hyg 2007; 76: 732-6. [ Links ]
54. Thein H, Thane T, Than S, Myat Lay K, Myint L. A controlled chemotherapeutic intervention trial on the relationship between Ascaris lumbricoides infection and malnutrition in children. Transactions of the Royal Society of Tropical Medicine and Hygiene 1991; 85: 523-8. [ Links ]
55. Conteh L, Engels T, Molyneux DH. Socioeconomic aspects of neglected tropical diseases. Lancet 375: 239-47. [ Links ]
56. Kasai T, Nakatani H, Takeuchi T, Crump A. Research and control of parasitic diseases in Japan: current position and future perspectives. Trends in parasitology 2007; 23: 230-5. [ Links ]
Recibido: 19-VI-2013
Aceptado: 15-VIII-2013














