Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Medicina (Buenos Aires)
versión impresa ISSN 0025-7680
Medicina (B. Aires) vol.74 no.3 Ciudad Autónoma de Buenos Aires jun. 2014
ARTÍCULO ESPECIAL
Papel de las mitocondrias y el estrés oxidativo en el proceso inflamatorio renal
Walter Manucha
Área de Farmacología, Departamento de Patología, Facultad de Ciencias Médicas. Universidad Nacional de Cuyo, Mendoza, Argentina
Dirección postal: Dr. Walter Manucha, Área de Farmacología, Departamento de Patología, Facultad de Ciencias Médicas, Universidad Nacional de Cuyo, Centro Universitario, 5500 Mendoza, Argentina
Fax: (54-261) 4287370 e-mail: wmanucha@yahoo.com.ar
Resumen
La muerte celular programada y la fibrosis renal son procesos inherentes a la enfermedad renal crónica y, en tal sentido, ha sido recientemente descripta una clara desregulación de la maquinaria respiratoria mitocondrial en pacientes con enfermedad renal crónica asociada con un aumento del estrés oxidativo. Las células tubulares lesionadas vinculadas a los macrófagos intersticiales y miofibroblastos producen citoquinas y factores de crecimiento que promueven un estado inflamatorio, inducen la apoptosis de las células tubulares y facilitan la acumulación de matriz extracelular. La angiotensina II desempeña un papel central en la fibrogénesis renal y conduce a una rápida progresión de la enfermedad renal crónica. Los niveles crecientes de la angiotensina II inducen citoquinas pro-inflamatorias, la activación de NF-kB, moléculas de adhesión, quimiocinas, factores de crecimiento y estrés oxidativo. Toda la evidencia actual sugiere que la angiotensina II aumenta el estrés oxidativo mitocondrial, regula la inducción de apoptosis y condiciona al estado inflamatorio. Por lo tanto, existiría un papel determinante de las mitocondrias y el estrés oxidativo en el proceso inflamatorio renal. Finalmente, esta revisión resume nuestro actual conocimiento acerca de los posibles mecanismos que contribuirían con la apoptosis modulada por la inflamación y/o el estrés oxidativo durante la enfermedad renal crónica. Además, se propone un nuevo concepto de herramientas anti-inflamatorias que regulan el estrés oxidativo mitocondrial lo cual afectaría directamente al proceso inflamatorio y la apoptosis. Esta idea podría tener consecuencias atractivas sobre el tratamiento de patologías inflamatorias renales y de otras afines.
Palabras clave: Mitocondria; Estrés oxidativo; Enfermedad renal crónica; Angiotensina; Óxido nítrico; Proceso renal inflamatorio
Abstract
Mitochondria and oxidative stress participation in renal inflammatory process. The apoptosis and renal fibrosis are processes inherent to the chronic kidney disease, and consequently a clear deregulation of the mitochondrial respiratory mechanism has been described in patients with chronic renal disease associated to an increase of the oxidative stress. The injured tubular cells linked to the interstitial macrophages and myofibroblasts produce cytokines and growth factors that encourage an inflammatory condition, inducing the apoptosis of the tubular cells and enabling the accumulation of the extracellular matrix. The angiotensin II has a central role in the renal fibrogenesis leading to a rapid progression of the chronic kidney disease. The growing levels of the angiotensin II induce pro-inflammatory cytokines, the activation of NF-kB, adhesion molecules,chemokines, growth factors, and oxidative stress. The current evidence suggests that the angiotensin II increases the mitochondrial oxidative stress, regulates the induction of the apoptosis and conditions the inflammatory process. Therefore the mitochondria and the oxidative stress would play a determinant role in the renal inflammatory process. Finally, this review summarizes our present knowledge regarding the possible mechanisms that would contribute to the apoptosis conditioned by inflammation and/or oxidative stress during the chronic renal disease. Additionally, a new concept of the anti-inflammatory tools is proposed to regulate the mitochondrial oxidative stress that would directly affect the inflammatory process and apoptosis. This concept could have positive consequences on the treatment of renal inflammatory pathologies and related diseases.
Key words: Mitochondria; Oxidative stress; Chronic kidney disease; Angiotensin; Nitric oxide; Renal inflammatory process
En la actualidad es ampliamente reconocida la estrecha relación entre apoptosis y la mitocondria, pero la historia se remonta a trabajos originales como el de Newmeyer y col.1, donde se sugiere por primera vez una relación estrecha entre las mitocondrias y el proceso apoptótico. Recientemente, ha sido descripta una clara desregulación de la maquinaria respiratoria mitocondrial en pacientes con enfermedad renal crónica (ERC) asociada con un aumento del estrés oxidativo2. Además, el estrés oxidativo mitocondrial y la expresión de genes inflamatorios son modulados por la angiotensina II. Así, la alteración de los receptores AT1 promueve la longevidad en ratones, posiblemente a través de la atenuación del estrés oxidativo y la sobre expresión de genes de supervivencia, lo que sugiere que la vía de los receptores de angiotensina II/AT1 puede estar dirigida a influir sobre duración de la vida en los mamíferos. La reducción del estrés oxidativo y la regulación de genes NAMP (nicotinamidephosphorybosiltransferase) y SIRT3 (Sirtuin 3) de supervivencia, condicionarían un menor daño mitocondrial3. El bloqueo de la angiotensina II se propuso como estrategia para frenar el envejecimiento mediante la protección de las mitocondrias. Dicho bloqueo reduce las especies reactivas del oxígeno (ERO) a nivel mitocondrial y aumenta el contenido y la función mitocondrial. Por otra parte, el bloqueo del sistema renina angiotensina aldosterona (SRAA) muestra una serie de efectos convergentes, es decir, retrasa las manifestaciones de la hipertensión, la diabetes, nefropatía, reduce la sensibilidad a la insulina; reduce la oxidación del ADN y la producción de H2O2 mitocondrial y aumenta la disociación de la proteína-2 y sirtuina. La superposición de estos efectos implica cambios en la función mitocondrial4. Además, los receptores activados por el proliferador de peroxisomas (PPARs) parecen contribuir al retraso del envejecimiento, en parte mediante la regulación de la función mitocondrial. La inhibición del SRAA modula también los PPARs; por esa razón es factible que la modulación de PPAR resulte fundamental para la protección mitocondrial por bloqueo del SRAA durante el envejecimiento4. Otros mecanismos potenciales que pueden ser la base de los beneficios mitocondriales como consecuencia del bloqueo del SRAA son la baja expresión de TGF-β1 y la regulación de Klotho (una proteína de membrana tipo I) y sirtuinas4. En particular, al estado inflamatorio durante el envejecimiento se lo refiere como inflammaging y se caracteriza por un origen inflamatorio de envejecimiento dado por la activación de los sistemas celulares responsables de la promoción y la supresión de genes como el NF-kB, las sirtuinas, ForkheadBox O y KLOTHO, que están involucrados directa o indirectamente en los mecanismos celulares de resistencia a estrés oxidativo, la apoptosis y reparación de errores de transcripción de los ácidos nucleicos5. El gen KLOTHO se identificó por primera vez como un gen putativo supresor de envejecimiento y codificante de una proteína trans-membrana, que está expresado predominantemente en el riñón, y donde funciona como un correceptor obligado para el factor de crecimiento de fibroblastos 23 (FGF-23). FGF-23 es una hormona derivada del hueso que suprime la reabsorción del fosfato y la síntesis renal de 1,25 dihidroxivitamina D3 (vitamina D). Además, los niveles de proteína Klotho se han identificado como uno de los primeros biomarcadores de la progresión de la ERC6. Por otro lado, la sirtuina 1 es una desacetilasa dependiente de NAD+ que ejerce efectos pleiotrópicos sobre el metabolismo oxidativo. La baja expresión de sirtuina 1 en células renales medulares intersticiales provenientes de ratón, redujo sustancialmente la resistencia celular al estrés oxidativo, mientras que la activación farmacológica por resveratrol condicionó una mayor supervivencia celular en respuesta al estrés oxidativo. En la obstrucción ureteral unilateral (OUU), sirtuina 1 ha demostrado ser un factor de protección importante para las células renales medulares intersticiales frente al estrés oxidativo. Esta función protectora de sirtuina 1 es en parte atribuible a la regulación de la ciclooxigenasa tipo 2 (COX-2)7.
La estrecha relación entre la inflamación y las enfermedades que se caracterizan por el envejecimiento acelerado de los órganos, entre ellas la ERC, puede ser explicada en parte desde que las citoquinas inflamatorias como TNF-α son inductores débiles de la apoptosis y además TNF-α regula una menor expresión de Klotho a través de un mecanismo dependiente de NF-κB8. La inhibición de NF-κB, reducción de la respuesta inflamatoria y del estrés oxidativo estarían involucrados en los efectos beneficiosos de la sulfasalazina durante OUU9.
Un trabajo reciente demostró que la inhibición de la producción de ERO en las mitocondrias, sumado a una reducción de la peroxidación de lípidos en el suero, podrían condicionar un retraso en la progresión de la ERC10. Cambios estructurales mitocondriales se demostraron en la atrofia tubular proximal durante la nefropatía obstructiva crónica11. En estrecha relación, hallazgos de nuestro laboratorio con microscopía electrónica demostraron un aumento de tamaño y contenido (crestas dilatadas) y espacios más grandes de lo normal en el interior de las mitocondrias (Fig. 1). Estos cambios ultra estructurales morfológicos se han asociado con la expresión del receptor AT1 en fracciones mitocondriales de corteza renal proveniente de ratas sometidas durante 15 días a OUU (losdatos histológicos confirman la expresión molecular de las inducciones apoptótica y/o fibrótica) (Fig. 2)12. Además, establecimos una mayor actividad de la enzima NADPH oxidasa relacionada con la expresión de la isoforma predominante en riñón, NOX4. Anteriormente, de Cavanaghy col. demostraron una mejora de la función mitocondrial relacionada con el bloqueo del SRAA y menor estrés oxidativo13-16. En este sentido, Ferdery col. sugirieron que NF-κB y la activación de la enzima NADPH oxidasa serían pasos fundamentales en estos mecanismos pro-inflamatorios, en los que el estrés oxidativo intra-mitocondrial de tejido renal podría desempeñar un papel crítico17. Por su parte, Felsen y col. han desarrollado recientemente una serie de péptidos que se concentran en la membrana mitocondrial interna y parecen prevenir la muerte celular. Estos péptidos antioxidantes intra-mitocondriales protegerían in vitro la mitocondria, disminuyendo el estrés oxidativo y regulando negativamente las vías de señalización NF-kB y p38 MAPK. Estos péptidos podrían proporcionar protección contra el daño renal en un modelo de ERC como la OUU18. Por el contrario, Omi/HtrA2 (Omi), una serinoproteasa mitocondrial pro-apoptótica, desempeñaría una función crucial en la fibrosis túbulo-intersticial asociada a la enfermedad por OUU. Por lo tanto, la inhibición de Omi atenuaría las características fibróticas en el riñón, como la atrofia y la dilatación de los túbulos, la expansión del intersticio, y el aumento de la expresión de colágenos, actina alfa del músculo liso y fibronectina19.

Fig. 1.- Microscopía electrónica de la corteza renal obstruida unilateralmente por 15 días. Efecto de paricalcitol. Las Fgs. A y B corresponden a riñón tratado con paricalcitol mientras que las C y D corresponden a los no tratados. Las áreas delimitadas por cuadrados en A y C se magnifican en la columna de la derecha (B y D, respectivamente). Material nuclear (n, Fig. C) aparece luminiscente, y las mitocondrias están presentes con crestas mitocondriales dilatadas (flechas, D) en los túbulos no tratados. A: 8000X B: 60 000X; C: 10 000X; D: 72 000X, E y F: 3000X. L: lumen; m: mitocondrias; mv: microvellosidades; bm: membrana basal.
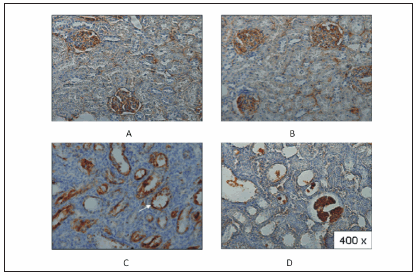
Fig. 2.- Secciones histológicas de las cortezas de los riñones después de la obstrucción unilateral por 15 días. Efecto citoprotector de paricalcitol. Técnica de TUNEL. Núcleos apoptóticos aparecen con color marrón en las células epiteliales del túbulo (flechas). Corteza renal control no tratada (A) y control tratada con paricalcitol(B). Aquí se visualizan escasamente células apoptóticas. Corteza renal obstruida (C), donde los núcleos apoptóticos aparecen fuertemente marcados. Por otro lado, hay un decremento significativo de células apoptóticas en las cortezas renales obstruidas de ratas tratadas con paricalcitol (D).
El estado actual de conocimientos nos permite sugerir como línea de razonamiento al daño mitocondrial como un componente clave del daño renal asociado con nefropatía obstructiva11 y por lo tanto a la enfermedad renal crónica20. En tal sentido, hemos informado sobre mecanismos de inducción e inhibición de apoptosis en las células epiteliales de los túbulos renales. Aquí determinamos que la sintasa de óxido nítrico endotelial (eNOS) estaría asociada con la expresión de Hsp70 y ambas condicionarían resistencia al estrés oxidativo y la muerte celular durante la OUU neonatal y como consecuencia del uso de rosuvastatina21. Esto es particularmente interesante, ya que la protección renal se ha relacionado con efectos pleiotrópicosde las estatinas, que incluyen la regulación de la eNOS y Hsp7022, 23. Por lo tanto, la disminución del óxido nítrico endógeno y una menor expresión de eNOS asociado con la baja expresión de Hsf 1 y Hsp70, se han caracterizado como eventos fisiopatogénicos en la corteza renal obstruida. También hemos definido un aumento de la actividad NADHP oxidasa e inducción de la apoptosis, regulada por la vía de señalización mitocondrial a través de una mayor relación Bax/BcL2(pro-apoptótica) y mayor actividad de caspasa 3. Sin embargo, existen algunas controversias sobre el papel que relaciona Hsp70 y óxido nítrico vinculados al proceso inflamatorio24-27. No obstante, puede ser inferido un rol emergente de las mitocondrias y el estrés oxidativo en el proceso inflamatorio durante la nefropatía obstructiva.
Las mitocondrias son las organelas productoras de energía que llevan a cabo otras tareas celulares claves. El daño mitocondrial puede afectar diversos aspectos del funcionamiento del tejido, como se ha mencionado, y probablemente contribuye a la fisiopatología de la enfermedad renal28. De especial interés, se ha descripto localización mitocondrial de los receptores de la vitamina D (VDR)29 y esto sugiere una novedosa actividad no genómica de los mismos. En vista de esto, de Cavanagh y col. propusieron que esta actividad no genómica mitocondrial del VDR podría estar asociada con el sistema SRAA (específicamente con el receptor AT1). Existen evidencias de posible contra-balance entre los receptores AT1 y la expresión de VDR. Así, el bloqueo de los receptores AT1 atenuó la lesión mitocondrial renal14 mientras que la expresión de VDR redujo la lesión renal obstructiva por supresión del SRAA30. Inéditamente, nuestro laboratorio demostró en las fracciones mitocondriales de las cortezas obstruidas un incremento en la expresión del ARNm del receptor de AT1 y disminución de expresión del ARNm de VDR. Además, fueron establecidos previamente valores elevados de la expresión NOX4 y actividad de la NADPH oxidasa concomitante12. El estrés oxidativo puede regular en menos el receptor de la vitamina D en las fracciones mitocondriales de cortezas renales obstruidas como consecuencia de la modulación del metabolismo de la vitamina D31. Previamente se demostró alta expresión mitocondrial de NOX4 asociada al esfuerzo cardíaco y el envejecimiento32. Por nuestra parte, informamos aumento de la actividad de la NADPH oxidasa e inducción de apoptosis regulada por la vía de señalización mitocondrial en OUU neonatal33. Las señales de apoptosis durante la OUU se amplifican en la mitocondria por la liberación de citocromo c para activar la cascada de caspasas. Además, demostramos ausencia de inducción apoptótica y mínimos cambios morfológicos mitocondriales en las cortezas renales de animales obstruidos tratados con paricalcitol (inductor de receptores de vitamina D). Por otra parte, menor expresión de los receptores AT1, NOX4 y actividad de NADPH, se estableció en las fracciones mitocondriales de cortezas renales obstruidas de animales tratados con paricalcitol en comparación con los animales no tratados. Estos cambios fueron consistentes con una mejora en la expresión de VDR12. Anteriormente, Crivello demostró (en células del túbulo contorneado proximal de bovinos) que el estrés oxidativo limita la expresión mitocondrial de la vitamina D3 y las actividades 1 alfa y 24-hidroxilasa31. También, el tratamiento con paricalcitol, enalapril, o la combinación, en ratas urémicas protegerían del estrés oxidativo mediante la inhibición de la actividad de la NADPH oxidasa34. Se encontró también que la disfunción mitocondrial renal en ratas espontáneamente hipertensas era atenuada por el tratamiento con losartán15. Por lo tanto, el VDR mitocondrial podría contrarrestar el SRAA mitocondrial, aunque esto resulte inédito y no fuera descrito previamente. Sin embargo, un hallazgo significativo reciente demostró la existencia de un SRAA mitocondrial funcional asociado con la producción de óxido nítrico35.
La angiotensina II es una hormona pro-inflamatoria que aumenta el estrés oxidativo mitocondrial y por lo tanto condicionaría a la regulación de la apoptosis. Por el contrario, la estimulación de VDR tendría el efecto opuesto. El análisis de nuestros resultados, junto con el desarrollo de otros autores, nos permite sugerir que los receptores de la vitamina D tienen un papel importante como protector renal, y que este efecto podría ser dependiente de receptor de AT1 en el nivel mitocondrial (demostrado en un modelo experimental de nefropatía obstructiva).
Finalmente, la obstrucción ureteral unilateral en roedores se puede utilizar como un paradigma para la obstrucción en seres humanos y una plataforma para estudiar el potencial de nuevas terapias para la nefropatía obstructiva y otras enfermedades inflamatorias renales. Surge así un nuevo concepto de posibles herramientas anti-inflamatorias que regulen al estrés oxidativo mitocondrial pudiendo afectar directamente al proceso inflamatorio y la apoptosis. Esta idea podría tener consecuencias atractivas en el tratamiento de patologías inflamatorias renales así también como extrarrenales.
Conflicto de intereses: Ninguno para declarar
1. Newmeyer DD, Farschon DM, Reed JC. Cell-free apoptosis in Xenopusegg extracts: inhibition by Bcl-2 and requirement for an organelle fraction enriched in mitochondria. Cell 1994;79: 353-64. [ Links ]
2. Granata S, Zaga G, Simone S, et al. Mitochondrial dysregulation and oxidative stress in patients with chronic kidney disease. BMC Genomics 2009; 10: 388. [ Links ]
3. Benigni A, Corna D, Zoja C, et al. Disruption of the Ang II type 1 receptor promotes longevity in mice. J Clin Invest 2009; 119: 524-30. [ Links ]
4. de Cavanagh EM, Inserra F, Ferder L. Angiotensin II blockade: a strategy to slow ageing by protecting mitochondria? Cardiovasc Res 2011; 89: 31-40. [ Links ]
5. Navarrete-Reyes AP, Montaña-Alvarez M. Inflammaging: Aging inflammatory origin. Rev Invest Clin 2009; 61: 327-36. [ Links ]
6. John GB, Cheng CY, Kuro-o M. Role of Klotho in aging, phosphate metabolism, and CKD. Am J Kidney Dis 2011; 58: 127-34. [ Links ]
7. He W, Wang Y, Zhang MZ, et al. Sirt1 activation protects the mouse renal medulla from oxidative injury. J Clin Invest 2010; 120: 1056-68. [ Links ]
8. Moreno JA, Izquierdo MC, Sanchez-Niño MD, et al. The inflammatory cytokines TWEAK and TNFα reduce renal klotho expression through NFκB. J Am Soc Nephrol 2011; 22: 1315-25.
9. Demirbilek S, Emre MH, Aydin EN, et al. Sulfasalazine reduces inflammatory renal injury in unilateral ureteral obstruction. Pediatr Nephrol 2007; 22: 804-12. [ Links ]
10. Owada S, Maeba T, Sugano Y, et al. Spherical carbon adsorbent (AST-120) protects deterioration of renal function in chronic kidney disease rats through inhibition of reactive oxygen species production from mitochondria and reduction of serum lipid peroxidation. Nephron Exp Nephrol 2010; 115: e101-11. [ Links ]
11. Møller JC, Jørgensen TM, Mortensen J. Proximal tubular atrophy: qualitative and quantitative structural changes in chronic obstructive nephropathy in the pig. Cell Tissue Res 1986; 244: 479-91. [ Links ]
12. García IM, Altamirano L, Mazzei LJ, et al.Role of mitochondria in paricalcitol-mediated cytoprotection during obstructive nephropathy. Am J Physiol Renal Physiol 2012; 302: F1595-605. [ Links ]
13. de Cavanagh EM, Inserra F, Ferder L. Angiotensin II blockade: a strategy to slow ageing by protecting mitochondria? Cardiovasc Res 2011; 89: 31-40. [ Links ]
14. de Cavanagh EM, Ferder L, Toblli JE, et al.Renal mitochondrial impairment is attenuated by AT1 blockade in experimental Type I diabetes. Am J Physiol Heart Circ Physiol 2008; 294: H456-65. [ Links ]
15. de Cavanagh EM, Ferder LF, Ferder MD, Stella IY, Toblli JE, Inserra F. Vascular structure and oxidative stress in salt-loaded spontaneously hypertensive rats: effects of losartan and atenolol. Am J Hypertens 2010; 23, 1318-25. [ Links ]
16. de Cavanagh EM, Toblli JE, Ferder L, Piotrkowski B, Stella I, Inserra F. Renal mitochondrial dysfunction in spontaneously hypertensive rats is attenuated by losartan but not by amlodipine. Am J Physiol Regul Integr Comp Physiol 2006; 290: R1616-25. [ Links ]
17. Ferder L, Inserra F, Martínez-Maldonado M. Inflammation and the metabolic syndrome: role of angiotensin II and oxidative stress. Curr Hypertens Rep 2006; 8: 191-8. [ Links ]
18. Mizuguchi Y, Chen J, Seshan SV, Poppas DP, Szeto HH, Felsen D. A novel cell-permeable antioxidant peptide decreases renal tubular apoptosis and damage in unilateral ureteral obstruction. Am J Physiol Renal Physiol 2008; 295: F1545-53. [ Links ]
19. Kim J, Kim DS, Park MJ, et al. Omi/HtrA2 protease is associated with tubular cell apoptosis and fibrosis induced by unilateral ureteral obstruction. Am J Physiol Renal Physiol 2010; 298: F1332-40. [ Links ]
20. Manucha W, Vallés P. Hsp70/nitric oxide relationship in apoptotic modulation during obstructive nephropathy. Cell Stress Chaperones 2008; 13: 413-20. [ Links ]
21. Manucha W, Kurbán F, Mazzei L, et al. eNOS/Hsp70 interaction on rosuvastatin cytoprotective effect in neonatal obstructive nephropathy. Eur J Pharmacol 2011; 650: 487-95. [ Links ]
22. Zhou MS, Schuman IH, Jaimes EA, Raij L. Renoprotection by statins is linked to a decrease in renal oxidative stress, TGF-beta, and fibronectin with concomitant increase in nitric oxide bioavailability. Am J Physiol Renal Physiol 2008; 295: F53-9. [ Links ]
23. Zager RA, Johnson A. Renal cortical cholesterol accumulation is an integral component of the systemic stress response. Kidney Int 2001; 60: 2299-310. [ Links ]
24. Parra G, Quiroz Y, Salazar J, et al. Experimental induction of salt-sensitive hypertension is associated with lymphocyte proliferative response to HSP70. Kidney Int (Suppl) 2008; 111: S55-9. [ Links ]
25. Nakada J, Matsura T, Okazaki N, et al. Oral administration of geranylgeranylacetone improves survival rate in a rat endotoxin shock model: administration timing and heat shock protein 70 induction. Shock 2005; 24: 482-7. [ Links ]
26. Bravo J, Quiroz Y, Pons H, et al. Vimentin and heat shock protein expression are induced in the kidney by angiotensin and by nitric oxide inhibition. Kidney Int (Suppl) 2003; 86: S46-51. [ Links ]
27. Yang RC, Wang CI, Chen HW, Chou FP, Lue SI, Hwang KP. Heat shock treatment decreases the mortality of sepsis in rats. Kaohsiung J Med Sci 1998; 14: 664-72. [ Links ]
28. de Cavanagh EM, Inserra F, Ferder M, Ferder L. From mitochondria to disease: role of the renin-angiotensin system. Am J Nephrol 2007; 27: 545-53. [ Links ]
29. Silvagno F, De Vivo E, Attanasio A, Gallo V, Mazzucco G, Pescarmona G. Mitochondrial localization of vitamin D receptor in human platelets and differentiated megakaryocytes. PLoS One 2010; 5: e8670. [ Links ]
30. Zhang Y, Kong J, Deb DK, Chang A, Li YC. Vitamin D receptor attenuates renal fibrosis by suppressing the renin-angiotensin system. J Am Soc Nephrol 2010; 21: 966-73. [ Links ]
31. Crivello JF. Oxidative stress limits vitamin D metabolism by bovine proximal tubule cells in vitro. Arch Biochem Biophys 1988; 262: 471-80. [ Links ]
32. Ago T, Matsushima S, Kuroda J, Zablocki D, Kitazono T, Sadoshima J. The NADPH oxidase Nox4 and aging in the heart. Aging (Albany NY) 2010; 2: 1012-6. [ Links ]
33. Rinaldi Tosi ME, Bocanegra V, Manucha W, Gil Lorenzo A. The Nrf2-Keap1 cellular defense pathway and heat shock protein 70 (Hsp70) response. Role in protection against oxidative stress in early neonatal unilateral ureteral obstruction (UUO). Cell Stress Chaperones 2011; 16: 57-68. [ Links ]
34. Husain K, Suarez E, Isidro A, Ferder L. Effects of paricalcitol and enalapril on atherosclerotic injury in mouse aortas. Am J Nephrol 2010; 32: 296-304. [ Links ]
35. Abadir PM, Foster DB, Crow M, et al. Identification and characterization of a functional mitochondrial angiotensin system. Proc Natl Acad Sci USA 2011; 108: 14849-54. [ Links ]
Recibido: 9-VIII-2013
Aceptado: 11-III-2014














