Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Medicina (Buenos Aires)
versión impresa ISSN 0025-7680
Medicina (B. Aires) vol.74 no.4 Ciudad Autónoma de Buenos Aires ago. 2014
CASUÍSTICA
Síndrome de Job asociado a tuberculosis miliar
Ana Gamberale1, Ileana Moreira2, Bruno Bartoletti1, Víctor Cruz1, Liliana Bezrodnik2, Federico Alberti1, Liliana Castro Zorrilla3, Domingo Palmero1
1División Neumotisiología, Hospital de Infecciosas Dr. F. J. Muñiz,
2Grupo de Trabajo de Inmunología, Hospital de Niños Dr. Ricardo Gutiérrez,
3Departamento Inmunología, Instituto Vaccarezza, Universidad de Buenos Aires, Argentina
Dirección postal: Dr. Domingo Palmero, División Neumotisiología, Hospital de Infecciosas Dr. Francisco J. Muñiz, Uspallata 2272, 1282 Buenos Aires, Argentina Fax: (54-11) 4304-8794 e-mail: djpalmero@intramed.net
Resumen
El síndrome de hiper IgE también denominado síndrome de Job, es una inmunodeficiencia primaria poco frecuente, cuyo modo de herencia puede ser autosómico recesivo o dominante. Se caracteriza por altos niveles de IgE, eosinofilia, abscesos cutáneos, eccema, candidiasis mucocutánea crónica e infecciones pulmonares recidivantes que contribuyen al desarrollo de neumatoceles y bronquiectasias. El germen más frecuentemente aislado es el Staphylococcus aureus. En la actualidad, ante la mayor supervivencia de los pacientes se han comunicado infecciones oportunistas y linfomas. Existen escasas publicaciones de pacientes con enfermedad por Mycobacterium tuberculosis asociada a síndrome de hiper IgE, por lo que consideramos relevante comunicar el caso de un paciente con antecedentes de una tuberculosis pulmonar, que presentó una tuberculosis miliar con grave compromiso respiratorio, con buena respuesta al tratamiento estándar con drogas de primera línea.
Palabras clave: Inmunodeficiencia primaria, Síndrome de hiper IgE, Síndrome de Job; Tuberculosis.
Abstract
Job´s syndrome and to miliary tuberculosis. The hyper Immunoglobulin E syndrome, also known as Job´s syndrome, is a rare primary immunodeficiency, its mechanisms of inheritance maybe recessive or dominant autosomal. It is characterized by high levels of IgE, eosinophilia, skin abscesses, eczema, chronic mucocutaneous candidiasis and recurrent pulmonary infections all of which contribute to the development of pneumatoceles and bronchiectasis. The most frequently isolated bacteria is Staphylococcus aureus. Currently, despite the highest survival of patients, lymphomas and other opportunistic infections have been reported. There are few reports of patients with Mycobacterium tuberculosis infection associated with hyper IgE syndrome. Therefore it is relevant that we report a case history of a patient with pulmonary tuberculosis, presenting miliary tuberculosis and severe respiratory compromise, who responded positively to standard anti-tuberculous treatment with first line drugs.
Key words: Primary immunodeficiency; Hyper IgE syndrome; Job syndrome; Tuberculosis.
El síndrome de hiper inmunoglobulina E (SHIE) fue descrito inicialmente como síndrome de Job (1966) y posteriormente por Buckley en 19721, 2. Es una poco frecuente inmunodeficiencia primaria (IDP). En Argentina fueron registrados 47 casos en el período 1984-20053. El SHIE comprende un grupo de IDP caracterizadas por altos niveles de IgE, usualmente > 2000 UI/ml, eosinofilia, abscesos cutáneos "fríos" recurrentes, eccema generalmente desde el nacimiento, candidiasis mucocutánea crónica (CMC) e infecciones pulmonares recidivantes que contribuyen al desarrollo de neumatoceles y bronquiectasias. Dentro de las etiologías de las infecciones podemos resaltar que los abscesos cutáneos son generados principalmente por Staphylococcus aureus y dentro de los patógenos que producen las infecciones respiratorias el primer lugar lo ocupa el mismo S. aureus y en menor medida Streptococcus pneumoniae y distintas especies de Haemophylus. Los pacientes con SHIE también pueden presentar durante su evolución infecciones por gérmenes oportunistas como Aspergillus, Pseudomonas y micobacterias atípicas. Dentro de las infecciones micóticas casi el 80% de los pacientes presenta CMC, aunque hay descriptas infecciones por Histoplasma, Cryptococcus y Coccidioides4, 5, 6.
Las infecciones pulmonares son causadas con menor frecuencia por micobacterias ambientales o BCGitis7, 8. En la bibliografía internacional (Pubmed, Scielo, Scholar Google) se hallaron contados informes de la asociación con tuberculosis activa (TB) por lo que resultó relevante comunicar este caso a fin de ser considerada dentro de las infecciones graves asociadas al SHIE.
Caso clínico
Varón de 19 años de edad, habitante del conurbano bonaerense, adicto a drogas ilícitas, sin referencia de contacto con enfermos pulmonares, en tratamiento actual en el Hospital de Niños Dr. Ricardo Gutiérrez con IgG EV 600 mg/kg/dosis cada 21 días más profilaxis con TMS e itraconazol desde 2009 por su SHIE.
Registraba, como antecedentes patológicos en su infancia, otitis a repetición y múltiples neumonías, algunas de ellas con pleuresía paraneumónica que requirieron internación. A los 8 años presentó abscesos múltiples de partes blandas que requirieron intervención quirúrgica. Fractura de clavícula y muñeca izquierda secundarias a un traumatismo leve a los 9 años de edad. Desarrolló marcada escoliosis. A los 12 años de edad, diagnóstico de TB pulmonar con baciloscopia positiva; realizó tratamiento 4 meses y abandonó. A los 13 años se diagnosticó pleuroneumonía con baciloscopia negativa, se indicó tratamiento específico, que abandonó. A los 14 años nuevo episodio de neumonía con derrame pleural y pericárdico, con evolución tórpida complicado con una mediastinitis. Se realizó decorticación pleuropericárdica con cultivo positivo para Candida albicans y se aisló en esputo Mycobacterium tuberculosis. Inició nuevamente tratamiento antifímico con drogas de primera línea y fluconazol, el cual abandona al ser externado. Presentó episodio de herpes zoster. Dada su presentación clínica se sospechó SHIE, sumando en el score de Grimbacher (1999)2 61 puntos (1) y en el score de Woellner (2010)9 de predicción de mutación en STAT3 más de 30 puntos (Tabla 2). Se efectuó secuenciación directa de los exones del gen STAT3 sin encontrarse mutación. El test de DHR (dihidro-rodamina) para enfermedad granulomatosa crónica (EGC) fue normal y la subpoblación de linfocitos B mostró disminución de las células B de memoria y aumento de los linfocitos B transicionales (LBT).
En junio de 2013 se derivó al Hospital Dr. F. J. Muñiz, donde fue internado en UTI por presentar disnea CF III-IV, pO2 = 63 mm Hg, leucocitos = 13.800 células/µl, esputo BAAR positivo (+++) y en su radiografía de tórax se observó compromiso nodulillar difuso bilateral de vértice a base y cavidades en ambos lóbulos superiores. Inició tratamiento con ceftriaxona, ciprofloxacina, oseltamivir, TMS, fluconazol, isoniacida, rifampicina, pirazinamida y etambutol. El hisopado nasofaríngeo para H1N1 fue negativo. Las serologías para HIV, Chagas, VDRL y hepatitis B y C fueron negativas.
Su dosaje de inmunoglobulinas de abril de 2013 fue: IgG 1.260 mg/dl, IgA 348 mg/dl, IgM 133 mg/dl e IgE 1.410 UI/ml. Eosinofilia 12% (1.656 células/µl).
La TAC de tórax mostró cavidades de pared gruesa e irregular en ambos lóbulos superiores, lóbulo medio, língula, y aisladas en base izquierda; patrón miliar en ambos campos pulmonares con imágenes de árbol en brote bilaterales; adenomegalias en huecos axilares; escoliosis dextroconvexa.
La ecografía abdominal no detectó esplenomegalia ni adenopatías retroperitoneales.
El M. tuberculosis aislado de esputo fue pansensible.
Mejoró progresivamente y pasó a sala de Neumonología. Fue externado al día 47 de internación con esputo directo negativo para BAAR, continuando tratamiento específico, profilaxis con TMS e itraconazol e IgG EV 30 g c/21 días en forma ambulatoria.
Discusión
En la actualidad se han encontrado varios genes involucrados en el SHIE (STAT3, DOCK8, Tyk2) con rasgos comunes pero con diferente compromiso clínico e inmunológico, sin el hallazgo de defecto molecular en aproximadamente la mitad de los casos. En 2007 se identificaron mutaciones autosómicas dominantes (AD) negativas en STAT3 (signal transducer and activator of transcription 3) como causa genética en este síndrome. Los pacientes con mutaciones en STAT3 presentan las características inmunológicas arriba descriptas junto a un variado rango de manifestaciones somáticas no inmunológicas que incluyen: una facies característica que se evidencia completamente luego de la adolescencia con frente y barbilla prominentes, base nasal ancha, craneosinostosis, retención de dientes primarios, paladar ojival, hiperlaxitud, escoliosis y osteoporosis que lleva a fracturas con traumatismos mínimos. Por otro lado, estos pacientes tienen riesgo elevado de desarrollar malignidad, particularmente linfoma no Hodgkin y aneurismas arteriales10, 11.
Aproximadamente el 25% de los pacientes con SHIE presentan mutación en STAT3. Posteriormente se han descripto formas de herencia autosómicas recesivas (AR) causadas por mutaciones en DOCK8 (dedicator of cytokinesis 8) y Tyk2 (tyrosine-protein kinase 2). Tanto las formas AD como las AR, comparten varias características fenotípicas del SHIE, pero difieren en su compromiso inmunológico y gravedad clínica. Las mutaciones en DOCK8 generan un fenotipo de SHIE con menor compromiso pulmonar pero mayor expresión de síntomas cutáneos y aumento de la susceptibilidad a infecciones virales, como infecciones diseminadas por molusco contagioso, virus herpes y varicela. Las deficiencias en Tyk2 presentan en especial IgE en valores menos elevados e incluso normales con un fenotipo clínico muy variable. Los pacientes con las formas autosómicas recesivas no comparten las características somáticas de las AD12, 13.
Una característica típica del SHIE es la inflamación aberrante, que lleva a la producción de abscesos fríos en la piel con una respuesta inflamatoria exagerada, principalmente pulmonar, que provocaría la formación de neumatoceles. Esto se debe a que el factor de transcripción STAT3 actúa como un activador de la señalización de diferentes receptores de citoquinas, que incluyen IL-6, IL-10, IL-11, IL-17, IL-21, IL-22 e IL-23 entre otros14, 15. El hecho que STAT3 participe tanto en vías de citoquinas pro como anti-inflamatorias conduce a una desregulación que promueve o inhibe la inflamación según las circunstancias.
Las mutaciones en STAT3 determinan una falla en la diferenciación Th17 y en la secreción de IL-17. Esto podría explicar, en parte, el aumento de susceptibilidad a diversas infecciones. La susceptibilidad a CMC debida a defectos en la señalización de IL-17 ha sido demostrada en pacientes con anticuerpos anti IL-17 o con mutaciones en IL-17F o en el receptor de IL-17. Las células Th17 secretan también IL-22, la cual participa en la up-regulation de distintas células para la producción de CCL20 y ß defensinas como por ejemplo keratinocitos y células epiteliales pulmonares. Se ha demostrado en pacientes con forma AD la reducción de la producción de esos péptidos antimicrobianos. Por otro lado, la anormal remodelación pulmonar hallada luego de infecciones o cirugías se ha relacionado con la participación de STAT3 en la regulación de distintas metaloproteinasas de la matriz pulmonar16, 17.
Se considera que el defecto de señalización de IL-11 sería la causa primordial de las malformaciones óseas y dentales14. Además como STAT3 participa en la señalización de distintos factores de crecimiento, los defectos en sus vías serían los responsables del mayor riesgo de malignidad.
En los últimos años y con la mayor supervivencia de los pacientes con SHIE, se han observado complicaciones graves con agentes oportunistas y/o tumores, que demuestran que esta IDP representa un compromiso combinado de los diferentes compartimentos T, B y células de la respuesta innata.
Dentro de las infecciones asociadas a ambas formas del SHIE, se destacan las piógenas, virales y micóticas, y dentro de las micobacterias se han comunicado casos por BCG y por micobacterias ambientales6, 7, que serían infecciones oportunistas. En las bases de datos consultadas raramente se menciona la TB como infección activa asociada al SHIE, describiéndose el informe de un caso de absceso cerebral de esa etiología18, una TB diseminada19 y una osteomielitis TB20. Una publicación del Hospital Garrahan sobre manifestaciones dermatológicas en 10 casos asistidos en un período de 17 años menciona una serie de complicaciones infecciosas en los pacientes pero ninguno con TB21. El paciente que comunicamos presentó dos episodios anteriores de TB, uno confirmado bacteriológicamente y otro sospechado de reactivación por abandono del tratamiento. En su último episodio presentó una TB con diseminación hematógena pulmonar (la ecografía abdominal no mostró lesiones hepáticas, esplénicas o ganglionares compatibles con diseminación hemática) con grave compromiso respiratorio que requirió su internación en UTI. Pese a su falta de adherencia al tratamiento, el antibiograma mostró una cepa de M. tuberculosis pansensible, lo que permitió continuarle un esquema estándar de tratamiento con isoniacida, rifampicina, pirazinamida y etambutol en su primera fase.
El paciente mostró un alto puntaje (ver Tablas 1 y 2) de los scores de manifestaciones clínicas, tanto de sospecha de SHIE (Grimbacher2) como de mutación del STAT3 (Woellner9), pero su búsqueda fue negativa. Queda pendiente la búsqueda de los otros genes candidatos, aunque es sabido que en el 50% de los pacientes no se encuentra la mutación responsable10, 11.
Tabla 1. Hallazgos positivos en el score de Grimbacher2 para el diagnóstico de síndrome de hiper IgE en el caso comunicado (< 20 puntos: diagnóstico poco probable, 20-40 puntos: diagnóstico dudoso, > 40 puntos: diagnóstico probable).
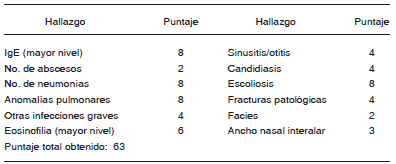
El total de hallazgos a considerar incluye: IgE, número de abscesos, número de neumonías, anomalías pulmonares, otras infecciones graves, infección fetal, eosinófilos, erupción neonatal, eccema, sinusitis/ otitis, candidiasis, dientes primarios retenidos, escoliosis, fracturas patológicas, hiperextensibilidad, facies, ancho nasal interalar, paladar alto, anomalías de la línea media, linfoma, puntaje a agregar por edad de diagnóstico.
Tabla 2. Score clínico de Woellner y col. para sospechar mutaciones del gen STAT3
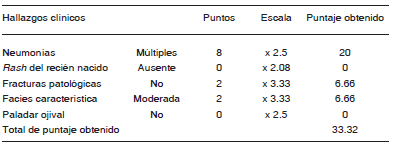
Woellner y col.9 describen en 2010 un score clínico de predicción de mutaciones del gen STAT3 basado en los 5 rasgos que son considerados más característicos. Un valor mayor a 30 es altamente predictivo.
Las adicciones del paciente y su consecuente falta de adherencia al tratamiento pudieron favorecer la presentación grave de TB que, de todos modos, se mostró como una infección crónica.
Como conclusión, se resalta la importancia de la investigación del M. tuberculosis dentro del estudio bacteriológico de las neumonías asociadas a este raro tipo de inmunodeficiencia primaria.
Conflicto de intereses: Ninguno para declarar
1. Buckley RH, Wray BB, Belmaker EZ. Extreme hyperimmunoglobulinemia E and undue susceptibility to infection. Pediatrics 1972; 49: 59-70. [ Links ]
2. Grimbacher B, Holland S, Gallin J, et al. Hyper-IgE syndrome with recurrent infections: an autosomal dominant multisystem disorder. N Engl J Med 1999; 340: 692-702. [ Links ]
3. Grupo de Inmunología Pediátrica. Registro argentino de inmunodeficiencias primarias. Segundo informe. Arch Argent Pediatr 2007; 105: 453-60. [ Links ]
4. Sowerwine KJ, Holland SM, Freeman AF. Hyper-IgE syndrome update. Ann N Y Acad Sci 2012; 1250: 25-32. [ Links ]
5. Yong PFA, Freeman AF, Engelhardt KR, Holland S, Puck JM, Grimbacher B. An update on the hyper-IgE syndromes (Review). Arthritis Research & Therapy 2012; 14: 228-37. [ Links ]
6. Malbrán A, Rey G, Yeyati EL. Síndrome de Job. Medicina (B Aires) 2003; 63: 227. [ Links ]
7. Pasic S, Lilic D, Pejnovic N, Vojvodic D, Simic R, Abinun M. Disseminated Bacillus Calmette-Guérin infection in a girl with hyperimmunoglobulin E syndrome. Acta Paediatr 1998; 87: 702-4. [ Links ]
8. Melia E, Freeman AF, Shea YR, Hsu AP, Holland SM, Olivier KN. Pulmonary nontuberculous mycobacterial infections in hyper-IgE syndrome. J Allergy Clin Immunol 2009; 124: 617-8. [ Links ]
9. Woellner C, Gertz M, Schäffer AA, et al. Mutations in STAT3 and diagnostic guidelines for hyper-IgE syndrome. J Allergy Clin Immunol 2010; 125: 424-32. [ Links ]
10. Holland SM, DeLeo FR, Elloumi HZ, et al. STAT3 mutations in the hyper-IgE syndrome. N Engl J Med 2007; 357: 1608-19. [ Links ]
11. Minegishi Y, Saito M, Tsuchiya S, et al. Dominant-negative mutations in the DNA-binding domain of STAT3 cause hyper-IgE syndrome. Nature 2007; 448: 1058-62. [ Links ]
12. Zhang Q, Davis JC, Dove CG, Su HC. Genetic, clinical, and laboratory markers for DOCK8 immunodeficiency syndrome. Dis Markers 2010; 29: 131-9. [ Links ]
13. Minegishi Y, Saito M, Morio T, et al. Human tyrosine kinase 2 deficiency reveals its requisite roles in multiple cytokine signals involved in innate and acquired immunity. Immunity 2006; 25: 745-55. [ Links ]
14. Nieminen P, Morgan NV, Fenwick AL, et al. Inactivation of IL11 signaling causes craniosynostosis, delayed tooth eruption, and supernumerary teeth. Am J Hum Genet 2011; 89: 67-8. [ Links ]
15. de Beaucoudrey L, Puel A, Filipe-Santos O, et al. Mutations in STAT3 and IL12RB1 impair the development of human IL-17-producing T cells. J Exp Med 2008; 205: 1543-50. [ Links ]
16. Milner JD, Brenchley JM, Laurence A, et al. Impaired Th17 cell differentiation in subjects with autosomal dominant hyper-IgE syndrome. Nature 2008; 452: 773-6. [ Links ]
17. Minegishi Y, Saito M, Nagasawa M, et al. Molecular explanation for the contradiction between systemic Th17 defect and localized bacterial infection in hyper-IgE syndrome. J Exp Med 2009; 206: 1291-301. [ Links ]
18. Metin A, Uysal G, Güven A, Unlu A, Oztürk MH. Tuberculosis brain abscess in a patient with hyper IgE syndrome. Pediatr Int 2004; 46: 97-100. [ Links ]
19. Shilpa G, Singhal V, Shimoga RM, Baliga K. Tuberculous osteomyelitis in Job syndrome. Indian J Paediatr Dermatol 2013; 14: 95-7. [ Links ]
20. Mahla H. Job's syndrome: A rare presentation of pulmonary Koch's with multiple splenic abscess. J Clin Immunology Immunopathology Res 2012; 4: 22-4. [ Links ]
21. Noriega A. Síndrome de Hiper IgE: sus manifestaciones cutáneas. Revisión casuística y bibliográfica. Arch Argent Dermatol 2013; 63: 125-36. [ Links ]
Recibido: 28-XI-2013
Aceptado: 10-III-2014














