Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Medicina (Buenos Aires)
Print version ISSN 0025-7680
Medicina (B. Aires) vol.74 no.5 Ciudad Autónoma de Buenos Aires Oct. 2014
CASUÍSTICA
Miopatía inflamatoria con compromiso inicial de músculos respiratorios y artritis reumatoidea
Martín Hunter1, Irene Telias1, Victoria Collado2, Judith Sarano2, Clarisa Álvarez3, Juan Pablo Suárez1
1Servicio de Clínica Médica,
2Servicio de Reumatología,
3Servicio de Anatomía Patológica Instituto de Investigaciones Médicas Alfredo Lanari, Facultad de Medicina, Universidad de Buenos Aires, Argentina
Dirección postal: Martín Hunter, Servicio de Clínica Médica, Instituto de Investigaciones Médicas Alfredo Lanari,Combatientes de Malvinas 3150, 1427 Buenos Aires, Argentina
Fax: (54-11) 4514-8701 e-mail: huntmart@gmail.com
Resumen
Las miopatías inflamatorias constituyen un grupo heterogéneo de enfermedades musculares adquiridas de presentación subaguda, crónica y a veces aguda. Las entidades clínicas más frecuentes son la dermatomiositis, la polimiositis, la miositis necrotizante autoinmune y la miositis por cuerpos de inclusión. Suelen presentarse con debilidad muscular con predominio proximal y simétrica, pero rara vez comprometen los músculos respiratorios. Presentamos el caso de una mujer de 39 años con miopatía inflamatoria inespecífica que presentó insuficiencia respiratoria secundaria a hipoventilación alveolar por debilidad muscular y requirió asistencia respiratoria mecánica. Respondió favorablemente y de forma rápida tras el tratamiento instaurado con inmunosupresores (corticoides y metotrexato) e inmunoglobulina humana endovenosa. Se utilizó ventilación no invasiva como alternativa a la intubación orotraqueal con adecuada tolerancia.
Palabras clave: Miositis; Insuficiencia respiratoria; Inmunosupresión; Ventilación no invasiva.
Abstract
Inflammatory myopathy with initial respiratory muscles involvement and rheumatoid arthritis. Inflammatory myopathies comprise a heterogeneous group of subacute, chronic and sometimes acute acquired muscle diseases. The most common inflammatory myopathies seen in practice can be separated into four distinct subsets: polymyositis, dermatomyositis, necrotizing autoimmune myositis and inclusion body myositis. These disorders present as proximal and symmetric muscle weakness but rarely respiratory muscles may also be affected. We report the case of a 39 year-old female with inflammatory myopathy with acute respiratory failure due to alveolar hypoventilation secondary to respiratory muscle dysfunction that required mechanical ventilation. The treatment with steroids, methotrexate and intravenous immune globulin was successful as well as the implementation of non-invasive ventilation as an alternative to endotracheal intubation.
Key words: Myositis; Respiratory insufficiency; Immunosuppression; Noninvasive ventilation.
Las miopatías inflamatorias constituyen un grupo heterogéneo de enfermedades musculares adquiridas de presentación subaguda, crónica y a veces aguda. Las entidades clínicas más frecuentes son la dermatomiositis, la polimiositis, la miositis necrotizante autoinmune y la miositis por cuerpos de inclusión1.
Tienen en común la presencia de debilidad muscular progresiva y a menudo simétrica. Por lo general, los pacientes experimentan dificultad para realizar tareas cotidianas que involucran la acción de los músculos proximales. Suelen estar alterados los músculos faríngeos y flexores del cuello ocasionando disfagia y pérdida del sostén cefálico. En casos avanzados, y rara vez en los agudos, se observa compromiso de los músculos respiratorios2.
La biopsia muscular constituye el mejor método para realizar el diagnóstico y permite, además, el reconocimiento de variedades clínicas de miositis inusuales tales como la granulomatosa o la eosinofílica3.
Caso clínico
Mujer de 39 años con artritis reumatoidea desde los 16 años, que realizó tratamiento crónico con corticoides y leflunomida. Comenzó en julio de 2011 con diplopía a la mirada extrema asociada a disfagia para líquidos y evolucionó, en un mes, con astenia, alteración en la voz, ptosis palpebral izquierda y debilidad muscular proximal en miembros superiores. Se internó en Santiago del Estero y se sospechó enfermedad de placa neuromuscular,
por lo que recibió tratamiento con glucocorticoides (se desconoce la dosis). Evolucionó con insuficiencia respiratoria aguda que requirió asistencia respiratoria mecánica, constatándose neumonía por Klebsiella pneumoniae por lo que recibió tratamiento con imipenem. Luego de siete días de asistencia respiratoria mecánica, se realizó traqueostomía.
Por destete dificultoso fue derivada a nuestra institución en agosto de 2011. Ingresó con debilidad muscular en los cuatro miembros y ptosis palpebral bilateral con reflejos vivos en miembros superiores, arreflexia en miembros inferiores, sin signos de liberación piramidal, ausencia de reflejo nauseoso y sin sostén cefálico. Los valores de creatinquinasa (CPK) y de lactato deshidrogenasa (LDH) fueron respectivamente 167 U/l y 471 U/l. Reinició tratamiento con corticoides por vía parenteral presentando mejoría de la fuerza muscular, lográndose destete exitoso. El electromiograma mostró patrón miopático, sin datos concluyentes tras la estimulación repetitiva. Los resultados de exámenes de laboratorio fueron: anticuerpos anti-receptor de acetilcolina negativo, anticuerpos antinucleares (FAN) negativos, látex para AR positivo (1/320), anticuerpos antipéptidos cíclicos citrulinados (anti-CCP) positivos: 225, anticuerpos específicos para miositis (Jo-1, PM/Scl-100, Pl-7, Pl-12, Mi-2, Ku p70/80, SRP) negativos y anticuerpos antinucleares (Sm, Ro, La, RNP, P ribosomal, histonas, centrómero) negativos. Se removió la cánula traqueal y se rotaron los corticoides a la vía oral. El examen funcional respiratorio (EFR) evidenció un patrón compatible con restricción grave: capacidad vital forzada (CVF) 1.51 l (46% del valor predicho). Sin diagnóstico preciso, pero descartando miastenia gravis como diagnóstico principal, se inició descenso paulatino de la dosis de corticoides. La paciente egresó de la institución con meprednisona 10 mg/día a fines de septiembre de 2011.
En octubre de 2011 se internó por debilidad muscular, mala mecánica ventilatoria y deterioro del sensorio en contexto de hipercapnia (PaCO2 84 mmHg). Al ingreso: CPK 3300 U/l, LDH 1253 U/l, GOT 92 U/l, aldolasa 30 U/l. Se inició ventilación no invasiva (VNI) y realizó tratamiento endovenoso con 3 pulsos de 250 mg de metilprednisolona y el primer ciclo de inmunoglobulina humana, dosis 2 g/kg por sospecha de miopatía inflamatoria. El electromiograma mostró potenciales polifásicos de baja amplitud y actividad espontánea en músculos paravertebrales compatible con patrón miopático. Se realizó biopsia muscular de deltoides izquierdo que evidenció infiltrado inflamatorio perivascular y perimisial con signos denervatorios y fibras en regeneración según histología convencional (Fig. 1) y técnicas de histoquímica en cortes por congelación. El EFR mostró persistencia de restricción grave (CVF 1.28 l -39%), PiMáx -35 cmH2O, PeMáx 40 cmH2O. Se inició tratamiento con metotrexato 20 mg/semana por vía oral y disminución lenta de la dosis de corticoides. Presentó mejoría clínica, con utilización de VNI nocturna. Se constató disminución de CPK (sin alcanzar valores normales) y persistencia de valores elevados del resto de las enzimas musculares. Al alta recibió ciclos programados de inmunoglobulina en diciembre de 2011 y enero de 2012.
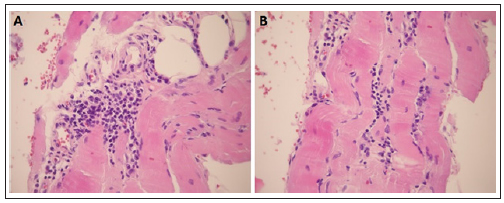
Fig.1. Biopsia muscular de deltoides izquierdo. A. Fibra muscular con inflamación perivascular. B. Fibra muscular con inflamación perimisial. Hematoxilina y eosina 100X.
La Fig. 1 puede verse en color en www.medicinabuenosaires.com
En noviembre de 2012 se internó por disnea, disfonía, fatiga muscular, con hipoxemia por hipoventilación (PaCO2 59 mmHg, a/A 0.75). CPK 4980 U/l, LDH 2240 U/l, GOT 220 U/laldolasa 21.3 U/l. Se interpretó el cuadro como una reagudización de la enfermedad de base secundaria a la reducción voluntaria del tratamiento con metrotexato por intolerancia digestiva. Recibió pulsos de 500 mg de metilprednisolona y nueva infusión de inmunoglubilina 2 g/kg. CVF 1.43 l (44%, con caída con el decúbito del 16%), PiMáx -45 cmH2O, PeMáx +45 cmH2O. Se reinició el metrotexato, ahora por vía subcutánea.
Desde enero del 2013 hasta la fecha (abril 2014) se encuentra asintomática sin requerimientos de VNI, bajo tratamiento con meprednisona 30 mg y metotrexato 20 mg semanal por vía subcutánea. Presentó disminución de enzimas musculares (CPK 87 U/l, aldolasa 2.9 U/l). Último EFR (julio 2013): CVF 2.12 l (64%), PiMáx -101 cmH2O, PeMáx 128 cmH2O.
Discusión
La enfermedad pulmonar intersticial y la neumonía aspirativa por debilidad de los músculos faríngeos son las formas más frecuentes de compromiso pulmonar en las miopatías inflamatorias. En el caso descripto, la forma de presentación fue el compromiso de músculos faríngeos, faciales y proximales de los miembros superiores. La presentación se acompañó de afectación grave de los músculos respiratorios con insuficiencia respiratoria aguda, una manifestación infrecuente en esta enfermedad4.
La insuficiencia respiratoria aguda fue secundaria a hipoventilación alveolar por debilidad muscular, presentando parámetros de intercambio gaseoso dentro de los límites normales (como el cociente arterio/alveolar de oxígeno, a/A). En ambas reagudizaciones de la enfermedad (octubre 2011 y noviembre 2012) el tratamiento instaurado en la unidad de cuidados intensivos consistió en inmunosupresión con corticoides e inmunoglobulina y el uso de VNI. Está descripto en la bibliografía que, en pacientes con insuficiencia respiratoria aguda secundaria a enfermedad neuromuscular, el uso de VNI por un período breve reduce la necesidad de intubación orotraqueal y ventilación mecánica invasiva5. También disminuye el tiempo de internación en la unidad de cuidados intensivos y se ha sugerido un incremento en la supervivencia de acuerdo a un estudio prospectivo6. Esta terapéutica fue tolerada de forma excelente por la paciente, con rápida mejoría de la mecánica ventilatoria dentro de las primeras 24 horas lo que permitió su pase a la sala de internación general. López Gastón y col. describieron un caso similar en nuestro país, de una paciente con polimiositis e insuficiencia ventilatoria7 aunque sin la implementación de VNI.
Desde el punto de vista clínico e histopatológico resulta difícil caracterizar el trastorno que presenta la paciente. La histología muscular puede confirmar el diagnóstico de miopatía inflamatoria idiopática. La degeneración y regeneración de miofibrillas es el hallazgo más común, mientras que un infiltrado inflamatorio crónico en áreas perivasculares e intersticiales es más específico de una miositis inmunomediada8. La biopsia muscular arrojó datos sugestivos de dermatomiositis, tales como la inflamación perivascular y perimisial, aunque no se encontró atrofia perifascicular, hallazgo histopatológico típico descripto en esta enfermedad9. Por otra parte, no se detectaron lesiones cutáneas características de dermatomiositis. La histología resultó inespecífica, tal vez modificada por el tratamiento con corticoides que la paciente había recibido previamente. De todas maneras, quedan pocas dudas de que la enfermedad descripta se engloba dentro del grupo de las miopatías inflamatorias inmunomediadas.
Es interesante recordar que la paciente tenía diagnóstico previo de artritis reumatoidea (confirmado en nuestra institución). Entre los síndromes de superposición está descripta la concurrencia de dermatomiositis o polimiositis y artritis reumatoidea10. Vale destacar que se han comunicado casos de desarrollo de miopatía inflamatoria luego de la utilización de fármacos antirreumáticos modificadores de la enfermedad (DMARD) como ciertas anticitocinas y leflunomida11, 12. De todos modos, la paciente recibió leflunomida muchos años antes del cuadro clínico descripto, por lo que su uso no puede correlacionarse temporalmente con el inicio de la debilidad muscular.
El objetivo principal en el tratamiento de las miopatías inflamatorias consiste en recuperar la fuerza muscular. Se describe una buena correlación entre los valores de CPK y la gravedad de la debilidad muscular: en general, al mejorar la fuerza muscular, se observa una caída en los valores plasmáticos de CPK aunque la relación inversa no siempre ocurre. Con la paciente que referimos, considerando el importante compromiso de los músculos respiratorios, utilizamos como parámetros objetivos de fuerza muscular respiratoria valores obtenidos a través del examen funcional respiratorio tales como la PiMáx y PeMáx así como la CVF. El deterioro clínico se acompañó, desde el inicio de la enfermedad, con caída en los valores de PiMáx, PeMáx y CVF. Asimismo, los parámetros espirométricos, especialmente la CVF, oscilaron en forma inversa a los valores de CPK (Fig. 2).
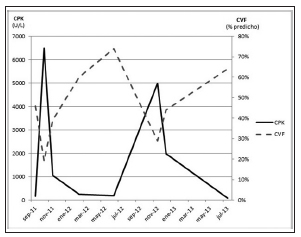
Fig. 2. Relación entre capacidad vital forzada (CVF) y creatinquinasa (CPK).
Inicialmente, gracias al tratamiento inmunosupresor con corticoides a altas dosis se logró el "destete" de la ventilación mecánica. Sin embargo, durante el descenso paulatino de la dosis de corticoides, la paciente presentó su primera reagudización, como ya se describió, en el mes de octubre del 2011. Por este motivo, y sumado a la gravedad del cuadro clínico (que requirió nueva internación en la unidad de cuidados intensivos para monitoreo estricto y utilización de ventilación no invasiva), el equipo tratante de nuestra institución decidió realizar pulsos de corticoides parenterales asociados a la administración de inmunoglobulina. Otros fármacos inmunosupresores, tales como el metotrexato, se utilizan en pacientes que no responden al tratamiento con corticoides, pero también se reservan como drogas "ahorradoras" de corticoides en esquemas en los que ambos tratamientos se inician conjuntamente. Existen series retrospectivas de casos de pacientes que han respondido al metotrexato luego de una mala respuesta clínica inicial a los corticoides13. Aunque el tratamiento con metotrexato y corticoides no ha sido comparado contra corticoide solo, hay un estudio doble ciego aleatorizado y controlado que comparó metotrexato con azatioprina en dermatomiositis y polimiositis. La eficacia de ambos tratamientos fue similar aunque el metotrexato tuvo mejor perfil de efectos adversos14.
La paciente que referimos se comportó como una buena respondedora al tratamiento inmunosupresor y, sobre todo, dependiente a esta terapéutica tal como se desprende de la descripción de su segunda reagudización en diciembre del 2012 en contexto de disminución de la dosis de metotrexato. La adecuada administración del metotrexato junto a las bajas dosis de corticoides lograron la remisión prácticamente total de la sintomatología, la normalización de las enzimas musculares y la obtención objetiva de valores espirométricos cercanos a los mejores históricos de la paciente.
En síntesis, el caso descripto representa una miopatía inflamatoria inmunomediada de presentación inusual debido a la baja frecuencia de falla respiratoria inicial por debilidad muscular en estas entidades. El diagnóstico se postergó debido a los valores normales de enzimas musculares, pero respondió de manera favorable al tratamiento inmunosupresor y a la implementación de ventilación no invasiva.
Conflicto de intereses: Ninguno para declarar
1. Dalakas MC. Review: An update on inflammatory and autoimmune myopathies. Neuropathol Appl Neurobiol 2011; 37: 226-42. [ Links ]
2. Dalakas MC. Polymyositis, dermatomyositis, and inclusion-body myositis. N Engl J Med 1991; 325: 1487-98. [ Links ]
3. Mastaglia FL, Garlepp MJ, Phillips BA, Zilko PJ. Inflammatory myopathies: clinical, diagnostic and therapeutic aspects. Muscle Nerve 2003; 27: 407-25. [ Links ]
4. Selva-O Callaghan A, Sanchez-Sitjes L, Muñoz-Gall X, et al. Respiratory failure due to muscle weakness in inflammatory myopathies: maintenance therapy with home mechanical ventilation. Rheumatology (Oxford) 2000; 39: 914-6. [ Links ]
5. Servera E, Sancho J, Zafra MJ, et al. Alternatives to endotracheal intubation for patients with neuromuscular diseases. Am J Phys Med Rehabil 2005; 84: 851-7. [ Links ]
6. Vianello A, Bevilacqua M, Arcaro G, Gallan F, Serra E. Non-invasive ventilatory approach to treatment of acute respiratory failure in neuromuscular disorders. A comparison with endotracheal intubation. Intensive Care Med 2000; 26: 384-90. [ Links ]
7. López Gastón O, Malvino E, Mc Loughlin D, López J, Nitsche A, Cueva F. Polimiositis con incapacidad ventilatoria e insuficiencia respiratoria. Medicina (B Aires) 2003; 63: 413-6. [ Links ]
8. Oddis CV. Miopatías inflamatorias idiopáticas. Reumatología 1ra. ed. Editores Maldonado Cocco JA, Citera G, eds. Buenos Aires. Ediiciones Azzurras, 2010, p 321-35. [ Links ]
9. Anthony DC, Frosch MP, De Girolami U. Peripheral nerve and skeletal muscle. Robbins and Cotran Pathologic Basis of Disease 8th ed. Kumar V, Abbas A, Fausto N, Aster J, eds. Philadelphia, PA: Saunders Elsevier, 2010. [ Links ]
10. Nagashima T, Iwamoto M, Minota S. Moderate incidence of prior rheumatoid arthritis in patients with polymyositis and dermatomyositis. Clin Rheumatol 2011; 30: 875-6. [ Links ]
11. Nagashima T,Minota S. Is polymyositis or dermatomyositis in patients with rheumatoid arthritis induced or unveiled by anti-tumor necrosis factor treatment? Clin Rheumatol 2010; 29: 819-20. [ Links ]
12. Ochi S, Taniguchi K, Nagashima M. Leflunomide-induced polymyositis in a patient with rheumatoid arthritis. Mod Rheumatol 2009; 19: 443-6. [ Links ]
13. Newman ED, Scott DW. The use of low-dose oral methotrexate in the treatment of polymyositis and dermatomyositis. J Clin Rheumatol 1995; 1: 99-102. [ Links ]
14. Miller J, Walsh Y, Saminaden S, et al. Randomized double blind trial of methotrexate and steroids compared with azathioprine and steroids in the treatment of idiopathic inflammatory myopathy. J Neurol Sci 2002;199 (Suppl 1):S53. [ Links ]
Recibido: 15-IV-2014
Aceptado: 28-VII-2014














